-
生猪养殖业近年来得到迅猛发展,养殖规模不断扩大,我国每年产生的畜禽粪污量达到38×108 t[1],由此产生的大量粪污严重威胁着周边的生态环境。通过厌氧发酵对猪粪废水进行处理是实现其资源化利用的有效手段[2-3]。由于饲养条件和粪污处理模式不同,猪粪废水中氨氮浓度差异较大[4-6]。氨氮能够为厌氧发酵提供氮源,适当的氨氮浓度有利于厌氧发酵,但氨氮浓度过高对厌氧发酵有抑制作用。
在研究氨氮对厌氧发酵的抑制作用时,由于使用的原料不同,抑制厌氧发酵的氨氮浓度和对厌氧发酵抑制的阶段也各不相同[7-10]。在高浓度氨氮抑制厌氧发酵的研究中,多以氯化铵作为模拟氮源。氯化铵溶解产生
$ {\rm{NH}}_4^{\rm{ + }}$ 和Cl−,而对厌氧发酵起抑制作用的主要是FAN而不是$ {\rm{NH}}_4^{\rm{ + }}$ [11-13],且Cl−对厌氧发酵也可能存在潜在的抑制作用[14-15]。由于猪对蛋白质饲料的利用率不高,饲料中大约50%~70%的氮以粪氮和尿氮的形式排出体外,在猪粪尿中,粪氮和尿氮含量分别占猪粪尿总量的约30%和70%,尿氮中有97%以尿素的形式存在[16],所以猪粪废水厌氧发酵氨氮的主要来源是尿素。TIAN等[17]采用模拟废水研究了尿素和氯化铵对厌氧发酵中4株乙酸型产甲烷菌和氢营养型产甲烷菌的抑制作用,结果发现尿素较氯化铵对产甲烷菌有更强的抑制作用。在复杂的实际废水厌氧发酵中,水解阶段的产酸、pH与温度均对FAN有影响[1]。以氯化铵和尿素为氮源,二者在厌氧发酵过程中氨氮释放规律可能有所不同。
$ {\rm{NH}}_4^{\rm{ + }}$ 离子和NH3分子对微生物抑制机理和程度可能存在一定差异,而两者的浓度关系与反应器的温度和pH直接相关,“氨氮-VFAs-碳酸盐”三元缓冲体系的调控模式亦会存在差异[1],二者对实际废水厌氧发酵的影响并不相同,并且目前有关不同氮源TAN能完成多少FAN转化的研究鲜有报道。因此,本研究以实际的猪粪废水为底物,研究了尿素和氯化铵对猪粪废水厌氧发酵的抑制作用,为解除高浓度氨氮废水在厌氧发酵中的抑制作用提供有效的解决办法。
全文HTML
-
发酵所用废水取自重庆天府镇某养猪场使用固液分离机螺旋挤压分离水冲粪后的液体,猪粪废水取回后过5 mm筛,置于4 ℃冰箱保存待用,接种物取自实验室上一批猪粪废水厌氧发酵结束后的发酵液。发酵原料和接种物的理化指标见表1。反应器体积为1 L,有效体积为0.7 L,反应器采用恒温循环水浴进行控温,温度控制在(35±1) ℃。
-
在厌氧反应器中加入560 mL的猪粪废水和140 mL(20%)的接种物,分别加入5种不同浓度氯化铵和尿素(表2),使其TAN浓度为500~2 500 mg·L−1,以不添加任何氮源为空白对照组,共计11组实验。
-
总固体含量(total solid, TS)、挥发性固体含量(volatile solid, VS)测定分别使用烘干法和灼烧法。pH通过pH计(PB-10)测定。采用重铬酸钾氧化法测定溶解性化学需氧量[18](soluble chemical oxygen demand,SCOD)。利用凯氏定氮仪(KD-310)测定TAN浓度,游离氨(FAN)浓度使用文献中的方法[19]计算,计算方法如式(1)所示。
式中:CFAN为FAN浓度,mg·L−1;CTAN为总氨氮浓度,mg·L−1;T为温度,K。
pH、TAN和SCOD发酵初期分别在12 h、1 d、2 d、3 d各测定1次,随后每隔3 d测定1次;甲烷和VFAs含量每3 d测1次,气体组成和VFAs含量采用气相色谱仪(GC-2030)[20]进行测定。
1.1. 实验原料
1.2. 实验设计
1.3. 测定指标及方法
-
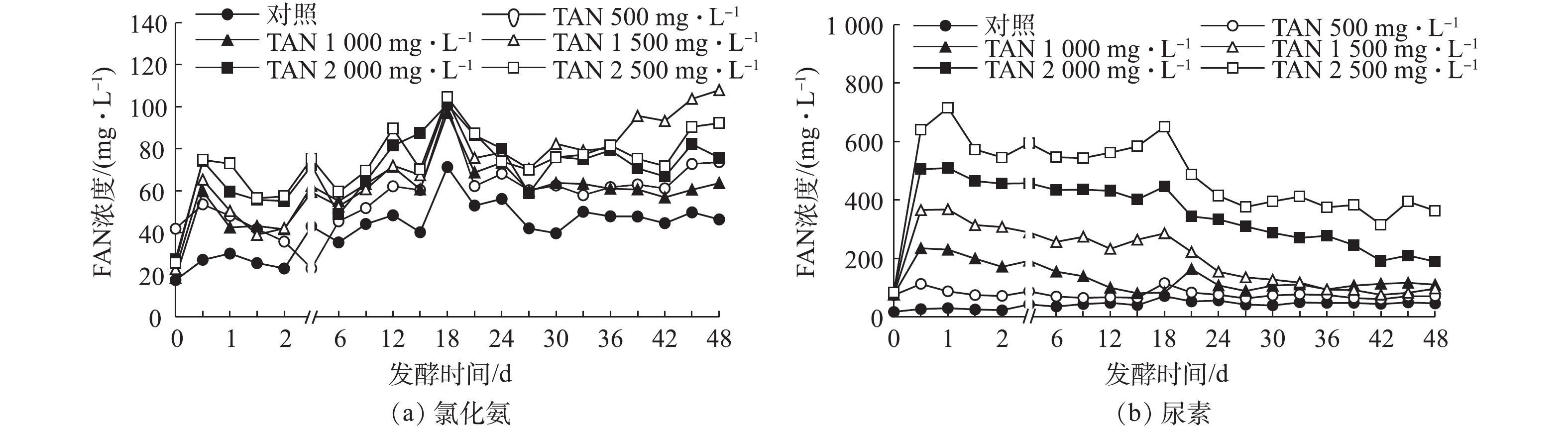
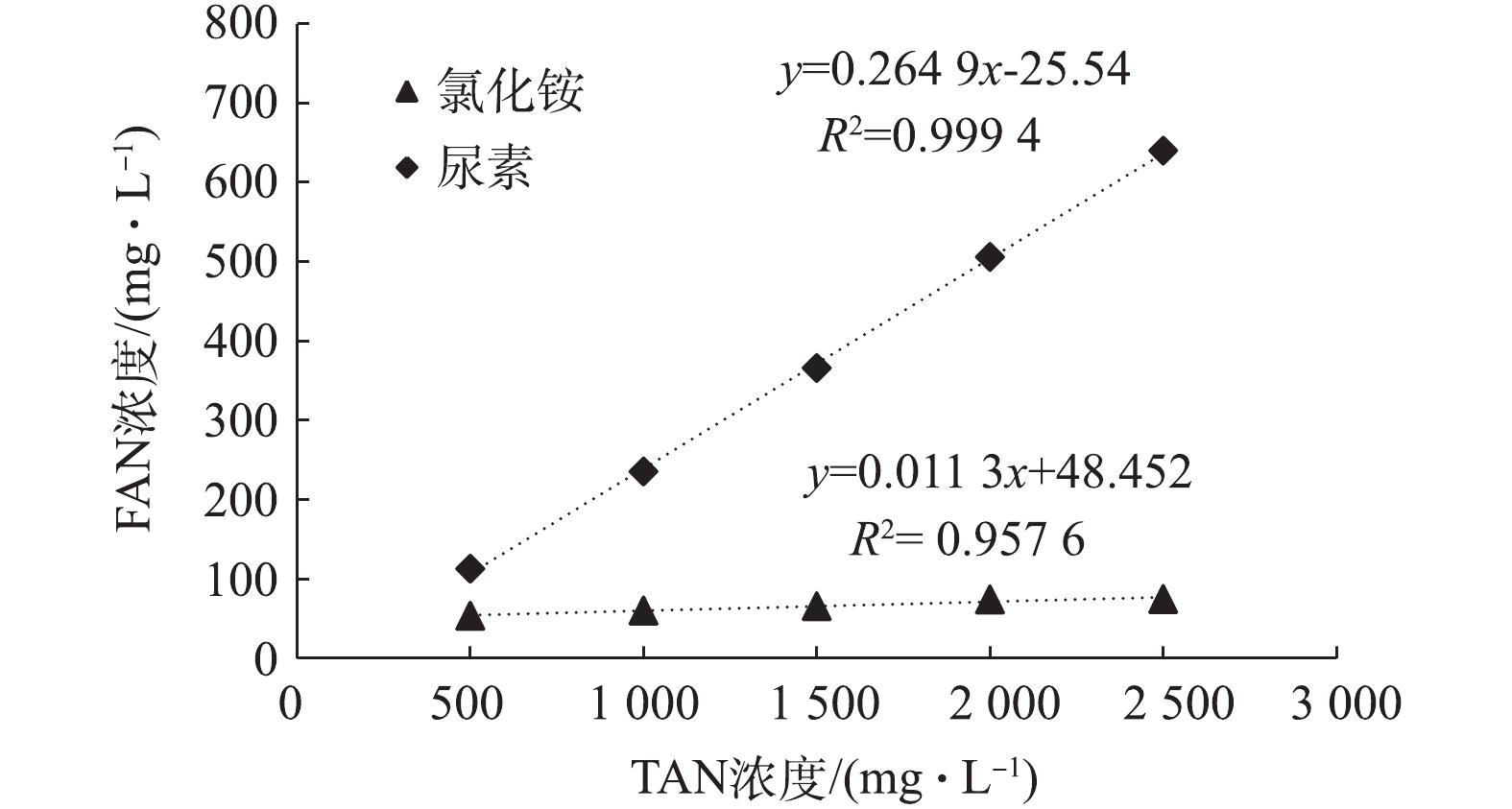
FAN是造成厌氧发酵氨氮抑制的重要原因。图1反映了为不同浓度尿素和氯化铵在加入相同接种物后发酵12 h的FAN浓度。由图1可知,以氯化铵为氮源,随着TAN浓度的增加,FAN浓度变化不大,TAN浓度为2 500 mg·L−1时,FAN的浓度仅为74.65 mg·L−1,且TAN与FAN浓度间的拟合度较低(R2=0.957 6);以尿素为氮源,FAN随TAN浓度的增加而迅速增加,TAN浓度从500 mg·L−1升至2 500 mg·L−1时,FAN的浓度从106.91 mg·L−1上升到639.95 mg·L−1,是氯化铵(TAN=2 500 mg·L−1)的8.57倍,且TAN与FAN浓度具有良好的拟合度(R2=0.999 4)。在氯化铵与尿素TAN浓度相同时,尿素的FAN浓度远高于氯化铵,而且,在猪粪废水厌氧发酵中,TAN的贡献来自于尿液中的尿素及蛋白质、核酸等的分解。因此,以尿素为氮源研究猪粪废水厌氧发酵的抑制作用更为合适。
-
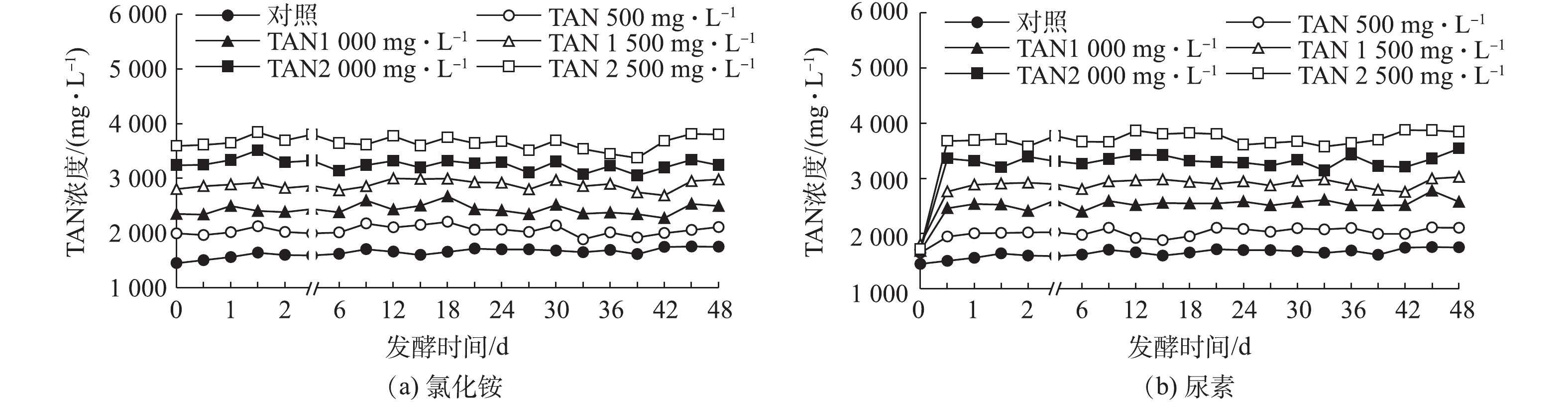
图2和图3反映了添加氯化铵和尿素为氮源时,猪粪废水厌氧发酵TAN和FAN浓度的变化。由图2可知,随着氯化铵和尿素浓度的增加,发酵液中TAN浓度也相应增加,但以氯化铵为氮源的各发酵组中,TAN在初始时就保持较高浓度,且随着发酵时间的延长,各组TAN浓度几乎保持不变;而以尿素为氮源的各发酵组中,TAN在初始时和对照组的浓度几乎一致。但在随后的12 h中,随着尿素的降解,各组的TAN浓度迅速增加;12 h后,以尿素为氮源的各组TAN浓度与以氯化铵为氮源的各组TAN浓度相差不大,且这2种氮源对应的TAN浓度均保持在稳定状态,这与唐波等[21]以餐厨垃圾为底物进行发酵时得到TAN的研究结果一致。这意味着对于2种不同氮源,猪粪废水在整个厌氧发酵过程中都可以保持在相同TAN浓度条件下进行。
由图3可知,2种氮源的FAN浓度都随初始TAN浓度的增加而增加,且在12 h内,各处理组的FAN浓度都在快速增加,12 h后各处理组的FAN浓度逐渐降低。但在以氯化铵为氮源的各处理组中,FAN浓度在第6天后整体均呈逐渐增加的变化趋势,以尿素为氮源的各处理组中,FAN浓度在第1天后都逐渐降低。在整个厌氧发酵过程中,以氯化铵为氮源的各处理组,FAN的浓度仅在18.6~107.9 mg·L−1变化,而以尿素为氮源的各处理组中,TAN浓度为2 500 mg·L−1的处理组中,FAN浓度在厌氧发酵第1天时就达到715.3 mg·L−1。在整个厌氧发酵过程中,以尿素为氮源TAN浓度由500 mg·L−1增加到2 500 mg·L−1的各处理组中,FAN浓度为74.1~715.3 mg·L−1。这表明在猪粪废水厌氧发酵过程中,氯化铵和尿素2种氮源即使产生的TAN浓度相同,但产生的FAN浓度差异也较大。当2种氮源的TAN浓度均为500 mg·L−1时,以氯化铵为氮源,FAN浓度最高可达到100.4 mg·L−1,以尿素为氮源时,FAN浓度最高可达到115.6 mg·L−1。当2种氮源的TAN浓度均为2 500 mg·L−1时,以氯化铵为氮源的FAN最高浓度为104.5 mg·L−1,以尿素为氮源的FAN最高浓度为715.3 mg·L−1,这表明在相同TAN浓度条件下,以尿素为氮源所产生的FAN浓度远高于氯化铵氮源,且TAN浓度越高,二者FAN浓度差异也越大。唐波等[21]对餐厨垃圾进行厌氧发酵时发现,当FAN浓度大于150 mg·L−1时,会影响厌氧发酵系统的效率。而NIU等[22]用鸡粪为基质进行厌氧发酵时发现,当FAN浓度为1 000 mg·L−1时,厌氧发酵才开始被抑制。原料来源不同导致底物发酵产生的FAN也不同,厌氧微生物对其耐受性也存在差异。猪粪废水厌氧发酵产生的氨氮多来自尿液中的尿素,因此,以尿素为氮源研究猪粪废水厌氧发酵的氨氮抑制机理才更具有代表性;同时,猪粪废水中尿素需要尿酶的作用才能降解,因此,以真实猪粪废水为基质研究氨氮抑制作用较模拟废水也更具有说服力。
-
表3反映了不同氮源处理组中猪粪废水厌氧发酵结束时SCOD的变化。由表3可知,猪粪废水厌氧发酵的SCOD初始浓度为7.11×103 mg·L−1,以氯化铵为氮源,发酵结束时各组的SCOD浓度均高于初始浓度,这可能是由于适当浓度的FAN能够促进有机物的释放所致。秦玉格[23]研究发现,FAN能破坏细胞膜,促进有机物的释放,为水解阶段提供了更多的物质。以尿素为氮源时,在TAN浓度为500 mg·L−1和1 000 mg·L−1的2组处理中,发酵结束时的SCOD浓度均低于初始浓度,而在TAN浓度≥1 500 mg·L−1的3个处理组中,发酵结束时的SCOD均远高于初始浓度。
-
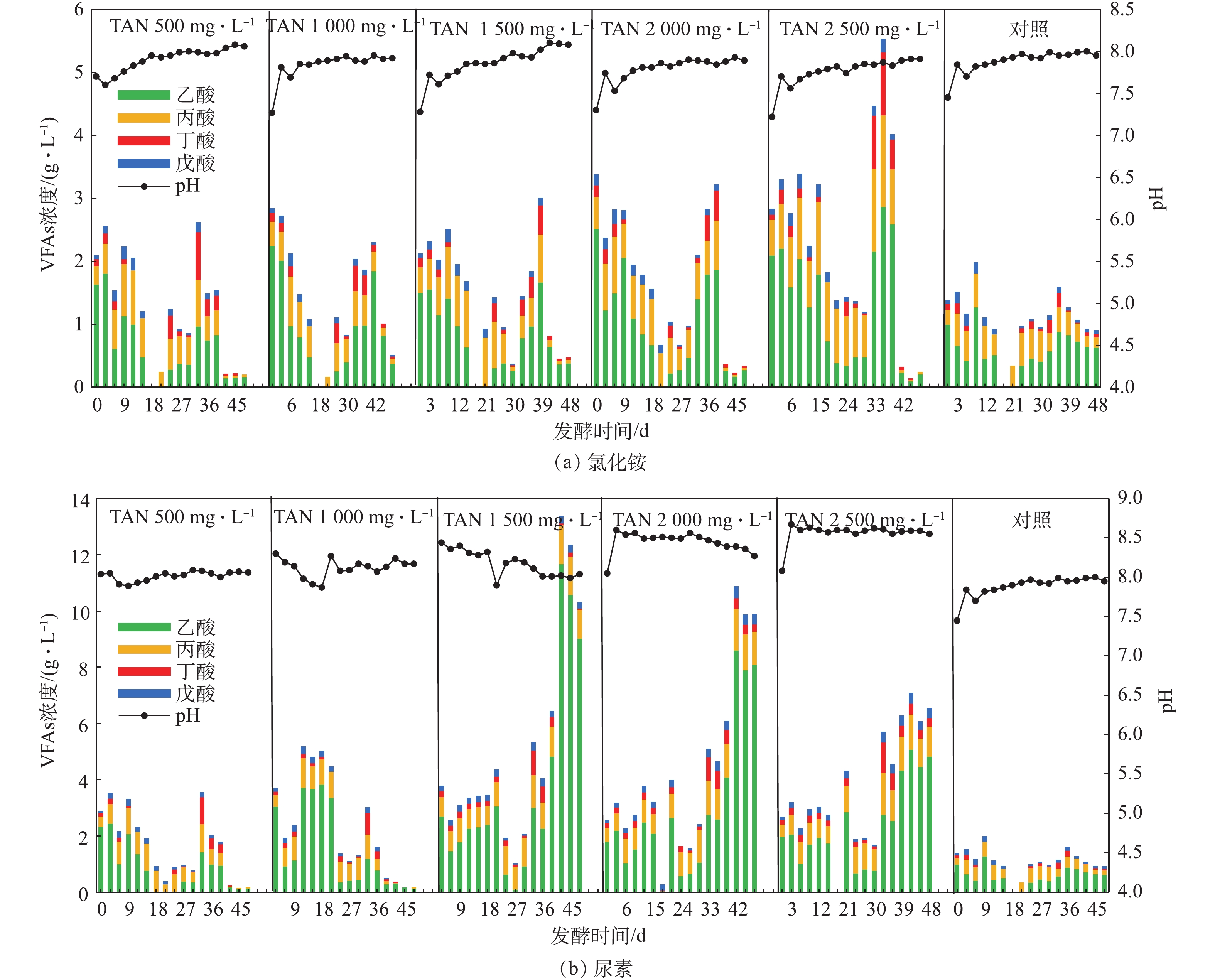
VFAs是厌氧发酵过程中有机物降解的中间产物,其与系统pH密切相关。图4反映了以氯化铵和尿素为氮源,厌氧发酵过程中VFAs和pH随时间的变化情况。由图4可知,猪粪废水厌氧发酵产生的VFAs以乙酸和丙酸为主。对于2种氮源,猪粪废水厌氧发酵产生的VFAs浓度均高于对照组,但以氯化铵为氮源时,猪粪废水厌氧发酵产生的VFAs浓度远小于以尿素为氮源的处理组。当TAN≥2 000 mg·L−1时,以氯化铵为氮源,发酵结束时几乎没有VFAs积累,而以尿素为氮源,则出现了大量乙酸和丙酸的积累。MOLAEY等[24]在鸡粪厌氧发酵时也发现,高氨氮会导致乙酸和丙酸积累,并且乙酸营养型产甲烷菌比氢营养型产甲烷菌更容易受高氨氮影响[25-27]。以氯化铵为氮源,VFAs呈现先降低后增加再降低的变化趋势。这是因为发酵前期,产甲烷菌利用乙酸产沼气,使乙酸含量逐渐减少,VFAs的减少导致pH上升,从而使FAN浓度升高,致使利用乙酸产甲烷过程被抑制,进而导致VFAs浓度增加。待乙酸型产甲烷菌适应此FAN浓度后继续消耗乙酸,VFAs浓度降低,故在发酵结束时几乎没有酸积累。以尿素为氮源,在TAN浓度为500 mg·L−1和1 000 mg·L−1的2处理组中,VFAs整体变化趋势与以氯化铵为氮源的各组变化趋势一致;而TAN≥1 500 mg·L−1(FAN≥370 mg·L−1)的各组在发酵初期VFAs并没有显著降低。这是由于较高的FAN浓度抑制了产甲烷菌利用乙酸产甲烷,形成了VFAs的积累,而VFAs积累促使pH降低,FAN浓度不断下降,产甲烷菌又可以重新恢复活性利用乙酸产甲烷。因此,在发酵21 d左右,VFAs浓度逐渐降低,从而使得pH也有些微波动上升,又导致FAN浓度维持在一个较高水平不再下降,制约着乙酸型产甲烷菌的活性,导致发酵后期VFAs的积累。
由图4可知,以氯化铵为氮源,不同浓度处理组的pH变化和对照一致,均呈逐渐增加的趋势,这是由厌氧发酵中VFAs被逐渐消耗殆尽造成的。在整个厌氧发酵过程中,各处理组的pH均不超过8.1。以尿素为氮源,pH在12 h内出现不同程度的增加,并且初始TAN越大,pH越大。这是由于尿素水解产生NH3,根据式(2)可知,平衡向左移动,导致pH增加;12 h后,随着VFAs的逐渐积累,各组pH均呈下降趋势,但发酵结束时各组pH均大于8.0。此外,以尿素为氮源,在不同TAN浓度的各处理组中,其pH均高于以氯化铵为氮源对应的各处理组。这是由于二者提供氮源种类不同,以氯化铵为氮源,提供
$ {\rm{NH}}_4^{\rm{ + }}$ ,式(2)平衡向右移动,pH减小;以尿素为氮源,提供NH3,式(2)平衡向左移动,pH变大。 -
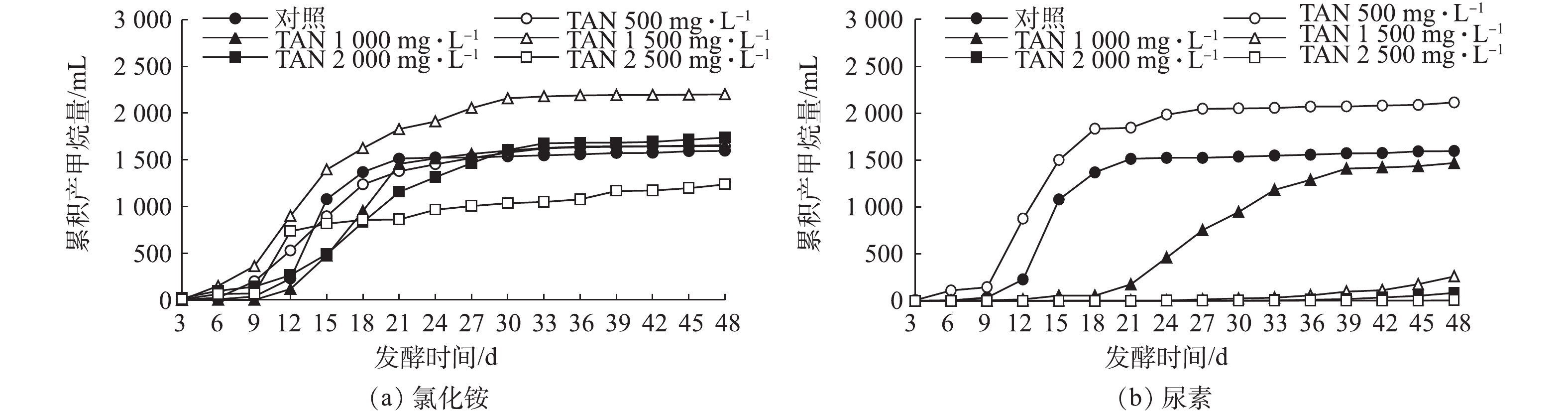
图5反映了添加不同氮源猪粪废水厌氧发酵的累积产甲烷产量变化。由图5可知,以氯化铵为氮源,TAN浓度由500 mg·L−1(FAN=53.50 mg·L−1)增加到1 500 mg·L−1(FAN=65.26 mg·L−1),累积产甲烷量由1 648.4 mL增加至2 201.43 mL,分别较对照组提高了3.25%和37.89%。在TAN≤1 500 mg·L−1的各处理组中,VFAs积累量也高于对照组,这说明在此浓度下FAN促进了厌氧发酵的水解产酸过程,厌氧发酵产酸量的增加使得累积产甲烷量高于对照;当TAN浓度继续增加到2 500 mg·L−1(FAN=74.65 mg·L−1)时,VFAs积累量高于对照组,而累积产甲烷量则降至1 236.88 mL,较对照组下降了22.53%,这是由于在高浓度FAN和大量VFAs作用下,抑制了产甲烷菌活性,使其累积产甲烷量减少。因此,以氯化铵为氮源,当TAN浓度低于1 500 mg·L−1(FAN=65.26 mg·L−1)时,对猪粪废水厌氧发酵产甲烷有促进作用,但当TAN浓度增加到2 500 mg·L−1(FAN=74.65 mg·L−1)时,就会对猪粪废水厌氧发酵产甲烷有抑制作用。以尿素为氮源,当TAN浓度为500 mg·L−1(FAN=112.87 mg·L−1)时,由于FAN对水解产酸的促进作用,发酵过程中VFAs积累量高于对照组,在发酵第4 天就开始产气,累积产甲烷量最高达到2 115.44 mL,较对照组提高了32.5%;TAN浓度为1 000 mg·L−1(FAN=235.12 mg·L−1)时,发酵过程中VFAs积累量高于对照组,但产甲烷菌活性在高浓度FAN受到抑制,发酵之初几乎不产甲烷,直至发酵到第12 天时,当FAN浓度降至100 mg·L−1左右才开始产甲烷,累积产甲烷量为1 469.5 mL,较对照下降了7.96%;当TAN浓度为1 500 mg·L−1时,累积产甲烷量仅为对照组的16.38%,当TAN≥1 500 mg·L−1(FAN≥370 mg·L−1)时,猪粪废水在整个厌氧发酵过程中几乎不产气,发酵结束时的累积甲烷产量几乎为零,而VFAs积累量随着TAN浓度的增加而减少,这表明此时厌氧发酵水解产酸过程也受到了高浓度氨氮的抑制。以尿素为氮源,当TAN浓度低于500 mg·L−1(FAN=112.87 mg·L−1)时,能促进猪粪废水厌氧发酵产甲烷;但当TAN浓度超过1 000 mg·L−1(FAN≥235.12 mg·L−1)时,厌氧发酵受到抑制,而且TAN浓度越高,抑制越强烈,累积产甲烷量越少;当FAN浓度低于235.12 mg·L−1时,产甲烷能力能够重新恢复;但当FAN浓度超过370 mg·L−1时,猪粪废水厌氧发酵的氨抑制解除较为困难,产甲烷能力受到影响。相较氯化铵,以尿素为氮源对厌氧发酵有更强的抑制作用。这是由于以尿素为氮源,主要提供的是FAN,FAN对厌氧发酵乙酸型产甲烷菌活性产生抑制[27],从而影响厌氧发酵产甲烷;而氯化铵主要提供
$ {\rm{NH}}_4^{\rm{ + }}$ ,$ {\rm{NH}}_4^{\rm{ + }}$ 对产甲烷菌群活性的影响不及FAN。因此,以氯化铵为氮源对厌氧发酵的氨抑制作用远小于尿素。
2.1. 不同氮源的FAN浓度变化
2.2. 不同氮源对猪粪废水厌氧发酵TAN和FAN的影响
2.3. 不同氮源对猪粪废水厌氧发酵SCOD的影响
2.4. 不同氮源对猪粪废水厌氧发酵VFAs和pH的影响
2.5. 不同氮源猪粪废水厌氧发酵的产甲烷特性
-
1)以尿素和氯化铵为氮源,猪粪废水厌氧发酵的TAN浓度几乎相同,但FAN浓度差异很大。当TAN=2 500 mg·L−1时,以尿素为氮源的FAN浓度为氯化铵的8.57倍。
2)猪粪废水在厌氧发酵过程中产生的VFAs以乙酸和丙酸为主,以尿素为氮源的猪粪废水在厌氧发酵过程中产生的VFAs和pH均高于以氯化铵为氮源的处理组。
3)以氯化铵为氮源(TAN≤1 500 mg·L−1)和以尿素为氮源(TAN≤500 mg·L−1)均对猪粪废水厌氧发酵产甲烷有促进作用,超过这一浓度后均对厌氧发酵有抑制作用。并且尿素较氯化铵有更强的氨抑制效果,以尿素为氮源更接近实际畜禽废水厌氧发酵受抑制过程,故其更具有代表性。



 下载:
下载: