-
石油化工企业在炼油和化工生产过程中,会排放出大量含有高浓度硫化物(主要为Na2S,质量百分比0.5%~5%[1])、高COD的强碱性废液。此类废碱液具有强烈的恶臭[2]、较大的毒性且不易被处理,同时会造成严重的二次污染[3]。因此,必须将此类废水中有毒的低价硫化物转化成无毒、无二次污染的高价态硫酸盐后才能进入后续的处理过程。
目前国内外含硫废碱液处理主要有中和法、综合利用法、氧化法、沉淀法和生物强化法[4]。中和法即使用酸调整溶液pH至中性或酸性,使硫化氢释放,而后将废气燃烧或用作他用,但存在废气处理和高含盐量的酸性废水处理问题。综合利用即结晶回收硫化钠,再将硫化钠综合利用,但废水中的有机物和其他物质会影响硫化钠的结晶纯度。氧化法即使用空气、氧气、过氧化氢等作为氧化剂,在催化剂或无催化剂作用下将低价硫氧化。沉淀法即采用过渡金属盐与硫化钠生成沉淀,而后将硫化物沉淀分离,沉淀法同样会受废水中其他无机盐的影响使沉淀的盐不纯。生物法需要大量水(6倍以上)稀释,只适用于低浓度废碱液处理,故存在局限性。氧化法相比其他方法适用范围广、氧化效率高、无二次污染。
氧化法处理废碱液中最常用的是湿式空气氧化法。湿式空气氧化工艺是在一定温度和压力条件下,以空气中的氧作为氧化剂对污水中的污染物进行水相氧化的处理技术[5]。根据处理温度和是否加入催化剂分为低温湿式氧化、中温湿式氧化、高温湿式氧化、催化湿式氧化4类,具体如表1所示。
上述工艺均需要加压,并且反应温度超过了100 ℃,在工程中,加温加压将会提高对设备的压力等级要求、降低操作的安全性、增加能源的消耗。为了降低能耗和设备的压力等级,近期,有催化空气氧化工艺在小于100 ℃下处理废碱液的报道,详见表2。
但上述研究的重点均在废碱液中硫化钠的初步氧化去除上,并没有对废碱液中本身存在以及初步氧化后生成的高浓度硫代硫酸钠的去除进行讨论。在实际废碱液处理过程中,硫代硫酸钠的存在很大程度影响了后续盐分离的处理效果,从而影响后续生化。因此,针对含硫废碱液中硫代硫酸钠氧化困难的实际问题,本研究的重点为开发一种小于100 ℃常压催化湿式空气氧化硫代硫酸钠的脱硫工艺,通过高效脱硫催化剂提高低价硫的氧化效率和氧化深度,实现高效、经济的氧化硫代硫酸钠。
TiO2作为载体被广泛应用于催化湿式氧化及其他工业催化过程,具有高强度及耐酸碱等特点;Mn具有+2、+3、+4、+7等多种价态,可以形成不同性质的稳定氧化物,在催化反应中能够通过不同价态Mn的催化循环表现出优异的氧化还原能力[9-10],锰基催化剂常被用作氧化还原反应的催化剂,如NH3-SCR(selctive catalytic reduction)[11-12]。
基于上述研究结果,本研究应用MnOx@TiO2作为催化剂,实现常压条件下对硫代硫酸钠的催化氧化,使硫代硫酸钠在较短时间内氧化生成易于后续盐-水分离的亚硫酸钠及硫酸钠。同时考察气量、反应温度、反应时间等反应条件对硫代硫酸钠转化率的影响。
-
测试载体TiO2的吸水率,称取一定量硫酸锰(AR,上海吉至生化科技有限公司)溶解于一定量去离子水中,等体积浸渍一晚,得到中间体A。将A放入120 ℃烘箱中完全烘干,所得样品放入马弗炉内在450 ℃空气气氛中焙烧4 h,最终得到Mn质量分数为2%的MnOx@TiO2。
-
载体及使用前后的催化剂研磨成粉末作为待测样品。采用荷兰PANAlytical公司生产的Zetium型X射线荧光光谱仪(XRF)进行元素分析。X-射线衍射测试采用荷兰PANAlytical公司生产的Empyrean-100型X射线粉末衍射仪(XRD),陶瓷X光管Cu辐射源(Kα2/Kα1=0.5),扫描角度2θ为10°~90°,扫描时间为10 min,扫描步长为0.026°。采用美国ThermoFisher公司生产的Thermo ScientificTM K-AlphaTM XPS能谱仪进行X-射线光电子能谱(XPS)表征。采用Aventage软件对曲线进行分峰拟合,背景扣除方式为Shirley背景。采用NH3-TPD研究催化剂表面酸性活性位量,使用浙江泛泰仪器有限公司FINESORB-3010型装置,取100 mg左右样品粉末,150 ℃下Ar气氛预处理2 h,使用NH3体积分数为1%的NH3/Ar(20 mL·min−1)混合气常温吸附2 h至饱和,于Ar气氛下以10 ℃·min−1升温至500 ℃脱附,记录NH3-TPD图谱。采用O2-TPD研究催化剂表面对氧气的吸附性能,使用浙江泛泰FINESORB-3010型装置,取100 mg左右样品粉末,150 ℃下Ar气氛预处理2 h,使用O2体积分数为10%的O2/Ar(20 mL·min−1)混合气在75 ℃进行2 h吸附,于Ar气氛下10 ℃·min−1升温至800 ℃脱附,记录O2-TPD图谱。采用H2-TPR(浙江泛泰FINESORB-3010)研究催化剂氧化还原性能,取50 mg左右样品粉末,常温Ar气氛下吹扫100 min,使用H2体积分数为10%的H2/Ar (20 mL·min−1)混合气以10 ℃·min−1升温至800 ℃进行还原,记录H2-TPR图谱。比表面积的测试使用浙江泛泰FINESORB-3010型装置,采用单点法进行测试,取约500 mg样品粉末,通过N2低温吸附常温脱附和BET方程计算得到比表面积。
-
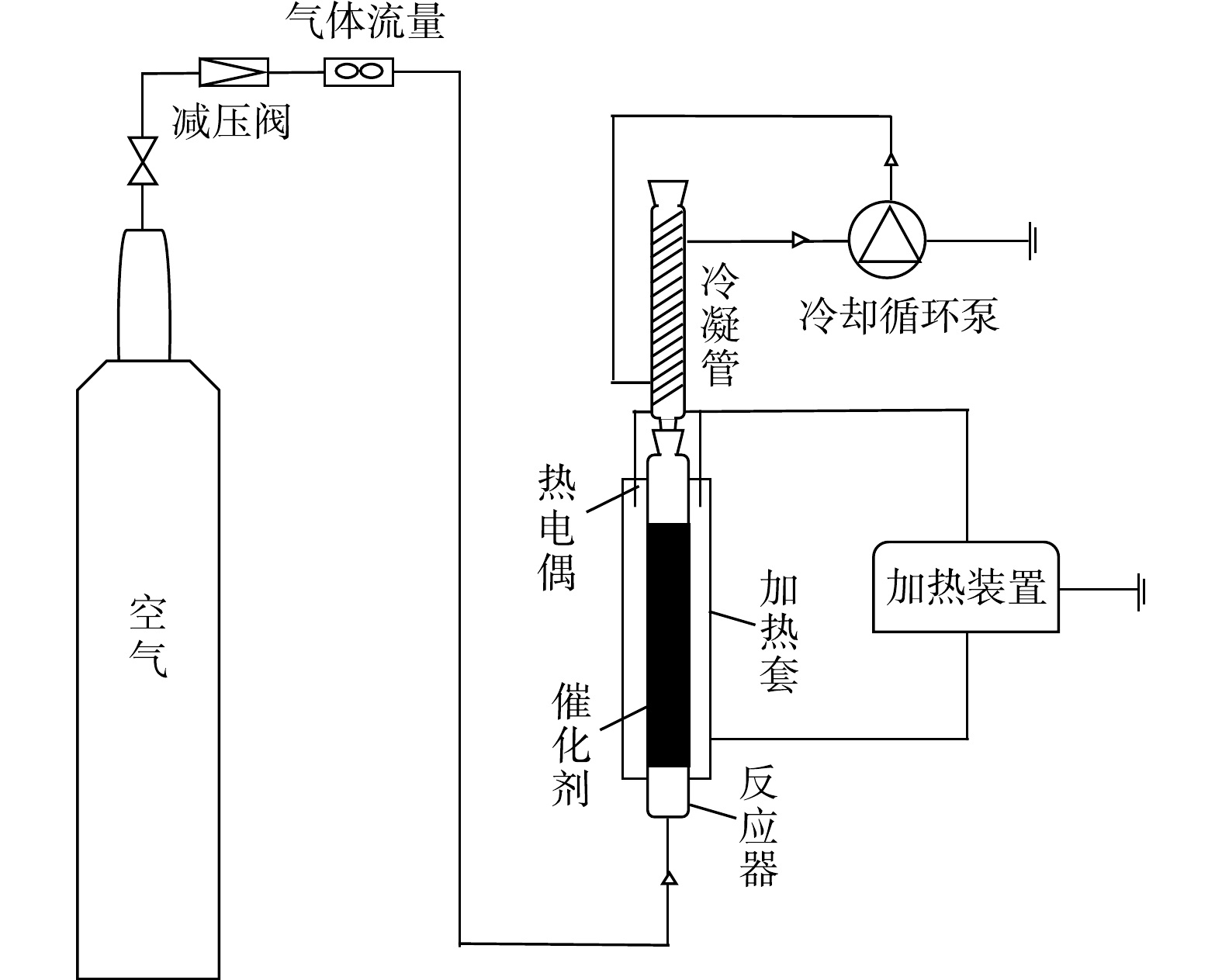
常压催化湿式氧化硫代硫酸钠的活性测试在鼓泡床反应器中进行,反应装置如图1所示。该装置主要分为3部分:气路系统、反应系统及冷却系统(防止溶液挥发)。反应器中装入50 mL催化剂和35 mL模型水,使用单独的硫代硫酸钠溶液作为模型底物,模型水中
$ {{\rm{S}}_{\rm{2}}}{{\rm{O}}_3}^{2 - }$ 质量浓度为10 000 mg·L−1,待空气流量与温度稳定后开始反应计为反应零点。每次反应结束后,出水使用0.45 μm滤头进行过滤,采用间接碘量法[13]测定每次出水水样中
$ {{\rm{S}}_{\rm{2}}}{{\rm{O}}_3}^{2 - }$ 和$ {\rm{S}}{{\rm{O}}_3}^{2 - }$ 质量浓度。使用体积比1∶1甲醛溶液屏蔽水样中$ {\rm{S}}{{\rm{O}}_3}^{2 - }$ ,在酸性条件下使用稀释50倍的碘标准溶液(C(1/2I2)=0.1 mol·L−1)滴定一定量稀释水样由无色变为浅蓝色计为反应终点,计算出$ {{\rm{S}}_{\rm{2}}}{{\rm{O}}_3}^{2 - }$ 的质量浓度。在一定量稀释水样中加入过量碘标准溶液,在酸性条件下使用硫代硫酸钠标准溶液(c(Na2S2O3)=0.1 mol·L−1)滴定剩余碘至溶液无色计为反应终点,计算得$ {{\rm{S}}_{\rm{2}}}{{\rm{O}}_3}^{2 - }$ 和$ {\rm{S}}{{\rm{O}}_3}^{2 - }$ 质量浓度之和,差值为$ {\rm{S}}{{\rm{O}}_3}^{2 - }$ 质量浓度。滴定过程发生的主要化学反应如式(1)~式(2)所示。 -
本研究所有反应均使用同一批次催化剂,每次使用后清洗干燥进行再生。催化剂使用过程中Mn的溶出量采用美国PerkinElmer公司生产的Optima 7300DV型电感耦合等离子体发射光谱仪(ICP)进行分析。
-
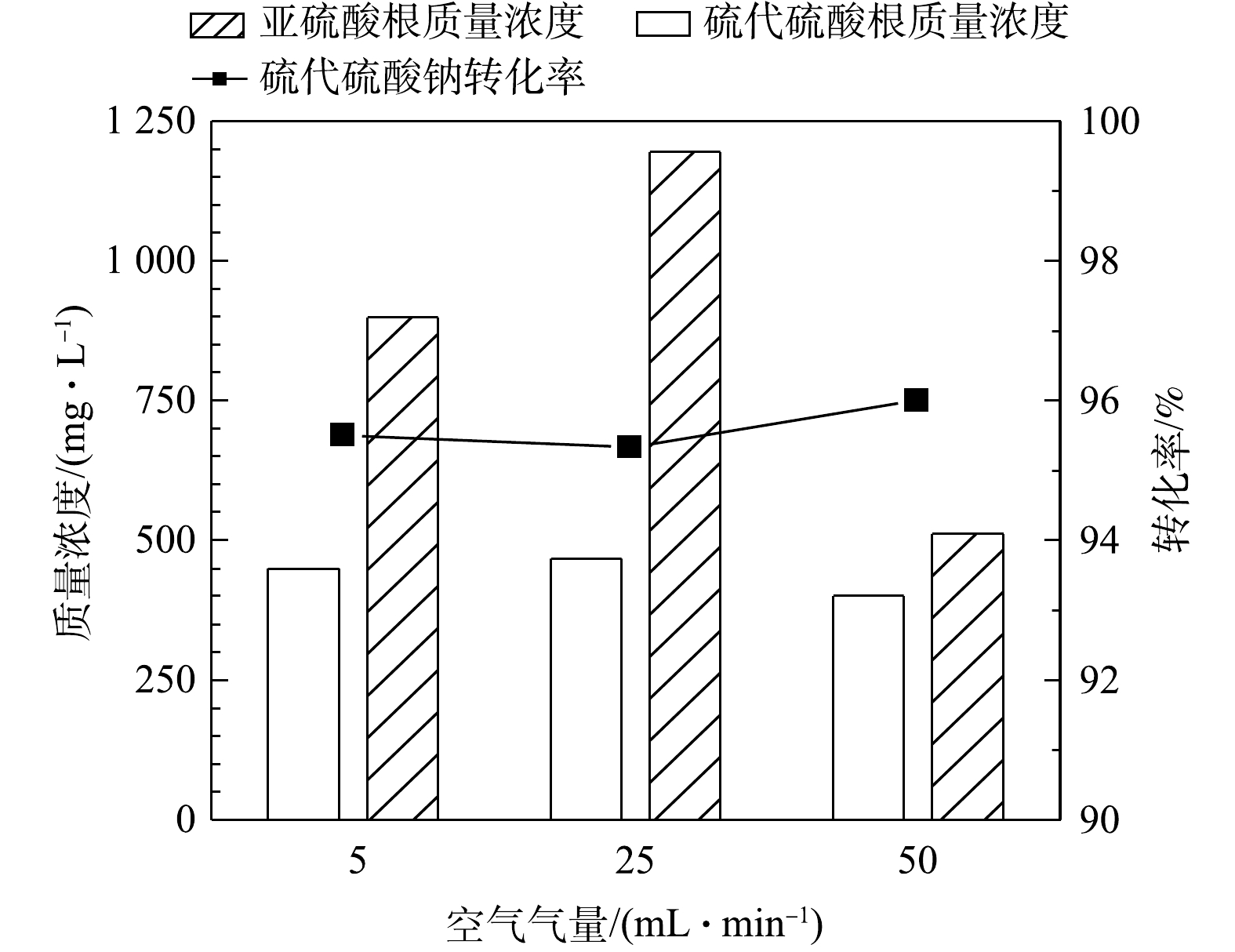
1) 空气气量的影响。在反应温度65 ℃、反应时间50 h的条件下,在5~50 mL·min−1内不同气量条件下硫代硫酸钠转化率(以
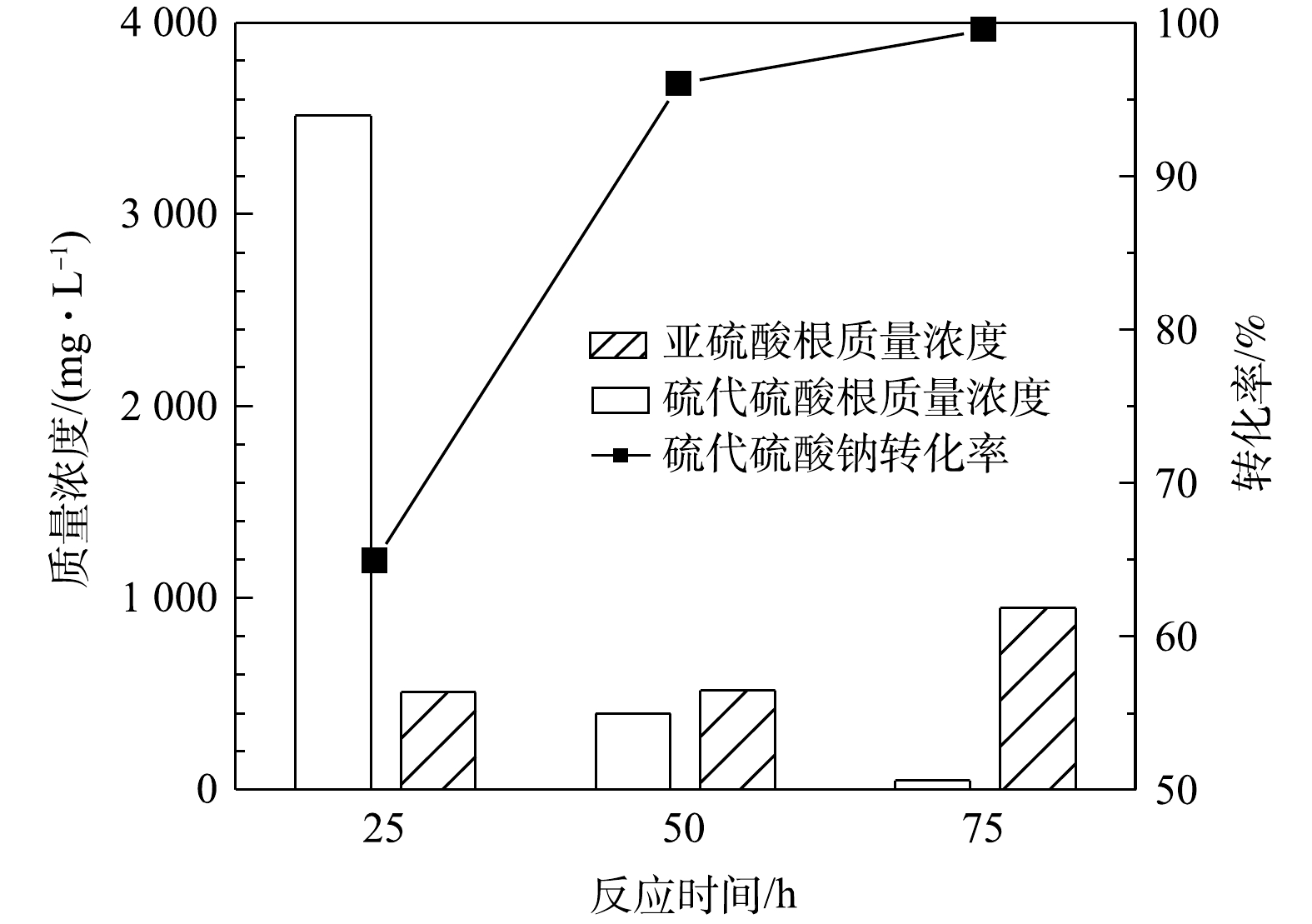
$ {{\rm{S}}_{\rm{2}}}{{\rm{O}}_3}^{2 - }$ 计)见图2。由图2可见,通入空气中氧气含量过量(经计算至少过量7.8倍),硫代硫酸钠的转化率可达96%,但不随气量的增加而升高,说明通过加大气量提高的传质水平已达上限。同时,MnOx@TiO2催化剂对亚硫酸钠的氧化也表现出了较好的催化效果,在通入气量为50 mL·min−1时氧化产物中的$ {\rm{S}}{{\rm{O}}_3}^{2 - }$ 质量浓度均在500 mg·L−1以下,说明大部分低价硫转化生成了硫酸钠。可见,当空气量在5~50 mL·min−1内,即空气过量的条件下气量对MnOx@TiO2活性的影响不大,通入气量为50 mL·min−1时最有利于硫代硫酸钠的深度氧化。2) 反应时间的影响。图3为反应温度65 ℃、空气气量50 mL·min−1的条件下,在25~75 h内反应时间对硫代硫酸钠转化率(以
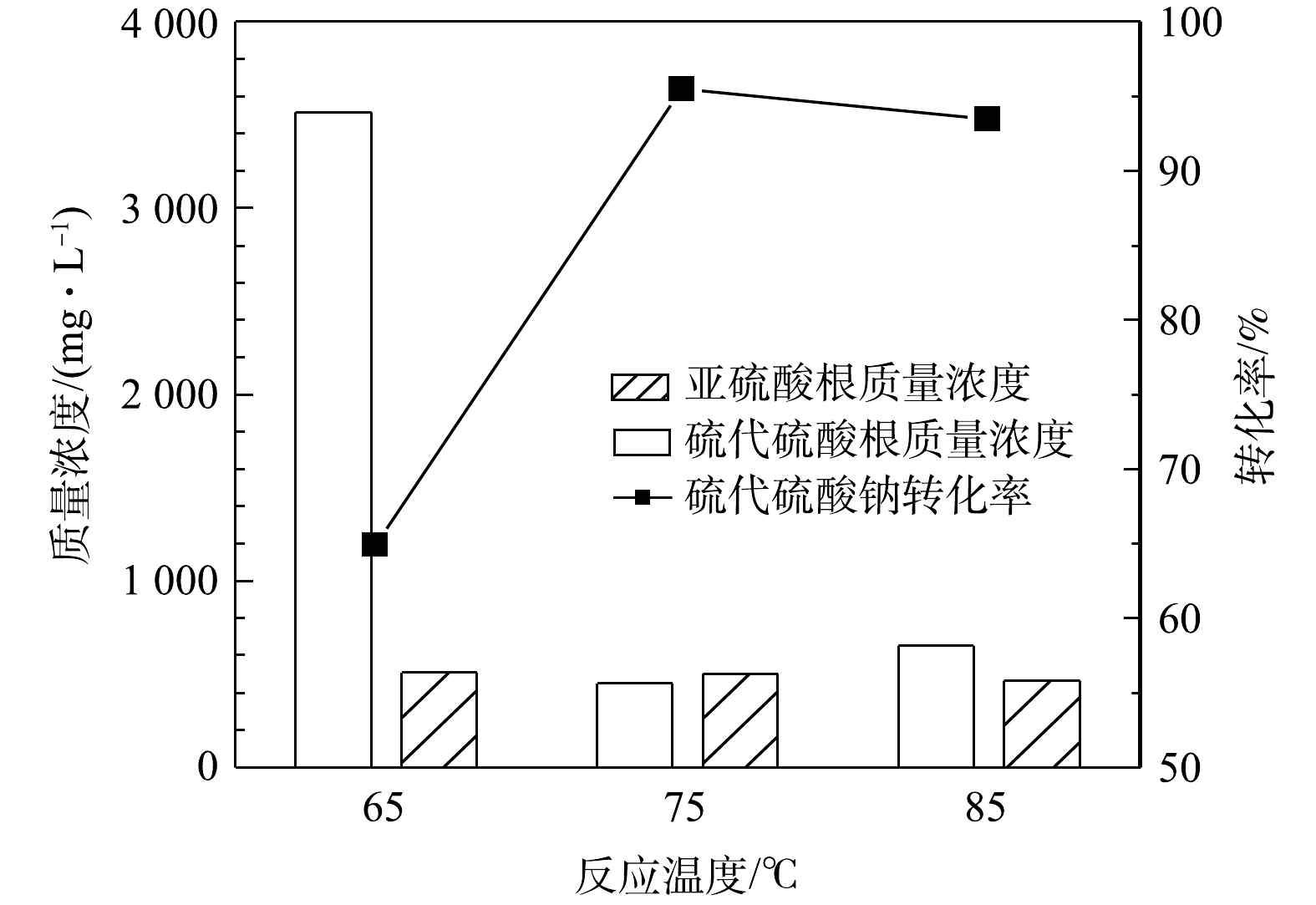
$ {{\rm{S}}_{\rm{2}}}{{\rm{O}}_3}^{2 - }$ 计)的影响。由图3可知,反应时间对硫代硫酸钠的转化有较大影响,硫代硫酸钠的转化率随反应时间的增加而升高,反应50 h后硫代硫酸钠的转化率即可达到96%,同时出水中$ {\rm{S}}{{\rm{O}}_3}^{2 - }$ 的质量浓度为518 mg·L−1。当反应时间延长至75 h时,硫代硫酸钠基本完全转化,出水中还存在少量的$ {\rm{S}}{{\rm{O}}_3}^{2 - }$ ,说明反应时间由50 h延长到75 h时会发生硫代硫酸钠氧化和亚硫酸钠氧化的竞争反应。由此研究结果可知,反应时间对MnOx@TiO2的活性影响较大,在此系统中最佳反应时间为50 h。3) 反应温度的影响。在反应时间为25 h、空气气量为50 mL·min−1的条件下,反应温度对硫代硫酸钠(以
$ {{\rm{S}}_{\rm{2}}}{{\rm{O}}_3}^{2 - }$ 计)转化率的影响结果见图4。由图4可见,硫代硫酸钠的催化氧化反应对温度敏感,在65~85 ℃内转化率首先随着温度的升高而升高,在75 ℃转化率达到最高(96%),当温度升高至85 ℃时转化率反而下降。温度升高有利于提高氧化效率,但是温度升高也会导致氧气溶解度降低,在温度和溶解氧的共同作用下,反应温度为75 ℃时氧化效率最高。 -
对最佳反应条件下(反应温度75 ℃、反应时间25 h、空气气量50 mL·min−1)不同因素对硫代硫酸钠转化的作用进行了讨论。通过空白反应(玻璃珠替代催化剂)考察空气氧化作用,此时硫代硫酸钠转化率(以
$ {{\rm{S}}_{\rm{2}}}{{\rm{O}}_3}^{2 - }$ 计)仅为4%;加入载体对硫代硫酸钠转化率的提高了1%;使用ICP分析MnOx@TiO2在最佳反应条件下Mn的溶出量为190.5 mg·L−1,在Mn2+(使用MnSO4为前驱体)质量浓度为190.5 mg·L−1的均相催化系统中,硫代硫酸钠的转化未见提高。硫代硫酸钠在最佳反应条件下转化率为96%。其中,空气氧化对硫代硫酸钠转化的贡献率为4.17%;吸附剂载体对硫代硫酸钠的吸附率为1.04%;而溶出Mn2+对硫代硫酸钠的转化没有影响;多相催化湿式空气氧化对硫代硫酸钠转化的贡献比重占94.79%。当硫代硫酸钠模型废水
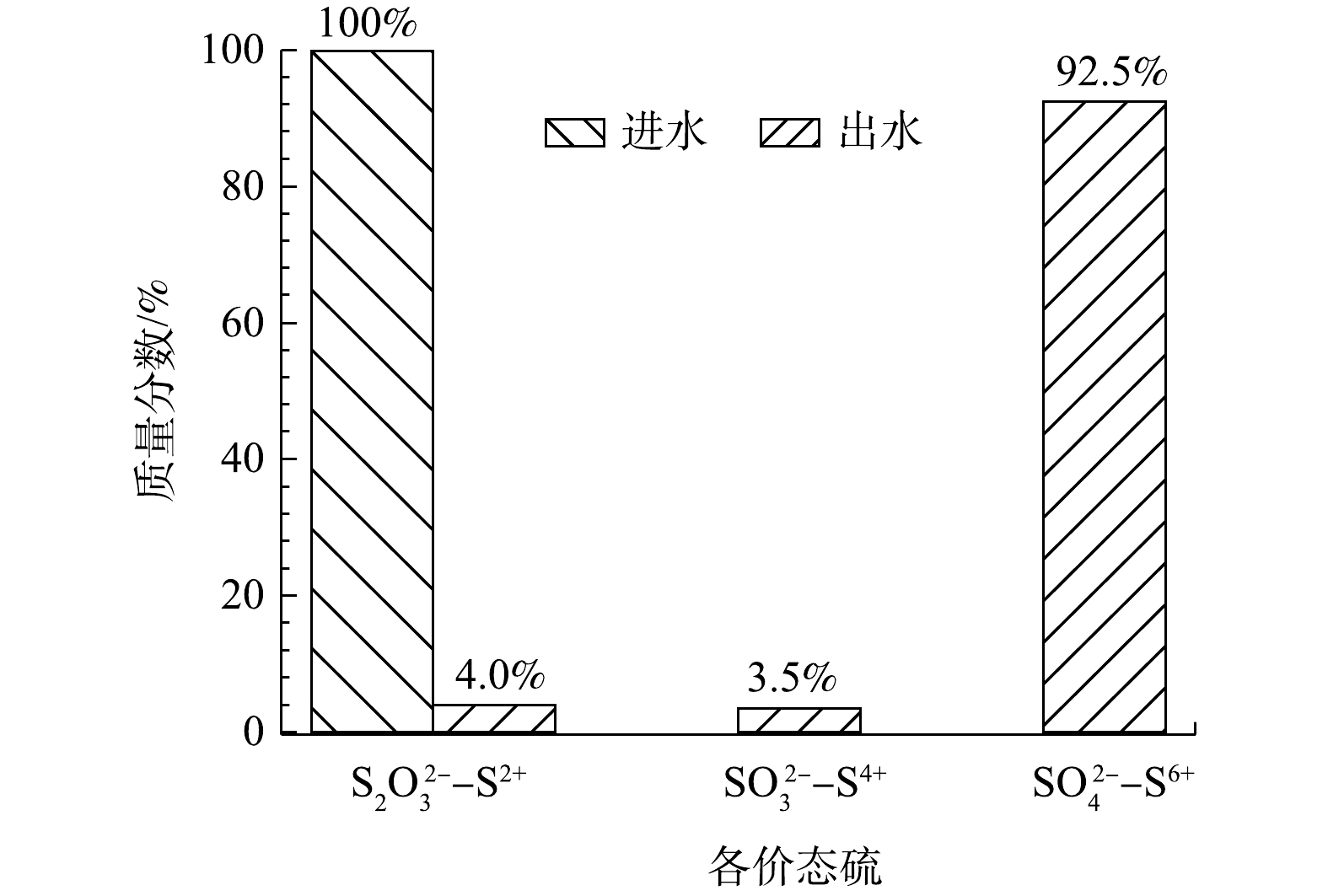
$ {{\rm{S}}_{\rm{2}}}{{\rm{O}}_3}^{2 - }$ 质量浓度为10 000 mg·L−1,硫代硫酸钠转化率在最佳条件下为96%。由图5可知,在最优条件下92.5%的低价态硫均被氧化为最高价态的硫酸根。 -
1) XRF表征。由表3的XRF元素分析结果可见,TiO2载体本身不含Mn,载体在经过浸泡-烘干-煅烧后负载Mn,其质量分数1.9%,基本符合理论值2%。催化剂在经过共300 h的使用后,Mn质量分数仅剩0.2%,较使用前流失1.7%,但Mn的流失并未影响催化剂对硫代硫酸钠催化氧化的活性,同图5中硫代硫酸钠转化率分析结果一致,即均相Mn2+不起作用,主要起催化作用的是多相催化剂MnOx@TiO2。由此可见,Mn质量分数为0.2%的MnOx@TiO2催化剂活性就足以在此半连续反应系统中处理
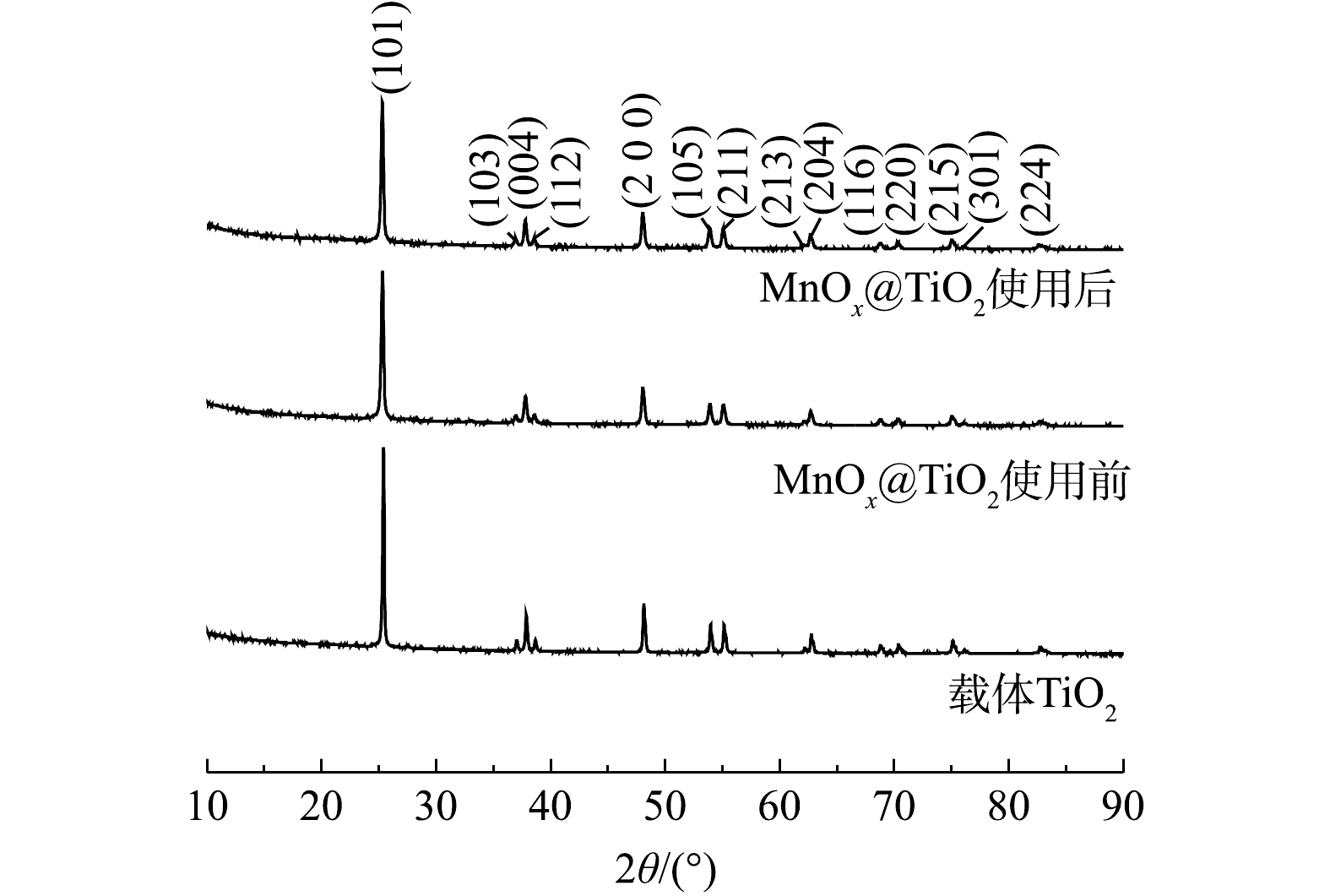
$ {{\rm{S}}_{\rm{2}}}{{\rm{O}}_3}^{2 - }$ 质量浓度高达10 000 mg·L−1的硫代硫酸钠废液。使用前MnOx@TiO2主要杂质元素为S,其质量分数为0.7%,使用后主要杂质为Na,其质量分数为0.5%。但杂质元素未对催化剂活性产生影响。2) XRD表征。TiO2及MnOx@TiO2使用前后的XRD衍射图谱如图6所示。由图6可以看出,载体及使用前后的催化剂均有明显的锐钛矿型TiO2的特征峰。MnOx@TiO2使用前后的衍射图谱基本重叠,可以说明MnOx@TiO2在使用过程中未发生晶体结构上的改变,表现出良好的催化剂稳定性。使用前后的MnOx@TiO2衍射图谱中并未出现锰氧化物的特征峰,这可能是因为MnOx质量分数较低或MnOx以无固定形态在载体表面均匀分散。为进一步确定催化剂表面Mn价态和催化剂表面组成,对样品进行XPS表征。
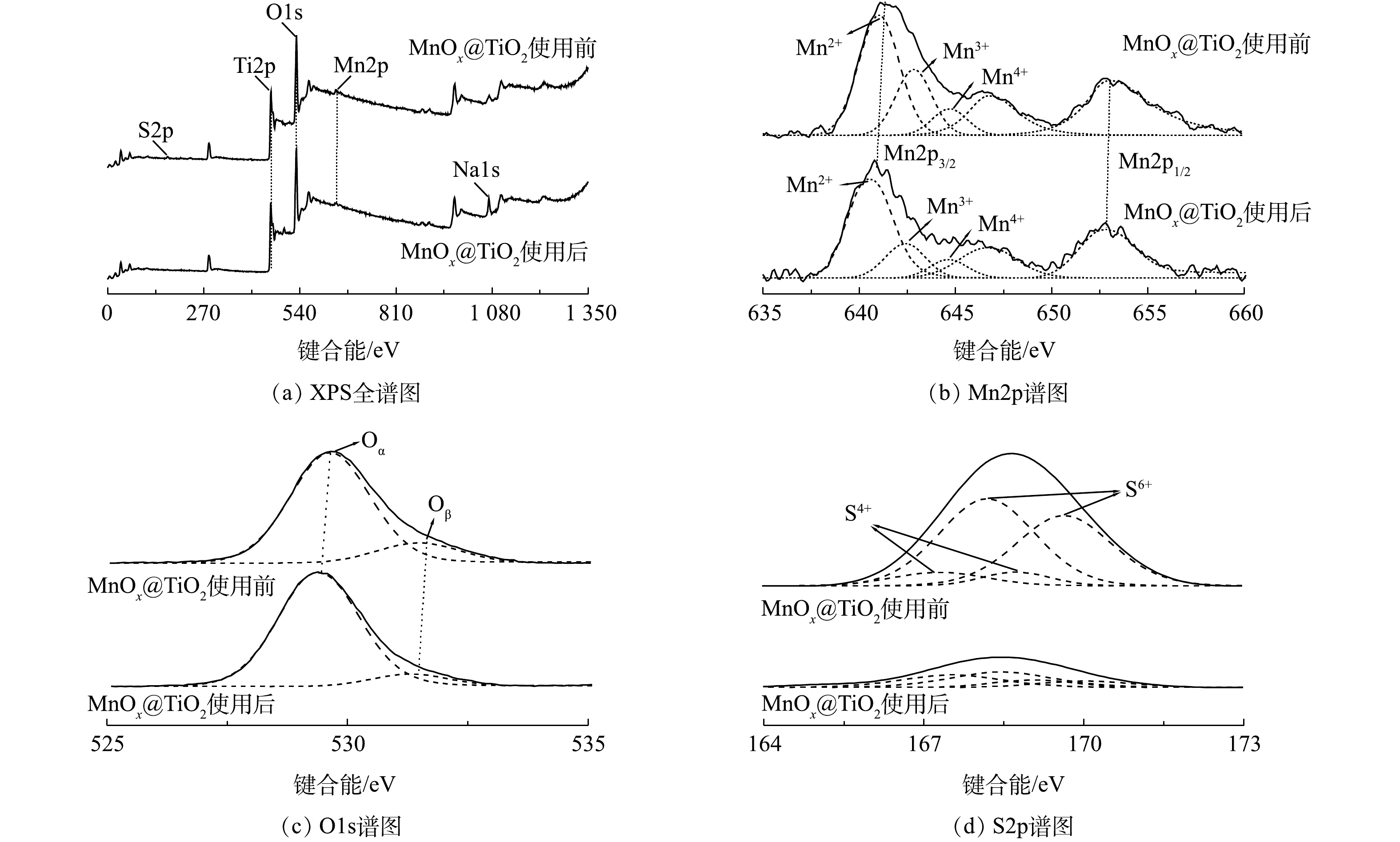
3) XPS分析。催化剂表面元素种类、价态及氧物种是影响催化剂活性的重要因素。图7为MnOx@TiO2使用前后的XPS谱图,图7(a)为MnOx@TiO2使用前后的全谱图。可以看出,使用前的MnOx@TiO2表面主要出现Ti2p、O1s、Mn2p和S2p峰,使用后S2P峰基本消失,出现Na1s峰,其结果与XPF结果(表3)相符。因Mn负载量较小,扫描出的Mn3s谱图信噪比较差,因此,不在此列出。
为确定催化剂表面Mn价态,对Mn2p谱图进行分峰拟合(图7(b))。Mn2p图谱因能级分裂产生2个分裂峰:Mn2p3/2和Mn2p1/2。使用前后MnOx@TiO2的Mn2p3/2可拟合出3个峰,说明催化剂表面存在多种价态的Mn,分别对应Mn2+(640.4~641.0 eV)、Mn3+(642.4~642.7 eV)以及Mn4+(644.1~644.6 eV),在646.6 eV处出现伴峰。Mn3+和Mn4+的结合能明显高于理论值(641.7±0.2) eV和(643.0±0.2) eV[14-15],这种结合能的偏移是由MnOx与TiO2载体的相互作用导致的。为了对催化剂表面Mn价态和组成的比例进行分析,对拟合峰进行积分,结果汇总于表4。催化剂使用前后Mn4+原子百分比在8%~9%保持不变,Mn2+原子百分比由46%升到54%,而Mn3+原子百分比由23%降到16%。以上结果说明,在此催化系统中催化剂活性主要依赖于表面Mn2+与Mn3+之间的催化循环,催化剂中的Mn3+在反应中被还原,起到了氧化位点作用。
图7(c)为MnOx@TiO2使用前后O1s的XPS谱图。O1s的峰可分为2个峰[16],在低结合能处的峰(529.4~529.7 eV)可归属于表面晶格氧Oα,在高结合能处的峰则归属于化学吸附氧Oβ(531.3~531.5 eV),主要以氧缺陷的形式存在(
$ {{\rm{O}}_2}^{2 - }$ 和O−[17])。结合表4可见,MnOx@TiO2在使用后,Oβ峰占比降低,Oα峰占比升高,说明催化剂表面化学吸附氧物种在硫代硫酸钠的氧化过程中可能转化为晶格氧。图7(d)为MnOx@TiO2使用前后S2p的XPS谱图。S2p的峰可分为4个峰[18],结合能由小到大分别为S4+2p3/2、S6+2p3/2、S4+2p1/2、S6+2p1/2。使用前MnOx@TiO2表面主要检测到S6+2p3/2峰及S6+2p1/2峰,说明S在使用前的MnOx@TiO2表面以硫氧化物的形态存在。反应后的MnOx@TiO2表面几乎检测不到S2p峰,可以推断,经MnSO4溶液浸泡、450 ℃空气气氛焙烧后的MnOx@TiO2表面仍有未完全转化为MnOx的MnSO4存在,而这些MnSO4随反应过程中的反复冲洗洗涤脱落,证明起到催化活性的不是MnSO4而是MnOx,这与硫代硫酸钠转化率分析结果一致。
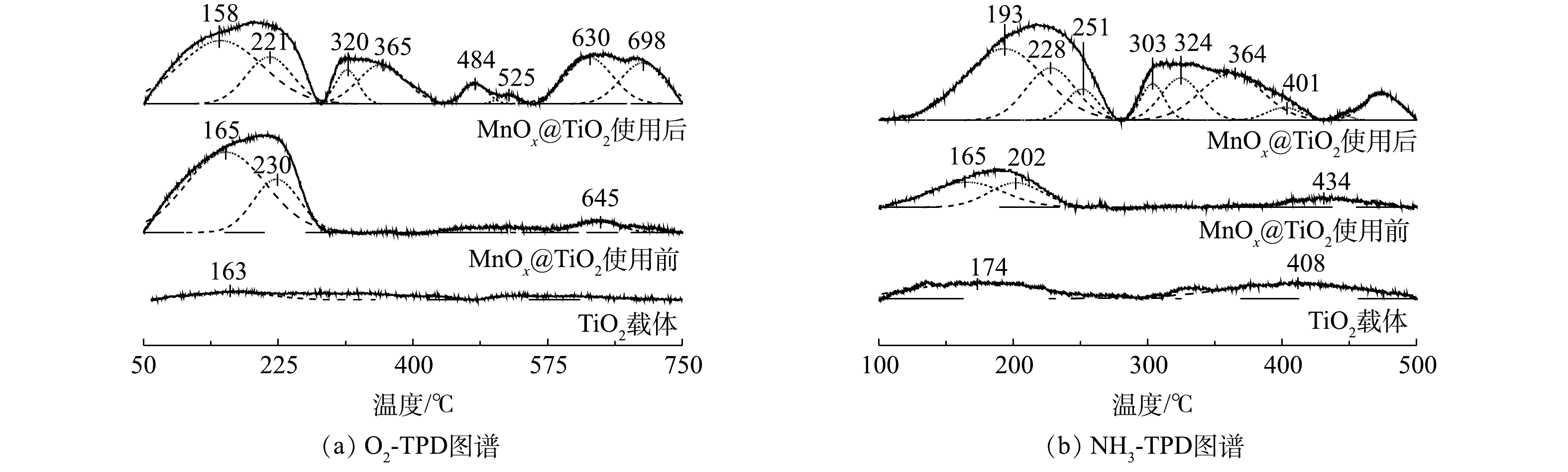
4) O2-/NH3-TPD分析。催化剂表面氧气吸附性能和表面酸性是影响催化剂活性的2个重要因素。采用O2-TPD研究MnOx@TiO2表面对氧气的吸附性能。一般来说,在O2-TPD测试中,低于400 ℃的脱附峰可归属为表面吸附氧(Oβ)的脱附峰;而高于400 ℃的脱附峰可归属于晶格氧(Oα)的脱附峰[19]。由图8(a)可见,TiO2的O2-TPD图谱的脱附峰信号非常弱,这说明TiO2表面吸附氧物种量非常少可忽略。通过负载MnOx,低温区出现O2脱附峰,MnOx@TiO2表面可以吸附氧物种。使用后MnOx@TiO2具有更高的氧吸附量,说明MnOx@TiO2在催化硫代硫酸钠的氧化过程中形成了更多的氧缺陷更容易吸附氧气,所以反应后催化剂仍能保持较高的催化活性。
催化剂表面酸性通过NH3-TPD的检测进行分析。由图8(b)可见,载体本身并没有出现明显的NH3脱附峰,说明载体表面本身酸性位点量非常少。使用前的MnOx@TiO2在100~250 ℃以及使用后的MnOx@TiO2在100~250 ℃和250~500 ℃有明显的NH3脱附峰。100~250 ℃的低温NH3脱附峰属于弱酸性位点的NH3脱附峰,250~500 ℃的高温NH3脱附峰则属于中强和强酸性位点的NH3脱附峰[14, 17]。新鲜制备的催化剂出现较强的NH3低温脱附峰,说明在负载MnOx后催化剂表面主要形成弱酸性位点,而这些酸性位点主要以Brønsted酸的形式存在[20]。使用后的催化剂出现了更强的低温NH3脱附峰,并且出现了多个较强的高温NH3脱附峰,说明MnOx@TiO2在使用后酸性位点增加,结合O2-TPD的结果,使用后MnOx@TiO2表面酸性位点的增加可能与反应过程中MnOx@TiO2表面形成的氧缺陷有关[21]。
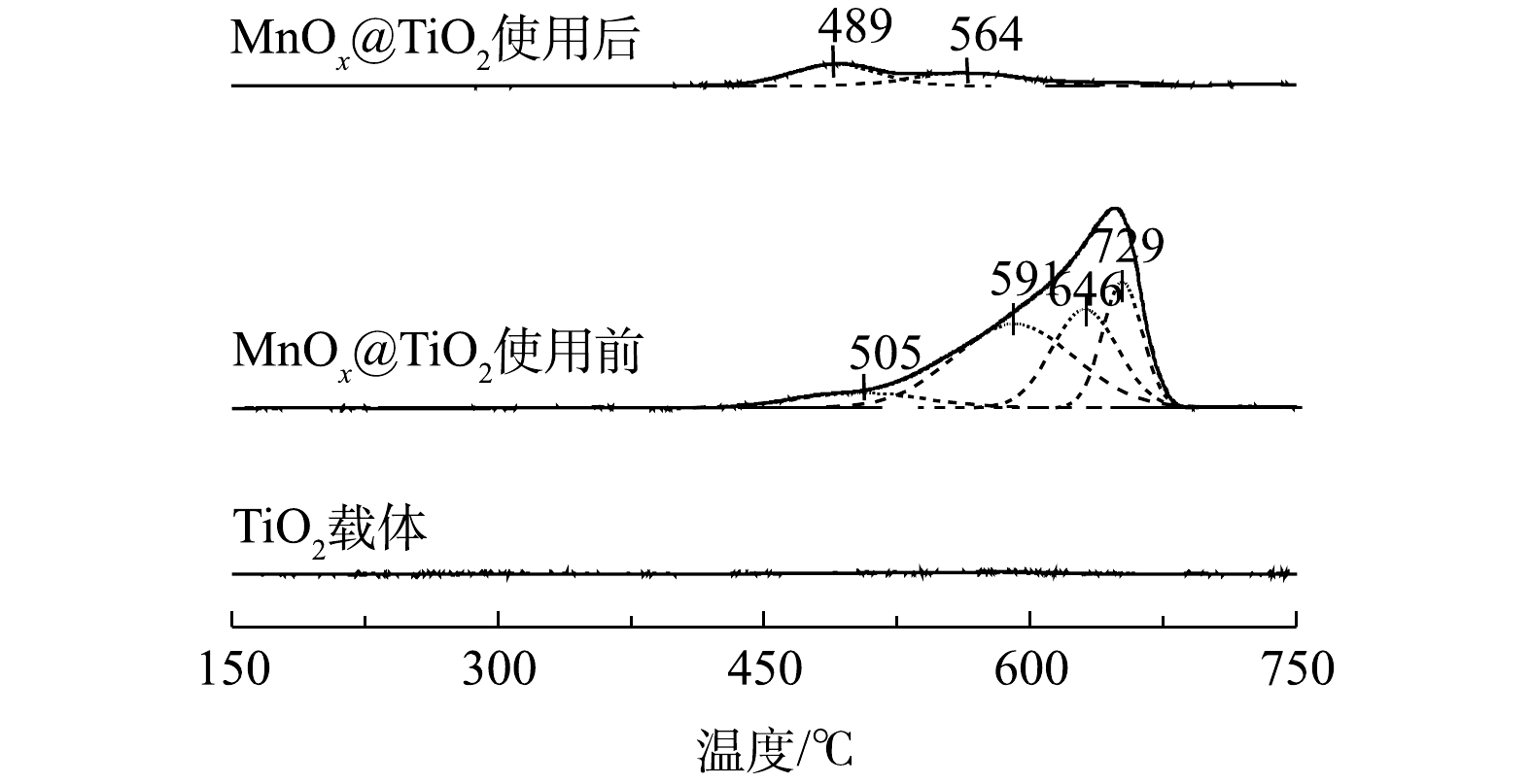
5) H2-TPR分析。图9为TiO2和MnOx@TiO2使用前后在150~750 ℃的H2-TPR图谱。TiO2没有耗氢峰,说明TiO2在这个范围内没有被H2还原。使用前后MnOx@TiO2在489~505 ℃出现的低温还原峰可归属为表面Mn4+氧化物还原为Mn3+氧化物的还原[22],结合XPS结果可见,MnOx@TiO2在使用前后Mn4+氧化物含量较少且保持不变。564~591 ℃内出现的还原峰可归属于Mn3+氧化物到Mn2+氧化物的的还原,此还原峰的显著降低可以再一次证明Mn3+氧化物在MnOx@TiO2催化氧化硫代硫酸钠过程中起到了重要的作用,上述结果同XPS结果一致。而600 ℃以上高温区出现的2个峰则可归属为表面氧及晶格氧的还原[23],使用后的MnOx@TiO2在此范围内只出现非常微弱的还原峰信号,说明表面活性氧及晶格氧在反应过程中的脱落,这与O2-/NH3-TPD的结果相符。
6) BET表征。BET测试结果表明,TiO2比表面积只有8 m2·g−1,通过浸渍-烘干-煅烧后MnOx@TiO2比表面积较载体增大至55 m2·g−1,通过负载煅烧Mn盐和TiO2载体相互作用改变了材料的孔结构,比表面积增加。MnOx@TiO2在每次反应过后都进行清洗干燥,在共计使用300 h后比表面积较使用前没有变化,表明MnOx@TiO2在使用后结构稳定。
-
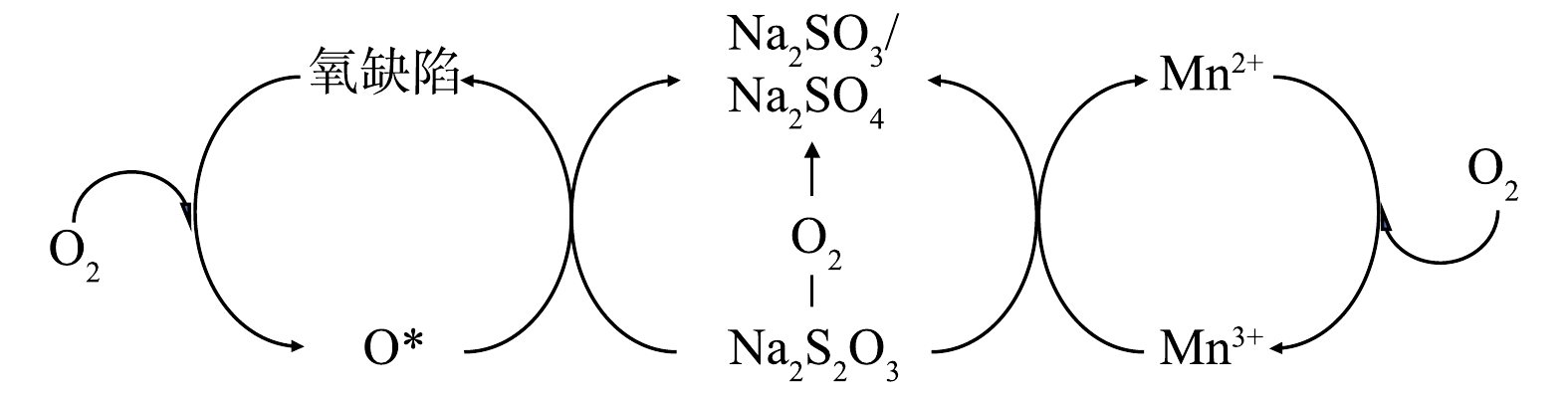
结合2.2中的分析和催化表征结果可知,常压催化湿式空气氧化硫代硫酸钠中起主要催化作用的是多相催化湿式空气氧化,对硫代硫酸钠转化的贡献比重占94.79%,可能的反应机制如图10所示。催化剂活性位点为Mn2+/Mn3+催化循环和催化剂表面氧缺陷。一方面,催化剂中的Mn3+作为氧化位点在反应中被还原生成Mn2+,而后Mn2+会被氧气氧化回Mn3+状态,从而实现催化循环;另一方面,MnOx@TiO2中的氧缺陷更容易吸附氧气形成活性氧物种或晶格氧,实现硫代硫酸钠的氧化。
为进一步验证此反应机理,使用Mn2O3与硫代硫酸钠直接进行氧化反应。在最佳反应条件 (反应温度75 ℃、反应时间25 h、空气气量50 mL·min−1)下,加入与MnOx@TiO2等物质量的Mn的Mn2O3,硫代硫酸钠转化率为35%,说明Mn2O3作为活性物种参与了硫代硫酸钠的氧化过程。最佳反应条件下使用MnOx@TiO2的硫代硫酸钠转化率为96%,较使用Mn2O3的硫代硫酸钠转化率高出61%,此结果可以说明,MnOx@TiO2催化氧化硫代硫酸钠是Mn2+/Mn3+氧化位点的催化循环以及催化剂表面形成的氧缺陷的共同作用。
-
1) 在常压系统下,通过浸渍-煅烧制备的MnOx@TiO2对硫代硫酸钠氧化有较好的催化效果,其催化活性受反应温度的影响,较低的温度不利于氧化反应的进行,而较高的温度不利于常压下氧气在水中的溶解,最佳反应温度为75 ℃。
2) 硫代硫酸钠的转化率随反应时间的延长而提高,反应25 h转化率可达到90%以上;继续延长反应时间可以提升硫代硫酸钠的转化率,但不利于硫代硫酸钠的深度氧化。
3) 当硫代硫酸钠模拟废水中
$ {{\rm{S}}_{\rm{2}}}{{\rm{O}}_3}^{2 - }$ 质量浓度为10 000 mg·L−1时,最佳反应条件为反应温度75 ℃、反应时间25 h、空气气量50 mL·min−1;硫代硫酸钠转化率在最佳条件下为96%,92.5%的低价态硫都被氧化为最高价态的硫酸根。4) MnOx@TiO2的主要活性成分为Mn2O3,反应过程中,在MnOx@TiO2表面主要发生由Mn2O3到MnO的转化。同时,MnOx@TiO2表面形成的氧缺陷为O2与
$ {{\rm{S}}_{\rm{2}}}{{\rm{O}}_3}^{2 - }$ 之间的电子转移提供了更多位点,从而可提高MnOx@TiO2对硫代硫酸钠的催化氧化效率。
MnOx@TiO2常压催化湿式空气氧化硫代硫酸钠
Catalytic wet air oxidation of sodium thiosulfate under atmospheric pressure with MnOx@TiO2
-
摘要: 应用MnOx@TiO2催化剂在常压条件下催化湿式空气氧化高浓度硫代硫酸钠,分别考察了空气气量、反应温度和反应时间对高浓度硫代硫酸钠转化率的影响,并采用XRF、XRD、XPS、NH3-/O2-TPD、H2-TPR、BET对使用前后的催化剂进行了分析和表征。结果表明,通入空气中的氧气含量在过量的情况下,气量对硫代硫酸钠的转化影响不大。硫代硫酸钠的转化率随着反应时间的增加而升高;在65~85 ℃内,硫代硫酸钠的转化率先增大后减小。使用Mn负载质量分数为2%的催化剂,使用硫代硫酸钠为模型底物,当
$ {{\rm{S}}_{\rm{2}}}{{\rm{O}}_3}^{2 - }$ 质量浓度为10 000 mg·L−1时,最佳反应条件为气量50 mL·min−1、反应时间25 h、反应温度75 ℃,硫代硫酸钠转化率可达到96%。催化剂表征结果表明,MnOx@TiO2表面存在多种形态的锰氧化物,其中主要活性成分为Mn2O3,硫代硫酸钠的氧化过程伴随着催化剂表面Mn3+到Mn2+的电子转移。同时,MnOx@TiO2表面的各种锰氧化物为$ {{\rm{S}}_{\rm{2}}}{{\rm{O}}_3}^{2 - }$ 与O2之间的电子转移提供了更多位点,而这种电子转移也导致催化剂表面氧缺陷的增加。这些结果证明了MnOx@TiO2常压催化湿式空气氧化硫代硫酸钠的可行性,为含硫废碱液高效、经济的预处理技术的开发提供了可能性。Abstract: This work reported the effects of the airflow, the temperature, the reaction time on sodium thiosulfate conversion. In this process, MnOx@TiO2 catalyst was prepared for the catalytic wet air oxidation of sodium thiosulfate in high concentration under atmospheric pressure. X-ray fluorescence (XRF), X-ray diffraction (XRD), X-Ray Photoelectron Spectroscopy (XPS), temperature-programmed desorption (TPD) with NH3 and O2, temperature-programmed reduction with H2 (H2-TPR) and BET were used to characterize the physicochemical properties of MnOx@TiO2 catalysts before and after the reactions. The results showed that airflow had an insignificant effect on sodium thiosulfate oxidation under the absolute excess of oxygen. Reaction time and reaction temperature were two important influence factors of the catalytic activities. Reaction time increasing showed a positive influence on the conversion of sodium thiosulfate. The catalytic activities first increased then decreased with the increase of temperature from 65 ℃ to 85 ℃. The optimal experimental conditions were airflow of 50 mL·min−1, the reaction time of 25 h, and reaction temperature of 75 ℃, respectively. Under the optimal experimental conditions, the conversion of sodium thiosulfate reached 96% by MnOx@TiO2 with Mn loading amount of 2% when the$ {{\rm{S}}_{\rm{2}}}{{\rm{O}}_3}^{2 - }$ concentration was 10 000 mg·L−1. The result of MnOx@TiO2 characterization showed that there existed various forms of Mn oxides on the surface of the catalyst, of which Mn2O3 was the main active component. The sodium thiosulfate oxidation process was accompanied by the valence conversion of Mn3+ to Mn2+ and electron transfer. At the same time, various Mn oxides on MnOx@TiO2 surface provided more active sites for electron exchange between$ {{\rm{S}}_{\rm{2}}}{{\rm{O}}_3}^{2 - }$ and O2, which led to an increase of oxygen defects on the catalyst surface. All these results proved the feasibility of the catalytic wet air oxidation of thiosulfate at atmospheric pressure with MnOx@TiO2 as the catalyst. This process provided a possibility for improving productivity and economic efficiency of pre-treatment technology for the industrial sulfur-containing spent caustic solution.-
Key words:
- MnOx@TiO2 /
- sodium thiosulfate /
- atmospheric pressure /
- catalytic wet air oxidation
-

-
表 1 湿式空气氧化脱硫工艺汇总
Table 1. A summary of desulfurization process with wet air oxidation process
工艺类型 代表公司 反应温度/℃ 反应压力/MPa 低温湿式氧化 美国斯通韦伯 115 0.7 中温湿式氧化 西门子 200 3.2 高温湿式氧化 西门子 260 8.6 催化湿式氧化 德国拜尔 220 8.6 表 2 催化空气氧化脱硫效果汇总
Table 2. A summary of desulfurization effect with catalytic air oxidation process
表 3 TiO2和MnOx@TiO2使用前后的XRF元素分析结果
Table 3. Elemental analyses of TiO2 and MnOx@TiO2 before and after the reaction
催化剂 质量分数/% Ti O Mn 其他 TiO2 59.3 40.0 0 0.6 MnOx@TiO2使用前 56.9 39.9 1.9 1.4 MnOx@TiO2使用后 58.6 39.9 0.2 1.3 表 4 MnOx@TiO2使用前后XPS结果
Table 4. XPS results of MnOx@TiO2 before and after the reaction
催化剂 键合能/eV (Mn3+/Mnx+)/% (Oβ/O)/% Mn2+ Mn3+ Mn4+ Oβ MnOx@TiO2 使用前 640.4 642.7 644.6 531.5 23 15 MnOx@TiO2 使用后 641.0 642.4 644.1 531.3 16 10 -
[1] 赵兴龙, 刘丽军, 张克利. 湿式氧化处理含硫废碱液的技术进展[J]. 石油化工安全环保技术, 2008, 24(1): 57-60. doi: 10.3969/j.issn.1673-8659.2008.01.019 [2] 高英. 处理废碱液中硫化物和有机物的方法研究[J]. 化学工程师, 2001(6): 79-50. [3] 何志祥, 宋远清, 戴友芝. 湿式空气氧化法处理废碱液运行调试[J]. 石油化工环境保护, 2004, 27(2): 48-51. [4] 王婷婷. 硫化钠废碱液催化氧化研究[D]. 北京: 北京化工大学, 2011. [5] FU F L, XIONG Y, XIE B P, et al. Adsorption of acid red 73 on copper dithiocarbamate precipitate-type solid wastes[J]. Chemosphere, 2007, 66(1): 1-7. doi: 10.1016/j.chemosphere.2006.05.054 [6] 刘崇华, 周皓, 刘晓群等. 催化氧化法处理含硫废碱液新技术的开发与应用[J]. 油气田环境保护, 2006, 16(3): 14-17. doi: 10.3969/j.issn.1005-3158.2006.03.005 [7] 马艺璇, 马冬晨, 蒋齐光. 湿式催化氧化处理塔河油田脱硫废碱液实验研究[J]. 仪器仪表与分析检测, 2015(4): 42-45. [8] 何长明, 李俊, 刘晓晶. 催化氧化法处理废碱液中硫化物的工程应用研究[J]. 应用化工, 2018, 47(1): 123-125. doi: 10.3969/j.issn.1671-3206.2018.01.031 [9] BAI B, LI J, HAO J. 1D-MnO2, 2D-MnO2 and 3D-MnO2 for low-temperature oxidation of ethanol[J]. Applied Catalysis B:Environmental, 2015, 164: 241-250. doi: 10.1016/j.apcatb.2014.08.044 [10] TANG X F, CHEN J L, HUANG X M, et al. Pt/MnOx-CeO2 catalysts for the complete oxidation of formaldehyde at ambient temperature[J]. Applied Catalysis B:Environmental, 2008, 81(1/2): 115-121. [11] ZHAO B G, RUI R, GUO X G, et al. Nb-modified Mn/Ce/Ti catalyst for the selective catalytic reduction of NO with NH3 at low temperature[J]. Applied Catalysis B:Environmental, 2017, 545: 64-71. doi: 10.1016/j.apcata.2017.07.024 [12] SUN C Z, LIU H, CHEN W, et al. Insights into the Sn/Zr co-doping effects on N2 selectivity and SO2 resistance of a MnOx-TiO2 catalyst for the NH3-SCR reaction[J]. Chemical Engineering Journal, 2018, 347: 27-40. doi: 10.1016/j.cej.2018.04.029 [13] 马兵兵, 苏中华, 弥海鹏, 等. 间接碘量法测定氧化铝生产流程样品铝酸钠溶液中硫离子、硫代硫酸钠和亚硫酸根[J]. 冶金分析, 2016, 36(11): 41-45. [14] KWON D W, NAM K B, HONG S C. Influence of tungsten on the activity of a Mn/Ce/W/Ti catalyst for the selective catalytic reduction of NO with NH3 at low temperatures[J]. Applied Catalysis A:General, 2015, 497: 160-166. doi: 10.1016/j.apcata.2015.01.013 [15] CHEN H H, ZHANG H P, YAN Y. Fabrication of porous copper/manganese binary oxides modified ZSM-5 membrane catalyst and potential application in the removal of VOCs[J]. Chemical Engineering Journal, 2014, 254: 133-142. doi: 10.1016/j.cej.2014.05.083 [16] WANG X M, LI X Y, ZHAO Q D, et al. Improved activity of W-modified MnOx-TiO2 catalysts for the selective catalytic reduction of NO with NH3[J]. Chemical Engineering Journal, 2016, 288: 216-222. [17] DUPIN J C, GONBEAU D, VINATIER P, et al. Systematic XPS studies of metal oxides, hydroxides and peroxides[J]. Physical Chemistry Chemical Physics, 2000, 2(6): 1319-1324. doi: 10.1039/a908800h [18] LIU S X, CHEN X Y. A visible light response TiO2 photocatalyst realized by cationic S-doping and its application for phenol degradation[J]. Journal of Hazardous Materials, 2008, 152: 48-55. doi: 10.1016/j.jhazmat.2007.06.062 [19] PUTLURU S S R, SCHILL L, JENSEN A D, et al. Mn/TiO2 and Mn-Fe/TiO2 catalysts synthesized by deposition precipitation-promising for selective catalytic reduction of NO with NH3 at low temperature[J]. Applied Catalysis B:Environmental, 2015, 165: 628-635. doi: 10.1016/j.apcatb.2014.10.060 [20] GUO R T, WANG Q S, PAN W G, et al. The poisoning effect of heavy metals doping on Mn/TiO2 catalyst for selective catalytic reduction of NO with NH3[J]. Journal of Molecular Catalysis A:Chemical, 2015, 407: 1-7. doi: 10.1016/j.molcata.2015.06.017 [21] SUN P, HUANG S X, GUO R T, et al. The enhanced SCR performance and SO2 resistance of MnOx/TiO2 catalyst by the modification with Nb: A mechanistic study[J]. Applied Surface Science, 2018, 447: 479-488. doi: 10.1016/j.apsusc.2018.03.245 [22] CHEN Q L, GUO R T, WANG Q S, et al. The catalytic performance of Mn/TiWOx catalyst for selective catalytic reduction of NOx with NH3[J]. Fuel, 2016, 181: 852-858. doi: 10.1016/j.fuel.2016.05.045 [23] QU R Y, PENG Y, SUN X X, et al. Identification of the reaction pathway and reactive species for the selective catalytic reduction of NO with NH3 over cerium-niobium oxide catalysts[J]. Catalysis Science & Technology, 2016, 6: 2136-2142. -







 下载:
下载: