-
我国分散式农村生活污水[1]、河流湖泊水体[2]等氮污染形势严峻,且存在低碳氮比问题,而国家对环境中的TN要求日益严格。目前污水中氮主要通过生物异养反硝化去除[3],其原理是反硝化菌在缺氧或厌氧环境下以有机物作为电子供体,硝氮 (NO3−-N) 为最终电子受体,通过电子传递链将NO3−依次还原为NO2−、NO、N2O和N2 [4]。碳源与电子供体会影响反硝化效果,碳源缺乏往往导致NO3−去除率低[5]。低碳氮比污水存在碳源不足的问题,致使总氮 (TN) 超标,为提高TN脱除效果,通常需投加额外碳源[6]。固相碳源是一种可替代传统液相碳源的新型碳源[7],包括人工合成聚合物[8]、农业废弃物[5]等,其已被应用于地表水、人工湿地[9]、循环水产养殖[10]等氮的去除中,并取得了一定的效果[11]。植物碳源 (如稻壳、秸秆、木屑、芦苇等[12]) 因其廉价易得逐渐成为研究热点,其主要成分为木质纤维素 (由纤维素、半纤维和木质素组成) ,木质纤维素中的纤维素和半纤维可被微生物降解为小分子有机物,用于反硝化脱氮[3, 5]。一般植物碳源存在碳源释放不稳定、反硝化率低、有机物过量释放等问题[11]。如何在碳源释放稳定的前提下,进一步提高碳源水解能力,是植物碳源应用的关键[11-12]。
我国竹资源丰富,竹林面积约占森林面积的3%[13]。同时竹产业成熟,竹产品获取方便灵活,是一种潜在的廉价碳源。纤维絮状竹刨花是竹加工后的产物,主要成分为木质纤维素[14]。竹刨花不同于粉碎的竹屑,其具有一定强度与韧性[15],纤维交互堆叠并具有丰富孔隙,不易堵塞,表面粗糙,利于微生物附着,可作为污水处理填料和反硝化碳源。与一般禾本科农业植物不同,竹为木质生物质,纤维素和木质素含量更高,纤维结构更加复杂紧密[16],导致微生物的分解相对困难。木质生物质的缺点是反硝化率不高[11, 17],优点是利于长期应用[18]。
零价铁具有化学还原性强、对微生物的生长有益、氧化产物无毒的特点[19],被广泛应用于地下水、废水污染物的去除[20]等方面。生物反应器中的零价铁可刺激微生物进化并增加微生物多样性,释放的铁离子可加强微生物聚集并增加生物量,提高生物降解能力[21]。已有研究[22-23] 将零价铁与厌氧生物处理方法耦合以去除水中硝氮,结果表明,耦合体系具有污染物质去除率高、性能稳定、成本低等特点。纳米铁、铁粉等粒径小的铁虽比表面积大、活性高,但腐蚀过快[24],不利于长期利用。此外,较小的粒径尺寸增加了实际应用难度。已有研究[21]显示,比表面积较低的铁形态在水中的腐蚀相对较慢,在强化生物脱氮的过程中,可减少NH4+的形成,是一种较受青睐的铁形态。铁屑是金属加工后的废料,不仅成本低,而且比表面积也低于纳米铁或铁粉等,利于长期应用,且其具有较好的机械与水力特性,更加符合实际应用需求[25]。目前,将铁屑与竹基固相反硝化系统耦合以强化脱氮的研究鲜见报道。
本研究以纤维絮状竹刨花为固体碳源和生物膜载体,引入铁屑,构成耦合体系,从而高效去除低C/N比废水中TN;通过监测装置进、出水水质,考察体系对TN的去除以及有机物、总铁的释放情况等;采用扫描电镜、高通量测序等表征方法分析微生物群落结构和多样性,旨在为高效、稳定、经济地去除低C/N比废水中TN提供技术参考,同时满足 “十四五”规划中“全面提高资源利用效率”“持续改善环境质量”等的要求。
-
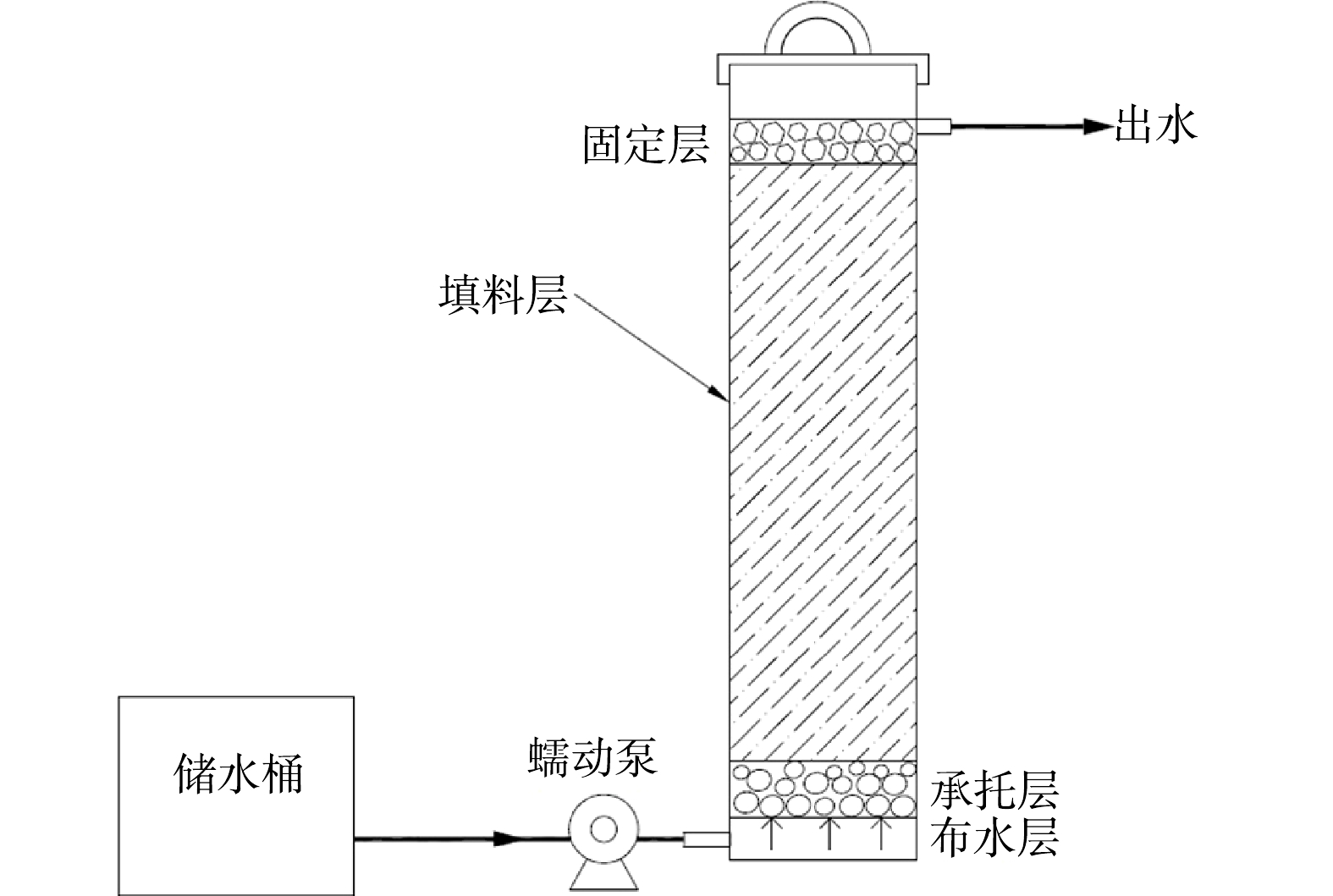
1) 实验材料。竹刨花为毛竹制作竹篾过程中的副产物,刨花丝宽0~4 mm、厚0~1 mm、长1~30 cm,整体呈为团聚状。将竹刨花过60目筛,去除粉屑,40 ℃ 烘干待用,测得其湿体积密度为182 g·L−1。铁屑为车床铁加工后的废料,挑选出宽1.5~3 mm,长2~5 cm的呈螺旋状的铁屑,40 ℃干燥待用,测得其湿体积密度为0.17 mL·g−1。将粒径为1.5~3 cm的鹅卵石与火山岩清洗干燥,用于反硝化装置的承托层与固定层。实验中,投加武汉水之国公司 (www.szghb.com) 生产的复合脱氮菌剂,以确保反硝化菌的挂膜。
2) 实验废水。实验废水采用自来水配置,以KNO3为N源,KH2PO4为P源,加入1 mg·L−1微量元素溶液,补充微生物生长所需微量元素。微量元素溶液中微量元素组成包括120 mg·L−1 ZnSO4·7H2O、20 mg·L−1 MgSO4·7H2O、30 mg·L−1 KI、30 mg·L−1 CoCl2·6 H2O、30 mg·L−1 CaCl2、20 mg·L−1 MnCl2。实验废水中TN为41.62~59.95 mg·L−1,COD为(9.92±3.36) mg·L−1,TP为 (1.14±0.06) mg·L−1,NO2−-N、NH3-N和总铁基本检测不到,pH为 7.29±0.21。
-
实验采用连续流动态反硝化装置 (图1) ,反应柱为透明有机玻璃制成,内径为11 cm,高为50 cm,从下至上分别为鹅卵石承托层 (约5 cm) 、填料层 (约32 cm) 和火山岩固定层 (约3 cm) 。装置共2组:1号为耦合体系实验组,其填料层为160 g竹刨花、80 g铁屑和1 g菌剂,竹刨花逐层铺设,铁屑分2次铺设于填料层底部,装填时,将1 g菌剂分层铺洒于填料层中;2号为单纯固相反硝化对照组,填料层只有160 g竹刨花,和1 g菌剂,铺设同上,菌剂为武汉水之国复合脱氮菌剂 (主要成分为短小芽孢杆杆菌、腊样芽孢杆菌、苏云金芽孢杆菌属微生物及营养剂等,有效活菌数≥200×108个·g−1) 。实验装置总有效体积约为2.16 L,采用底部连续进水方式,室温运行 105 d (2021年5—9月) 。先从装置底部进水,使填料完全浸没,之后停止进水并浸泡1周,再开始连续进水并计时。进水流速为2 mL·min−1,水力停留时间约为18 h。定期测试进、出水的TN、COD、总铁等指标。0~73 d,进水TN约为40 mg·L−1;74~105 d,进水TN升至60 mg·L−1左右。根据进水TN质量浓度与TN去除效果,运行的0~12 d设定为启动阶段,13~73 d为阶段I,74~105 d为阶段II。
-
1) 水质分析。采用德国耶拿Multi N/C ®2100仪器测定TN,采用重铬酸盐法 (HJ 828-2017) 测定COD,采用邻菲罗啉分光光度法 (HJ/T 345-2007) 测定总铁,采用N-(1-萘基)-乙二胺分光光度法 (GB/T 7493-1987) 测定NO2−-N,采用纳氏试剂分光光度法 (HJ 535-2009) 测定NH3-N,采用钼酸铵分光光度法 (GB 11893-1989) 测定TP,采用电极 (PHB-4) 测定pH,所用药品均为分析纯。
2) 微生物及分子生物学分析。在装置运行的第98天,取装置内部生物膜生长良好的竹刨花进行SEM观察并进行16S rRNA测试。选取2~5 mm竹刨花填料小块,使用2.5%戊二醛 (电镜专用) 使其固定,使用磷酸缓冲液进行清洗,使用乙醇进行梯度脱水,再进行临界点干燥和喷金,然后置于SEM电镜下观察。实验前的竹刨花由于没有生物膜,无需进行生物固定操作,直接干燥喷金观察。取填料层顶部5~7 cm厚湿竹刨花,质量约为100 g,放在装有纯水的烧杯中,用玻璃棒振搅,使其表面生物膜脱落,之后再将竹刨花回填于装置内,剩余生物膜溶液离心浓缩至约5 mL,低温保存,用于高通量测序。高通量测序采用MiseqPE 250测序模式,选择16S rRNA V3~V4区引物338 F和806 R (引物序列ACTCCTACGGGAGGCAGCA和GGACTACHVGGGTWTCTAAT) 对样品进行测试并分析测试结果,得到样品的菌群结构。以上所有表征均由杭州研趣信息技术有限公司完成。
-
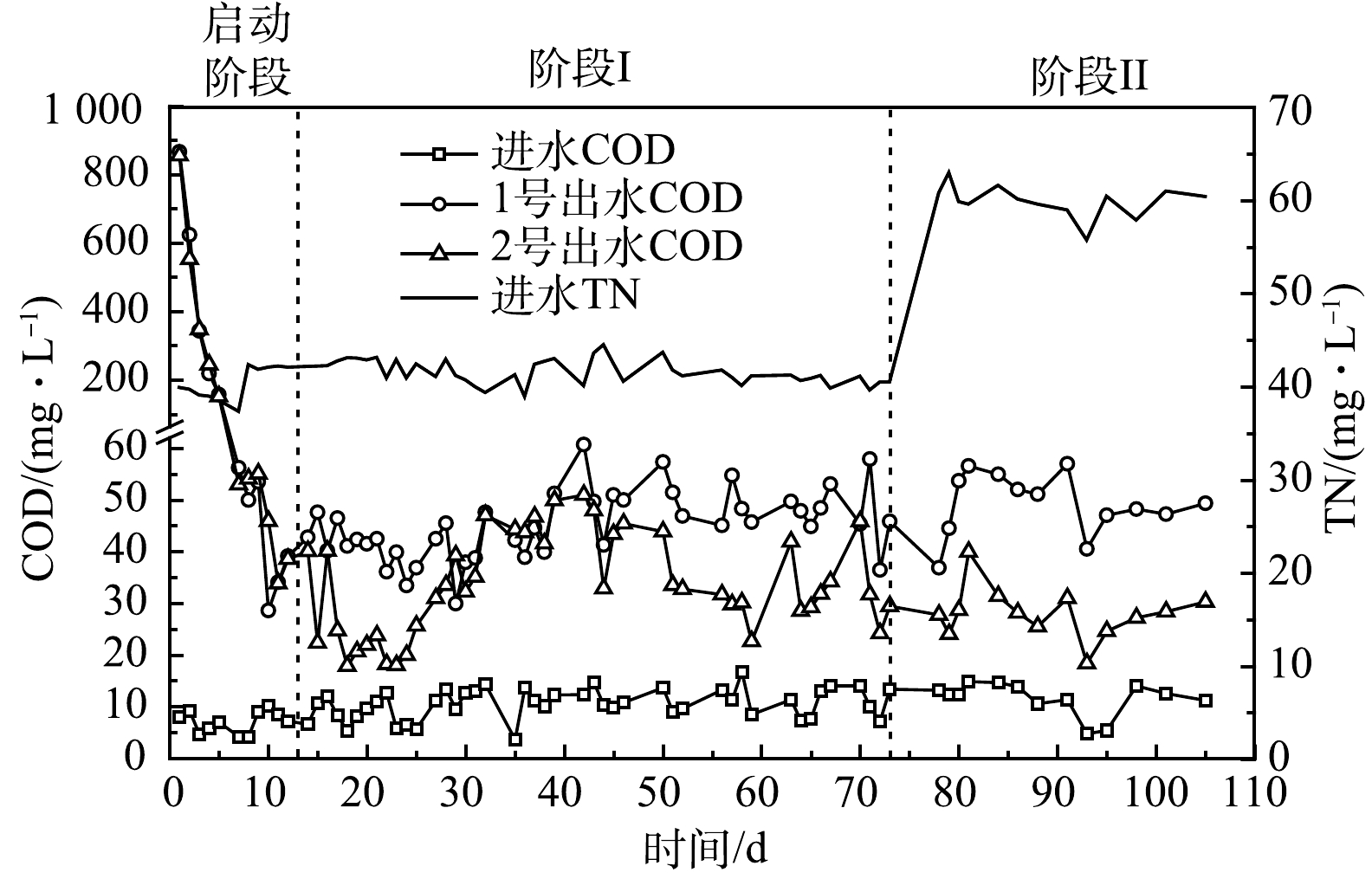
有机物是反硝化的主要电子供体与能量来源,但有机物过多会引发二次污染。图2为实验装置进、出水COD变化情况。由图2可知,启动阶段 (0~12 d) ,前5 d,2组出水COD较高 (>100 mg·L−1) ,之后迅速降低,9 d后,2组出水COD低于50 mg·L−1。13~105 d (阶段I~阶段II),2 组出水COD基本稳定,预示挂膜成熟,1号和2号出水COD分别为 (45.97±6.58) mg·L−1和 (32.37±9.05) mg·L−1。启动阶段,竹刨花表层可溶性有机物溶出较多[5],导致前5 d出水COD较高,这确保了生物膜的快速生长。运行约12 d后,竹刨花表层可溶性有机物基本消耗完全,微生物主要通过分解、利用竹纤维素获取能源与电子供体等,但木质纤维素结构复杂稳定,分解较慢。另外,随着菌群的逐渐稳定,微生物对纤维素类物质的分解与利用趋于平衡,随水流出的有机物不多,因此,2组出水COD在阶段I~阶段II基本维持在较低水平。
在阶段I~阶段II,1号出水COD整体较2号高42.04%。这是因为铁促进了微生物的繁殖与酶的分泌,提高了微生物对竹纤维类物质的分解[19, 26-27]。此外,随着TN负荷的增加,在阶段II,1号和2号出水COD较阶段I分别增加9.17%、−16.44%,说明耦合体系有机物供应机制适应性更好。最后,13~105 d,2组出水COD均值均低于一级A限值 (50 mg·L−1,GB 18918-2002) ,未出现碳源过度释放情况。
-
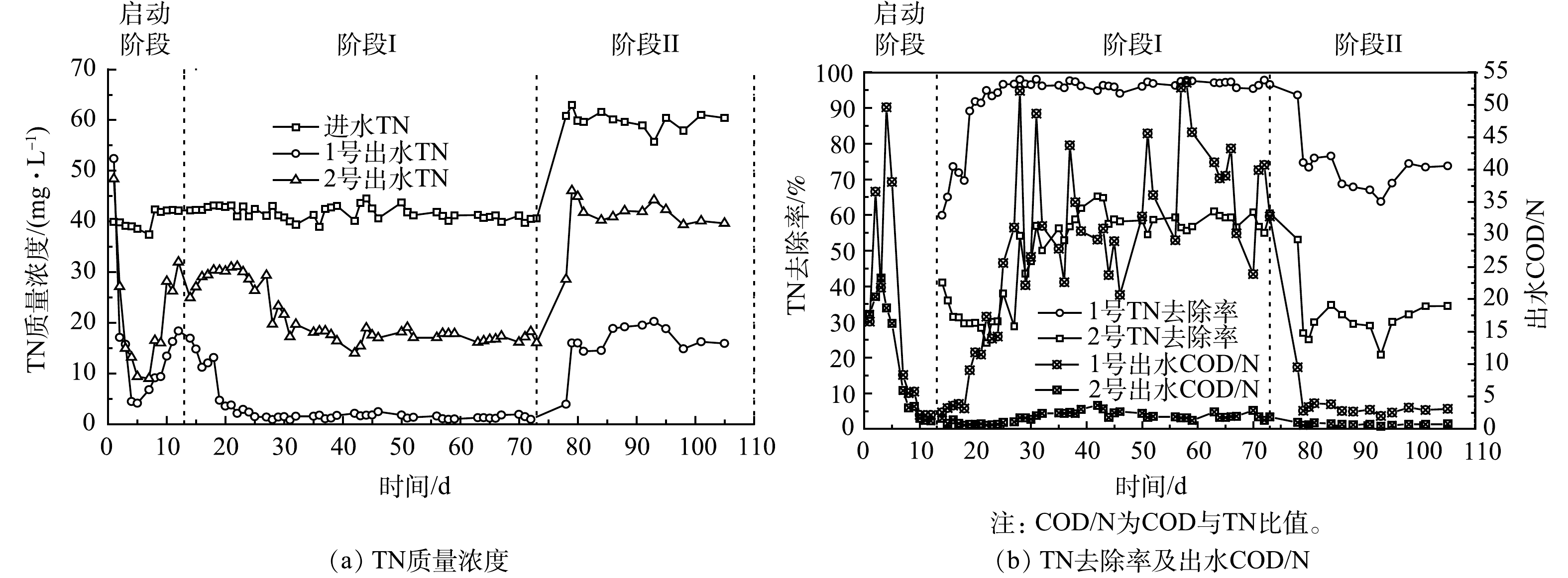
图3为实验装置TN去除及出水COD/N曲线。在启动阶段,2组出水TN先降低再上升,运行12 d后 (阶段I和阶段II) ,2组出水TN基本趋于稳定。由于N是竹基本组分之一[28],竹刨花在初始大量释放有机物,这些有机物中的N经微生物分解后会增加水中TN,因此,第1天,测量2组出水TN均较高 (48.36~52.40 mg·L−1) 。2~7 d,2组出水COD/N均大于4,而满足或完成反硝化所需的COD/TN比为4~15[29],说明此时2组有机物充足,反硝化率高,TN去除率也达到启动阶段的最大值,分别为89.34%和75.98%。这表明2组均形成了较好的脱氮效能,且初期差异不大。8~12 d,2组出水COD/N逐渐降至低点,第12 天,2组出水TN达到最大值,为18.34~31.96 mg·L−1。另外,由图2可知,运行12 d后,2组出水有机物基本稳定,体系内部相对稳定的碳源环境使得反硝化反应趋于平衡,因此,13~105 d ,2组出水TN也相对稳定。
在阶段I,运行61 d,进水TN为 (41.62±1.29) mg·L−1,1号和2号出水TN均值分别为3.03 mg·L−1和21.05 mg·L−1,TN去除率分别为(92.79±9.31)%和(49.52±12.68)%,1号TN去除率比2号高87.36%;且运行50~73 d,1号TN去除率在95%以上,出水TN均值(1.30 mg·L−1)低于地表水IV类标准限制1.50 mg·L−1 (GB 3838-2002) 。在阶段II,运行32 d,进水TN为 (59.95±1.77) mg·L−1,1号和2号出水TN均值分别为16.01 mg·L−1和40.91 mg·L−1,TN去除率分别为70%和30%左右,1号TN去除率比2号高131.09%。总体而言,13~105 d,耦合体系TN去除率较单纯固相反硝化体系高近1倍。
赵文莉等[30]以碱处理玉米芯、零价铁和活性炭构成复合填料处理低碳氮比污水厂尾水,进水NO3−为20~30 mg·L−1,初期有机物多,TN去除率达100%,后有机物降低,运行60 d 时,TN去除率降为60%左右,碳源不足是限制脱氮的主要因素。在本研究的阶段I~阶段II,1号出水COD/N均高于2号,说明1号碳源更丰富,因此1号TN去除率更高。同时,随着TN负荷的增加,2组TN去除率均降低,且出水COD/N均小于4。这是因为竹中有机物释放缓慢,无法完全满足高负荷下的碳源需求。另外,从阶段I至阶段II,1号和2号TN削减量 (式 (1) ) 分别增加了13.89%和−7.44%,这与上文COD变化相似。以上情况说明碳源是影响2组脱氮效能的重要原因。
式中:∆Ci 为TN削减量;C0为进水TN质量浓度;Cei为出水TN质量浓度;i为1号或2号反应器。
纤维素分解后会释放腐殖质和类蛋白、小分子有机酸和糖等[31],而反硝化菌只能利用小分子有机酸脱氮[11]。铁可提高复杂有机物的降解率[19],改善碳源分解,从而提高耦合体系TN去除率。但研究[32]显示,采用植物碳源脱氮时,出水中有机质主要为腐殖质和类蛋白等。这类大分子物质反硝化菌无法直接利用[33],需进一步分解。因此,2组出水始终残留有COD而暂时无法用于脱氮,此时,可后接有机物处理模块,以进一步减少有机物污染。
-
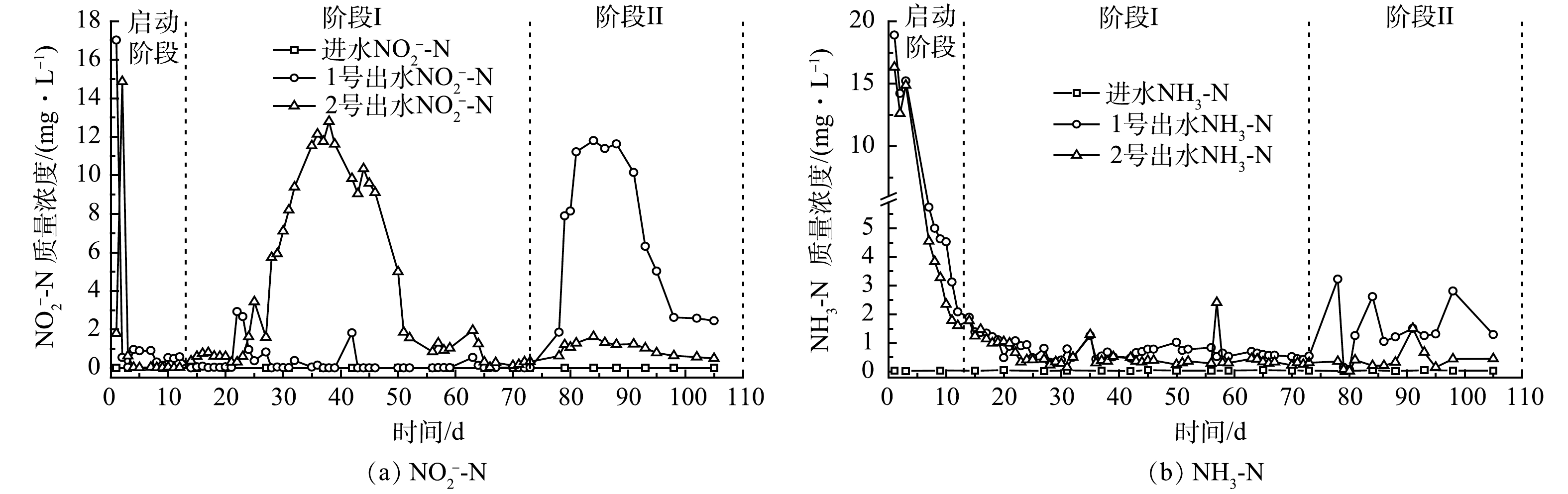
图4 (a) 为实验装置NO2−-N积累情况。反硝化由硝酸盐还原酶 (Nar) 和亚硝酸盐还原酶 (Nir) 等完成。碳源不足,部分NO2−无法还原,造成NO2−积累[4]。碳源充足,Nar和Nir会竞争底物,且NaR竞争力更强[34-35],NO3−会优先还原为NO2−[36],造成NO2−积累[37]。在启动阶段,1~2 d,2组NO2−-N积累较高,由于NiR的合成与诱导时间晚于Nar[36-37],因此,运行初始出现NO2−-N积累,同时也证明2组反硝化菌生长成功。由此可知,在阶段I,1号出水COD/N均值大于4,碳源充足,NO2−-N积累平均质量浓度低于1 mg·L−1;2号出水COD/N均值小于4,碳源不足,24~50 d,NO2−-N积累较多,最大积累量为12.79 mg·L−1,之后逐渐降低并稳定至1 mg·L−1以下。在阶段II,1号出水COD/N降至4以下,碳源不足,78~98 d出现NO2−-N大量积累,最大积累量为11.62 mg·L−1,之后逐渐减少并稳定至2.5 mg·L−1左右;2号出水COD/N依然较低,NO2−-N平均积累质量浓度为1 mg·L−1。碳源不足时,2组均出现NO2−-N大量积累,但大量积累是暂时的,这与钟胜强等[38]和张恒亮等[39]实验情况类似。此外,51~73 d和74~105 d,2号TN削减量均值为23.71和19.04 mg·L−1,变化不显著,因此,51~105 d,2号NO2−-N积累变化不大。总之,耦合体系TN去除过程虽有一定NO2−-N积累,但大量积累时间不长,稳定积累量不高,通过后接曝气设施可减少NO2−-N危害。
植物碳源中的N经生物作用后会释放NH4+[40]。当有机电子供体远高于受体NO3−时,NO3−易异化还原成NH4+ (DNRA)[5, 41]。同时,Fe0生物系统中NO3−可化学还原为NH4+[21, 23]。图4 (b) 为实验装置NH3-N积累情况。可以看出,0~5 d,2组出水NH3-N较高,之后随着有机物释放的减少与稳定,2组出水NH3-N也随之减少和稳定;12 d后,2组出水NH3-N平均质量浓度均低于1 mg·L−1。由此可知,0~5 d,2组出水COD远高于TN,因此,前几天NH3-N较高主要是因为碳源释放与DNRA反应所致。另外,在阶段II (73 d后) ,1号出水NH3-N增加,此时期1号出水COD虽有少量增加,但出水COD/N较低,排除DNRA的影响。已有研究[42]显示,Fe2+易将生物还原型NO2−化学还原为NH4+ (式 (2) ) ,并形成Fe2+-Fe3+水合氧化物,其中的Fe2+会继续与NO3−或NO2−化学反应生成NH4+。在阶段II,NO3−增加,加剧了铁的腐蚀[21, 43],释放更多Fe2+ (式 (3)~式 (5) ) 以及 NH4+ (式 (5) ) 。此时1号碳源缺乏,积累的生物还原型NO2−和残余NO3−增多,导致NH4+进一步增加。由于铁腐蚀有限,故NH4+增加不多,加上材料自身释放的增加,最终导致73 d后1号NH3-N升高。整体而言,耦合体系出水NH3-N虽然略高于单纯固相反硝化体系,但并未出现NH3-N的明显积累。
-
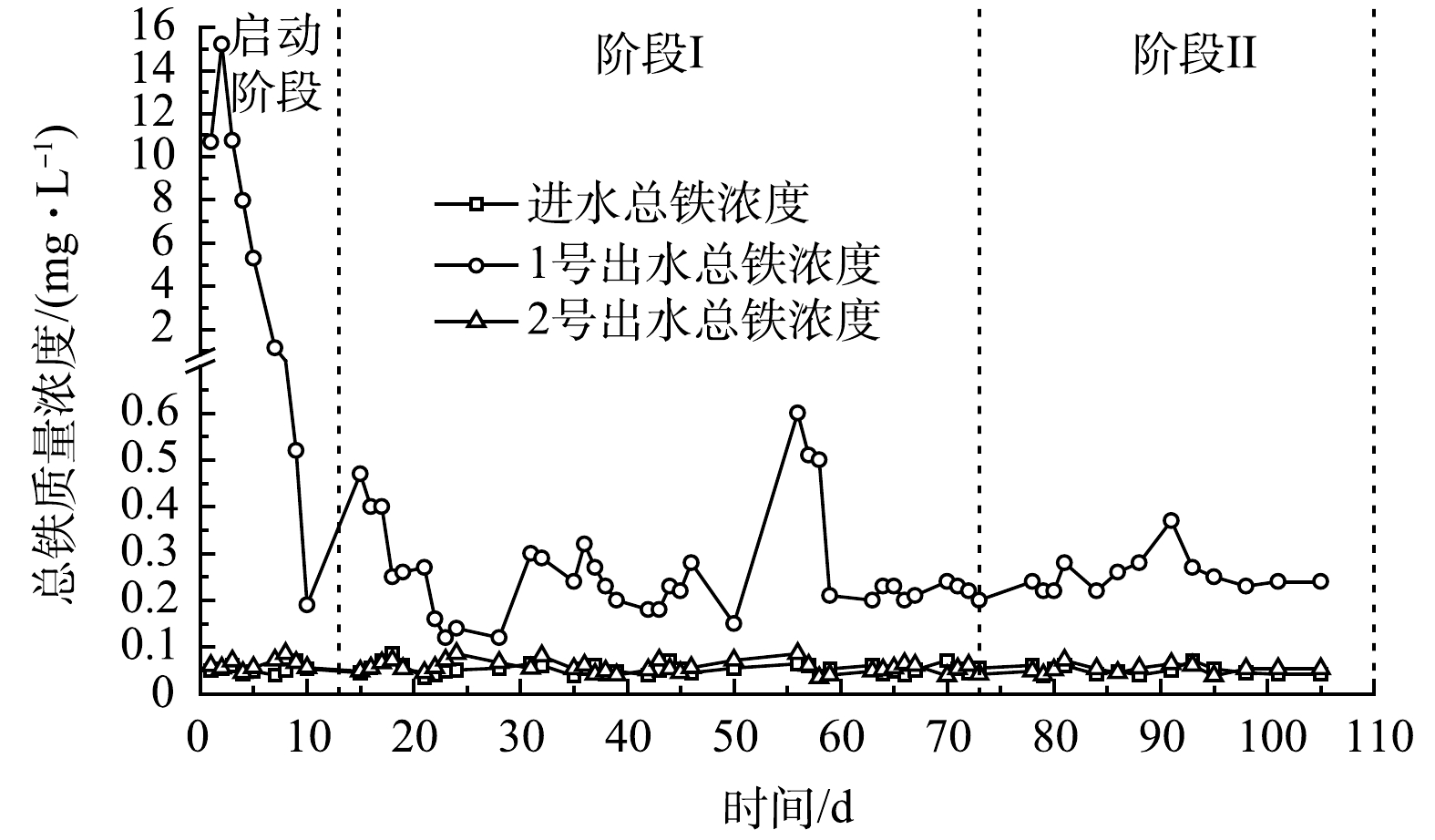
图5为实验装置进出水总铁浓度变化情况。由于进水与2号出水总铁基本低于检测线,故主要讨论1号出水总铁情况。在启动阶段,1号出水总铁先升高后快速降低,运行12 d后,总铁释放稳定,出水总铁为 (0.26±0.09) mg·L−1,整体低于地表水环境质量标准限值0.3 mg·L−1 (GB 3838-2002)。耦合体系总铁的释放主要源于铁屑腐蚀。在启动阶段,铁屑在水中发生氧化、生物腐蚀,生成大量的Fe2+与Fe(OH)2[19, 44],导致前几天出水总铁较高。但铁屑表面的生物膜会减少物质交换而阻碍腐蚀[45],其表面生成的铁氧化物或氢氧化物会使铁钝化而失去活性,一些微生物会利用Fe2+还原NO3−,产生Fe3+,促进铁氧化物沉淀,进一步抑制腐蚀[42]。因此,随着装置的运行,总铁质量浓度迅速减少。然而铁的释放并未停止,有研究[43,46]指出,当水中硝酸盐质量浓度大于10 mg·L−1时,不稳定的腐蚀产物 (β-FeOOH) 容易脱落促进腐蚀。总之,基于各类生物化学活动,铁屑的腐蚀与抑制腐蚀作用处于一定的平衡,使得装置内总铁在运行12 d后基本维持在较低质量浓度范围。铁过高,会对微生物造成损伤[21],较低的铁释放保证了耦合体系强化脱氮的长期作用。
另外,铁型反硝化菌可以Fe2+为电子供体将NO3− /NO2− 还原为N2,但反应Fe/N比为 (3~5) :1[24],而1号总铁均值约为0.3 mg·L−1。铁自养反硝化虽可提高脱氮效能[24, 47],但不是耦合体系TN去除的主要途径。
根据实验结果,铁屑强化反硝化包括3个过程:1) 铁屑腐蚀,生成Fe2+及其氧化物[20] ,反应式见式 (3)~式 (5) ;2) Fe2+氧化,形成Fe(OH)3、FeOOH、Fe2O3、Fe3O4等氧化物[23] ,反应式见式 (2) 、式 (6)~式 (8) ;3) Fe2+、Fe3+及其各类氧化物是提升反硝化的关键,它们可强化微生物繁殖、活性、丰度和多样性等[21],减少有机质流失,提高电子传递效率等[19]。而铁离子与有机物间鳌和/络合反应[48]可促进系统与铁的作用,多种因素综合影响,最终表现为:改善碳源释放,增强脱氮效能。但目前Fe0生物系统强化脱氮机理复杂,尚不明确[21],还有待进一步深入研究。
-
图6为竹刨花被利用前后表面扫描电镜图。被利用前的竹刨花(图6 (a) 和图6 (b) )由于加工原因和竹纤维结构特点,有许多不规则碎片与孔隙,利于微生物附着生长。被利用近100 d后,1号和2号竹刨花均附着有微生物。这些微生物主要为杆状,已有研究[49]显示,固相碳源被利用后,其表面微生物多呈杆状。但1号竹刨花表面(图6 (c) 和图6 (d) )有许多交错黏结、大小不一的纤维絮体,同时微生物与微生物、微生物与纤维絮体之间黏附团聚,形成更为紧密的生物膜。而2号竹刨花(图6 (e) 和图6 (f) )被利用后,表面虽有一些残余纤维絮体,但数量少,表面相对平整,微生物分布也更加稀疏。密实的生物膜利于纤维素分解与污染物的去除,铁一方面刺激了微生物的生长及其胞外物的分泌,强化微生物、纤维絮体等的黏附,同时铁离子及其氢氧化物的絮凝作用进一步将浸泡分解出的竹纤维絮体吸附截留,增加微生物附着点,减少有机质流失,提高有机物的利用率。
-
Alpha多样性指数可表征微生物多样性[4],结果见表1。2组样本的覆盖率指数均大于0.99,表明该测序结果能较好反映菌群的真实情况[8]。Chao1值越大,群落丰度越好[50]。2组样本Chao1指数都大于2 000,说明2体统均具有复杂的群落丰度,但1号群落丰度明显高于2号。Shannon指数、Simpson指数和系统发育树指数反映群落的多样性,受样品群落中物种丰度和物种均匀度的影响。Shannon指数和系统发育树指数越大[51-52],Simpson指数越小[53],则菌群多样性越高。1号的Shannon指数和系统发育树指数均高于2号,而Simpson指数低于2号,说明1号耦合体系内生物多样性高于2号单纯固相反硝化体系。
-
1号与2号竹刨花填料表面微生物门水平群落组成如图7 (a) 所示。2体系细菌门类主要为变形菌门Proteobacteria (49.75%~66.51%) 、放线菌门Actinobacteria (11.39%~12.38%) 、拟杆菌门Bacteroidetes (11.21%~12.93%) ,厚壁菌门Firmicutes (3.27%~4.70%) 和绿弯菌门Chloroflexi (1.65%~3.77%) 等。2体系优势门为变形菌门,但1号变形菌门占比(65.51%)明显高于2号(49.75%)。此外,2号疣微菌门Verrucomicrobia丰度 (8.80%) 远高于1号 (小于1%) 。变形菌门是各类水环境反硝化微生物的主导门类[4, 54-55];拟杆菌门主要由水解菌组成,可降解纤维素在内的大分子有机物[56];放线菌门是丝状菌,具有絮凝作用[57],可降解氨基酸等;厚壁菌门可降解纤维素和进行反硝化[4, 58];绿弯菌门常见于各类污水处理中,是反硝化主要菌种之一[1];疣微菌门在活性污泥中较为常见,其与有机物、氨氮降解有关[59]。总体而言,变形菌门、拟杆菌门、放线菌门、绿弯菌门、厚壁菌门普遍存在于植物碳源反硝化系统中[12, 60],是反硝化主要参与者,2体系这些门类占比均高于80%,说明2体系TN去除主要为生物反硝化。2体系均存在降解有机物的微生物,如拟杆菌门、放线菌门、疣微菌门等。由于2号疣微菌门丰度较大,其有机物降解相关门类 (门水平,丰度>5%) 的总占比高于1号,说明铁屑未促进有机物降解相关门类生长。由于1号菌群总丰度、多样性、生物膜条件比2号更好,说明是各类因素的共同作用增强了耦合体系碳源释放。另外,严子春等[61]发现,富铁生物系统中疣微菌科丰度与空白组相比,显著降低,这与本研究类似,表明铁会抑制疣微菌门/科的生长。2体系门类差异最大的为变形菌门 (1号较高) ,其次为疣微菌门 (1号较低) ,说明铁屑强化了脱氮功能菌的生长。
图7 (b) 为竹刨花填料表面微生物属水平群落组成情况。由于一些序列不能归入已知属,本数据库以Family (科) 后缀-uncultured,-unclassified来表示。变形菌门是2体系占比最大、差异最显著的门类。表2为2体系变形菌门主要属组成 (属,丰度>1%) ,1号和2号变形菌门中优势菌属分别为假单胞菌属Pseudomonas和热单胞菌属Thermomonas。已有研究表明,Pseudomonas[17]、Denitratisoma[54, 62]、 Thermomonas [55]、Xanthobacteraceae_unclassified[61, 63]、Rhodocyclaceae_unclassified[7, 64]和Rhodocyclaceae-uncultured[65-66]、Desulfovibrio[7]、Rhizobiaceae_unclassified[67]、Devosia[55]、Bataproteobacteria_unclassified[67]和Gammaproteobacteria_unclassified[68-69]均是与反硝化有关的微生物。由表2可知:1号变形菌门中反硝化功能菌群共有9个类别 (表2中标记为DNB (denitrifying bacteria) 的菌属) ,总占比为35.75%;2号共有4个类别 (表2中标记为DNB的菌属) ,总占比为23.89%,表明耦合体系具有更多类别的反硝化菌群和占比,这有利于系统的稳定与强化脱氮[23-24]。
另外,与其他脱氮菌不同,1号优势菌属Pseudomonas是一种同步脱氮除磷菌[70]。已有研究[61]显示,富铁环境可明显促进Pseudomonas菌的生长并提升氮磷的去除率。当进水TP为 (1.14±0.06) mg·L−1时,0~105 d,1号和2号TP的平均去除率分别为75%和44%。因铁屑释铁少,故生物同步脱氮除磷是1号高效除磷的重要线索,也表明铁屑在诱导同步脱氮除磷菌方面潜力巨大。
此外,1号变形菌门中硫杆菌Desulforhabdus占比为1.05%,而2号未检测到该菌属。已有研究[24]显示,基于反硝化颗粒污泥的亚铁型厌氧铁氧化系统中的硫杆菌在Fe2+的氧化过程中起着重要作用。这证实耦合体系中存在Fe2+氧化反硝化,其可促进TN的去除,但硫杆菌丰度较小,说明Fe2+氧化反硝化不多,这与耦合体系总铁释放情况基本一致。
-
1) 进水TN为41.62~59.95 mg·L−1、COD/N<0.5、水力停留时间为18 h时,13~105 d,耦合体系碳源较单纯固相反硝化体系丰富,但2体系出水COD均值均低于一级A限值;耦合体系TN平均去除率为73.21%~92.79%,总体较单纯固相反硝化体系高近1倍,出水TN可达到地表水IV类标准;另外,耦合体系中铁释放稳定,出水总铁均值低于地表水环境质量标准限值。
2) SEM表征结果显示,竹刨花表面植物组织碎片与孔隙较多,适于微生物附着生长;被利用近100 d后,耦合体系竹填料表面明显黏附有许多纤维絮体,黏性物质与微生物数量更多,生物膜生长更加密实。
3) 16S rRNA表征结果显示,耦合体系与单纯固相反硝化体系相比,微生物丰度与多样性更高。2体系反硝化脱氮相关门类占主体,优势门类均为变形菌门,但耦合体系变形菌门丰度更高;在变形菌门主要属组成中,耦合体系反硝化菌群 (属水平,丰度﹥1%) 类别和总占比均高于单纯固相反硝化体系。这与耦合体系高效、稳定的脱氮效果基本吻合。
铁屑耦合固相反硝化对低碳氮比废水中总氮的处理
Treatment of total nitrogen in wastewater with low C/N ratio by iron shavings coupled solid-phase nitrification
-
摘要: 为考察脱氮效率并解决碳源不足导致总氮 (TN) 去除率不高的问题,将竹刨花作为固体碳源与挂膜载体,引入铁屑,构成耦合体系,搭建2套反硝化实验装置 (分别为耦合体系1号与单纯固相反硝化体系2号) 并对脱氮率及微生物进行分析。结果表明:进水TN为41.62~59.95 mg·L−1,COD/N<0.5,水力停留时间为18 h; 13~105 d,1号TN平均去除率为73.21%~92.79%,比2号平均去除率高近1倍;1号碳源相对2号更为充足,但2体系出水COD均值都低于一级A;1号总铁释放稳定,出水总铁均值低于0.3 mg·L−1,未出现NH3-N明显积累。SEM表征结果显示,1号竹填料表面黏性物质与微生物数量更多,生物膜更加紧密。16S rRNA表征结果显示:1号具有更高的微生物丰度与多样性;2体系反硝化脱氮相关门类占主体,优势门类均为变形菌门,但1号变形菌门占比高于2号;变形菌门中,1号反硝化菌群 (属水平,丰度>1%) 类别和总占比均高于2号。由此可知,铁屑强化了碳源的分解与利用,促进了脱氮功能菌生长,显著提升了耦合体系脱氮效能,出水TN可达到地表水IV类标准(GB 3838-2002)。竹刨花获取方便灵活,铁屑低廉,两者构成的耦合体系具有巨大的实际应用前景。Abstract: In order to investigate the denitrification efficiency and solve the problem of poor TN removal due to insufficient carbon source, bamboo flakes were used as a solid carbon source and biofilm carrier, and a coupled system was designed with the introduction of iron shavings. Then two sets of denitrification experimental devices were built (coupled system No. 1 and simple solid-phase denitrification system No. 2 , respectively) and their nitrogen removal rates and microorganisms were analyzed. The results showed that when the inlet TN was 41.62~59.95 mg·L−1, COD/N<0.5, and the hydraulic retention time was 18 h, the average TN removal rate of No. 1 was 73.21%~92.79% among 13~105 d, which was nearly 1 time higher than the average removal rate of No. 2; the carbon source of No.1 was more adequate than that of No.2, but the mean effluent COD values of No.2 were lower than that of Class A. The total iron release of No. 1 was stable, the average value of total iron in the effluent was less than 0.3 mg·L−1, and there was no significant accumulation of NH3-N. SEM characterization results showed that there were more sticky material and microorganisms on the surface of the bamboo filler of No. 1, and the biofilm was more compact. 16S rRNA characterization results showed that No. 1 had higher microbial abundance and species diversity; the denitrification-related phylums dominated in both systems, and the dominant microbial phylum were all Proteobacteria, but the abundance of Proteobacteria in No. 1 was higher than that in No. 2; among Proteobacteria, the category and total percentage of denitrifying group (genus level, abundance >1%) in No. 1 were higher than those in No. 2. It can be seen that iron shavings enhanced the decomposition and utilization of carbon source, promoted the growth of nitrogen removal functional bacteria, which significantly improved the efficiency of nitrogen removal in the coupled system, and the effluent TN could reach class IV of the surface water standard (GB 3838-2002). Bamboo flakes are convenient and flexible to obtain, and iron shavings are inexpensive, and their coupled system has great practical application prospects.
-
Key words:
- bamboo flakes /
- iron shavings /
- coupled system /
- denitrification /
- 16S rRNA
-

-
表 1 微生物Alpha多样性指数
Table 1. Microbial Alpha diversity index
样品 Chao1指数 Simpson指数 Shannon指数 观察到的物种指数 系统发育树指数 覆盖率指数 1号 3 238.29 0.012 6 8.975 7 3 230.1 126.485 0.996 0 2号 2 276.47 0.025 5 7.772 2 2 265.2 105.928 0.996 2 表 2 变形菌门主要属组成 (属,丰度大于1%)
Table 2. Major genus composition of Proteobacteria (genera, abundance >1%)
1号属名称 占比/% 2号属名称 占比/% Denitratisoma (DNB) 4.46 Thermomonas (DNB) 11.44 ANP-Rhizobium 6.91 Denitratisoma (DNB) 7.31 Pseudomonas (DNB) 8.66 ANP-Rhizobium 3.16 Rhodocyclaceae_uncultured (DNB) 8.01 Burkholderiaceae_unclassified 3.34 Burkholderiaceae_unclassified 3.95 Xanthobacteraceae_unclassified (DNB) 3.71 Xanthobacteraceae_unclassified (DNB) 3.25 Sphingobium 2.31 Rhodocyclaceae_unclassified (DNB) 4.01 Pleomorphomonas 1.27 Desulfovibrio (DNB) 3.61 Afipia 1.16 Pleomorphomonas 1.57 Devosia (DNB) 1.47 Burkholderiaceae_uncultured 1.63 — — Afipia 1.07 — — Rhizobiaceae_unclassified (DNB) 1.32 — — Gammaproteobacteria_unclassified (DNB) 1.40 — — Betaproteobacteriales_unclassified (DNB) 1.03 — — Desulforhabdus 1.05 — — 合计 51.93 合计 35.17 注:DNB为反硝化菌(denitrifying bacteria)。 -
[1] 赵远哲, 杨永哲, 王海燕, 等. 新型填料A/O生物滤池处理低碳氮比农村污水脱氮[J]. 环境科学, 2020, 41(5): 2329-2338. doi: 10.13227/j.hjkx.201910118 [2] ASHOK V, HAIT S. Remediation of nitrate-contaminated water by solid-phase denitrification process: A review[J]. Environmental Science and Pollution Research, 2015, 22(11): 8075-8093. doi: 10.1007/s11356-015-4334-9 [3] SÁNCHEZ M P, SULBARÁN-RANGEL B C, TEJEDA A, et al. Evaluation of three lignocellulosic wastes as a source of biodegradable carbon for denitrification in treatment wetlands[J]. International Journal of Environmental Science and Technology, 2020, 17(12): 4679-4692. doi: 10.1007/s13762-020-02815-9 [4] HAO S Z, SHAN S X, HUI W Y, et al. Intensified heterotrophic denitrification in constructed wetlands using four solid carbon sources: Denitrification efficiency and bacterial community structure[J]. Bioresource Technology, 2018, 267: 416-425. doi: 10.1016/j.biortech.2018.07.029 [5] YU L, YAN G K, WANG H Y, et al. Release mechanism, secondary pollutants and denitrification performance comparison of six kinds of agricultural wastes as solid carbon sources for nitrate removal[J]. International Journal of Environmental Research and Public Health, 2021, 18(3): 1232. doi: 10.3390/ijerph18031232 [6] GUAN X X, JI G X, XU S Y, et al. Selection of agricultural straws as sustained-release carbon source for denitrification in a drawer-type biological filter[J]. Water, Air, & Soil Pollution, 2019, 230(18): 1-11. [7] SUN H, ZHOU Q, ZHAO L, et al. Enhanced simultaneous removal of nitrate and phosphate using novel solid carbon source/zero-valent iron composite[J]. Journal of Cleaner Production, 2020, 289: 125757. [8] YANG Z, YANG L, WEI C, et al. Enhanced nitrogen removal using solid carbon source in constructed wetland with limited aeration[J]. Bioresource Technology, 2018, 248: 98-103. doi: 10.1016/j.biortech.2017.07.188 [9] LI Y Y, WANG S, LI Y, et al. Corn straw as a solid carbon source for the treatment of agricultural drainage water in horizontal subsurface flow constructed wetlands[J]. Water, 2018, 10(4): 511. doi: 10.3390/w10040511 [10] SHEN Z Q, ZHOU Y X, HU J, et al. Denitrification performance and microbial diversity in a packed-bed bioreactor using biodegradable polymer as carbon source and biofilm support[J]. Journal of Hazardous Materials, 2013, 250-251: 431-438. doi: 10.1016/j.jhazmat.2013.02.026 [11] ZHANG F F, MA C J, HUANG X F, et al. Research progress in solid carbon source-based denitrification technologies for different target water bodies[J]. Science of the Total Environment, 2021, 782: 1466669. [12] ZHOU B B, DUAN J J, XUE L H, et al. Effect of plant-based carbon source supplements on denitrification of synthetic wastewater: Focus on the microbiology[J]. Environmental Science and Pollution Research International, 2019, 26(24): 24683-24694. doi: 10.1007/s11356-019-05454-x [13] 李玉敏, 冯鹏飞. 基于第九次全国森林资源清查的中国竹资源分析[J]. 世界竹藤通讯, 2019, 17(6): 45-48. [14] 郑龙, 吴义强, 左迎峰. 竹剩余物资源化利用研究现状与展望[J]. 世界林业研究, 2021, 34(3): 82-88. [15] 江泽慧, 王戈, 费本华, 等. 竹木复合材料的研究及发展[J]. 林业科学研究, 2002(6): 712-718. doi: 10.3321/j.issn:1001-1498.2002.06.013 [16] 彭洋洋. 预处理对竹子组织结构和纤维的影响及高得率纳米纤维素制备的研究[D]. 广州: 华南理工大学, 2019. [17] WANG J, CHU L. Biological nitrate removal from water and wastewater by solid-phase denitrification process[J]. Biotechnology Advances, 2016, 34(6): 1103-1112. doi: 10.1016/j.biotechadv.2016.07.001 [18] HARTZ T K, SMITH R, CAHN M D, et al. Wood chip denitrification bioreactors can reduce nitrate in tile drainage[J]. California Agriculture, 2017, 71: 41-47. doi: 10.3733/ca.2017a0007 [19] XU Y, WANG C, HOU J, et al. Application of zero valent iron coupling with biological process for wastewater treatment: A review[J]. Reviews in Environmental Science and Biotechnology, 2017, 16: 667-693. doi: 10.1007/s11157-017-9445-y [20] FU F, DIONYSIOU D D, LIU H. The use of zero-valent iron for groundwater remediation and wastewater treatment: A review[J]. Journal of Hazardous Materials, 2014, 267: 194-205. doi: 10.1016/j.jhazmat.2013.12.062 [21] YOU G, WANG P, HOU J, et al. The use of zero-valent iron (ZVI)-microbe technology for wastewater treatment with special attention to the factors influencing performance: A critical review[J]. Critical Reviews in Environmental Science and Technology, 2017, 47(10): 877-907. doi: 10.1080/10643389.2017.1334457 [22] 杨燕, 朱静平. 添加零价铁的反硝化系统中发生的主要反应[J]. 工业水处理, 2021, 41(3): 77-82. [23] WANG C, XU Y, HOU J, et al. Zero valent iron supported biological denitrification for farmland drainage treatments with low organic carbon: Performance and potential mechanisms[J]. Science of the Total Environment, 2019, 689: 1044-1053. doi: 10.1016/j.scitotenv.2019.06.488 [24] 于妍, 刘宁, 廖祖刚, 等. 铁型反硝化脱氮技术研究进展[J]. 中国环境科学, 2022, 42(1): 83-91. doi: 10.3969/j.issn.1000-6923.2022.01.010 [25] OU C, SHEN J, ZHANG S, et al. Coupling of iron shavings into the anaerobic system for enhanced 2, 4-dinitroanisole reduction in wastewater[J]. Water Research, 2016, 101: 457-466. doi: 10.1016/j.watres.2016.06.002 [26] 童海航, 石德智, 刘嘉宇, 等. 金属纳米颗粒辅助木质纤维素暗发酵生物制氢的研究进展[J]. 化工学报, 2022, 73(4): 1417-1435. doi: 10.11949/0438-1157.20211412 [27] 颜涌捷, 任铮伟. 纤维素连续催化水解研究[J]. 太阳能学报, 1999, 20(1): 56-59. doi: 10.3321/j.issn:0254-0096.1999.01.010 [28] 杨清培, 欧阳明, 杨光耀, 等. 竹子生态化学计量学研究: 从生物学基础到竹林培育学应用[J]. 植物生态学报, 2016, 40(3): 264-278. doi: 10.17521/cjpe.2015.0298 [29] 韦琦, 罗方周, 徐相龙, 等. A2/O工艺处理低温低碳氮比生活污水的脱氮效率及反应动力学[J]. 环境工程学报, 2021, 15(4): 1367-1376. doi: 10.12030/j.cjee.202010126 [30] 赵文莉, 郝瑞霞, 王润众, 等. 复合碳源填料反硝化脱氮及微生物群落特性[J]. 中国环境科学, 2015, 35(10): 3003-3009. doi: 10.3969/j.issn.1000-6923.2015.10.017 [31] 许兵, 张旭, 刘佳, 等. 植物碳源对人工湿地脱氮过程的影响[J]. 工业水处理, 2021, 41(12): 89-94. doi: 10.19965/j.cnki.iwt.2021-0201 [32] ZHENG Y, CAO T, ZHANG Y, et al. Characterization of dissolved organic matter and carbon release from wetland plants for enhanced nitrogen removal in constructed wetlands for low C-N wastewater treatment[J]. Chemosphere, 2021, 273: 129630. doi: 10.1016/j.chemosphere.2021.129630 [33] 陈广林, 胡荣庭, 祖凌鑫, 等. 木质碳源释碳能力的优化及其对地下水生物反硝化的强化效果[J]. 环境工程学报, 2022, 16(1): 154-163. doi: 10.12030/j.cjee.202110085 [34] 李卫芬, 郑佳佳, 张小平, 等. 反硝化酶及其环境影响因子的研究进展[J]. 水生生物学报, 2014, 38(1): 166-170. [35] 赵文莉, 郝瑞霞, 李斌, 等. 预处理方法对玉米芯作为反硝化固体碳源的影响[J]. 环境科学, 2014, 35(3): 987-994. doi: 10.13227/j.hjkx.2014.03.024 [36] 董晓莹, 彭党聪. 不同碳氮比下污水反硝化过程中亚硝氮积累的特性研究[J]. 环境科学学报, 2017, 37(9): 3349-3355. [37] GE S, PENG Y, WANG S, et al. Nitrite accumulation under constant temperature in anoxic denitrification process: The effects of carbon sources and COD/NO3-N[J]. Bioresource Technology, 2012, 114: 137-143. doi: 10.1016/j.biortech.2012.03.016 [38] 钟胜强, 杨扬, 陶然, 等. 5种植物材料的水解释碳性能及反硝化效率[J]. 环境工程学报, 2014, 8(5): 1817-1824. [39] 张恒亮, 朱铁群, 王海燕, 等. 芦苇碳源投加量对表面流人工湿地中试系统强化脱氮启动的影响[J]. 环境工程技术学报, 2017, 7(3): 332-339. doi: 10.3969/j.issn.1674-991X.2017.03.047 [40] 彭锦玉, 张克峰, 王全勇, 等. 以4种天然植物材料为碳源的固相反硝化研究[J]. 工业水处理, 2021, 41(10): 1-9. [41] 万雨轩, 王鑫. 废水处理中异化硝酸盐还原为铵的研究进展[J]. 土木与环境工程学报, 2021, 43(6): 134-144. [42] ETIQUE M, JORAND F P, ZEGEYE A, et al. Abiotic process for Fe(II) oxidation and green rust mineralization driven by a heterotrophic nitrate reducing bacteria (Klebsiella mobilis)[J]. Environmental Science & Technology, 2014, 48(7): 3742-3751. [43] 张雅君, 吕静静, 孙丽华, 等. 不同硝酸盐浓度对再生水管网腐蚀状况的影响[J]. 腐蚀科学与防护技术, 2018, 30(3): 259-265. doi: 10.11903/1002.6495.2017.229 [44] ZHU L, GAO K, JIN J, et al. Analysis of ZVI corrosion products and their functions in the combined ZVI and anaerobic sludge system[J]. Environmental Science and Pollution Research International, 2014, 21(22): 12747-12756. doi: 10.1007/s11356-014-3215-y [45] 李园怡, 李杰. Fe0-生物铁法中铁的微生物腐蚀机理研究进展[J]. 绿色科技, 2019(8): 50-52. [46] SUN H, SHI B, YANG F, et al. Effects of sulfate on heavy metal release from iron corrosion scales in drinking water distribution system[J]. Water Research, 2017, 114: 69-77. doi: 10.1016/j.watres.2017.02.021 [47] WANG R, YANG C, WANG W Y, et al. An efficient way to achieve stable and high-rate ferrous ion-dependent nitrate removal (FeNiR): Batch sludge replacement[J]. Science of the Total Environment, 2020, 738: 139396. doi: 10.1016/j.scitotenv.2020.139396 [48] 李伟, 李贤军, 王望, 等. 木材腐朽机理研究现状及展望[J]. 世界林业研究, 2022, 35(2): 64-69. [49] 方晶晶, 马传明, 刘存富. 反硝化细菌研究进展[J]. 环境科学与技术, 2010, 33(S1): 206-210. [50] 严子春, 唐瑞祥, 吴大冰. 有机物对厌氧氨氧化生物膜反应器脱氮效能及微生物群落的影响[J]. 环境科学学报, 2021, 41(4): 1303-1308. [51] 刘亚妮, 朱宏伟, 黄荣新, 等. 曝气生态滤池中微生物群落组成及物种多样性[J]. 中国环境科学, 2020, 40(3): 1075-1080. doi: 10.3969/j.issn.1000-6923.2020.03.017 [52] 万琼, 吴仪, 王信, 等. BAF中不同高度海绵铁填料表面物种多样性分析[J]. 环境工程技术学报, 2018, 8(2): 161-168. doi: 10.3969/j.issn.1674-991X.2018.02.022 [53] 彭帅, 陈晓国, 李晓光, 等. 不同填埋龄垃圾腐殖土中细菌群落结构特征[J]. 环境工程技术学报, 2021, 11(5): 879-887. doi: 10.12153/j.issn.1674-991X.20210147 [54] ZHANG M, DARAZ U, SUN Q, et al. Denitrifier abundance and community composition linked to denitrification potential in river sediments[J]. Environmental Science and Pollution Research International, 2021, 28(37): 51928-51939. doi: 10.1007/s11356-021-14348-w [55] 张兰河, 左正艳, 王旭明. 固相反硝化系统中微生物群落结构的研究进展[J]. 生物技术通报, 2015, 31(1): 39-45. [56] 杨腾腾, 周宏, 王霞, 等. 微生物降解纤维素的新机制[J]. 微生物学通报, 2015, 42(5): 928-935. [57] 赵彬, 丁雪松, 吴丹青, 等. 高负荷条件下好氧颗粒污泥同步脱氮除碳特性及微生物群落结构分析[J]. 环境工程学报, 2020, 14(2): 295-304. doi: 10.12030/j.cjee.201903202 [58] EICHORST S A, VARANASI P, STAVILA V, et al. Community dynamics of cellulose-adapted thermophilic bacterial consortia[J]. Environmental Microbiology, 2013, 15(9): 2573-2587. doi: 10.1111/1462-2920.12159 [59] 林芳妃. 活性污泥法去除城市径流雨水有机污染物研究[D]. 兰州: 兰州理工大学, 2020. [60] HU R T, ZHENG X, ZHENG T Y, et al. Effects of carbon availability in a woody carbon source on its nitrate removal behavior in solid-phase denitrification[J]. Journal of Environmental Management, 2019, 246: 832-839. [61] 严子春, 史登峰, NOSAKHARE I. 富铁填料强化A/O-曝气生物滤池工艺的脱氮除磷效果[J]. 环境污染与防治, 2017, 39(11): 1186-1188. [62] XU D, YING S, WANG Y H, et al. A novel SAD process: Match of anammox and denitrification[J]. Water Research, 2021, 193: 116874. doi: 10.1016/j.watres.2021.116874 [63] OSVALDO D F, GUILLERMO Q, REBECA P, et al. Simultaneous biological nitrous oxide abatement and wastewater treatment in a denitrifying off-gas bioscrubber[J]. Chemical Engineering Journal, 2016, 288: 28-37. doi: 10.1016/j.cej.2015.11.088 [64] 蔺凌云, 尹文林, 潘晓艺, 等. 自然微生物挂膜处理水产养殖废水的效果及微生物群落分析[J]. 水生生物学报, 2017, 41(6): 1327-1335. doi: 10.7541/2017.164 [65] 苑宏英, 王雪, 李原玲, 等. 碳氮比对低温投加介体生物反硝化脱氮的影响[J]. 环境工程学报, 2020, 14(1): 60-67. doi: 10.12030/j.cjee.201902025 [66] CHU L B, WANG J L. Denitrification performance and biofilmcharacteristics using biodegradable polymers PCL ascarriers and carbon source[J]. Chemosphere, 2013, 91: 1310-1316. doi: 10.1016/j.chemosphere.2013.02.064 [67] WANG X Y, LI Y J, CIAMPITTI I A, et al. Response of soil denitrification potential and community composition of denitrifying bacterial to different rates of straw return in north-central China[J]. Applied Soil Ecology, 2022, 170: 104312. doi: 10.1016/j.apsoil.2021.104312 [68] LV B, ZHANG D, CHEN Q, et al. Effects of earthworms on nitrogen transformation and the correspond genes (amoA and nirS) in vermicomposting of sewage sludge and rice straw[J]. Bioresource Technology, 2019, 287: 121428. doi: 10.1016/j.biortech.2019.121428 [69] KANG Z, ZOU J, HUANG Y, et al. Tuber melanosporum shapes nirS-type denitrifying and ammonia-oxidizing bacterial communities in Carya illinoinensis ectomycorrhizosphere soils[J]. PeerJ, 2020, 8: e9457. doi: 10.7717/peerj.9457 [70] 王雨阳, 李茹莹. 同步脱氮除磷复配菌剂对河流水质净化效果研究[J]. 环境科学学报, 2022, 42(5): 187-194. -



 下载:
下载: