-
河流生态系统是连接陆地与海洋的纽带,也是重要的氮汇和碳汇,对陆地生态系统输出营养盐和有机质的迁移转化过程起主要作用。而沉积物作为河流生态系统的重要组成部分,不仅是流域C、N、P等营养元素的重要蓄积库,也是许多环境污染物的接收器[1]。输入河流中的 NH4+ 和NO3−发生着以各种微生物为媒介的硝化 (nitration) 、反硝化 (denitrification) 、异化还原成铵 (dissimilatory nitrate reduction to ammonium,DNRA) 和厌氧氨氧化 (anaerobic ammonium oxidation,ANAMMOX) 等活跃的生物地球化学反应,使河流中的氮元素以氮气形式返回大气圈,以达到河流中除氮和减少温室气体氧化亚氮 (N2O) 排放的目的[2-4]。甲烷 (CH4) 对全球变暖的贡献占22%,是除了N2O和CO2气体外最重要的温室气体[5-7]。河流也是大气中CH4主要排放源之一。目前,大气中有50%CH4来自于河流、河口等水生生态系统[8-10]。在水环境中广泛存在着厌氧甲烷氧化 (anaerobic oxidation to methane,AOM) ,而反硝化型厌氧甲烷氧化 (denitrifying anaerobic methane oxidation,DAMO) 能在厌氧条件下使甲烷直接作为碳源,以硝酸盐作为电子供体发生脱氮反应。该反应能减少甲烷排放的同时,还能达到除氮目的,因此,被认为是淡水环境中连接碳和氮循环的新型微生物过程,对于厌氧环境中甲烷消除具有重要意义[7,11-14]。国内外研究学者针对湖泊[12,15]、湿地[16-17]及河流[13,18]等多地淡水环境开展了相关研究,但针对易受农业径流污染的河流及河口环境研究较少[11,13,15-18]。城市内陆河流营养盐及电子供体较为丰富、有机质和硝酸盐含量较高、氧化还原电位梯度频繁交迭,为各种以硝酸盐为电子受体的生物化学反应提供了最大反应驱动力,促进了碳氮循环。
西溪为厦门市最大的内陆入海河流。该河流及河口环境的厌氧和好氧交界面发生着多种生物地球化学反应[12,19-20]。西溪所在流域存在较多人类活动,不同地区受人类影响的程度不同。因此,针对西溪中脱氮反应速率及连接碳氮循环的反硝化型厌氧甲烷氧化反应速率研究是很有必要。
本研究选取西溪中下游为研究对象,在2021—2022年期间沿溪流进行季节性采样。基于15N以及13C同位素配对技术,开展沉积物培养实验,评估西溪流域中下游沉积物季节性的反硝化和厌氧氨氧化潜在速率及脱氮贡献,同时也验证反硝化型厌氧甲烷氧化反应的发生并测定其反应速率,并结合上覆水等理化特征分析,探讨了沉积物中生物化学反应潜在速率时空及季节性差异的原因,以掌握河流内部反硝化、厌氧氨氧化作用及反硝化型厌氧甲烷氧化 (DAMO) 的变化规律,从而揭示生态环境中河流生态系统在甲烷参与下碳、氮的动态变化过程,以期为探究该河流中碳氮循环并开展下游沉积物脱氮治理提供参考。
-
西溪起源于同安区西北部的寨尖尾山,全长大约34 km,流域面积约为494 km2,多年平均年径流量约为4.66×109 m3,其东南方向流经东咀港入海。西溪流域地处南亚热带海洋性季风气候区。该区域内气候温和、雨量充沛、热量充足,且河流沿途有莲花溪、澳溪和汀溪等水流汇入,故流域境内主要水系多呈树枝状,有丰富的农林牧渔水利气候资源,是同安区主要工农业、生活用水的来源。西溪中下游流经农田村庄,沿途穿过城市居民区域,且末端接近入海口,存在工农业含氮污水、沿岸生活污水的流入及较为复杂的河口环境,可能会对河流中的碳氮循环过程起到负面作用,其周围环境复杂,对河流生态系统中的碳氮循环过程亦有重要影响。
-
考虑到河流流域周围环境的复杂性及不同时间尺度的可对比性,分别在2021—2022年对西溪中下游河流进行了季节性样品采集。从上游到下游共布置了5个采样点 (图1) ,分别从农业区、城市居民生活区,再到入海口地区。每一个采样点采集0~10 cm 的沉积物混合样 500 g 装入自封袋,并采集相应上覆水样,现场测定溶解氧 (DO) 、电导率、pH及温度等指标。
-
潜在的反硝化和厌氧氨氧化速率利用15N 同位素配对法测定。分别取2组沉积物加入厌氧瓶中并加入200 mL上覆水,将泥样与水样中气体用高纯氦气吹扫干净后密封。通过注射器向2组培养瓶内分别添加 100 μm 和 200 μm 的 K15NO3 溶液。反应稳定一段时间后,保持采样当天的流速与温度,在黑暗条件下培养72 h 。当反应过程结束后,在厌氧手套箱中用引流法将培养好的上覆水样注入经氦气吹扫过的顶空瓶中,并添加饱和 ZnCl2溶液终止反应,使用GasBench-IRMS在线连续分析氮气 (28N、29N、30N) 同位素后进行速率计算[21-25]。计算公式见式 (1)~(5) 。
式中:
$ V $ 是不同浓度体系添加15NO3− 浓度比值;$ {r}_{14} $ 为还原体系中14NO3−/15NO3−比值;式(1)和式(2)分别为加入100 μmol·L−1 和 200 μmol·L−1的 K15NO3培养体系;$ {{P}^{29}}_{{\mathrm{N}}_{2}} $ 和$ {{P}^{30}}_{{\mathrm{N}}_{2}} $ 分别为同位素的 29N2和30N2的生成量;$ {P}_{14} $ 为总N2实际的生成量;${P}_{14,{\rm A}}$ 为厌氧氨氧化所产生28N2的量;${P}_{14,{\rm D}}$ 为反硝化所产生28N2的量。利用13C 同位素配对法测定潜在的反硝化型厌氧甲烷氧化速率。将沉积物泥浆在厌氧条件下至少培养2~3 d,尽可能去除残留的氧气。随后将泥浆分为2组:1) 13CH4;2) 13CH4+NO3− (处理组) 。在培养瓶中加50 g沉积物并加入50 mL高纯水以确保土样处于饱和状态,再将此混合物转移到 500 mL培养瓶中,采用高纯氦气进行吹扫,拧紧盖子密封;再用注射器通过厌氧培养瓶顶端加入KNO3 溶液 (处理组) 和高纯水 (对照组) ,稳定一段时间后,通过向培养瓶中注入13CH4气体。保持采样当天的流速及温度,避光在恒温培养箱中进行培养。分别在培养12 h与48 h进行破坏性采样,用注射器抽取培养瓶顶部空间气体,注入铝箔气体袋中,随后使用DeltaV Advantage同位素质谱仪测定培养瓶中产生的13CO2丰度值。培养瓶顶部空间气体中产生的13CO2浓度计算参考GUPTA等[26-30]的算法。首先根据测定结果按照式 (6) 计算出13C的原子分数(AT%),再根据等式 (7) 计算13CO2浓度值。
式中:
$\delta ^{13}{\rm C}_{\mathrm{P}\mathrm{D}\mathrm{B}}$ 指将样品的13C稳定同位素值(δ 13C)进行国际标准PDB处理的结果;$ {\mathrm{R}}_{\mathrm{s}\mathrm{t}\mathrm{a}\mathrm{n}\mathrm{d}\mathrm{a}\mathrm{r}\mathrm{d}} $ 为所采用的标准物质的同位素比值,取值为0.011 237 2;${}\mathrm{A}\mathrm{T}\mathrm{\%}$ 指13C原子分数;[13CO2]指13CO2浓度值,mmol·L−1;$\left[{\rm CO}_{2}\right]$ 指CO2浓度值,mmol·L−1。 -
采样点上覆水及沉积物孔隙水的理化特征见表1所示。西溪中下游上覆水中氮的总质量浓度 (TN) 为3.02~5.68 mg·L−1,这说明西溪中下游地区水体处于富营养水平。研究区域内无机氮的赋存形态以硝氮和氨氮为主,但不同采样点之间无机氮的主要赋存形态不相同,这与水体中发生的生物化学反应强弱及速率快慢有关。其中,上覆水中硝氮质量浓度最大值为X2点的1.585 mg·L−1,平均值为1.200 mg·L−1;氨氮质量浓度最大值为X4点的2.391 mg·L−1,平均值为0.630 mg·L−1;总有机碳的质量浓度为7.56~16.29 mg·L−1,平均值为9.84 mg·L−1。沉积物孔隙水中主要氮素仍以硝氮和氨氮为主,其中硝氮质量浓度最大值为X2点1.14 mg·L−1 ,平均值为0.88 mg·L−1;氨氮质量浓度最大值为X4点3.80 mg·L−1,平均值为0.96 mg·L−1,总有机碳的质量浓度为3.00~5.68 mg·L−1,平均值为4.22 mg·L−1。研究区域内不同采样点沉积物孔隙水氨氮质量浓度明显高于上覆水氨氮,总有机碳的质量浓度孔隙水低于上覆水。表2表明,沉积物中氮素主要以硝氮和氨氮形式存在,除X4点外,硝氮质量浓度均大于氨氮。其中,硝氮质量浓度最大值在X2点,为10.58 mg·kg−1,平均值为8.62 mg·kg−1;氨氮质量浓度最大值在X4点,为15.81 mg·kg−1,平均值为7.09 mg·kg−1;西溪中下游全氮的质量浓度为2 717~5 376 mg·kg−1,平均值为3 962 mg·kg−1。
-
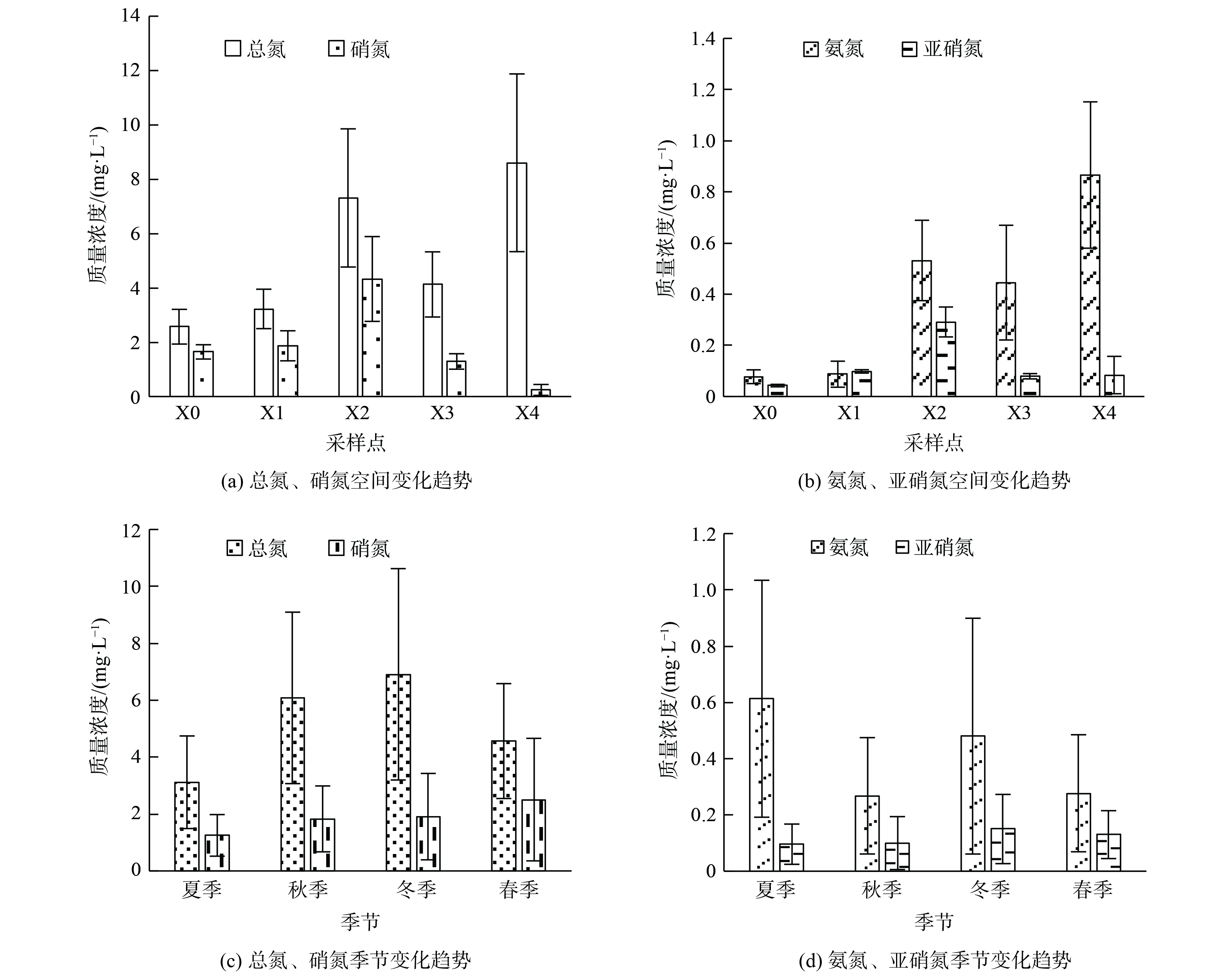
从空间分布趋势来看,上覆水中总氮与氨氮空间变化趋势相同,沿程均呈现逐渐升高的变化趋势;硝氮与亚硝氮空间变化趋势相同,沿程均呈现先升高后降低的变化趋势 (图2) 。上覆水及沉积物氮素指标中X4点相比其他点位氨氮质量浓度偏高而硝酸盐质量浓度较低,氨氮作为水体硝化过程的反应底物会收到硝化作用及沉积物吸附的影响。结合沉积物氮素含量变化趋势 (图3) 可知,X4点位沉积物中氨氮质量浓度为15.81 mg·kg−1。上覆水中硝氮质量浓度在X2点最高后又沿程降低。西溪中下游污染源输入及水体的自净过程对硝氮沿程变化起主要作用。
从时间变化上看,上覆水及沉积物中总氮、硝氮及亚硝氮等指标的变化呈冬季>秋季>春季>夏季的变化趋势。由于春季属于丰水期,河流氮循环加快,而秋冬季节属于枯水期,河流水量减少,氮循环过程减缓导致氮素浓度升高。上覆水及沉积物中氨氮质量浓度变化呈夏季>冬季>秋季>春季的变化趋势,在夏季呈明显升高的现象。在夏季采样过程中发现,夏季温度较高导致河水蒸发量较,水体呈现大面积干涸,河岸以及水体中漂浮了大量水生动物尸体。有研究表明,水生动植物腐烂会首先进行氨化反应,即水体中的微生物分解有机氮转化为氨氮的过程。这一环境因素对水体中氨氮的升高起到主要作用,也致使许多水生动植物死亡腐烂,水中的氨氮质量浓度升高[31]。水体经过高温日晒水体温度会升高,并导致相关菌活性受抑制,从而使氨氮的迁移转化效率下降。同时,有研究表明氨氮质量浓度过高时,水体中游离氨 (free ammonia,FA) 会对水体中的硝化菌产生抑制作用。这就使得水体中的氨氮不能在硝化菌的作用下转化为硝氮,从而致使X4点硝酸盐或亚硝酸盐的质量浓度降低[32-33]。
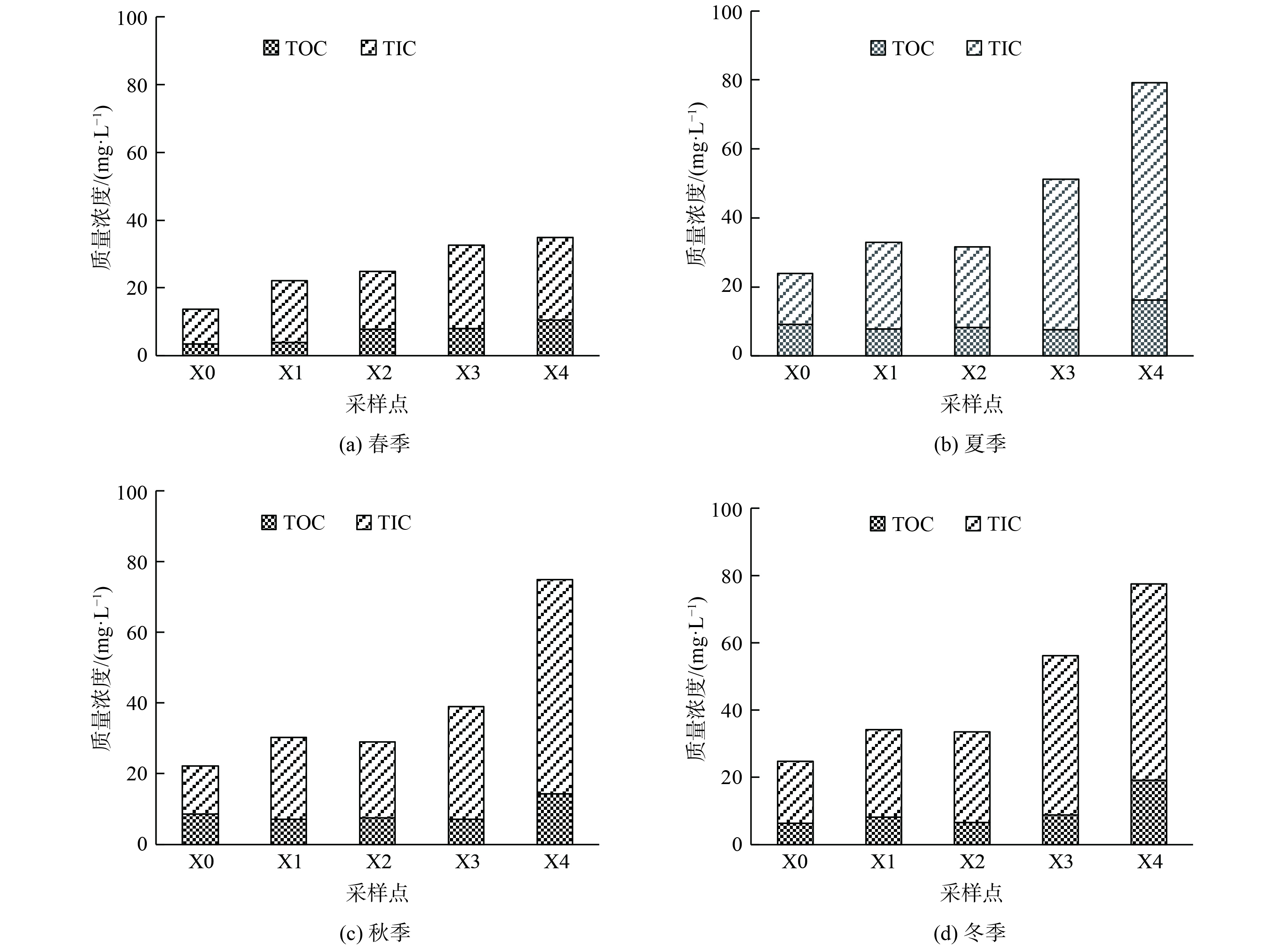
西溪中下游水体中TOC为3.563~14.38 mg·L−1,平均质量浓度为8.52 mg·L−1;TIC为10.06~58.396 mg·L−1,平均质量浓度为28.11 mg·L−1 (图4) 。水体中的TOC是外源输入、内源产生及河流内迁移转化等多个过程动态平衡的结果。从空间分布来看,各碳素分布呈现明显沿程增加的变化趋势,最大浓度在X4点。从时间分布来看,TOC与TIC呈秋冬季节较高,相对较低的是春季。
以上水质检测结果表明,上覆水及沉积物中硝氮质量浓度较高。因此,针对自然水体硝氮的15N、18O进行相关丰度测定,再结合不同来源硝酸盐δ15N-NO3−及δ18OV-SMOW典型值域分布图[34],这表明水体中硝酸盐氮的主要污染来源。另外,西溪中下游水样δ15N-NO3−为10.84‰~67.23‰,δ18OV-SMOW为1.69‰~24.90‰,这表明西溪中下游污染物主要来源于有机肥和污水。
-
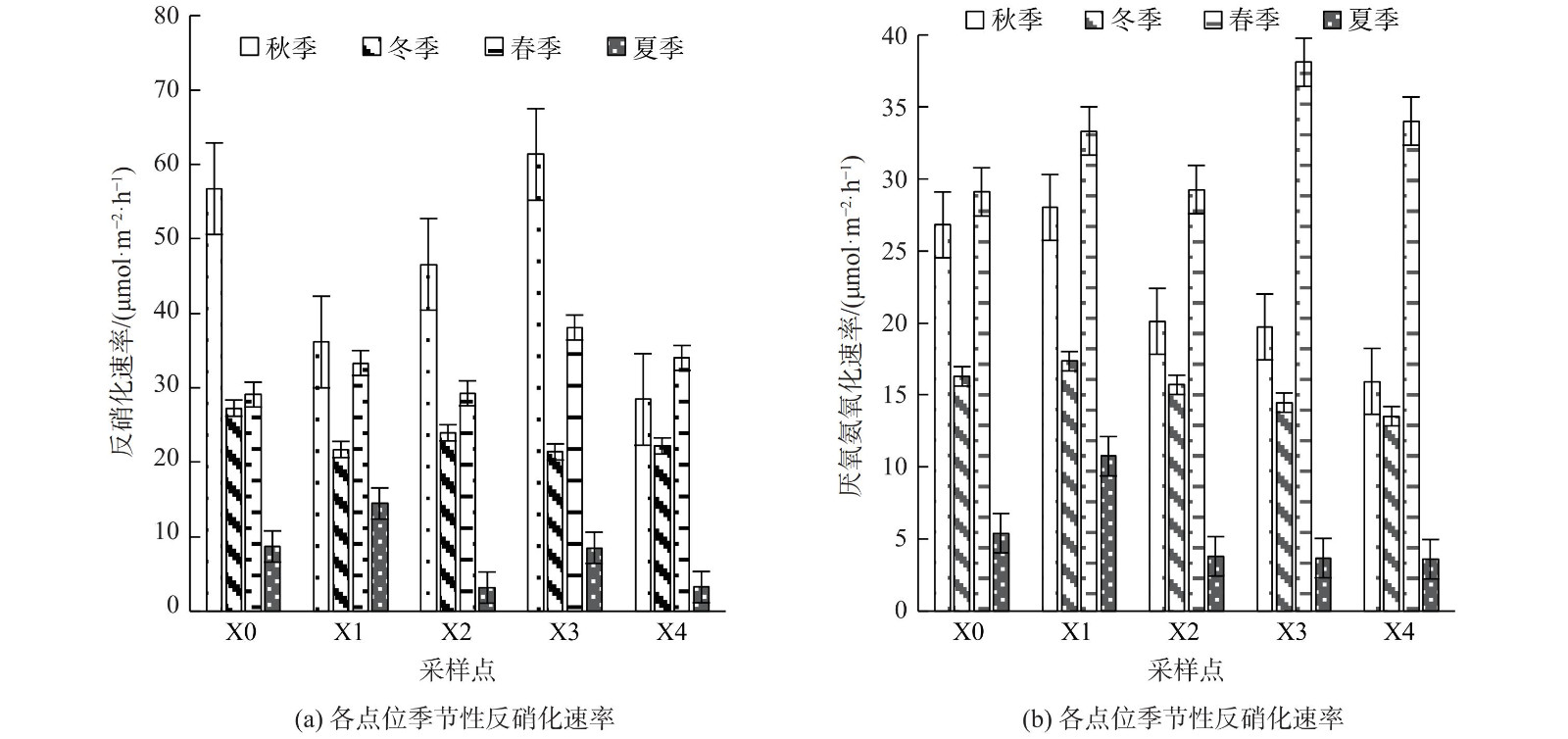
西溪中下游沉积物的反硝化速率为3.233~61.341 μmol·m−2·h−1,最大反应速率为秋季X3点,平均速率为27.386 μmol·m−2·h−1,脱氮贡献率为56.30%~66.76%,在空间上呈现先升高后降低的变化趋势,在时间上呈现秋季>春季>冬季>夏季的变化趋势。厌氧氨氧化速率为3.604~38.101 μmol·m−2·h−1,最大反应速率为春季X3点,平均反应速率为18.953 μmol·m−2·h−1,脱氮贡献率的变化范围为33.24%~43.70%,从沿程呈现逐渐降低的空间变化趋势,在时间变化上厌氧氨氧化潜在反应速率呈现春季>秋季>冬季>夏季的变化趋势 (图5) 。
-
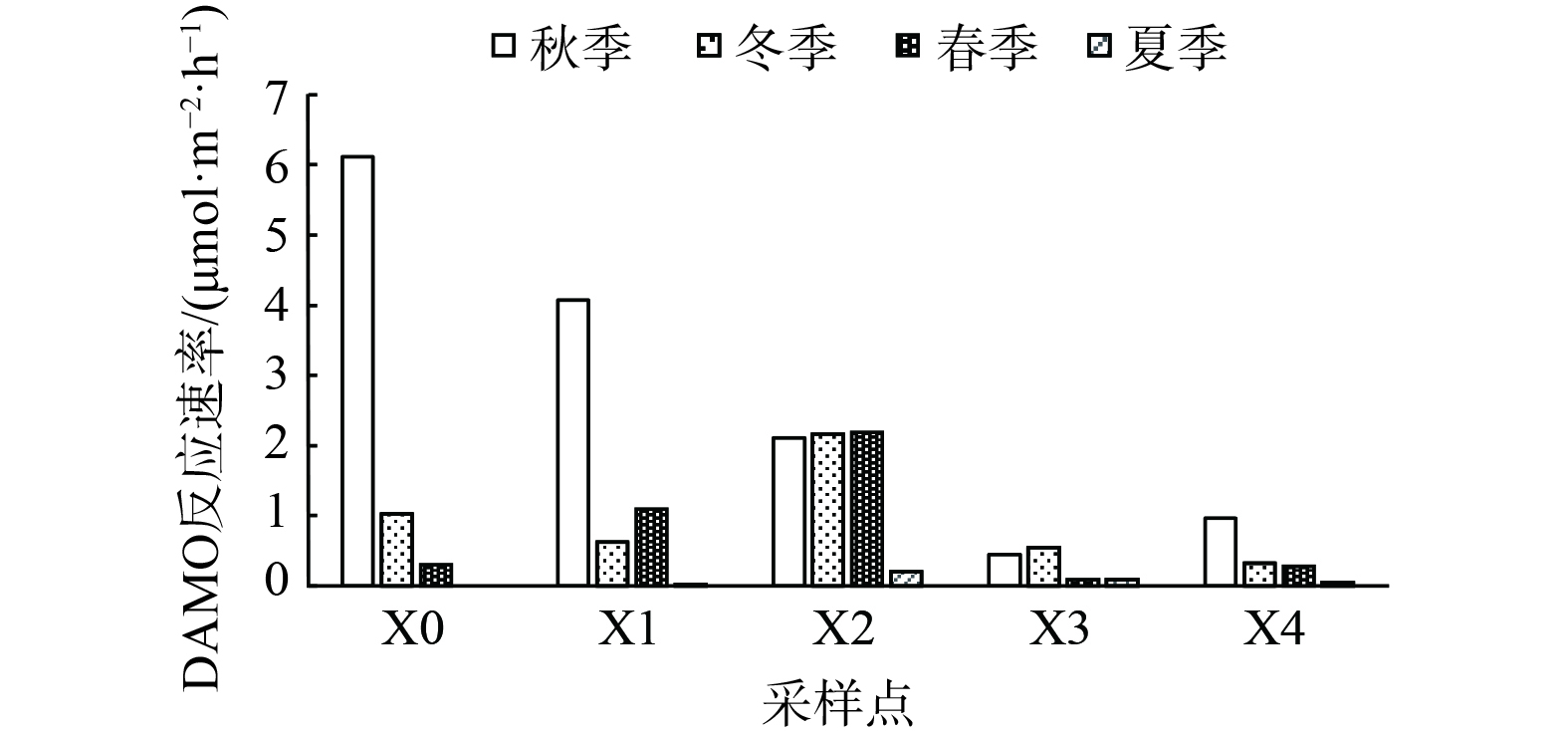
沉积物样品对照组与处理组的顶部空间气体中均检测产生13CO2,且二氧化碳质量浓度随培养时间呈上升的变化趋势,因此,各采样点的沉积物样品均可在厌氧条件下将甲烷氧化转化成为二氧化碳。这也说明西溪中下游沉积物中均有DAMO反应发生。西溪中下游沉积物中DAMO反应速率为0~6.122 µmol·m−2·h−1,平均速率为1.139 µmol·m−2·h−1,最大反应速率点在秋季的X0点,最低反应速率在夏季的X0点。从空间上看,西溪中下游各采样点在空间特征上变化具有较大差异性。从时间上看,西溪中下游各采样点的DAMO速率秋季最强,春季和冬季次之,夏季反应速率最低 (图6) 。
-
由于营养物可用性和环境条件的差异,各种沉积物中生物化学反应的潜在反应速率会受到多种因素及其之间相互作用的影响。溶解氧对厌氧氨氧化产生抑制作用,且厌氧氨氧化相比于反硝化对低氧环境的依赖性更强[35]。西溪中下游河流中有机质的输入也为反硝化细菌提供了充足碳源,厌氧氨氧化细菌在针对氨氮及亚硝氮的竞争中处于劣势,导致西溪中下游河流沉积物中脱氮以反硝化反应为主[36]。值得注意的是,X4点氨氮含量较高,但同时厌氧氨氧化的反应速率明显较低。这是由于该点氨氮含量过高会对硝化细菌及亚硝化菌产生毒害作用,致使没有足够的硝酸盐或亚硝酸盐作为电子受体进行厌氧氨氧化反应[21]。适宜的硝酸盐底物质量浓度对反硝化速率的起到促进作用,结合上覆水中硝酸盐质量浓度可知,在流经城区的X2与X3点,硝酸盐质量浓度高于其他采样点,故反硝化速率也较高[37]。在季节上呈现厌氧氨氧化与反硝化速率春秋两季大于冬季的变化趋势[38]。受营养盐及温度的双重控制,虽然冬季处于枯水期,导致河流断流,致使河流沉积物中没有充足硝酸盐作为反硝化反应的底物,水体氮循环减弱,导致反硝化速率较低[39-40]。针对淡水河流中的脱氮研究中反硝化脱氮贡献率均大于厌氧氨氧化脱氮贡献率,西溪中下游沉积物中的反硝化速率与潮白河 (25.82±0.98)~(142.32±17.06) μmol·m−2·h−1,以及太湖地区西部6条河流(18.5±2.8)~(133.2±27.1) μmol·m−2·h−1相当[41-43]。
DAMO反应过程会受到多种因素及其相互作用的干扰。河流周围不同的环境条件与河流系统中氮素与碳素含量有着密切关系,从而也会主要影响DAMO速率的快慢 [44-46]。其中,X0和X1点氮肥的冲刷及生活污水的排放为河道带来大量氮,王超等[45]发现硝酸盐可用性可提高反硝化程度,能进一步增加DAMO速率。同时,本研究经相关性分析发现冬季与春季硝酸盐质量浓度与DAMO反应速率相关性为0.977 5与0.959,在0.01级别 (双尾) 呈现显著相关性。值得注意的是,除秋季以外,靠近入海口的X4点DAMO反应速率较低而盐度与沉积物中DAMO细菌的丰度及活性呈负相关,会抑制DAMO的速率[47]。秋季X4点接近入海口但反应速率较高,这可能是由于碳素的累积效应所造成的,也有研究表明TOC对DAMO菌群呈显著正相关[9][17]。从时间上看,秋季DAMO速率较大,由于适宜的环境温度能对DAMO的相关微生物生长代谢起到促进作用,长时间更适宜厌氧甲烷氧化菌参与反应,进而也会对DAMO的反应速率起到提升作用,从而促进DAMO的反应过程[48-49]。
厌氧氨氧化反应能以硝酸盐或者亚硝酸盐为电子受体将氨氮转化为氮气,DAMO反应能利用NO3−作为电子供体将甲烷氧化,最终产生二氧化碳与氮气。两种反应均可实现减少水体氮素污染及甲烷排放的目的。厌氧氨氧化与反硝化过程存在竞争,且DAMO与反硝化过程存在一定协同作用。当反硝化反应速率较高时,则厌氧氨氧化速率相应较低。这是由于硝酸盐转化为亚硝酸盐含量的多少及反应竞争强度所决定的。当反硝化过程较强,能将硝酸盐转化为亚硝酸盐进而转化为N2O,因此,反应体系中所含的亚硝酸盐就会被消耗进而会使厌氧氨氧化速率较低。DAMO反应能利用硝酸盐作为电子受体将甲烷氧化成二氧化碳,并在此过程中完成脱氮。因此,反硝化过程所产生的电子受体能促进甲烷氧化,2种生物化学反应之间存在一定的协同作用。由图4与图5可知,反硝化与厌氧氨氧化反应速率在空间上变化趋势相反,而反硝化与DAMO反应速率在空间变化上趋势相同。3种反应相互协同为西溪中下游沉积物脱氮及碳减排做出重要贡献,因此,3种生物化学反应之间存在碳氮交互过程,并且硝酸盐对城市内陆河流沉积物中发生的生物化学反应起到重要作用,因此,进一步研究硝酸盐质量浓度变化对三者反应速率的影响,以及脱氮减排的作用途径至关重要。
城市内陆河流的环境复杂容易受到污染源干扰,为保证城市水生态环境的健康可持续发展,应加大对城市内陆河流水质管控。根据本研究结果,河流沉积物中的反硝化、厌氧氨氧化、DAMO对河流中的脱氮,以及甲烷氧化方面都起着一定的作用,且厌氧氨氧化过程最终产物N2相较于反硝化的产物N2O,降低了温室气体排放的可能性,甲烷转化成二氧化碳排放也降低了温室气体的暖化能力,间接地有助于碳减排。因此,一方面可以对河流中的底泥进行修复,去除河流沉积物中的污染物质减少河流中污染源的释放,从而改善河流水质;另一方面可向受污染水体中投加厌氧氨氧化菌等能提高污染物代谢能力的高效菌种微生物,利用微生物的分解脱氮能力降低水质的污染程度,还可投加促进功能菌微生物生长和提高微生物活性的物质,从而加快污染物的降解和转化,提高沉积物中的脱氮速率。
-
1) 各形态氮及碳素在空间上呈逐渐累积的变化趋势,总氮变化范围为3.02~5.68 mg·L−1,上覆水体中硝氮的主要污染来源为有机肥和污水。西溪中下游沉积物中厌氧氨氧化反应平均脱氮贡献率为40.13%,反硝化平均脱氮贡献率为59.87%,溪流沉积物中脱氮主要是以反硝化作用进行的,但同时厌氧氨氧化也发挥着不小的作用;西溪中下游沉积物中发生着DAMO反应,但不同的点位存在差异性且平均反应速率为1.139 µmol·m−2·h−1,硝酸盐质量浓度与DAMO反应速率相关性较大。
2) 盐度、硝酸盐负荷及碳源的输入对DAMO过程至关重要,也可能对于甲烷汇及氧化过程起到主导作用,因此,进一步探究内陆淡水河流沉积物中反硝化作用对厌氧甲烷氧化过程影响的方式也具有重要生态意义。
3) 针对城市内陆河流水质管控,可对河流底泥进行修复,减少污染物的释放;沿程向受污染水体中投加反硝化、厌氧氨氧化菌等高效菌种微生物及促进功能菌微生物生长和提高微生物活性的物质,提高水体环境中的脱氮速率,加快污染物的降解和转化。
沉积物碳氮交互效应及其对河流水体脱氮治理的影响——以厦门市西溪中下游为例
Interaction effect of sediment carbon and nitrogen and its influence on nitrogen removal in river water —A case study of the middle and lower reaches of Xixi River in Xiamen
-
摘要: 通过福建厦门市内陆河流西溪中下游上覆水及沉积物中碳氮理化指标的时空分布特征,利用碳 (13C) 、氮 (15N) 稳定同位素技术研究了沉积物中厌氧氨氧化 (ANAMMOX) 、反硝化 (denitrification) 及反硝化型厌氧甲烷氧化 (DAMO) 的反应速率及其分布规律。结果表明:西溪中下游上覆水水质总氮为3.02~5.68mg·L−1;利用15N同位素技术测得西溪中下游沉积物中厌氧氨氧化的平均速率为18.953 μmol·m−2·h−1,平均脱氮贡献率为40.13%,反硝化平均速率为27.386 μmol·m−2·h−1,平均贡献率为59.87%;起主要脱氮贡献的为反硝化反应,但厌氧氨氧化的脱氮作用仍不可忽视。利用13C同位素技术测得西溪中下游沉积物中DAMO反应速率为0~6.122 µmol·m−2·h−1,平均速率为1.139 µmol·m−2·h−1。这表明西溪中下游沉积物中存在DAMO反应,可在厌氧条件下以硝酸盐作为电子受体将CH4转化为CO2。在空间上,西溪中下游DAMO速率存在较大差异性;而在时间上,DAMO速率秋季高于冬春季。反硝化与厌氧氨氧化作用对西溪生态系统中脱氮具有重要意义,DAMO在西溪中下游沉积物虽然反应速率较低,但仍然证明了西溪沉积物生态系统存在连接碳氮循环的微生物反应。反硝化、厌氧氨氧化和DAMO的相互协同,在西溪中下游沉积物脱氮治理及相应过程中的温室气体减排中起到重要作用。
-
关键词:
- 河流 /
- 沉积物 /
- 同位素 /
- 脱氮速率 /
- 反硝化型厌氧甲烷氧化
Abstract: Based on the spatial and temporal distribution characteristics of carbon and nitrogen physical and chemical indexes in overlying water and sediments of the middle and lower reaches of Xixi River in Xiamen City, Fujian Province, the reaction rates and distribution of Anaerobic ammonia oxidation ( Anammox ), Denitrification and denitrifying anaerobic methane oxidation ( DAMO ) in sediments were studied by using carbon ( 13C ) and nitrogen ( 15N ) stable isotope techniques. The results showed that the total nitrogen concentration of overlying water in the middle and lower reaches of Xixi River ranged from 3.02 to 5.68 mg·L−1. The average rate of anaerobic ammonia oxidation in the sediments of the middle and lower reaches of Xixi River was 18.953 μmol·m−2·h−1, and the average contribution rate of denitrification was 40.13 %. The average rate of denitrification was 27.386 μmol·m−2·h−1 and the average contribution rate was 59.87 %. The main contribution of denitrification was denitrification, but the denitrification effect of anaerobic ammonia oxidation could not be ignored. The DAMO reaction rate was 0~6.122 μmol·m−2·h−1 and the average rate was 1.139 μmol·m−2·h−1 measured by 13C isotope technique in the sediments of the middle and lower reaches of Xixi River, indicating that there was DAMO reaction in the sediments of the middle and lower reaches of Xixi River, which could convert CH4 into CO2 with nitrate as electron acceptor under anaerobic conditions. In space, the DAMO rate in the middle and lower reaches of Xixi River was quite different; in terms of time, the DAMO rate in autumn was higher than that in winter and spring. Denitrification and anammox were important for nitrogen removal in Xixi ecosystem. Although the reaction rate of DAMO in the sediments of the middle and lower reaches of Xixi was low, it still proved that there were microbial reactions connecting carbon and nitrogen cycles in Xixi sediment ecosystem. Denitrification, anammox and DAMO synergistically played an important role in sediment nitrogen removal and greenhouse gas emission reduction in the middle and lower reaches of Xixi River.-
Key words:
- river /
- sediment /
- isotope /
- nitrogen removal rate /
- denitrifying anaerobic methane oxidation(DAMO)
-

-
表 1 研究区域上覆水及沉积物孔隙水中理化特征
Table 1. Physicochemical characteristics of overlying water and sediment pore water in the study area
mg·L−1 采样点 上覆水 孔隙水 硝氮 亚硝氮 氨氮 总氮 总有机碳 硝氮 亚硝氮 氨氮 总有机碳 X0 0.850 0.035 0.100 3.02 9.23 0.63 0.03 0.17 3.00 X1 0.744 0.035 0.292 3.22 7.89 0.66 0.03 0.36 3.01 X2 1.585 0.094 0.175 4.89 8.21 1.14 0.09 0.20 4.89 X3 1.475 0.047 0.214 4.52 7.56 1.01 0.04 0.29 4.52 X4 1.324 0.328 2.391 5.68 16.29 0.96 0.30 3.80 5.68 平均值 1.200 0.110 0.630 4.26 9.84 0.88 0.10 0.96 4.22 表 2 沉积物中各氮素理化特征
Table 2. Physicochemical characteristics of nitrogen in sediment
mg·kg−1 采样点 硝氮 亚硝氮 氨氮 有机氮 全氮 X0 7.34 0.24 4.42 2 705 2 717 X1 6.6 0.24 5.38 2 903 2 915 X2 10.58 0.54 4.77 4 558 4 574 X3 10.4 0.35 5.05 4 212 4 228 X4 8.18 1.71 15.81 5 350 5 376 平均值 8.62 0.61 7.09 3 946 3 962 -
[1] XU G P, WANG X F, CHEN L J. Application of principal component analysis for the estimation of source of heavy metal contamination in sugarcane soil[J]. Applied Mechanics and Materials, 2014, 651-653: 1402-1409. doi: 10.4028/www.scientific.net/AMM.651-653.1402 [2] 朱广伟, 陈英旭. 沉积物中有机质的环境行为研究进展[J]. 湖泊科学, 2001, 13(3): 272-279. doi: 10.3321/j.issn:1003-5427.2001.03.012 [3] WANG J F, CHEN J G, DING S M, et al. Effects of seasonal hypoxia on the release of phosphorus from sediments in deep-water ecosystem: A case study in Hongfeng Reservoir, Southwest China.[J]. Environmental Pollution, 2016, 219: 858-865. doi: 10.1016/j.envpol.2016.08.013 [4] HARIKA, NARUMANCHI, DISHANT, et al. In situ, high-resolution evidence of phosphorus release from sediments controlled by the reductive dissolution of iron-bound phosphorus in a deep reservoir, southwestern China[C]// 2018 IEEE International Conference on Smart Cloud. 0. [5] WANG J, CAI C, LI Y, et al. Denitrifying anaerobic methane oxidation: A previously overlooked methane sink in intertidal zone[J]. Environmental Science & Technology, 2019, 53(1): 203-212. [6] SIVAN O, ADLER M, PEARSON A, et al. Geochemical evidence for iron-mediated anaerobic oxidation of methane[J]. Limnology and Oceanography, 2011, 56(4): 1536-1544. doi: 10.4319/lo.2011.56.4.1536 [7] RAGHOEBARSING A A, POL A, VAND P K, et al. A microbial consortium couples anaerobic methane oxidation to denitrification[J]. Nature, 2006, 440: 918-921. doi: 10.1038/nature04617 [8] 保琼莉, 黄益宗. 湿地反硝化型甲烷厌氧氧化研究进展[J]. 生态学杂志, 2019, 38(10): 3202-3210. doi: 10.13292/j.1000-4890.201910.004 [9] 吴红宝. 典型河流生态系统碳氮温室气体扩散传输研究[D]. 芜湖: 安徽师范大学, 2017. [10] BEAULIEU J J, SHUSTER W D, REBHOLZ J A. Nitrous oxide emissions from a large, impounded river: The Ohio River[J]. Environmental Science & Technology, 2010, 44(19): 7527. [11] 王瑞飞, 王亚利, 杨清香. 淡水生态系统中反硝化型厌氧甲烷氧化微生物的研究进展[J]. 环境污染与防治, 2018, 40(12): 1443-1448. doi: 10.15985/j.cnki.1001-3865.2018.12.023 [12] DEUTZMANN J S, STIEF P, BRANDES J, et al. Anaerobic methane oxidation coupled to denitrification is the dominant methane sink in a deep lake[J]. Proceedings of the National Academy of Sciences, 2014, 111(51): 18273-18278. doi: 10.1073/pnas.1411617111 [13] SHEN L D, ZHU Q, LIU S, et al. Molecular evidence for nitrite-dependent anaerobic methane-oxidising bacteria in the Jiaojiang Estuary of the East Sea (China)[J]. Applied Microbiology & Biotechnology, 2014, 98(11): 5029-5038. [14] ETTWIG K F, BUTLER M K, PASLIER D L, et al. Nitrite-driven anaerobic methane oxidation by oxygenic bacteria[J]. Nature, 2010, 464(7288): 543-548. doi: 10.1038/nature08883 [15] KOJIMA H, TOKIZAWA R, KOGURE K, et al. Community structure of planktonic methane-oxidizing bacteria in a subtropical reservoir characterized by dominance of phylotype closely related to nitrite reducer[J]. Scientific Reports, 2014, 4: 5728. doi: 10.1038/srep05728 [16] SHEN L D, LIU S, HUANG Q, et al. Evidence for the cooccurrence of nitrite-dependent anaerobic ammonium and methane oxidation processes in a flooded paddy field[J]. Applied & Environmental Microbiology, 2014, 80(24): 7611-7619. [17] HU B L, SHEN L D, LIAN X, et al. Evidence for nitrite-dependent anaerobic methane oxidation as a previously overlooked microbial methane sink in wetlands[J]. Proceedings of the National Academy of Sciences, 2014, 111(12): 4495-4500. doi: 10.1073/pnas.1318393111 [18] YAN P, LI M, WEI G, et al. Molecular fingerprint and dominant environmental factors of nitrite-dependent anaerobic methane-oxidizing bacteria in sediments from the Yellow River Estuary, China[J]. PLOS ONE, 2015, 10(9): e0137996. doi: 10.1371/journal.pone.0137996 [19] SHEN L D, LIY S, ZHU Q, et al. Distribution and diversity of nitrite-dependent anaerobic methane-oxidising bacteria in the sediments of the Qiantang River[J]. Microbial Ecology, 2014, 67(2): 341-349. doi: 10.1007/s00248-013-0330-0 [20] GUILLAUME B, DIDIER J, CORINNE B P, et al. Production and consumption of methane in freshwater lake ecosystems.[J]. Research in Microbiology, 2011, 162(9): 832-847. doi: 10.1016/j.resmic.2011.06.004 [21] SONG G D, LIU S M, KUYPERS M M M, et al. Application of the isotope pairing technique in sediments where anammox, denitrification, and dissimilatory nitrate reduction to ammonium coexist[J]. Limnology and Oceanography:Methods, 2016, 1(9): 63-73. [22] TRIMMER M,NICHOLLS J C,DEFLANDRE B. Anaerobic ammonium oxidation measured in sediments along the Thames estuary, United Kingdom[J]. Applied and Environmental Microbiology, 2003, 69(11): 6447-6454. [23] KUYPERS M M M, SLIEKERS A O, LAVIK G, et al. Anaerobic ammonium oxidation by anammox bacteria in the Black Sea[J]. Nature, 2003, 422(10): 608-611. [24] RISGAARD-PETERSEN N, NIELSEN L P, RYSGAARD S, et al. Application of the isotope pairing technique in sediments where anammox and denitrification coexist[J]. Limnology and Oceanography:Methods, 2003, 1(1): 63-73. doi: 10.4319/lom.2003.1.63 [25] CAO W Z, YANG J X, LI Y. Dissimilatory nitrate reduction to ammonium conserves nitrogen in anthropogenically affected subtropical mangrove sediments in Southeast China[J]. Marine Pollution Bulletin, 2016, MPB-07832: 1-7. [26] GUPTA V, SMEMO K A, YAVITT J B, et al. Stable isotopes reveal widespread anaerobic methane oxidation across latitude and peatland type[J]. Environmental Science & Technology, 2013, 47(15): 8273-8279. [27] WEISS R F. The solubility of nitrogen, oxygen and argon in water and seawater[J]. Deep-Sea Research and Oceanographic Abstracts, 1970, 17(4): 721-735. doi: 10.1016/0011-7471(70)90037-9 [28] WANNINKHOF R. Relationship between gas exchange and wind speed over the ocean[J]. Journal of Geophysical Research:Oceans, 1992, 97(C5): 7373-7382. doi: 10.1029/92JC00188 [29] 陈能汪, 吴杰忠, 洪华生. 九龙江河口区夏季反硝化作用初探[J]. 环境科学, 2011, 32(11): 3229-3234. doi: 10.13227/j.hjkx.2011.11.027 [30] 施瑶. 氮输入对泥炭沼泽碳氮转化的影响研究[D]. 长春: 东北师范大学, 2019. [31] 蒋艾青. 残饵、死鱼及排泄物腐解对山区精养池养殖水质的影响[J]. 现代农业科技, 2007(10): 143-144. doi: 10.3969/j.issn.1007-5739.2007.10.101 [32] 孙洪伟, 尤永军, 赵华南, 等. 游离氨对硝化菌活性的抑制及可逆性影响[J]. 中国环境科学, 2015(1): 95-100. [33] 刘富龙. 氨氮浓度对硝化反应影响的研究[D]. 太原: 太原理工大学, 2009. [34] 徐志伟, 张心昱, 于贵瑞, 等. 中国水体硝酸盐氮氧双稳定同位素溯源研究进展[J]. 环境科学, 2014, 35(8): 3231-3238. doi: 10.13227/j.hjkx.2014.08.056 [35] 王超, 单保庆, 赵钰. 滏阳河水系沉积物硝化速率分布及溶解氧的限制效应[J]. 环境科学学报, 2015, 35(6): 1735-1740. doi: 10.13671/j.hjkxxb.2014.0897 [36] 赵锋, 许海, 詹旭, 等. 太湖春夏两季反硝化与厌氧氨氧化速率的空间差异及其影响因素[J]. 环境科学, 2021, 42(5): 2296-2302. doi: 10.13227/j.hjkx.202008303 [37] 俞琳, 王东启, 邓焕广, 等. 上海市苏州河与崇明岛河流沉积物反硝化速率及其影响因素[J]. 生态与农村环境学报, 2015, 31(1): 100-105. doi: 10.11934/j.issn.1673-4831.2015.01.015 [38] 王子聪, 许海, 詹旭, 等. 天目湖流域沟塘湿地脱氮速率的时空差异[J]. 环境科学研究, 2022, 35(4): 979-988. doi: 10.13198/j.issn.1001-6929.2022.02.01 [39] 王正文, 姚晓龙, 姜星宇, 等. 季节与水文影响下鄱阳湖碟形湖湿地沉积物氮去除功能变化[J]. 长江流域资源与环境, 2022, 31(3): 673-684. [40] 王静, 刘洪杰, 雷禹, 等. 三峡库区小江支流沉积物硝化反硝化速率在蓄水期和泄水期的特征[J]. 环境科学, 2017, 38(3): 946-953. doi: 10.13227/j.hjkx.201606202 [41] 秦红益. 太湖沉积物厌氧氨氧化细菌分布多样性及其活性研究[D]. 南京: 南京师范大学, 2017. [42] 赵永强, 夏永秋, 李博伦, 等. 利用膜进样质谱同时测定河流沉积物反硝化和厌氧氨氧化[J]. 农业环境科学学报, 2014, 33(4): 794-802. doi: 10.11654/jaes.2014.04.026 [43] 彭强, 关傲梅, 齐维晓, 等. 基于同位素示踪和分子生物学技术对潮白河沉积物中氮还原功能特征的研究[J]. 环境科学学报, 2021, 41(11): 4615-4624. doi: 10.13671/j.hjkxxb.2021.0193 [44] 沈李东. 湿地亚硝酸盐型厌氧氨氧化和厌氧甲烷氧化微生物生态学研究[D]. 杭州: 浙江大学, 2014. [45] 张亚迪, 宋永会, 彭剑峰, 等. 浑河底泥反硝化厌氧甲烷氧化菌群落多样性的时空分布特征及其与环境因子关系分析[J]. 环境科学, 2018, 39(8): 3670-3676. doi: 10.13227/j.hjkx.201710162 [46] 袁梦冬, 朱静, 吴伟祥. 微生物厌氧甲烷氧化反硝化研究进展[J]. 微生物学报, 2014, 54(2): 129-138. doi: 10.13343/j.cnki.wsxb.2014.02.002 [47] SHEN L D, HU B L, LIU S, et al. Anaerobic methane oxidation coupled to nitrite reduction can be a potential methane sink in coastal environments[J]. Applied Microbiology & Biotechnology, 2016, 100(16): 7171-7180. [48] XU Y, TONG T, CHEN J, et al. Nitrite-dependent methane-oxidizing bacteria seasonally and spatially shift in a constructed wetland used for treating river water[J]. Ecological Engineering, 2018, 110: 48-53. doi: 10.1016/j.ecoleng.2017.10.005 [49] LOU J, LV J, YANG D Y. Effects of environmental factors on Nitrate-DAMO activity[J]. Water, Air, & Soil Pollution, 2020, 231: 263. doi: 10.1007/s11270-020-04640-9 -



 下载:
下载: