-
面对当前日益严峻的环境污染和资源短缺问题,世界各国政府和科学家都大力提倡废弃生物质的资源化利用[1]。由廉价废弃生物质生产的生物基化学品具有成本低、用途广和环境友好等优势,既可被加工成各类可生物降解的化工产品,也可作为绿色能源。回收利用生物质能不仅能有效减轻人类发展对不可再生化石资源的依赖,还能在一定程度上缓解废弃有机物对环境的污染。微生物厌氧发酵技术是一种广受认可的生物基化学品生产平台,在微生物的作用下,廉价废弃生物质 (如有机废水、餐厨垃圾、剩余污泥、农业废弃物等) 可被转化为甲烷、乙醇、丁醇、乳酸、短链脂肪酸 (SCFAs) 、中链脂肪酸 (MCFAs) 等[2]。
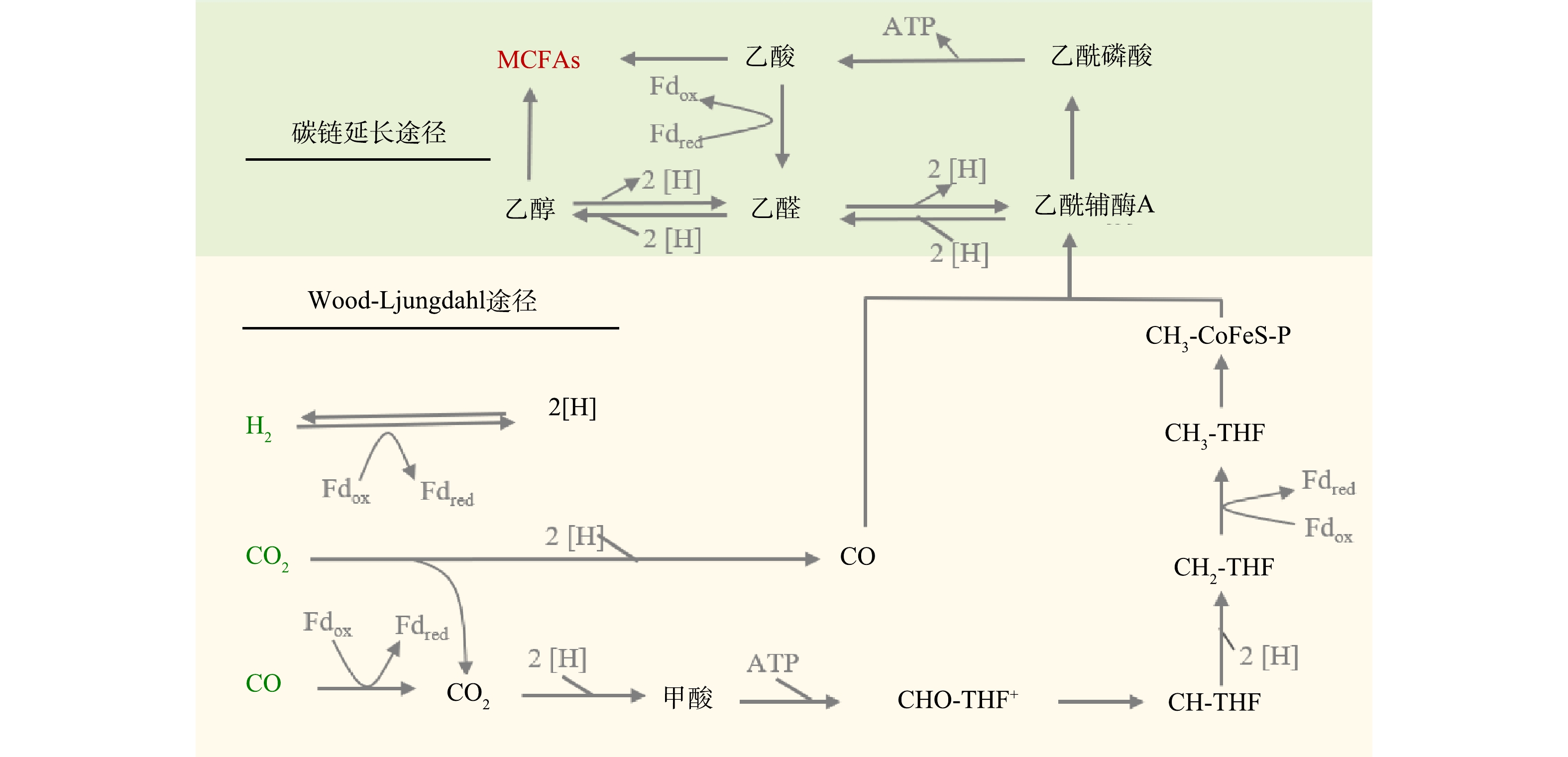
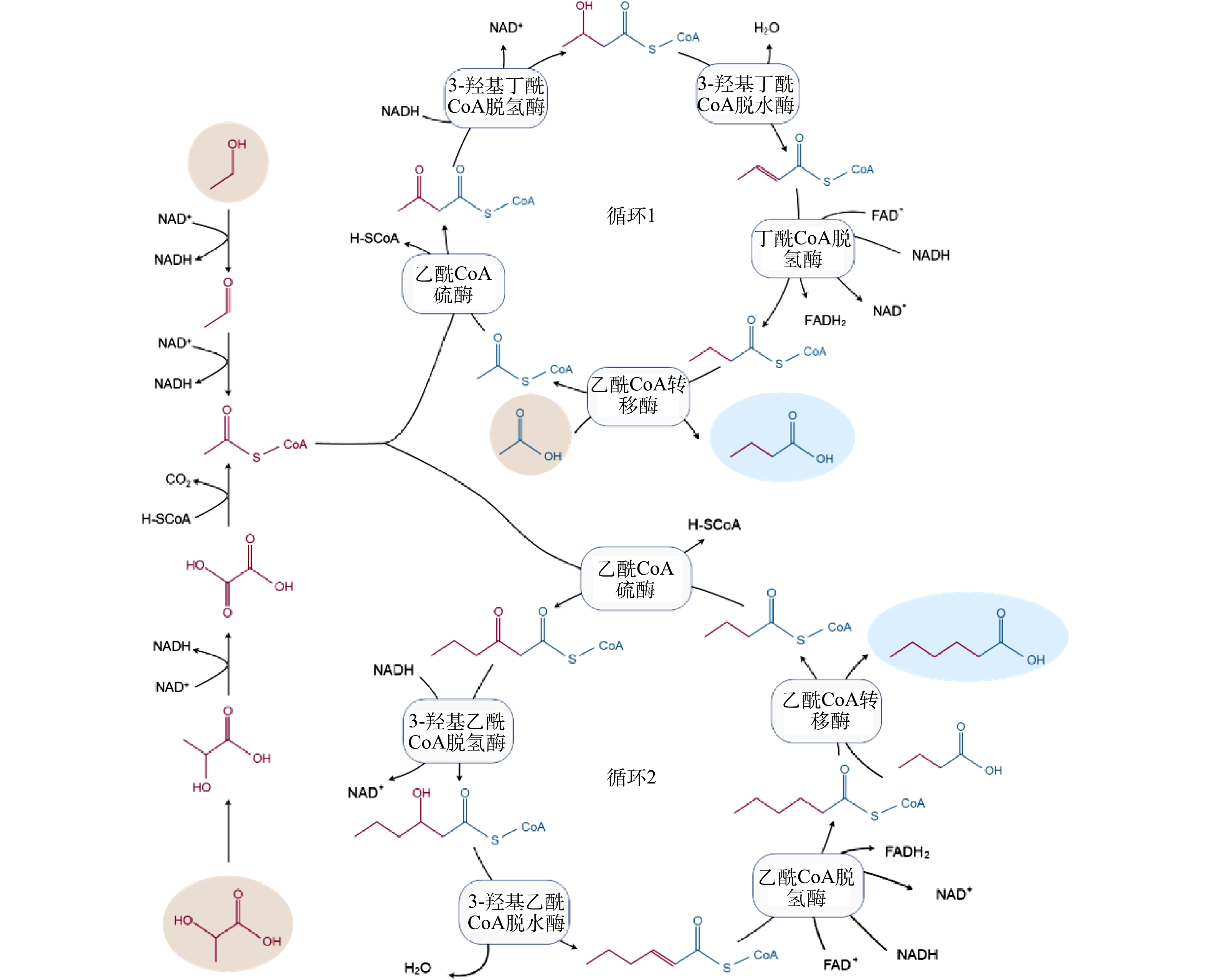
利用新兴的微生物碳链延长 (CE) 技术可实现高值资源化利用废弃生物质合成化学品MCFAs。图1所示为CE反应原理,当利用不同电子供体来引导CE反应进行时,差异主要在于电子供体氧化阶段,而逆β氧化的代谢途径是相似的。例如,当利用乙醇作为电子供体时,乙醇会在乙醇脱氢酶和乙醛脱氢酶的催化作用下转化依次转化为乙醛和乙酰辅酶A。而当乳酸作为电子供体时,D-乳酸会通过旋光性转变为L-乳酸,进一步在辅酶I (NAD+) 和辅酶A作用下,先后被转化为丙酮酸和乙酰辅酶A。在后续循环的逆β氧化途径中,在酶促作用下,乙酰辅酶A可先与电子受体乙酸结合生成丁酸,其进一步结合1分子的乙酰辅酶A通过延长碳链生成己酸[3-5]。除了利用乙醇和乳酸两种常见电子供体合成MCFAs外,合成气 (H2、CO和 CO2) 发酵与CE反应的耦合也是生产MCFAs的重要途径。如图2所示,合成气可先通过碳固定通路Wood-Ljungdahl被转化为乙酰辅酶A,生成的部分乙酰辅酶A可被转化为乙酸和乙醇,它们可分别作为CE反应的电子受体和电子供体被进一步地转化为MCFAs[5]。
相较于SCFAs,MCFAs的主要优势在于具有更高的能量密度和更强的疏水性,其附加值高,在各个领域均有着广泛的应用[6]。MCFAs可加工为生物燃料,包括柴油和航空燃料[7];可广泛应用于化学药品的合成,如正己酸可用作绿色抗菌剂[8];也可替代甲醇作为碳源,平均1.87~3.00 mg的MCFAs可去除1 mg的氮和磷[9];因其特殊的生物学功能,MCFAs在动物饲料行业中常作为添加剂出售[9];此外,MCFAs还可被甘油酯化为中链甘油三酯,具有良好的氧化稳定性,可进一步用于化工生产中[10]。不同类型MCFAs的功能总结如表1所示[11-12]。因此,作为生物基化学品中的新星,MCFAs具有突出的实用性、经济性和环保性,极具推广利用价值。基于廉价废弃生物质为底物的MCFAs规模化生产也能在一定程度上推动以MCFAs为基础原料的化工产业实现绿色可持续发展之路。
-
截至目前,研究者已分离几种能进行CE反应的纯菌株,主要包括Clostridium kluyveri、Megasphaera elsdenii、Clostridium sp. BS-1、Ruminococcaceae bacterium CPB6、Eubacterium limosum、Eubacterium pyruvativoran等几种。纯菌培养下的CE反应要求严格的灭菌环境和底物,这大大限制了可利用的底物类型并复杂化了操作流程。混菌培养的CE方式则能够在非灭菌环境与底物以及适当外界扰动下保持稳定运行[13],因而其更适宜于以复杂废弃生物质为底物的MCFAs生产。本文重点梳理CE混合功能菌群。
STEINBUSCH等[14]首次证实,混合菌群可以利用乙醇和乙酸合成MCFAs。混合菌可以来自污泥、沉积物、自然废弃物以及其他有机物[13, 15-17],但为了达到较理想的MCFAs生产性能,这些混合菌必须经过有目的的驯化过程,以使其适应底物和环境,并富集所需的CE功能微生物。AGLER等[18]将此过程定义为塑造微生物群,主要方法包括改变底物成分、调整运行条件和在运行过程中施加扰动。利用自然界提取的混合菌群进行一段时间的微生物群塑造 (控制pH为5、温度为30 ℃、乙醇为底物和实时提取产物) 后,此混合菌群利用复杂啤酒废液 (包含乙醇、微生物残留物和酵母细胞等) 生产MCFAs时获得的产率甚至可以与纯培养的CE功能细菌C. kluyveri 及工程菌种 Escherichia coli 相比[13]。经塑造后的菌群中,超过50%微生物属于CE功能菌Clostridium spp.,其他物种则与水解反应和乙醇氧化有关[13]。CE菌群结构也主要依赖于底物组成,当利用甘油作为底物,以厌氧消化污泥作为初始接种菌时,几乎没有C. kluyveri,而Clostridium butyricum和Escherichia coli被大量富集,并在生产中发挥了主要作用[19]。以含乳酸废弃物为底物时,一般较常见的微生物是M. elsdenii,也有一些研究者发现Veillonellaceae, Bacteroides spp.和Comamonas spp.是潜在的CE反应功能微生物[20]。值得注意的是,相比于CE微生物可以直接利用的纯底物,当使用实际废弃生物质为底物时,微生物群落结构会更复杂。例如,以酒厂废水为底物时,Bacteroides spp.、Oscillospira spp.和Clostridium spp.在MCFAs生产过程中扮演着重要的角色[17]。以黄水为底物,以窖泥为接种菌反应90 d后,菌群中以Clostridium IV为主 (占79.07%) ,其在原始窖泥中只占12.71%[21]。据宏基因分析报告,由于窖泥中包含大量具有CE功能的微生物,因而窖泥是生产MCFAs的一种优质的微生物来源,将其进行驯化培养后能取得比其他菌源显著更佳的MCFAs生产性能[22]。
值得注意的是,菌群重塑后,环境变化也会再次改变微生物群落结构,这并不利于保持MCFAs生产的稳定性与效能。因此,防止菌群向不利方向演变,同时保持长期生产的稳定性仍然是一个很大的挑战,其中反应器类型、运行参数、底物条件、产物浓度、新引入的微生物源都是影响菌群变化的主要因素。有文献报道,在接种相同的菌源 (Clostridium spp. > 50%) 时,当底物由乙醇和乙酸改为乳酸和丁酸后,菌群的主要微生物变为Rhodocyclaceae K82 spp. (63.3%) (30 d后) 和Acinetobacter spp. (62.9%) (140 d后) [23];当将底物中乙醇和乙酸比例提高到15后,微生物群落从以Acinetobacter spp.为主 (55.5%,130~145 d) 变为以Rhodocyclaceae K82 spp.为主 (70.8%,160~170 d) [20];当使用酒糟作为底物并加快提取装置的回流速率时,Bacteroides spp.变为主要微生物[17];而当以酸乳清作底物时,Bacteroidales spp. (21.7%) 和Clostridiales spp. (12.6%) 成为最主要的微生物[24]。可见,为实现MCFAs的稳定和高效生产,需要引导菌群向有益的结构和功能演变。为此,未来的研究还需要更深入地理解CE性能、运行条件、底物类型和微生物群落演变之间的关系,以定向地指导功能菌群构筑。
-
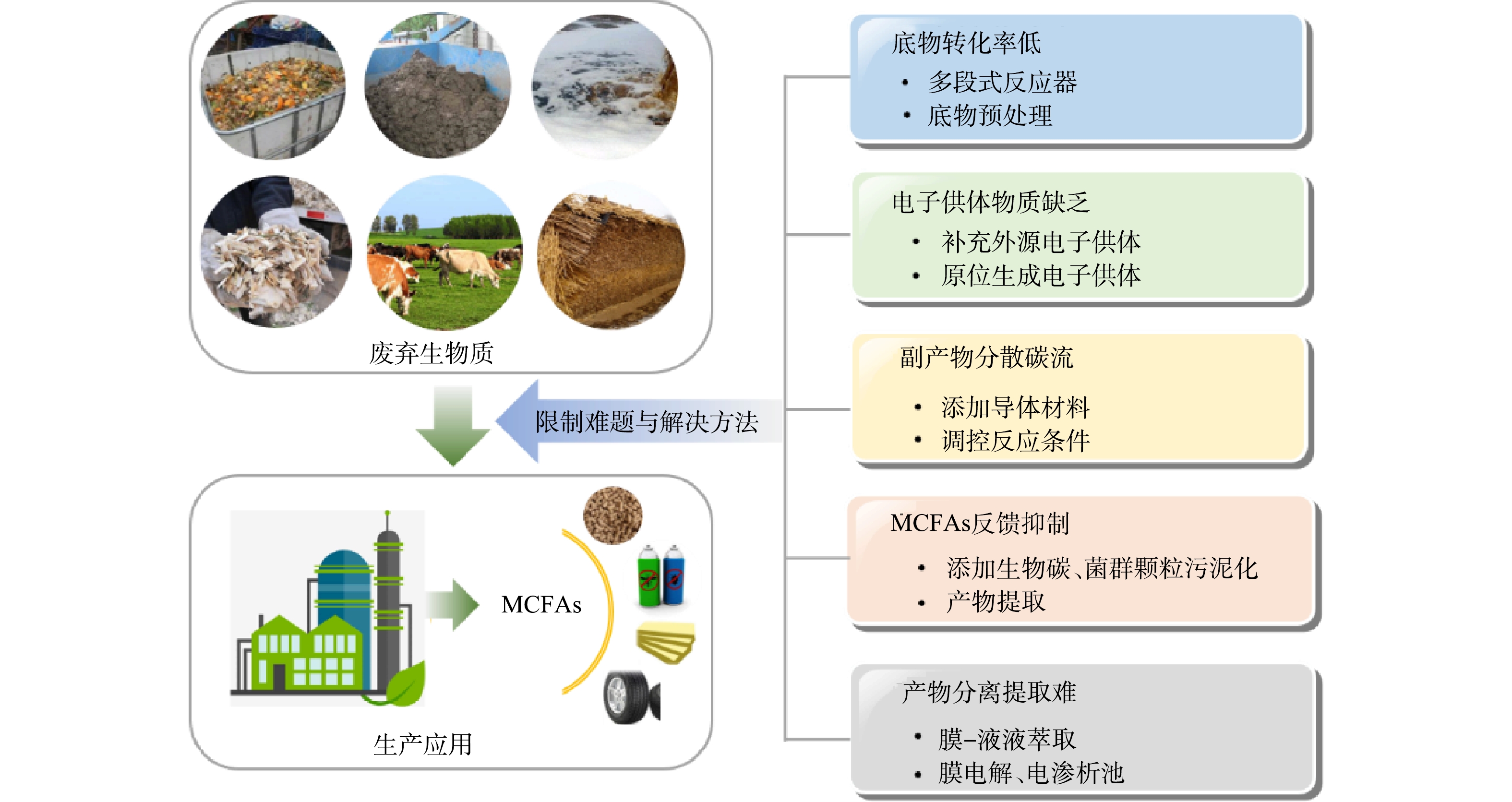
废弃生物质生产MCFAs得以应用的关键挑战在于MCFAs浓度和产率低,这使得下游产品纯度低、回收难,极大地限制了MCFAs的市场价值与应用范围。其主要原因在于底物转化率低、电子供体物质缺乏、副产物分散碳流、MCFAs反馈抑制以及MCFAs产物的分离提取难 (图3) 。
-
为了实现经济环保的MCFAs生产,研究人员偏向于使用富含有机物的废弃生物质而非纯化学物质作为原料。然而,废弃生物质中的大分子有机物需要经过溶解、水解、酸化和碳链延长等多步骤转化才能形成MCFAs,这使得底物的整体转化效率比纯底物要低得多。据报道,当80 g·L−1 (以COD计) 的餐厨垃圾和12.8 g·L−1 (以COD计) 的乙醇作为混合底物时,最终MCFAs产量仅为约11.49 g·L−1 (以COD计) ,COD转化率约为12.38%,这意味着大部分有机物都未被充分利用[25]。利用酸乳清作为底物时,COD转化效率为25%[26]。利用剩余污泥和乙醇转化合成MCFAs时,总COD转化效率约为21.43%[27]。由此可见,以实际废弃生物质生产MCFAs的有机物转化效率大多低于50%。当使用难降解生物质作为底物时,转化效率会更低。例如,WEIMER等[28]利用黑麦草和乙醇作为原料,最终的碳回收量约等于添加的乙醇碳量,表明黑麦草在整个反应过程中基本未被有效利用。
对于复杂的废弃生物质,其水解程度决定了后续反应的效率,然而外部添加的乙醇和生成的MCFAs在一定程度上抑制了水解速率[25]。因此,可以通过两段式反应器将水解和酸化过程分离。GROOTSCHOLTEN等[29]报道,通过运行两段式反应器促进餐厨垃圾水解/酸化,可将MCFAs产量提高到31.81 g·L−1 (以COD计) ,这比他们运行的一段式反应器获得的MCFAs产量提高了一倍以上[25]。此外,当以酸乳清废物为底物时,两段式反应器获得了高达53.5%的COD转化率[24],而一段式反应器获得的底物COD转化率仅为25%[26]。为了促进剩余污泥中有机物利用,WU等[30]首先将剩余污泥转化为SCFAs,然后将其与乙醇一起加入碳链延长反应器进行MCFAs生产,显著提高了总COD转化率,达到约41.67%。显然,两段式反应器有利于提高废弃生物质的利用效率。但值得注意的是,对于一些难生物降解的底物,例如纤维素和木质纤维素类生物质,在进入反应器前可能还需要额外地施加预处理以促进难降解物质的分解。
-
电子供体是开启CE反应的必要物质,合适的电子供体质量浓度以及电子供体/电子受体比例对于保证高效的底物利用与MCFAs产率至关重要,这是因为电子供体物质氧化后可为后续的逆β氧化途径提供能量、还原当量和必要中间产物乙酰辅酶A,而这些是MCFAs合成的必要条件[6]。然而,在利用废弃生物质生产MCFAs时通常存在电子供体不足的问题,这直接导致CE过程停滞或中断。比如,当以酒糟为底物时,由于乙醇不足,酒糟中只有约30%的COD可以被转化为SCFAs和MCFAs [31]。互营氧化菌-甲烷菌造成的乙醇过度氧化作用也会造成CE过程中的可用电子供体缺乏,进而影响MCFAs合成[32]。针对此问题,补充外源电子供体物质是其中一个有效的解决方法。据报道,通过添加啤酒 (乙醇) 补充电子供体,MCFAs百分比增加到54%,庚酸产量大大增加到17.7 g·L−1 (以COD计) [33]。相比之下,使用富含乙醇的酵母发酵啤酒作为原料,获得了高达7.5 g·L−1·d−1 (以COD计) 的庚酸产率,COD转化率为70.3%[34]。同样地,利用富含乙醇的酒糟为底物时也取得了7 g·L−1·d−1 (以COD计) 的MCFAs产率和67%的COD转化率,并且辛酸比例达到了30%[17]。此外,利用含有高比例乙醇/乙酸的合成气发酵液为底物时,获得了目前最高的辛酸产率和转化率,分别为19.4 g·L−1·d−1 (以COD计) 和96%[20]。
补充外源电子供体可以提高MCFAs产量,但其也存在高物耗高成本的问题。因此,针对富含碳水化合物的废弃生物质,可以通过将它们原位转化为乳酸来作为合成MCFAs的电子供体。通过这种方法,NZETEU等[35]使用餐厨垃圾作为唯一底物获得了23 g·L−1 (以COD计) 的辛酸产量。XU等[24]和DUBER等[16]在无外源电子供体添加下,利用酸乳清分别获得50%和58%~83%的MCFAs产率。因此,底物中电子供体的含量是影响MCFAs的生产和组成的关键因素,未来需要开展更多的研究以明确最佳电子供体含量值,以指导发酵条件和控制发酵进程。
-
MCFAs的微生物合成过程通常也会伴随着SCFAs和醇类的生成,它们无疑会分散底物碳流,从而降低MCFAs的产量。其中,SCFAs主要来自于某些特定功能菌在进行碳链延伸时电子受体物质的不完全碳链延长。比如,C. kluyveri 在利用底物乙醇和乙酸时,获得的主要产物通常是丁酸而非己酸[36]。ZHANG等[37]证实,混合菌群可以转化H2和CO2生产MCFAs,而观察到的MCFAs质量浓度 (1.4 g·L−1) 显著低于SCFAs的质量浓度 (9.2 g·L−1) 。在以乙醇和丙酸为底物生产庚酸的实验中,获得的庚酸选择性 (23%) 和质量浓度 (3.2 g·L−1) 均低于戊酸 (28%和4.2 g·L−1) [38]。同样地,在以合成气发酵液为底物时也获得了较低的己酸产量 (1.7 g·L−1·d−1) 和显著更高的丁酸产量 (20 g·L−1·d−1) [39]。在接种瘤胃菌的混菌体系中,丁酸和戊酸的总质量浓度与己酸质量浓度相似 (4.9~6.1 g·L−1) [28]。此外,以剩余污泥和乙醇为底物获得的丁酸产量达到了10.3 g·L−1 (以COD计) ,超过了己酸产量的3倍[40]。醇类是另一种常见的副产物,其主要是SCFAs和MCFAs的还原产物。将氢分压提高至0.6 atm时,在碳链延长反应器中观察到0.4 g·L−1丁醇[41]。此外,在利用剩余污泥发酵液和乙醇生产MCFAs时也检测到丁醇和己醇,其总质量浓度甚至约占MCFAs质量浓度的1/2[40]。
为减少副产物分散碳流对于MCFAs合成的不利影响,近年来有研究者尝试将可介导直接种间电子传递 (DIET) 的导电材料用于促进SCFAs和醇类转化[42-43]。LIU等[44]首次在CE反应器中添加生物碳,发现其将反应滞后期缩短了2.3倍,并使废水转化己酸的产量提高了46%。在最佳的生物碳粒径 (<5 μm) 下,丁酸的质量浓度仅为0.3 g·L−1,实现了93.6%的高己酸选择性,然而未添加生物碳的对照组的丁酸质量浓度达到6.4 g·L−1,同时己酸选择性仅为24.6%,表明生物碳有效地促进了丁酸向己酸的进一步转化[45]。GHYSELS等[46]比较了生物碳和活性炭对C. kluyveri纯培养体系中己酸产量的影响,结果表明,10 g·L−1生物碳实验组获得的己酸产率和产量分别为12 g·L−1·d−1和10.1 g·L−1,同时活性炭也发挥了与生物碳类似的作用,但其需要比生物碳更高的用量。FU等[47]发现,添加了2 g·L−1导电材料纳米零价铁后获得了3.25 g·L−1己酸产量,比对照组高16.7%,认为这主要可归因于纳米零价铁对乙醇利用和丁酸延长的促进作用。WANG等[40]向反应器中添加20 g·L−1的导电材料零价铁 (200目) 以促进剩余污泥生产MCFAs,结果表明与未添加零价铁的反应器相比,添加零价铁后使得SCFAs和丁醇的质量浓度分别下降了约300%和54%,同时MCFAs的质量浓度增加了5倍以上 (从2.9 g·L−1增加到15.4 g·L−1 (以COD计) ) 。此外,检测发现导电性和电子转移效率都得到了大幅提高,猜测零价铁可能充当电子穿梭体促进了DIET的发生,然而到目前为止还没有直接证据来证实CE反应存在DIET过程。
-
未解离态的MCFAs自身带有毒性,当其达到毒性阈值时会对碳链延长菌产生反馈抑制行为,从而可中断MCFAs的合成[33]。有研究者发现,未解离态的己酸最低质量浓度为4.6 g·L−1时就完全抑制了大肠杆菌,而癸酸的抑制浓度降低到了3.4 g·L−1,说明MCFAs的毒性随着碳链长度的增加而加剧。在混菌培养中,MCFAs对菌群的抑制毒性阈值可能更低,仅0.4 g·L−1己酸就可使微生物活性降低,并抑制丁酸向己酸的转化[39]。据报道,添加生物碳可有效缓解此毒性抑制效应[44, 45]。大多数微生物会吸附在生物碳的粗糙表面或孔隙中,生物碳周围较高的pH值会降低微生物周围未解离态MCFAs的浓度,进而减轻抑制行为。同样地,将微生物聚集成颗粒污泥也有助于微生物抵御毒性物质,这也是因为颗粒污泥具有松散和多孔的结构[30, 48-49]。此外,pH可以影响MCFAs的电离平衡,从而影响未解离MCFAs在发酵液中的浓度。有报道表明,在pH为5.5时,未解离的正己酸质量浓度超过0.8 g·L−1,就会显著抑制微生物细胞的活性[23],适当调高pH值以降低未解离MCFAs浓度也是缓解毒性效应的潜在方法[14, 50]。上述缓解产物毒性反馈抑制的方法均是将未解离MCFAs的浓度限制在碳链延长菌的耐受范围以内,然而低的MCFAs浓度会使得下游处理和产品回收困难,因此,消除产物毒性抑制的根本方法是实时地提取出MCFAs[34]。
-
从发酵液中分离和提取MCFAs是实现其产业化生产应用的基本要求[51]。在生物炼制厂中,产物的下游分离-提取通常占总生产成本的40%~50%,因此,分离提取环节的技术改进非常重要[52]。理想的分离-提取技术应该具有设备简单、运营成本低和工作效率高等特点[53]。提取策略可分为下游提取和原位提取2种。考虑到未解离MCFAs对微生物的毒性行为,尤其是在生产较长碳链的MCFAs (C8~C10) 时,原位提取是首选的提取策略[54]。
XIONG等[55]研究了基于纳滤的厌氧膜生物反应器在生产和提取MCFAs方面的能力,发现低pH和低压有利于排斥小分子酸,但其对MCFAs的选择性相对较低。相比之下,基于特定萃取溶剂 (如阿拉明336,三正辛基磷氧化物) 的液-液萃取法对MCFAs具有更高的选择度。目前基于液-液萃取的原位两相提取发酵反应器已被设计用于实现MCFA的生产和原位提取,其可提取出大于90%的己酸[56]。AGLER等[13]开发了一种基于中空纤维膜的液-液萃取装置,其具有隔离提取溶剂与微生物和发酵液的优点,在运行中获得了83%~85%的MCFAs提取效率,并在确保高MCFA生产速率为7.5 g·L−1·d−1) 的情况下,实现了反应器的长期 (550 d) 运行,从酵母发酵啤酒中得到了良好的MCFAs生产效果[34]。借助此原位的产物提取方法,以合成气发酵液为底物时也获得了当前最高的己酸产率 (19.4 g·L−1·d−1) [20]。需要注意的是,碱性萃取溶液中提取出的MCFAs是以盐的形态存在,为了获得分子油状MCFAs,XU等[9]在液-液膜萃取器后偶联了膜电解装置,利用两电解池之间的pH梯度实现了MCFAs盐向油状液体 (> 90%纯度) 的有效分离,且无需添加盐酸等pH调节剂。在此基础上,CARVAJAL-ARROYO等[57]在放大的反应器中比较了2种在线萃取系统的MCFAs萃取性能,即膜萃取耦合2室膜电解和直接用3室膜电解,研究发现前者在收获MCFAs油产品方面表现更好 (萃取效率73%) ,且功耗 (6.2 kWh·kg−1油) 比3室膜电解 (160 kWh·kg−1油) 显著更低。此外,XU等[54]还开发了5室电渗析/相分离电解池,其获得最大的MCFAs油通量为1.7 kg·d−1·m−2,功耗约为膜电解池的1/10。然而,在提取低浓度MCFAs时,电渗析/相分离电解池的功耗会大大增加,同时电渗析池内形成的盐会导致提取系统的清洁和维护成本/时间增加,因此,未来还需要更多的研究以攻克产物分离提取中的难题。
-
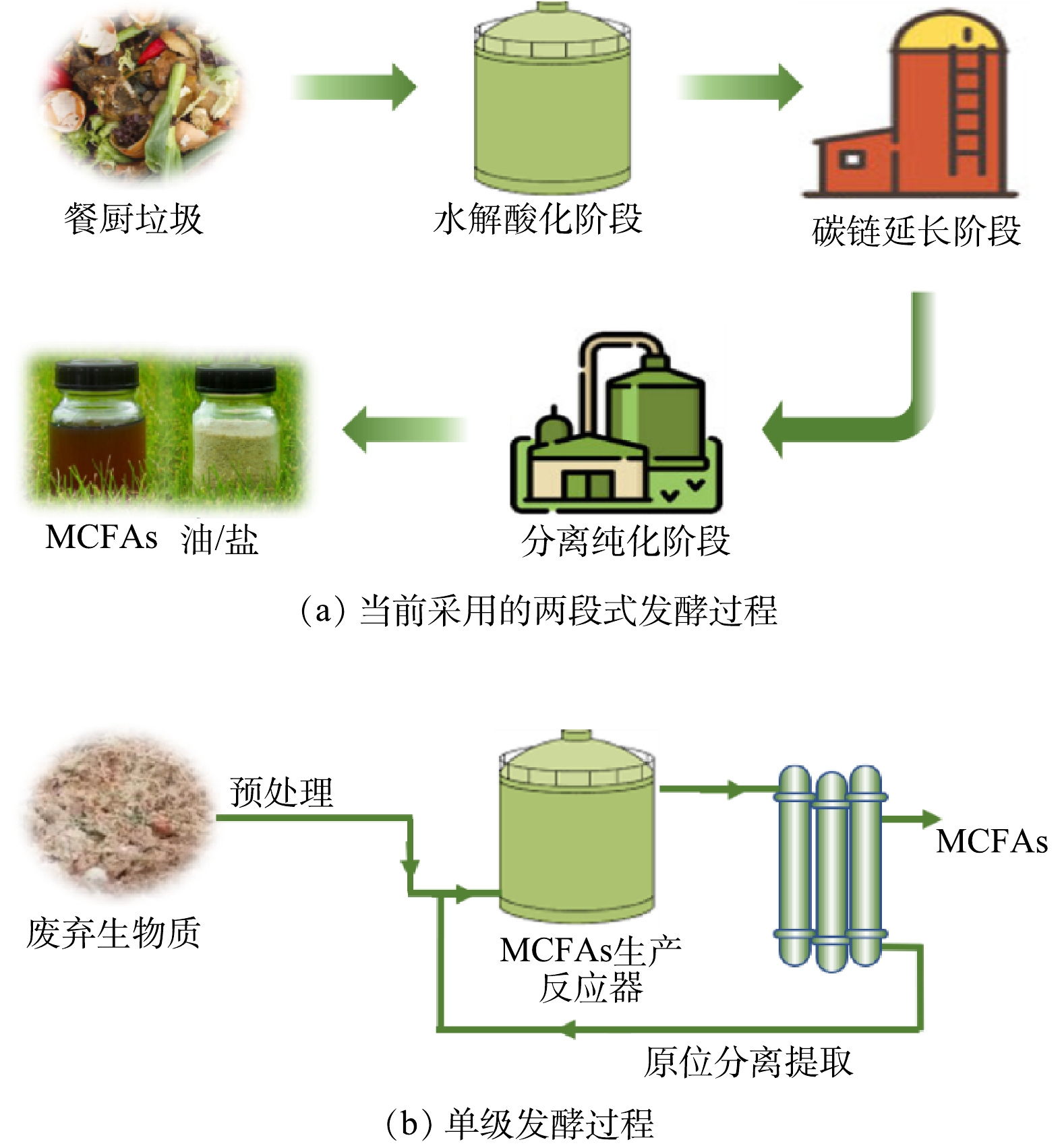
荷兰一家名为ChainCraft的工厂已经证明了从食品废物中通过“酸化发酵+碳链延长”的两级反应器提取MCFAs的商业可行性。该工厂还配备了下游分离和纯化设备,以获得纯净的MCFAs粉末和液态2种产品形式,并最终加工成动物饲料,生产流程见图4 (a) 。然而,其在生产过程中需要在碳链延长阶段添加乙醇作为电子供体,这大大增加了生产成本。对于此类富含碳水化合物的底物,原位合成乳酸+碳链延长可能是更为经济环保的MCFAs替代生产策略,其可以免除添加外源性电子供体步骤。此外,德国达姆施塔特的一个堆肥厂实现了使用混合有机废弃物生产SCFAs和MCFAs[58]。生产流程分为4个阶段:首先通过兼性厌氧处理获得富含脂肪酸的液体;然后通过厌氧发酵进一步降解有机物以提高脂肪酸含量;进一步添加乙醇发生碳链延长过程获得MCFAs;最后使用生物柴油作为提取剂提取出脂肪酸[58]。然而,上述应用实例中的有机废物组成的不稳定性也对脂肪酸产量和组成产生了影响,此外脂肪酸的提取效率取决于其碳链长和极性,其中只有非极性脂肪酸可被提取,因此整个资源回收工艺仍需改进。
综上所述,以废弃生物质生产MCFAs通常是基于多段式发酵,这要求相对较高的建设成本、占地面积和复杂的操作过程[29]。未来的生产模式也可能考虑使用更集成的酸化发酵与碳链延长耦合单级过程 (图4 (b) ) ,正如被广泛应用的单级厌氧消化反应器。与厌氧消化类似,对于难降解的废弃生物质,在投入反应器之前也需要进行底物预处理以提高整体转化率。此外,考虑到MCFAs积累对微生物的抑制影响,原位分离提取MCFAs对于确保高的微生物活性非常重要,这也被证明是高癸酸产量的必要条件[20]。基于硅橡胶膜萃取[13]和电渗析[54]的MCFAs提取方法可以获得较高纯度MCFA,有望在未来得到应用。
-
基于混菌发酵的CE技术为废弃生物质减量和MCFAs生产提供了一个重要平台。然而,当前较低的MCFAs浓度、产率与选择性增加了MCFAs产品提取和下游利用的难度,因此当前亟需提高MCFAs生产性能以增强其市场竞争力,推动其规模化应用。为突破MCFAs生产瓶颈,提出以下几点建议。
1) 构建高效产酸发酵体系。高效的功能菌群构建、菌群定向驯化、功能优化是提高MCFAs产量的关键,可借助先进的生物信息手段解析代谢途径、功能基因等,以精准优化系统性能。
2) 促进碳素定向转化。碳流分散消耗是限制MCFAs产量的直接原因,可通过抑制竞争反应、调控氧化还原力、微生物电化学、化学催化等手段优化碳素转化途径。
3) 目标产物可控合成策略。混菌发酵制备MCFAs常以短碳链和混酸为主,目标酸纯度低、长链酸合成难,限制了产品的应用和经济价值,可通过代谢调控、功能重构和性能优化等方法,如发挥导电介体、电磁场刺激、强化界面作用等化学手段优势,支撑生化过程的产物可控合成。
4) 产物分离提取技术与装备。亟需开发实时-原位MCFAs分离提取设备以攻克MCFAs反馈抑制瓶颈,可尝试将先进膜分离、电渗析、电泳分离等技术与生产反应器有效耦合,构建生产分离提取一体化的工艺装备。未来可通过生物化学材料等多手段多方法集成,突破底物转化与产物回收瓶颈,以实现MCFAs的高效生产与应用。
微生物碳链延长技术转化废弃生物质合成中链脂肪酸
Medium chain fatty acids biosynthesis from waste biomass by microbial chain elongation technology
-
摘要: “碳中和”目标下,废弃生物质制备可再生化学品成为落实碳中和、减污降碳等国家重大战略需求的重要技术之一。其中,微生物碳链延长技术生产中链脂肪酸 (MCFAs) 是高值化回收废弃碳源的一个重要方向。MCFAs作为生物基化学品新星,兼具经济、环保与实用性优势,可部分地替代化石原料合成环保型燃料与化学品,降低传统化石资源依赖与碳排放,助力经济社会发展绿色转型。为此,系统梳理了碳链延长技术的反应机理、功能菌群,以及MCFAs生产应用存在的关键瓶颈和研究进展,以期为相关领域研究者开展创新研究、突破技术瓶颈提供参考。Abstract: Under the goal of "carbon neutral", the preparation of renewable chemicals from waste biomass has become an important technology to implement major national strategies such as carbon neutrality, pollution reduction and carbon reduction. Among them, the production of medium-chain fatty acids (MCFAs) by microbial chain elongation (CE) technology is an important direction for high-value recovery of waste carbon sources. As a new star of bio-based chemicals, MCFAs have economic, environmental and practical advantages, which can partially replace fossil raw materials to synthesize environmentally friendly fuels and chemicals, reduce traditional fossil resource dependence and carbon emissions, and promote green transformation of economic and social development. This review aimed to introduce the mechanism and functional microbial communities of CE technology, as well as the key bottlenecks and research progress in the production and application of MCFAs, in order to inspire researchers to carry out innovative research and breakthrough technological bottlenecks.
-
Key words:
- medium chain fatty acids /
- chain elongation /
- waste biomass /
- microorganism /
- electron donor
-

-
-
[1] 何品晶. 农村生活垃圾处理的目标、原则和评价方法浅议[J]. 环境卫生工程, 2018, 26: 52-55. [2] 王薪淯, 朱晓宇, 李海翔, 等. 乳酸碳链延长技术及其在有机废弃物资源化中的应用研究进展[J]. 应用与环境生物学报, 2020, 26(4): 827-835. [3] SEEDORF H, FRICKE W F, VEITH B, et al. The genome of Clostridium kluyveri, a strict anaerobe with unique metabolic features[J]. Proceedings of the National Academy of Sciences of the United States of America, 2008, 105: 2128-2133. doi: 10.1073/pnas.0711093105 [4] PRABHU R, ALTMAN E, EITEMAN M A. Lactate and acrylate metabolism by Megasphaera elsdenii under batch and steady-state conditions[J]. Applied and Environmental Microbiology, 2012, 78: 8564-8570. doi: 10.1128/AEM.02443-12 [5] SPIRITO C M, RICHTER H, RABAEY K, et al. Chain elongation in anaerobic reactor microbiomes to recover resources from waste[J]. Current Opinion in Biotechnology, 2014, 27: 115-122. doi: 10.1016/j.copbio.2014.01.003 [6] WU Q, BAO X, GUO W, et al. Medium chain carboxylic acids production from waste biomass: Current advances and perspectives[J]. Biotechnology Advances, 2019, 37: 599-615. doi: 10.1016/j.biotechadv.2019.03.003 [7] HARVEY B G, MEYLEMANS H A. 1-Hexene: a renewable C6 platform for full-performance jet and diesel fuels[J]. Green Chemistry, 2014, 16: 770-776. doi: 10.1039/C3GC41554F [8] DESBOIS A P. Potential applications of antimicrobial fatty acids in medicine, agriculture and other industries[J]. Recent Patents on Anti-infective Drug Discovery, 2012, 7: 111-122. doi: 10.2174/157489112801619728 [9] XU J, GUZMAN J J, ANDERSEN S J, et al. In-line and selective phase separation of medium-chain carboxylic acids using membrane electrolysis[J]. Chemical Communications (Cambridge, England), 2015, 51: 6847-6850. doi: 10.1039/C5CC01897H [10] 刘翠, 吴元, 朱丽可, 等. 中链脂肪酸的研究进展[J]. 广东化工, 2021, 48(438): 60-61. [11] JIANG Y, CHU N, QIAN D K, et al. Microbial electrochemical stimulation of caproate production from ethanol and carbon dioxide[J]. Bioresource Technology, 2020, 295: 122266. doi: 10.1016/j.biortech.2019.122266 [12] WU S L, SUN J, CHEN X, et al. Unveiling the mechanisms of medium-chain fatty acid production from waste activated sludge alkaline fermentation liquor through physiological, thermodynamic and metagenomic investigations[J]. Water Research, 2020, 169: 115218. doi: 10.1016/j.watres.2019.115218 [13] AGLER M T, SPIRITO C M, USACK J G, et al. Chain elongation with reactor microbiomes: upgrading dilute ethanol to medium-chain carboxylates[J]. Energy & Environmental Science, 2012, 5: 8189-8192. [14] STEINBUSCH K, HAMELERS H, Plugge C, et al. Biological formation of caproate and caprylate from acetate: fuel and chemical production from low grade biomass[J]. Energy & Environmental Science, 2011, 4: 216-224. [15] SCARBOROUGH M, LYNCH G, DICKSON M, et al. Increasing the economic value of lignocellulosic stillage through medium-chain fatty acid production[J]. Biotechnology for Biofuels, 2018, 11: 200. doi: 10.1186/s13068-018-1193-x [16] DUBER A, JAROSZYNSKI L, ZAGRODNIK R, et al. Exploiting the real wastewater potential for resource recovery – n-caproate production from acid whey[J]. Green Chemistry, 2018, 20: 3790-3803. doi: 10.1039/C8GC01759J [17] KUCEK L, XU J, NGUYEN M, et al. Waste conversion into n-caprylate and n-caproate: resource recovery from wine lees using anaerobic reactor microbiomes and in-line extraction[J]. Frontiers in Microbiology, 2016, 7: 1-14. [18] AGLER M, WERNER J, ITEN L, et al. Shaping reactor microbiomes to produce the fuel precursor n-butyrate from pretreated cellulosic hydrolysates[J]. Environmental Science & Technology, 2012, 46: 10229-10238. [19] LENG L, YANG P, MAO Y, et al. Thermodynamic and physiological study of caproate and 1, 3-propanediol co-production through glycerol fermentation and fatty acids chain elongation[J]. Water Research, 2017, 114: 200-209. doi: 10.1016/j.watres.2017.02.023 [20] KUCEK L, SPIRITO C, Angenent L. High n-caprylate productivities and specificities from dilute ethanol and acetate: chain elongation with microbiomes to upgrade products from syngas fermentation[J]. Energy & Environmental Science, 2016, 9: 3482-3494. [21] ZHU X, TAO Y, LIANG C, et al. The synthesis of n-caproate from lactate: a new efficient process for medium-chain carboxylates production[J]. Scientific Reports, 2015, 5: 14360-14368. doi: 10.1038/srep14360 [22] TAO Y, WANG X, LI X, et al. The functional potential and active populations of the pit mud microbiome for the production of Chinese strong-flavour liquor[J]. Microbial Biotechnology, 2017, 10: 1603-1615. doi: 10.1111/1751-7915.12729 [23] KUCEK L A, NGUYEN M, Angenent L T. Conversion of L-lactate into n-caproate by a continuously fed reactor microbiome[J]. Water Research, 2016, 93: 163-171. doi: 10.1016/j.watres.2016.02.018 [24] XU J, HAO J, GUZMAN J, et al. Temperature-Phased conversion of acid whey waste into medium-chain carboxylic acids via lactic acid: no external e-donor[J]. Joule, 2018, 2: 280-295. doi: 10.1016/j.joule.2017.11.008 [25] GROOTSCHOLTEN T, DALBORGO F, HAMELERS H, et al. Promoting chain elongation in mixed culture acidification reactors by addition of ethanol[J]. Biomass & Bioenergy, 2013, 48: 10-16. [26] DOMINGOS J, MARTINEZ G, SCOMA A, et al. Effect of operational parameters in the continuous anaerobic fermentation of cheese whey on titers, yields, productivities, and microbial community structures[J]. ACS Sustainable Chemistry & Engineering, 2016, 5: 1400-1407. [27] WU S L, LUO G, SUN J, et al. Medium chain fatty acids production from anaerobic fermentation of waste activated sludge[J]. Journal of Cleaner Production, 2021, 279: 123482. doi: 10.1016/j.jclepro.2020.123482 [28] WEIMER P J, NERDAHL M, BRANDL D J. Production of medium-chain volatile fatty acids by mixed ruminal microorganisms is enhanced by ethanol in co-culture with Clostridium kluyveri[J]. Bioresource Technology, 2015, 175: 97-101. doi: 10.1016/j.biortech.2014.10.054 [29] GROOTSCHOLTEN T, STRI D, STEINBUSCH K, et al. Two-stage medium chain fatty acid (MCFA) production from municipal solid waste and ethanol[J]. Applied Energy, 2014, 116: 223-229. doi: 10.1016/j.apenergy.2013.11.061 [30] WU Q, FENG X, CHEN Y, et al. Continuous medium chain carboxylic acids production from excess sludge by granular chain-elongation process[J]. Journal of Hazardous Materials, 2020, 402: 123471. [31] ANDERSEN S, CANDRY P, BASADRE T, et al. Electrolytic extraction drives volatile fatty acid chain elongation through lactic acid and replaces chemical pH control in thin stillage fermentation[J]. Biotechnology for Biofuels, 2015, 8: 221. doi: 10.1186/s13068-015-0396-7 [32] ROGHAIR M, HOOGSTAD T, STRIK D, et al. Controlling ethanol use in chain elongation by co2 loading rate[J]. Environmental Science & Technology, 2018, 52: 1496-1505. [33] ANDERSEN S, GROOF V, KHOR W, et al. A clostridium group iv species dominates and suppresses a mixed culture fermentation by tolerance to medium chain fatty acids products[J]. Frontiers in Bioengineering and Biotechnology, 2017, 5: 8. [34] GE S, USACK J, SPIRITO C, et al. Long-term n-caproic acid production from yeast-fermentation beer in an anaerobic bioreactor with continuous product extraction[J]. Environmental Science & Technology, 2015, 49: 8012-8021. [35] NZETEU C, TREGO A, ABRAM F, et al. Reproducible, high-yielding, biological caproate production from food waste using a single-phase anaerobic reactor system[J]. Biotechnology for Biofuels, 2018, 11: 108. doi: 10.1186/s13068-018-1101-4 [36] LONKAR S, FU Z, HOLTZAPPLE M. Optimum alcohol concentration for chain elongation in mixed-culture fermentation of cellulosic substrate[J]. Biotechnology and Bioengineering, 2016, 113: 2597-2604. doi: 10.1002/bit.26024 [37] ZHANG F, DING J, ZHANG Y, et al. Fatty acids production from hydrogen and carbon dioxide by mixed culture in the membrane biofilm reactor[J]. Water Research, 2013, 47: 6122-6129. doi: 10.1016/j.watres.2013.07.033 [38] GROOTSCHOLTEN T, STEINBUSCH K, HAMELERS H, et al. High rate heptanoate production from propionate and ethanol using chain elongation[J]. Bioresource Technology, 2013, 136: 715-718. doi: 10.1016/j.biortech.2013.02.085 [39] VASUDEVAN D, RICHTER H, ANGENENT L. Upgrading dilute ethanol from syngas fermentation to n-caproate with reactor microbiomes[J]. Bioresource Technology, 2014, 151: 378-382. doi: 10.1016/j.biortech.2013.09.105 [40] WANG Y, WEI W, WU S L, et al. Zerovalent iron effectively enhances medium-chain fatty acids production from waste activated sludge through improving sludge biodegradability and electron transfer efficiency[J]. Environmental Science & Technology, 2020, 54: 10904-10915. [41] ZAGRODNIK R, DUBER A, LEZYK M, et al. Enrichment versus bioaugmentation-microbiological production of caproate from mixed carbon sources by mixed bacterial culture and Clostridium kluyveri[J]. Environmental Science & Technology, 2020, 54: 5864-5873. [42] HUANG W, YANG F, HUANG W, et al. Weak magnetic field significantly enhances methane production from a digester supplemented with zero valent iron[J]. Bioresource Technology, 2019, 282: 202-210. doi: 10.1016/j.biortech.2019.03.013 [43] ZHAO Z. LI Y, YU Q, et al. Ferroferric oxide triggered possible direct interspecies electron transfer between Syntrophomonas and Methanosaeta to enhance waste activated sludge anaerobic digestion[J]. Bioresource Technology, 2018, 250: 79-85. doi: 10.1016/j.biortech.2017.11.003 [44] LIU Y, HE P, SHAO L, et al. Significant enhancement by biochar of caproate production via chain elongation[J]. Water Research, 2017, 119: 150-159. doi: 10.1016/j.watres.2017.04.050 [45] LIU Y, HE P, HAN W, et al. Outstanding reinforcement on chain elongation through five-micrometer-sized biochar[J]. Renewable Energy, 2020, 161: 230-239. doi: 10.1016/j.renene.2020.07.126 [46] GHYSELS S, BUFFEL S, RABAEY K, et al. Biochar and activated carbon enhance ethanol conversion and selectivity to caproic acid by Clostridium kluyveri[J]. Bioresource Technology, 2021, 319: 124236. doi: 10.1016/j.biortech.2020.124236 [47] FU X, YE R, JIN X, et al. Effect of nano zero-valent iron addition on caproate fermentation in carboxylate chain elongation system[J]. Science of the Total Environment, 2020, 743: 140664. doi: 10.1016/j.scitotenv.2020.140664 [48] ROGHAIR M, STRIK D, STEINBUSCH K, et al. Granular sludge formation and characterization in a chain elongation process[J]. Process Biochemistry, 2016, 51: 1594-1598. doi: 10.1016/j.procbio.2016.06.012 [49] WU Q, FENG X, GUO W, et al. Long-term medium chain carboxylic acids production from liquor-making wastewater: Parameters optimization and toxicity mitigation[J]. Chemical Engineering Journal, 2020, 388: 124218. doi: 10.1016/j.cej.2020.124218 [50] WASELEFSKY W. Studies on the substrate range of Clostridium kluyveri; the use of propanol and succinate[J]. Archives of Microbiology, 1985, 141: 187-194. doi: 10.1007/BF00408056 [51] CAVALCANTE W, LEITÃO R, GEHRING T, et al. Anaerobic fermentation for n-caproic acid production: A review[J]. Process Biochemistry, 2017, 54: 106-119. doi: 10.1016/j.procbio.2016.12.024 [52] RAMASWAMY. Separation and purification technologies in biorefineries[J]. Focus on Catalysts, 2013, 10: 8. [53] MENON A, LYNG J G. Circular bioeconomy solutions: driving anaerobic digestion of waste streams towards production of high value medium chain fatty acids[J]. Reviews in Environmental Science and Bio/Technology, 2021, 20: 189-208. doi: 10.1007/s11157-020-09559-5 [54] XU J, GUZMAN J, ANGENENT L. Direct medium-chain carboxylic acid oil separation from a bioreactor by an electrodialysis/phase separation cell[J]. Environmental Science & Technology, 2021, 55: 634-644. [55] XIONG B, RICHARD T, KUMAR M. Integrated acidogenic digestion and carboxylic acid separation by nanofiltration membranes for the lignocellulosic carboxylate platform[J]. Journal of Membrane Science, 2015, 489: 275-283. doi: 10.1016/j.memsci.2015.04.022 [56] CHOI K, JEON B, KIM B, et al. In situ biphasic extractive fermentation for hexanoic acid production from sucrose by Megasphaera elsdenii NCIMB 702410[J]. Applied Biochemistry and Biotechnology, 2013, 171: 1094-1107. doi: 10.1007/s12010-013-0310-3 [57] CARVAJAL-ARROYO J, ANDERSEN S, GANIGUÉ R, et al. Production and extraction of medium chain carboxylic acids at a semi-pilot scale[J]. Chemical Engineering Journal, 2021, 416: 127886. doi: 10.1016/j.cej.2020.127886 [58] KANNENGIESSER J, SAKAGUCHI-SODER K, MRUKWIA T, et al. Extraction of medium chain fatty acids from organic municipal waste and subsequent production of bio-based fuels[J]. Waste Management, 2016, 47: 78-83. doi: 10.1016/j.wasman.2015.05.030 -



 下载:
下载: