-
我国目前农村污水处理基本沿用城市污水处理厂的集中式活性污泥处理方法,然而农村污水存在水量波动大、分布较为分散、维护水平不足等问题,相比城市污水处理率不佳。2021年,全国农村生活污水进行处理的乡村仅占36.94%,远低于城市污水处理率97.89[1]。农村污水处理通常沿用城市污水处理的活性污泥法,活性污泥法虽然能够有效去除污水中的有机物和氮磷,但适合污水合流集中处理模式,然而,大部分农村的管网覆盖率不高,合流集中处理难度大。农村污水COD、TN、TP、氨氮平均值分别为205、62.5、5.5、50 mg·L−1[2],只含有有机物、氮、磷等物质,有毒成分和重金属含量低,可生化性好。而微藻适用于可生化性好的污水净化,利用小球藻和球形红杆菌处理富氮养猪场废水和富碳淀粉废水,TP、COD和TN的回收率分别可达到100%、96%、97%和95%[3]。在利用斜生栅藻处理不同处理阶段城市污水,处沉池污水的TN和TP去除率分别为99.8%和83.1%,二沉池污水的TN和TP去除率分别为98.9%和97.6%[4]。从当地奶业收集的乳品废水作为生长介质(未经任何预处理),用于培养微藻4 d后,COD去除率达到90%以上;培养6 d后氨氮完全消耗[5]。微藻可以利用小型光生物反应器分散式处理可生化性好的农村污水,与活性污泥法相比,无需铺设管网对污水收集集中处理,在适宜的工艺条件下,污水中氮磷的去除率可达90%以上[6]。并且微藻处理污水无需要额外添加碳源用于硝化/反硝化、只需少量曝气、剩余微藻生物质价值高,适合在温度适宜的南方地区处理污水。在微藻处理污水的过程中,通常会有部分有机物难以被微藻高效吸收转化[7]、生物质油脂含量低和藻水分离困难的问题,藻水分离的方法包括絮凝(化学、生物、电)、重力沉降、过滤、浮选、离心等方法,但是这些方法普遍分离成本高或者周期长,限制了微藻处理污水的应用[8]。有研究表明,利用微藻与细菌联合可以大幅提高处理各种污水能力,同时可促进微藻油脂的合成。微藻与细菌之间存在互利共生关系,两者之间的相互作用主要有营养交换、信号传导等[9]。营养交换是藻菌相互作用最基本的关系,微藻通过光合作用产生的O2、释放出有机物可以通过异养细菌的呼吸作用吸收利用。同时细菌呼吸作用产生的CO2又会被微藻光合作用吸收合成生物质。藻菌之间O2、CO2交换可以降低污水处理的曝气需求,减少污水处理造成的CO2排放。共生菌群可以为微藻提供维生素、植物激素、铁载体等。微藻在优化条件下可积累高达50%干生物质占比的油脂,被认为是极具前景的可再生第三代生物能源来源[10]。而且污水中的有机碳为微藻提供了混合营养的环境,混合营养环境相比于普通培养基(BG11)可观察到更高的生物量和脂质生产力[11]。因此,利用微藻处理污水的同时还具有碳减排、生物柴油生产等多重效果[12]。
近年来,微藻生物膜系统受到广泛的重视,因为微藻生物膜生物密度高,可通过机械刮取、挤压等方法收取微藻[13],减少了微藻处理污水后回收生物质的成本。微藻生物膜的形成来源微藻的贴壁生长的特性,当微藻吸附固体基质上时,与其他共生菌群分泌EPS形成稳定的藻菌生物膜,生物膜状态下的比悬浮系统具有更好的光照可用性[14]。微藻生物膜附着基质要求较高,必须考虑到微藻附着效率和形成生物膜后的稳定性,但同时生物膜载体在污水中也会降低反应器透光度的问题。
微藻通过叶绿素a和叶绿素b光合色素吸收光能,具有蓝光(450~480 nm)和红光(605~700 nm)双重吸收波长[15]。特定的红光和蓝光照射微藻可以提高细胞生长速度和脂质生产力[16],有助于提升微藻的光合作用效率。有报道在悬浮微藻体系中加入碳量子点,光合活性显著提高并且微藻的脂质产率提高了34%[17]。但是在悬浮体系中加入碳量子点,碳量子点难以回收,同时新物质引入的可能会给水环境带来潜在的风险。而藻菌共生容易沉淀,沉淀在底部的微藻细胞难以接受到光照,导致光合作用效率低。碳量子点与壳聚糖结合改性的纤维可能有助于改善光照可用性差和藻菌共生易沉淀的问题。微藻在载体表面附着和载体表面性质有关,微藻会在静电力、范德华力等作用下[13],吸附在表面粗糙的载体材料上。由于微藻细胞带负电荷,表面带正电的材料更易于吸附微藻附着,带正电的多孔性材料有效吸附带负电的小球藻快速集和接种,促进了微藻生物膜的形成。脱乙酰基后的壳聚糖含有大量的-NH2基团,带有丰富的正电荷,适合作为生物膜附着载体的改性剂。碳量子点(CQDs)是一种新型的荧光材料,具有光致发光、化学惰性、高生物相容性等优越性能[18],可以通过调节光谱特性和发光强度,实现定向转移未利用光到蓝光和红光。
根据目前微藻系统存在的光利用程度差、附着效率低、生物质油脂含量低的问题。本文设计制备了碳量子点-壳聚糖(CS)交联改性的聚乙烯醇缩甲醛(PVF)纤维作为生物膜附着载体,以该载体为填料构建藻菌生物膜系统,研究该系统净水分散污水协同油脂转化的效能,并解析藻菌生物膜机制。为构建稳定高效的微藻资源化处理[12]污水系统提供理论依据。
-
水热法合成碳量子点。将1.0 g柠檬酸和0.5 g尿素完全溶解在25 mL超纯水中,并将混合溶液转移至水热反应釜中(50 mL聚四氟乙烯内衬)中在160 °C下加热6 h。待自然冷却至室温后取出,将合成的碳量子点溶液经0.22 μm醋酸纤维滤膜过滤。最后,将过滤后的碳量子点溶液在70 °C下干燥4 h,得到的棕色粉末状碳量子点。
制备改性溶液。将0.5 g的壳聚糖(CS)溶解在100 mL 2%(w/v)的乙酸溶液中,不断搅拌直至壳聚糖完全溶解;将50 mg CQDs加入搅拌中的壳聚糖溶液中,磁力搅拌器持续搅拌1 h,得到CQDs/CS溶液。
CS@PVF与CQDs/CS@PVF纤维制备。将纤维浸泡在含有2%戊二醛的CS溶液和CQDs/CS溶液中,静置1 h使PVF与涂层充分交联。取出交联后的纤维置于60 ℃干燥箱中干燥,分别制得CS@PVF与CQDs/CS@PVF 2种纤维附着载体。
-
通过傅里叶红外光谱仪(Bruker Vertex 70,德国)对载体进行红外光谱测试,搭配衰减全反射(attenuated total reflection,ATR)附件使用,通过傅里叶红外光谱进行官能团测定,实验仪器参数设定为:波数为400~4 000 cm−1,分辨率为16 cm−1,扫描次数为32次。光致发光(PL)光谱通过荧光分光光度计(日立 荧光分光光度计F7000,日本)测定。
-
实验所用藻种斜生栅藻(Scenedesmus obliquus)购置于中国科学院淡水藻种库。将藻种置于光照培养箱内(温度为25 ℃,光照强度为3 000 lx,光暗比为12 h:12 h)BG11培养基中传代培养。每天定时取样,测定微藻的吸光度(OD680),绘制得到斜生栅藻生长曲线,以选取处于对数生长期的微藻用于后续实验。实验菌种来源活性污泥曝气驯化后得到的好氧混合菌种,可挥发性悬浮固体浓度(MLVSS)为1 800 mg·L−1。
实验所用污水取北京某农村污水处理站,经过滤去除大粒径悬浮物后灭菌后使用,污水水质指标为COD为320~400 mg·L−1,TN为25~50 mg·L−1,氨氮为25~45 mg·L−1,TP为4.5~5 mg·L−1。
本研究采用流动挂膜法在基质表面接种微藻与菌种(质量比5:1),藻液流过载体基质表面,在空气曝气量为0.2 L·min−1下通过细胞与载体基质之间的静电力、范德华力、水力作用等,使一定量的藻细胞附着在载体表面。研究PVF(添加藻菌生物质与PVF)、CS@PVF(添加藻菌与CS@PVF)、CQDs/CS@PVF(添加藻菌与CQDs/CS@PVF)、悬浮(添加藻菌)和吸附对照(添加PVF)各系统水质指标COD、TP、TN和生物量的变化。
-
取水样经0.45 µm滤膜过滤后,参照《水和废水监测分析方法》测定水质指标COD、TP、TN。COD采用重铬酸钾法、TP浓度采用钼锑抗分光光度法测定,TN浓度采用过硫酸钾氧化-紫外分光光度法测定。
-
1) 微藻生物量用干重法测定。将0.45 μm滤膜放入烘箱烘至恒重称重。悬浮微藻直接取一定体积的藻液通过真空抽滤装置将藻细胞过滤到滤膜上,负载有生物膜的载体经过超声洗涤多次后,使载体上的生物膜分离到液相中,再通过真空抽滤装置将藻细胞过滤到滤膜上,并用蒸馏水清洗3次。将滤有微藻细胞的滤膜放入烘箱烘干至恒重,计算其前后差值确定生物量和藻液的浓度。
2) 微藻油脂含量的测定。将表面附着微藻的载体用去离子水冲洗、超声,使得微藻生物膜脱离下来,然后在8 000 r·min−1下离心,倒去上清液,剩余微藻生物质冷冻干燥12 h得到冻干藻粉。取100 mg冻干藻粉,根据氯仿-甲醇法[19]提取测定油脂质量:用4 mL氯仿:甲醇(2:1,v/v)在室温下提取冷冻干燥的微藻1 h,将细胞从上清液中分离,7 000 r·min−1离心7 min。然后在上清液中加入0.5 mL水,5 000 r·min−1离心10 min,将脂质提取到氯仿相,非脂质提取到甲醇水相。仔细去除顶部的水相,底部含有脂质的氯仿相在60 °C蒸发,以称量脂质的含量。油脂含量=油脂的质量/干藻粉的质量×100%。
3) 微藻脂肪酸组成的测定。取30 mg的利用2)中方法提取的藻油加入2 mL含1%浓硫酸的甲醇,迅速混匀,于70 ℃水浴反应30 min。冷却至室温后,加入2 mL正己烷和2 mL饱和氯化钠,充分振荡并静置分层,离心后取正己烷层转移到小瓶中,使用岛津2014C (岛津,日本),配备火焰电离检测器(FID)和SHIMADZU(SK-5)气相毛细管色谱柱(30 m×0.32 mm×0.25 μm),对脂肪酸甲酯(FAMEs)进行测定:氮气作载气,在10:1的分流模式下,注入温度为280 ℃,进样量为2 μL,探测器温度设置为280 °C。FAME成分与标准FAME(C8-C22;SUPELCO)比较,以面积归一法得到各脂肪酸组分的相对含量。
4) 微藻光合活性的测定。采用叶绿素荧光仪(WALZ PAM-2500,德国)测定藻细胞的光合作用参数,悬浮微藻直接取一定体积的藻液通过真空抽滤装置将藻细胞过滤到滤膜上,负载有生物膜的载体经过超声洗涤多次后,使载体上的生物膜分离到液相中,再通过真空抽滤装置将藻细胞过滤到0.45 μm醋酸纤维滤膜上,将含有相同生物量的醋酸纤维滤膜用叶片夹夹住,置于黑暗下暗适应30 min后,测定藻细胞的Fv/Fm (PSⅡ最大光化学量子产量)、NPQ (非光化学淬灭系数)。
-
微藻生物降解COD、TN、TP的动力学均为一级反应,如式(1)所示。
式中:Ct为该t时间污染物(COD、TN、TP)的质量浓度,mg·L−1;C0为污染物初始质量浓度,mg·L−1;t为反应时间,d;k为污染物讲解速率,d−1。
-
Logistic增长模型(式(2))是应用较为广泛的微藻生长模型,在本研究中用于不同体系下生长曲线的拟合。
式中:Y为微藻生物量,g·L−1;B为最大微藻生物量,g·L−1;k为比生长速率,d−1;t为生长时间,d。
-
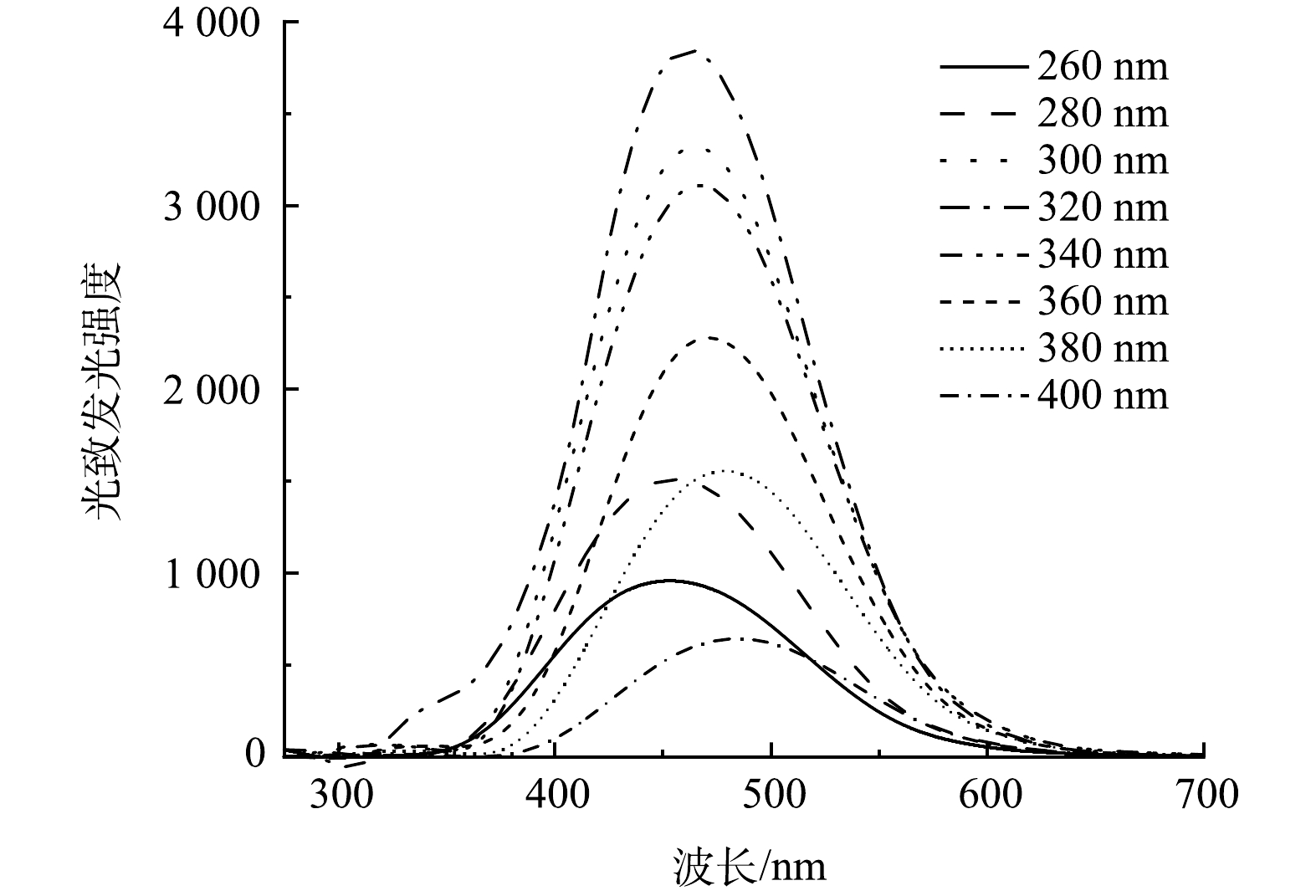
1) CQDs/CS光致发光性能分析。CQDs/CS改性显著提升了载体在260~400 nm波长下的光致发光性能,因为CQDs优异且可调谐的光学特性。当CQDs/CS在紫外激发波长(260~400 nm),表现出良好的的蓝光发射,发射光的最大值集中在455~480 nm。如图1所示,CQDs/CS光致发光强度随着激发波长增加,呈现先增大后减小的趋势,从260 nm开始随着激发波长增加,光致发光强度逐渐增大,在激发波长为320 nm处发光强度达到最大,最佳光致发光的波长为470 nm,激发波长为320 nm后的发光强度不断降低,这与各类碳量子点材料发光特性[20-21]相似。总体来说,当CQDs/CS处于激发波长(260~400 nm))时,在450~480 nm处有强而宽的蓝光发射,并且发射峰逐渐向右偏移,这表明CQDs可以把微藻难以利用的紫外光定向转移到微藻可以利用的蓝光上,具有在实际阳光下的转换光谱特性。一般情况下光合作用只能利用400~700 nm的可见光,而通过CQDs转换后,小于400 nm的紫外光也可以有效地被微藻利用。可被微藻利用的光谱范围提升了30%以上,这可为微藻生长繁殖提供更好的光利用范围。
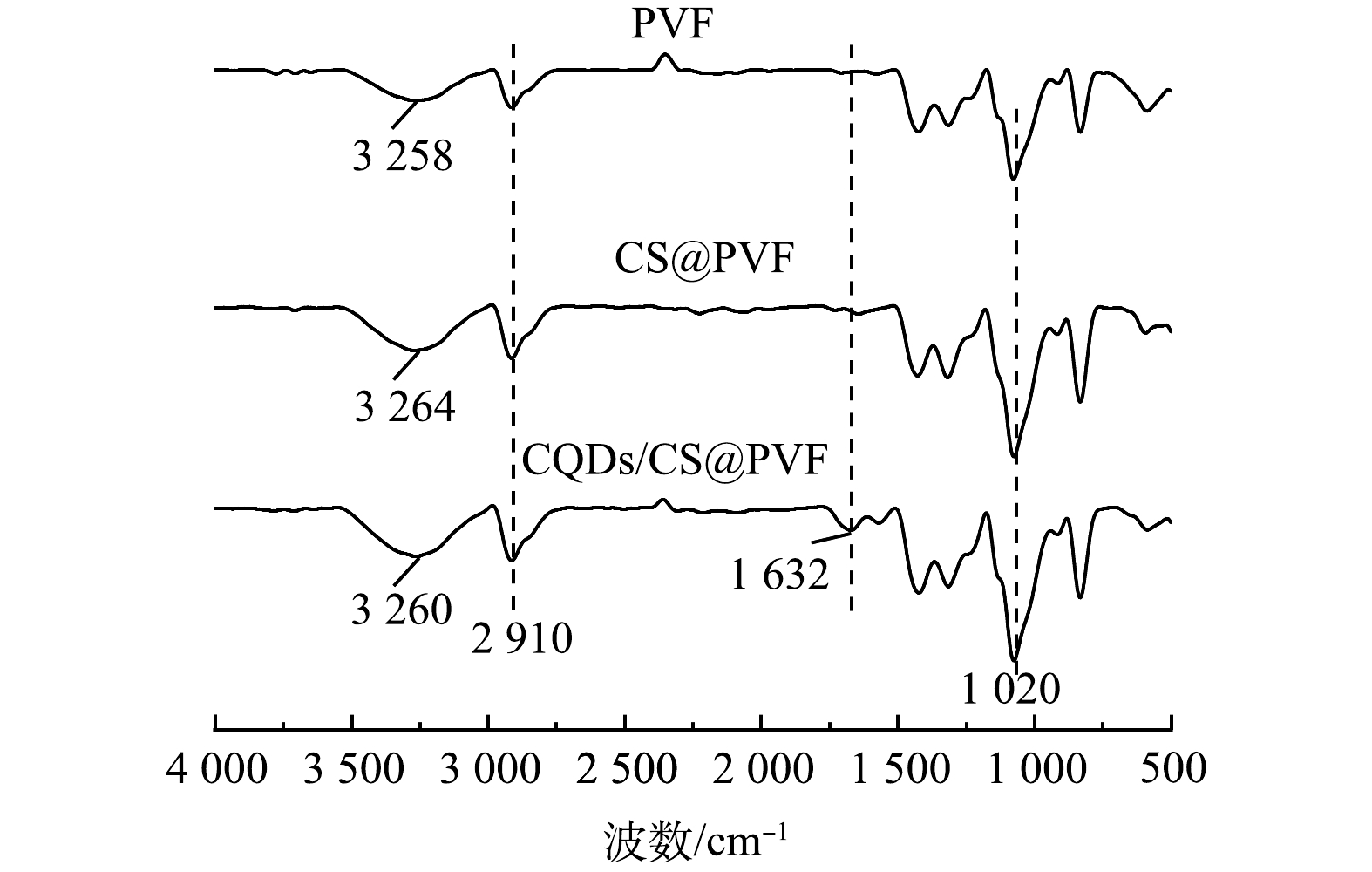
2)表面官能团分析。新增C=N吸收峰和—NH2官能团吸收峰强度的增加表明了CQDs/CS成功引入。载体在3 260 cm−1处强而宽的吸收峰对应N—H与—OH的伸缩振动峰的叠加,2 910 cm−1处的峰对应C—H的伸缩振动峰,1 632 cm−1处为C=N的伸缩振动吸收峰,1 020 cm−1处的吸收峰对应C—O—C(图2)。对比未改性的PVF,CQDs/CS@PVF在1 632 cm−1出现了新的较强伸缩振动吸收峰,应为CQDs中C=N基团引起,表明材料表面成功负载了光转化效能提升的CQDs。CS@PVF与CQDs/CS@PVF在3 200~3 400 cm−1处的吸收峰强度增加,这是因为引入的CS含有丰富的N—H与—OH。CS@PVF与CQDs/CS的FTIR光谱对比,3 200~3 400 cm−1处的吸收峰发生了—OH和N—H伸缩振动的红移,其由CQDs和CS之间的氢键相互作用引起的,CQDs与CS形成的氢键作用使得CQDs与CS形成稳定的聚合物均匀的分布在PVF表面,避免了CQDs因团聚而造成的荧光猝灭。CS提供的丰富的带正电的—NH2官能团为提供了带负电微藻吸附的静电引力,有利于后续生物膜的形成和稳定附着,进而促进后续生物降解反应发生。
-
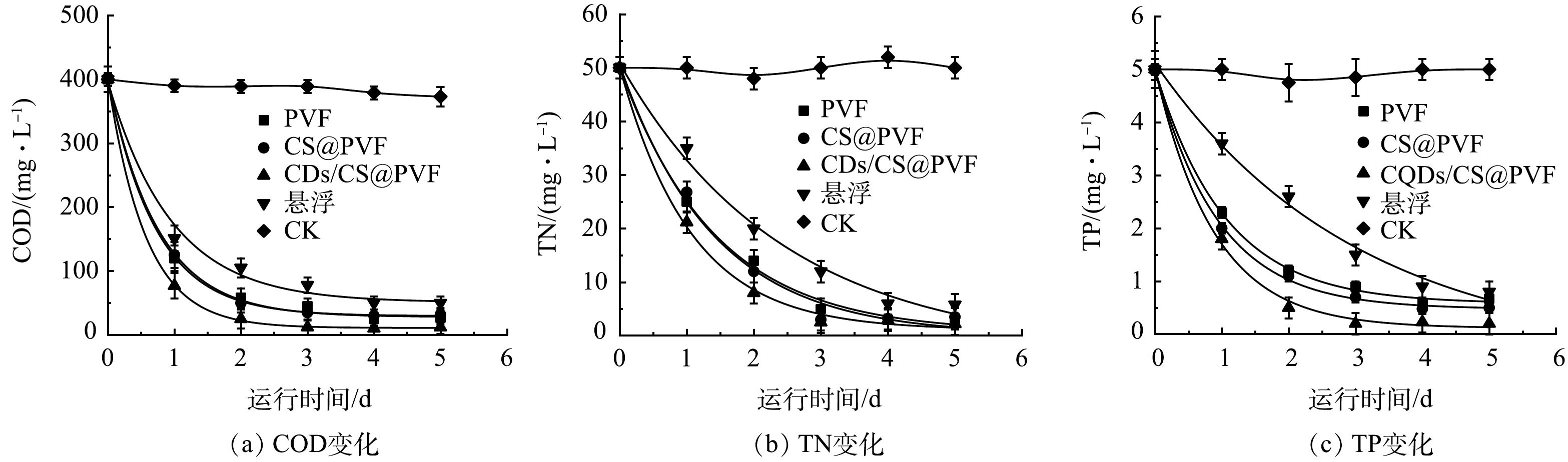
1)污水净化效能提升分析。CQDs/CS@PVF的加入显著提高了污水中COD、TN、TP的去除速率,与未加材料的对照组相比降解速率分别提高了68.2%、120.2%、79.2%(表1)。如图3所示,在各藻菌共生系统中,CK对照组(纯PVF没有添加藻菌)表明材料通过吸附作用对污染物的去除率小于0.5%。表明污染物的去除依靠藻菌生物膜的降解。CQDs/CS@PVF生物膜系统去除效率最快,这是因为 CQDs/CS@PVF藻菌生物膜相比于悬浮藻菌在低曝气状态下不会沉淀,更好接受光照;生物膜传质距离短,藻菌之间的气体交换作用更强,从而更好的降解污水中的C、N、P。CQDs/CS@PVF载体上CQDs可以改善反应器内的光分布,能把光转移到微藻偏好利用的波长下。对于COD的去除,相比于之前纯藻体系的研究结果相比,本研究在实验结束时达到了较高的COD去除率。这是因为藻类在培养过程中会释放胞外有机物,这将提升废水中COD。而藻菌共生体系中,藻类可以为细菌提供氧气,细菌还可以利用微藻分泌的有机物增强了COD的降解,细菌还可以为藻类提供CO2,从而促进藻类的生长。添加CQDs/CS@PVF载体的生物膜系统在处理5 d后COD、TN、TP分别达到12.1、6.2、0.2 mg·L−1,出水满足北京《农村生活污水处理设施水污染物排放标准》一级A标准。有研究[22]表明,生物降解是菌藻共生体系对污水中C、N、P去除的主要贡献机制,因此,研究进一步通过分析微藻生物量和生长速率等指标,探讨材料对于微藻生物效能的提升作用。
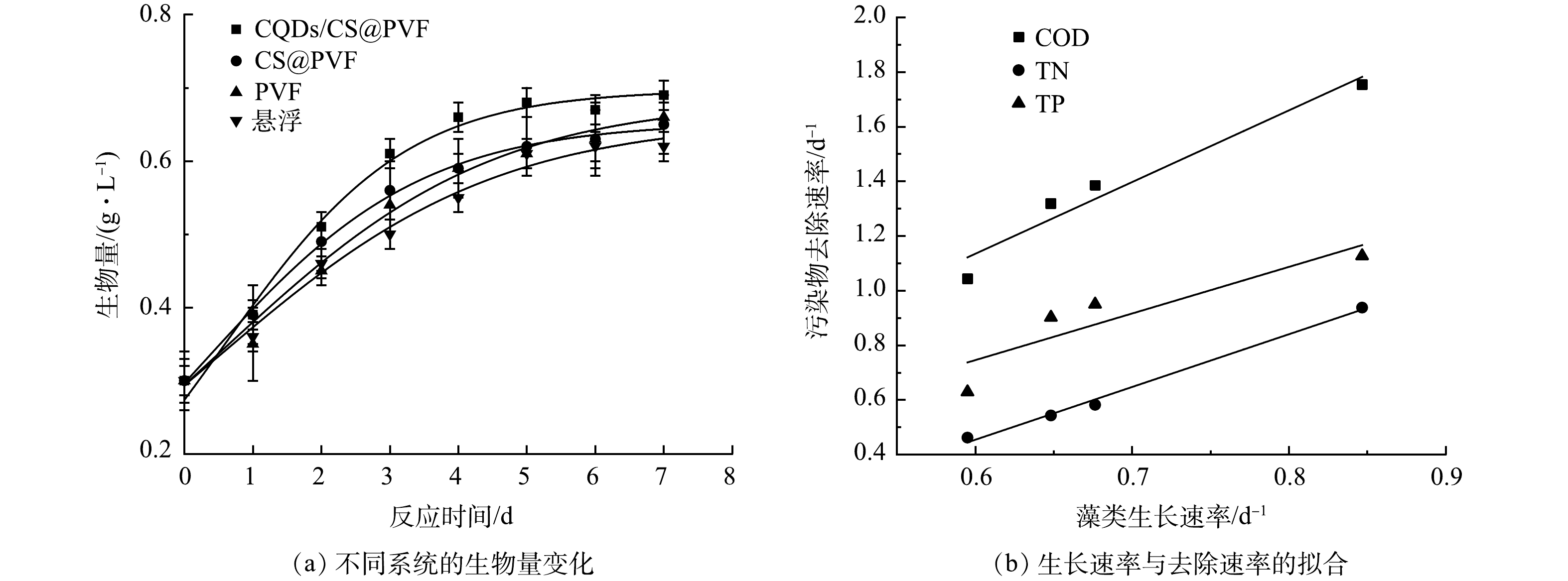
2)微藻生物量与污染物降解协同关系分析。微藻在不同反应器中的的生长情况均符合Logistic模型(R2均大于0.98;P<0.05)(图4(a))。CQDs/CS@PVF系统相比悬浮系统比生长速率提高了42.3%(表2)。较高的生长速率是因为碳量子点的光致发光和氨基的静电力作用使CQDs/CS@PVF系统中快速形成了稳定的生物膜。不同系统下微藻的生长速率与污染物的去除率呈显著正相关,生长速率与COD、TN、TP去除速率的相关性分别为0.925、0.991、0.715(P<0.05,图4(b))。表明微藻生物量的增长是COD、TN去除的主要原因,TP的去除速率与生物量增长速率拟合较差,可能是因为TP的去除机制除了生物降解还有化学沉淀。微藻在不同生长条件下的的生长曲线均符合“S”型增长,微藻在接种后开始1~3 d生物量迅速增加,在4 d后保持稳定,这与污水水质指标的变化保持一致。但是生物膜体系中微藻增长速率明显高于悬浮性体系,在4 d的培养过程中,藻类生物量增长为3.1倍。CQDs/CS@PVF提升原因一是微藻生物膜低曝气的情况下,依然可以均匀附着支撑载体上,避免了微藻生长过程中的沉降导致的光照不足;二是因为投加的CQDs/CS@PVF材料的光致发光性能,提升了微藻生物膜光合作用效率,使得微藻生物膜快速生长。藻类生物膜的快速生长使得污水中各种营养元素迅速吸收利用,同时生物膜生长状态下微藻细胞是以相对固定的状态附着在载体表面,所处光环境不存在必然的明暗循环,相比于悬浮微藻降低了光照到达藻细胞过程中的光衰减,更多的藻细胞得到有效光照,从而提高了微藻的光能利用率,生物量增长速率也相应提高。
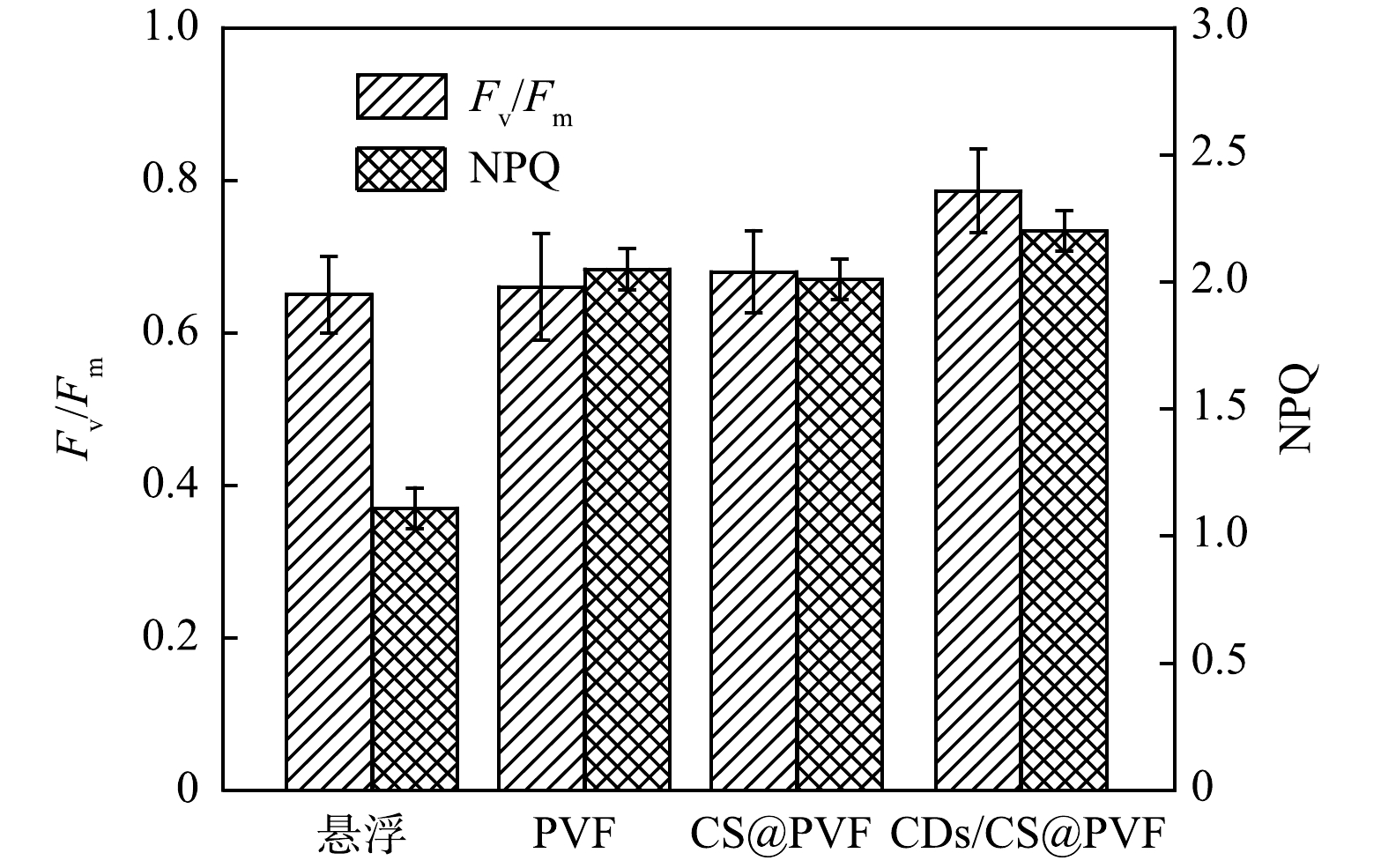
3) CQDs/CS@PVF载体对微藻光合活性提升分析。CQDs/CS@PVF载体提升了代表性的微藻光合活性因子(PSII)最大光能转化效率(Fv/Fm)提高了20.9%,NPQ提高了98.0%。Fv/Fm提高是因为CQDs用于光致发光可调发射时,扩大了可被微藻利用的光波长范围。如图5所示,CQDs/CS@PVF生物膜培养模式Fv/Fm最高。但在3种生物膜系统中,存在CQDs的载体生物膜系统中Fv/Fm有所上升,CQDs存在时生物膜PSII活性最强。这是因为当CQDs用于光致发光可调发射时,优化转换了更有效被微藻利用的光波长(紫外光-蓝光)。生物膜培养下的微藻NPQ显著提高,因为生物膜系统相比悬浮系统,微藻能够在强光下将多余的光快速转化成热能散失,以减少高强度光照对叶绿体的损伤[23]。而CQDs/CS@PVF组NPQ高于其他两组生物膜系统,可能是因为CQDs促进了光的吸收利用,从而提高了叶绿体内部热转化能力。NPQ值的提高表明CQDs/CS@PVF系统能够在高光照条件下保护藻株免受光损伤,从而提高光合效率和更高的生物量积累。
-
材料的加入不仅促进了污染物的降解,同时对于微藻的产脂也有促进作用。具体表现在产脂量的增加,微藻油脂脂肪酸的改变。CQDs/CS@PVF微藻生物膜体系的构建提高了微藻油脂的不饱和脂肪酸的含量,降低了饱和脂肪酸的含量,提高了生物柴油的品质和产量。
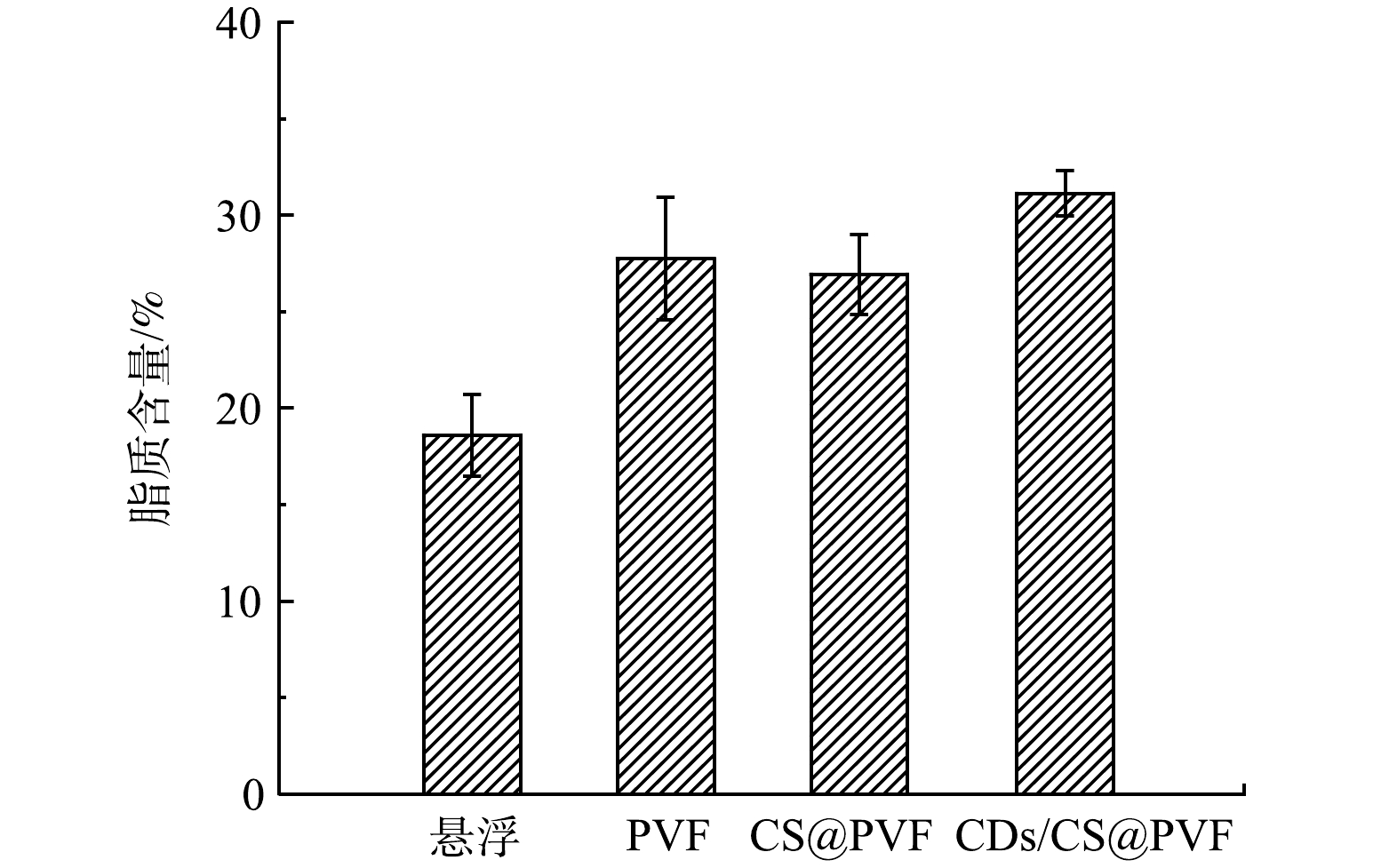
1)微藻脂质含量分析。处理污水5 d后的CQDs/CS@PVF微藻生物膜系统中微藻油脂含量相比悬浮培养提升了52.0%(图6),各生物膜系统下油脂含量相比悬浮系统均显著提升,并且富含可作为生物柴油组分的C16-C18。这是因为具有一定厚度生物膜环境会导致内部细胞营养吸收相对缺乏,内部形成微胁迫环境[24],相关研究表明[25]藻细胞的生长受到缺水、缺氮和缺磷等条件胁迫时,微藻细胞更偏向积累脂质;而相比没有加入CQDs的载体上的微藻生物膜,CQDs/CS@PVF载体上的生物膜脂质含量进一步提升,这可能和载体表面CQDs的光谱转换有关,CQDs光致发光可以促进微藻光合作用产生更多脂质,CQDs/CS@PVF载体上的生物膜脂质达到30.1%,是良好的生产生物柴油的原料。
2)微藻脂质脂肪酸品质分析。CQDs/CS@PVF的加入使微藻产生的脂质向着高质量的单不饱和脂肪酸转换,微藻中脂肪酸的主要组成均以C16~C18为主,为绿藻门脂质中常见脂肪酸。适合制备生物柴油的原料应含有较多的C16~C18脂肪酸,主要包括十六烷酸(C16:0)、十八烷酸(C18:0)、十八烯酸(C18:1)、十八碳二烯酸(C18:2)、十八碳三烯酸(C18:3),生物膜系统微藻油脂脂肪酸甲酯C16-C18基本都在96%以上(表3)。不同载体生物膜体系中单不饱和脂肪酸(MUFA)的比例为39.09%~40.70%,多不饱和脂肪酸(PUFA)的比例为21.18%~21.99%,均高于悬浮培养体系的35.63%和19.91%,而饱和脂肪酸(SFA)比例降低。不饱和脂肪酸有助于改善微生物油的低温性能和运动黏度,提升生物柴油的品质。
-
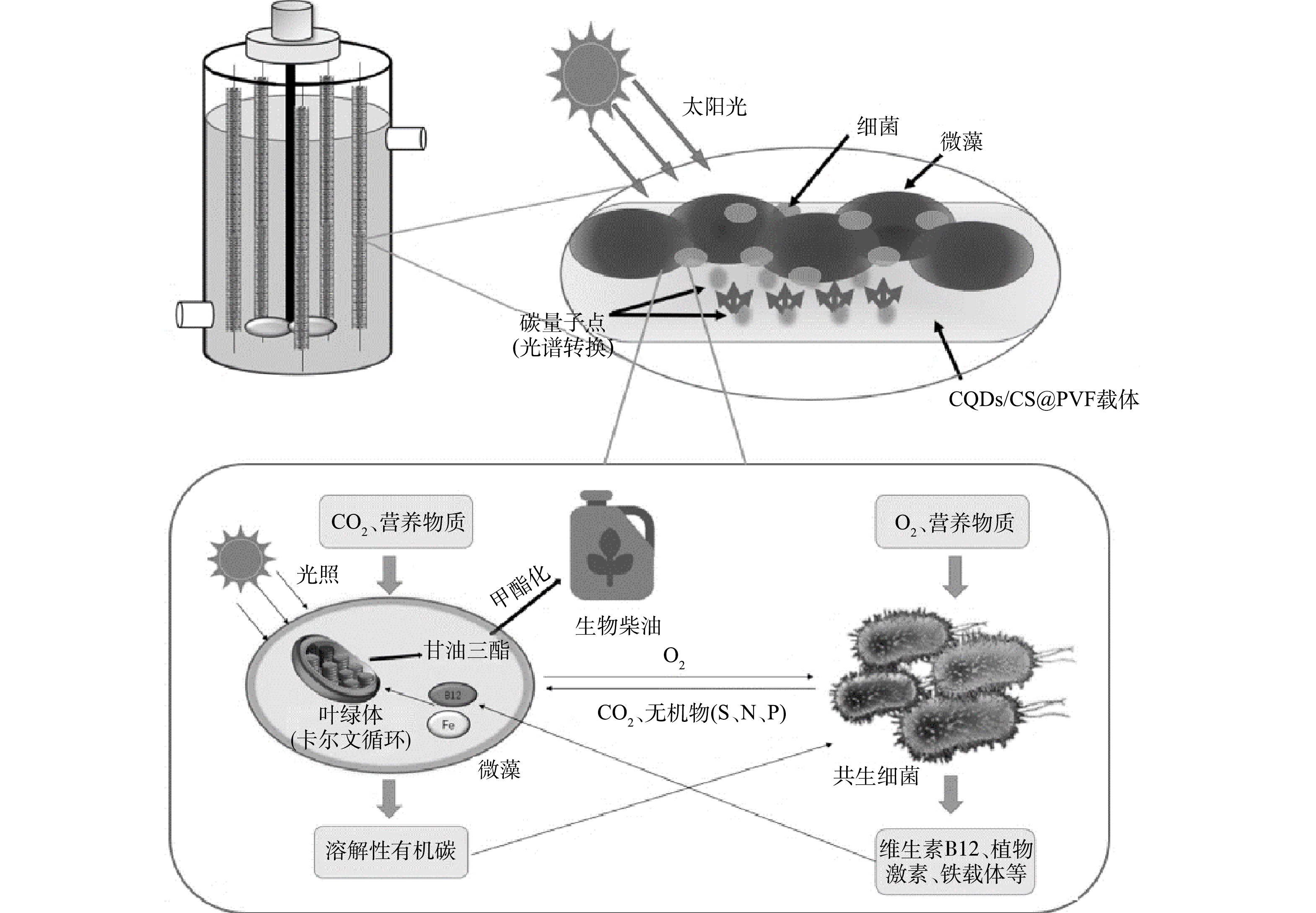
微藻可以为细菌提供碳源、O2和稳定的栖息地。细菌通过呼吸作用分解碳、氮、磷等营养物质,为微藻的生长提供CO2维生素、植物激素和铁载体等。如图7所示,在CQDs/CS@PVF微藻生物膜系统中,微藻与细菌的相互作用关系更密切(O2-CO2交换,营养物质协同利用,促生因子维生素、植物激素、铁载体传递),微藻与细菌在富含营养的废水中协同生长。由于微藻和细菌的代谢物可以相互促进生物量生长,因此微藻的生物量产量远高于单独培养的微藻。在生物膜光反应器中,CQDs/CS@PVF载体光谱转换的将紫外光转换为蓝光,CQDs转换后的蓝光可用于微藻光合作用,蓝光将有助于微藻积累油脂。藻菌的互惠互利和载体的蓝光转换都有助于微藻甘油三酯的合成,甲酯化后即可制成高品质生物柴油,实现对污水资源化的利用。
-
1) CQDs/CS@PVF微藻生物膜系统显著提升了污水中COD、TN、TP污染物的去除速率,分别提高了68.2%、120.2%、79.2%。污水中的营养组分转化成为微藻生物质油脂,其含量提升了50.2%,尤其是单不饱和脂肪酸组分含量的提升有助于提高生物柴油的品质。
2)污染物去除同步转化为油脂的协同机制主要为:CQDs/CS@PVF载体吸附形成的生物膜相比悬浮藻菌气体交换效率、营养交换效率高;CQDs/CS@PVF载体表面的碳量子点可以通过光致发光把入射的紫外线吸收并转化为可见光,促进了PSII能量转移,提高了微藻的光合作用,通过CQDs的光致发光促进对微藻对光的吸收利用和油脂的合成,实现了将能量从光转化为生物量。
3)通过设计CQDs/CS@PVF微藻生物膜系统,在对农村污水短时间达标处理的实现了含有高质量油脂的微藻生物质低成本分离,为农村地区分散式处理污水提供了良好的理论依据。
碳量子点/壳聚糖@维纶纤维载体强化藻菌生物膜净化农村污水及脂质积累效能
The efficiency of carbon quantum dots/chitosan @ vinylon fiber carrier enhanced algae and bacteria biofilm in purification of rural wastewater and lipid accumulation
-
摘要: 本文针对微藻净化污水效率低、藻水分离困难以及微藻含油量低等系列问题,设计制备碳量子点/壳聚糖@维纶纤维(CQDs/CS@PVF)附着载体强化藻菌生物膜系统对污水净化协同产油。结果表明,CQDs/CS@PVF添加形成的藻菌生物膜系统与对照组相比,对污水中的COD、TN和TP的去除速率分别提高了68.2%、120.2%、79.2%,这是由于CQDs/CS@PVF藻菌生物膜系统提高了42.3%的微藻比生长速率,出水达到北京《农村生活污水处理设施水污染物排放标准》一级A标准。污水中的有机物被微藻利用转化为生物质油脂,其含量达到30.1%,脂肪酸C16~C18含量占比为96%,此组份的脂质更适合作为底物合成生物柴油,实现污染物向生物柴油优质原料的转化。CQDs/CS@PVF微藻生物膜快速去除有机物的同时高效生产油脂的机理是藻菌生物膜体系微藻与细菌细胞间距小,从而提高了O2-CO2气体与营养组分交换效率;此外,CQDs/CS@PVF通过拓展藻30%的可吸收光谱可提升20.9%的光合作用效率,非光化学淬灭系数提升了98.0%。以上研究结果可为CQDs/CS@PVF载体强化藻菌生物膜系统高效率处理农村污水同步收获油脂提供参考。Abstract: In this study, carbon quantum dots/chitosan @ poly (vinyl alcohol) fibers (CQDs/CS@PVF) were designed and prepared to address a series of issues such as low efficiency in sewage purification by microalgae, difficulty in algae water separation, and low oil content in microalgae. Synergistic oil production by attaching carriers to enhance algal biofilm systems for wastewater purification. The results show that CQDs/ CS@PVF compared with the control group, the removal efficiencies of COD, TN, and TP in wastewater by the added algal biofilm system increased by 68.2%, 120.2% and79.2 %, respectively, which was due to CQDs/ CS@PVF-loaded algal biofilm system increased the growth rate of microalgae by 42.3%, and the effluent could meet the Class I A standard of Beijing Water Pollutant Discharge Standard for Rural Domestic Sewage Treatment Facilities. The organic matter in sewage was utilized by microalgae and converted into biomass oil with a content of 30.1%, and the content of fatty acid C16-C18 accounted for 96%. The lipid of this component was more suitable as a substrate for the synthesis of biodiesel, realizing the conversion of pollutants into high-quality raw materials for biodiesel. The mechanism of CQDs/CS@PVF-loaded microalgae biofilm for rapid removal of organic matter and efficient production of oil was small distance between microalgae and bacterial cells in the algal bacterial biofilm system, thereby improving the exchange efficiency of O2-CO2 gas and nutrient components. In addition, CQDs/ CS@PVF could expand the absorbable spectra of algae by 30%, which could lead to the increase of the photosynthetic efficiency by 21%, and the increase of non photochemical quenching coefficient by 98%. This study provides a reference for CQDs/CS@PVF carrier-enhanced algal biofilm system to efficiently treat rural sewage and simultaneously harvest oil.
-
Key words:
- microalgae /
- rural sewage /
- biodiesel
-

-
表 1 一级反应动力学模型拟合参数
Table 1. First order reaction kinetics model fitting parameters
系统 COD TN TP R2 k R2 k R2 k 悬浮 0.981 1.043 0.986 0.462 0.981 0.629 PVF 0.998 1.319 0.994 0.543 0.998 0.902 CS@PVF 0.998 1.385 0.983 0.582 0.998 0.95 CQDs/CS@PVF 0.999 7 1.754 0.985 0.938 0.990 51 1.127 表 2 logistic模型拟合参数
Table 2. Logistic model fitting parameters
系统类别 R2 k CQDs/CS@PVF 0.990 1 0.846 71 CS@PVF 0.999 08 0.676 43 PVF 0.996 69 0.648 27 悬浮 0.999 17 0.595 04 表 3 不同系统下微藻脂肪酸占比
Table 3. Proportion of microalgal fatty acids in different systems %
脂肪酸 悬浮 PVF CS@PVF CQDs/CS@PVF C14:0 0.63 0.8 0.92 0.43 C16:0 40.58 36.49 37.11 37.03 C16:1 7.30 7.18 6.42 6.22 C18:0 2.89 2.26 2.05 2.98 C18:1 25.81 29.94 29.34 29.15 C18:2 11.33 16.81 15.53 15.53 C18:3 8.58 5.18 5.66 5.65 C20:1 0.41 0.55 0.36 0.36 C20:1 0.36 0.37 0.54 0.58 C22:1 2.11 1.42 2.07 2.07 饱和脂肪酸 44.10 43.55 43.08 43.44 不饱和脂肪酸 55.90 56.45 56.92 56.56 C16-C18 96.49 96.86 96.11 96.56 -
[1] 住房和城乡建设部. 中国城乡建设统计年鉴[M]. 北京: 中国统计出版社, 2022. [2] 罗惠莉, 周颖, 朱晴, 等. 农村生活污水处理技术模式的层次分析研究[J]. 环境科学与管理, 2016, 41(8): 78-81. [3] YOU K, GE F, WU X, et al. Nutrients recovery from piggery wastewater and starch wastewater via microalgae-bacteria consortia[J]. Algal Research, 2021, 60: 102551. doi: 10.1016/j.algal.2021.102551 [4] HAN W, JIN W, LI Z, et al. Cultivation of microalgae for lipid production using municipal wastewater[J]. Process Safety and Environmental Protection, 2021, 155: 155-165. doi: 10.1016/j.psep.2021.09.014 [5] CHOKSHI K, PANCHA I, GHOSH A, et al. Microalgal biomass generation by phycoremediation of dairy industry wastewater: An integrated approach towards sustainable biofuel production[J]. Bioresource Technology, 2016, 221: 455-460. doi: 10.1016/j.biortech.2016.09.070 [6] HAN X, HU X, YIN Q, et al. Intensification of brewery wastewater purification integrated with CO2 fixation via microalgae co-cultivation[J]. Journal of Environmental Chemical Engineering, 2021, 9(4): 105710. doi: 10.1016/j.jece.2021.105710 [7] 卞含笑, 韩挺, 高风正等. 猪粪沼液培养微藻系统中试试验[J]. 农业工程学报, 2023, 39(2): 157-165. [8] 刘金金. 微藻的固定化和分离技术及其在污水处理中的应用[J]. 辽宁化工, 2021, 50(6): 836-839. [9] LI S, CHU Y, XIE P, et al. Insights into the microalgae-bacteria consortia treating swine wastewater: Symbiotic mechanism and resistance genes analysis[J]. Bioresource Technology, 2022, 349: 126892. doi: 10.1016/j.biortech.2022.126892 [10] SCHNURR P J, ALLEN D G. Factors affecting algae biofilm growth and lipid production: A review[J]. Renewable and Sustainable Energy Reviews, 2015, 52: 418-429. doi: 10.1016/j.rser.2015.07.090 [11] LIU J, YIN J, GE Y, et al. Improved lipid productivity of Scenedesmus obliquus with high nutrient removal efficiency by mixotrophic cultivation in actual municipal wastewater[J]. Chemosphere, 2021, 285: 131475. doi: 10.1016/j.chemosphere.2021.131475 [12] SONG Y, WANG L, QIANG X, et al. The promising way to treat wastewater by microalgae: Approaches, mechanisms, applications and challenges[J]. Journal of Water Process Engineering, 2022, 49: 103012. doi: 10.1016/j.jwpe.2022.103012 [13] HU Y, XIAO Y, LIAO K, et al. Development of microalgal biofilm for wastewater remediation: from mechanism to practical application[J]. Journal of Chemical Technology & Biotechnology, 2021, 96(11): 2993-3008. [14] 高斌, 成家杨, 崔岩. 基于热力学模型的微藻固定化材料优选研究[J]. 环境工程, 2016, 34(S1): 411-415. [15] MOHSENPOUR S F, WILLOUGHBY N. Luminescent photobioreactor design for improved algal growth and photosynthetic pigment production through spectral conversion of light[J]. Bioresource Technology, 2013, 142: 147-153. doi: 10.1016/j.biortech.2013.05.024 [16] SEO Y H, CHO C, LEE J, et al. Enhancement of growth and lipid production from microalgae using fluorescent paint under the solar radiation[J]. Bioresource Technology, 2014, 173: 193-197. doi: 10.1016/j.biortech.2014.09.012 [17] YANG L, SU Q, SI B, et al. Enhancing bioenergy production with carbon capture of microalgae by ultraviolet spectrum conversion via graphene oxide quantum dots[J]. Chemical Engineering Journal, 2022, 429: 132230. doi: 10.1016/j.cej.2021.132230 [18] XUE R, FU L, DONG S, et al. Promoting Chlorella photosynthesis and bioresource production using directionally prepared carbon dots with tunable emission[J]. Journal of Colloid and Interface Science, 2020, 569: 195-203. doi: 10.1016/j.jcis.2020.02.080 [19] WANG W, ZHOU W, LIU J, et al. Biodiesel production from hydrolysate of Cyperus esculentus waste by Chlorella vulgaris[J]. Bioresource Technology, 2013, 136: 24-29. doi: 10.1016/j.biortech.2013.03.075 [20] DE B, KUMAR M, MANDAL B B, et al. An in situ prepared photo-luminescent transparent biocompatible hyperbranched epoxy/carbon dot nanocomposite[J]. RSC Advances, 2015, 5(91): 74692-77474. doi: 10.1039/C5RA12131K [21] CHEN L, ZHANG C, DU Z, et al. Fabrication of amido group functionalized carbon quantum dots and its transparent luminescent epoxy matrix composites[J]. Journal of Applied Polymer Science, 2015, 132(42): 42667. [22] HONG W, DENG L W, QI Z Y, et al. Constructed microalgal-bacterial symbiotic (MBS) system: Classification, performance, partnerships and perspectives[J]. Science of The Total Environment, 2022, 803: 150082. doi: 10.1016/j.scitotenv.2021.150082 [23] WANG Y, JIANG Z, LAI Z, et al. The self-adaption capability of microalgal biofilm under different light intensities: Photosynthetic parameters and biofilm microstructures[J]. Algal Research, 2021, 58: 102383. doi: 10.1016/j.algal.2021.102383 [24] 刘颖颖, 朱梅, 崔红利, 等. 不同培养模式及生物膜含水量对栅藻生长和油脂积累的影响[J]. 植物生理学报, 2022, 58(3): 543-553. [25] 聂煜东, 耿媛媛, 张贤明, 等. 产油微藻胁迫培养策略研究综述[J]. 中国环境科学, 2021, 41(8): 3853-3866. -



 下载:
下载: