-
随着人类生产生活的发展,越来越多的镉(cadmium,Cd)通过不同的途径进入到水环境中,对环境和生物产生潜在的危险。Cd2+在环境中的污染具有持久性,并且对生物器官有毒害作用甚至具有致癌风险[1]。因此,去除水溶液中的Cd2+十分重要。
目前已有多种方法可以去除水溶液中的Cd2+,其中吸附法是一种成熟有效的技术[2]。在生产生活中产生的大量生物质废弃物往往没有得到有效利用,近年来一些研究报道生物质可以直接作为吸附剂使用。贾郁菲等[3]利用甲壳生物质去除酸性矿坑水中的Cd2+,最大吸附量为235.45 mg·g−1。LEE等[4]利用柿子树叶生物质作为吸附材料,能够有效吸附水溶液中的Cu2+、Cd2+和Pb2+,其中对Cd2+的吸附量为18.26 mg·g−1 。刘栖萍等[5]通过10种树皮类吸附材料对Pb2+、Cd2+污染废水进行吸附,均有不错的吸附效果,对实际工业区废水中的Pb2+和Cd2+的吸附率最高可达98.21%。生物质材料对比生物炭可以有效降低材料制备时的能耗和污染,具有可观的利用前景。
番石榴是一种常见的亚热带水果,其果实和枝叶含有丰富的有机类物质。有研究表明番石榴树叶(guava leaf,Gl)可以吸附水中的Cd、Cr等重金属元素,ABDELWAHAB等[6]研究了Gl活化前后对Cd2+的吸附性能,研究表明Gl和AGl通过有机络合反应吸附溶液中的Cd2+,最大吸附量分别为10.53 mg·g−1和19.20 mg·g−1。MITRA等[7]使用Gl作为反应柱填料来吸附Cr6+,吸附量最高为8.72 mg·g−1。BEHERA等[8]利用Gl吸附30 mg·L−1的As3+溶液,去除率达到90.88%。上述研究可以看出Gl直接作为吸附剂使用效果并不出色,因此可以通过改性或与其他材料复合来提高吸附性能。类水滑石(layered double hydroxide, LDH)是一种具有层状结构的无机黏土矿物材料,其具有金属氢氧化物组成的阳离子层板和层间阴离子夹层,利用其组成可调控性等特性可以有效的去除Cd2+[9]。SHAN等[10]通过共沉淀法合成的镁铝类水滑石(MgAl-Layered double hydroxide, MgAl-LDH)可以有效吸附溶液中的Cd2+,最大吸附量能达到47.30 mg·g−1。ZHONG等[11]利用合成的MgAl-LDH和MgAlFe-LDH修复重金属污染的土壤,加入材料后土壤中的水提态Cd含量均降低了90%以上。通过将LDH和其他材料如生物炭等进行复合可以提升对重金属的去除能力,TAN等[12]将MgFe-LDH与猕猴桃枝生物炭复合用来吸附Cd2+,复合之后吸附量由1.78 mg·g−1提升到25.60 mg·g−1。
本研究通过将Gl与MgAl-LDH进行复合,合成了一种新型环保的复合材料Gl/MgAl-LDH,通过吸附动力学、等温吸附等实验探究了该复合材料对Cd2+的吸附特性,同时通过XRD、FT-IR和XPS等表征手段探究其性质特征和吸附机理,为生物质作为吸附剂的资源化利用提供了参考。
-
六水合硝酸镁(Mg(NO3)2·6H2O)、九水合硝酸铝(Al(NO3)3·9H2O)、四水合硝酸镉(Cd(NO3)2·4H2O) 、氢氧化钠(NaOH)、碳酸钠(Na2CO3)均为分析纯,硝酸(HNO3)为优级纯。所使用水为超纯水。本研究使用的Gl采自广西壮族自治区,经超纯水洗净后于70 ℃烘干至恒重,粉碎后过100目筛,储存备用。
-
通过稳态共沉淀法制备MgAl-LDH,称取7.69 g Mg(NO3)2·6H2O和3.75 g Al(NO3)3·9H2O溶于超纯水中(c(Mg 2+): c( Al3+)=3:1),记为溶液A;称取3.20 g NaOH和0.74 gNa2CO3溶于超纯水中,记为溶液B。将A、B溶液常温下同时逐滴滴入到100 mL超纯水中,期间保持磁力搅拌,调整滴加速度以保持反应溶液pH在10.0左右。滴加完成后继续搅拌2 h,抽滤洗涤生成物至pH趋近于中性,之后在60 ℃下干燥24 h得到MgAl-LDH,磨碎过筛。Gl/MgAl-LDH的制备方法与MgAl-LDH类似,取5 g Gl倒入A溶液中搅拌浸泡48 h形成悬液,按照制备MgAl-LDH的方法进行共沉淀制备,全程对A悬液持续搅拌以保持均匀。干燥研磨后得到Gl/MgAl-LDH。
-
采用SEM(TESCAN MIRA4 LMS,Czech)配备能谱仪(OXFORD,UK)对材料的形貌结构进行观察。采用比表面积分析仪(MicromeriticsTristar 3000,USA)探究材料的表面特性及孔隙分布。采用XRD(Bruker D8,Germany)进行材料的晶体结构分析。采用FT-IR(Thermo Scientific iN10,USA)测定材料波长400~4 000 cm−1范围内的官能团特征。采用XPS(Thermo Scientific K-Alpha,USA)测定了材料表面的元素组成及化学形态。对材料吸附前后的XPS、FT-IR以及XRD进行分析,探究Gl /MgAl-LDH对Cd2+的吸附机理。
-
使用Cd(NO3)2·4H2O配置Cd2+溶液,通过HNO3和NaOH调节pH为6.0。进行吸附动力学实验研究不同材料对Cd2+的吸附速率及平衡时间。分别称取0.01 g的Gl/MgAl-LDH、Gl及MgAl-LDH添加到20 mL的Cd2+溶液(20 mg·L−1)中,振荡5~360 min,吸附完毕后离心取上清液测定Cd2+的质量浓度。分别使用以下动力学模型对对实验数据进行拟合:拟一级动力学方程(式(1))、拟二级动力学方程(式(2))、Elovich方程(式(3))。
式中:qe为吸附平衡时的吸附量,mg·g−1;qt为t时刻的吸附量,mg·g−1;t为吸附时间,min;k1为拟一级动力学方程的速率常数,min−1; k2为拟二级动力学方程的速率常数,g·(mg·min)−1;k3为Elovich方程的速率常数。
等温吸附实验分别称取0.01 g的Gl/MgAl-LDH、Gl及MgAl-LDH添加到20 mL不同质量浓度(10、20、30、50、70、100 mg·L−1)的Cd2+溶液中,振荡6 h后离心取上清液测定Cd2+的质量浓度。采用Langmuir方程(式(4))和Freundlich方程(式(5))对实验数据拟合。
式中:ce为吸附平衡时的溶液剩余Cd2+的质量浓度,mg·L−1;qe为吸附平衡时的吸附量,mg·g−1;qm为最大吸附量,mg·g−1;kL为Langmuir吸附常数,L·mg−1;kF为Freundlich吸附常数,mg1-n·Ln·g−1;n为常数。
采用0.45 μm的滤膜对上清液进行过滤后,使用原子吸收分光光度计(Shimadzu AA-7000,Japan)测定Cd2+的质量浓度。根据式(6)计算Cd2+的吸附量。
式中:qt为t时刻Cd2+的吸附量,mg·g−1;c0为初始溶液中的Cd2+的质量浓度,mg·L−1;ct为的t时刻溶液中剩余Cd2+的质量浓度,mg·L−1;V为加入的Cd溶液体积,L;m为投加的材料的质量,g。
-
由图1的SEM图像中可以观察到,Gl呈现纤维状的植物组织形态(图1(a)~(b)),表面光滑没有明显的植物特征。由图1(d)~(e)可见,MgAl-LDH为典型的LDH片状结构并因其电荷特性团聚在一起[13],材料尺寸为纳米级。图1(g)中,经过复合后Gl/MgAl-LDH表面不再像Gl一样光滑,而是附着有密集的结晶状物质。进一步放大后(图1(h)),可以清晰地看到LDH分散在Gl表面,呈明显的片状结构,证明了LDH成功构筑到Gl上。复合造成的分散分布有效减轻了LDH的团聚,变相提升了LDH与污染物质的接触面积。结合图1的EDS能谱图,复合后Gl/MgAl-LDH(图1(i))的图谱中对比Gl(图1(c))出现了Mg、Al元素的谱峰,且Mg、Al元素的原子比接近3:1,与材料制备的比例相吻合,进一步证实了LDH已经成功构筑到Gl上。
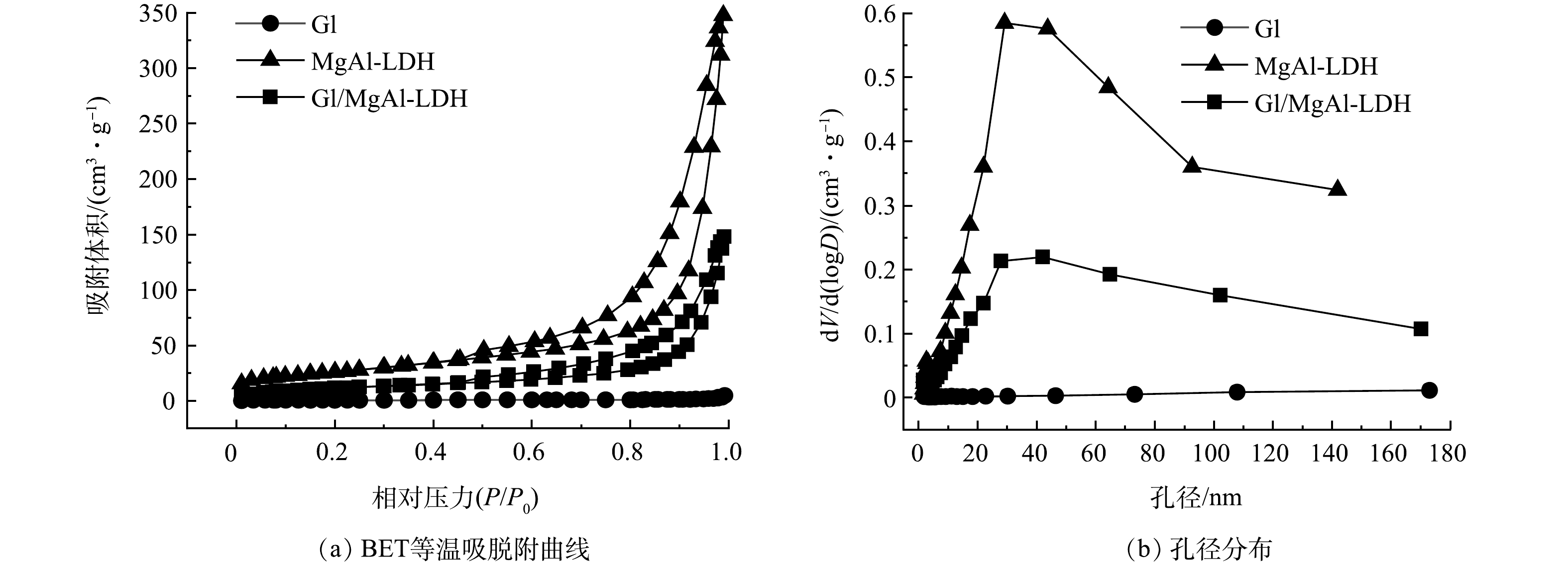
如图2(a)所示,Gl/MgAl-LDH和MgAl-LDH的BET等温吸脱附曲线类型为Ⅳ型等温线(IUPAC分类[14]),并具有明显的吸附回滞环,回滞类型为H3型,这表明2种材料的孔结构并不规整。结合图2(b)可知,Gl/MgAl-LDH和MgAl-LDH孔径范围分布广泛,不仅存在大量的介孔,还具有一定数量的大孔。这说明2种材料均属于分级多孔结构的介孔吸附剂。Gl的BET等温吸脱附曲线为Ⅱ型吸附等温线,Ⅱ型等温线代表非孔性或者大孔吸附剂上典型的物理吸附过程,说明 Gl没有丰富的孔隙且孔径多集中在大孔范围内。由表1可以看出,经过复合之后,Gl/MgAl-LDH的比表面积(42.41 m2·g−1)和孔容(0.23 cm3·g−1)明显大于Gl,但要小于MgAl-LDH。说明MgAl-LDH有着丰富的孔隙结构,通过将LDH构筑到Gl上,可为材料提供更多的孔隙。
-
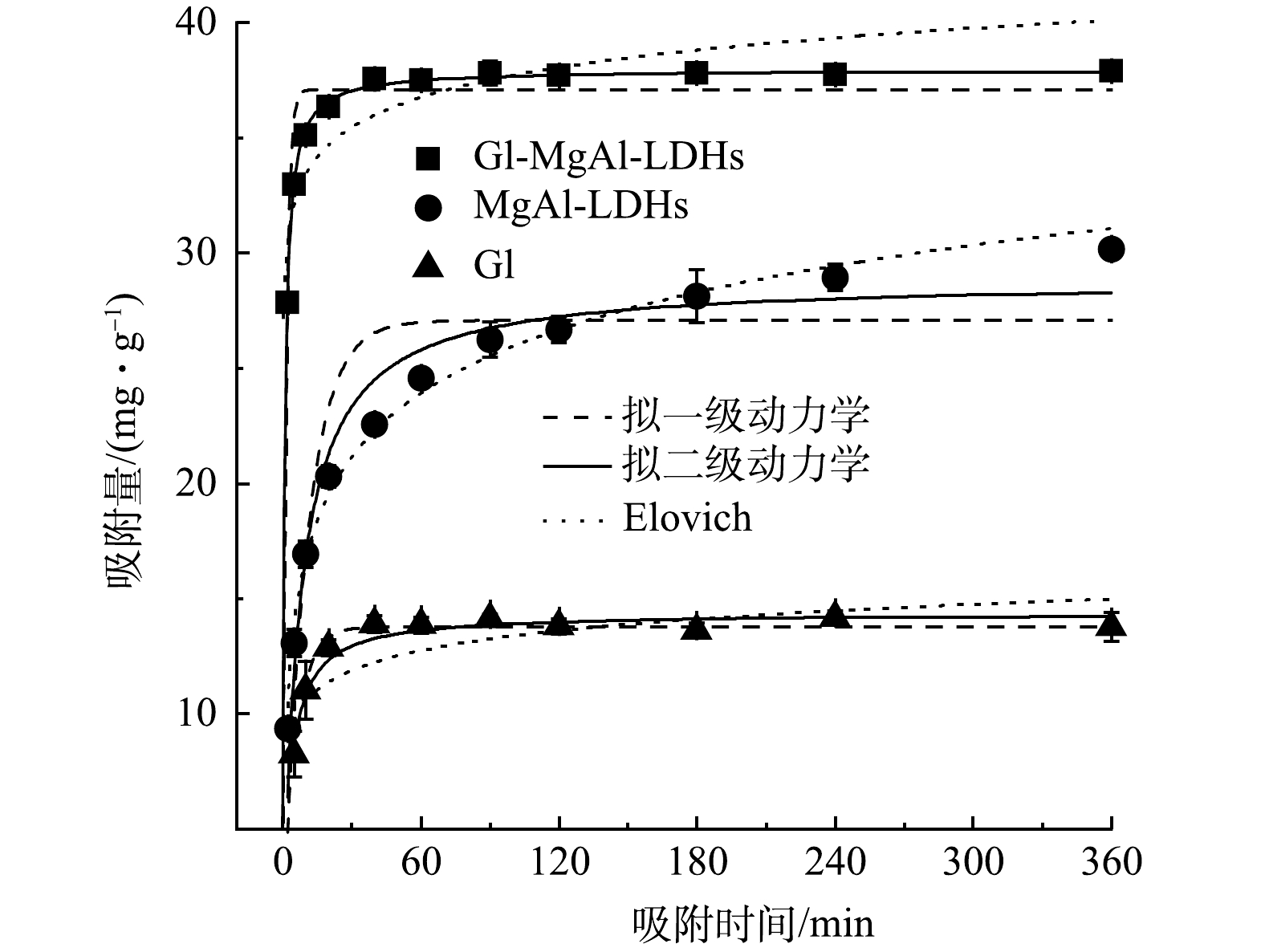
如图3所示, Gl/MgAl-LDH复合材料有着更高的吸附量,吸附平衡时(60 min),吸附量为37.50 mg·g−1,大于MgAl-LDH(24.58 mg·g−1)和Gl(13.86 mg·g−1)。这是因为复合之后Gl/MgAl-LDH相比Gl有着更大的比表面积和更多的吸附位点,同时由于树叶的疏水性Gl/MgAl-LDH在溶液中相比MgAl-LDH更加分散,进一步降低了LDH的团聚,加大了与Cd2+的接触面积。此外,Gl/MgAl-LDH还表现出良好的吸附速率,在吸附的初始阶段时吸附速率迅速提升,5 min时吸附量达到32.97 mg·g−1,10 min后吸附速率开始减缓,并在60 min时达到吸附平衡。这说明吸附初始阶段Gl/MgAl-LDH表面含有大量吸附位点,Cd2+主要由溶液扩散到材料表面,随后这一过程逐渐转变为颗粒内扩散,直至达到吸附平衡。值得注意的是,MgAl-LDH的吸附速率要低于其他材料,在6 h后仍未达到吸附平衡,这可能与MgAl-LDH的团聚现象有关,随着吸附的Cd2+不断增加,MgAl-LDH的电荷特性发生改变,可能导致团聚减弱,从而暴露出新的吸附位点。
由表2的拟合结果可见,Gl/MgAl-LDH对Cd2+的吸附更符合拟二级动力学方程(R2=0.997),涉及吸附剂与Cd2+之间的电子共用和电子转移等机理,可能存在化学沉淀等机理。由拟二级动力学方程得到的最大吸附量为37.95 mg·g−1与实验实际所测数据(37.50 mg·g−1)基本一致。此外,由拟二级动力学方程所得的速率常数k2也可以看出,Gl/MgAl-LDH的吸附速率要远高于其他材料。MgAl-LDH一定程度上也符合拟二级动力学方程(R2=0.973),但更适合Elovich方程的拟合(R2=0.989),Elovich方程属于经验方程,更合适描述非均相的扩散过程[15],这可能与MgAl-LDHs的结构特性和团聚效应有关。Gl作为生物质材料也展现出一定的吸附效果,最高吸附量可以达到14.50 mg·g−1,这与Abdelwahab等的研究结果接近[6]。Gl对Cd2+的吸附可由拟一级动力学方程(R2=0.985)和拟二级动力学方程(R 2=0.970)进行描述。
-
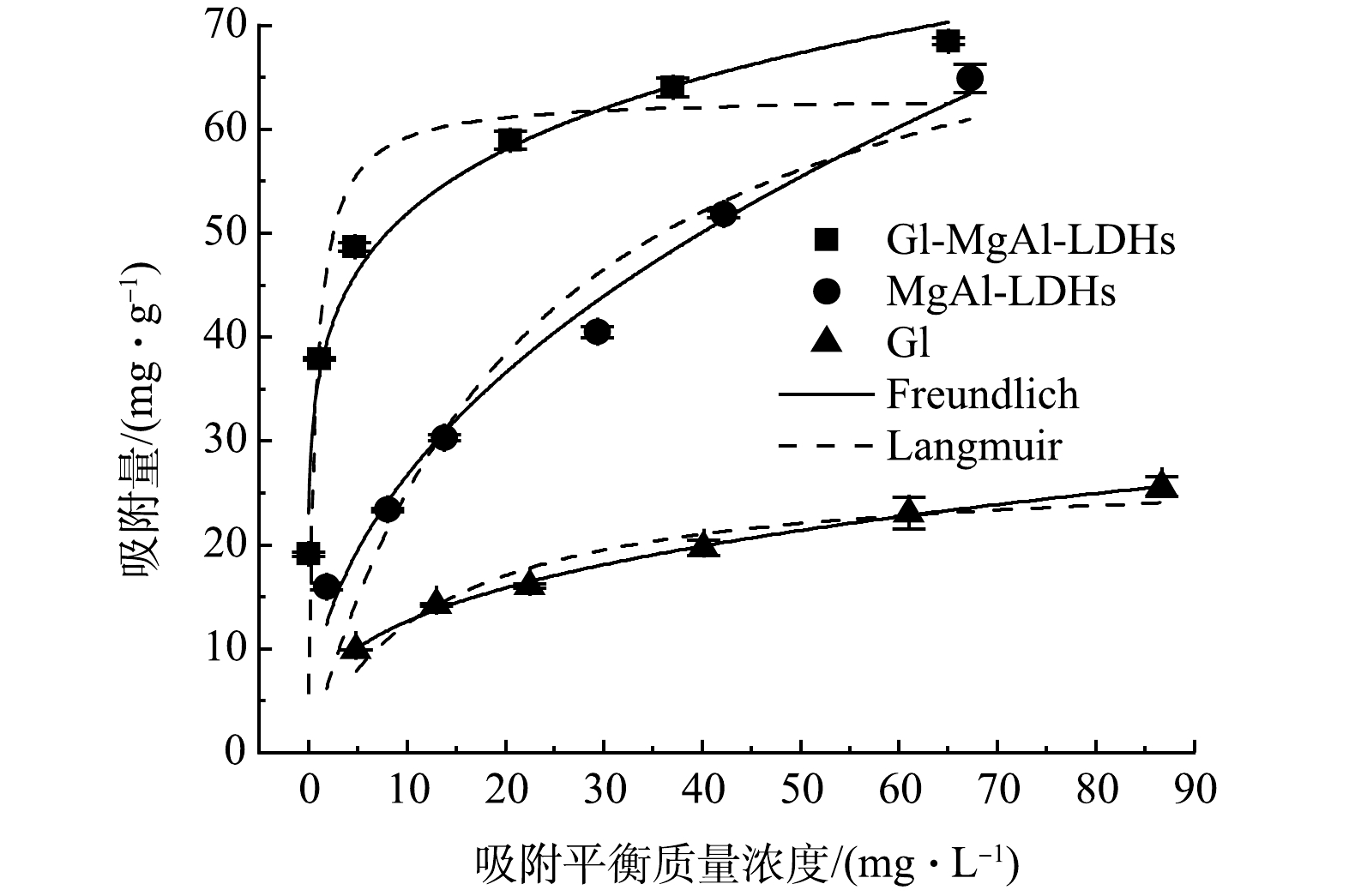
由表3可知,Gl/MgAl-LDH对Cd2+的等温吸附更符合Freundlich模型(R 2=0.983),表明吸附为不均匀表面吸附。同时,其Freundlich拟合的1/n指数为0.16(0.1<1/n<0.5),说明吸附较为容易。MgAl-LDH和Gl也均更符合Freundlich模型,说明两者表面较为复杂,可能存在多相吸附。由图4可见,Gl/MgAl-LDH对Cd2+的最大吸附量为68.43 mg·g−1。有趣的是,在较高Cd2+质量浓度下MgAl-LDH的吸附量接近于Gl/MgAl-LDH,推测可能是由于高Cd2+浓度环境下MgAl-LDH的表面电荷性质发生变化,导致团聚减弱,更有利于吸附的发生。
-
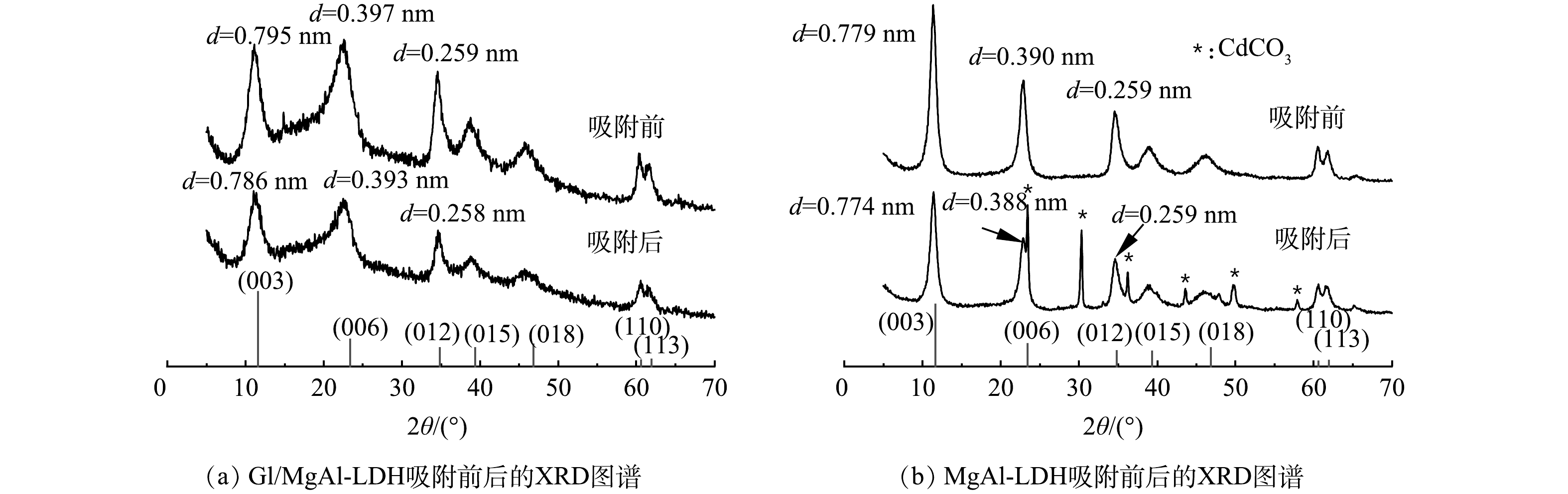
1) XRD分析。 Gl/MgAl-LDH和MgAl-LDH的XRD图谱如图5所示。可见,2种材料均具有明显的MgAl-LDH晶面衍射峰,说明复合之后LDH仍然保持着良好的晶型结构。比较吸附Cd2+前后,Gl/MgAl-LDH峰型并没有出现明显的Cd化合物衍射峰,这可能是因为Cd2+高度分散吸附在Gl/MgAl-LDH上,未能形成晶体结构物质[16-17],同时复合材料中有机类物质的大量加入也对少量生成的Cd化合物的衍射产生影响。MgAl-LDH在吸附后出现了CdCO3的峰型,说明Cd2+与MgAl-LDH阴离子夹层中的CO32-反应产生了CdCO3,这和SHAN等[10]的研究结果一致。在吸附后,Gl/MgAl-LDH图谱(图5(a))中代表(003)、(006)、(012)晶面的衍射峰2θ分别由11.130°、22.443°、34.577°偏移至11.238°、22.701°、34.569°。通过计算不同晶面的晶格间距,(003)、(006)、(012)晶面的晶格间距d分别由0.795、0.397、0.259 nm减少到0.786、0.393和0.258 nm,晶格间距变化的原因可能为Cd2+与LDH层间CO32-发生反应有关[17]。MgAl-LDH的(003)、(006)晶面的晶格间距在吸附后同样发生了变化,分别由0.779 nm、0.390 nm减小到0.774 nm、0.388 nm,这在一定程度上证明了Gl/MgAl-LDH拥有和MgAl-LDH相同的吸附机理。
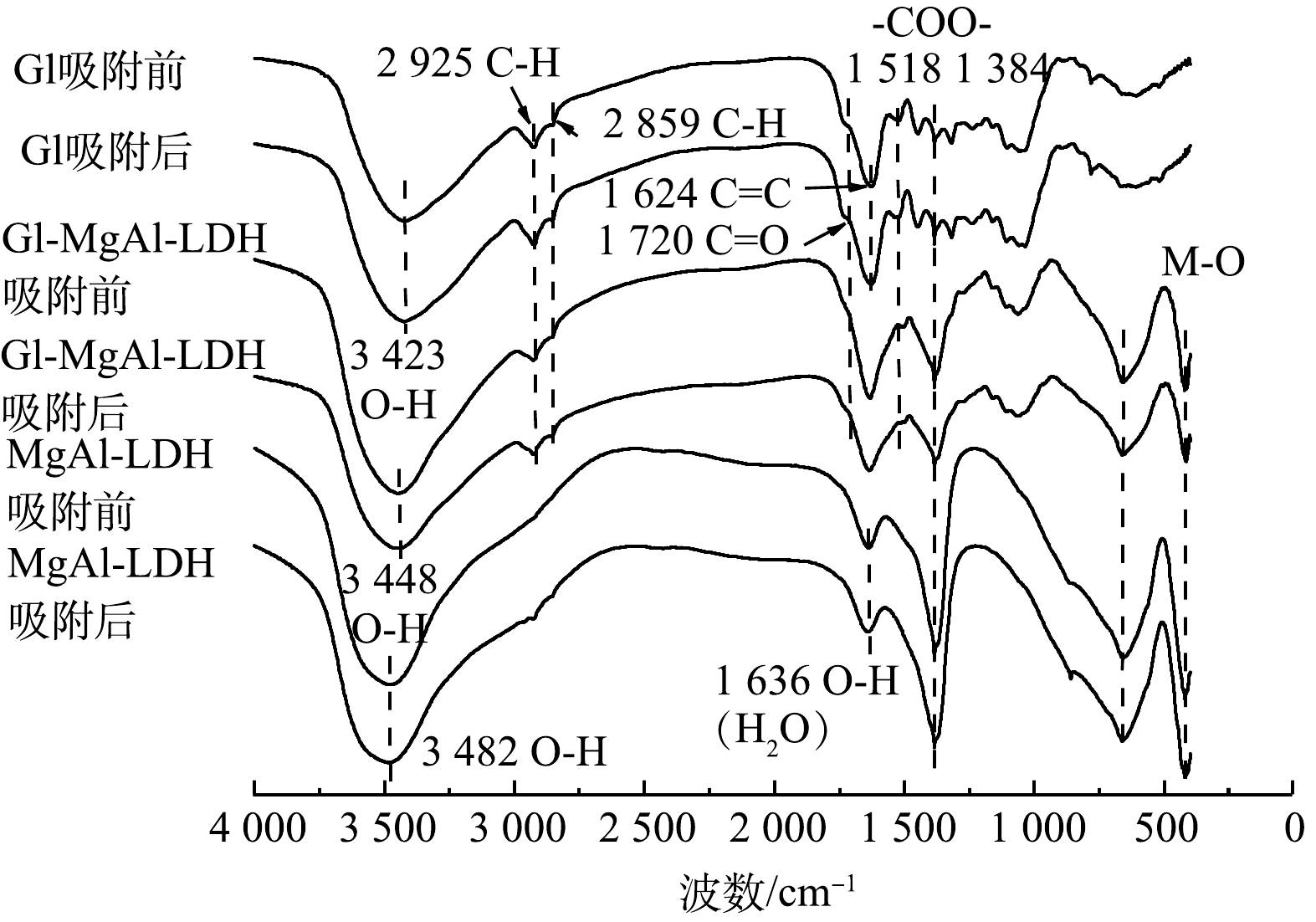
2) FT-IR分析。 由图6中的FT-IR图谱可以看出,Gl作为生物质材料有着丰富的官能团,其中在3 423 cm−1处出现O—H的宽峰,来源于分子间氢键的伸缩振动。这表明Gl中含有大量含有羟基的高分子化合物[6-8]。2 925 cm−1和2 859 cm−1处的谱带为C—H键引起的CH2对称伸缩振动。1 624 cm−1的尖峰为芳香化合物的C=C骨架振动造成的,同时在780 cm−1处出现了芳香族C—H键的面外弯曲振动峰,说明Gl中含有丰富的以木质素为主的芳香族聚合物[6-7]。出现在1 518 cm−1和1 384 cm−1谱带处的吸收峰归因于—COO—键,而1 720 cm−1处的肩峰应该为C=O键的伸缩振动峰,分布在1 000~1 300 cm−1内的峰则是C—O键的伸缩振动峰,证实了Gl中有着丰富的羧基及羟基。此外,也有研究[18]表明,Gl也含有丰富的醛和酮类等有机物。随着MgAl-LDH的加入,LDH中大量的氢氧根导致Gl/MgAl-LDH的O—H峰发生偏移和变化,1 384 cm−1处的变化为LDH中的CO32-的加入导致的[10],1 636 cm−1处峰的偏移则是因为LDH中夹层结晶水带来的影响[17],同时在660 cm−1和421 cm−1处出现了LDH的特殊金属骨架M—O的振动峰,这些均证明了LDH的成功复合。对比复合前后Gl中1 720 cm−1处代表的C=O峰消失,并且1 518 cm−1谱带的—COO—峰偏移至1 502 cm−1且有所减弱,1 105 cm−1及1 035 cm−1谱带处的C—O峰也出现一定程度的减弱。这些变化表明复合的机理可能是Mg2+、Al3+与羟基和羧酸基团发生有机络合反应形成化学键,从而使类LDH构筑到Gl上。
吸附Cd2+之后可以看到Gl/MgAl-LDH的O—H峰以及1 384 cm−1谱带处的—COO—峰均出现了明显的减弱,比较MgAl-LDH吸附前后也出现了此现象,原因可能为Gl/MgAl-LDH通过复合得到的OH−和CO32-和Cd2+发生吸附沉淀作用[10]。同时421 cm−1处M—O峰偏移至412 cm−1处,可能与Cd2+与LDH中的Mg2+发生同晶取代有关。1 720 cm−1和1 061 cm−1处的有机官能团峰也出现了少量的减弱和偏移,结合Gl吸附前后的光谱变化证明有机官能团的有机络合作用对Cd2+的吸附也起到了一些作用。
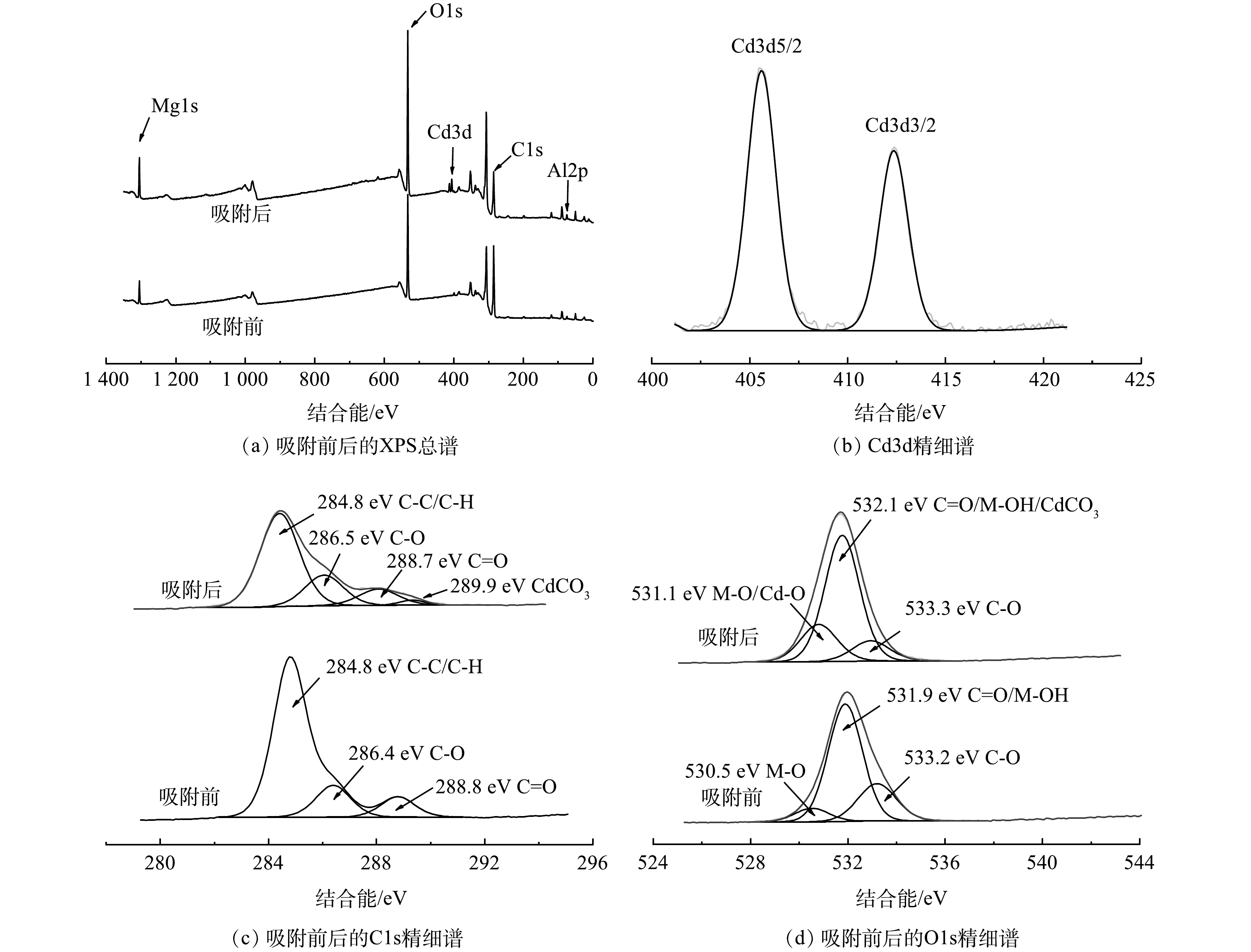
3) XPS分析。 从XPS图谱(图7(a))可以看出,Gl/MgAl-LDH吸附Cd2+后谱带上出现了Cd元素谱峰。图7(b)为Cd元素的精细谱扫描,可以看到明显的3d轨道双峰,证实Cd2+被成功吸附到Gl/MgAl-LDH上[17,19]。分别对吸附前后的C和O元素进行精细谱扫描,拟合后在286.4 eV、533.2 eV和288.8 eV、531.9 eV处确认了C—C和C=O等有机官能团谱峰(图7(c)~(d)),证明Gl/MgAl-LDH含有大量有机聚合物。同时O1s的谱图中出现金属氢氧化物和金属氧化物的谱峰,证明Gl/MgAl-LDH同时含有LDH。
吸附Cd2+后,C1s谱图中在289.9 eV处出现了金属碳酸盐的谱峰,原因为Gl/MgAl-LDH中的类水滑石夹层里的CO32-与Cd2+反应生成了CdCO3。结合C1s和O1s的谱图,观测到吸附之后C—O和C=O的谱峰均有一定程度减弱,同时M—O谱峰出现了增强,原因可能为Gl/MgAl-LDH上的有机官能团与Cd2+之间发生络合反应,这与FT-IR的结果一致。综上所述,Gl/MgAl-LDH的吸附机理主要为吸附沉淀和有机络合。
-
1)使用番石榴树叶生物质和镁铝类水滑石复合制备了一种环保的新型吸附剂Gl/MgAl-LDH,表征结果表明,经过复合后MgAl-LDH成功构筑到Gl上,改变了Gl的表面特征并提升了比表面积,同时Gl/MgAl-LDH含有丰富的有机官能团。
2) Gl/MgAl-LDH能有效吸附溶液中的Cd2+,在20 mg·L−1的Cd2+溶液中60 min时即可达到吸附平衡,吸附量为37.50 mg·g−1,高于MgAl-LDH和Gl。Gl/MgAl-LDH对Cd2+的吸附过程符合拟二级动力学模型及Freundlich模型,最大吸附量达到68.43 mg·g−1。
3)表征结果表明Cd2+被成功吸附到Gl/MgAl-LDH上,Gl/MgAl-LDH去除Cd2+的主要机理包括吸附沉淀以及有机络合作用。
番石榴树叶/镁铝类水滑石复合材料对镉的吸附性能及机制
Adsorption performance and mechanism of cadmium by guava leaf/MgAl-LDH composites
-
摘要: 采用共沉淀法将番石榴树叶(guava leaf,Gl)和镁铝类水滑石(MgAl-layered double hydroxide, MgAl-LDH)复合得到一种环保的新型复合吸附剂Gl/MgAl-LDH,并将其用于吸附溶液中的镉(cadmium,Cd)。通过吸附动力学、等温吸附探究了Gl/MgAl-LDH对Cd2+的吸附性能,并使用各种表征手段探究了材料的理化性质及吸附机理。结果表明,Gl/MgAl-LDH在60 min时即可达到吸附平衡,吸附量为37.50 mg·g−1,高于MgAl-LDH和Gl。Gl/MgAl-LDH对Cd2+的吸附过程符合拟二级动力学模型及Freundlich模型,最大吸附量为68.43 mg·g−1。表征结果表明LDH通过金属离子与Gl上的有机官能团发生络合反应,成功构筑到Gl表面。Gl/MgAl-LDH吸附后的XPS图谱中出现了Cd元素的谱峰,证实了Cd2+被有效吸附到材料表面。Gl/MgAl-LDH去除Cd2+的主要机理为吸附沉淀和有机络合。以上研究结果可为生物质作为吸附剂的资源化利用提供参考。Abstract: An environmentally friendly and novel composite adsorbent, Gl/MgAl-LDH, was obtained by Guava leaf (Gl) and MgAl-Layered double hydroxide (MgAl-LDH) composite with a co-precipitation method, and Gl/MgAl-LDH was used to adsorb cadmium (Cd) in solution. The adsorption performance of Gl/MgAl-LDH towards Cd2+ was investigated by adsorption kinetics and isotherm, its properties and adsorption mechanism were studied by different characterization instruments. The experimental results showed that Gl/MgAl-LDH could reach the adsorption equilibrium at 60 min, and the adsorption amount was 37.50 mg·g−1, which was higher than that of MgAl-LDH or Gl. Adsorption process of Cd2+ onto Gl/MgAl-LDH conformed to the proposed secondary kinetic and Freundlich models with a maximum adsorption amount of 68.43 mg·g−1. Characterization results showed that the complex reaction occurred between metal ions on LDH and organic functional groups on Gl, and LAD was successfully anchored on Gl surface. The appearance of the spectral peaks of elemental Cd in the XPS spectra of the adsorbed Gl/MgAl-LDH confirmed the effective adsorption of Cd2+ onto the material. The main mechanisms of Cd2+ removal by Gl/MgAl-LDH were adsorption precipitation and organic complexation. The results of this study provide a reference for the resource utilization of biomass as an adsorbent.
-
Key words:
- adsorption /
- biomass /
- MgAl-LDH /
- composites /
- cadmium /
- resource utilization
-

-
表 1 Gl/ MgAl-LDH、MgAl-LDH及Gl的表面性质
Table 1. Surface properties of Gl/ MgAl-LDH, MgAl-LDH and Gl
吸附剂 比表面积/(m2·g−1) 孔容/(cm3·g−1) 孔径/nm Gl/MgAl-LDH 42.41 0.23 21.57 MgAl-LDH 92.10 0.54 23.37 Gl 1.68 0.01 17.39 表 2 Gl/ MgAl-LDH、MgAl-LDH以及Gl吸附Cd2+的动力学拟合
Table 2. Kinetic fitting of Cd2+ adsorption by Gl/MgAl-LDH, MgAl-LDH and Gl
吸附剂 拟一级动力学 拟二级动力学 Elovich k1/(min−1) qe/(mg·g−1) R2 k2/(g·(mg·min)−1) qe/(mg·g−1) R2 A k3 R2 Gl/MgAl-LDHs 0.67 37.10 0.894 0.04 37.95 0.997 29.11 1.87 0.794 MgAl-LDHs 0.10 27.07 0.878 0.01 28.85 0.973 7.55 4.00 0.989 Gl 0.17 13.78 0.985 0.02 14.37 0.970 7.67 1.24 0.766 表 3 Gl/ MgAl-LDH、MgAl-LDH及Gl吸附Cd2+的等温吸附拟合
Table 3. Isothermal adsorption fitting of Cd2+ adsorption by Gl/MgAl-LDH, MgAl-LDH and Gl
吸附剂 Langmuir Freundlich qm/(mg·g−1) kL/(L·mg−1) R 2 kF/(mg·g−1) 1/n R 2 Gl/MgAl-LDH 64.14 1.49 0.843 35.63 0.16 0.983 MgAl-LDH 81.34 0.04 0.911 9.33 0.46 0.985 Gl 27.42 0.08 0.931 0.33 0.12 0.997 -
[1] CHEN J X, HUANG H, ZHANG C L, et al. The mechanism of Cd sorption by silkworm excrement organic fertilizer and its effect on Cd accumulation in rice[J]. Journal of Soils and Sediments, 2022, 22: 2184-2195. doi: 10.1007/s11368-022-03208-w [2] PYRZYNSKA K. Removal of cadmium from wastewaters with low-cost adsorbents[J]. Journal of Environmental Chemical Engineering, 2019, 7(1): 102795. doi: 10.1016/j.jece.2018.11.040 [3] 贾郁菲, 陈宏坪, 李婧, 等. 甲壳生物质去除酸性矿坑水中镉的性能与机制[J]. 环境工程学报, 2024, 18(1): 189-196. doi: 10.12030/j.cjee.202310069 [4] LEE S Y, CHOI H J. Persimmon leaf bio-waste for adsorptive removal of heavy metals from aqueous solution[J]. Journal of Environmental Management, 2018, 209: 382-392. [5] 刘栖萍, 王贵胤, 张世熔, 等. 铅、镉污染废水树皮类吸附材料的筛选[J]. 环境化学, 2020, 39(4): 1105-1115. doi: 10.7524/j.issn.0254-6108.2019110501 [6] ABDELWAHAB O, FOUAD Y O, AMIN N K, et al. Kinetic and thermodynamic aspects of cadmium adsorption onto raw and activated guava(Psidium guajava)leaves[J]. Environmental Progress & Sustainable Energy, 2015, 34(2): 351-358. [7] MITRA T, DAS S K. Cr(VI) removal from aqueous solution using Psidium guajava leaves as green adsorbent: column studies[J]. Applied Water Science, 2019, 9(7): 153. doi: 10.1007/s13201-019-1029-2 [8] BEHERA U S , MISHRA P C , RADHIKA G B . Optimization of multiple parameters for adsorption of arsenic (III) from aqueous solution using Psidium guajava leaf powder[J] Water Science & Technology. 2022, 85(1): 515. [9] CAO Y H, ZHENG D J, ZHANG F, et al. Layered double hydroxide (LDH) for multi-functionalized corrosion protection of metals: A review[J]. Journal of Materials Science & Technology, 2022, 102: 232-263. [10] SHAN R R, YAN L G, YANG K, et al. Adsorption of Cd(II) by Mg–Al–CO3- and magnetic Fe3O4/Mg–Al–CO3-layered double hydroxides: Kinetic, isothermal, thermodynamic and mechanistic studies[J]. Journal of Hazardous Materials, 2015, 299: 42-49. doi: 10.1016/j.jhazmat.2015.06.003 [11] ZHONG K, ZHANG C L, REN S W, et al. Remediation of soil in a deserted arsenic plant site using synthesised MgAlFe-LDHs[J]. Bulletin of Environmental Contamination and Toxicology, 2021, 107(1): 167-174. doi: 10.1007/s00128-021-03189-5 [12] TAN Y H, YIN X Q, WANG C Y, et al. Sorption of cadmium onto Mg-Fe Layered Double Hydroxide (LDH)-Kiwi branch biochar[J]. Environmental Pollutants and Bioavailability, 2019, 31(1): 189-197. doi: 10.1080/26395940.2019.1604165 [13] LIAO W, ZHANG X, SHAO J G. Simultaneous removal of cadmium and lead by biochar modified with layered double hydroxide[J]. Fuel Processing Technology, 2022, 235: 107389. doi: 10.1016/j.fuproc.2022.107389 [14] SING K S W. Reporting physisorption data for gas/solid systems with special reference to the determination of surface area and porosity (Recommendations 1984)[J]. Pure & Applied Chemistry, 1985, 57(4): 603-619. [15] JUANG R S, CHEN M L. Application of the Elovich equation to the kinetics of metal sorption with solvent-impregnated resins[J]. Industrial & Engineering Chemistry Research, 1997, 36(3): 813-820. [16] 曹青青. 类水滑石/生物炭复合材料对镉和苯酚污染土壤的修复研究[D]. 南京: 东南大学, 2020. [17] SHI M, ZHAO Z J, SONG Y R, et al. A novel heat-treated humic acid/MgAl-layered double hydroxide composite for efficient removal of cadmium: Fabrication, performance and mechanisms[J]. Applied Clay Science, 2020, 187: 105482. doi: 10.1016/j.clay.2020.105482 [18] 陈欣怡, 黄积武, 李创军, 等. 番石榴叶乙醇提取物的化学成分研究[J]. 药学研究, 2021, 40(7): 432-436. [19] LYU P, LI L F, HUANG X Y, et al. Pre-magnetic bamboo biochar cross-linked Ca Mg Al layered double-hydroxide composite: High-efficiency removal of As(III) and Cd(II) from aqueous solutions and insight into the mechanism of simultaneous purification[J]. Science of the Total Environment, 2022, 823: 153743. doi: 10.1016/j.scitotenv.2022.153743 -




 下载:
下载: