-
城市化持续快速的推进,导致了不透水面积显著增加,从而引发城市水文的变化,严重的影响了水质和径流状况[1-2]。由于大量的污染物随着雨水径流排放到水体,城市雨水已成为城市河湖水质恶化的主要污染源[3]。水生生态系统中过量的氮输入将导致水体富营养化,最终会改变生态群落结构,降低生境质量,增加“藻华”事件的发生率和持续时间[4-5]。人工湿地(CWs)污水处理技术具有建造成本投入低、设施后期维护便捷、景观效果明显等优点,被广泛用于各类型污水的小型化和分散化处理。
国内外对CWs的研究已经很多,对CWs的除氮技术也在逐渐优化,单纯的处理工艺往往导致人工湿地的除氮效果不好,潮汐流(TF)和潜流(SF)CWs组合形成的好氧和厌氧环境[6-7],有利于氮进行硝化和反硝化反应,从而达到对氮的去除,可防止处理后的污水排入环境导致水体“富营养化”。CWs中的氮通过植物的吸收作用、基质的过滤和吸附、氨挥发、微生物的氨化、硝化反硝化和厌氧氨氧化等方式被去除[8]。研究表明,填料基质和植物作用所做的贡献仅占CWs脱N量的20%—30%[9]。ZHANG等[10]研究发现,微生物参与的硝化反硝化作用是CWs去除废水中TN的主要途径,可占66.9%—80.5%。DU等[11]研究发现,植物种植增加了微生物的丰富度和生物多样性;同时,相关的反硝化属假单胞菌、不动杆菌、根瘤菌、芽孢杆菌和红假单胞菌丰度的增加,增强了微生物对氮的去除作用。HE等[12]研究发现,γ–变形菌、α–变形菌和β–变形菌是人工湿地基质中的主要细菌,并在减少硝酸盐和亚硝酸盐的功能上发挥了重要作用。但是,现有的研究缺少潮汐流人工湿地污染物的去除途径和微生物群落相结合的分析,以及植物的种植对微生物群落以及微生物氮净化作用的影响分析。
本研究构建潮汐流和潜流人工湿地组合,采用工业废弃物—赤泥制成的颗粒作为基质,种植黄菖蒲作为净水植物,分析该潮汐流-潜流人工湿地组合对氮的去除效果以及微生物群落的变化,探讨水生植物和微生物群落对氮去除效果的影响,以期为人工湿地强化脱氮提供科学依据。
-
实验基质所用赤泥取自山西省吕梁市华兴铝业有限公司,取回后自然风干。将其研磨成粉,过100目筛,保存于干燥处。赤泥颗粒的具体实验方法:将过100目筛的赤泥和水泥粉末按照3∶7的比例混合,再加入2.5%的起泡剂,加入去离子水充分搅拌后放入模具中,放室温条件下养护24 h。自然晾干后取出赤泥块放于温度22℃、相对湿度≥ 90%的数控水泥砼标准养护箱中,28 d后取出,将其切割成粒径为10—20 mm的颗粒。
-
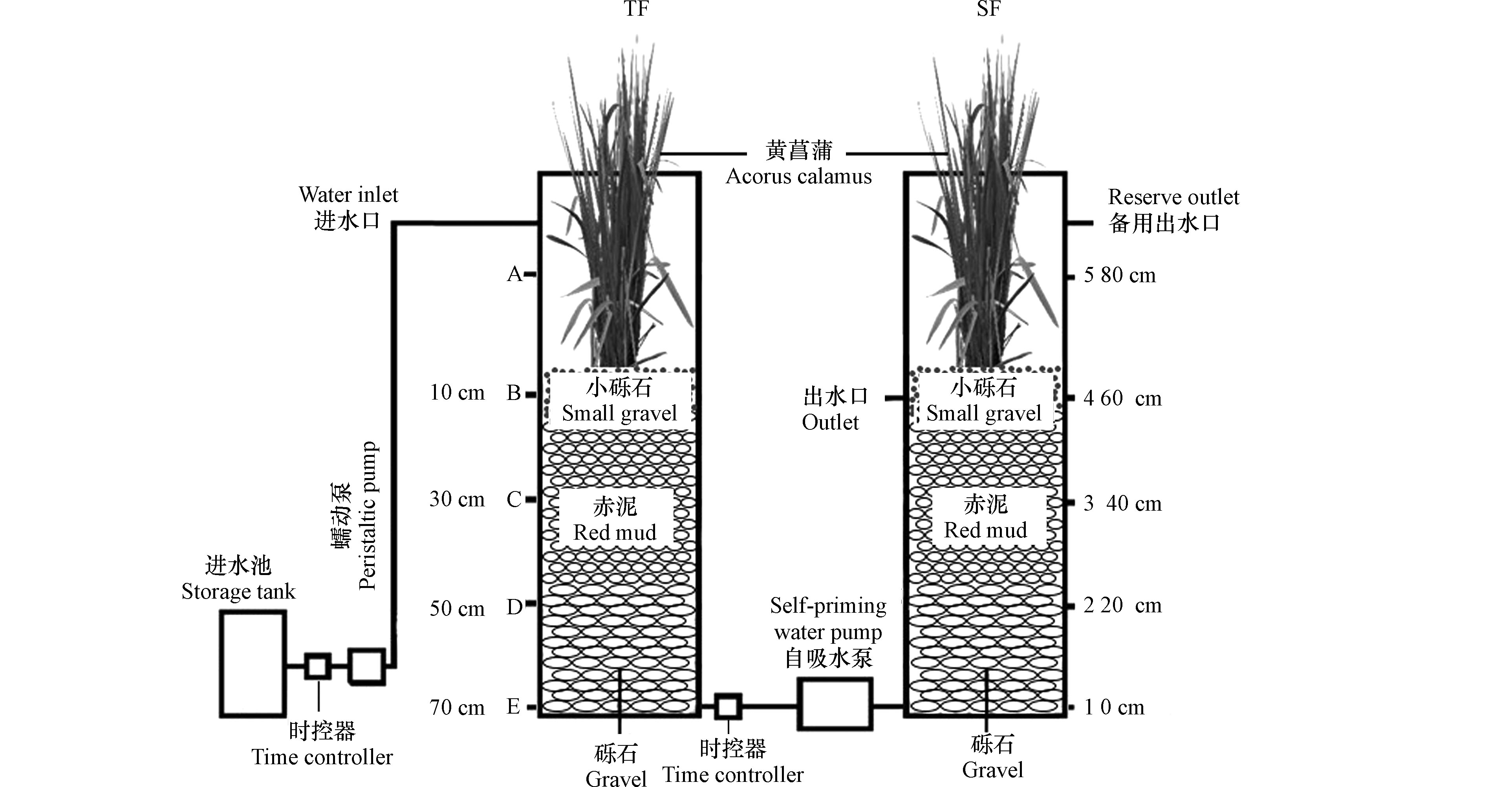
本实验中人工湿地模型工艺组合(TF–SF)由潮汐流湿地单元(TF)和潜流湿地单元(SF)组成(图1)。在装置运行上,TF采用间歇进水和瞬间排水,SF采用瞬间进水和缓慢排水,并且进水和排水同时进行,以保证基质始终处于淹没状态。用两台蠕动泵控制TF单元进水,进出水方式为下行流,PLC时控器负责定时调控装置的进出水;SF单元采用上行流方式进水,进水由自吸水泵控制。在TF单元,自上而下取样(10—70 cm),SF单元自下而上取样(0—40 cm)。TF-SF由两个亚克力圆柱体组成。圆柱体直径为30 cm,高度为100 cm,体积约为70 L。装置的填料高65 cm(底部为Ф25—50 mm砾石,厚度为25 cm;中部为Ф10—20 mm赤泥颗粒,厚度为30 cm;上部Ф2—5 mm砾石,厚度为10 cm),在潮汐流人工湿地单元和潜流人工湿地单元最上部砾石层种植黄菖蒲水生景观植物。为了植被的光合作用,在两个湿地单元上均设有30 W的节能灯作为补充光照,灯光由PLC时控器定时调控,光照时间为每天的6:30—18:30。
TF单元运行方式为:瞬时进水0.33 h—反应期4.82 h—瞬时排水0.05 h—闲置期5.80 h,每个周期12 h,每天2个周期,每个周期处理水量为10 L。SF单元运行方式为:瞬间进水和缓慢排水,且进水和排水同时进行,处理水量为10 L,水力停留时间为11.95 h。2019年7月启动反应器,实验室温度为18—25 ℃,实验用水为人工模拟污水,由葡萄糖、氯化铵、磷酸二氢钾配制,同时投加无水氯化钙、硫酸镁、FeSO4·7H2O等补充微量元素,污水pH为4.81—6.42。其他主要水质指标见表1。反应器进行为期2个月的微生物挂膜,直到出水稳定后,开始正式实验。
-
CODcr、TN、
${\rm{NH}}_4^{+} $ -N、${\rm{NO}}_3^{-} $ -N等指标的测定按照国家环境总局编著的《水和废水监测分析方法(第四版)》[13]进行。 -
种植植物前,测定用于实验的植物生物量,供后续计算使用。植物高度在实验运行的全过程中进行长期测量,以观察植物长势,实验结束后,对湿地植物进行收割,分为地上、地下两部分,测定植物生物量、根长[14]。在实验的开始和结束时测定植物的湿重W1(g),挑选代表性的植株样品在105 ℃下干燥10 min,以灭活植物中酶的活性,然后在70 ℃下干燥12 h,测定干重W2(g),将植物粉碎成粉末(过40目筛),混合均匀并密封保存,采用H2SO4-H2O2溶液消解,采用半微量凯氏法测定植物全氮[14]。
植物氮积累量(PA),单位为mg·株−1,计算公式如下:
式中,PA为植物氮积累量(mg·株−1),PB为植物不同器官生物量(g·株−1),PC为植物不同器官全氮含量(mg·g−1)。
-
通过OMEGA Soil DNA试剂盒提取基质中微生物DNA。使用通用细菌引物16S rRNA的5′–ACTCCTACGGGAGGCAGCAG–3′和5′–GGACTACHVGGGTWTCTAAT–3′(V3—V4区)对提取的DNA进行PCR扩增。PCR扩增条件:98 ℃(3 min)初始变性,然后进行25个循环,98 ℃变性30 s,50 ℃退火30 s,72 ℃延伸30 s,最后5 min延伸至72 ℃。将所有序列读数聚类到操作分类单位(OTU)(相似性阈值为97%)。高通量测序服务由上海美吉生物平台提供(上海,中国)。
-
实验数据使用Microsoft Excel 2010统计分析,数据图使用Origin 2015软件进行绘制。
-
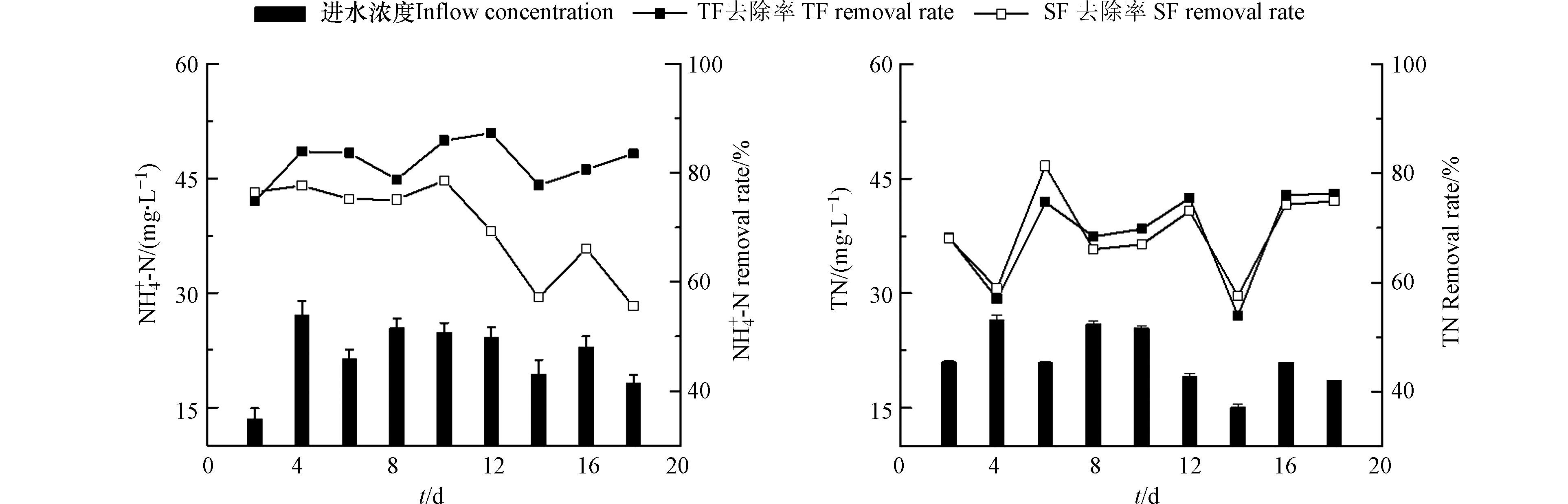
TF–SF的进水TN含量为15.12—26.54 mg·L−1,平均TN含量为21.52 mg·L−1(图2);潮汐流人工湿地单元(TF)出水的TN去除率为53.96%—76.22%,平均去除率为68.88%;TF–SF的出水TN去除率为57.52%—81.29%,平均去除率为68.99%。TF–SF进水的
${\rm{NH}}_4^{+} $ -N含量为13.51—27.09 mg·L−1,平均含量为21.86 mg·L−1;TF出水的${\rm{NH}}_4^{+} $ -N去除率为74.80%—87.26%,平均去除率为81.79%;TF–SF出水的${\rm{NH}}_4^{+} $ -N去除率为55.59%—78.59%,平均去除率为70.12%。在TF–SF中,SF对${\rm{NH}}_4^{+} $ -N的去除没有起到促进作用,反而其出水的${\rm{NH}}_4^{+} $ -N含量高于其进水。${\rm{NH}}_4^{+} $ -N和TN表现出相似的去除趋势,这是因为${\rm{NH}}_4^{+} $ -N是进水中氮的主要来源,${\rm{NH}}_4^{+} $ -N经过硝化-反硝化作用去除,说明人工湿地有较强的反硝化作用。TF的运行方式可将氧气带入装置,进而提高氮的去除效果。随着运行时间的增加,TF–SF的
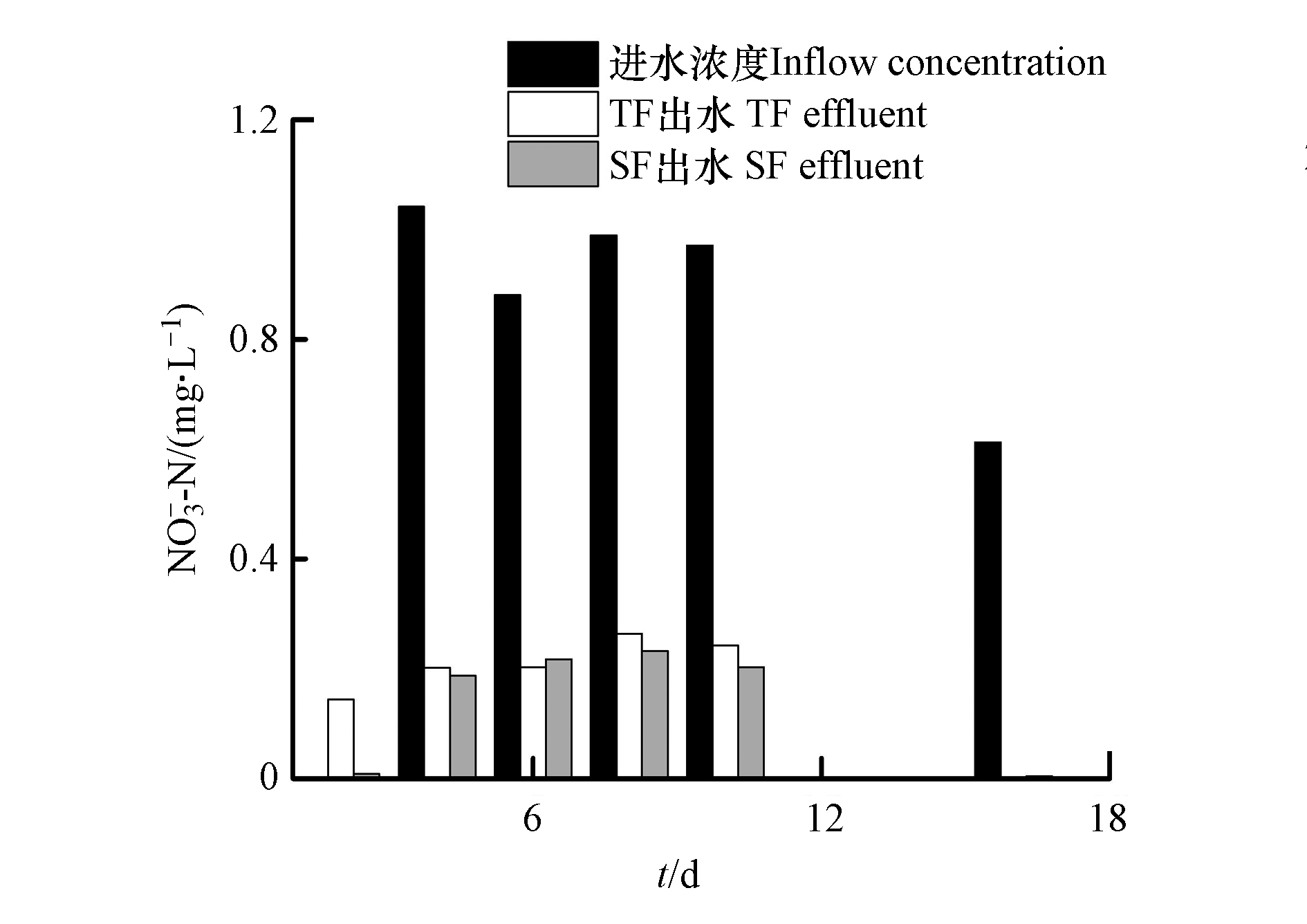
${\rm{NH}}_4^{+} $ -N去除率越来越低。这是由于SF的运行方式为快速进水和缓慢排水,一直处于充满水的状态,其氧含量过低,硝化强度相比TF较低,仅发生在SF的上部;且基质对${\rm{NH}}_4^{+} $ -N的吸附作用,致使一部分${\rm{NH}}_4^{+} $ -N留存在SF中。随着运行时间的增加,${\rm{NH}}_4^{+} $ -N残留量越来越高,从而使得SF出水${\rm{NH}}_4^{+} $ -N含量越来越高。基于以上现象,应在装置运行一段时间后,进行停床处理,排空TF–SF内的水,使得系统内留存的氨氮能够与空气接触,减小TF–SF内${\rm{NH}}_4^{+} $ -N的留存量。另需对装置进行改良,对SF进水补充适量碳源,提高污水的停留时间,为该单元发挥反硝化作用提高能量。${\rm{NH}}_4^{+} $ -N为进水主要氮源形态,${\rm{NO}}_3^{-} $ -N是在硝化反应过程中生成的(图3)。TF–SF进水${\rm{NO}}_3^{-} $ -N含量为0—1.04 mg·L−1,平均值为0.50 mg·L−1;TF出水${\rm{NO}}_3^{-} $ -N含量为0—0.26 mg·L−1,平均值为0.12 mg·L−1;TF–SF出水的${\rm{NO}}_3^{-} $ -N含量为0—0.23 mg·L−1,平均含量为0.09 mg·L−1。在TF–SF中,TF和SF出水的${\rm{NO}}_3^{-} $ -N含量均很小,均低于1.0 mg·L−1,有些甚至浓度为零,整体呈不规律的变化。在TF–SF中,TF在第2天出水的${\rm{NO}}_3^{-} $ -N浓度明显增加,而SF中又降低,说明TF中发生了硝化反应,SF中发生了反硝化作用。在TF–SF运行的第4—10天和第16天,TF和SF出水浓度都低于进水,说明TF内发生了反硝化作用。在TF中,出水${\rm{NO}}_3^{-} $ -N含量低于进水,说明TF中发生了同步硝化—反硝化[15]。TF在充满水的状态下,${\rm{NH}}_4^{+} $ -N主要通过填料或生物膜的吸附作用被消耗;微生物的硝化作用主要发生在TF处于空置的状态时,此时大气中的O2进入基质的孔隙间,与基质表面的生物膜发生接触,此时${\rm{NH}}_4^{+} $ -N转化成${\rm{NO}}_3^{-} $ -N。与SF相比,TF单元表现出更好的
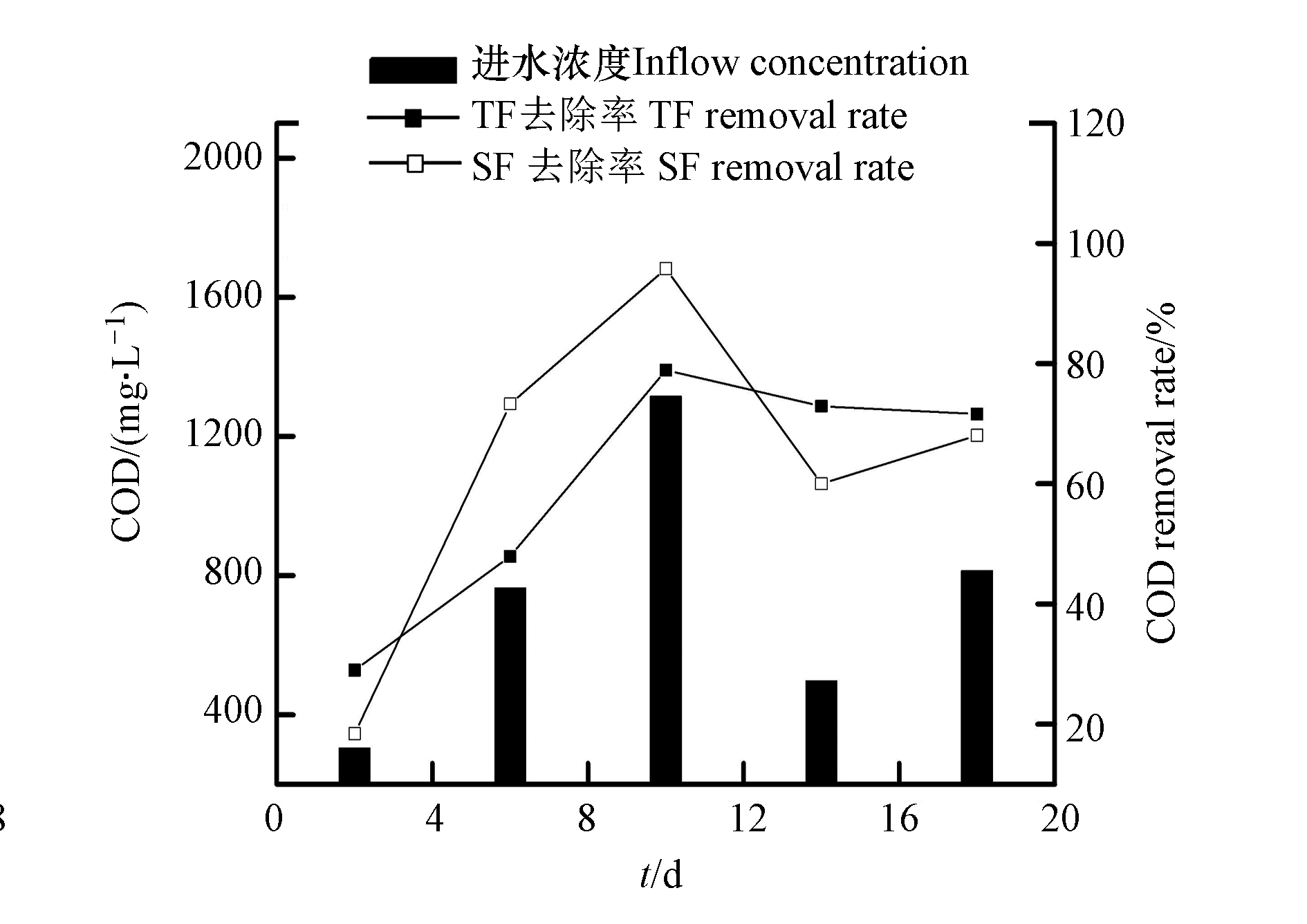
${\rm{NO}}_3^{-} $ -N去除效果。其原因是,在TF中,首先发生了除氮的第一步—硝化反应,生成了${\rm{NO}}_3^{-} $ -N,其中消耗了大部分可用碳源;在水进入到SF中,虽SF为缺氧和厌氧环境,有利于反硝化作用的发生,但因其可利用碳源含量少,缺少反硝化作用所需的能量。反硝化细菌多为异养细菌,污水中有机碳源的含量制约着反硝化细菌的生长繁殖,从而影响了反硝化作用,有机碳浓度较低会使NO3−-N的去除效果表现较差[16]。微生物吸收、基质过滤以及植物根系截留为人工湿地系统中有机物的主要去除途径,在对有机物的去除中,植物的贡献较小,可溶性有机物通过在淹水过程中与基质表面的微生物膜接触反应被消耗分解,不溶性有机物通过基质截留后在排空阶段、系统充氧时被微生物降解[17]。TF–SF进水的COD含量为304.72—1315.83 mg·L−1,平均含量为739.31 mg·L−1;TF出水的COD去除率为29.01%—78.91%,平均去除率为60.07%;TF–SF出水的COD去除率为38.43%—95.80%,平均去除率为67.12%(图4),说明TF–SF对有机物具有较好的去除效果。在TF–SF中,TF和SF都对有机物较好的去除。TF独特的间歇进水和瞬时排水的潮汐运行模式下,基质上附着的有机物在TF空置时被硝化作用利用,减少了COD含量。TF–SF进水的COD浓度变化较大,这是由于本实验进水配置采用葡萄糖作为碳源,4 d配置1次,葡萄糖在室温下易挥发[18],使得进水COD含量变化较大。
TF–SF中第2天的COD去除率较低,是因为TF–SF进水的COD含量较低,进水中可利用的碳源较低。然而,第2天的
${\rm{NH}}_4^{+} $ -N和TN的去除率却没有表现的很差,这是因为TF–SF刚培养完微生物,系统内能量充足,硝化反应所需能量系统内可提供,从而在进水COD含量较小的情况下也表现出较高的除氮效果。在TF–SF运行的第6—10天,SF对COD的去除发挥了一定作用,说明SF利用进水中的碳源发生了反硝化作用,使得装置的除氮效果表现较好。随着运行时间的增加,SF逐渐对COD的去除不发挥作用,且SF中COD的含量高于TF,可能是由于基质对有机物的吸附作用,部分COD残留在SF中,致使SF出水的COD含量高于其进水。对此,应延长水体在装置内的停留时间,以提高其除氮效果,保证其长时间的稳定运行。实验期间,进水和出水的pH、溶解氧(DO)的平均值如表2所示。与进水DO相比,在TF–SF中,TF和SF的出水DO浓度都下降了6.74—7.48 mg·L−1。这是因为微生物去除COD和氨氧化过程中消耗了水体中的DO。在TF中,好氧微生物利用进水中的溶解氧以及从大气携带进入的O2发生硝化反应,使得DO浓度降低;SF中的DO含量更低,说明SF单元为缺氧和厌氧环境,进行反硝化作用,可弥补TF由于氧含量高导致反硝化作用不好的缺点,可提高氮的去除率。
在TF和SF中,硝化反应和反硝化反应的进行需要一定的碱性环境来维持系统内pH的缓冲性能。由于赤泥呈强碱性(pH=10—12),本实验设计时将进水配置呈弱酸性。在前期的培养实验中,基质的碱性被进水中和,装置内呈弱酸环境(表2)。因此,不适合的pH环境减弱了基质表面微生物的活性,导致对氮的去除效果降低。在今后的研究中,需注意进水的pH值。
-
TF–SF的微生物多样性和丰富度见表3,采用Alpha多样性分析方法对TF–SF中细菌的多样性进行分析。在TF–SF中,TF和SF的微生物测序中样本文库覆盖率均大于0.99,说明测序结果能够代表湿地的真实情况[19]。TF–10(即TF中10 cm处理深度)、TF–30(即TF中30 cm处理深度)和SF–60(即SF中60 cm处理深度)的Ace指数分别为1587.47、1514.32、1550.49,Chao指数分别为1556.43、1499.46和1526.75,TF–10和SF–60的Ace指数和Chao指数均大于TF–30;TF–10、TF–30和SF–60的Shannon指数分别为5.54、5.23和5.59,Simpson指数分别为0.0110、0.0189和0.0109,TF–10和SF–60的Shannon指数均大于TF–30,且TF–30的Simpson指数最大,因为TF–10和SF–60这两个取样点都在植物根系周围,说明人工湿地中种植植物可拥有更高的微生物群落丰富度和多样性,进而提高了人工湿地对氮的去除作用。植物根系分泌氧气和有机物,可促进微生物富集生长,所以种植植物可以提高微生物群落多样性。
-
TF–SF中微生物独有和共有的OTU数目。从图5可知,在TF–SF中,TF–10、TF–30和SF–60检测到的细菌OTU数目分别为1381、1279和1428,说明相比于SF,TF的运行方式会使装置内细菌的种类减少,一些不能适应TF内部厌氧—好氧环境交替出现的菌群会逐渐消亡,最终留存下来的菌群成为优势菌群。TF–SF中共有的OTU有981个,分别占TF–10、TF–30和SF–60检测到的OTU数目的71.04%、76.70%和68.70%,说明TF–SF中,TF–10和TF–30微生物群落不同,这是因为TF中植物根系周围具有富集微生物的作用;TF–10和SF–60微生物群落不同,是因为TF和SF不同的运行方式致使其氧环境不同。
TF–SF微生物门(Phylum)水平组成见图6(a)。可将微生物检测频率>1%的菌门作为主要的菌门[20]。共发现有9个菌门,分别为Proteobacteria(变形菌门)、Actinobacteria(放线菌门)、Chloroflexi(绿弯菌门)、Bacteroidota(拟杆菌门)、Firmicutes(厚壁菌门)、Patescibacteria(髌骨细菌门)、Acidobacteriota(酸杆菌门)、Nitrospirota(硝化螺旋菌门)、Myxococcota(粘球菌门),这9种菌门在TF-SF中3个取样点的相对丰度比例之和为94.35%—96.27%。
本研究中的主要优势菌门为变形菌门,其在生物脱氮的过程中具有重要作用,这与ZHANG等[21]、LI等[22]的研究结果一致,说明人工湿地基质具有相似的优势菌门。MIAO等[23]研究表明,变形菌门和厚壁菌门对反硝化作用有重要作用,硝化螺旋菌门含有丰富的硝化功能的菌属。变形菌门在TF–10、TF–30和SF–60的相对丰度分别为28.04%、30.12%和21.90%,厚壁菌门的相对丰度分别为7.68%、9.01%和3.73%,硝化螺旋菌门的相对丰度分别为1.22%、0.79%和2.22%,变形菌门和厚壁菌门在3个取样点的相对丰度表现为TF–30 > TF–10 > SF–60,这种趋势与各取样点的氮去除率一致。TF–30处变形菌门的相对丰度高于TF–10,但TF–30硝化螺旋菌门的相对丰度却低于TF–10,这是因为植物的种植改善了微生物的多样性。
TF–SF微生物纲(Class)水平组成见图6(b)。将微生物检测频率>1%的菌纲作为主要的菌纲,共发现15个菌纲。变形菌门中的γ–变形菌纲(Gammaproteobacteria)、α–变形菌纲 (Alphaproteobacteria) 在TF–SF中3个取样点的相对丰度占比分别为14.89%—22.81%、7.01%—7.94%。γ–变形菌纲和α–变形菌纲均属于革兰氏阴性菌,说明TF–SF中的基质富集了革兰氏阴性菌,促进了系统中污染物的生物降解。LI等[24-25]发现γ–变形菌在去除
${\rm{NO}}_3^{-} $ -N和${\rm{NO}}_2^{-} $ -N方面具有重要作用。γ–变形菌纲在3个取样点的相对丰度表现为TF–30 > TF–10 > SF–60,这种趋势与各取样点的氮去除率一致。 -
有关研究表明,不动杆菌属(Acinetobacter)、硫杆菌属 (Thiobacillus)和索氏菌属(Thauera)等具有反硝化作用,参与氮的转化[26-28]。硝化杆菌属(Nitrobacter)和硝化螺菌属(Nitrospira)具有硝化功能[29-30],亚硝化单胞菌属(Nitrosomonas)和亚硝化螺菌属(Nitrosospira)具有氨氧化功能[31]。另外,YAO等[32]研究表明,不动杆菌可通过异养来转化氮硝化和好氧反硝化。
TF–SF微生物属(Genus)水平组成见图6(c)。其中检测出相对丰度大于0.5%的菌属有71个,包括不动杆菌属、硝化螺菌属和亚硝化单胞菌属,以及其他未知属。TF–SF中硝化作用硝化螺菌属丰度(0.79%—2.22%)高于具有氨氧化细菌的亚硝化单胞菌属(0.12%—0.52%)。某些硝化螺菌属能将
${\rm{NH}}_4^{+} $ -N完全氧化成${\rm{NO}}_3^{-} $ -N,这可能是TF–SF有较好氨氮去除效果的原因[33]。硝化螺菌属是常见的亚硝酸盐氧化菌[34],在TF–10、TF–30和SF–60中的丰度分别为1.22%、0.79%和2.22%,TF–10和SF–60中的硝化螺菌属丰度均高于TF–30,说明植物的种植有利于基质表面NO2−-N的氧化,从而提高了氨氮的去除效果。不动杆菌属是丰度最高的异养反硝化菌属,在TN去除过程中具有重要作用。不动杆菌属在TF–10、TF–30和SF–60中的丰度分别为1.15%、1.38%和0.07%,TF–30处不动杆菌的丰度最高,且此处的氮去除效果最好,说明不动杆菌丰度的增加是微生物氮去除率较高的原因。
-
黄菖蒲(学名:Iris pseudacorus L.)为鸢尾科、鸢尾属植物,为多年生湿生或挺水宿根草本植物,植株高大,根茎短粗,绿色长剑形叶,5—6月开黄色花[35]。实验所用黄菖蒲产自山东临沂,购买回幼苗后对其进行种植培养,使其适应生长环境。培养一段时间后,将植物移植到模型中。在移植到潮汐流-潜流人工湿地系统前,测量植物生物量,并选取相同高度的植物,测量其植物生物量和全氮含量。
在实验期间,实验室温度为15—22 ℃,是黄菖蒲的适生环境,植物地上部分颜色鲜亮,整个实验期间没有枯黄和枯萎的现象,植物均保持着良好的生长状态(表4)。TF内黄菖蒲的长势表现最好,株高、重量和根长也在整个系统中表现最大。TF在进水和排水空置床体时,氧气会进入到装置内,提高了植物根系周边环境的氧浓度,有利于根部细胞的有氧呼吸,促进根部生长,在生长过程中吸收水中的营养物质,从而表现出良好的长势。相比TF,SF内黄菖蒲的长势较差,其原因是潜流的运行方式使得植物周围氧浓度低,不利于植物根部的生长,也说明黄菖蒲能够在人工湿地中成活且长势良好。
黄菖蒲水生景观植物地上部分和地下部分的氮积累量均随着植物的生长而累积。人工湿地水生植物的氮积累量是评价水生植物对氮去除效果的重要指标[36]。TF–SF中黄菖蒲植物的氮积累量见表5。TF–SF中生长的黄菖蒲植物,对TN的累积作用以植株地上部分为主,黄菖蒲植物地上部分TN累积量占整株的42.74%—84.26%。研究表明,植物的收割方式由其体内营养物质的分配特点决定[37]。本研究结果表明,人工湿地植物内的氮可通过收割植物地上部分的方式来将氮移出人工湿地。其中,TF中黄菖蒲的地上部分TN累积量占整株比例为84.26%,SF中黄菖蒲的地上部分TN累积量占整株比例为77.64%。TF中种植的黄菖蒲植物氮积累量在相同生长时间内远大于SF,这与潮汐流人工湿地独特的运行方式密不可分。TF中充足的氧环境保障了植物根部细胞的有氧呼吸,使得植株生长健壮且生长迅速,表现出较高的植物生物量,从而具有较高的植物氮吸收量。
-
TF–SF的水力停留时间为11.95 h,运行周期为12 h时,对
${\rm{NH}}_4^{+} $ -N的去除大于TN,表明TF比SF对${\rm{NH}}_4^{+} $ -N具有更高的去除量。在TF–SF中,TF为好氧环境,SF为以厌氧和缺氧为主的环境,整个组合人工湿地为硝化—反硝化组合,使系统表现出较强的脱氮效果。TF–SF中微生物群落具有较高的丰富度和多样性,且黄菖蒲植物的种植可改善基质微生物的丰富度和多样性,并发现微生物丰富度和多样性的改善促进了微生物的除氮作用,使TF–SF表现出较好的脱氮效果。TF–SF中富集不动杆菌属、硝化螺菌属和亚硝化单胞菌属等优势硝化和反硝化菌属,这些菌属是人工湿地中主要的脱氮菌属,它们的增加是微生物氮去除率较高的原因。黄菖蒲能够在人工湿地中成活且长势良好,能够在我国华北地区种植。植物生物量直接影响植物体内氮积累量,植物的除氮效果优劣可直接通过生物量得出结论。在今后的人工湿地建造过程中,多选择像黄菖蒲这样的具有高生物量的植物种类,有利于水体净化效果的提高。黄菖蒲植物表现出较高的去除率与其发达的根系、试验期间生长量大有关,根系的分泌物有利于微生物的生长,促进降解物质的分泌,从而对水体中的氮具有较高的去除率。
本研究采用TF和SF的组合形式,SF在除氮过程中未起到太大作用,是由于实验设置的水力停留时间太短,以及SF中的进水COD含量太低,不利于反硝化作用的进行。仍需继续研究来寻找TF、SF及多种组合方式的最优运行参数。在今后人工湿地的除氮实验中,应使进水的pH值控制在7.0—8.0,保证人工湿地系统的稳定除氮效果。
潮汐流-潜流人工湿地对城市污染水体中氮的去除
Research on the removal effect of tidal flow–subsurface flow constructed wetland on nitrogen in urban polluted water
-
摘要: 为了探索人工湿地对城市污染水体的除氮效果,构建潮汐流(TF)与潜流(SF)人工湿地模拟组合(TF–SF),探讨水生植物和微生物群落对氮的去除效果的影响。结果表明,TF–SF对氨氮和总氮都有较好的处理效果,去除率分别为55.59%—78.59%和57.52%—81.29%。黄菖蒲地上部分氮积累量分别为195.05、111.18 mg·株−1,地下部分氮积累量分别为36.44、32.01 mg·株−1,黄菖蒲对污染水体中的氮去除发挥着重要作用。高通量测序分析表明,TF中黄菖蒲根部表现出较高的微生物丰富度、多样性,不动杆菌属、硝化螺菌属和亚硝化单胞菌属是人工湿地中主要的脱氮菌属,是氮去除的主要驱动者。
-
关键词:
- 潮汐流-潜流人工湿地 /
- 脱氮 /
- 黄菖蒲 /
- 微生物群落
Abstract: In order to explore the nitrogen removal effect of tidal flow-subsurface flow constructed wetlands on urban polluted water bodies, a simulation combination of tidal flow (TF) and subsurface flow (SF) constructed wetlands (TF–SF) was constructed and to explore the influence of aquatic plants and microbial communities on the removal of nitrogen. The results show that TF–SF has a good treatment effect on ammonia nitrogen and total nitrogen, and the removal rates are 55.59%—78.59% and 57.52%—81.29%, respectively. The nitrogen accumulation in the ground part of the acorus calamus was 195.05 mg·plant−1 and 111.18 mg·plant−1, respectively, and the nitrogen accumulation in the underground part was 36.44 mg·plant−1 and 32.01 mg·plant−1, respectively. The acorus calamus played an important role in the removal of nitrogen in polluted waters. High-throughput sequencing analysis showed that the roots of acorus calamus showed high microbial richness and diversity in TF. Acinetobacter, Nitrospirillum, and Nitrosomonas are the main denitrifying bacteria in constructed wetlands, and they are also the main driver of nitrogen removal. -

-
表 1 实验水质
Table 1. Experimental water quality
项目水质参数
Project water quality parameters初始浓度范围/(mg · L−1)
Initial concentration rangeCODcr 304.72—902.62 ${\rm{NH}}_4^{+} $ 13.51—27.09 TN 15.12—26.54 ${\rm{NO}}_3^{-} $ 0.00—1.04 表 2 潮汐流-潜流人工湿地的进出水参数
Table 2. Water inlet and outlet parameters of TF–SF
组别Group pH DO / (mg·L−1) 进水 Inflow 5.74 8.62 TF出水 TF effluent 5.61 1.88 TF–SF出水 TF–SF effluent 5.82 1.14 表 3 潮汐流-潜流人工湿地微生物多样性和丰富度
Table 3. Microbial diversity and richness in samples of TF–SF
组别Group 测序数量 Sequence number 丰富度指数 Richness index 多样性指数Diversity index 覆盖率Fraction of Coverage Sequences Sobs Ace Chao Shannon Simpson Coverage TFCW-10 45744 1381 1587.47 1556.43 5.54 0.0110 0.994 TFCW-30 41302 1279 1514.32 1499.46 5.23 0.0189 0.993 SFCW-60 49453 1428 1550.49 1526.75 5.59 0.0109 0.996 表 4 潮汐-潜流人工湿地黄菖蒲植物生长状况
Table 4. The growth status of yellow calamus in TF–SF
人工湿地
Constructed wetland地上部分Aboveground 地下部分Underground 株高/cm
Plant height鲜重/g
Fresh weight干重/g
Dry weight根长/cm
Root length鲜重/g
Fresh weight干重/g
Dry weight种植前 36.3 8.53 0.92 14.5 5.22 2.15 潮汐流 128.2 56.48 8.08 23.8 19.40 3.00 潜流 74.2 32.03 5.11 20.1 16.06 2.51 表 5 潮汐流-潜流人工湿地黄菖蒲植物氮积累量
Table 5. Nitrogen accumulation of acorus calamus in TF–SF
人工湿地
Constructed wetland植物生物量/g Plant biomass 植物氮积累量/(mg·株−1)Plant nitrogen accumulation 地上部分
Aboveground地下部分
Underground总净重
Total net weight地上部分
Aboveground地下部分
Underground总净重
Total net weight种植前 0.92 2.15 3.07 18.17 24.34 42.51 潮汐流 8.08 3.00 11.08 195.05 36.44 231.49 潜流 5.11 2.51 7.62 111.18 32.01 143.20 -
[1] O'SULLIVAN A D, WICKE D, HENGEN T J, et al. Life Cycle Assessment modelling of stormwater treatment systems [J]. Journal of Environmental Management, 2015, 149: 236-244. [2] ZHOU N Q, ZHAO S. Urbanization process and induced environmental geological hazards in China [J]. Natural Hazards, 2013, 67(2): 797-810. doi: 10.1007/s11069-013-0606-1 [3] WANG Y Q, XIAN C F, JIANG Y Q, et al. Anthropogenic reactive nitrogen releases and gray water footprints in urban water pollution evaluation: The case of Shenzhen City, China [J]. Environment, Development and Sustainability, 2020, 22(7): 6343-6361. doi: 10.1007/s10668-019-00482-6 [4] LUO L, DUAN N, WANG X C, et al. New thermodynamic entropy calculation based approach towards quantifying the impact of eutrophication on water environment [J]. Science of the Total Environment, 2017, 603/604: 86-93. doi: 10.1016/j.scitotenv.2017.06.069 [5] XU L, XU S L, HAN X Y, et al. Spatial heterogeneity and long-term dynamics of cladoceran ephippia in a monsoonal reservoir, driven by hydrology and eutrophication [J]. Journal of Paleolimnology, 2017, 58(4): 571-584. doi: 10.1007/s10933-017-9993-8 [6] 吕纯剑, 高红杰, 宋永会, 等. 潮汐流-潜流组合人工湿地微生物群落多样性研究 [J]. 环境科学学报, 2018, 38(6): 2140-2149. LÜ C J, GAO H J, SONG Y H, et al. Microbial community diversity in the combined tide flow-subsurface flow constructed wetland [J]. Acta Scientiae Circumstantiae, 2018, 38(6): 2140-2149(in Chinese).
[7] STOTTMEISTER U, WIEßNER A, KUSCHK P, et al. Effects of plants and microorganisms in constructed wetlands for wastewater treatment [J]. Biotechnology Advances, 2003, 22(1/2): 93-117. [8] 杨敦, 周琪. 人工湿地脱氮技术的机理及应用 [J]. 中国给水排水, 2003, 19(1): 23-24. doi: 10.3321/j.issn:1000-4602.2003.01.007 YANG D, ZHOU Q. Mechanism and application of nitrogen removal technology in constructed wetland [J]. China Water & Wastewater, 2003, 19(1): 23-24(in Chinese). doi: 10.3321/j.issn:1000-4602.2003.01.007
[9] 黄杉, 怀静, 吴娟, 等. 碳源补充促进人工湿地脱氮研究进展 [J]. 水处理技术, 2018, 44(1): 13-16. HUANG S, HUAI J, WU J, et al. Research progress of nitrogen removal promotion in constructed wetland system by carbon addition [J]. Technology of Water Treatment, 2018, 44(1): 13-16(in Chinese).
[10] ZHANG S N, XIAO R L, LIU F, et al. Effect of vegetation on nitrogen removal and ammonia volatilization from wetland microcosms [J]. Ecological Engineering, 2016, 97: 363-369. doi: 10.1016/j.ecoleng.2016.10.021 [11] DU L, TRINH X, CHEN Q R, et al. Enhancement of microbial nitrogen removal pathway by vegetation in Integrated Vertical-Flow Constructed Wetlands (IVCWs) for treating reclaimed water [J]. Bioresource Technology, 2018, 249: 644-651. doi: 10.1016/j.biortech.2017.10.074 [12] HE Q L, ZHOU J, WANG H Y, et al. Microbial population dynamics during sludge granulation in an A/O/A sequencing batch reactor [J]. Bioresource Technology, 2016, 214: 1-8. doi: 10.1016/j.biortech.2016.04.088 [13] 国家环境保护总局, 水和废水监测分析方法. 水和废水监测分析方法[M]. 4版. 北京: 中国环境出版社, 2002. [14] 夏磊. 强化潜流人工湿地脱氮除磷过程研究[D]. 哈尔滨: 哈尔滨工业大学, 2018. XIA L. Study on the processes of nitrogen and phosphorus removal by enhanced subsurface flow constructed wetland[D]. Harbin: Harbin Institute of Technology, 2018(in Chinese).
[15] 陈秀荣, 周琪. 人工湿地脱氮除磷特性研究 [J]. 环境污染与防治, 2005, 27(7): 526-529. CHEN X R, ZHOU Q. Study on the characteristics of N/P removal in constructed wetland [J]. Environmental Pollution & Control, 2005, 27(7): 526-529(in Chinese).
[16] 张萍, 和丽萍, 陈静, 等. 污染负荷对人工湿地污染处理效果的影响 [J]. 环境科学导刊, 2013, 32(1): 8-12. doi: 10.3969/j.issn.1673-9655.2013.01.003 ZHANG P, HE L P, CHEN J, et al. The impact of pollution load on the pollution treatmentefficiency of the artificial wetland [J]. Environmental Science Survey, 2013, 32(1): 8-12(in Chinese). doi: 10.3969/j.issn.1673-9655.2013.01.003
[17] 汤显强, 黄岁樑. 人工湿地去污机理及其国内外应用现状 [J]. 水处理技术, 2007, 33(2): 9-13. doi: 10.3969/j.issn.1000-3770.2007.02.003 TANG X Q, HUANG S L. Mechanisms of pollutant removal in constructed wetlands and their applications both at home and abroad [J]. Technology of Water Treatment, 2007, 33(2): 9-13(in Chinese). doi: 10.3969/j.issn.1000-3770.2007.02.003
[18] 张亚琼. 不同进水方式潮汐流人工湿地污染物去除研究[D]. 北京: 中国林业科学研究院, 2015. ZHANG Y Q. Research of pollutant removal in tidal flow constructed wetlands based on different inflows way[D]. Beijing: Chinese Academy of Forestry, 2015(in Chinese).
[19] 李玲丽. 复合人工湿地脱氮途径及微生物多样性研究[D]. 重庆: 重庆大学, 2015. LI L L. Nitrogen removal pathways and microbial diversity in A hybrid constructed wetland[D]. Chongqing: Chongqing University, 2015(in Chinese).
[20] WU Y H, HAN R, YANG X N, et al. Correlating microbial community with physicochemical indices and structures of a full-scale integrated constructed wetland system [J]. Applied Microbiology and Biotechnology, 2016, 100(15): 6917-6926. doi: 10.1007/s00253-016-7526-4 [21] ZHANG Y Y, DONG J D, YANG B, et al. Bacterial community structure of mangrove sediments in relation to environmental variables accessed by 16S rRNA gene-denaturing gradient gel electrophoresis fingerprinting [J]. Scientia Marina, 2009, 73(3): 487-498. doi: 10.3989/scimar.2009.73n3487 [22] LI X, LI Y Y, LI Y, et al. Diversity and distribution of bacteria in a multistage surface flow constructed wetland to treat swine wastewater in sediments [J]. Applied Microbiology and Biotechnology, 2018, 102(24): 10755-10765. doi: 10.1007/s00253-018-9426-2 [23] MIAO Y, LIAO R H, ZHANG X X, et al. Metagenomic insights into Cr(VI) effect on microbial communities and functional genes of an expanded granular sludge bed reactor treating high-nitrate wastewater [J]. Water Research, 2015, 76: 43-52. doi: 10.1016/j.watres.2015.02.042 [24] LI C, REN H Q, XU M, et al. Study on anaerobic ammonium oxidation process coupled with denitrification microbial fuel cells (MFCs) and its microbial community analysis [J]. Bioresource Technology, 2015, 175: 545-552. doi: 10.1016/j.biortech.2014.10.156 [25] LI L Z, HE C G, JI G D, et al. Nitrogen removal pathways in a tidal flow constructed wetland under flooded time constraints [J]. Ecological Engineering, 2015, 81: 266-271. doi: 10.1016/j.ecoleng.2015.04.073 [26] XU M, LIU W J, LI C, et al. Evaluation of the treatment performance and microbial communities of a combined constructed wetland used to treat industrial park wastewater [J]. Environmental Science and Pollution Research, 2016, 23(11): 10990-11001. doi: 10.1007/s11356-016-6181-8 [27] BELLINI M I, GUTIÉRREZ L, TARLERA S, et al. Isolation and functional analysis of denitrifiers in an aquifer with high potential for denitrification [J]. Systematic and Applied Microbiology, 2013, 36(7): 505-516. doi: 10.1016/j.syapm.2013.07.001 [28] KANG Y, ZHANG J, XIE H J, et al. Enhanced nutrient removal and mechanisms study in benthic fauna added surface-flow constructed wetlands: The role of Tubifex tubifex [J]. Bioresource Technology, 2017, 224: 157-165. doi: 10.1016/j.biortech.2016.11.035 [29] DALAHMEH S S, JÖNSSON H, HYLANDER L D, et al. Dynamics and functions of bacterial communities in bark, charcoal and sand filters treating greywater [J]. Water Research, 2014, 54: 21-32. doi: 10.1016/j.watres.2014.01.019 [30] 张弘弢, 谌书, 王彬, 等. 组合式人工湿地对分散型生活污水净化效果及其微生物群落结构特征 [J]. 环境化学, 2019, 38(11): 2535-2545. doi: 10.1002/etc.4547 ZHANG H T, CHEN S, WANG B, et al. Purification effect of combined artificial wetlands on dispersed domestic sewage and analysis of microbial community structure [J]. Environmental Chemistry, 2019, 38(11): 2535-2545(in Chinese). doi: 10.1002/etc.4547
[31] JIA F, LAI C, CHEN L, et al. Spatiotemporal and species variations in prokaryotic communities associated with sediments from surface-flow constructed wetlands for treating swine wastewater [J]. Chemosphere, 2017, 185: 1-10. doi: 10.1016/j.chemosphere.2017.06.132 [32] YAO S, NI J R, MA T, et al. Heterotrophic nitrification and aerobic denitrification at low temperature by a newly isolated bacterium, Acinetobacter sp. HA2 [J]. Bioresource Technology, 2013, 139: 80-86. doi: 10.1016/j.biortech.2013.03.189 [33] DAIMS H, LEBEDEVA E V, PJEVAC P, et al. Complete nitrification by Nitrospira bacteria [J]. Nature, 2015, 528(7583): 504-509. doi: 10.1038/nature16461 [34] 李青, 成小英. 不同填料生物反应器中脱氮微生物群落比较分析 [J]. 安全与环境学报, 2017, 17(6): 2360-2365. LI Q, CHENG X Y. Discriminative analysis of denitrifying microbial communities in bioreactors with different materials as biofilm carriers [J]. Journal of Safety and Environment, 2017, 17(6): 2360-2365(in Chinese).
[35] 王庆海, 夏凡, 李翠, 等. 黄菖蒲对水中阿特拉津污染的去除贡献研究 [J]. 农业环境科学学报, 2020, 39(11): 2613-2620. doi: 10.11654/jaes.2020-0543 WANG Q H, XIA F, LI C, et al. Contribution of Iris pseudacorus to atrazine dissipation in water: Effects of initial atrazine concentrations [J]. Journal of Agro-Environment Science, 2020, 39(11): 2613-2620(in Chinese). doi: 10.11654/jaes.2020-0543
[36] 代蕾. 沉水植物对不同水质的净化作用及相关机理研究[D]. 重庆: 重庆大学, 2018. DAI L. Purification and related mechanism of submerged macrophytes on different water quality[D]. Chongqing: Chongqing University, 2018(in Chinese).
[37] 胡世琴. 人工湿地不同植被净化污水效果及其氮磷累积研究 [J]. 水土保持研究, 2017, 24(1): 200-206. HU S Q. Research on domestic sewage purification efficiencies of plants and N, P accumulation in biomass in constructed wetland [J]. Research of Soil and Water Conservation, 2017, 24(1): 200-206(in Chinese).
-



 下载:
下载: