-
全氟和多氟烷基物质(per/polyfluorinated alkyl substances,PFASs)因其热稳定性和化学惰性,在厨具、纺织、皮革、农药和消防等生产生活过程中具有广泛应用[1-3]. 同样,正因为PFASs独特的稳定性,其环境持留性和生物毒性近年来备受关注. 全氟烷基酸(perfluoroalkyl acid,PFAAs)是PFASs的一个子类,其所有的碳氢键(C—H)都被碳氟键(C—F)取代,其中全氟辛基羧酸(perfluorooctanoic acid,PFOA)和全氟辛基烷磺酸(perfluorooctane sulfonates,PFOS)是两种最典型的PFAAs(表1为PFOA和PFOS的结构和物理化学性质). 据最近的研究估计,每年大约有23—506 t PFOA和42—810 t PFOS被排放入大气,而每年沉积到陆地环境的PFOA和PFOS分别为1—13 t以及1—20 t[4]. 另有研究表明,全球PFAAs的累计排放量至少为4.6万t,其中很大一部分被直接排放到环境水体中[5]. 2000年以来,通过部分国家和企业的自愿行为,长链PFAAs(≥C7)的产量已大为减少[6],但中短链PFAAs在工业领域的应用仍未有明确限制. PFAAs的大规模使用造成其在全球环境中的普遍污染,其中水体是其重要环境归宿,并可能最终影响饮用水安全. 最近的一项研究表明,我国许多城市和地区的饮用水都受到了不同程度的PFAAs污染,而PFOA和PFOS是饮用水中残留最主要的两类PFAAs. 不同城市污染特征不同,杭州和自贡主要为PFOA,浓度分别高达115.40 ng·L−1和467.96 ng·L−1,而连云港的饮用水中PFOS的浓度高达186.17 ng·L−1[7-8],均高于2016年美国环境保护署建议的饮用水中PFOA和PFOS的健康指南阈值(70 ng·L−1)[9]. 大多数PFAAs具有较强的生物蓄积性,进入生物体后分布于肝脏以及血清内,可能对生物体产生各种潜在危害[10-14],研究发现,多种急性或慢性人类疾病,如甲状腺疾病、哮喘、焦虑、肥胖、儿童过敏、高尿酸血症、过氧化物酶体增殖、免疫毒性、肾脏疾病、肝损害和心血管疾病,都可能与PFAAs暴露有关[15-16]. 世界卫生组织国际癌症研究所于2014年6月发布的《关于人类致癌风险的专题报告》将PFOA类物质划分为2B类(人类可疑致癌物).
水环境中PFAAs的去除效果影响生态安全和人群健康,已成为近年研究的热点. 对水环境中PFAAs的去除技术主要包括物理分离和化学降解. 其中吸附和过滤等物理分离技术仅能将PFAAs从水相中转移,而未破坏其分子结构,不能有效降低PFAAs环境风险. 目前更多的研究关注通过不同技术手段断裂C—F键,最终达到矿化和彻底脱除PFAAs环境毒性的目的. 由于氟的强电负性(E0(F/F−) =3.6 V)[17],以及氟原子和碳原子的紧密键合,使得C—F键具有极高的化学键能(116 kcal·mol−1)[18],其次,3个未成对的氟离子可以形成保护性外壳,使中心碳原子极难与亲核物质反应[19],以上PFAAs特殊的化学结构,使PFAAs对化学和热破坏表现较高稳定性,可以抵抗大多数降解技术的破坏[20]. 高级氧化技术能够产生各种自由基强氧化剂,被认为是处理难降解有机污染物的有效手段,其中光催化氧化和电催化氧化因其处理过程高效、低成本和环境友好等特点,在PFAAs降解应用的前途最被关注[21].
激发光降解催化剂的光能量,光生活性基团的种类和产率以及催化反应活性的位点是影响PFAAs光降解效率的主要因素,也是研究者们开发PFAAs光催化材料,提高其催化降解效率的关键落脚点. 元素掺杂、构筑异质结、金属沉积、材料复合以及形貌调控等是科学家选择改性催化材料,提升光催化性能最常用的技术手段. 对于电催化氧化技术而言,面临高能耗、阳极腐蚀、析氧副反应竞争等问题,对电极进行三维化、引入中间层和金属负载的改性方法,以增加电催化活性,延长电极寿命,提高析氧过电位等成为提高电催化氧化PFAAs性能研究的热点. 除此之外,研究者们还探索了通过超声/辐射辅助、阴阳电极协同以及多自由基反应扩展降解路径等多重技术协同的方法,进一步提高PFAAs的降解效率.
本文就近5年来(2016—2021年),针对PFOA和PFOS两类典型PFAAs的光催化和电催化氧化降解的研究进展进行了文献调研,综述了两种高级氧化技术在降解水环境中PFAAs过程的机理和关键影响因素,分别分析了现有提高两种技术氧化降解效率的技术方法和原理,并对其可行的发展方向进行了初步展望,以期为今后PFAAs处理处置技术研究提供有益参考.
-
光催化降解是指通过引入光催化剂辅助增强光能对污染物降解的技术,其关键是构筑能够高效利用光能的半导体催化剂材料. 光催化降解污染物的一般过程可简单描述为:(1)半导体光催化剂低能价带(valence band,VB)上的电子被特定波长的光能激发;(2)电子跃迁至高能导带(conduction band,CB)上,并在VB上产生具有强氧化性的空穴(h+);(3)电子空穴对(e−/h+)向催化剂表面迁移的过程中大部分e−/h+发生复合,并以光和热的形式释放能量. (4)未复合的e−和h+分别具有强还原和氧化能力,可直接反应降解催化剂表面吸附的污染物;(5)也可与催化剂表面吸附的水、氧气等前驱物反应生成羟基自由基(·OH)和超氧自由基(·O2−)等活性氧物种(ROS)参与水中的污染物氧化还原反应[22].
TiO2、氧化镓(Ga2O3)、ZnO、氧化铟(In2O3)以及铋系材料等半导体材料因其较强的可见光响应、独特的电子能带结构、优异的热和化学稳定性、易于制备和功能化等特点是用于PFAAs降解的主要光催化剂. 例如,Furtado等[23]利用响应面法得出降解最佳条件,在该条件下通过紫外线(UV,250 W)激发TiO2,8 h内PFOS的降解率达到83%;Li等[24]利用In2O3对PFOA进行降解,254 nm UV照射下,4 h内降解率达到80%. 但是此类光催化剂普遍存在光生e−/h+对易复合,活性基团产率低和反应活性位点少等缺点,影响光催化降解效率. 提升光催化剂的催化性能的策略主要包括:(1)通过对光催化剂进行元素掺杂、异质结构筑、金属沉积以增加活性基团产率,(2)通过材料复合以及形貌调控等功能改性增加活性基团与底物的反应几率,以及(3)通过多自由基协同扩展反应降解路径等.
-
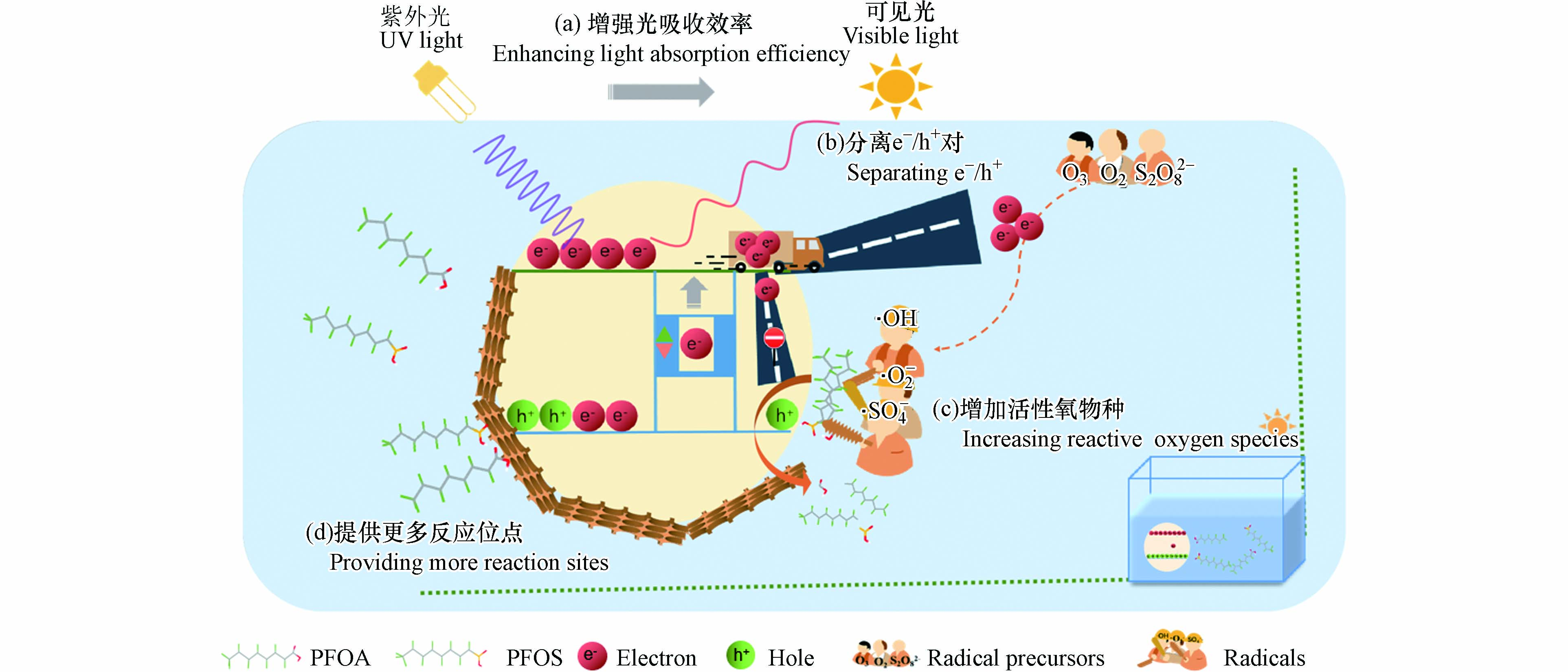
光催化反应中可直接参与污染物(底物)活化降解的基团包括h+、e−及其与H2O、O2、过硫酸盐等前驱物生成的·OH、·O2−、·SO4−等自由基. 活性基团的丰度和种类直接影响底物降解反应进行的程度与效率. 如图1中(a)、(b)和(c)所示可知,增加活性基团产率的途径有:一是扩大光响应范围,使得光催化剂在低激发能下也可激发产生e−,提高h+的产率;二是抑制光生e−/h+的复合,以提高自由基的生成率;三是通过外加过硫酸盐/O3等前驱物,协同产生·SO4−、·O2−和·OH等多种自由基.
-
掺杂是调节半导体光催化剂带隙、增强光吸收效率的技术之一. 在光催化剂中掺杂不同的元素,引入的杂质原子取代半导体催化剂上的原子,形成晶格缺陷引入杂质能级,有利于降低带隙能量,降低催化剂所需的光激发能量[25]. Wang等[26]通过一步水热法将氟原子(F)掺杂于BiOI中(BiOI0.8F0.2),F掺杂改变了BiOI的晶体结构,与纯BiOI(1.875 eV)和BiOF(1.981 eV)相比,该光催化剂禁带间隙减小为1.809 eV,电子跃迁所需的能量更低,从而提高对可见光(480—550 nm)的利用率,对PFOA的降解速率常数是纯BiOI和BiOF的10倍.
将两种不同能带结构的半导体通过物理化学过程进行复合,在这两种半导体之间形成的界面称为异质结,异质结结构使催化剂带隙变窄,吸收边红移,增强光催化剂对可见光的吸收,进而提高其光催化性能[27]. Yang等[28]通过将负载BiOI的Zn-Al水滑石(BOI0.04-BHZA)在400 ℃下煅烧,得到花状Bi5O7I/ZnO n-n异质结微球,用于在可见光照射下光催化降解PFOA. Bi5O7I/ZnO n-n异质结中由于费米能级的重新排列,形成了一个内部电场,使得带隙宽度变窄,扩大了对可见光区的光响应. 与原来的半导体相比,该光催化剂的光催化活性被大大提高,对PFOA的降解速率为0.013 h−1,分别是BOI,BHZA和BOI0.04-BHZA的2.9、2.4、1.8倍. TiO2是常用的光催化剂,但TiO2存在对紫外光的吸收效率低的不足. 因此,Yao等[29]通过设计介孔Sb2O3/TiO2提高了光催化降解效率. 结果表明,负载助催化剂Sb2O3后,光催化剂的价带边缘提高,带隙变窄,增强了对紫外光的吸收,光能利用率提高. 在最佳配比下,催化剂在2 h内可去除81.7%的PFOA,降解动力学比商业TiO2快4.2倍.
-
光生e−/h+对易复合是半导体光催化剂面临的普遍问题,分离光生e−/h+对的途径主要包括调节半导体禁带宽度,捕获光生电子,以及加速光生载流子的迁移. 研究表明,通过金属掺杂和异质结构筑调节禁带宽度,不仅可以扩大催化剂的光响应范围,也有效促进光生e−/h+对的分离,使得更多的e−和h+参与PFAAs降解.
Luo等[30]通过化学共沉淀法制备了新型的钐(Sm)掺杂铁氧体复合材料. 在铁电材料优异的稳定性和高效的电荷分离的基础上,掺杂修饰Sm3+通过提高导带能级,增加了铁氧体的禁带宽度,延缓e−和h+复合,将铁电材料的光催化降解PFOA从6.78%提高到48.61%. Tian等[31]通过将贵金属银(Ag)纳米粒子沉积修饰于TiO2纳米管(NTs)表面,起到电子陷阱的作用,延缓了e−/h+对的复合,TiO2-NTs表面产生的h+在PFOA降解中起关键的作用. Zhu等[32]通过用表面活性剂十二烷基硫酸钠辅助Ti3+的分布,使其氧化产物TiO2的尺寸最小化,生成TiO2量子点(QD). 零维纳量子点的特殊量子效应提高了TiO2单元晶胞的效率. 一方面,从晶体界面到催化剂表面的短距离,加速光生载流子迁移到催化剂表面参与反应;另一方面,更高的比表面积-体积比,允许在光催化剂表面有更大的光子吸收和更少的e−和h+重组,两方面的共同促进使PFOA降解率从近似0%提升到91%. Tan[33]在改性Ga2O3纳米片时,通过增加前驱体中In盐的含量,在纳米片上形成In2O3纳米粒子而构成异质结,该异质结结构使Ga2O3上的光生载流子转移至In2O3上,因此提高了光生e−/h+对的分离.
-
通过往水中加入其他氧化物种前驱物,例如过硫酸盐、过一硫酸盐和臭氧等,产生·SO4−、·O2−和·OH等自由基,以扩展多种降解途径协同h+氧化PFAAs,以增强光催化活性.
·SO4−(E0=2.6 eV)是一种强氧化性的自由基,被广泛应用于污染物的降解,在一定条件下,可通过过硫酸盐激活获得·SO4−[34]. Xu等[35]通过活化过一硫酸盐(PMS)辅助TiO2对PFOA进行光降解,PMS与TiO2上产生的e−反应生成·SO4−,这不仅增加了水中·SO4−的数量,同时抑制了TiO2上e−/h+对的复合,加速了PFOA的降解. 之后又通过PMS辅助比TiO2催化性能强的Ga2O3降解PFOA,降解速率与TiO2一样得到了提高,其中·SO4−、·O2−和光生e−共同降解PFOA. Wu等[36]通过臭氧氧化辅助ZnO纳米棒光催化(ZnO/UV/O3)降解PFOA,O3因其较强的氧化性与ZnO表面的光生电子反应,在生成臭氧负离子(O3−)的同时产生一定量的·OH,并抑制了ZnO中光生e−/h+的复合. PFOA吸附于ZnO上,被h+和·OH协同降解,其降解效率较单独使用O3和UV分别提高了8倍和4倍. 之后Wu等[37]又通过O3和过硫酸盐共同协助氧化锌-还原氧化石墨烯(ZnO-rGO)降解PFOA,O3促进过硫酸盐产生·SO4−,提高光降解效率,与ZnO/UV/O3相比其对PFOA的降解效率明显提高.
-
提高光催化降解效率的另一个关键是,增加与底物反应的活性位点,以提高目标污染物与光催化剂上活性基团的反应几率. 绝大多数活性基团在催化剂表面产生且寿命有限,因此仅对靠近催化剂表面的PFAAs具有较高的降解效率. 如图1(d)所示,研究者们通过元素掺杂、材料复合和形貌调控等策略增大催化剂表面积,或增加特异性吸附位点,从而提高PFAAs与活性基团反应几率.
Liu等[38]通过煅烧法对In2O3改性,其中低温煅烧(400 ℃)不但可以在In2O3表面掺杂氧空位,同时还增大其比表面积,增强了In2O3-400对PFOA的吸附,4 h内达到接近100%的吸附率,提高了In2O3对PFOA的降解. Zhu等[39]则以活性炭和TiO2为原料,通过金属Ga掺杂制备了新型吸附光催化剂Ga/TNTs@AC,Ga与碳粒子的结合,同时存在疏水、配体交换和π-阴离子相互作用,有利于PFOS的多点侧结合,10 min内对PFOS的吸附大于99%. 这种吸附模式有利于随后PFOS在光催化剂上的电子转移和氧化还原反应.
选择合适的具有多孔特性的材料或大比表面积的纤维或织物为光催化剂负载载体,可以增加光催化剂的比表面积,增大与有机污染物的接触面积,提高对有机物的降解效率[40]. Xu等[41]通过将碳球(CS)负载于BiOHP光催化剂(BiOHP/CS),碳改性提高了PFOA的吸附能力,而且有利于PFOA在光活性位点上的侧吸附构型(CF2/CF3部分和头部羧酸基团都参与在BiOHP/CS上的吸附),有利于后续C—F键的光催化裂解,其PFOA降解速率是纯BiOHP的18倍. Wu等[37]采用一步水热法在423 K条件下合成了氧化锌-还原氧化石墨烯(ZnO-rGO). rGO的大比表面积提高了ZnO催化剂的电子传输能力,促进了PFOA的降解,光催化臭氧分解4 h内,负载0.6 wt%的rGO对PFOA的降解率为83%. Zhu等[32]将TiO2量子点(QD)与磺化石墨烯(SG)纳米片进行复合,后利用冰模板自组装了一系列三维SG-TiO2QD气凝胶. SG气凝胶的疏水表面提供了PFOA分子的吸附位点,而中间产物PFHpA、PFHxA和PFPeA比反应物PFOA更容易从SG气凝胶表面脱附,从而重新暴露吸附位点,促进了降解反应的发生. 此外,与rGO和氧化石墨烯相比,SG平面上没有含氧官能团,可以使TiO2QD分散更加均匀.
光催化材料的形貌结构包括量子点(零维)、纳米线或纳米管(一维)、纳米片(二维)、空心球形或壳核结构(三维),通过催化剂自身形貌调控,同样可以增加催化活性位点的数量,这主要受其比表面积大小的影响. Liu等[42]使用金属有机框架(MOF)衍生的In2O3纳米球和纳米管在紫外光照射下光催化降解PFOA. MOF衍生的In2O3具有超亲水性和较大的比表面积,有利于PFOA与In2O3的吸附和紧密配位. Wang等[26]通过一步水热法制备了F掺杂的中空微球结构的BiOI0.8F0.2固溶体,中空结构使其具有较大的比表面积,BiOI0.8F0.2的比表面积(54.207 m2·g−1)是纯BiOI(22.119 m2·g−1)的两倍,孔隙体积从0.095 cm3·g−1增加到0.267 cm3·g−1,从而为PFOA分子的吸附和反应提供了更多的反应位点.
-
根据限制催化剂催化活性的特定关键因素(如活性基团产率不足,活性位点少等),有针对性地设计优化改进策略,可以极大地改善PFAAs光催化降解效率. 然而,当涉及对催化剂进行多重优化改进时,则可能造成催化剂制备难度和成本的增加,因此,可以同步实现多重优化效果的催化剂改进策略,“一举多得”备受青睐.
Li等[43]通过溶剂热合成法在BiOI中掺杂非金属元素Br,成功合成了一种新型高(001)面催化剂BiOI0.95Br0.05,该光催化剂具有比表面积大、紫外吸收强和有效分离光生载流子的优点,其降解速率是BiOI的4.3倍. 此外通过自由基清除实验发现,PFOA的降解是光生h+和e−协同作用的结果. Li等[44]则通过碱性水热法基于低成本的商用活性炭(AC)和TiO2制备了活性炭包被的钛纳米管(TNTs),后沉积过渡金属铁(Fe),制备了新型光催化剂Fe/TNTs@AC. Fe是一种优良的电子导体,能起到电子阱的作用,防止光生e−/h+对复合. 此外,Fe为反应提供了活性位点,可以与PFOA的羧酸头基相互作用以促进PFOA的侧吸附模式. Fe(Ⅲ)涂层抑制了负表面电位,增强了孔和PFOA头基(羧酸)之间的相互作用. Fe(Ⅲ)-Fe(Ⅱ)氧化还原循环促进·OH产生,防止e−/h+对的重组. 由于氧化铁的能带能隙较窄(2.1—2.3 eV Fe2O3 vs 3.0—3.2 eV TiO2),Fe/TNTs@AC中掺入铁也增强了可见光的吸收,4 h内PFOA降解率大于90%,62%被完全矿化为F−.
-
综上所述,研究者基于提高光催化活性基团产率,增加PFAAs与活性基团反应几率等不同优化策略,通过元素掺杂、异质结构筑、表面修饰与负载、形貌调控等催化剂改性技术以及增加活性物质等反应优化方法,提高光催化降解PFAAs的效率. 如表2所示,改进后的光催化降解PFOA/PFOS的去除率在48%—100%之间,大部分研究中去除率能达到70%以上. 目前对光催化降解的PFAAs的脱氟率和矿化率研究不多,少数报道的脱氟率和矿化率也不高. 这可能是因为随着降解中间体碳链的缩短,短链PFAAs疏水性减弱,与光催化剂表面的结合能降低,从而游离于水相中,降低了与ROS的反应几率[45]. 另一方面,短链中间体C—F的稳定性更强,需要更高的活化能.
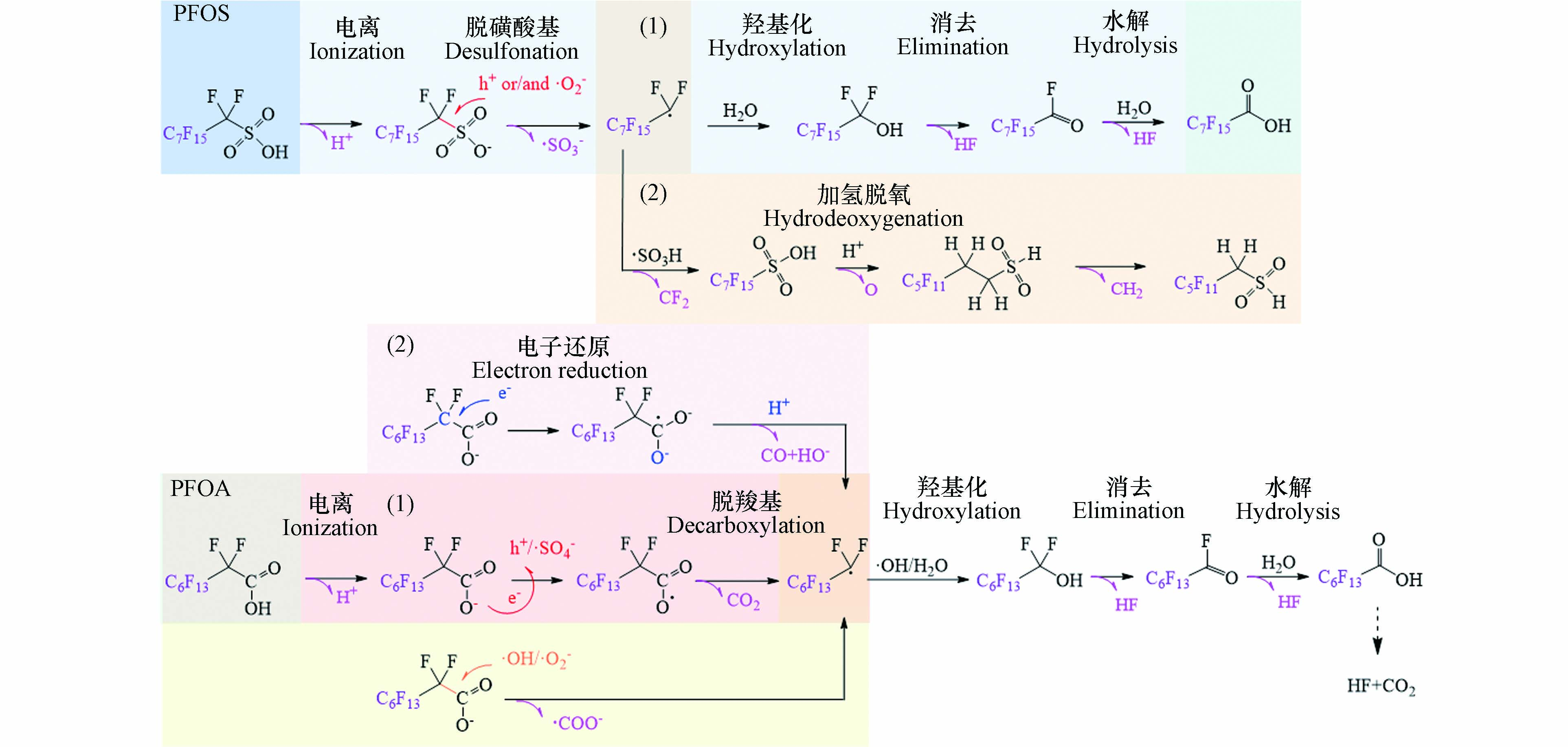
根据现有文献资料,推测PFOA的光催化降解机理如下图2表示. 水中PFOA电离形成的阴离子C7F15COO−,被吸附于光催化剂上,然后根据参与反应的基团不同,PFOA的光催化降解以不同路径进行. (1)脱羧基-羟化-消除-水解(DHEH)机制. 降解从末端的羧基开始,h+或者·SO4−夺取羧基e−,形成的C7F15COO·不稳定,进一步自发Kolbe脱羧,转化为C7F15·和CO2. C7F15·进一步与H2O或·OH反应生成C7F15OH. 产生的C7F15OH不稳定,消去HF形成酰卤化合物C7F15COF,C7F15COF易水解再脱去一个HF,形成C6F13COOH. 形成的C6F13COOH将经历相同的循环,通过释放CO2和HF来去除CF2[36];(2)还原脱羧机制. 光催化剂表面光生e−首先攻击α-碳生成不稳定的C7F15COO2-·,然后C7F15COO2-·与H+反应生成C7F15·和HCOO−,随后的反应同DHEH机制[43];(3)·O2−和·OH等直接攻击C—C键,使C7F15COO−直接转化为C7F15·,之后的反应同DHEH机制[26]. 然而,也有学者通过自由基实验表明,·OH无法直接氧化PFOA. PFOA只有通过h+、·O2−和·SO4−等失去一个e−,形成失去羧酸基官能团的自由基后,方可参与·OH主导的链式反应[46]. 因此仍需开展更多深入研究,进一步探究PFOA的光催化氧化机制.
关于PFOS的光催化降解机制,因相关研究较少,目前仍存在较大争议. 有学者[24]认为,·O2−和h+首先攻击裂解C—S键,将C8F17SO3−氧化为C8F17·. 后经过羟化,消除和水解生成C7F15COOH,然后从C7F15COOH进入全氟羧酸的降解过程. 通过高分辨质谱在降解产物中检出不同链长的PFCAs似乎印证了这一观点. 然而另有学者[23]根据鉴定得到碳链缩短PFSA和氢取代的亚磺酸中间产物,推断脱磺酸基后C8F17·可直接失去1个CF2单元之后与SO3−的重组,形成C7F15SO3H,之后通过H/F交换和脱氧形成C7H4F11SO2H,进一步失去1个CH2单元后形成C6H2F11SO2H. 然而该过程中的H/F交换和亚磺酸的生成机制仍待进一步研究.
光催化降解其他难降解污染物研究中得到的经验,也可能为今后PFAAs降解提供参考. 例如通过催化剂表面光敏化可以增强可见光吸收能力,拓宽光谱响应的范围. Murcia等[47]通过将敏化剂奎尼萨林和锌原卟啉对钛纳米管进行敏化处理. 研究发现,光敏化后的钛纳米管对苯酚和甲基橙降解效率提高,在太阳光下也具有光催化活性. 此外单原子光催化剂由于其高催化活性,对目标物的高选择性和稳定性而成为光催化领域的研究热点,Liu等[48]研究发现将Ag和Cu单原子负载于介孔石墨氮化碳(mpg-C3N4)上光催化降解污染物,实现了配体到金属的电荷转移,减少了有毒中间体的产生,同时具有对目标污染物的高选择性,与不负载单原子金属的mpg-C3N4相比,降解后形成的气态组分更多,有机副产物组分更少. 光敏化和单原子改性光催化剂具有易制备、高催化性和高选择性等优点,符合未来光催化剂发展的方向,然而相关技术在PFAAs光催化降解中的研究还较少. 采用多种技术的联合,定向改进催化材料,进一步降低催化反应条件,提高脱氟和矿化效率,是今后光催化降解PFAAs研究努力的方向.
-
电催化降解是指污染物在电场作用下,在电极表面得失电子被直接氧化还原或者电极反应催化产生活性基团间接氧化还原的降解反应. 电催化反应的形式主要有阳极氧化、阴极还原和阴阳两极协同作用三种类型. 由于水溶液中PFAAs多以阴离子形态存在,阳极氧化(即电催化氧化,EO)是电催化降解PFAAs采取的主要手段.
阳极材料是影响EO降解PFAAs效率的关键因素[49],常用于降解PFAAs的阳极材料有掺硼金刚石(BDD)、氧化锡(SnO2)和氧化铅(PbO2)等. 限制阳极氧化降解效率的主要因素有电催化活性基团的产率,目标物到电极表面的传质速率,电极表面提供目标物反应的活性位点以及电极的稳定性和电流传输效率等.
-
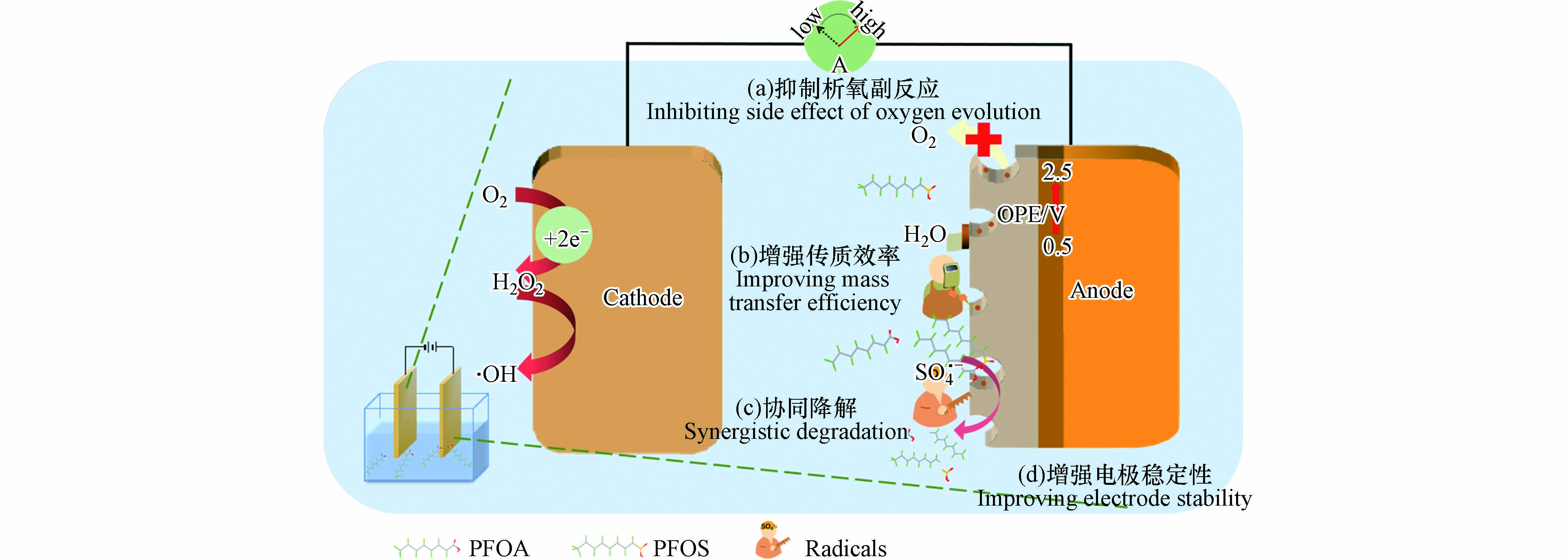
提高电化学氧化效率的一个关键是提高电极产生活性基团的效率. 结合电极降解污染物的机理可知,可通过抑制阳极的析氧副反应,提高物理吸附型·OH产量;阴阳极协同产生·OH以及添加氧化自由基前驱物等方式提高活性基团的产率(图3(a)和(c)),以提高对PFAAs的降解.
在电极的表面层中掺杂特定功能物质,有利于优化催化电极晶型,使粒子间更加紧密,有效提高电极产生物理吸附型·OH的能力[50]. Yang等[51]利用元素F和Sb对Ti/SnO2阳极进行共掺杂改性以降解PFOS. F和Sb(尤其是F)共掺使电极晶体生长一致,表面更光滑,产生的·OH不会进入电极内部而是吸附于电极表面,PFOS去除率2 h内达到99%. 研究表明,氟树脂(FR)具有较强的疏水性,FR通过降低电极表面对水的吸附和阻碍游离氧原子向电极内部的运动和膨胀,抑制产生氧气副产物[52]. 四氟乙烯(PTFE)是主要的一类FR,Luo等[53]将管状PTFE掺杂于PbO2薄膜阳极,PbO2-PTFE电极具有较强生成吸附·OH的能力,且PTFE的掺杂使电极析氧电位提高至2.45 V(相对于标准氢电极,vs. SHE),可有效抑制H2O电解产生O2的副反应. 5 h内对PFOA达到98.9%的降解率,80.7%的总有机碳(TOC)去除率和52.5%的脱氟率.
在电催化降解PFAAs的研究中,通常通过对阳极材料改进而提高间接氧化所需的·OH产率. 而Wang等[54]首次提出了一种阴极电芬顿和阳极氧化协同电化学降解PFOA的方法,以提高间接氧化效果. 制备了含铁锰碳气凝胶作为阴极,Fe-Mn掺杂的碳气凝胶具有良好的活性位点分布,以FeII和MnII作为Fenton催化剂生成·OH,提高了系统中·OH的生成效率. 电催化4 h后PFOA和TOC的去除率分别达到97%和93%.
硫酸盐在天然水环境中广泛存在,硫酸盐活化产生的·SO4−是污染物天然电化学降解过程中的重要活性成分. 在强化电催化降解体系中添加硫酸盐生成·SO4−,比过硫酸盐或过氧单硫酸盐活化更经济、更可持续. Liu等[55]研究Ti4O7阳极在硫酸盐存在下对PFOA的电化学降解. 研究发现,阳极直接电子转移(DET)和·OH间接氧化均可活化硫酸盐产生·SO4−,PFOA的降解是·SO4−和·OH共同作用的结果. 在恒定电流密度为10 mA·cm−2的条件下,硫酸盐的存在使PFOA的降解率提高2.3倍,能耗降低1/3,电解2 h的脱氟效率提高16.1%. Liu等[56]设计了B/N共掺金刚石(BND)电极,用于活化硫酸盐产生·SO4−降解PFOA. 在相对较低的电流密度(4 mA·cm−2)下,其降解一级动力学常数为2.4 h−1,3 h内总有机碳去除率为77.4%,是一种高效稳定的氧化PFOA的方法.
-
提高电化学氧化PFAAs效率的另一个关键是提高传输效率,包括增强目标污染物从溶液往阳极表面的迁移以及电子从污染物向电极的转移,如图3(b)所示,通过对电极材料进行三维化处理和负载金属可以提高电极的传输效率.
研究者们通过结构的改变使阳极从二维转变为三维,三维化主要通过增大比表面积与活性位点以增强目标污染物向阳极的迁移,并将污染物吸附于电极表面提高反应效率[57]. Lin等[58]采用高温烧结法制备了具有广泛连通大孔的Magnéli相Ti4O7陶瓷材料,其平均孔径为2.6 μm,孔隙率为21.6%. 结果表明在矿化过程中,溶液中的PFOA和PFOS向阳极迁移,并被吸附于阳极上发生近乎完全的氧化降解,溶液中仅检测到微量的中间体短链PFCAs. 多孔Ti4O7陶瓷阳极与传统的Ce-PbO2和Ti/BDD电极相比具有更高的PFOA/PFOS氧化率. 3 h内,PFOA和PFOS在该降解体系中的脱氟率分别达到95%和80.9%. Shi等[59]制备了多孔的Magnéli相Ti4O7陶瓷膜,研究反应电化学膜(REM)系统中PFOS的降解. 得益于REM改善了电活性表面积和相间传质,显著提高了PFOS的降解效率. 相对于标准氢电极(vs. SHE),在3.15 V的阳极电位下,通过交叉流过滤模式PFOS被快速矿化为CO2和F−,去除率达到98.30%±0.51%.
电极表面负载金属是提高电子转移的重要手段. Huang等[60]将非晶态钯簇(Pd)负载到Ti4O7电极上,非晶Pd簇较高的氧化态和缺电子的5d轨道有助于更有效地从PFOA中提取电子,其表面大量的Pd—O可作为电子从PFOA转移到电极的通道,增强阳极氧化能力. 该系统中没有自由基参与,整个降解过程由阳极的电子转移驱动。 1 h内,PFOA的去除率86.7%,TOC去除率81.3%,脱氟率77.9%.
-
常用的电极材料除电化学氧化效率低外,还存在一个问题是电极寿命短,表现为电极表面活性层易与电极基底脱落. 如图3中(d)所示,针对该问题,研究者们通过引入中间层增强活性层与基底的结合,中间层的加入可以增强电极活性层和基体之间的结合作用,避免活性层的脱落,提高电极稳定性,延长电极使用寿命.
Zhou等[61]通过将Ag2O作为中间层引入Ti/TiO2-NTs/PbO2阳极用于降解PFOS,研究表明,与Ti/PbO2和Ti/TiO2-NTs/PbO2阳极相比,Ti/TiO2-NTs/Ag2O/PbO2阳极寿命为47.22 h,高于Ti/PbO2的8.89 h和Ti/TiO2-NTs/PbO2的43.61 h. 同样的,Yang等[50]研究了不同中间层对电极寿命的影响,研究发现,将Sn-Sb作为中间层引入Ti/SnO2电极,Ti基片与SnO2涂层之间的Sn-Sb中间层明显提高电极的稳定性,电极寿命从80.1 h提高到103.1 h.
-
上述研究分别针对提高活性基团产率、增强传质效率以及提高电极稳定性三个方面进行电极的改进. 除此之外,研究人员还探索了通过电极复合改性,同时优化多重因素影响,提高电极氧化的效率.
Duan等[62]通过电沉积技术制备三维石墨烯-二氧化铅(3DG-PbO2)复合阳极,用于电催化氧化PFOS. 三维石墨烯的三维网状、层次化多孔结构抑制了石墨烯的聚集和堆积,具有更大的比表面积和多维电子传递通道,因此具有较强的·OH生成能力、较多的活性位点、电子传递速率快的突出优势. 在3DG-PbO2阳极上PFOS的降解速率常数是纯PbO2阳极的2.33倍. Wang等[63]通过在TiO2纳米管阵列(TiO2-NTA)自掺杂Ti3+,通过Ti3+的掺杂,一方面形成质子夹层(Ti4++e−+H+→Ti3+H+)增强了电极导电率,另一方面促进目标物在阳极上形成Ti—F键键合,Ti—F键的结合可以通过库仑力降低阳极表面的电子迁移率,从而促进与PFOA的DET反应. 此外,表面Ti—F基团还可作为电子捕获位点,降低价带h+和导带e−的复合率,有利于·OH的生成. 在增强阳极DET和高·OH产率的共同作用下,仅需低电流密度(2 mA·cm−2),就可实现快速高效脱氟(90 min内脱氟率达到74.8%).
Xu等[64]在电化学氧化过程中,辅以低频超声(20 kHz),研究其对PFOA矿化的影响. 以Ti/SnO2-Sb/Ce-PbO2作为阳极,该阳极可产生物理吸附于电极表面的·OH,3 h内对PFOA的降解率为89.4%,脱氟率为75.9%,矿化率为71.9%. 在超声的协同作用下,阳极电子传递加快,·OH产量提高(1.82倍),3 h内PFOA去除率、脱氟率和矿化率分别提高至98.7%、87.9%和86.1%,其一级动力学速率常数从0.017 min−1增加到0.031 min−1,矿化电流效率在电流密度为15 mA·cm−2从0.66%增加到0.77%.
-
如上所述,研究者们围绕增加活性基团产率、提高传质效率以及提高电极稳定性三个方面对电化学降解系统进行改进. 通过掺杂、·SO4−协同和阴/阳电极协同等方式提高电极活性基团的产率,通过负载金属和三维化的改性手段提高电极表面传质效率,通过引入功能化中间层提高电极的稳定性. 而随着研究的不断深入,通过一次改性同时提高电极多方面的性能或多技术辅助协同降解也逐渐成为关注的焦点. 表3列举比较了近年来,电催化降解PFAAs研究的电极优化参数和降解效果. 如表3中的去除率、降解条件、脱氟率和矿化率中所列数据所示,PFAAs的电催化去除率基本可以达到90%以上,降解时间为1.5—4 h,脱氟率和矿化率大部分也可以达到50%以上.
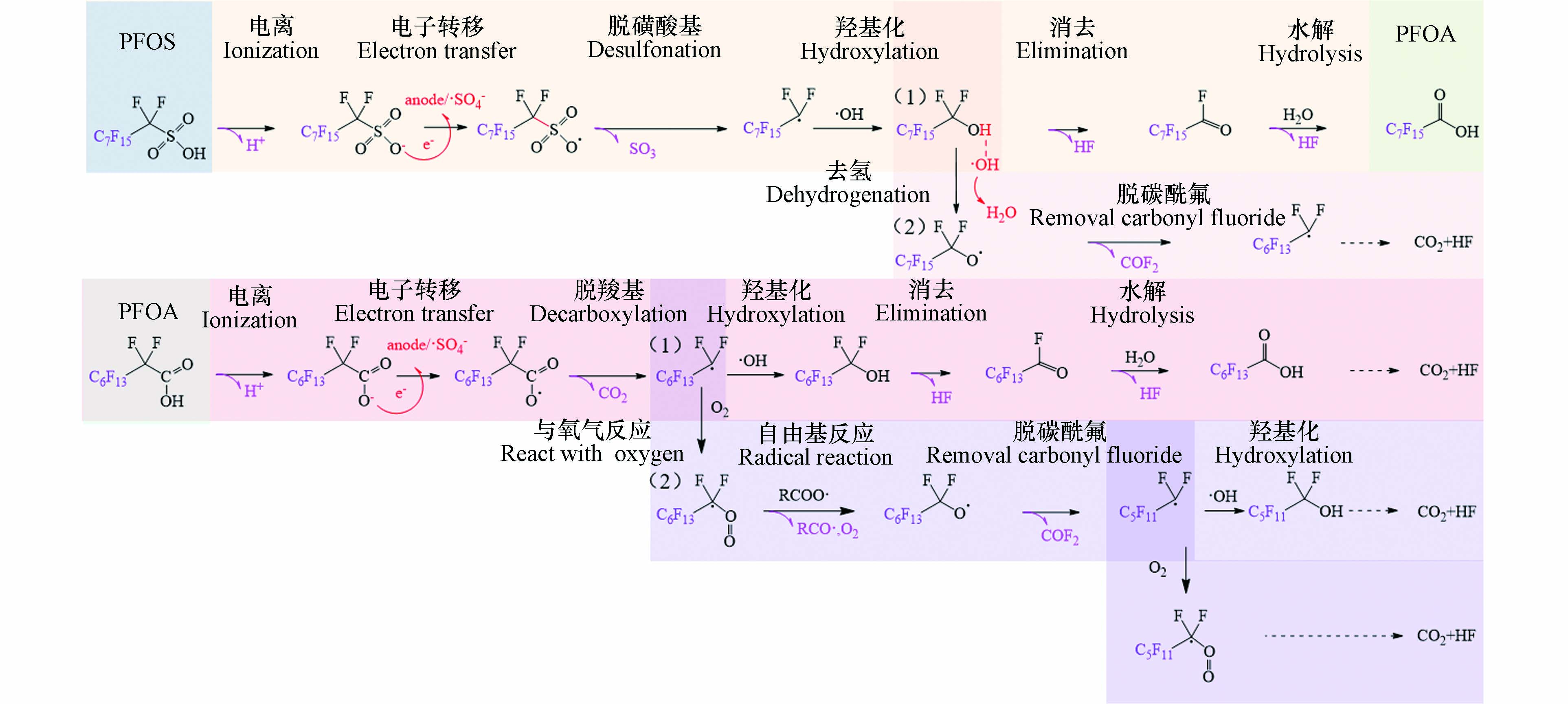
目前对于PFOS的电催化降解机制的理解,可归纳为如下过程. 首先离子化的C8F17SO3−在电场作用下向阳极迁移,磺酸基经DET或·SO4−氧化,失去电子形成C8F17SO3·,然后C—S键继续在电场作用下延伸裂解,形成C8F17·和SO3,其中SO3在水溶液中转化为SO42-,而生成的C8F17·与阳极表面吸附的·OH反应生成氟代醇C8F17OH. 进一步的降解可能通过两种机制进行:(1)与光催化降解相同,C8F17OH经过HF消除和酰卤水解形成C7F15COOH,然后开始进入全氟羧酸的降解[62];(2)C8F17OH也可能继续被·OH氧化,经C8F17O·,快速分解为C7F15·和碳酰氟(COF2). 通过这个重复的CF2降解循环(C8F17·至C7F15·),C8F17SO3·可以完全矿化为CO2和HF[58]. 与PFOS相似,PFOA的电催化降解也从电极表面的脱羧基开始,生成的自由基C7F15·可能经(1)羟化、消去HF和酰卤水解脱去CF2,缩短碳链的C6F13COOH,进入下一个脱羧基循环[60];或经(2)与电解水产生的电极氧气反应生成C7F15OO·,并在羧酸自由基(RCOO·)作用下经自由基转化形成C7F15O·,随后分解脱去COF2生成碳链缩短的C6F13·,CnF2n+1·(≤6)同样可经上述两种机制实现逐级降解[65-66]. 通过以上两种途径,均可实现PFOA的完全矿化(图4).
比较电催化和光催化降解PFAAs的效率和机理发现,电催化氧化的降解速率更快,脱氟和矿化程度更高. 这可能与两种降解技术的驱动力不同有关. 光催化通过光能转化为化学能,驱动h+间接活化PFAAs,而电催化则通过电场驱动,电极直接活化PFAAs,电子传递效率更高,反应也更快更彻底,当然也意味着额外能耗的增加. 因此两种PFAAs技术也具有各自的优势和不同的应用场景,同时也存在相互结合,协同应用的可能.
在电催化处理各种难降解污染物的研究过程中,研究人员还探索了其他多种电极强化方法,其中不乏可为PFAAs降解研究的借鉴. 例如,Behara等[67]报道了一种II型异质结构复合TiO2和ZnO纳米材料用于电化学晶体紫染料降解的研究. 其中电极的半导体异质结构为电子传输提供了自由路径,是增强电导率的有效方法;而纳米化电极的大表面积可容纳更多的染料分子与氧化剂相互作用. 提高催化反应的选择性是实现PFAAs高效降解的重要途径,其中分子印迹(MIP)电极正是极具应用前景的技术之一. Tang等[68]研究了一种分子印迹介孔SnO2电极对实际水体中2,4-二氯苯氧乙酸(2,4-D)的深度降解. 利用分子印迹材料对目标分子2,4-D的特异性电化学识别,在实际水体中对2,4-D实现了选择性降解. 再如,粒子电极是在常规二维电极基础上在电极板之间填充颗粒催化剂作为第三维电极,与常规二维电极相比,三维电极结构增加了有效电极面积和传质效率,从而具有更高的电流效率和污染物降解能力[69]. Li等[70]以铜铁素体(CuFe2O4)作为粒子电极和过硫酸盐活化催化剂,改善三维电化学过程中对阿特拉津(ATZ)的降解. CuFe2O4不但具有反应面积大、传质量大、能耗低等优点,其催化产生的·SO4−是ATZ降解过程中的主要活性自由基,该电极电化学系统是一种高效、清洁的电化学技术. 异质结构,分子印迹和三维电极具有导电率强,高选择性,比表面积大和传质效率高等特点,符合将来电催化阳极材料的发展趋势,然而在目前电催化降解PFAAs研究中应用较少. 因此,在改进电催化氧化体系提高降解PFAAs效率时,可借鉴以上方法.
-
光电催化(PEC)是将光催化和电化学技术结合,用于低浓度污染物降解的技术. 其中主要由半导体光触媒材料组成光电极,能被光激发产生e−/h+对. 通过施加小额的外加电压,可以使光催化产生的电子在外电场的作用下,由阳极传导到阴极,克服光催化技术中e−/h+对易复合的缺点. Peng等[71]通过制备碳氮共掺杂TiO2纳米管阵列(C-N-TNTAs)为阳极研究PEC降解PFOA. 在该PEC催化系统中,光激发C-N-TNTAs产生的电子在电场作用下被转移到阴极,发生析氢反应,从而最小化光生e−/h+的复合. 与单独光或电催化相比,PEC模式下(1.0 V vs.Ag/AgCl)体系中可以检测到更多种类的短链PFCAs,说明PFOA的降解路径延长,更多的-CF2单元被剥离,PFOA被有效矿化. C-N-TNTA光阳极在3 h内对PFOA(初始浓度为40 mg·L−1)的去除率达到56.1%,而单独的光催化和电催化降解效率分别为18.1%和4.96%.
研究发现,UV激发的水合电子(eaq−)具有很强的还原性,可以断裂C—F键,并已成功实现PFOS的降解,但eaq−降解效率有限,5 d后降解率仅为35%[72]. 通过电催化降低C—F键的活化能,是提高eaq−还原PFAAs效率的一个重要途径. Su等[73]提出一种UV-电催化结合阴极还原降解PFOS的方法. 在阴极制备过程中加入阳离子表面活性剂(十六烷基三甲基溴化铵),电极上的阳离子表面活性剂与PFOS产生静电作用,促进PFOS在阴极上的吸附. 阴极表面和被吸附的PFOS之间的电位差提供DET的驱动力,使电极表面产生的e−与PFOS结合,使C—F键的活化能降低了约70%,从而增强了eaq−对PFOS的脱氟效率,2 h内的脱氟率从6.8%增加到23.0%.
光电结合协同降解PFAAs的技术,实现了光能和电能向化学能的转换,通过促进光生e−/h+对的分离,提高光阳极氧化能力;或通过电催化活化,增强光阴极eaq−的还原能力,实现PFAAs的降解. 虽然光电结合在催化降解PFAAs应用中显示了较好的研究前景,但是目前相关研究还十分匮乏,缺少系统性的光阳极/光阴极材料的优化研究. 因此,我们建议在后续的研究中,通过借鉴光催化/电催化中催化剂和电极材料优化策略,进一步提高光电结合催化降解PFAAs的降解和脱氟效率,重点开发具有现实应用前景的处理材料.
-
本文通过综述近五年国内外光催化和电催化降解两种典型PFAAs(PFOA和PFOS)的研究发现:1)光催化降解具有绿色高效和能耗低等特点,电催化降解具有不添加化学添加剂和易操作等优点成为目前降解PFAAs主要的两种降解方法;2)为了达到更高的降解效益,近年来对光催化进行了不同策略的改进,研究者们通过掺杂、金属沉积、构造异质结和加入自由基前驱体等手段增加活性基团的产率. 通过掺杂、材料复合和形貌调控等手段增加PFAAs与活性基团的反应几率,改进后对PFOS和PFOA的去除率大部分都达到70%以上. 3)在电催化的改进策略上,研究者们通过掺杂、阴/阳极协同和加入硫酸盐等改进手段增加活性基团的产率,通过三维化和金属负载的改性手段提高传质效率,以及通过引入中间层的手段增强电极稳定性,改性后对PFOS和PFOA的去除率都可达到70%以上,脱氟率大部分达到60%以上,矿化率大部分达到65%以上.
同时也总结发现了PFAAs降解研究中存在的不足. 1)首先,对降解机理和降解中间产物的认识不足,特别是在光催化降解过程,未完全矿化的PFAAs,其生态风险不容忽视. 同时相较于电催化降解技术,光催化降解技术的脱氟率和矿化率较低,亟需更深入的脱氟机理研究以提高矿化率;2)近年来在对PFAAs的降解中,多为针对PFOA或PFOS的单独研究,而缺乏两者的比较研究,对不同官能团对降解的影响的理解不足;3)缺乏多种优化策略协同,或多种技术协同作用的研究; 4)当前PFAAs降解研究多在实验室条件下进行,缺少实际水体环境,如pH、温度、水中的无机离子、溶解性有机质及存在其他污染物竞争等因素对降解效率影响的研究.
基于上述研究现状和不足,建议在今后的研究中应:1)增强光催化降解脱氟机理的研究,寻找提高脱氟效率的优化策略,同时加强降解中间产物种类和毒性的研究,以生态或毒性效应指标替代降解率、脱氟率等单纯化合物指标评估PFAAs污染控制效果. 2)加强PFAAs中不同官能团对其光/电催化降解性能的影响研究,从而优化降解路径,提高降解效率. 3)深入研究协同处理技术在PFAAs降解中的优势,提高催化材料的利用率,降低处理成本. 4)开展真实环境条件下PFAAs的催化降解研究,为水体PFAAs污染修复技术的实际应用奠定基础.
典型全氟烷基酸的光/电催化降解:性能提升策略与反应机制
Photocatalytic and electrocatalytic degradation of typical perfluoroalkyl acids: Performance improvement strategies and reaction mechanisms
-
摘要: 全氟烷基酸(perfluoroalkyl acids,PFAAs)在全球水体中普遍存在,且对生物体和人体均具有潜在毒害作用,是近年来被广泛关注的主要污染物之一. 水环境中PFAAs的去除和降解是降低其生态健康风险的重要手段,也是目前研究的焦点之一. PFAAs分子中所有C—H键均被C—F键取代,特殊的结构使PFAAs具有极高的化学稳定性,常规的氧化技术难以实现水环境中PFAAs的有效降解. 光催化氧化和电催化氧化是目前处理难降解有机污染物的两种主要高级氧化技术,也是研究水环境中PFAAs降解去除的主流关键技术. 以全氟辛基羧酸(perfluorooctanoic acid,PFOA)和全氟辛基磺酸(perfluorooctane sulfonates,PFOS)为研究PFAAs降解的两类典型代表,本文综述了近年来光催化氧化和电催化氧化两种技术在水相PFOA和PFOS降解研究的文献报道,对提高PFAAs降解效率所采用的主要技术改进策略及其背后的理论机制进行了梳理和总结. 基于提高催化反应活性物质产率,增加活性反应位点和反应物传质效率以及提高反应体系稳定性等优化策略,对光催化中催化剂和电催化中电极材料的优选,通过元素掺杂、异质结构筑、金属沉积、材料复合、形貌调控等对材料进行特定功能化改性,以及向反应体系添加氧化物种前驱体、多技术耦合等协同改进方法,两类PFAAs的氧化降解效率显著提高. 光/电催化氧化对水中PFAAs的去除率、脱氟率和矿化率(中位值)分别达到91%和98%、38%和76%、65%和81%,展现了这两种高级氧化技术在PFAAs降解中优越的性能和应用前景. 结合两种高级氧化技术进展,展望其在PFAAs降解研究的发展方向,以期为今后PFAAs的污染控制技术研究提供有益参考.Abstract: Perfluorinated alkyl acids (PFAAs), a group of widely concerned pollutants in recent years, are widespread in water bodies around the world and are potentially toxic to both organisms and humans. The degradation and removal of PFAAs in aqueous environment are crucial means to reduce their ecological and health risks, and are also focuses of current research. PFAAs show extremely chemical stability due to all C—H bonds being replaced by C—F bonds, which makes it difficult to achieve effective degradation of PFAAs by conventional oxidation techniques. Photocatalytic oxidation and electrocatalytic oxidation are two main advanced oxidation techniques for the treatment of refractory organic pollutants and already become the key techniques for the degradation and removal researches of PFAAs in the aqueous environment. With perfluorooctanoic acid (PFOA) and perfluorooctane sulfonates (PFOS) been selected as the two typical representatives, we reviewed the literature reports on the degradation of PFAAs in the aqueous phase by photocatalytic oxidation and electrocatalytic oxidation in recent years. And the main technical improvement strategies and the underlying theoretical mechanism to improve the degradation efficiency were summarized. The main optimization strategies adopted in literature works including improving the yield of active groups in the catalytic reaction, increasing the active reaction sites and mass transfer efficiency of reactants, and improving the stability of the reaction system. Specific functional modifications such as element doping, heterostructure construction, metal deposition, material composition and morphology control, were carried out to optimize the catalysts in photocatalysis and the electrode in electrocatalysis. Several synergistic methods such as adjunction of active oxide precursors and multi-technology coupling were also applied to accomplishing significant improvements of oxidation degradation efficiency of the two types of PFAAs. The removal rate, defluorination rate, and mineralization rate (median) of PFOA and PFOS in water by photocatalytic/electrocatalytic oxidation reached 91% and 98%, 38% and 76%, and 65% and 81%, respectively, demonstrating the superior performance and application prospects of these two advanced oxidation techniques in the degradation of PFAAs. Finally, based on the progress in the two advanced oxidation technologies, development directions of PFAAs degradation research were prospected. We hope this review will help in the pollution control researches of PFAAs in future.
-

-
表 1 PFOA和PFOS的结构和物理化学性质
Table 1. Structure and physicochemical properties of PFOA and PFOS
化合物
Compounds分子式
Molecular formula化合物结构
Chemical structures分子量
Molecular weight酸度系数
pKa沸点/℃
Boiling point熔点/℃
Melting pointPFOA C7F15COOH 
414.07 0.5 40—50 189—192 PFOS C8F17SO3H 
500.13 -3.27 >400 133 表 2 不同改进策略的PFAAs光催化降解反应效率
Table 2. Photocatalytic degradation reaction efficiency of PFAAs with different improved strategies
化合物
Compounds浓度
Concentration降解条件
Degradation conditions降解率/%
Degradation脱氟率/%
Defluorination矿化率/%
Mineralization中间产物
Intermediate
products参考文献
ReferencesPFOS 0.1 mg·L−1 TiO2, CTiO2=1.45g·L−1,
pH=4, 25 ℃, 8 h, UV83% — — C7HF15O3S
C7H5F11O2S
C6H3F11O2S[23] 0.1 mg·L−1 2% Ga/TNTs@AC, pH=7,4 h, UV,
电流强度=210 W·m−275% — 66.2% C4—C8 PFCAs [39] PFOA 100 μmol·L−1 In2O3, 254 nm, 4 h 80% — — C2—C7 PFCAs [24] 40 mg·L−1 Bi/BiOI0.8F0.2, UV–vis 100%(2 h) 10%(3 h) 19%(2 h) C5—C7 PFCAs [26] 1 mg·L−1 0.5 g·L−1 Bi5O7I/ZnO, 6 h,
pH=4, 420 nm91% — — C4—C7 PFCAs [28] 10 mg·L−1 0.25 g·L−1 Sb2O3/TiO2, 2 h, UV 81.7% — — — [29] 0.5 mmol·L−1 2.0 g·L−1 Sm-Fe, 185 nm, 2 h 48.61% — — C5—C7 PFCAs [30] 50 mg·L−1 MIP-Ag/TiO2NTs-UV, 23 W,
254 nm, 8 h91% — — C3—C7 PFCAs [31] 0.3 mmol·L−1 3DSG-TiO2QD,UV,10 h 91% — — C4—C7 PFCAs [32] 20 mg·L−1 0.5 g·L−1 In-Ga2O3, UV,
pH=4.5, 25 ℃100%(1 h) 57%(4 h) — C3—C7 PFCAs [33] 50 mg·L−1 0.25 g·L−1 TiO2, 0.75 g·L−1 PMS,
400—770 nm, pH=3, 8 h100% — — C5—C7 PFCAs [35] 10 mg·L−1 0.2 g ZnO nanorods, 50 mg·h−1 O3,
254 nm, pH=3, 4 h70.5% — — C2—C7 PFCAs [36] 10 mg·L−1 0.2 g 0.6%-ZnO-rGO, 50 mg·h−1 O3,
254 nm, 100 mg·L−1 S2O82-, 4 h99.2% — — C4—C7 PFCAs [37] 10 mg·L−1 In2O3-400, UV ~100%(4 h) 38%(8 h) — C5—C7 PFCAs [38] 0.2 mg·L−1 1.0 g·L−1 BiOHP/CS, pH=7,
254 nm, 21 mW·cm−290%(1 h) 32.5%(4 h) — C2—C7 PFCAs [41] 10 mg·L−1 40 mg In2O3纳米棒和纳米球,
254 nm, 8 h100% — 75–80% C5—C7 PFCAs [42] 10 mg·L−1 12 mg BiOI0.95Br0.05, UV 96%(2 h) — 65%(3 h) C4—C7 PFCAs [43] 0.1 mg·L−1 1g·L−1 Fe/TNTs@AC,
21 mW·cm−2, 254 nm, 4 h90% 62% — C2—C7 PFCAs [44] 表 3 不同改进策略的PFAAs电催化氧化降解反应效率
Table 3. Electrocatalytic oxidation degradation reaction efficiency of PFAAs with different improved strategies
化合物
Compounds浓度
Concentration降解条件
Degradation conditions降解率/%
Degradation脱氟率/%
Defluorination矿化率/%
Mineralization中间产物
Intermediate
products参考文献
ReferencesPFOS 100 mg·L−1 Ti/Sn-Sb/SnO2-F-Sb, pH=3,
10 mmol·L−1 NaClO4, 20 mA·cm−2, 2 h99% 87.1% 65.7% C2—C8 PFCAs [51] 0.1 mmol·L−1 Ti4O7, 3.9—3.7 V vs.SCE, 3 h 93.1% 80.9% 90.3% PFHpS
PFHxS[58] 2.0 μmol·L−1 Ti4O7 REM, 3.15 V,
100 mmol·L−1 Na2SO498.3%(2 h) — 72%(2.5 h) C4—C8 PFCAs [59] 50 mg·L−1 Ti/TiO2-NTs/Ag2O/PbO2, 3 h,
30 mA·cm−2, 1.4 g·L−1 NaClO474.87%, 11.49% — C4—C8 PFCAs [61] 50 mg·L−1 3DG-PbO2, 0.05 mol·L−1 Na2SO4,
30 mA·cm−2, pH=7, 2 h96.17% 68.5% — C2—C8 PFCAs [62] PFOA 20 mg·L−1 陶瓷/PbO2-PTFE, 15 mA·cm−2,
pH=7, 15 mmol·L−1 Na2SO4, 5 h98.9% 52.5% 80.7% C4—C7 PFCAs [53] 120 μmol·L−1 BDD为阳极,Fe10MnC为阴极, 4 h 97% — 93% C2—C7 PFCAs [54] 0.1 mmol·L−1 Ti4O7,10 mA·cm−2,硫酸盐, pH=6.9, 2 h 97.1% 61.4% — — [55] 50 mg·L−1 BND, 4.0 mA·cm−2, 0.05 mol·L−1
Na2SO499.3%(1.5 h) 76.8%(3 h) 77.4%(3 h) C2—C7 PFCAs [56] 0.12 mmol·L−1 Pd-Ti4O7, 10 mA·cm−2, 1 h,
50 mmol·L−1 Na2SO4, 25 ℃,86.7% 77.9% 81.3% C4—C7 PFCAs [60] 50 mg·L−1 Ti3+/TiO2-NTA, 2 mA·cm−2, 1.5 h 98.1% 74.8% 93.3% C2—C7 PFCAs [63] 60 mg·L−1 Ti/SnO2-Sb/Ce-PbO2, 52 W,
20 kHz, 15 mA·cm−2, 3 h~100% 87.9% — C2—C7 PFCAs [64] -
[1] WANG T Y, WANG P, MENG J, et al. A review of sources, multimedia distribution and health risks of perfluoroalkyl acids (PFAAs) in China [J]. Chemosphere, 2015, 129: 87-99. doi: 10.1016/j.chemosphere.2014.09.021 [2] SCHULTZ M M, BAROFSKY D F, FIELD J A. Quantitative determination of fluorinated alkyl substances by large-volume-injection liquid chromatography tandem mass spectrometry-characterization of municipal wastewaters [J]. Environmental Science & Technology, 2006, 40(1): 289-295. [3] GOSS K U, BRONNER G, HARNER T, et al. The partition behavior of fluorotelomer alcohols and olefins [J]. Environmental Science & Technology, 2006, 40(11): 3572-3577. [4] JOHANSSON J H, SALTER M E, NAVARRO J C A, et al. Global transport of perfluoroalkyl acids via sea spray aerosol [J]. Environmental Science. Processes & Impacts, 2019, 21(4): 635-649. [5] WANG Z Y, COUSINS I T, SCHERINGER M, et al. Global emission inventories for C4-C14 perfluoroalkyl carboxylic acid (PFCA) homologues from 1951 to 2030, Part I: Production and emissions from quantifiable sources [J]. Environment International, 2014, 70: 62-75. doi: 10.1016/j.envint.2014.04.013 [6] LENKA S P, KAH M, PADHYE L P. A review of the occurrence, transformation, and removal of poly-and perfluoroalkyl substances (PFAS) in wastewater treatment plants [J]. Water Research, 2021, 199: 117187. doi: 10.1016/j.watres.2021.117187 [7] 彭碧霞, 洪文俊, 李方方, 等. 浙江杭嘉湖地区水环境中全氟烷基化合物的污染特征及健康风险评估 [J]. 环境化学, 2021, 40(10): 3001-3014. doi: 10.7524/j.issn.0254-6108.2021032002 PENG B X, HONG W J, LI F F, et al. Distribution characteristics and health risk assessment of perfluoroalkyl substances in aquatic environment of Hangzhou-Jiaxing-Huzhou region in Zhejiang Province [J]. Environmental Chemistry, 2021, 40(10): 3001-3014(in Chinese). doi: 10.7524/j.issn.0254-6108.2021032002
[8] LIU L Q, QU Y X, HUANG J, et al. Per-and polyfluoroalkyl substances (PFASs) in Chinese drinking water: risk assessment and geographical distribution [J]. Environmental Sciences Europe, 2021, 33(1): 1-12. doi: 10.1186/s12302-020-00446-y [9] 鲍佳, 聂青宇, 马嘉川, 等. 水中全氟和多氟化合物的去除技术最新研究进展 [J]. 江西农业学报, 2019, 31(11): 58-65. doi: 10.19386/j.cnki.jxnyxb.2019.11.12 BAO J, NIE Q Y, MA J C, et al. Recent research progress in removal technology of perfluorinated and polyfluorinated compounds in water [J]. Acta Agriculturae Jiangxi, 2019, 31(11): 58-65(in Chinese). doi: 10.19386/j.cnki.jxnyxb.2019.11.12
[10] QIN W P, CAO L Y, LI C H, et al. Perfluoroalkyl substances stimulate insulin secretion by islet β cells via G protein-coupled receptor 40 [J]. Environmental Science & Technology, 2020, 54(6): 3428-3436. [11] LI C H, SHI Y L, LI M J, et al. Receptor-bound perfluoroalkyl carboxylic acids dictate their activity on human and mouse peroxisome proliferator-activated receptor γ [J]. Environmental Science & Technology, 2020, 54(15): 9529-9536. [12] REN X M, QIN W P, CAO L Y, et al. Binding interactions of perfluoroalkyl substances with thyroid hormone transport proteins and potential toxicological implications [J]. Toxicology, 2016, 366/367: 32-42. doi: 10.1016/j.tox.2016.08.011 [13] LI C H, REN X M, GUO L H. Adipogenic activity of oligomeric hexafluoropropylene oxide (perfluorooctanoic acid alternative) through peroxisome proliferator-activated receptor γ pathway [J]. Environmental Science & Technology, 2019, 53(6): 3287-3295. [14] XIN Y, WAN B, YU B L, et al. Chlorinated polyfluoroalkylether sulfonic acids exhibit stronger estrogenic effects than perfluorooctane sulfonate by activating nuclear estrogen receptor pathways [J]. Environmental Science & Technology, 2020, 54(6): 3455-3464. [15] RUAN Y F, LALWANI D, KWOK K Y, et al. Assessing exposure to legacy and emerging per-and polyfluoroalkyl substances via hair-the first nationwide survey in India [J]. Chemosphere, 2019, 229: 366-373. doi: 10.1016/j.chemosphere.2019.04.195 [16] JIAN J M, GUO Y, ZENG L X, et al. Global distribution of perfluorochemicals (PFCs) in potential human exposure source-A review [J]. Environment International, 2017, 108: 51-62. doi: 10.1016/j.envint.2017.07.024 [17] WARDMAN P. Reduction potentials of one‐electron couples involving free radicals in aqueous solution [J]. Journal of Physical and Chemical Reference Data, 1989, 18(4): 1637-1755. doi: 10.1063/1.555843 [18] KEY B D, HOWELL R D, CRIDDLE C S. Fluorinated organics in the biosphere [J]. Environmental Science & Technology, 1997, 31(9): 2445-2454. [19] 梁宇, 马安周, 宋茂勇, 等. 全氟辛烷磺酸生物降解研究进展 [J]. 微生物学通报, 2020, 47(8): 2536-2549. doi: 10.13344/j.microbiol.china.190981 LIANG Y, MA A Z, SONG M Y, et al. Advances in biodegradation of perfluorooctane sulfonate(PFOS) [J]. Microbiology China, 2020, 47(8): 2536-2549(in Chinese). doi: 10.13344/j.microbiol.china.190981
[20] PHONG VO H N, NGO H H, GUO W S, et al. Poly‐and perfluoroalkyl substances in water and wastewater: A comprehensive review from sources to remediation [J]. Journal of Water Process Engineering, 2020, 36: 101393. doi: 10.1016/j.jwpe.2020.101393 [21] LU D N, SHA S, LUO J Y, et al. Treatment train approaches for the remediation of per-and polyfluoroalkyl substances (PFAS): A critical review [J]. Journal of Hazardous Materials, 2020, 386: 121963. doi: 10.1016/j.jhazmat.2019.121963 [22] 许晨敏. 水中典型全氟化合物(PFCs)的吸附及光催化降解研究[D]. 南京: 南京理工大学, 2018. XU C M. Removal of typical perfluorinated compounds (PFCs) by adsorption and photocatalysis[D]. Nanjing: Nanjing University of Science and Technology, 2018(in Chinese).
[23] FURTADO R X S, SABATINI C A, ZAIAT M, et al. Perfluorooctane sulfonic acid (PFOS) degradation by optimized heterogeneous photocatalysis (TiO2/UV) using the response surface methodology (RSM) [J]. Journal of Water Process Engineering, 2021, 41: 101986. doi: 10.1016/j.jwpe.2021.101986 [24] LI X Y, ZHANG P Y, JIN L, et al. Efficient photocatalytic decomposition of perfluorooctanoic acid by indium oxide and its mechanism [J]. Environmental Science & Technology, 2012, 46(10): 5528-5534. [25] JIN C Y, LI Z L, ZHANG Y, et al. The construction of g-C3N4/Sm2+ doped Bi2WO6 2D/2D Z-scheme heterojunction for improved visible-light excited photocatalytic efficiency [J]. Separation and Purification Technology, 2019, 224: 33-43. doi: 10.1016/j.seppur.2019.05.006 [26] WANG J Z, WANG Y N, CAO C S, et al. Decomposition of highly persistent perfluorooctanoic acid by hollow Bi/BiOI1-xFx: Synergistic effects of surface plasmon resonance and modified band structures [J]. Journal of Hazardous Materials, 2021, 402: 123459. doi: 10.1016/j.jhazmat.2020.123459 [27] LI H J, ZHOU Y, TU W G, et al. State-of-the-art progress in diverse heterostructured photocatalysts toward promoting photocatalytic performance [J]. Advanced Functional Materials, 2015, 25(7): 998-1013. doi: 10.1002/adfm.201401636 [28] YANG Y Q, JI W Q, LI X Y, et al. Insights into the degradation mechanism of perfluorooctanoic acid under visible-light irradiation through fabricating flower-shaped Bi5O7I/ZnO n-n heterojunction microspheres [J]. Chemical Engineering Journal, 2021, 420: 129934. doi: 10.1016/j.cej.2021.129934 [29] YAO X Y, ZUO J Q, WANG Y J, et al. Enhanced photocatalytic degradation of perfluorooctanoic acid by mesoporous Sb2O3/TiO2 heterojunctions [J]. Frontiers in Chemistry, 2021, 9: 690520. doi: 10.3389/fchem.2021.690520 [30] LUO D D, YUAN J H, ZHOU J, et al. Synthesis of samarium doped ferrite and its enhanced photocatalytic degradation of perfluorooctanoic acid (PFOA) [J]. Optical Materials, 2021, 122: 111636. doi: 10.1016/j.optmat.2021.111636 [31] TIAN A J, WU Y B, MAO K. Enhanced performance of surface modified TiO2 nanotubes for the decomposition of perfluorooctanoic acid [J]. AIP Conference Proceedings, 2017, 1794(1): 020029. [32] ZHU C, XU J L, SONG S, et al. TiO2 quantum dots loaded sulfonated graphene aerogel for effective adsorption-photocatalysis of PFOA [J]. Science of the Total Environment, 2020, 698: 134275. doi: 10.1016/j.scitotenv.2019.134275 [33] TAN X J, CHEN G H, XING D Y, et al. Indium-modified Ga2O3 hierarchical nanosheets as efficient photocatalysts for the degradation of perfluorooctanoic acid [J]. Environmental Science:Nano, 2020, 7(8): 2229-2239. doi: 10.1039/D0EN00259C [34] GAO H P, CHEN J B, ZHANG Y L, et al. Sulfate radicals induced degradation of Triclosan in thermally activated persulfate system [J]. Chemical Engineering Journal, 2016, 306: 522-530. doi: 10.1016/j.cej.2016.07.080 [35] XU B T, AHMED M B, ZHOU J L, et al. Visible and UV photocatalysis of aqueous perfluorooctanoic acid by TiO2 and peroxymonosulfate: Process kinetics and mechanistic insights [J]. Chemosphere, 2020, 243: 125366. doi: 10.1016/j.chemosphere.2019.125366 [36] WU D, LI X K, TANG Y M, et al. Mechanism insight of PFOA degradation by ZnO assisted-photocatalytic ozonation: Efficiency and intermediates [J]. Chemosphere, 2017, 180: 247-252. doi: 10.1016/j.chemosphere.2017.03.127 [37] WU D, LI X K, ZHANG J X, et al. Efficient PFOA degradation by persulfate-assisted photocatalytic ozonation [J]. Separation and Purification Technology, 2018, 207: 255-261. doi: 10.1016/j.seppur.2018.06.059 [38] LIU X Q, CHEN Z J, TIAN K, et al. Fe3+ promoted the photocatalytic defluorination of perfluorooctanoic acid (PFOA) over In2O3 [J]. ACS ES& T Water, 2021, 1(11): 2431-2439. [39] ZHU Y M, XU T Y, ZHAO D Y, et al. Adsorption and solid-phase photocatalytic degradation of perfluorooctane sulfonate in water using gallium-doped carbon-modified titanate nanotubes [J]. Chemical Engineering Journal, 2021, 421: 129676. doi: 10.1016/j.cej.2021.129676 [40] 朱佳新, 熊裕华, 郭锐. 二氧化钛光催化剂改性研究进展 [J]. 无机盐工业, 2020, 52(3): 23-27,54. doi: 10.11962/1006-4990.2019-0245 ZHU J X, XIONG Y H, GUO R. Research progress in modification of TiO2 photocatalyst [J]. Inorganic Chemicals Industry, 2020, 52(3): 23-27,54(in Chinese). doi: 10.11962/1006-4990.2019-0245
[41] XU T Y, ZHU Y M, DUAN J, et al. Enhanced photocatalytic degradation of perfluorooctanoic acid using carbon-modified bismuth phosphate composite: Effectiveness, material synergy and roles of carbon [J]. Chemical Engineering Journal, 2020, 395: 124991. doi: 10.1016/j.cej.2020.124991 [42] LIU X Q, XU B T, DUAN X G, et al. Facile preparation of hydrophilic In2O3 nanospheres and rods with improved performances for photocatalytic degradation of PFOA [J]. Environmental Science:Nano, 2021, 8(4): 1010-1018. doi: 10.1039/D0EN01216E [43] LI T F, WANG C S, WANG T C, et al. Highly efficient photocatalytic degradation toward perfluorooctanoic acid by bromine doped BiOI with high exposure of (001) facet [J]. Applied Catalysis B:Environmental, 2020, 268: 118442. doi: 10.1016/j.apcatb.2019.118442 [44] LI F, WEI Z S, HE K, et al. A concentrate-and-destroy technique for degradation of perfluorooctanoic acid in water using a new adsorptive photocatalyst [J]. Water Research, 2020, 185: 116219. doi: 10.1016/j.watres.2020.116219 [45] PARK H, VECITIS C D, CHENG J, et al. Reductive defluorination of aqueous perfluorinated alkyl surfactants: Effects of ionic headgroup and chain length[J]. The Journal of Physical Chemistry A. 2009, 113(4): 690-696. [46] LIU Z K, BENTEL M J, YU Y C, et al. Near-quantitative defluorination of perfluorinated and fluorotelomer carboxylates and sulfonates with integrated oxidation and reduction [J]. Environmental Science & Technology, 2021, 55(10): 7052-7062. [47] MURCIA J J, ÁVILA-MARTÍNEZ E G, ROJAS H, et al. Powder and nanotubes titania modified by dye sensitization as photocatalysts for the organic pollutants elimination [J]. Nanomaterials (Basel, Switzerland), 2019, 9(4): 517. doi: 10.3390/nano9040517 [48] LIU J X, ZOU Y J, CRUZ D, et al. Ligand-metal charge transfer induced via adjustment of textural properties controls the performance of single-atom catalysts during photocatalytic degradation [J]. ACS Applied Materials & Interfaces, 2021, 13(22): 25858-25867. [49] O`BOCKRIS M J. A primer on electrocatalysis [J]. Journal of the Serbian Chemical Society, 2005, 70(3): 475-487. doi: 10.2298/JSC0503475B [50] 周键, 王三反. 钛基二氧化铅阳极去除有机污染物的研究进展 [J]. 环境工程, 2014, 32(12): 1-4. doi: 10.13205/j.hjgc.201412001 ZHOU J, WANG S F. The research progress on the removal of organic pollutants by ti-based lead dioxide anode [J]. Environmental Engineering, 2014, 32(12): 1-4(in Chinese). doi: 10.13205/j.hjgc.201412001
[51] YANG B, WANG J B, JIANG C J, et al. Electrochemical mineralization of perfluorooctane sulfonate by novel F and Sb co-doped Ti/SnO2 electrode containing Sn-Sb interlayer [J]. Chemical Engineering Journal, 2017, 316: 296-304. doi: 10.1016/j.cej.2017.01.105 [52] ZHAO G H, ZHANG Y G, LEI Y Z, et al. Fabrication and electrochemical treatment application of a novel lead dioxide anode with superhydrophobic surfaces, high oxygen evolution potential, and oxidation capability [J]. Environmental Science & Technology, 2010, 44(5): 1754-1759. [53] LOU Z M, WANG J Z, WANG S B, et al. Strong hydrophobic affinity and enhanced •OH generation boost energy-efficient electrochemical destruction of perfluorooctanoic acid on robust ceramic/PbO2-PTFE anode [J]. Separation and Purification Technology, 2022, 280: 119919. doi: 10.1016/j.seppur.2021.119919 [54] WANG Q N, LIU M Y, ZHAO H Y, et al. Efficiently degradation of perfluorooctanoic acid in synergic electrochemical process combining cathodic electro-Fenton and anodic oxidation [J]. Chemical Engineering Journal, 2019, 378: 122071. doi: 10.1016/j.cej.2019.122071 [55] LIU G S, ZHOU H, TENG J, et al. Electrochemical degradation of perfluorooctanoic acid by macro-porous titanium suboxide anode in the presence of sulfate [J]. Chemical Engineering Journal, 2019, 371: 7-14. doi: 10.1016/j.cej.2019.03.249 [56] LIU Y M, FAN X F, QUAN X, et al. Enhanced perfluorooctanoic acid degradation by electrochemical activation of sulfate solution on B/N codoped diamond [J]. Environmental Science & Technology, 2019, 53(9): 5195-5201. [57] 黄海彬, 陈栩竺, 施乐华, 等. 二氧化铅阳极改性及电化学氧化性能研究进展 [J]. 广东石油化工学院学报, 2019, 29(3): 71-75. doi: 10.3969/j.issn.2095-2562.2019.03.016 HUANG H B, CHEN X Z, SHI L H, et al. Research process of the lead dioxide anode's modification and electrochemical oxidation performance [J]. Journal of Guangdong University of Petrochemical Technology, 2019, 29(3): 71-75(in Chinese). doi: 10.3969/j.issn.2095-2562.2019.03.016
[58] LIN H, NIU J F, LIANG S T, et al. Development of macroporous Magnéli phase Ti4O7 ceramic materials: As an efficient anode for mineralization of poly-and perfluoroalkyl substances [J]. Chemical Engineering Journal, 2018, 354: 1058-1067. doi: 10.1016/j.cej.2018.07.210 [59] SHI H H, WANG Y Y, LI C G, et al. Degradation of perfluorooctanesulfonate by reactive electrochemical membrane composed of magnéli phase titanium suboxide [J]. Environmental Science & Technology, 2019, 53(24): 14528-14537. [60] HUANG D H, WANG K X, NIU J F, et al. Amorphous Pd-loaded Ti4O7 electrode for direct anodic destruction of perfluorooctanoic acid [J]. Environmental Science & Technology, 2020, 54(17): 10954-10963. [61] ZHUO Q F, LUO M Q, GUO Q W, et al. Electrochemical oxidation of environmentally persistent perfluorooctane sulfonate by a novel lead dioxide anode [J]. Electrochimica Acta, 2016, 213: 358-367. doi: 10.1016/j.electacta.2016.07.005 [62] DUAN X Y, WANG W Y, WANG Q, et al. Electrocatalytic degradation of perfluoroocatane sulfonate (PFOS) on a 3D graphene-lead dioxide (3DG-PbO2) composite anode: Electrode characterization, degradation mechanism and toxicity [J]. Chemosphere, 2020, 260: 127587. doi: 10.1016/j.chemosphere.2020.127587 [63] WANG C, ZHANG T A, YIN L F, et al. Enhanced perfluorooctane acid mineralization by electrochemical oxidation using Ti3+ self-doping TiO2 nanotube arrays anode [J]. Chemosphere, 2022, 286: 131804. doi: 10.1016/j.chemosphere.2021.131804 [64] XU L, QIAN X B, WANG K X, et al. Electrochemical mineralization mechanisms of perfluorooctanoic acid in water assisted by low frequency ultrasound [J]. Journal of Cleaner Production, 2020, 263: 121546. doi: 10.1016/j.jclepro.2020.121546 [65] WANG K X, HUANG D H, WANG W L, et al. Enhanced perfluorooctanoic acid degradation by electrochemical activation of peroxymonosulfate in aqueous solution [J]. Environment International, 2020, 137: 105562. doi: 10.1016/j.envint.2020.105562 [66] ZHUO Q F, DENG S B, YANG B, et al. Efficient electrochemical oxidation of perfluorooctanoate using a Ti/SnO2-Sb-Bi anode [J]. Environmental Science & Technology, 2011, 45(7): 2973-2979. [67] BEHARA D K, TAMMINENI J, MAHESWARI M S. TiO2/ZnO: Type-II Heterostructures for electrochemical crystal violet dye degradation studies [J]. Macedonian Journal of Chemistry and Chemical Engineering, 2020, 39(2): 217-226. doi: 10.20450/mjcce.2020.2058 [68] TANG B, SHI H J, FAN Z Y, et al. Preferential electrocatalytic degradation of 2, 4-dichlorophenoxyacetic acid on molecular imprinted mesoporous SnO2 surface [J]. Chemical Engineering Journal, 2018, 334: 882-890. doi: 10.1016/j.cej.2017.10.086 [69] ZHANG C, JIANG Y H, LI Y L, et al. Three-dimensional electrochemical process for wastewater treatment: A general review [J]. Chemical Engineering Journal, 2013, 228: 455-467. doi: 10.1016/j.cej.2013.05.033 [70] LI J, YAN J F, YAO G, et al. Improving the degradation of atrazine in the three-dimensional (3D) electrochemical process using CuFe2O4 as both particle electrode and catalyst for persulfate activation [J]. Chemical Engineering Journal, 2019, 361: 1317-1332. doi: 10.1016/j.cej.2018.12.144 [71] PENG Y P, CHEN H L, HUANG C P. The synergistic effect of photoelectrochemical (PEC) reactions exemplified by concurrent perfluorooctanoic acid (PFOA) degradation and hydrogen generation over carbon and nitrogen codoped TiO2 nanotube arrays (C-N-TNTAs) photoelectrode [J]. Applied Catalysis B:Environmental, 2017, 209: 437-446. doi: 10.1016/j.apcatb.2017.02.084 [72] GU Y R, LIU T Z, WANG H J, et al. Hydrated electron based decomposition of perfluorooctane sulfonate (PFOS) in the VUV/sulfite system [J]. Science of the Total Environment, 2017, 607/608: 541-548. doi: 10.1016/j.scitotenv.2017.06.197 [73] SU Y M, RAO U, KHOR C M, et al. Potential-driven electron transfer lowers the dissociation energy of the C-F bond and facilitates reductive defluorination of perfluorooctane sulfonate (PFOS) [J]. ACS Applied Materials & Interfaces, 2019, 11(37): 33913-33922. -



 下载:
下载: