-
毛细管液相色谱是一种微型化的液相色谱分离技术[1],毛细管直径范围从几微米至几百微米. 由于其具有柱内体积小(0.01—30 μL)、节约试剂(0.1—10 L·a−1)、所需样品量少以及易与当前使用较为广泛的检测器(如质谱、光学和电化学检测器等)在线联用等诸多优势[2],在痕量样本检测方面具有独特优势[3-4].
毛细管柱的填充方法包括多种:有湿法填充[5](包括上行法和下行法)、干法填充[6]和电泳填充法[7]. 在上世纪70年代,Ishii[8]和Novotny[9]等就开展了一系列的研究工作,致力于填充出高效毛细管柱. 他们填充的毛细管柱内径较大,约为几百微米. 之后Jorgenson和Kennedy等研发了多种填充方法,极大地提高了柱效,并且能够填充超低内径的毛细管柱(低至12 μm)[2,9-14]. 但是上行法装填毛细管柱的过程中,为了防止填料的自然沉降,采用磁子对匀浆持续地搅拌[15]. 这种填充方式带来的弊端就是会使填料破碎,这样会导致填料的硅羟基暴露于色谱环境中,不断地吸附样品,例如碱性物质、大分子蛋白质、核酸等分子等[16],进而影响色谱柱的柱效、分离度下降、色谱柱寿命降低等情况. 因此,毛细管柱的装填过程应格外注意保护填料,避免破碎. 与上行法相比较,下行法无需磁力搅拌装置,可降低破碎率. 但是下行法为了抵抗由于重力引起的填料聚沉,多采用快速填充方式,利用低粘度的有机溶剂进行快速填充[17]. 填料在快速下行过程中,仍然会与管口碰撞而导致破碎.
为解决此类难题,关亚风研发了干法填充技术[6],用于填充大内径色谱柱(例如200—500 μm),填料尺寸为5—10 μm的球形填料. 在过程采用低压填充(低于1 MPa),因此完全避免了填料的破碎,色谱柱的柱效高且性能稳定、惰性好. 但是干法填充技术不适合采用尺寸≤ 3 μm的填料和填充内径低于50 μm的毛细管柱,而匀浆法没有这个限制.
针对以上问题,本文拟解决细内径毛细管填充所面临的填料易破碎、柱效不稳定等问题. 首先,自主设计一款填充装置,装置内部为一款自制的尼龙漏斗,为进一步减小填料碰撞,尼龙的出料口直径与柱内径相同;本文也研制出一款下行式填充方法,采用体积比为9:1丙酮/甲醇作为匀浆溶剂进行缓慢填充,确保在填充过程中填料可均匀分散,提高柱效. 本实验填充的毛细管柱内径为25—250 μm, 有效长度为100 mm和150 mm.
-
石英毛细管(外径365 μm,内径分别为25、50、75、100、200、250 μm);填料为大连化学物理研究所赠与,填料表面修饰C18的硅胶球(填料直径3 μm). 所用匀浆试剂为乙腈、丙酮、甲醇、己烷(色谱纯,Merck)和曲拉通X-100(Triton X-100,美仑生物). 4种测试柱效的试剂分别为硝基苯、萘、菲和芘(分析纯,阿拉丁),用乙腈/水(80:20)配成0.25 g·L−1的测试混合样品. 筛板采用正硅酸乙酯(TEOS)、盐酸(1.2 mol·L−1)以及5 μm的硅胶填料制作.
-
岛津液相色谱泵;Jasco CE-975多波长紫外检测器(日本),设置波长254 nm;采用色谱3010工作站采集数据和计算实际柱效;倒置显微镜IX30;场发射扫描电子显微镜(FESEM)型号JSM-7800F(日本).
-
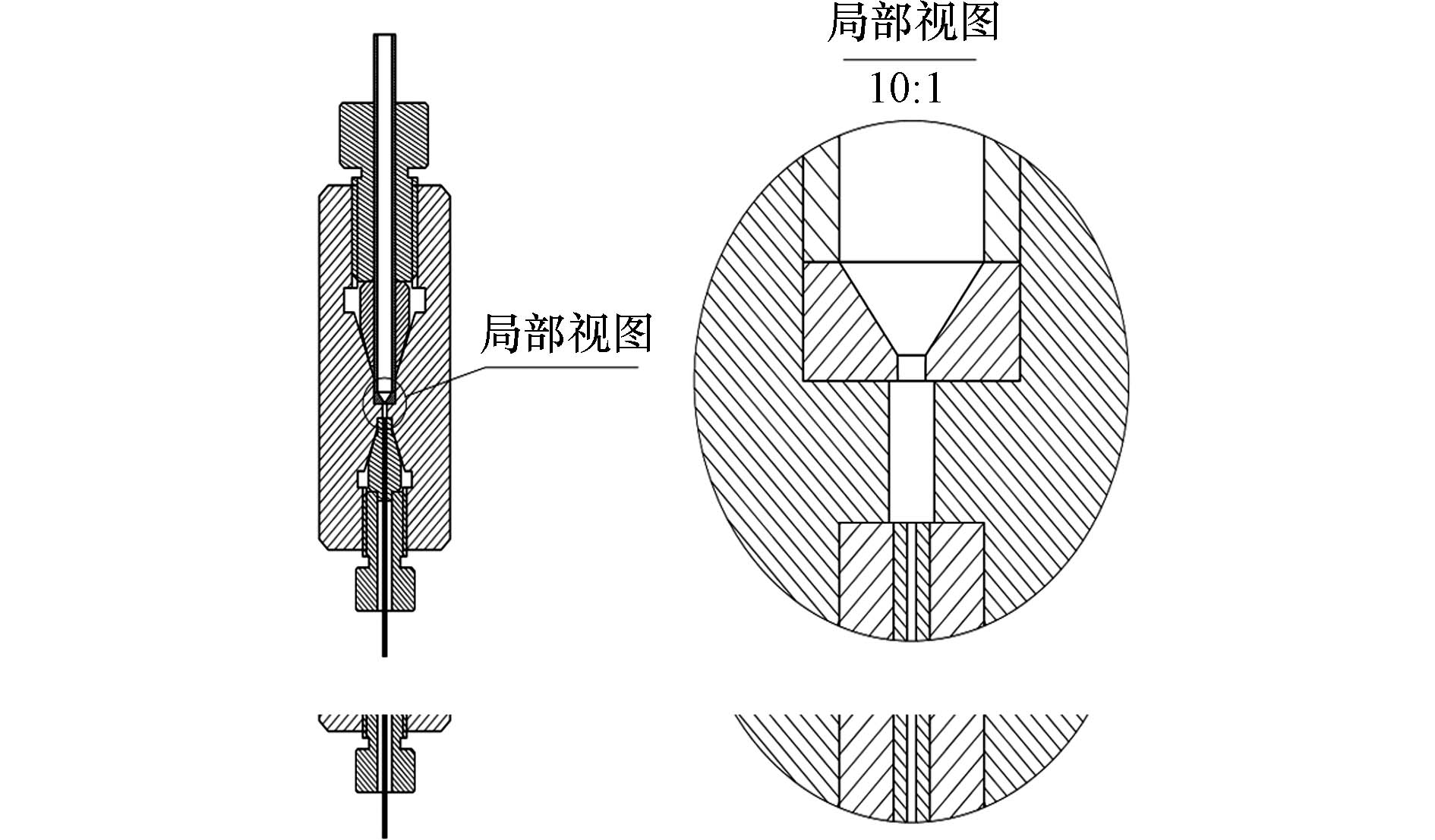
本实验研发一款填充装置,该装置为一个不锈钢罐,罐的内部添加一个尼龙漏斗,罐的上部连接液相色谱泵,罐的下部与毛细管柱连接,并采用PEEK管进行密封(外径1/16英寸,内径0.4 mm). 该填充装置的设计图如图1所示.
-
为测定填料的粒径分布,采用场发射扫描电子显微镜(field emission scanning electron microscopy, FESEM)观测填料的粒径和形貌,在照片中选取约143颗填料进行粒径分析. 形貌见图2(A),填料均呈现均匀的圆形且较完整,其粒径分布统计图见2(B). 经Gwyddion软件分析,粒径平均为3.68 μm (RSD=5.56%).
-
分别采用甲醇、丙酮、己烷、体积比为9:1丙酮/甲醇以及体积比为99:1水/Triton X-100作为匀浆溶剂,配置浓度为5 mg·mL−1和10 mg·mL−1的匀浆,将匀浆在超声仪中放置10 min后,移取10 μL匀浆置于显微镜下观察其匀浆状态;然后将上述匀浆重新超声5 min测定填料下沉时间.
-
在填充毛细管柱之前,首先制作毛细管柱的筛板. 制作的简要步骤如下:取115 μL HCl(1.2 mol·L−1),加入200 μL的TEOS后进行超声混匀,然后迅速加入5 μm的硅胶填料,两者的混合比例约为100 mL:30 mg,迅速进行超声2 min. 随后匀浆填料虹吸至毛细管内,注意筛板的长度约为几毫米,若太长则会影响色谱柱的通透性. 虹吸之后放入60℃烘箱,加热34 h,生成耐高压的筛板[18].
本实验采用3.68 μm的C18硅胶色谱填料,填充不同内径的毛细管柱. 在填充之前,经过实验优化,确定了5—30 mg·mL−1为最佳浓度,因为浓度大于30 mg·mL−1则会导致填料迅速沉降,堵塞管口,造成填充失败;而浓度低于5 mg·mL−1,则会导致填料浓度过低,柱中出现柱塌陷和孔隙率较大的情况,进而导致柱效低的情况,因此,综合以上情况来看,5—30 mg·mL−1为最佳浓度. 将上述匀浆经超声处理10 min[19],快速放入匀浆罐进行填充. 色谱泵中溶剂为纯水,采用高压填充,流速为0.1 mL·min−1. 由于采用恒流模式,在填充过程中,柱压会不断升高,当填充压力为35 MPa时,关闭流动相,最后,在20 MPa下过夜冲洗(甲醇和水各6 h).
-
为了最小化柱外效应,采用柱上检测方式(On-Column Detection),采用4种常见的苯系物硝基苯、萘、菲和芘为分析物,测定实际的柱效和分离度,分析流动相为体积比为80:20的ACN/H2O,改变测试流速并绘制h-V曲线. 评价完毕后取出填料并在电镜下观测其形貌.
-
由于上行法所采用的磁力搅拌会增加填料破碎率[20],因此,本文研发下行法填充毛细管. 设计装置如图1所示. 装置内部有一个尼龙漏斗,其出口内径与柱内径相同减少填充过程中的冲击. 色谱柱评价后,填料在电镜下的照片如图3所示,经高压冲洗和测试后,填料仍可保持完整.
-
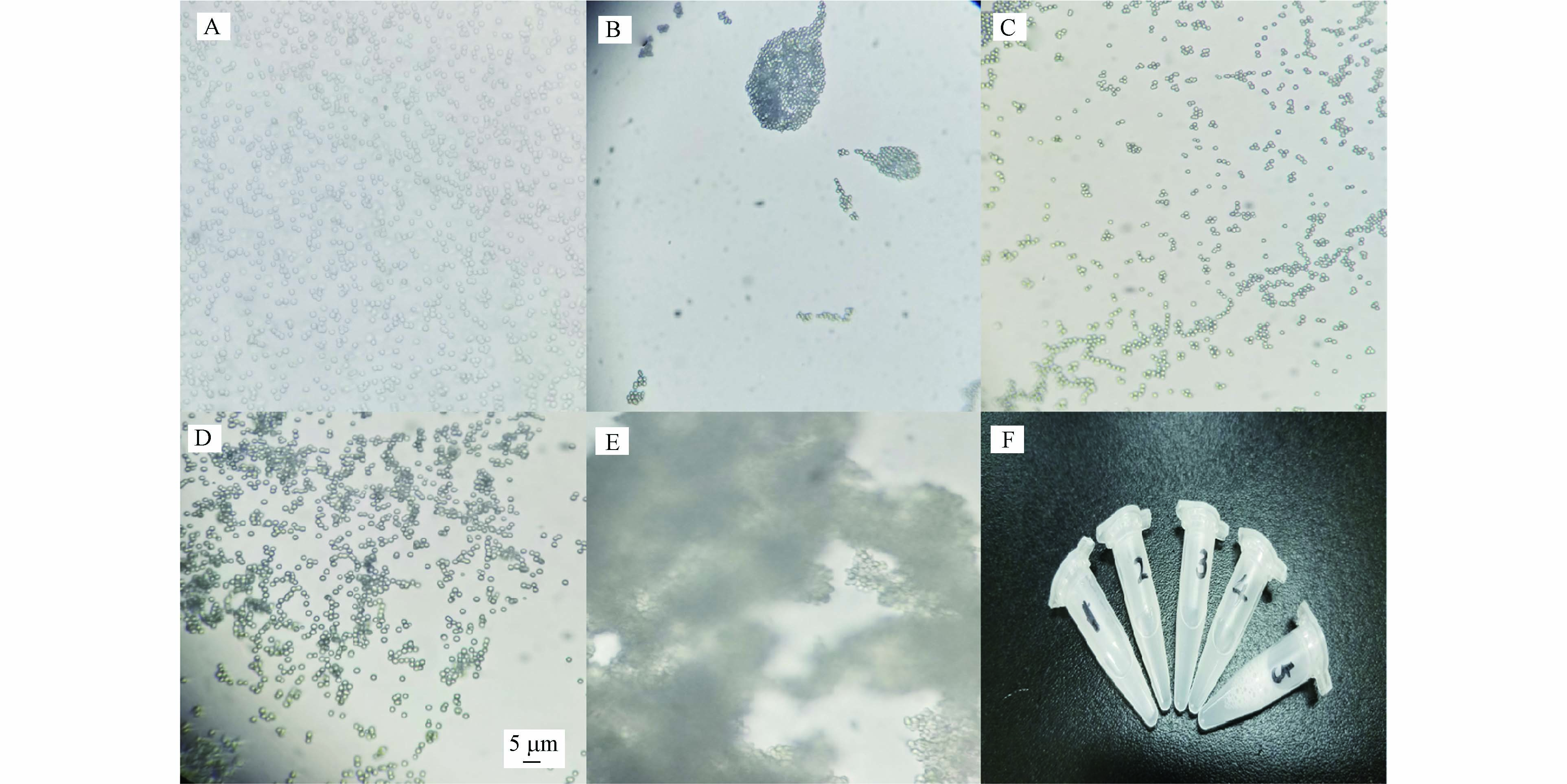
填料的分散状态会影响填充色谱柱的性能[20-21]. 填料表面的电荷会导致填料彼此吸引,出现大块的粘结现象,填充过程中容易堵塞毛细管口,造成填充失败. 并且经过研究发现,相互“粘结”的填料在填充过程中容易导致柱子填充不紧实,而造成较大的“死体积”,进而导致低柱效. 因此,匀浆溶剂的选择十分重要,需要充分的分散填料. 本实验选择体积比为99:1水/Triton X-100、丙酮、体积比为9:1丙酮/甲醇、己烷和甲醇等作为匀浆溶剂,测定填料的分散状态,相比之下,图4(A)中体积比为99:1水/Triton X-100和图4(C)中体积比为9:1丙酮/甲醇的分散能力相对较好,可作为C18硅胶填料的匀浆溶剂.
由于重力的作用,填料会自然沉降,导致柱内填料的均匀度变差. 因此,需要在填料完全沉降之前完成色谱柱填充. 经测定,填料沉降时间见表1,并且填料浓度越高,沉降速度越快. 填料在体积比为99:1水/Triton X-100中的沉降较慢,在甲醇中沉降最快,在丙酮、体积比为9:1丙酮/甲醇和己烷中的沉降速度相当.
-
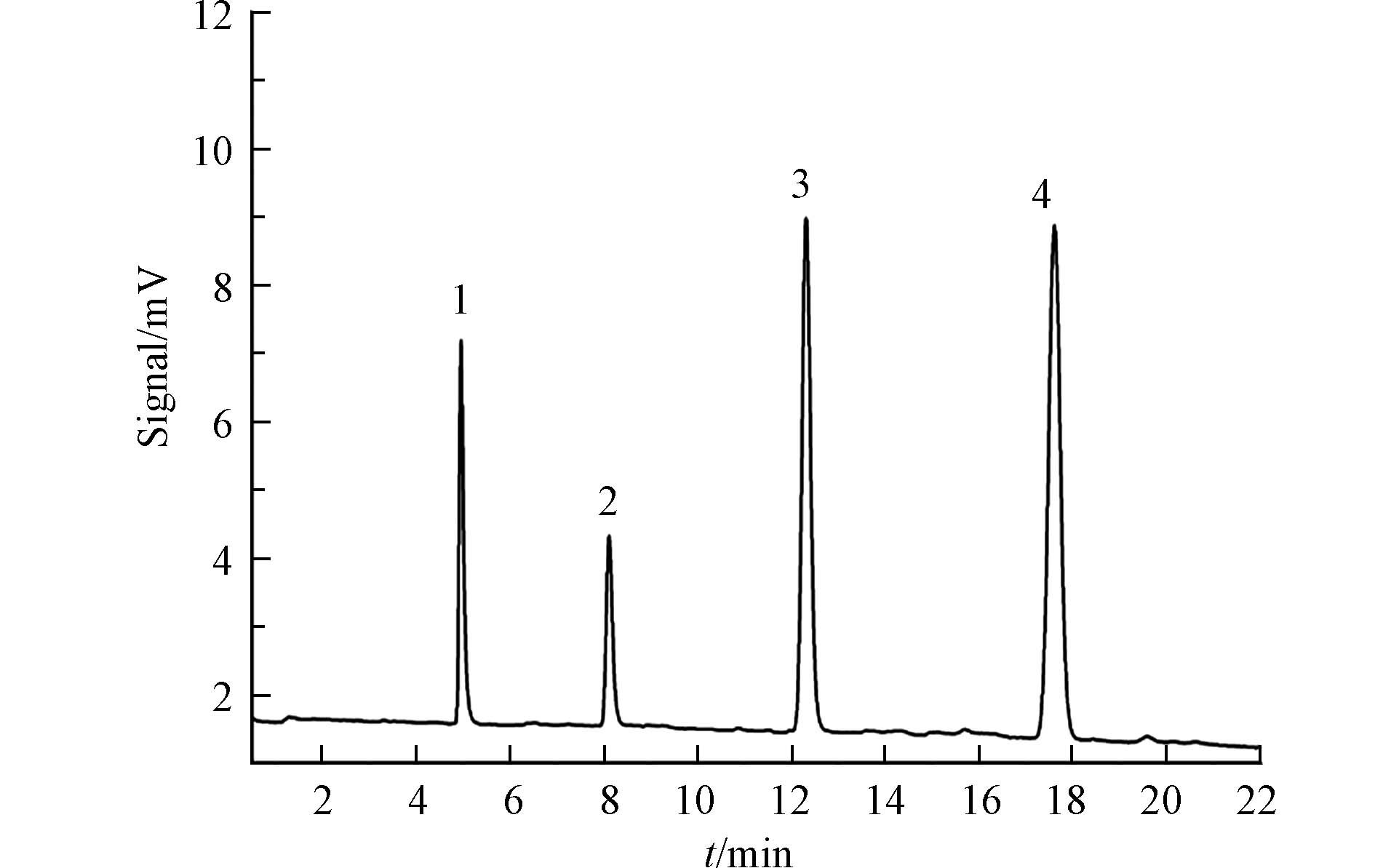
基于以上测定结果,最终以体积比为99:1水/Triton X-100、体积比为9:1丙酮/甲醇和己烷作为匀浆溶剂,填充内径为50 μm(i.d.)的毛细管柱并测定柱效,见表2. 结果表明, 采用体积比为9:1丙酮/甲醇填充的柱子性能最优. 为了去除溶解残留,柱子填充后分别采用甲醇和水冲洗6 h. 图5为25 μm(i.d.)毛细管柱在折合流速(V=2.4)下的色谱图,4种物质的调整保留值(k′)分别为0.60、1.62、2.97、4.68(此色谱图中的信噪比可达200). 其最小折合塔板高仅为2.25(k′=4.68),非常接近理论值(h=2). 图6为内径为25 μm(i.d.)毛细管柱的Van Deemter曲线(分析物为芘).
-
为研究柱效与柱内径的关系,本文制备了6种规格的毛细管柱. 6种色谱柱匀浆浓度的变化范围是5—30 mg·mL−1,除此之外,其他填充条件均相同,实验条件见1.5节,实验结果见表3,柱内径越细,柱效越高.
-
Van Deemter方程(式1)可以较直观的反映出色谱柱的性能.
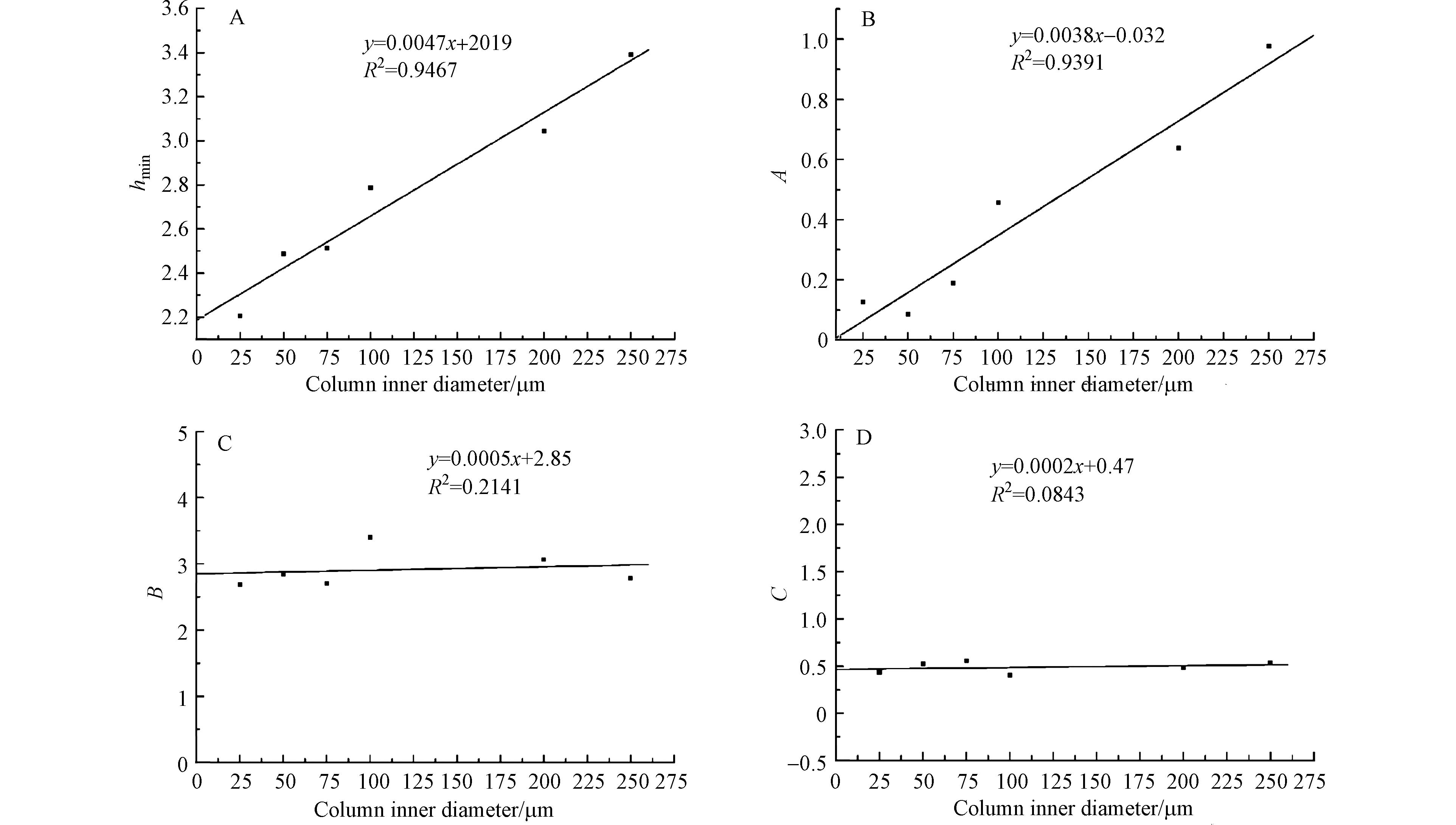
图7为不同内径毛细管色谱柱的Van Deemter 方程中A、B、C三个系数随内径的变化情况. 在Van Deemter方程中的系数中,A(涡流扩散项的系数)与柱内径呈现出良好的线性关系,随着柱内径减小,A数值变小. 原因是:色谱柱内具有靠近管壁较疏松的“管壁区”与靠近中心区域较紧密的“核心区”,两个区域的相比不同,分析物在两个区域的保留时间将产生差异;内径越细,两个区域的差异越小,由此所造成的峰展宽也会随之减小[22]. 直至颗粒与柱直径之比降低到6以下,核心区域将消失[23],分析物在柱内的移动速度趋于一致. 因此,柱内径越细,色谱柱内部的均匀程度越高,涡流扩散(A)项越小.
B(纵向扩散项的系数)与毛细管的内径无明显线性关系,从Van Deemter 方程(式1)分析可知,纵向扩散项(B项)与色谱柱中填料的填充因子(γ≈0.6)和溶质在流动相中的扩散系数有关(DM≈10−6 — 10−5cm2·s−1),与柱内径无关. 从图7(C)可知,B项数值不随内径的改变而呈现线性变化,其原因是不同的色谱柱的填充密度与填充的均匀程度略有差异,与填充方式有关,与柱内径无关.
C(传质阻力项的系数)也不随内径的改变而呈现线性变化. 因为C项为固定相传质阻力和流动相传质阻力的加和,取决于分析物在流动相中的扩散系数和填料粒径及固定相膜厚度等因素,由于不同内径的毛细管柱所用的固定相和流动相均相同,因此,各个毛细管柱的C项相差不大.
-
填充细内径毛细管柱是一个精细且复杂的过程. 常规毛细管内径约为(200—500 μm),管径较大,填充较容易,可以采用干法填充和湿法填充;而细内径毛细管由于内径较小(仅约25—150 μm),在填充过程中容易导致填料堵塞管口而造成填充失败,并且由于填充过程需要较高压力(20—40 MPa),应该格外注意安全,仅能使用湿法填充. 其柱效会受到填充溶剂、填充压力和填料质量等因素的影响. 实际上,随着色谱柱内径和颗粒直径的减小,填充的难度会急剧增加. 本文采用自行设计的填充装置以下行式匀浆法填充细内径毛细管液相色谱柱,降低了填充时填料的破碎率. 采用体积比为9:1丙酮/甲醇作为匀浆溶剂进行缓慢填充,在填充过程中填料在匀浆溶剂中可保持均匀分散的状态,获得高柱效.
本实验研究了内径与Van Deemter方程中A, B, C项的系数及柱效的关系. 在细内径毛细管柱(25—250 μm)中,随着内径降低,毛细管色谱柱的柱效呈现明显增加的趋势. 在柱内径25 μm时,最小折合塔板高度仅为2.25(k′=4.68),柱效高达148200 m−1. 在应用方面,因为细内径毛细管柱对于样品的稀释效应较小,其对于痕量样品分析具有极大的优势,有望应用于环境、生物样品中痕量成分的高效分离分析.
下行式匀浆法填充细内径毛细管液相色谱柱
Preparation of small-diameter capillary liquid chromatography columns using downward packing method
-
摘要: 本文采用下行式匀浆法填充内径为25—250 μm,有效长度为100 mm和150 mm的毛细管液相色谱柱,填料为3 μm C18修饰的多孔硅球. 经实验条件优化,匀浆溶剂是体积比为9 : 1丙酮/甲醇,匀浆浓度的变化范围为5—30 mg·mL−1. 在此条件下,色谱柱的柱效随柱内径减小而提高. 通过比较Van Deemter方程中A、B和C项系数与毛细管内径之间的关系发现,随着柱内径减小,A项的系数呈线性减小的趋势,B和C项的系数与内径无明显关系. 在最佳流速下,内径为25 μm毛细管柱的折合塔板高度低至2.25,接近理论塔板高度.
-
关键词:
- 下行法 /
- 毛细管柱 /
- 柱效 /
- Van Deemter方程.
Abstract: We developed a downward packing method for preparing the efficient capillary column with inner diameters (i.d.) from 25—250 µm in the effective length of 100—150 mm. The columns were packed by 3 μm of C18 modified silica particles with 5—30 mg·mL−1 slurries in acetone/methanol (9:1, V/V). In this condition, the column efficiency was increased as the diameter of the column decreased. By comparing the coefficients of A, B and C term in the Van Deemter equation with the inner diameters of the capillary columns, we found the coefficient of A term decreased linearly with decreasing the i.d. of the column. However, there is no linear relationship between the coefficients of the B and C terms with the i.d. of the column. At the optimum reduced velocity, the hmin (the minimum plate height) of the 25 μm i.d. column was as low as 2.25, which is very close to the theoretical plate (HETP).-
Key words:
- downward packing method /
- capillary columns /
- column efficiency /
- Van Deemter equation.
-

-
表 1 不同浓度下色谱填料在溶剂中的沉降时间
Table 1. Sedimentation time of chromatography packing materials in solvents at different concentrations
匀浆溶剂
Slurry solvents沉降时间/ min
Sedimentation time甲醇 (30 mg·mL−1) 2.5 丙酮 (30 mg·mL−1) 12 己烷 (30 mg·mL−1) 14 丙酮/甲醇(9:1,V/V)(30 mg·mL−1) 8 水/Triton X-100(99:1,V/V)(30 mg·mL−1) 67 甲醇 (10 mg·mL−1) 3 丙酮 (10 mg·mL−1) 14 己烷 (10 mg·mL−1) 16 丙酮/甲醇(9:1,V/V)(10 mg·mL−1) 10 水/Triton X-100(99:1,V/V)(10 mg·mL−1) 70 甲醇 (5 mg·mL−1) 5 丙酮 (5 mg·mL−1) 16 己烷 (5 mg·mL−1) 18 丙酮/甲醇(9:1,V/V)(5 mg·mL−1) 12 水/Triton X-100(99:1,V/V)(5 mg·mL−1) 75 表 2 不同匀浆溶剂填充下毛细管柱的柱效及柱压比较(50 μm i.d.)
Table 2. Comparison of the column efficiency of capillary column packed by different slurry solvents (50 μm i.d.)
匀浆溶剂
Solvents理论塔板数/m
N折合塔板高度
Reduced h min压力* / MPa
Pressure水/Triton X-100(99:1,V/V) 98340 2.76 2.6 丙酮/甲醇(9:1,V/V) 131970 2.06 4.8 己烷 114380 2.38 4.7 *压力为最佳流速下的柱压(MPa)(The column pressure is detected at the optimal flow rate) 表 3 不同内径毛细管柱的柱效比较
Table 3. Comparison of column efficiency of different inner diameter capillary columns
柱内径/μm
Column inner diameter匀浆浓度/(mg·mL−1)
Slurry concentration柱效N/ m−1 折合塔板高度
Reduce h min25 5 148200 1.83 50 10 134000 2.03 75 15 132700 2.05 100 20 119600 2.27 200 25 109500 2.48 250 30 98300 2.76 -
[1] JORGENSON J W. Capillary liquid chromatography at ultrahigh pressures [J]. Annual Review of Analytical Chemistry (Palo Alto, Calif. ), 2010, 3: 129-150. doi: 10.1146/annurev.anchem.1.031207.113014 [2] MACNAIR J E, LEWIS K C, JORGENSON J W. Ultrahigh-pressure reversed-phase liquid chromatography in packed capillary columns [J]. Analytical Chemistry, 1997, 69(6): 983-989. doi: 10.1021/ac961094r [3] NOVOTNY M V. Development of capillary liquid chromatography: A personal perspective [J]. Journal of Chromatography A, 2017, 1523: 3-16. doi: 10.1016/j.chroma.2017.06.042 [4] WILSON S R, VEHUS T, BERG H S, et al. Nano-LC in proteomics: Recent advances and approaches [J]. Bioanalysis, 2015, 7(14): 1799-1815. doi: 10.4155/bio.15.92 [5] BORRA C, HAN S M, NOVOTNY M. Quantitative analytical aspects of reversed-phase liquid chromatography with slurry-packed capillary columns [J]. Journal of Chromatography A, 1987, 385: 75-85. doi: 10.1016/S0021-9673(01)94623-0 [6] GUAN Y F, ZHOU L M, SHANG Z H. Dry-packed capillary columns for micro HPLC [J]. Journal of High Resolution Chromatography, 1992, 15(7): 434-436. doi: 10.1002/jhrc.1240150706 [7] JORGENSON J W, LUKACS K D. High-resolution separations based on electrophoresis and electroosmosis [J]. Journal of Chromatography A, 1981, 218: 209-216. doi: 10.1016/S0021-9673(00)82057-9 [8] ISHII D, ASAI K, HIBI K, et al. A study of micro-high-performance liquid chromatography [J]. Journal of Chromatography A, 1977, 144(2): 157-168. doi: 10.1016/S0021-9673(00)99351-8 [9] GLUCKMAN J C, HIROSE A, MCGUFFIN V L, et al. Performance evaluation of slurry-packed capillary columns for liquid chromatography [J]. Chromatographia, 1983, 17(6): 303-309. doi: 10.1007/BF02270662 [10] GODINHO J M, REISING A E, TALLAREK U, et al. Implementation of high slurry concentration and sonication to pack high-efficiency, meter-long capillary ultrahigh pressure liquid chromatography columns [J]. Journal of Chromatography A, 2016, 1462: 165-169. doi: 10.1016/j.chroma.2016.08.002 [11] MELLORS J S, JORGENSON J W. Use of 1.5-microm porous ethyl-bridged hybrid particles as a stationary-phase support for reversed-phase ultrahigh-pressure liquid chromatography [J]. Analytical Chemistry, 2004, 76(18): 5441-5450. doi: 10.1021/ac049643d [12] REISING A E, GODINHO J M, JORGENSON J W, et al. Bed morphological features associated with an optimal slurry concentration for reproducible preparation of efficient capillary ultrahigh pressure liquid chromatography columns [J]. Journal of Chromatography A, 2017, 1504: 71-82. doi: 10.1016/j.chroma.2017.05.007 [13] BLUE L E, JORGENSON J W. 1.1 μm Superficially porous particles for liquid chromatography [J]. Journal of Chromatography A, 2015, 1380: 71-80. doi: 10.1016/j.chroma.2014.12.055 [14] REISING A E, GODINHO J M, BERNZEN J, et al. Axial heterogeneities in capillary ultrahigh pressure liquid chromatography columns: Chromatographic and bed morphological characterization [J]. Journal of Chromatography A, 2018, 1569: 44-52. doi: 10.1016/j.chroma.2018.07.037 [15] TREADWAY J W, WYNDHAM K D, JORGENSON J W. Highly efficient capillary columns packed with superficially porous particles via sequential column packing [J]. Journal of Chromatography A, 2015, 1422: 345-349. doi: 10.1016/j.chroma.2015.10.013 [16] QI Y X, WU D P, WEI J Y, et al. Selective extraction of low molecular weight proteins by mesoporous silica particles with modified internal and external surfaces [J]. Analytical and Bioanalytical Chemistry, 2010, 398(4): 1715-1722. doi: 10.1007/s00216-010-4081-1 [17] 唐意红, 朱道乾, 关亚风. 不锈钢宽口径填充毛细管液相色谱柱的制备及评价 [J]. 分析化学, 2001, 29(10): 1228-1232. doi: 10.3321/j.issn:0253-3820.2001.10.030 TANG Y H, ZHU D Q, GUAN Y F. Preparation and evaluation of stainless-steel wide-bore packed capillary high performance liquid chromatographic columns [J]. Chinese Journal of Analytieal Chemistry, 2001, 29(10): 1228-1232(in Chinese). doi: 10.3321/j.issn:0253-3820.2001.10.030
[18] DENG N, HE Y Z, WANG L, et al. Reversed-phase electrochromatography with a monolithic microcolumn prepared in a 2.2-mm-inner diameter fused-silica tube [J]. Analytical Chemistry, 2005, 77(17): 5622-5627. doi: 10.1021/ac050589q [19] BRUNS S, FRANKLIN E G, GRINIAS J P, et al. Slurry concentration effects on the bed morphology and separation efficiency of capillaries packed with sub-2 μm particles [J]. Journal of Chromatography A, 2013, 1318: 189-197. doi: 10.1016/j.chroma.2013.10.017 [20] KARLSSON K E, NOVOTNY M. Separation efficiency of slurry-packed liquid chromatography microcolumns with very small inner diameters [J]. Analytical Chemistry, 1988, 60(17): 1662-1665. doi: 10.1021/ac00168a006 [21] VISSERS J P C. Recent developments in microcolumn liquid chromatography [J]. Journal of Chromatography A, 1999, 856(1/2): 117-143. [22] HSIEH S, JORGENSON J W. Preparation and evaluation of slurry-packed liquid chromatography microcolumns with inner diameters from 12 to 33 microns [J]. Analytical Chemistry, 1996, 68(7): 1212-1217. doi: 10.1021/ac950682m [23] KNOX J H, PARCHER J F. Effect of the column to particle diameter ratio on the dispersion of unsorbed solutes in chromatography [J]. Analytical Chemistry, 1969, 41(12): 1599-1606. doi: 10.1021/ac60281a009 -



 下载:
下载: