-
近年来由于食品加工行业的发展,随之产生了大量有机物浓度较高且含盐量较高的废水. 由于高浓度盐分的存在,采用生化处理会造成微生物活性受到严重抑制,最终导致对废水中的有机物降解效率低下[1]. 好氧膜生物反应器(aerobic membrane bioreactor,MBR)技术相较于传统好氧工艺,能很好将污泥截留在系统中,从而提高处理效率. 此外,MBR能将污泥停留时间(sludge retention time, SRT)与水力停留时间(hydraulic retention time, HRT)分开控制,易于管理控制,因此近几年在高盐废水处理中受到普遍关注[2-3]. 然而在采用MBR工艺处理高盐废水过程中面临的主要问题是膜污染问题[4]. 膜污染是指混合液中的污泥絮体、胶体粒子或有机盐和无机盐类,与膜存在物理化学作用而在膜表面沉淀与积累,或由于膜孔的吸附而使膜孔堵塞,过滤性下降,从而导致膜通量与分离特性的不可逆的变化的现象[5]. 膜污染的表观现象是随着MBR的运行,系统拦截的污泥和过滤的水量增多,膜表面会堆积形成滤饼层以及凝胶层,从而造成跨膜压差(trans-membrane pressure,TMP)的增加,导致膜通量越来越低. 当TMP增加到一定值时,膜无法正常使用,需要进行物理和化学清洗,高频次的化学清洗会影响膜的寿命. 因此膜污染是膜生物反应器在运行过程种需要重点控制的对象,它不仅影响膜组件的产水率,还影响膜组件的使用寿命及设备的能耗[6].
目前关于MBR处理高盐废水的膜污染已有较多报道,李津[7]研究发现,MBR工艺处理高盐废水过程中微生物所分泌的大量溶解性微生物产物(soluble microbial products, SMP)和胞外聚合物(bound extracellular polymeric substances, BEPS)是造成膜污染的主要原因,用清水结合次氯酸钠溶液能有效清洗膜. 李彬等[8]针对MBR处理高盐废水时膜面污染物的特性进行了研究,发现随着MBR系统盐度的升高,污泥的性质发生了较大变化,污泥的悬浮性固体(SS)及挥发性悬浮固体(VSS)与SS的比值均发生了下降,SMP的含量略有上升,膜面的有机污染物主要成分为糖类、蛋白和腐殖酸等. 陈启伟[9]研究表明,较小的污泥粒径对膜通量是不利的,较小的粒径会加速浓差极化的形成,从而加速膜污染. 还有报道指出盐度的存在会增加膜表面的结垢倾向,加速膜污染的形成[10].
尽管关于高盐废水处理过程的膜污染问题及影响因素已有相关报道,然而膜污染问题及成因仍然是一个比较复杂的问题,且不同的水质和运行条件对膜污染和污泥性质产生的影响均不同. 因此,本研究针对连云港某营养食品加工企业生产的两种SO42-浓度分别为1.6%和2.6%的废水,采用两套中试规模好氧膜生物反应器(MBR)进行处理,通过对两系统的TMP和污泥性质以及膜阻分布情况进行监测,初步研究对比探讨不同硫酸盐浓度对活性污泥性质和膜污染的影响. 通过对MBR处理高盐废水中膜污染规律和污泥性质的研究,有利于MBR系统在处理高盐废水中的改造和膜清洗方案的选择,且对膜生物反应器的开发及工程化应用有一定的指导意义.
-
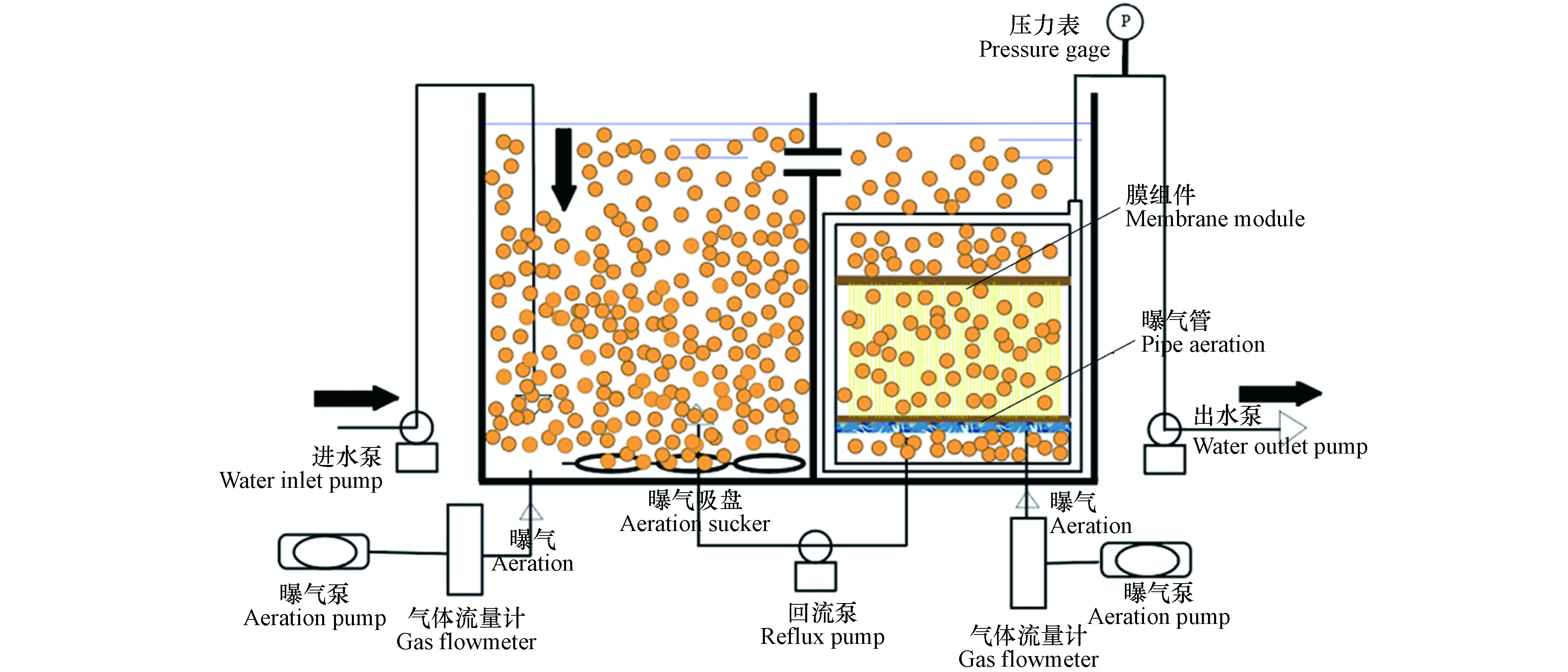
本研究采用MBR工艺,装置如图1所示.
装置主要由硝化池(O池)和MBR池组成,两池的有效容积都为44 L,整套反应器的总有效容积为88 L. 在O池和MBR出的底部装有纳米吸盘曝气装置,曝气装置分别用空气流量计控制,用以保持池内的溶解氧在2—4 mg·L−1,同时可以使池内的污泥混合液充分混合,防止污泥沉底堆积. MBR池的硝化液通过蠕动泵控制回流至O池,以控制两池污泥浓度相同,防止MBR池污泥经浓缩后浓度过高,影响两池的硝化性能. 污泥停留时间(sludge retention time,SRT)为44 d.
实验所用的膜组件为聚偏氟乙烯(PVDF,江苏诺莱智慧水务装备有限公司)的中空纤维膜,有效膜面积为0.43 m2,过滤方式采用负压抽吸. 膜组件底部设有射流曝气装置,在提供溶解氧的同时可以冲刷膜表面,缓解膜污染. 反应器的进出水均采用蠕动泵控制,出水的抽停比为9 min:1 min,跨膜压差(trans-membrane pressuredrop,TMP)采用压力表测定,当TMP超过30 kPa时,对膜组件进行清洗.
-
本实验接种的污泥取自无锡市某餐厨废水处理厂的好氧生化污泥,所用废水为连云港某营养食品加工企业产生的废水,因生产工艺的不同,会产生不同
${\rm{SO}}_4^{2-} $ 浓度的废水,故本实验采用两种${\rm{SO}}_4^{2-} $ 浓度的废水进行实验研究. 其详细水质如表1和表2所示.两股废水中原水有机物较高,而TN较低,使得C/N过高,在运行了25 d后,
${\rm{SO}}_4^{2-} $ 浓度为1.6%的反应器,因有机物降解效率不佳,尝试通过调整进水C/N,控制C/N在25左右. 进水${\rm{SO}}_4^{2-} $ 浓度为2.6%的反应器低,在运行了40 d后,添加尿素补充氮源控制C/N同样为25左右. 且其进水${\rm{SO}}_4^{2-} $ 在第50 d有所降低,在2.2%—2.3%范围内波动. -
同时运行两组实验MBR装置,一组进水
${\rm{SO}}_4^{2-} $ 浓度保持为1.6%,另一组初始进水${\rm{SO}}_4^{2-} $ 浓度为2.6%,运行50 d后由于进水水质变化调整为2.3%. 有机负荷根据出水COD值来判断是否提升,若出水COD稳定于200 mg·L−1以下则提升负荷. 进水${\rm{SO}}_4^{2-} $ 浓度为1.6%的MBR装置运行时期分两个时期,第一个时期为提盐驯化期(有机负荷为0.5 kg·(m3·d)−1 COD,1—20 d),第二个时期为负荷提升期(21—110 d),其中负荷提升期又分为3个阶段:0.6 kg·(m3·d)−1 COD (21—40 d),0.72 kg·(m3·d)−1 COD (41—80 d),1.0 kg·(m3·d)−1 COD (81—110 d). 因${\rm{SO}}_4^{2-} $ 浓度为2.6%的MBR装置出水COD一直高于200 mg·L−1,故此套装置运行阶段分两个时期,分别为提盐驯化期(1—36 d)和负荷稳定期(37—110 d,其有机负荷一直稳定在0.5 kg·(m3·d)−1 COD). 两反应器的运行参数如表3所示. 运行期间室内温度控制在25 ℃左右. -
MLSS、MLVSS采用国家环保总局规定的检测方法[11];溶解性微生物产物(SMP)和结合性胞外聚合物(BEPS)的提取参考陈康等[12]的方法;采用苯酚-硫酸法和Folin-酚法测定SMP和BEPs中的多糖和蛋白质含量,两者的总和即为SMP和BEPS的含量[13]. 采用激光粒径分析仪(BT-2003)测定污泥粒径及粒径分布. 膜阻力分布根据Darcy定律[14]:
式中,Rt时过滤时的总阻力(m−1),Rm是固有阻力(m−1),Rc是外部阻力(m−1),Rf是由不可逆吸附和膜孔堵塞引起的内部阻力(m−1),J是膜通量(L·(m2·h)−1),
$ \Delta p $ 是TMP(Pa),$ \mu $ 是过滤液的动力黏度(Pa·s). 新膜使用前,采用纯水过滤得到Rm,每个装置第3次清洗前,根据最终的膜通量和TMP计算Rt,采用纯水去除膜面污染物后过滤纯水得到Rm+Rf,根据这些数值利用公式计算出Rt、Rm、Rc和Rf. -
两套实验装置的主要运行数据如表4所示,进水
${\rm{SO} }_4^{2-} $ 浓度为1.6%的系统在提盐驯化阶段(最大有机负荷OLR为0.5 kg·(m3·d)−1 COD)后期出水COD值稳定在205—210 mg·L−1,COD的平均去除率为96.2%,氨氮和TN的去除率分别为81.3%和36.7%. 而2.6%系统在提盐驯化阶段(OLR为0.5 kg·(m3·d)−1 COD)末期出水COD值在400—460 mg·L−1波动,平均去除率为94.77%,氨氮和TN的去除率分别为68.2%和35.6%.进入负荷提升/稳定阶段后,对两系统的进水C/N作了调整,通过添加尿素,补充有机氮源,控制C/N在25左右. 随后进水
${\rm{SO} }_4^{2-} $ 浓度为1.6%的系统COD值有所下降,在负荷提升阶段Ⅰ(OLR为0.6 kg·(m3·d)−1 COD)和Ⅱ(OLR为0.72 kg·(m3·d)−1 COD)末期出水COD值均稳定在145 mg·L−1以下,COD去除率稳定在97.5%左右. 在负荷提升阶段Ⅲ(OLR为1.0 kg·(m3·d)−1 COD)时,1.6%系统的出水COD值仍稳定在200 mg·L−1以下,平均去除率达97.2%. 而在2.6%系统负荷稳定(OLR为0.5 kg·(m3·d)−1 COD)初期调整C/N后,出水COD仍高于200 mg·L−1,其去除率最终稳定在96.3%. 调整C/N后,1.6%系统的氨氮去除率在负荷提升阶段Ⅰ时,受到影响,下降至57.6%,而后在负荷提升阶段Ⅲ时该系统对氨氮的去除率最终稳定在92.5%,而2.6%系统的氨氮去除率在负荷稳定阶段末期的氨氮去除率为82.6%. 经过稳定运行,两系统对TN均有一定的去除效果,其中1.6%系统最终对TN的去除效率为89.5%,而2.6%系统对TN的去除效率为80.7%. 两种${\rm{SO} }_4^{2-} $ 浓度的系统对总磷的去除效率都呈现上升的趋势,最终均达到全部去除的效果. 在本研究中总磷去除率为100%,其原因可能是一体式的膜生物反应器由于膜对微生物的完全截留使得反应器内能维持较高的污泥浓度,会造成氧传递效率降低,形成局部的厌氧环境. 在这种好氧厌氧共存的环境中,一部分的磷通过“厌氧释磷,好氧过量吸磷”的方式去除. 另一方面,BEPS也能储存磷元素,其除磷量也能达到很高,达60%以上. 在本研究中发现,1.6%系统和2.6%系统成熟污泥的BEPS较初始污泥增加了4—5倍. 因此,另一部分磷去除可能是通过BEPS的储存后,再以排泥的方式对水中的磷进行有效去除. 对比发现,运行效能受盐度的影响呈现出明显的差异,相比于2.6%${\rm{SO} }_4^{2-} $ 系统,1.6%${\rm{SO} }_4^{2-} $ 系统能获得更高的有机负荷,其在较高的有机负荷下,其对COD、氨氮和TN的去除效率均高于2.6%${\rm{SO} }_4^{2-} $ 系统.综上,2.6%
${\rm{SO} }_4^{2-} $ 系统所能获得的有机负荷和污染物去除效率均不如1.6%${\rm{SO} }_4^{2-} $ 系统,这是由于参与污染物处理的大多数微生物都是非耐盐/嗜盐性的微生物,盐度的升高会导致这些微生物逐渐失活[15]. 此外,微生物的生物活性和细菌群落结构随着盐度水平的变化而变化,在较低盐分的环境下,经过长期的驯化有机物去除效率可以得到提高. 然而,当浓度较高时,微生物将面临渗透压力,导致细胞脱水,对生物膜造成不可修复的损害,从而导致系统对污染物的去除效率低下[16]. 因此在本实验室中,较低盐度的1.6%系统相比于2.6%系统能获得较高的有机负荷和污染物去除效率. -
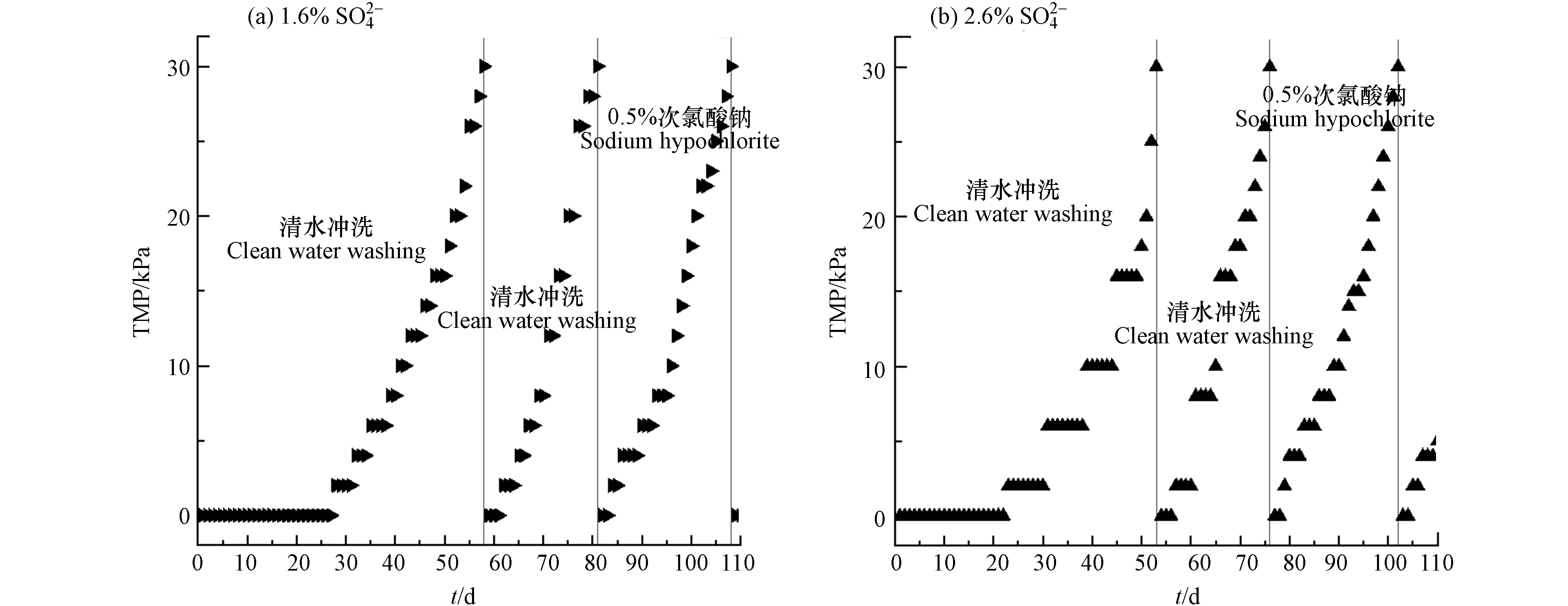
膜污染是衡量膜生物反应器稳定运行最重要的限制因素之一,频繁的膜清洗会减少膜的使用寿命,增加运行成本. 因此,进行膜污染的研究对于了解膜的运行性能至关重要. TMP可以用来表征膜污染的程度,随着反应器的运行,膜组件逐渐受到污染,TMP会随之增加. 图2为MBR在运行期间的TMP变化情况. 在110 d的运行时间里,进水
${\rm{SO} }_4^{2-} $ 浓度为1.6%的反应器随着进水量和有机负荷的提升,膜通量作了相应调整. 在0—20 d、21—40 d、41—80 d和80—110 d的4个阶段的膜通量分别控制在0.9 LMH、1.1 LMH、1.3 LMH和12.5 LMH. 而进水${\rm{SO} }_4^{2-} $ 浓度为2.6%的反应器由于进水量和有机负荷未增加,膜通量一直控制在0.64 LMH左右.在整个运行过程中,进水
${\rm{SO} }_4^{2-} $ 浓度为1.6%和2.6%的反应器TMP均累计3次达到30 kPa. 其中1.6%${\rm{SO} }_4^{2-} $ 系统(图2a)分别在第58、81和108 天达到30 kPa,而2.6%${\rm{SO} }_4^{2-} $ 系统(图2b)分别是在第53、76和102 天达到30 kPa,分别提早了5、5、6 d. 1.6%和2.6%${\rm{SO} }_4^{2-} $ 系统第一次出现TMP读数(2.0 kPa)分别在第28 天和23天,说明${\rm{SO} }_4^{2-} $ 浓度为2.6%的反应器膜组件比1.6%的膜污染更快. 有研究表明在更高的盐度下,系统内的微生物会产生更多的SMP和BEPS,加剧膜污染[17]. 在第58 天时对进水${\rm{SO} }_4^{2-} $ 浓度为1.6%膜组件进行物理清洗,继续运行时初始TMP为0 kPa,到第81 天第二次TMP达30 kPa,历时23 d. 而进水${\rm{SO} }_4^{2-} $ 浓度为2.6%的膜组件在第53 天时进行物理清洗,到第76 天时TMP第二次达30 kPa,历时同样为23 d. 尽管1.6%和2.6%${\rm{SO} }_4^{2-} $ 系统TMP到达30 kPa的时间相同,但2.6%${\rm{SO} }_4^{2-} $ 系统的膜运行通量较低,说明经过物理清洗后2.6%系统膜污染仍然比1.6%系统更严重. 第二次物理清洗后,两反应器的TMP增加至30 kPa的时间均比第一次少很多,说明两个反应器的膜污染出现了不可逆污染,普通的物理清洗已无法完成有效清洗.随后在第81天用0.5%NaClO对进水
${\rm{SO} }_4^{2-} $ 浓度为1.6%的反应器膜组件进行清洗,运行到第108 天,1.6%系统TMP第3次达30 kPa,所需时间为27 d. 同样在第78 天用0.5%NaClO对进水${\rm{SO} }_4^{2-} $ 浓度为2.6%的膜组件进行清洗,到102 d,2.6%系统TMP第3次达30 kPa,历时26 d. 说明化学清洗后,尽管2.6%系统的膜运行通量相比1.6%系统较低,但其膜污染速度却更快. 叶芳凝[1]的研究表明,高盐环境下污泥混合液的过滤性会降低,膜污染加剧. -
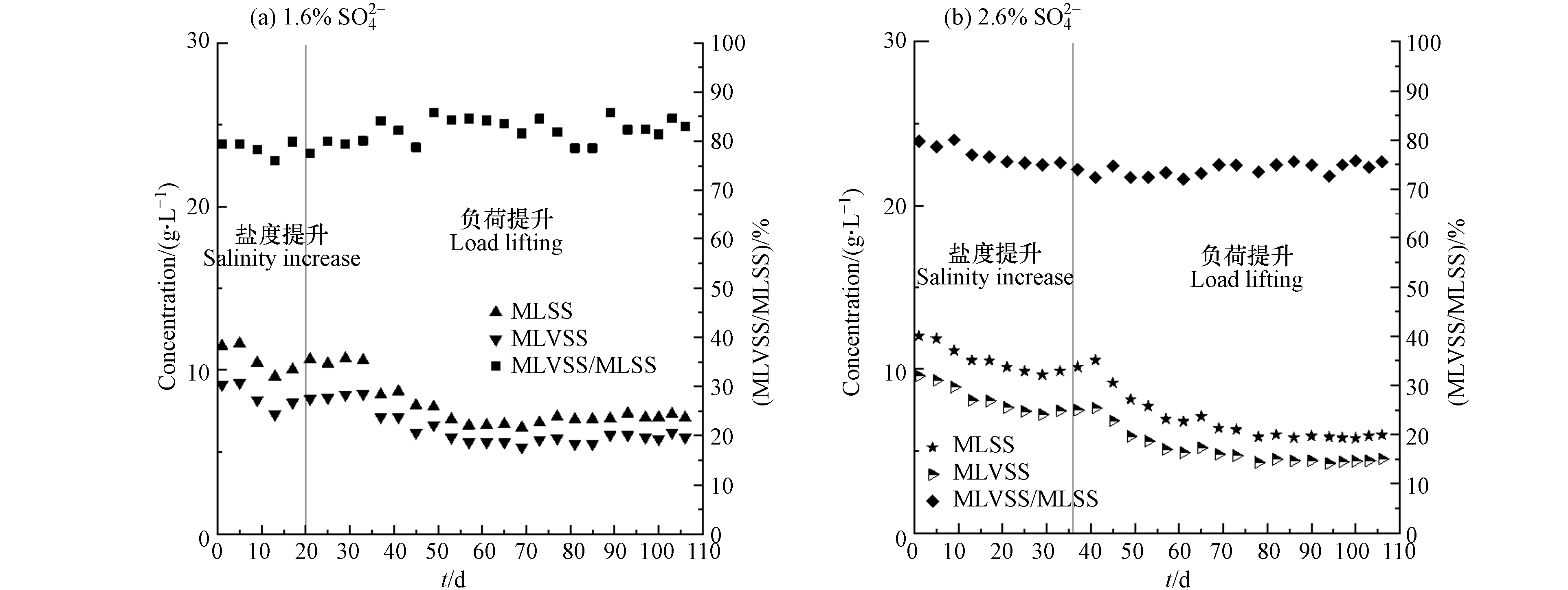
为了解盐度和负荷提升对活性污泥的影响情况,对两反应器MBR池中MLSS、MLVSS以及MLVSS/MLSS的变化情况进行了监测,结果如图3所示. 进水
${\rm{SO} }_4^{2-} $ 浓度为1.6%的反应器在提盐驯化期内(1—15 d),系统中的MLSS及MLVSS从11.4 g·L−1和9.3 g·L−1分别下降至9.6 g·L−1和7.3 g·L−1,MLSS/MLVSS从80.2%下降至76%(图3a). 同样进水${\rm{SO} }_4^{2-} $ 浓度为2.6%的反应器在提盐驯化期内(1—35 d),MLSS及MLVSS分别从12.0 g·L−1和9.6 g·L−1降低到9.9 g·L−1和7.5 g·L−1,MLVSS/MLSS由接种时的80%降低到了75.4%(图3b).可以看出两系统的MLSS、MLVSS和MLVSS/MLSS在提盐时期均呈现下降趋势,这是由于初始两系统内接种活性污泥盐度较低,随着体系内盐度的逐渐上升,部分活性污泥因为难以适应环境的改变而死亡[18-19],从而导致MLSS、MLVSS以及MLVSS/MLSS的整体下降.
随着活性污泥的逐渐驯化,耐盐微生物开始逐渐增殖,进水
${\rm{SO} }_4^{2-} $ 浓度为1.6%的反应器内污泥浓度在负荷提升初期(第26 d)MLSS和MLVSS分别增加至10.4 g·L−1和8.3 g·L−1,MLVSS/MLSS为80.0%. 随后开始排泥2 L以控制SRT为44 d,MLSS和MLVSS逐渐下降最终分别为7.1 g·L−1和5.9 g·L−1,但其MLVSS/MLSS略有上升,最终为83%且高于接种初始值. 进水${\rm{SO} }_4^{2-} $ 为2.6%的反应器内污泥浓度在提盐驯化期(1—35 d)结束后缓慢上升,到负荷稳定初期(第40 天),MLSS及MLVSS分别增长到10.5 g·L−1和7.0 g·L−1,而MLVSS/MLSS的值下降到了72.3%. 第40 天开始,2.6%系统开始排泥2 L以控制SRT为44 d,排泥后系统MLSS和MLVSS不断下降至6 g·L−1和4.5 g·L−1左右. MLVSS/MLSS虽略有上升,但始终低于接种初始值,最后稳定在75%左右. 很多研究表明在合适的盐度下,活性污泥经过长期的驯化,MLVSS/MLSS的值会逐渐升高,最终高于接种污泥值. 例如武骁[20]利用好氧污泥处理含盐有机废水时发现,在合适的溶解氧条件下,长期驯化的活性污泥浓度较接种污泥浓度有大幅度提升,接种污泥的MLVSS/MLSS为63%,驯化成熟污泥的值高达78%. 但也有研究表明,在高盐环境下,MLVSS/MLSS的会受到高盐环境的冲击,最终低于接种污泥值. 例如肖小兰等[21]研究发现,在盐度约为3.5%条件下,活性污泥经过长期驯化,负荷提升阶段的MLSS和MLVSS会逐渐增长,但运行结束时,MLVSS/MLSS的值仍是低于接种污泥值. 本研究中发现进水${\rm{SO} }_4^{2-} $ 浓度为1.6%的体系内微生物含量(MLVSS/MLSS)经过驯化后逐渐升高,但在更高盐的环境下(${\rm{SO} }_4^{2-} $ 浓度为2.6%)微生物受到的影响更加明显,微生物增长较慢,且较高的无机盐也容易在反应器中累积,从而造成MLVSS/MLSS较接种初始值低.目前关于污泥浓度和膜污染关系的研究中,不同学者之间有很大的差别. 研究结果的差异可能来源于不同的反应装置以及不同的污泥性质等,但普遍认为MLSS的变化对膜污染的影响与其范围有很大关系. Le等[22]研究表明,污泥浓度的增加会导致污泥粘度呈现指数形式的增加,从而加剧膜污染;而陆继来[23]在研究污泥浓度对膜污染的影响时,考察了4—10 g·L−1范围内污泥浓度变化对MBR装置TMP变化的影响,发现污泥浓度的升高,有助于保持膜通量,在高污泥浓度下,TMP的升高趋势更加平缓. 陈莉佳等[24]通过中试规模的反应装置,考察了MLSS在4—9 g·L−1和10—14 g·L−1范围内对膜TMP的影响,发现在较低污泥浓度下TMP上升速率很快,膜污染也更加严重,当污泥浓度升高时,TMP上升速率减小. 在本研究中,两套装置在前期接种的污泥浓度均较高,经过盐度驯化以及排泥后,污泥浓度有所降低,TMP增加逐渐加快,而2.6%
${\rm{SO} }_4^{2-} $ 系统的膜污染相比于1.6%${\rm{SO} }_4^{2-} $ 系统更严重,可能是由于运行稳定后2.6%${\rm{SO} }_4^{2-} $ 系统中MLSS值较1.6%${\rm{SO} }_4^{2-} $ 系统更低. 此外,MLVSS/MLSS的值对膜污染也有一定影响,在王浩宇[25]的研究表明,同时运行的两套一体化膜生物反应器中,MLVSS/MLSS值更低的装置膜污染情况更严重,在本研究中也能得到相似的结论. -
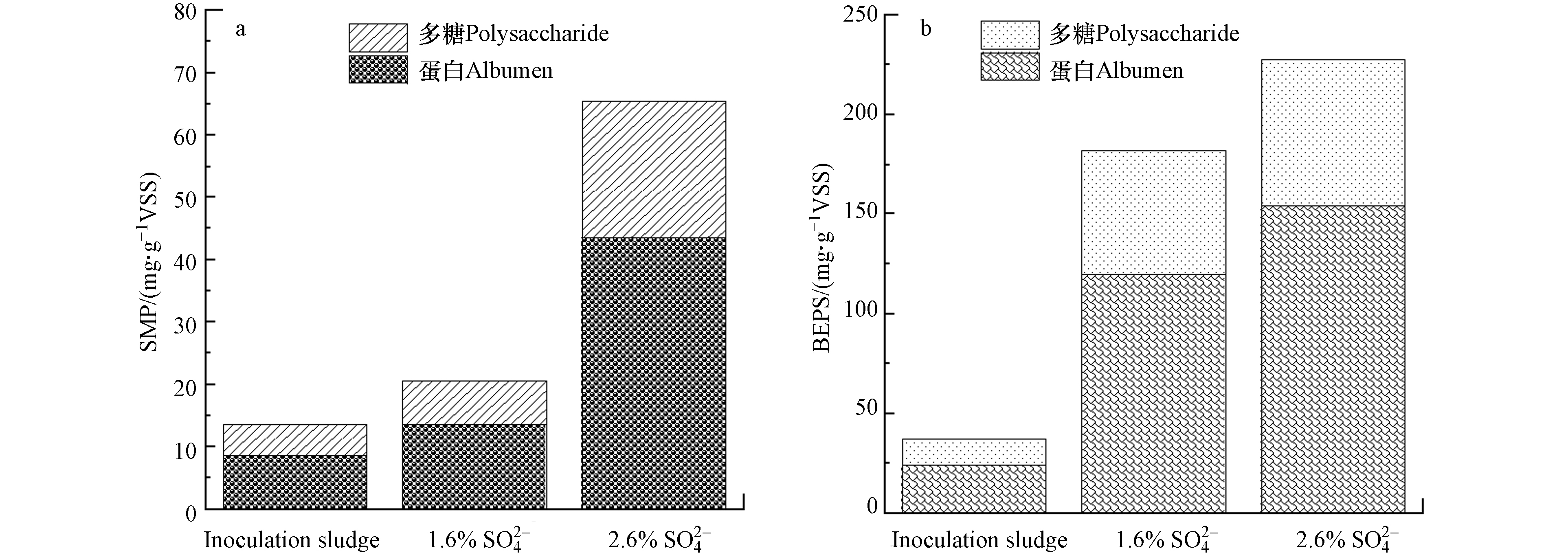
SMP是溶解性的微生物产物,在MBR运行过程中,其会被吸附到膜上或进入到膜孔中造成污染. BEPS是一种结合的细胞外聚合物,它聚集于微生物细胞表面,对微生物具有保护作用,BEPS的存在会使污泥的性质发生改变,从而影响过滤性能. SMP和BEPS主要由蛋白质和多糖构成,在MBR运行结束后,提取两反应器MBR池中成熟污泥的SMP和BEPS,并与接种时污泥的组分进行比较,结果如图4所示. 两反应器接种污泥时其SMP和BEPS浓度分别为13.5 mg·g−1VSS和36.9 mg·g−1VSS (图4a),经过长期的高盐环境驯化后,进水
${\rm{SO} }_4^{2-} $ 浓度为1.6%和 2.6%反应器中成熟污泥SMP浓度分别上升到20.4 mg·g−1VSS和65.3 mg·g−1VSS,BEPS浓度分别为181.8 mg·g−1VSS和227.3 mg·g−1VSS (图4b). 可以看出2.6%${\rm{SO} }_4^{2-} $ 系统中SMP和BEPS增量比1.6%${\rm{SO} }_4^{2-} $ 要高很多. 常规生活污水MBR的处理中,一般SMP处于10—20 mg·g−1VSS,BEPS处于40—80 mg·g−1VSS的范围. 在本研究中,1.6%系统的盐度相对低一些,微生物能有效适应,有机物的降解未受到明显抑制,其含量在20 mg·g−1VSS左右,SMP略高于常规处理体系. 而2.6%系统的有机物降解水平,受到明显抑制,其SMP的含量在65 mg·g−1VSS左右,高于常规的污水MBR处理体系. 此外,两系统的盐度高于常规生活污水的MBR处理体系,微生物需产生更多的BEPS应对因盐度而改变的渗透压力,故两系统的BEPS均是高于常规体系[19, 26]. Luo等[27]和Hong等[28]的研究表明,盐度升高时高浓度的SMP和BEPS可归因于细胞的自溶和细胞分泌的聚合物以及来自有机物质不完全降解的未代谢和/或中间产物的积累.很多研究表明膜污染主要来源于MBR系统中的SMP,其值越高膜污染程度越严重[26, 29-30]. Gao等[31]的报道中指出SMP是MBR中膜面污染物凝胶层的主要成分来源,同时SMP含量的升高会增加混合液的黏度,造成MBR通量下降,膜阻力上升[32]. 而BEPS也是引发膜污染的主要因素,大多数研究都已表明BEPS浓度与膜污染成正相关关系[33-34]. 例如Patsios等[35]发现,生物絮凝体的BEPS含量在MBR长期运行时会影响TMP跳跃期间的不可逆污染的增加率,对膜的过滤性能造成负面的影响. 从2.2节可知,尽管2.6%
${\rm{SO} }_4^{2-} $ 系统膜运行通量较小,但其膜污染却比1.6%${\rm{SO} }_4^{2-} $ 系统较严重,究其原因很可能是由于2.6%系统中SMP和BEPS含量均高于1.6%系统,导致其膜污染加快. -
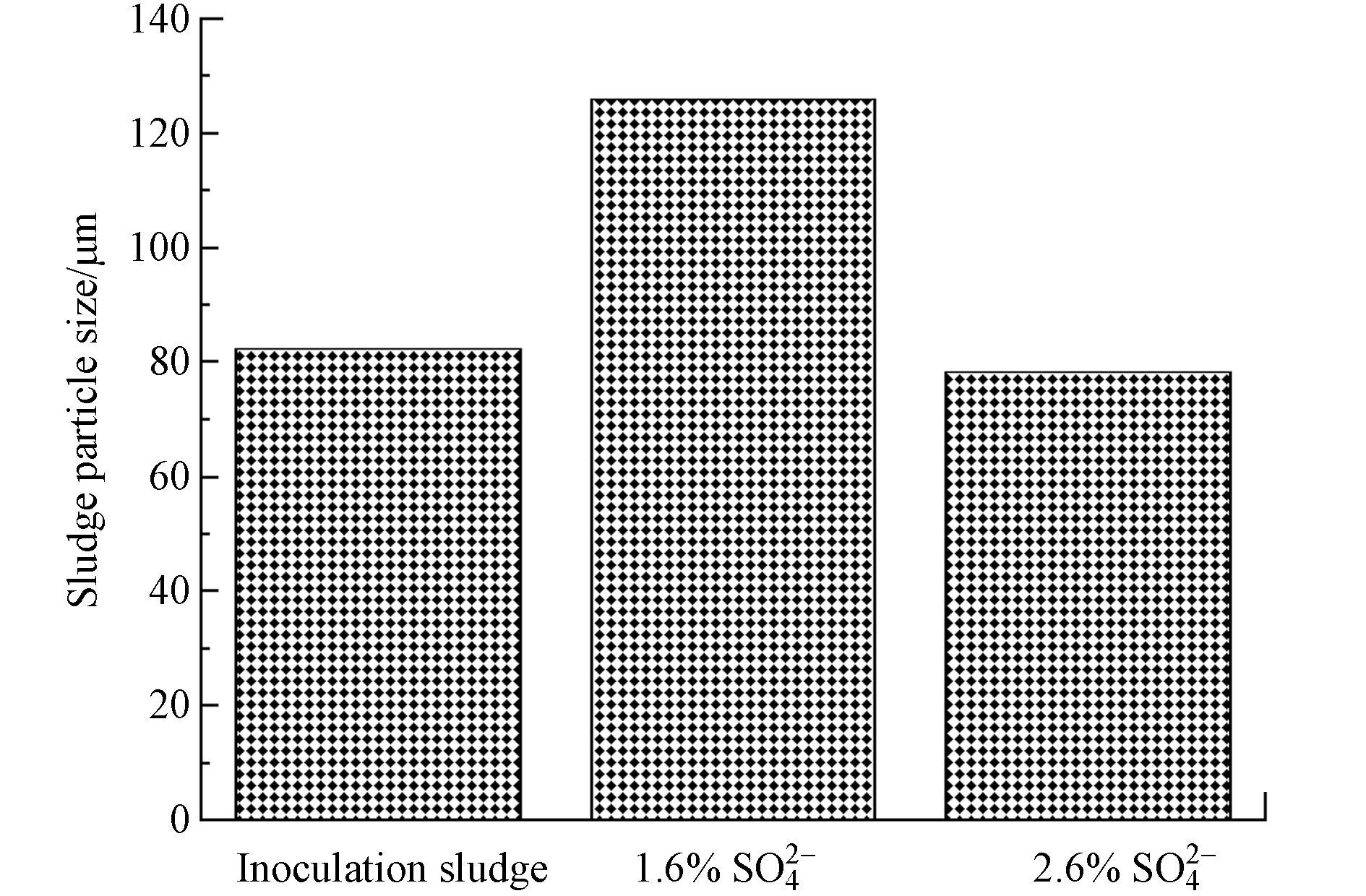
反应器中污泥体积平均粒径的变化如图5所示,两反应器初始接种污泥MBR池的体积平均径为82.3 µm,经过110 d的运行后,进水
${\rm{SO} }_4^{2-} $ 浓度为1.6%的反应器中MBR池的污泥粒径增加至125.8 µm. 而进水${\rm{SO} }_4^{2-} $ 浓度为2.6%的反应器中污泥驯化成熟后,其MBR池的污泥粒径略有降低至78.2 µm. 目前大部分研究认为盐度会影响污泥的絮凝性能,导致污泥的平均粒径下降. 例如李津[7]研究发现,在盐度为0.35%时,活性污泥颗粒很大,形状为不规则形,絮凝体性能良好;当盐度为1.4%时,活性污泥的结构发生变化,絮凝体变小且紧密度变高. Corsino等[36]研究发现,在3.5%的盐度下,经过115 d的驯化,好氧絮状污泥的粒径平均尺寸略有下降,从152 µm下降至115 µm. 在本研究种发现,在${\rm{SO} }_4^{2-} $ 浓度为2.6%的系统中,活性污泥的粒径所有降低,但在${\rm{SO} }_4^{2-} $ 浓度为1.6%的系统中,活性污泥经过长期驯化,污泥粒径反而有所增加. 说明适当的盐度可能会刺激微生物产生较多的BEPS使得污泥絮体之间更容易相互聚集,絮体容易变大,粒径增加. 然而在更高盐度下,环境中过高的渗透压力会使微生物细胞脱水,同时丝状菌的生长受到抑制[19],使得2.6%${\rm{SO} }_4^{2-} $ 系统污泥絮状物的粒径变小.很多研究表明,膜污染速度和污泥粒径有很大关系,污泥粒径越小,污泥越容易沉积在膜表面,膜污染速率越快[14, 37]. Shen等 [38]研究发现,导致膜污染的泥饼层中粒径较小的污泥絮体的比例更高,也就是说小絮体更容易附着在膜表面,导致膜污染. Lim等[39]研究发现,污泥粒径越小,越容易吸附或沉积在膜表面,甚至堵塞膜内部孔道,形成孔隙率低、密实的膜污染层,造成严重的膜污染. 在本研究中,2.6%
${\rm{SO} }_4^{2-} $ 系统中的污泥平均粒径较1.6%${\rm{SO} }_4^{2-} $ 更小,其更容易向膜表面迁移,致使膜污染速度也更快. -
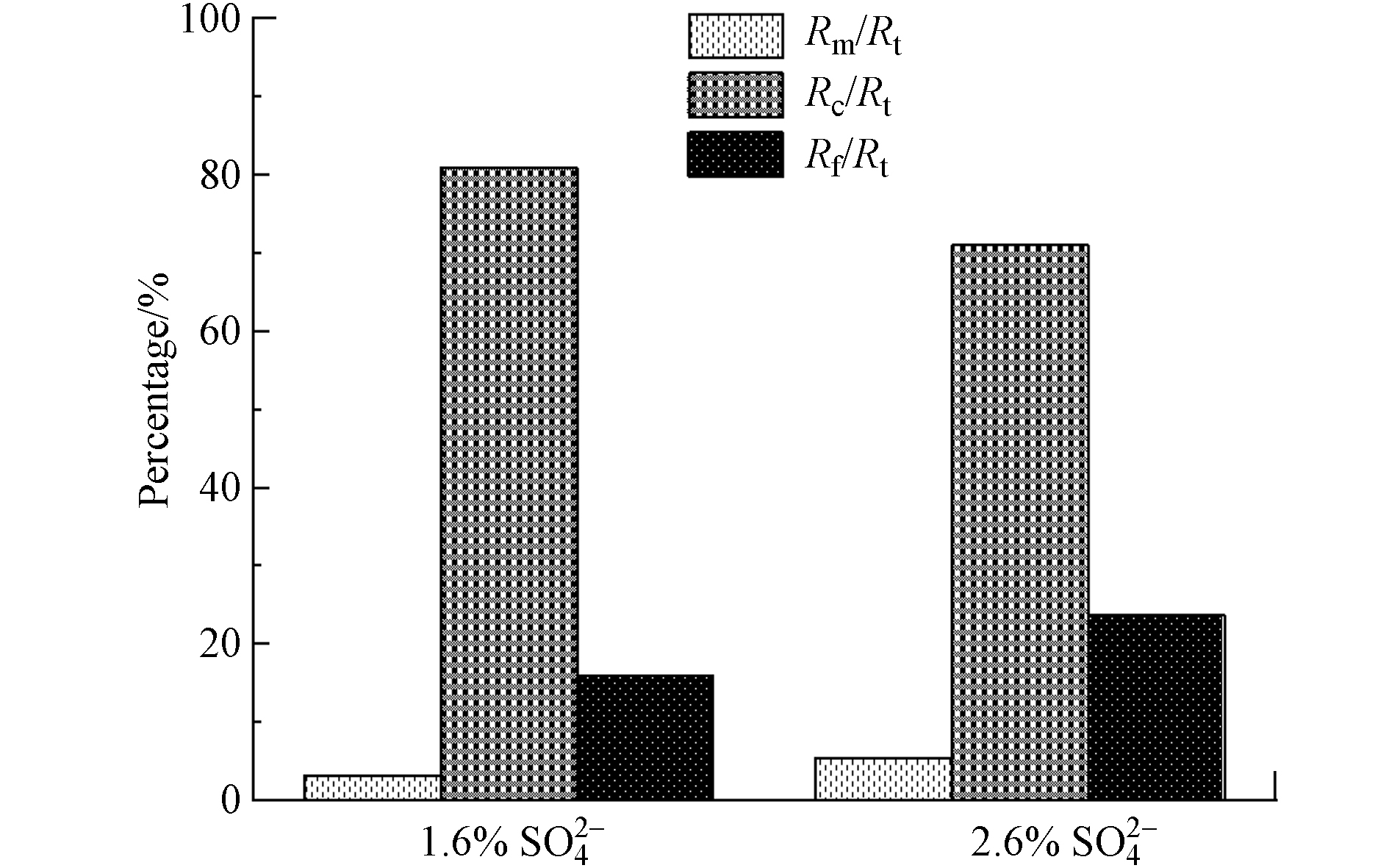
膜阻力主要由三部分组成:膜固有阻力(Rm)、外部阻力(Rc)和不可逆吸附及膜孔堵塞引起的内部阻力(Rf)[12]. 膜固有阻力是指膜未使用之前的自身阻力. 外部阻力主要由泥饼层和凝胶层组成,通过物理清洗可以去除,而内部阻力需要通过化学方法才能去除. 为了探究在不同
${\rm{SO} }_4^{2-} $ 浓度下膜阻力的分布差异,对两系统第3次清洗膜时各自的膜阻力分布进行了测定,结果如图6所示.第3次清洗时,进水
${\rm{SO} }_4^{2-} $ 浓度为1.6%和2.6%反应器的Rm占比分别为3.2%和5.4%,差异不大. 对比外部阻力和内部阻力发现,1.6%和2.6%${\rm{SO} }_4^{2-} $ 系统中膜过滤阻力主要是由外部阻力引起的,分别为80.9%和71%. 此外,系统1.6%${\rm{SO} }_4^{2-} $ 系统的内部阻力(Rf)占比为15.9%,而2.6%${\rm{SO} }_4^{2-} $ 系统的内部阻力占比为23.6%. 有学者的研究表明,SMP的存在会加剧膜孔堵塞,增加膜的内部阻力. 例如孟凡刚[40]研究发现,MBR中的SMP主要是微生物代谢及细胞破碎等释放的物质,或者称之为溶解性EPS,其分子量分布一般在1000—100000左右,极易堵塞膜孔,增大膜的内部阻力. Tian等[41]的研究表明,SMP通常根据细菌阶段分为两类:与底物吸收和生物量生长相关的生物产物(UAPs),以及与生物量衰减相关的生物产物(BAPs). 这两个阶段的产物均会增加膜孔堵塞的几率,导致膜内部阻力增加. 此外,无机盐的存在也会导致内部阻力的增加. Resosudarmo等[42]研究发现,盐浓度的提高会显著增加腐殖酸等有机质在膜表面的结垢倾向,而结垢层主要是由小尺寸的有机质引起的,这些有机质会堵塞膜孔,增加膜的内部阻力.综上,进水
${\rm{SO} }_4^{2-} $ 浓度为2.6%的系统中SMP的含量相比于1.6%系统更高,其中有很多小分子量的SMP,增加了膜孔堵塞的几率;同时较高的无机盐环境,会使得很多小尺寸有机质在膜表面堆积,从而堵塞膜孔增加该系统膜的内部阻力. -
1)经过长期的运行,进水
${\rm{SO} }_4^{2-} $ 浓度为1.6%的系统能获得更高的负荷及更好的污染物降解效率.2)在MBR的运行过程中,进水
${\rm{SO} }_4^{2-} $ 浓度为2.6%系统相比于1.6%系统的膜污染更严重.3)长期运行下,相比于进水 1.6% 系统,2.6%
${\rm{SO} }_4^{2-} $ 中微生物增长较慢且无机盐累积较快,造成MLVSS/ MLSS较接种污泥均有所下降,且比1.6%${\rm{SO} }_4^{2-} $ 系统低.4) 1.6%和2.6%
${\rm{SO} }_4^{2-} $ 系统中高盐驯化成熟后的污泥较接种污泥的SMP和BEPS均有所增加,其中2.6%${\rm{SO} }_4^{2-} $ 系统释放的更多. 此外1.6%${\rm{SO} }_4^{2-} $ 系统较接种污泥的粒径有大幅增加,而2.6%系统较接种污泥的粒径有所降低.5)从膜阻力分布来看,两套装置的膜阻力都主要来源于外部阻力,且2.6%
${\rm{SO} }_4^{2-} $ 系统的内部阻力相比于1.6%${\rm{SO} }_4^{2-} $ 更大.
膜生物反应器(MBR)处理不同浓度高硫酸盐有机废水污泥性质和膜污染研究
Sludge properties and membrane fouling of aerobic membrane bioreactor (MBRs ) in treating organic wastewater with different concentrations of sulfate
-
摘要: 针对食品加工过程中产生的高
${\rm{SO}}_4^{2-} $ 的高浓度有机物废水,采用膜生物反应器(MBR)工艺对其进行处理研究,分别考察了1.6%和2.6%${\rm{SO}}_4^{2-} $ 浓度下反应器运行性能、污泥性质和膜污染变化情况. 经过110 d的运行时间对比发现,1.6%${\rm{SO}}_4^{2-} $ 浓度下MBR获得的最大有机负荷为1.0 kg·(m3·d)−1 COD,其化学需氧量(COD)、氨氮和总氮的去除率分别为97.2%、92.5%和89.5%. 2.6%${\rm{SO}}_4^{2-} $ 浓度下微生物受到的抑制更强,其获得的最大有机负荷仅为0.5 kg ·(m3·d)−1 COD,其COD、氨氮和总氮的去除率分别为96.3%、82.6%和80.7%. 此外,${\rm{SO}}_4^{2-} $ 浓度为1.6%的反应器在更高的膜运行通量下,膜污染速率反而比2.6%系统更慢. 进一步分析其污泥性质发现${\rm{SO}}_4^{2-} $ 浓度为1.6%系统内的混合液悬浮固体浓度(MLSS)和挥发性悬浮固体浓度(MLVSS)稳定在7.1 g·L−1和5.9 g·L−1左右,MLVSS/MLSS值较初始污泥有所提高,从80.2%升高到83%.${\rm{SO}}_4^{2-} $ 浓度为2.6%体系内MLSS和MLVSS稳定在6 g·L−1和4.5 g·L−1左右,MLVSS/MLSS较初始污泥有所降低,最终稳定在75%左右. 较低的MLSS和MLVSS/MLSS加速了膜表面滤饼层的形成,导致2.6%${\rm{SO}}_4^{2-} $ 系统膜污染更快. 经过长期的高盐环境驯化后,1.6%${\rm{SO}}_4^{2-} $ 和2.6%${\rm{SO}}_4^{2-} $ 系统成熟污泥的溶解性微生物产物(SMP)和结合性的胞外聚合物(BEPS)均有所上升,SMP从13.5 mg·g−1 VSS上升到20.4 mg·g−1 VSS和65.3 mg·g−1 VSS,BEPS从36.9 mg·g−1 VSS上升到181.8 mg·g−1 VSS和227.3 mg·g−1 VSS. 2.6%${\rm{SO}}_4^{2-} $ 系统的SMP和BEPS的值均大于1.6%${\rm{SO}}_4^{2-} $ 系统,从而使得2.6%${\rm{SO}}_4^{2-} $ 系统的TMP上升加快,膜污染加剧. 1.6%系统MBR中污泥粒径从接种时的82.3 μm增加至125.84 μm,而2.6% SO42-系统中污泥粒径降至78.23 μm. 相较于1.6%${\rm{SO}}_4^{2-} $ 系统,2.6%${\rm{SO}}_4^{2-} $ 系统的污泥粒径更小,更容易堆积于膜表面,使得滤饼层更加紧致,加速了膜污染的形成. 两套装置的膜阻力都主要来源于外部阻力,但2.6%${\rm{SO}}_4^{2-} $ 系统的内部阻力占比较1.6%${\rm{SO}}_4^{2-} $ 系统更高. 综上,不同盐度对MBR体系的运行效能、污泥性质及膜污染情况具有显著的影响. 因此本研究可为MBR应用于高盐高浓度有机物废水的处理提供理论基础和实践指导.Abstract: The organic wastewater with high${\rm{SO}}_4^{2-} $ concentration produced in the food processing plant was treated by aerobic membrane bioreactor (MBR) process, and the performance, sludge properties and membrane fouling of the MBR were investigated at different${\rm{SO}}_4^{2-} $ concentrations of 1.6% and 2.6% respectively. For the operation period of 110 days, it was found that the maximum organic loading rate (OLR) of the MBR at the concentration of 1.6%${\rm{SO}}_4^{2-} $ was 1.0 kg· (m3·d)−1 COD, and the removal efficiencies of chemical oxygen demand(COD), ammonia nitrogen and total nitrogen were 97.2%, 92.5% and 89.5% respectively. However, at the concentration of 2.6%${\rm{SO}}_4^{2-} $ , the maximum OLR was only 0.5 kg·(m3·d)−1 COD, and removal efficiencies of COD, ammonia nitrogen and total nitrogen were 96.3%, 82.6% and 80.7% respectively. In addition, the membrane fouling rate of the reactor with 1.6%${\rm{SO}}_4^{2-} $ concentration was slower than that of the 2.6% system, although the reactor with 1.6%${\rm{SO}}_4^{2-} $ concentration operated at higher membrane flux than the 2.6% system. Further analysis of the sludge properties showed that the MLSS and MLVSS in the system with 1.6%${\rm{SO}}_4^{2-} $ concentration were stable at about 7.1 g·L−1 and 5.9 g·L−1, and the MLVS/MLSS was 83% with higher than that of the initial sludge. The MLSS and MLVSS in the system with 2.6%${\rm{SO}}_4^{2-} $ concentration were stable at 6 g·L−1 and 4.5 g·L−1, and the MLSS/MLVSS was only 75% with lower than that of the initial sludge. Lower MLSS and MLVSS/MLSS accelerated the formation of cake layer on the membrane surface, resulting in a serious membrane fouling of 2.6%${\rm{SO}}_4^{2-} $ system. After long-term acclimation in high-salt environment, SMP and BEPS of mature sludge for 1.6%${\rm{SO}}_4^{2-} $ and 2.6%${\rm{SO}}_4^{2-} $ systems increased. SMP increased from 13.5 mg·g−1VSS to 20.4 mg·g−1VSS and 65.3 mg·g−1VSS, and BEPS increased from 36.9 mg·g−1VSS to 181.8 mg·g−1VSS and 227.3 mg·g−1VSS respectively for 1.6%${\rm{SO}}_4^{2-} $ and 2.6%${\rm{SO}}_4^{2-} $ systems. The SMP and BEPS in 2.6%${\rm{SO}}_4^{2-} $ system were both higher than that of 1.6% SO42- system, thus the TMP of 2.6%${\rm{SO}}_4^{2-} $ system increases rapidly and the fouling aggravated. Compared with inoculated sludge, the particle size of MBR in 1.6% system increased from 82.3 μm to 125.84 μm respectively, while that of 2.6%${\rm{SO}}_4^{2-} $ system decreased from 82.3 μm to 78.23 μm. Compared with 1.6%${\rm{SO}}_4^{2-} $ system, the smaller particle size in 2.6%${\rm{SO}}_4^{2-} $ system was easier to accumulate on the membrane surface, which made the cake layer more compact and accelerated the membrane fouling. The membrane resistances of both the two MBRs mainly composed of the external resistance. However, the internal resistance of 2.6%${\rm{SO}}_4^{2-} $ system was higher than that of 1.6%${\rm{SO}}_4^{2-} $ system. In short, different salinity had significant influence on the operation efficiency, sludge properties and membrane fouling of MBR system. Therefore this study can provide theoretical basis and practical guidance for the application of MBR in the treatment of high-salt and high-concentration organic wastewater. -

-
表 1 1.6%
${\rm{SO}}_4^{2-} $ Table 1. The influent quality of 1.6%
${\rm{SO}}_4^{2-} $ 第1 天—第25天 第26天—第60天 第61天—第110天 pH 3.8—4.2 3.8—4.2 3.8—4.2 硫酸根/(mg·L−1) 16000—17800 17200—17900 17200—17900 COD/(mg·L−1) 5400—5600 5400—5600 7500—8100 TDS/(g·L−1) 27—30 27—30 27—30 电导率/(ms·cm−1) 25—30 28—30 28—30 TN/(mg·L−1) 20—25 180—200 320—350 TP/(mg·L−1) 5—10 8—10 8—10 氨氮/(mg·L−1) 15—20 15—20 15—20 Ca/(mg·L−1) 25—35 25—35 25—35 Mg/(mg·L−1) 5—15 5—15 5—15 Fe/(mg·L−1) 0.1—0.6 0.1—0.6 0.1—0.6 表 2 2.6%
${\rm{SO}}_4^{2-} $ Table 2. The influent quality of 2.6%
${\rm{SO}}_4^{2-} $ 第1天—第40天 第41天—第50天 第51天—第110天 pH 3.7—3.9 3.5—4.1 3.6—4.2 硫酸根/(mg·L−1) 26800—28000 26800—28000 22600—23000 COD/(mg·L−1) 8000—8900 7000—7800 7500—8000 TDS/(g·L−1) 42—45 45—55 50—54 电导率/(ms·cm−1) 38—40 38—40 38—40 TN/(mg·L−1) 28—30 320—350 320—350 TP/(mg·L−1) 10—15 10—15 15—20 氨氮/(mg·L−1) 15—20 15—20 15—20 Ca/(mg·L−1) 35—45 35—45 35—45 Mg/(mg·L−1) 10—20 10—20 10—20 Fe/(mg·L−1) 0.2—0.8 0.2—0.8 0.2—0.8 表 3 MBR反应器运行策略
Table 3. Operating strategy of MBR reactor
${\rm{SO}}_4^{2-} $
${\rm{SO}}_4^{2-} $ 阶段
Stage天数/d
Days容积负荷/(kg·(m3·d)−1
COD)
VLRHRT /d SRT/d 1.6% 提盐驯化阶 1—20 0.5 10 不排泥 负荷提升阶段Ⅰ 21—40 0.6 8.5 44 负荷提升阶段Ⅱ 41—80 0.72 8.5—10.2 44 负荷提升阶段Ⅲ 81—110 1.0 7 44 2.6% 提盐驯化阶段 1—36 0.5 16 不排泥 负荷稳定阶段 37—110 0.5 16—22 44 注:进水 ${\rm{SO}}_4^{2-} $ Note: The reactor with influent of 1.6% ${\rm{SO}}_4^{2-} $ 表 4 反应器运行数据
Table 4. Reactor Operation Data
$ {\rm{SO} }_4^{2-} $ $ {\rm{SO} }_4^{2-} $ 阶段
Stage天数/d
Days容积负荷/
(kg·(m3·d)−1 COD)
VLR出水COD值/
(mg·L−1)
COD value of
effluentCOD去除率/%
COD removal
rate氨氮去除率/%
Ammonia
nitrogen
removal rateTN去除率/%
TN removal rateTP去除率/%
TP
removal
rate
1.6%提盐驯化阶 1—20 0.5 205—210 96.2 81.3 36.7 35.2 负荷提升阶段Ⅰ 21—40 0.6 135—145 97.4 57.6 88.4 57.5 负荷提升阶段Ⅱ 41—80 0.7 120—145 97.5 90.8 89.7 99.8 负荷提升阶段Ⅲ 81—110 1.0 180—190 97.2 92.5 89.5 100.0 2.6% 提盐驯化阶段 1—36 0.5 400—460 94.7 68.2 35.6 59.6 负荷稳定阶段 37—110 0.5 280—290 96.3 82.6 80.7 100.0 -
[1] 叶芳凝, 石先阳. 盐度对MBR处理高氨氮废水的运行及微生物群落影响研究 [J]. 膜科学与技术, 2018, 38(5): 77-83. YE F N, SHI X Y. Effect of salinity on operation and microbial community of MBR for treatment of high ammonia nitrogen wastewater [J]. Membrane Science and Technology, 2018, 38(5): 77-83(in Chinese).
[2] 张万友, 张茜新, 张海丰, 等. 膜生物反应器工艺及其在高盐废水处理中的应用 [J]. 硅酸盐通报, 2014, 33(6): 1439-1442. ZHANG W Y, ZHANG X X, ZHANG H F, et al. MBR process and its application to high salinity wastewater [J]. Bulletin of the Chinese Ceramic Society, 2014, 33(6): 1439-1442(in Chinese).
[3] 于得旭. 膜分离技术在水处理工作中的运用分析 [J]. 冶金管理, 2020(11): 83-84. YU D X. Application of membrane separation technology in water treatment [J]. China Steel Focus, 2020(11): 83-84(in Chinese).
[4] 许宝华, 朱桂生, 黄诚. 膜生物反应器处理轻工废水研究进展 [J]. 安徽化工, 2016, 42(6): 12-17. doi: 10.3969/j.issn.1008-553X.2016.06.004 XU B H, ZHU G S, HUANG C. Application of membrane bioreactor in light industrial wastewater treatment [J]. Anhui Chemical Industry, 2016, 42(6): 12-17(in Chinese). doi: 10.3969/j.issn.1008-553X.2016.06.004
[5] 吴金玲, 黄霞. 膜-生物反应器混合液性质对膜污染影响的研究进展 [J]. 环境污染治理技术与设备, 2006(2): 16-24. WU J L, HUANG X. Research progress on effect of mixed liquor characteristics on membrane fouling in membrane reactors [J]. Techniques and Equipment for Environmental Pollution Control, 2006(2): 16-24(in Chinese).
[6] 袁野, 罗玲, 陆柳鲜, 等. MBR膜污染缓解与处理技术 [J]. 应用化工, 2021, 50(10): 2834-2839,2846. doi: 10.3969/j.issn.1671-3206.2021.10.044 YUAN Y, LUO L, LU L X, et al. MBR membrane pollution mitigation and treatment technology [J]. Applied Chemical Industry, 2021, 50(10): 2834-2839,2846(in Chinese). doi: 10.3969/j.issn.1671-3206.2021.10.044
[7] 李津. 膜生物反应器(MBR)处理高盐废水的试验研究[D]. 青岛: 青岛大学, 2008. LI J. Experimental study on treatment of high salinity wastewater by membrane bioreactor (MBR)[D]. Qingdao: Qingdao University, 2008 (in Chinese).
[8] 李彬, 王志伟, 安莹, 等. 膜-生物反应器处理高盐废水膜面污染物特性研究 [J]. 环境科学, 2014, 35(2): 643-650. LI B, WANG Z W, AN Y, et al. Membrane surface fouling properties in MBRs for high-salinity wastewater treatment [J]. Environmental Science, 2014, 35(2): 643-650(in Chinese).
[9] 陈启伟. 浸没式正渗透膜生物反应器通量提高策略研究[D]. 合肥: 合肥工业大学, 2019. CHEN Q W. Study on flux enhancement strategy of submerged osmotic membrane bioreactor[D]. Hefei: Hefei University of Technology, 2019 (in Chinese).
[10] HE Z W, KASEMSET S, KIRSCHNER A Y, et al. The effects of salt concentration and foulant surface charge on hydrocarbon fouling of a poly(vinylidene fluoride) microfiltration membrane [J]. Water Research, 2017, 117: 230-241. doi: 10.1016/j.watres.2017.03.051 [11] 国家环保局本书编委会. 水和废水监测分析方法 [M]. 水和废水监测分析方法, 1989. Editorial Board of the State Environmental Protection Agency. Monitoring and Analysis Methods of Water and Wastewater [M]. Monitoring and Analysis Methods of Water and Wastewater, 1989(in Chinese).
[12] 陈康. 钙离子调配下污泥性质及膜污染行为的识别研究[D]. 无锡: 江南大学, 2012. CHEN K. Identification of sludge properties and membrane fouling in membrane bioreactors with the addition of calcium ion[D]. Wuxi: Jiangnan University, 2012 (in Chinese).
[13] 亓金鹏. AnMBR+AO-MBR组合工艺处理高盐榨菜废水的运行效能及膜污染研究[D]. 无锡: 江南大学, 2021. QI J P. Operation performance and membrane fouling of AnMBR+AO-MBR process for treating high-salt mustard wastewater[D]. Wuxi: Jiangnan University, 2021 (in Chinese).
[14] LEE H S, KIM C G, YOON T I. Comment on Comparison of the filtration characteristics between attached and suspended microorganisms in submerged membrane bioreactor [J]. Water Research, 2002, 36(19): 4938-4939. doi: 10.1016/S0043-1354(02)00039-8 [15] TAN X, ACQUAH I, LIU H Z, et al. A critical review on saline wastewater treatment by membrane bioreactor (MBR) from a microbial perspective [J]. Chemosphere, 2019, 220: 1150-1162. doi: 10.1016/j.chemosphere.2019.01.027 [16] CAO T N D, BUI X T, LE L T, et al. An overview of deploying membrane bioreactors in saline wastewater treatment from perspectives of microbial and treatment performance [J]. Bioresource Technology, 2022, 363: 127831. doi: 10.1016/j.biortech.2022.127831 [17] JANG D, HWANG Y, SHIN H, et al. Effects of salinity on the characteristics of biomass and membrane fouling in membrane bioreactors [J]. Bioresource Technology, 2013, 141: 50-56. doi: 10.1016/j.biortech.2013.02.062 [18] 简陈生. 高盐氨氮废水MBR处理效能及微生物特性研究[D]. 赣州: 江西理工大学, 2016. JIAN C S. Study on MBR treatment efficiency and microbial characteristics of high salinity ammonia nitrogen wastewater[D]. Ganzhou: Jiangxi University of Science and Technology, 2016 (in Chinese).
[19] HE H J, CHEN Y J, LI X, et al. Influence of salinity on microorganisms in activated sludge processes: A review [J]. International Biodeterioration & Biodegradation, 2017, 119: 520-527. [20] 武骁. 好氧颗粒污泥处理含盐有机废水性能及耐盐机理研究[D]. 上海: 华东理工大学, 2020. WU X. Study on performance and salt-tolerance mechanism of aerobic granular sludge treating saline organic wastewater[D]. Shanghai: East China University of Science and Technology, 2020 (in Chinese).
[21] 肖小兰, 亓金鹏, 刘皓, 等. AOA-MBR处理高盐榨菜废水厌氧膜生物反应器出水的效能 [J]. 环境工程学报, 2021, 15(9): 3057-3066. doi: 10.12030/j.cjee.202105095 XIAO X L, QI J P, LIU H, et al. Operation performance of an AOA-MBR treating the effluent from an anaerobic membrane bioreactor dealing with high-salt mustard tuber wastewater [J]. Chinese Journal of Environmental Engineering, 2021, 15(9): 3057-3066(in Chinese). doi: 10.12030/j.cjee.202105095
[22] LE-CLECH P, CHEN V, FANE T A G. Fouling in membrane bioreactors used in wastewater treatment [J]. Journal of Membrane Science, 2006, 284(1/2): 17-53. [23] 陆继来, 刘舒华, 张敏健, 等. 污泥浓度对MBR混合液特性及膜污染的影响 [J]. 中国给水排水, 2014, 30(9): 92-95. doi: 10.19853/j.zgjsps.1000-4602.2014.09.023 LU J L, LIU S H, ZHANG M J, et al. Influence of MLSS on mixed liquor characteristics and membrane fouling in membrane bioreactor [J]. China Water & Wastewater, 2014, 30(9): 92-95(in Chinese). doi: 10.19853/j.zgjsps.1000-4602.2014.09.023
[24] 陈莉佳, 关永年, 庞维海. 平板膜生物反应器用于工业区污水处理厂尾水深度处理中试研究[J]. 给水排水, 2014, 50(S1): 274-277. CHEN L J, GUAN Y N, PANG W H. Pilot study on advanced treatment of tail water of sewage treatment plant in industrial area by flat membrane bioreactor[J]. Water & Wastewater Engineering, 2014, 50(Sup 1): 274-277 (in Chinese).
[25] 王浩宇. 一体式厌氧膜生物反应器在生活污水处理中的应用研究[D]. 哈尔滨: 哈尔滨工业大学, 2014. WANG H Y. The application of submerged anaerobic membrane bioreactor treating domestic wastewater[D]. Harbin: Harbin Institute of Technology, 2014 (in Chinese).
[26] YUAN Y, ZHOU Z, JIANG J, et al. Partial nitrification performance and microbial community evolution in the membrane bioreactor for saline stream treatment [J]. Bioresource Technology, 2021, 320: 124419. doi: 10.1016/j.biortech.2020.124419 [27] LUO W H, HAI F I, KANG J G, et al. Effects of salinity build-up on biomass characteristics and trace organic chemical removal: Implications on the development of high retention membrane bioreactors [J]. Bioresource Technology, 2015, 177: 274-281. doi: 10.1016/j.biortech.2014.11.084 [28] HONG J M, LI W B, LIN B, et al. Deciphering the effect of salinity on the performance of submerged membrane bioreactor for aquaculture of bacterial community [J]. Desalination, 2013, 316: 23-30. doi: 10.1016/j.desal.2013.01.015 [29] Di BELLA G, Di TRAPANI D, TORREGROSSA M, et al. Performance of a MBR pilot plant treating high strength wastewater subject to salinity increase: Analysis of biomass activity and fouling behaviour [J]. Bioresource Technology, 2013, 147: 614-618. doi: 10.1016/j.biortech.2013.08.025 [30] NG K K, LIN C F, LATEEF S K, et al. The effect of soluble microbial products on membrane fouling in a fixed carrier biological system [J]. Separation and Purification Technology, 2010, 72(1): 98-104. doi: 10.1016/j.seppur.2010.01.011 [31] GAO D W, FU Y, REN N Q. Tracing biofouling to the structure of the microbial community and its metabolic products: A study of the three-stage MBR process [J]. Water Research, 2013, 47(17): 6680-6690. doi: 10.1016/j.watres.2013.09.007 [32] WANG X H, CHANG V W C, TANG C Y. Osmotic membrane bioreactor (OMBR) technology for wastewater treatment and reclamation: Advances, challenges, and prospects for the future [J]. Journal of Membrane Science, 2016, 504: 113-132. doi: 10.1016/j.memsci.2016.01.010 [33] TANG J L, PU Y H, ZENG T, et al. Enhanced methane production coupled with livestock wastewater treatment using anaerobic membrane bioreactor: Performance and membrane filtration properties [J]. Bioresource Technology, 2022, 345: 126470. doi: 10.1016/j.biortech.2021.126470 [34] WANG X, ZHANG B, SHEN Z Q, et al. The EPS characteristics of sludge in an aerobic granule membrane bioreactor [J]. Bioresource Technology, 2010, 101(21): 8046-8050. doi: 10.1016/j.biortech.2010.05.074 [35] PATSIOS S I, KARABELAS A J. An investigation of the long-term filtration performance of a membrane bioreactor (MBR): The role of specific organic fractions [J]. Journal of Membrane Science, 2011, 372(1/2): 102-115. [36] CORSINO S F, CAPODICI M, Di PIPPO F, et al. Comparison between kinetics of autochthonous marine bacteria in activated sludge and granular sludge systems at different salinity and SRTs [J]. Water Research, 2019, 148: 425-437. doi: 10.1016/j.watres.2018.10.086 [37] 逄超. 厌氧反应器构型对膜污染的影响及作用机制研究[D]. 合肥: 合肥工业大学, 2019. PANG C. Comparative study of membrane fouling and formation mechanism on different anaerobic reactor configuration[D]. Hefei: Hefei University of Technology, 2019 (in Chinese).
[38] SHEN L G, LEI Q, CHEN J R, et al. Membrane fouling in a submerged membrane bioreactor: Impacts of floc size [J]. Chemical Engineering Journal, 2015, 269: 328-334. doi: 10.1016/j.cej.2015.02.002 [39] LIM A L, BAI R B. Membrane fouling and cleaning in microfiltration of activated sludge wastewater [J]. Journal of Membrane Science, 2003, 216(1/2): 279-290. [40] 孟凡刚. 膜生物反应器膜污染行为的识别与表征[D]. 大连: 大连理工大学, 2007. MENG F G. Identification and characterization of fouling behavior in submerged membrane bioreactors[D]. Dalian: Dalian University of Technology, 2007 (in Chinese).
[41] TIAN Y, CHEN L, ZHANG S, et al. A systematic study of soluble microbial products and their fouling impacts in membrane bioreactors [J]. Chemical Engineering Journal, 2011, 168(3): 1093-1102. doi: 10.1016/j.cej.2011.01.090 [42] RESOSUDARMO A, YE Y, LE-CLECH P, et al. Analysis of UF membrane fouling mechanisms caused by organic interactions in seawater [J]. Water Research, 2013, 47(2): 911-921. doi: 10.1016/j.watres.2012.11.024 -








































 下载:
下载: