-
磷是水体藻类生长所需的重要元素。随着工农业现代化的进程,大量污染物被直接排入江河湖泊,过量的磷元素导致水体富营养化,使得藻类生物过量繁殖产生水华,最终破坏水生态环境[1]。水环境中总磷的含量是衡量水体质量的重要指标之一。磷在水环境中主要以磷酸盐、无机磷和有机磷3种形式存在。其中,磷酸盐主要包括正磷酸盐(H3PO4、
${{\rm{H}}_2}{\mathop{\rm PO}\nolimits} _4^ - $ 、${\rm{HPO}}_4^{2 - }$ 、${\rm{PO}}_4^{3 - }$ )和聚磷酸盐等。目前,水体总磷的检测思路为,先通过强氧化剂消解[2]将水体中各种形态磷全部转化为正磷酸盐,再进行测量。我国环境水质总磷的标准检测方法主要是钼酸铵分光光度法[3]。因为测量时通常需要加温加压并添加化学试剂,所以若测量后生成的废弃试剂处理不当会造成人体伤害和环境污染等影响。其他检测方法还包括重力测定法和离子色谱法等[4-5],但这些方法操作流程复杂,响应时间慢,不适合水质连续自动监测和现场分析。近年来,电化学分析法逐渐被运用于测定无机磷酸盐含量[6]。其中,离子选择电极法因其具有操作简单、适合实时测量、环境友好、小型化、运行成本低等许多优点[7-8]引起了学者的广泛关注。然而,由于离子选择电极存在交叉敏感性,且容易受到工作环境影响,所以仍处于研究阶段,其电极检测精度和稳定性的改进成为当前研究的重点[9-12]。
金属钴被广泛应用于磷酸根离子选择电极的制备,但这类电极大多仅适用于酸性环境,且无法测定溶液中的总磷酸盐浓度。肖丹等[13]制备的钴棒电极在pH为4时,对
${{\rm{H}}_2}{\mathop{\rm PO}\nolimits} _4^ - $ 的响应斜率为50~56 mV·dec−1(dec为10倍摩尔浓度电化学标准单位),响应浓度为10−5~10−2 mol·L−1,溶液中的溶解氧量和压力大小会对测定产生影响。XU等[14]在钴电极表面涂覆磷酸钴构筑磷酸根离子选择电极,在浓度为10−5~10−1 mol·L−1时,线性响应斜率为−39 mV·dec−1,测量pH范围为4.0~6.5,可保持性能稳定性,但电极制备过程的细微偏差会影响测定结果。本课题组前期采用金属钼离子选择电极测定磷酸根离子浓度[15]时发现,在浓度为10−5~10−1 mol·L−1的
${\rm{HPO}}_4^{2 - }$ 溶液中,钼电极的响应电位与${\rm{HPO}}_4^{2 - }$ 浓度呈现良好的线性关系和较好的选择性。常见的阴离子不会干扰电极对磷酸盐的测定。在pH=8.5时,检测斜率达到(−26.9±0.5) mV·dec−1,检出限为1.9×10−6 mol·L−1,响应时间小于60 s。钼电极制备简单,且具有较好的重复性和稳定性,可至少使用3个月。但在现场检测过程中,很难保证电极测量环境与电极标定环境完全一致,被测溶液pH变化存在不确定性,同时被测溶液温度变化也会使电极响应电位产生偏移,从而使电极检测精度受到影响。本研究综合分析溶液pH和被测溶液温度对电极测量的影响,通过磷酸根在不同pH条件下的分布系数,根据能斯特方程,采用最小二乘回归分析方法,建立补偿模型消除被测溶液pH和温度变化对电极输出电位的影响,以期为提高钼电极检测精度提供解决方案。
全文HTML
-
离子选择电极(ion selective electrode,ISE)是一种分析溶液中特定离子浓度的电化学传感器。当离子选择电极浸入待测溶液中时,电极敏感膜与溶液在相界面上产生与待测离子活度有关的浓度差膜电势。该电位与待测离子含量之间满足能斯特(Nernst)方程[16],方程如式(1)所示。
式中:
$E$ 为某一浓度下的电极电势,mV;${E_0}$ 为电极标准电势,mV;$R$ 为气体常数(8.314 J·(K·mol)−1);T为热力学温度,K;$F$ 为法拉第常数(9.649×104 C·mol−1);$n$ 为参加反应的电荷数;${c_i}$ 为待测离子浓度;$K$ 为能斯特电位响应斜率。在pH和温度保持恒定的情况下,用最小二乘法估计${E_0}$ 和$K$ ,可得电极响应电势与待测离子浓度对数之间的线性关系。以金属钼离子选择电极作为工作电极,Ag/AgCl电极作为参比电极,与被测溶液共同构成磷酸根离子浓度测量系统。通过建立标准磷酸根溶液浓度与电极响应电位之间的线性关系,测量钼电极的响应电位即可获得磷酸根离子(
${\rm{HPO}}_4^{2 - }$ )的浓度。 -
1) 被测溶液pH的影响。溶液中的溶质一般都属于电解质,根据电离程度的不同可分为强电解质和弱电解质。磷酸盐属于弱电解质,在水中有H3PO4、
${{\rm{H}}_2}{\mathop{\rm PO}\nolimits} _4^ - $ 、${\rm{HPO}}_4^{2 - }$ 、${\rm{PO}}_4^{3 - }$ 这4种形态。各种形态含量所占比例随着溶液pH的不同而变化。在化学平衡体系中,通常用分布系数来表示某物质中某一形态的存在比例[17],并由此计算出特定条件下某种离子形态的浓度。对于三元酸H3PO4,其各存在形态的平衡浓度可用式(2)表示。式中:
${c_{{{\rm{H}}^ + }}} = {10^{{\rm{ - pH}}}}$ ,为溶液的酸度;${c_{{{\rm{H}}_{\rm{3}}}{\rm{P}}{{\rm{O}}_4}}}$ 、${c_{{{\rm{H}}_{\rm{2}}}{\rm{P}}{{\rm{O}}^ -_4} }}$ 、${c_{{\rm{HP}}{{\rm{O}}^{{\rm{2 - }}}_{\rm{4}}}}}$ 、${c_{{\rm{P}}{{\rm{O}}^{{\rm{3 - }}}_{\rm{4}}}}}$ 为对应磷酸根离子不同形态的平衡浓度;${\delta _{{{\rm{H}}_{\rm{3}}}{\rm{P}}{{\rm{O}}_{\rm{4}}}}}$ 、${\delta _{{{\rm{H}}_{\rm{2}}}{\rm{P}}{{\rm{O}}^ -_{\rm{4}}} }}$ 、${\delta _{{\rm{HP}}{{\rm{O}}^{{\rm{2 - }}}_{\rm{4}}}}}$ 、${\delta _{{\rm{P}}{{\rm{O}}^{{\rm{3 - }}}_{\rm{4}}}}}$ 为对应磷酸根离子不同形态的分布系数;${K_{{\rm{a1}}}}$ 、${K_{{\rm{a2}}}}$ 、${K_{{\rm{a3}}}}$ 分别表示H3PO4、${{\rm{H}}_2}{\mathop{\rm PO}\nolimits} _4^ - $ 、${\rm{HPO}}_4^{2 - }$ 在水中电离水解的平衡常数,分别为${K_{{\rm{a1}}}} = 6.9 \times {10^{ - 3}}$ 、${K_{{\rm{a2}}}} = 6.2 \times {10^{ - 8}}$ 、${K_{{\rm{a3}}}} = 4.8 \times $ ${10^{ - 13}} $ [17]。因此,当溶液的pH已知时,将pH、${K_{{\rm{a1}}}}$ 、${K_{{\rm{a2}}}}$ 、${K_{{\rm{a3}}}}$ 的值代入式(3),可求得溶液中各离子形态的磷酸根分布系数,进一步可通过溶液磷酸盐总浓度及其各形态的分布系数求得溶液中磷酸盐各离子形态此时的平衡浓度。图1显示了不同pH下磷酸盐各离子形态的具体分布情况。不同pH范围内磷酸盐的存在形态不同:当溶液pH<4时,溶质主要以H3PO4和
${{\rm{H}}_2}{\mathop{\rm PO}\nolimits} _4^ - $ 存在;当溶液pH为4~10时,溶质主要以${{\rm{H}}_2}{\mathop{\rm PO}\nolimits} _4^ - $ 和${\rm{HPO}}_4^{2 - }$ 存在;当pH>10时,溶质主要以${\rm{HPO}}_4^{2 - }$ 和${\rm{PO}}_4^{3 - }$ 存在。在钼电极进行实际测定时,很难确保每次待测溶液的pH相同,则不同pH的被测溶液中${{\rm{H}}_2}{\mathop{\rm PO}\nolimits} _4^ - $ 比例不相等,故将${{\rm{H}}_2}{\mathop{\rm PO}\nolimits} _4^ - $ 的分布系数${\delta _{{\rm{HP}}{{\rm{O}}^{{\rm{2 - }}}_{\rm{4}}}}}$ 引入能斯特方程,因此,有必要计算溶液中磷酸盐的总含量。在实际测定过程中,被测溶液pH的变化一方面会影响溶液中磷酸盐离子的形态分布,另一方面磷酸根离子选择电极对溶液中OH−也会存在一定的电位响应,使得测量结果产生误差。因此,本研究考虑在Nernst方程中引入
${\rm{HPO}}_4^{2 - }$ 分布系数和pH线性补偿项来消除被测溶液pH变化对电极测量电位产生的干扰,由此建立基于金属钼的磷酸根离子选择电极测量模型,可用式(4)表示。式中:
${E_0}$ 为电极标准电位,mV;$K$ 为电极对${\rm{HPO}}_4^{2 - }$ 浓度的响应斜率,mV·dec−1;${{\rm{\delta }}_{{\rm{HPO}}_{\rm{4}}^{{\rm{2 - }}}}}$ 为${\rm{HPO}}_4^{2 - }$ 的分布系数;${K_0}$ 为电极对OH−的响应斜率,mV·dec−1;${\rm{pH}}$ 为溶液的pH。2) 溶液温度的影响。在磷酸根离子选择电极测量过程中,温度是影响电极测量准确性的重要因素之一。测量温度对电极的影响主要有2个方面:1) 对电极敏感膜产生影响,造成离子选择电极标准电位和参比电极电位的漂移;2) 会引起溶液离子浓度变化。由式(1)可知,温度变化时,离子选择电极检测斜率(能斯特响应斜率2.303RT/nF)与温度呈线性关系。
在现场实测过程中,很难将电极保持在恒温条件下进行测定,因此,可通过建立相应补偿模型对能斯特测量模型进行改进,消除温度对电极测量的影响,从而得到磷酸根离子选择电极的温度校正模型。
1.1. 磷酸根离子选择电极的检测原理
1.2. 钼电极测量的干扰因素分析
-
仪器:FE28-Standard型pH计(梅特勒-托利多仪器有限公司);218型Ag/AgCl参比电极(上海精密仪器有限公司);DA-968型超声波清洗仪(广东顺德灵通电子厂);DF-101S集热式磁力加热搅拌器(金坛市医疗仪器厂)。
试剂:钼棒(99.99%,2 mm);磷酸氢二钠(Na2HPO4);氢氧化钠(NaOH);硫酸(H2SO4)。材料和试剂都购自国药集团化学试剂有限公司。所有测量溶液均用去离子水配制。
-
先将金属钼棒(长约5 cm)的一端与铜线相连,用环氧树脂密封,再放在烘箱中烘干。另一端(工作面)用砂纸打磨成光滑表面,即可制得金属钼电极。制备的钼电极测量前无需预处理,只需在使用一段时间后在磨砂纸上用Al2O3粉末抛光,再用去离子水冲洗干净后,放乙醇和去离子水中超声波清理干净即可。
-
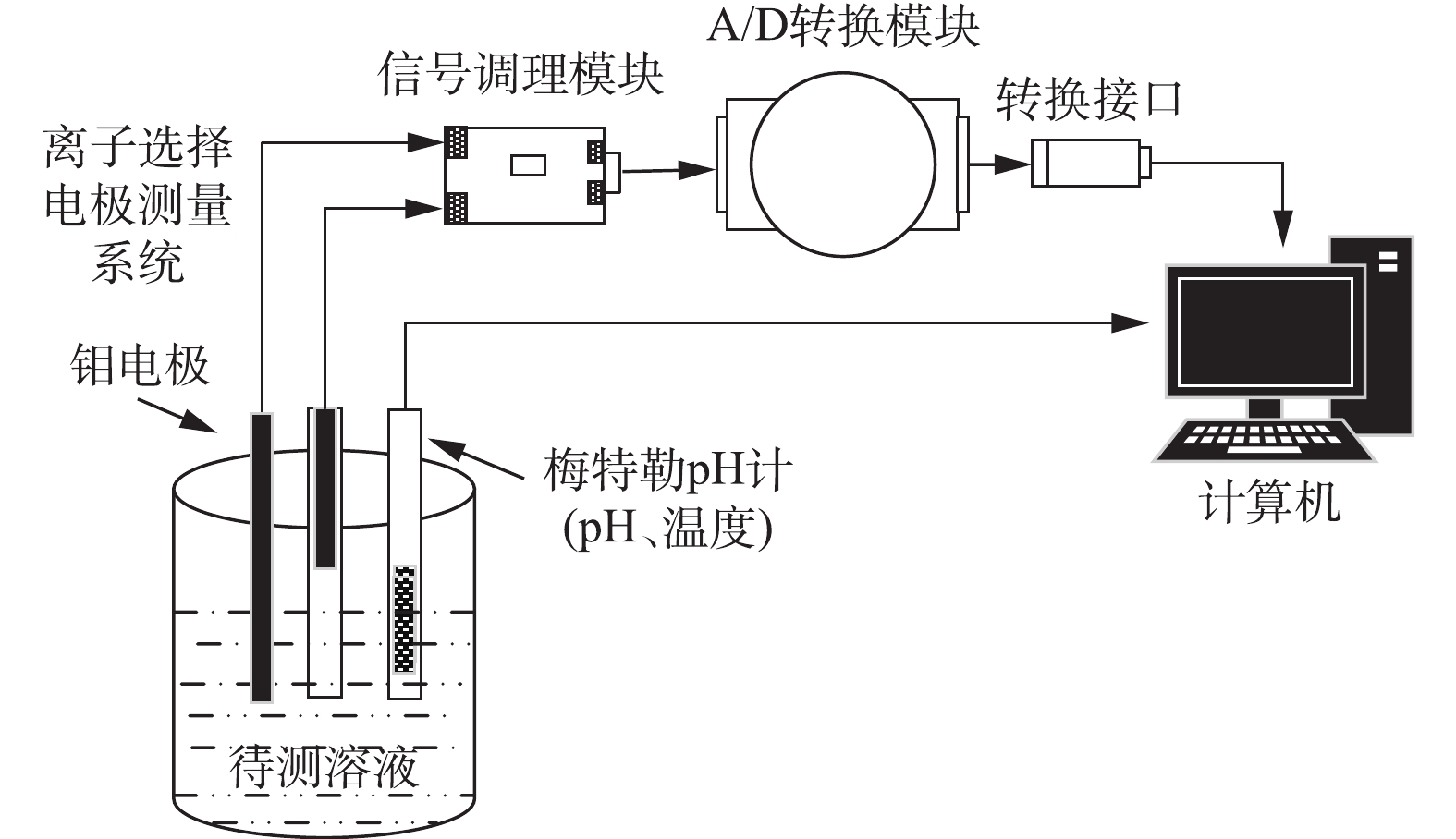
装置结构如图2所示。装置由磷酸根离子选择电极测量系统、电极信号调理模块、pH计(包含温度测量)、A/D转换模块、数据接口和计算机组成。由钼电极作为工作电极,Ag/AgCl电极作为参比电极构成磷酸根离子选择电极测量系统,将其产生的响应信号经过前置放大器和信号调理电路,由A/D转换模块通过RS485转USB接口连接至计算机,实现对串口数据的采集、分析和存储。
-
称取一定质量的Na2HPO4试剂,利用去离子水配制成浓度为10−6~10−1 mol·L−1的Na2HPO4标准溶液,调节被测溶液pH为7~12,经检测系统测得磷酸根离子电极响应电位值。依次改变溶液测量温度分别为5、15、25、35、40 ℃,测量电极响应电位。观测溶液pH和温度的变化对不同浓度磷酸根离子选择电极输出电位的影响,利用测量数据拟合建立磷酸根离子选择电极模型。
2.1. 实验仪器及原料
2.2. 电极的制备
2.3. 检测装置
2.4. 实验方法
-
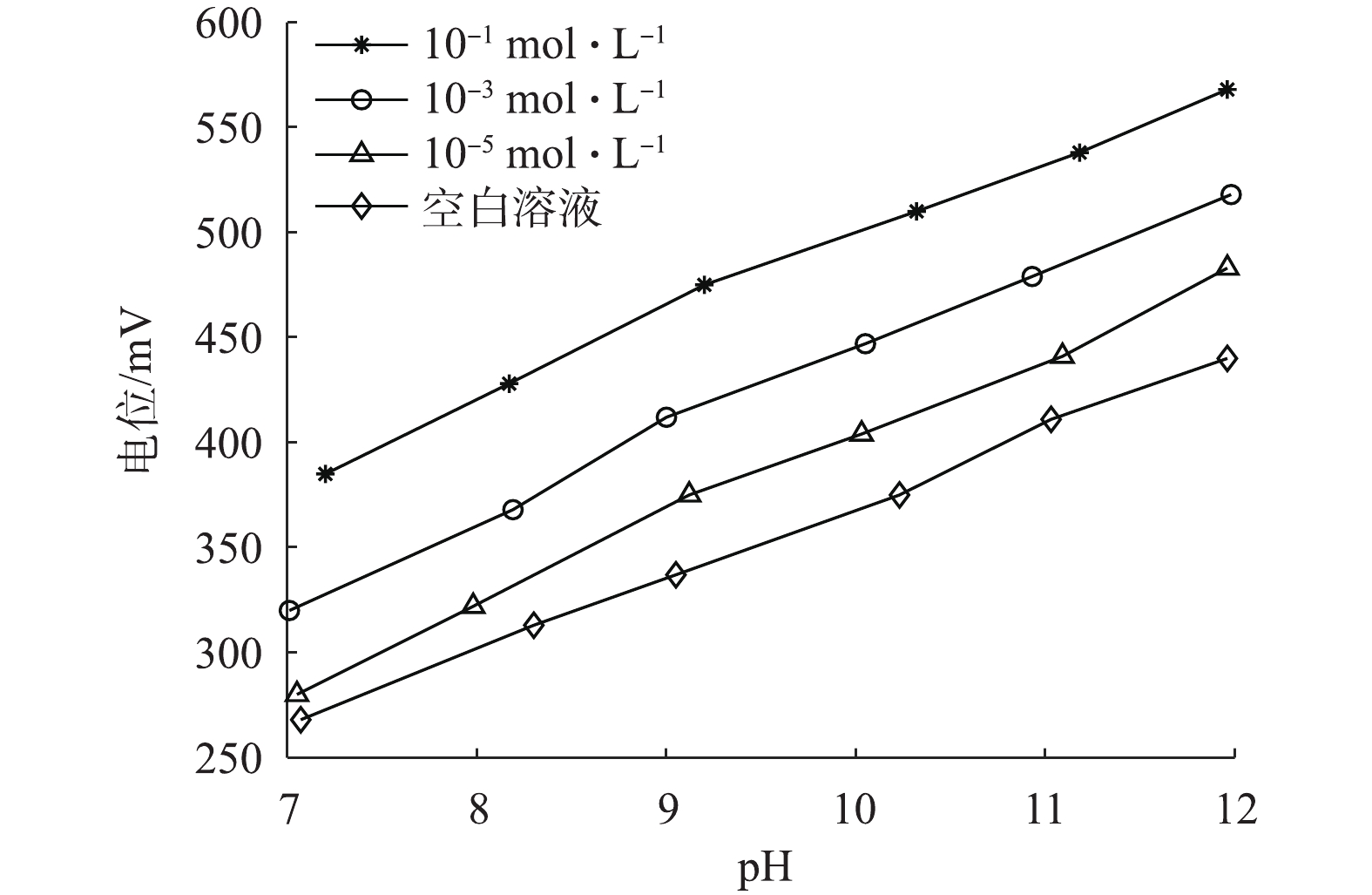
在恒定温度25 ℃下,分别调节浓度为10−5、10−3、10−1 mol·L−1的Na2HPO4溶液pH,并测量电极输出电位,观测被测溶液pH变化对磷酸根电极响应电位的影响,结果如图3所示。在相同浓度磷酸根溶液下,电极的响应电位也随着pH的增大而增大,表明被测溶液pH变化直接影响钼电极的输出电位值。
由图3的结果发现,在空白溶液中改变溶液pH测量电极输出电位,溶液pH和电极的响应电位变化近似呈线性关系。电极的响应电位随溶液pH的增大而提高,表明OH−的存在会对电极测量造成干扰,影响电极测量精度。pH与电极响应电位的关系见式(5)。
式中:
${E_{{\rm{O}}{{\rm{H}}^ - }}}$ 为电极的响应电位;${K_0}$ 为pH对电极的响应斜率;${E_{\rm{m}}}$ 为电极的初始电位。根据式(5),利用图3中空白溶液测定数据进行线性拟合,得到pH对电极响应斜率${K_0}$ 为35.22 mV·dec−1。将${K_0}$ 值作为pH的线性补偿系数代入式(4),得到式(6)。进一步分析被测溶液温度变化对电极测量的影响,由于前期研究表明[15],钼电极在碱性条件下与
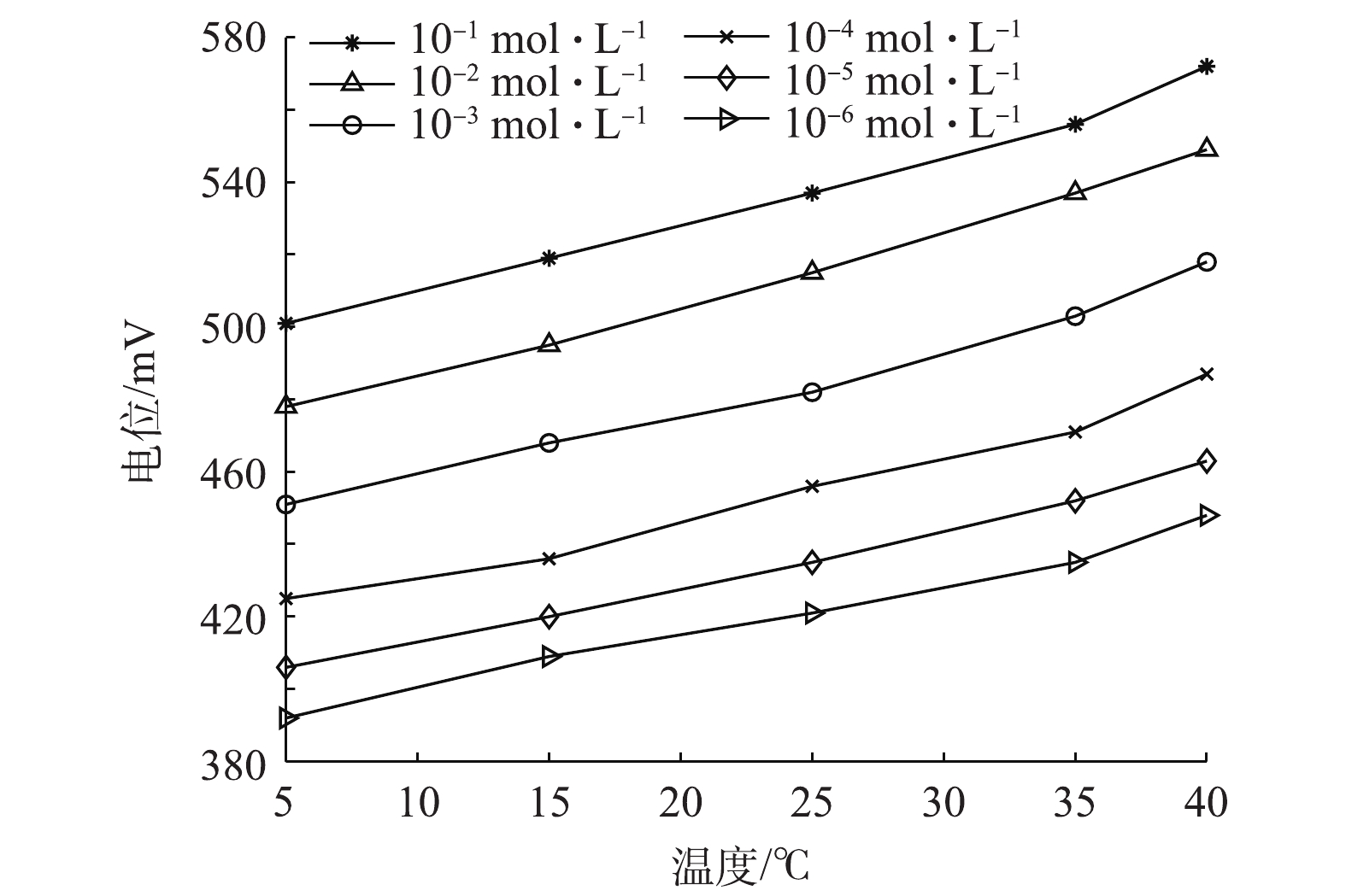
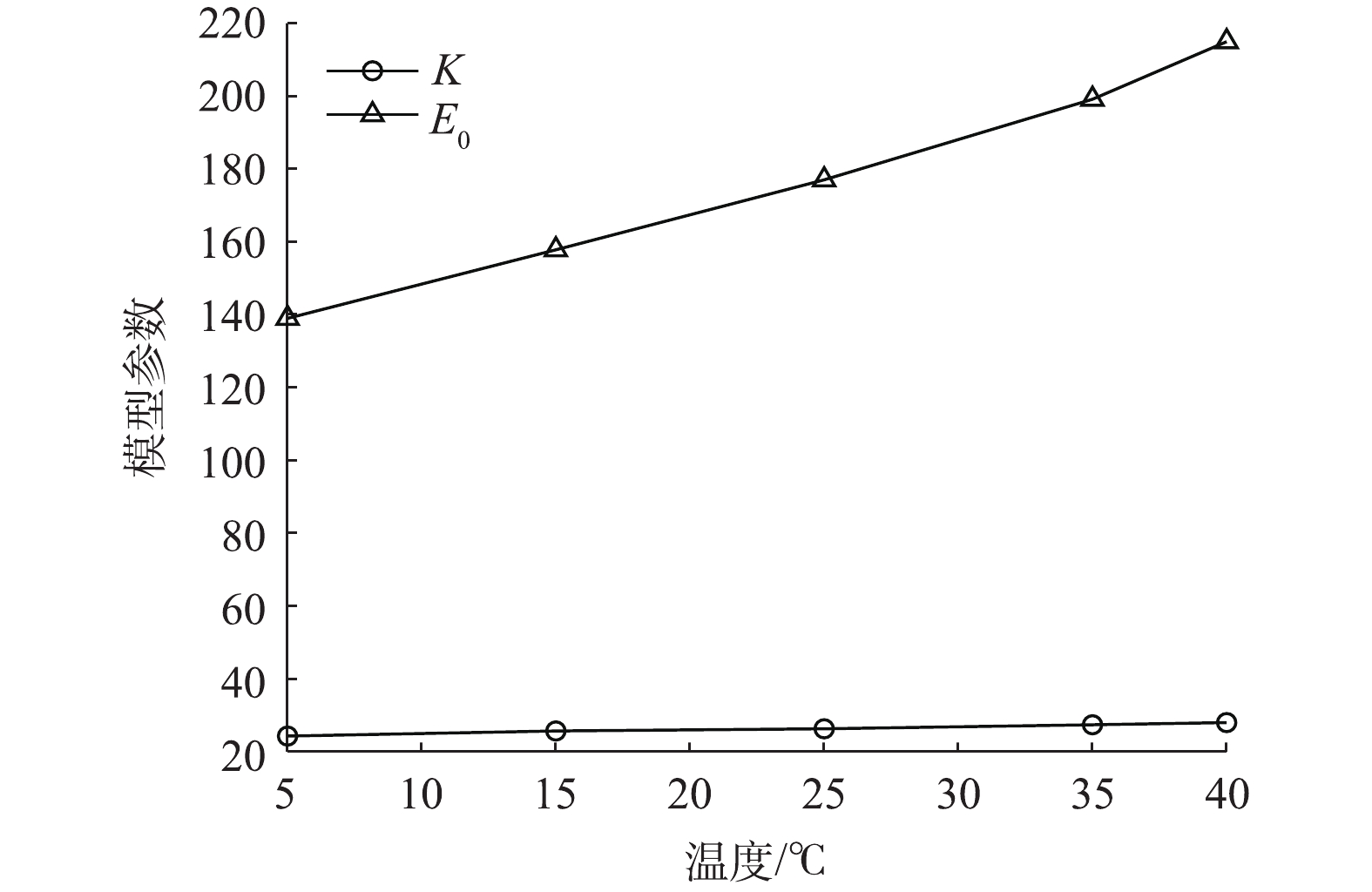
${\rm{HPO}}_4^{2 - }$ 发生响应,且当pH为11时,整体测量效果更佳。因此,取浓度为10−6~10−1 mol·L−1的Na2HPO4溶液,调节溶液pH为11,改变溶液温度依次为5、15、25、35、40 ℃,测定钼电极的响应电位,结果如图4所示。由图4结果可知,温度的变化会引起钼电极输出电位的漂移。以25 ℃时的电势值为基准,温差增大,电位值变化幅度随之增大。利用式(6)以及图4中不同温度下10−6~10−1 mol·L−1Na2HPO4溶液的电极响应电位测定数据,运用最小二乘法分别拟合得到不同温度时的
${E_0}$ 和$K$ ,结果如图5所示。由图5可发现,钼电极对
${\rm{HPO}}_4^{2 - }$ 浓度的响应斜率与标准电势会随着温度改变而改变,近似呈线性变化,假定温度与${E_0}$ 和$K$ 的关系可用式(7)表示。式中:
${E_0}$ 为电极的标准电位,mV;$K$ 为${\rm{HPO}}_4^{2 - }$ 对电极响应电位的斜率,mV·dec−1;$a$ 、$c$ 分别为电极标准电位和响应斜率随温度改变的变化系数;$b$ 、$d$ 分别为电极标准电位和响应斜率的初始值。利用图5中${E_0}$ 和$K$ 随温度变化的关系作回归拟合,可得到$a = 2.129$ 、$b = 126.5$ 、$c = 0.100\;9$ 、$d = 23.92$ 。将$a$ 、$b$ 、$c$ 、$d$ 的值代入式(7),得式(8)。将式(8)代入式(6),得到基于金属钼的磷酸根离子选择电极的测定模型(式(9)),并将式(9)变形转化为式(10)。
将式(3)中
${\delta _{{\rm{HP}}{{\rm{O}}_{\rm{4}}}^{{\rm{2 - }}}}}$ 代入式(10),可得到磷酸盐总浓度值与电极输出电位、溶液pH、温度之间的关系式(式(11))。式中:
${c_i}$ 为磷酸根离子浓度,mol·L−1;$E$ 为电极测量输出电位值,mV;${\rm{pH}}$ 为溶液的pH;$T$ 为温度,℃。 -
为验证测定模型的准确性,使用Na2HPO4试剂配制不同浓度的Na2HPO4溶液,改变溶液pH和温度,用磷酸根离子选择电极检测系统测定其响应电位,将所得数据代入式(11)计算出磷酸盐总浓度。比较离子浓度计算值与实际浓度值的相对误差,结果如表1所示。结果表明,该测量模型在10−6~10−1 mol·L−1的Na2HPO4溶液中测量误差最大为6.33%。
-
配制不同浓度的Na2HPO4溶液,使用该装置测定磷酸根离子含量,同时利用离子色谱法对这些溶液进行检测。为避免配制溶液过程中产生的系统误差,以离子色谱法检测结果作为溶液浓度真值,利用钼电极检测得到的结果及相对误差如表2所示。结果表明,本研究提出的计算方法与离子色谱法的测定结果间相对误差差值最大为5.50%,测定结果相近。因此,本研究建立的补偿模型可用于提高钼电极的检测精度。
3.1. 干扰因素的影响
3.2. 模型验证
3.3. 对比实验
-
1)利用离子选择电极法进行溶液磷酸根离子含量测定过程中,被测溶液pH和环境温度的变化会引起电极响应电位的漂移、电极线性斜率的变化,对测量结果产生误差。
2)在能斯特方程的基础上,通过引入
${\rm{HPO}}_4^{2 - }$ 分布系数、pH的线性补偿项及温度校正模块建立基于金属钼的磷酸根离子选择电极的测量模型,以消除测量过程中溶液pH值和温度的改变对测量结果的影响。建立的测量模型10−6~10−1 mol·L−1的Na2HPO4溶液中对磷酸根离子含量的测量误差最大为6.33%,大大提高了磷酸根离子选择电极的检测精度。3)采用离子选择电极法检测操作简单,建立测量模型有利于进一步实现水环境中磷酸根离子含量的在线实时监测,为环境水质总磷的自动化监测提供参考。




 下载:
下载: