-
锑(Sb)是自然界中存在的一种有毒重金属。长期接触Sb可导致严重的健康问题,如引起人体肝脏、皮肤、呼吸系统和心血管系统疾病。因此,Sb被美国和欧盟列为优先控制污染物[1]。我国是世界上最大的Sb生产国,全球超过80%的Sb供应量来自中国西南部的矿山[2]。环境中Sb既可以通过自然过程,如岩石风化、热液喷发等产生,也可以通过人为活动,如矿山开采、化石燃料燃烧、地下水抽取等过程产生[3]。在Sb高污染地区,Sb负荷超过土壤的自然衰减能力,故导致Sb在谷物和蔬菜中积累,进而沿食物链富集,对人类健康构成巨大的威胁。有研究者发现,Sb矿区附近居民膳食中Sb摄入量是健康标准(360 μg·d−1)的1.5倍[4]。严峻的Sb污染形势,促使全球开始关注Sb的生物地球化学过程[5]。
Sb的化学形态决定了它的毒性、生物利用度和环境迁移性[6]。在自然环境中,Sb主要有2种无机形态,在含氧环境中以五价锑酸盐[Sb(Ⅴ)]为主要形态,而在缺氧条件下主要以毒性较大的三价亚锑酸盐[Sb(Ⅲ)]形式存在[7]。在使用O2作为电子受体的自然环境条件下,Sb的氧化是极其缓慢的,而微生物介导的酶促反应在Sb的形态转化中起着重要的作用[8]。Sb氧化细菌(SbOB)编码的锑氧化酶能够催化Sb(Ⅲ)向Sb(Ⅴ)的转化,以降低Sb的毒性,从而为Sb污染环境的生物修复提供了基础[9]。
近年来,微生物参与的Sb的生物地球化学循化及其介导Sb在固液界面之间的迁移转化引起了较多关注。生物吸附是Sb与微生物复杂的相互作用过程的第一步。大多数微生物表面含有多种带负电荷的基团,如羧基、氨基、羟基,这些基团通过络合、静电吸引和离子交换等作用方式吸附和固定包括Sb在内的多种重金属[10]。菌体表面的吸附作用能显著影响土壤中溶解离子的迁移和转化。另一方面,大多数土壤微生物会附着在含铁、锰、铝氧化物的天然黏土矿物上,形成的微生物—矿物复合物成为土壤中Sb的重要吸附剂[11]。目前,较多研究集中在锑氧化菌的筛选鉴定和分子机理的探究。虽然已经分离出了一些SbOB,但受到Sb耐受性或氧化效率的限制,关于SbOB在Sb污染土壤中对Sb迁移转化的影响机制有待阐明[12]。因此,本研究的目的是:1)从Sb污染土壤中分离和鉴定新的高效SbOB;2)阐释SbOB对污染土壤中Sb的存在形态以及迁移转化的影响。
-
筛菌的土壤样品选自锑矿资源丰富的贵州省三都县苗龙村(26°2'51''N,107°52'33''E)。使用土壤采集器收集矿厂排水口附近的沉积物,将采回的样品风干后过筛。经测定,土壤锑质量分数为155.9 mg·kg−1。
用于孵育的土壤选取湖南省冷水江市锡矿山龙王池末段矿泥(27°44′39″N,11°27′44″E),土壤中金属元素的质量分数如表1所示。按照我国《土壤环境质量建筑用地土壤污染风险管控标准》(试行)(GB36600-2018)[13]规定,工矿用地中锑的管制值为360 mg·kg−1,供试污染土壤样品中的Sb大约是管制值的4.7倍。
主要试剂:酒石酸锑钾(C8H4K2O12Sb2·3H2O)、焦锑酸钾(K2H2Sb2O7·4H2O)。LB培养基(1 L液体培养基中含有蛋白胨10 g、酵母5 g、氯化钠5 g,pH约为7.5),CDM培养基(1 L液体培养基中含有MgSO4·7H2O,2 g;NH4Cl,1 g;Na2SO4,1 g;K2HPO4,0.013 g;CaCl2·2H2O,0.067 g;Na-lactate,5 g;Fe2SO4·7H2O,0.033 g;NaHCO3,0.798 g),固体培养基为液体培养基中加入1.5%的琼脂制备。
-
首先,从锑污染土壤中分离筛选出Sb氧化率较高(>90%)的菌株[9, 14],验证其对Sb的抗性及氧化效率;然后,进行锑氧化菌与土壤的孵育实验,所有处理均重复3次。
Sb抗性实验。接种1%菌液到100 mL的LB培养基中,设置Sb(Ⅲ)浓度梯度为0、0.1、1、2、3 mol·m−3,设置Sb(Ⅴ)浓度梯度为0、0.1、1、5、10 mol·m−3,每隔2 h取样,使用分光光度计测定细菌的OD600并绘制生长曲线。
Sb氧化实验。接种1%菌液于Sb(Ⅲ)浓度为100 mmol·m−3的100 mL CDM培养液的三角瓶中,在30 ℃、180 r·min−1下震荡培育6 d,间隔适当的时间取样1 mL,离心后使用0.22 μm滤膜过滤,利用原子荧光光谱仪(AFS)测定Sb的形态和浓度。
土壤孵育实验。将5 g已灭菌的土壤加入到200 mL已灭菌的CDM培养基中,将筛选得到的锑氧化细菌以1%的接种量加入上述体系中,设为加菌体系,对照体系中不接种细菌。在30 ℃、180 r·min−1下震荡培育,前10 d每隔2 d取样1 mL,之后,间隔5 d取样1 mL,样品过0.22 μm滤膜,用原子荧光光谱仪(AFS)测定Sb(Ⅲ)和Sb(Ⅴ)的浓度。取样时测定pH值,并使用稀HCL或NaOH调节加菌体系中的pH,使其与对照体系的pH保持一致。另外取出100 μL溶液稀释适当倍数用于平板涂布,计数细菌的生长情况。
细菌对锑的吸附实验。在CDM培养基中,将细菌培养至对数生长期,加入50 mmol·m−3 Sb(Ⅲ)和50 mmol·m−3 Sb(Ⅴ),设为加菌体系,在30 ℃下,以180 r·min−1振荡培养,在0和4 h时取样,以5 000 r∙min−1离心10 min,上清液过0.22 μm滤膜,用原子荧光光谱仪(AFS)测定Sb的浓度。设置不加菌的对照体系,加菌体系与对照体系溶液中的Sb含量之差即为细菌对Sb的吸附量[15]。
萃取实验。将土壤孵育实验结束后的土壤样品进行萃取,表2显示了土壤萃取的步骤及每种萃取剂所针对的锑的萃取形态[16],将过滤得到的萃取液用原子荧光光谱仪(AFS)测定Sb的形态和浓度。
-
菌体样品经过预处理后使用扫描电子显微镜(Quattro,北京理德东方科技有限公司)观察菌体的表面形貌[17]。将土壤样品冷冻干燥,研磨过200目筛用于土壤样品的表征。采用X射线粉末衍射仪(X’ Pert 3 powder,荷兰帕纳科分析仪器有限公司)分析土壤样品中物质的晶体结构。利用显微激光共聚焦拉曼光谱仪(LabRAM HR evolution,东方科学仪器进口集团有限公司)对土壤样品中存在的官能团进行分析[18]。利用X射线光电子能谱(AXIS SUPRA,岛津公司)分析Sb的4d轨道在土壤颗粒表面的分布。
-
1)形态观察及生理生化特征。如图1所示,生长在CDM平板上的菌落呈淡黄色,不透明,形状不规则,表面有褶皱并突起。利用SEM扫描电镜对细菌进行观察,菌体为杆状,长约1 μm。对细菌生理生化特性进行鉴定如表3所示。
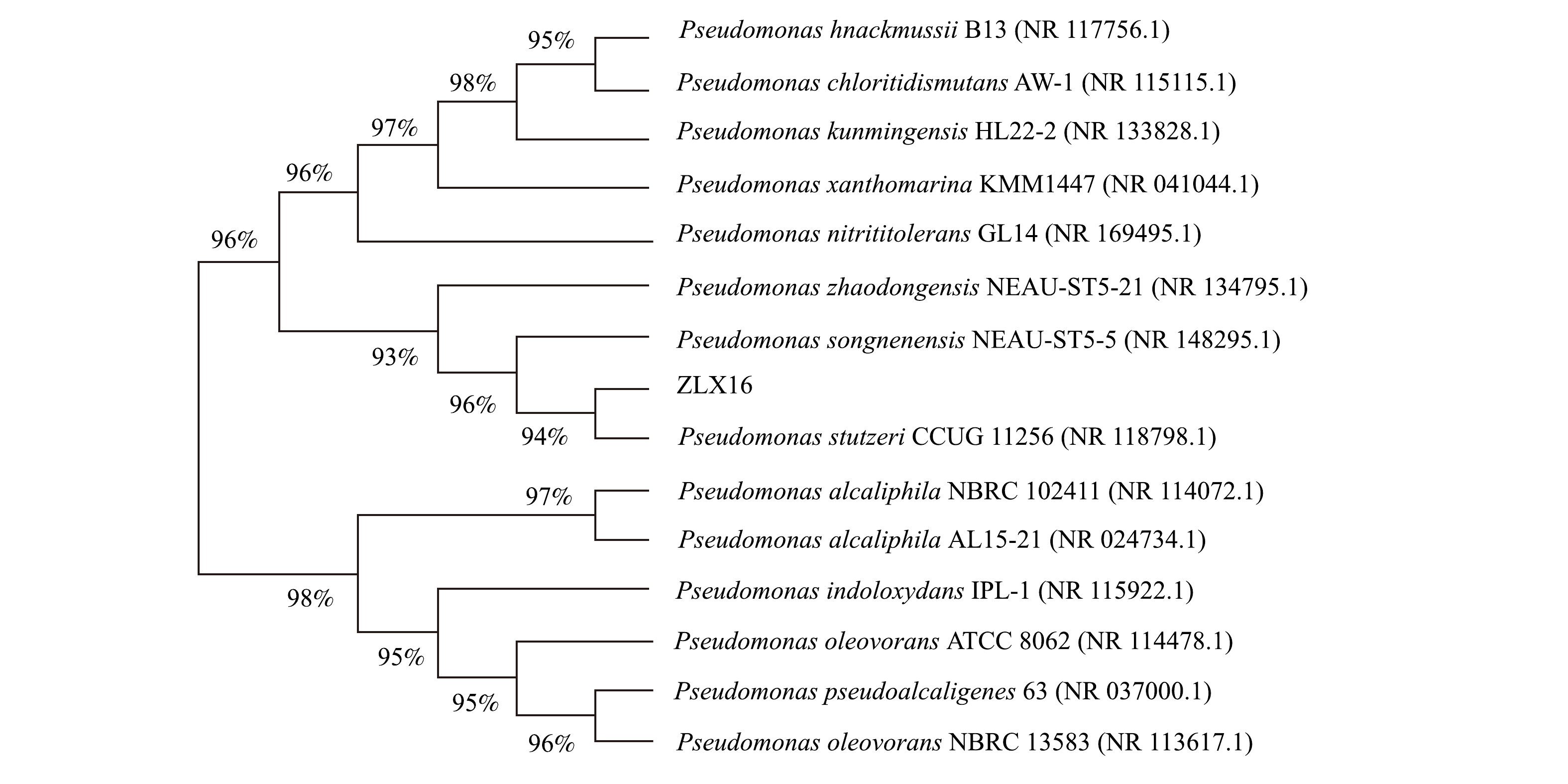
2)系统发育树。如图2所示,16S rDNA基因系统发育树,显示了细菌的亲缘关系。该菌株与Pseudomonas stutzeri CCUG 11 256 (NR 118 798.1)菌株的同源性达94%,为假单胞菌属,命名为Pseudomonas sp. ZLX16。
-
1)生长曲线及对锑的耐受性。菌株ZLX16对Sb(Ⅲ)和Sb(Ⅴ)都具有一定的抗性能力。菌株ZLX16的最小生长抑制浓度分别为2 mol·m−3 Sb(Ⅲ)、至少10 mol·m−3 Sb(Ⅴ)。好氧SbOB的MIC值普遍分布在Sb(Ⅲ) 0.1~5 mol·m−3及Sb(Ⅴ) 10 mol·m−3以上的范围[9, 14, 19]。已有研究[14]表明,从11种不同地区的锑矿土壤中分离出125株可培养的Sb(Ⅲ)抗性细菌,其中不动杆菌属对Sb(Ⅲ)的MIC最高为3.43 mol·m−3,假单胞菌属为1.65 mol·m−3。相较于假单胞菌属,菌株ZLX16对Sb(Ⅲ)具有较强的抗性。ZLX16对Sb(Ⅴ)的MIC高于10 mol·m−3,这说明Sb(Ⅴ)的毒性远低于Sb(Ⅲ)。值得注意的是,实验中用于菌株筛选的土壤Sb的质量分数约为155.9 mg·kg−1。可见,为了应对高Sb的毒性环境,菌株进化出了较强的Sb耐受能力,这也进一步解释了SbOB的Sb耐受性较强的原因。
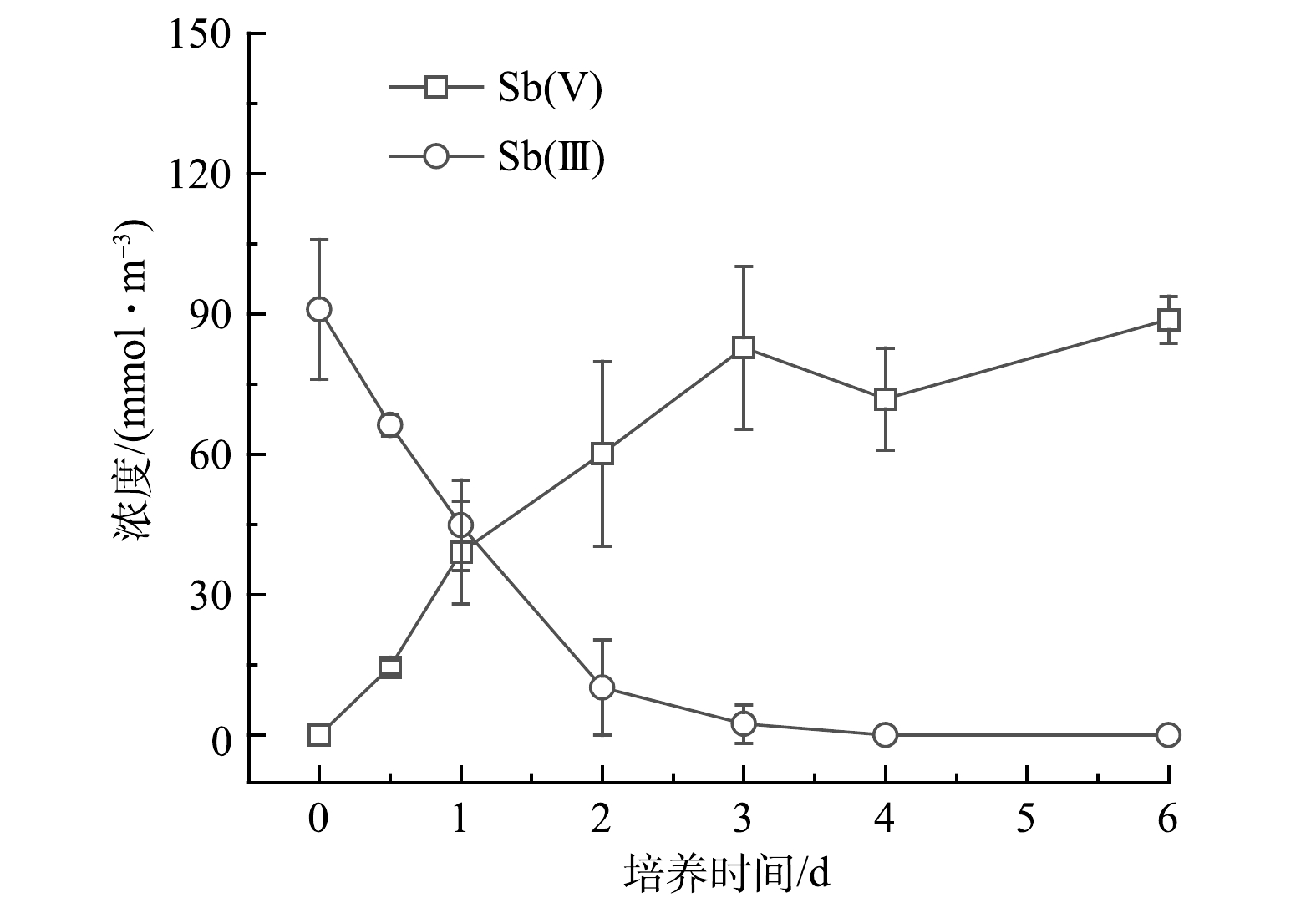
2)氧化实验。如图3所示,Sb氧化细菌ZLX16在3 d内能够将97.3%的Sb(Ⅲ)氧化为Sb(Ⅴ),氧化速率为29.5 μmol·d−1。在LI等[9]分离得到的Sb氧化菌中,氧化效率最高的Comamonas spp.S44和JL40,其氧化速率分别为16.67和10.00 μmol·d -1。相较于已报道[19]的一系列Sb氧化菌中,菌株ZLX16表现为较强的Sb氧化速率。
-
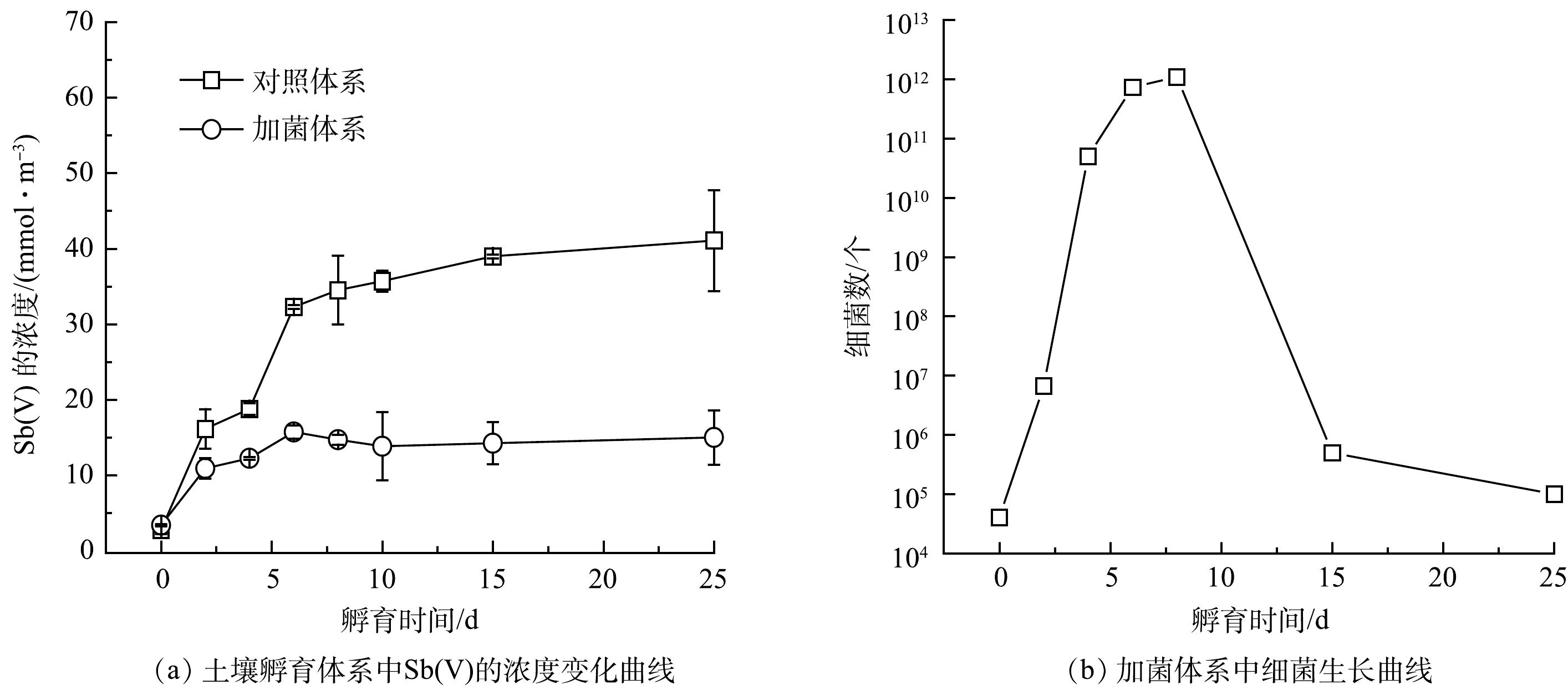
1)菌株ZLX16对土壤中锑的释放及氧化。土壤孵育实验过程中,Sb的释放量变化如图4(a)所示。其中,只有Sb(Ⅴ)从土壤释放到液相,Sb(Ⅲ)浓度低于检测限。加菌体系和对照体系在25 d时,释放到液相的Sb(Ⅴ) 浓度分别为15.0和41.1 mmol·m−3,加菌体系中Sb的释放量比对照体系中减少约63.5%。这表明,细菌能够明显阻碍Sb由固相到液相中的转移。
实验过程中通过涂平板计数来掌握细菌的生长情况,同时监测了pH的变化。图4(b)中细菌的生长曲线表明,细菌生长状态良好,细菌数在第10 d左右达到最大量。对照体系中的pH初始为8.2,随培养时间的延长有缓慢上升的趋势,在第6 d稳定在8.9左右。加菌体系中pH较对照体系略有上升,通过调节pH,使之与实验体系保持一致,以排除pH变化对Sb的状态的影响。
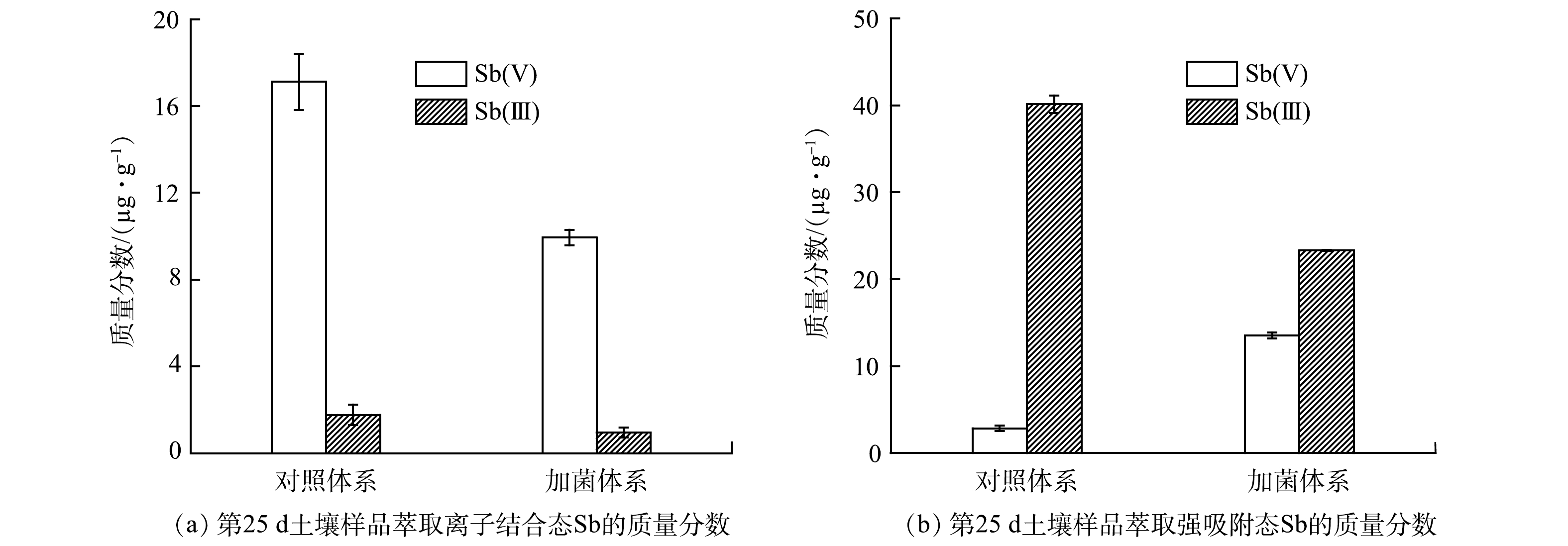
为了探究菌株ZLX16对土壤中Sb存在形态的影响,对土壤中以离子结合态和强吸附态形式结合的Sb分别进行了萃取。如图5(a)、图5(b)所示,对比2个体系土壤中Sb(Ⅲ)的质量分数,菌株ZLX16对固相中离子结合态和强吸附态的Sb(Ⅲ)都有一定的氧化作用,氧化率分别为46.2%和41.9%。而且,2个体系中以离子结合态形式存在的Sb(Ⅲ)较低,对照体系和加菌体系分别为1.8和0.9 mg·kg−1;以强吸附态形式存在的Sb(Ⅲ)较高,对照体系和加菌体系分别为40.2和23.3 mg·kg−1。由于环境中Sb(Ⅲ)主要以Sb(OH)3形式存在,呈电中性,易与土壤产生静电吸附,导致Sb(Ⅲ)不易从固相中释放[20],因此,2个体系中的Sb(Ⅲ)均以强吸附态形式为主,这与图4(a)中未检测到Sb(Ⅲ)的现象相符。
对比2个体系土壤中Sb(Ⅴ)的质量分数,如图5(a)所示,加菌体系中和对照体系中以离子结合态形式存在的Sb(Ⅴ)分别为9.9和17.1 mg·kg−1,此结果与图4(a)加菌体系中Sb(Ⅴ)释放量低的现象一致。图5(b)显示,加菌体系和对照体系中以强吸附态形式存在的Sb(Ⅴ)分别为13.5和2.9 mg·kg−1。这表明ZLX16可以将一部分游离态Sb(Ⅴ)转化为强吸附态Sb(Ⅴ),从而固定在土壤中。由于环境中Sb(Ⅴ)主要以Sb(OH)6−形式存在,与土壤存在静电斥力,流动性较强,容易释放,因此,2个体系中的Sb(Ⅴ)均以离子结合态形式为主。
2)细菌和土壤对锑的吸附。为了探究加菌体系与对照体系相比所减少的Sb的去向,进行了细菌吸附实验和土壤消解实验。细菌吸附实验结果表明,细菌对Sb的吸附量约为16 mg·g−1。已有研究证实,细菌表面的大分子物质和官能团可以吸附络合重金属离子[21]。杜辉辉等[15]发现,细菌主要通过细胞壁或胞外EPS的羧基、氨基络合Sb,实验结果表明理论最大吸附容量约为1%。这主要是由于锑以含氧酸根的形式存在,与细菌存在静电斥力,导致吸附量较少。土壤消解结果显示,加菌体系和对照体系的土壤中Sb分别为1 114、1 037 mg·kg−1。与对照体系相比,加菌体系液相中减少的Sb中有92.0%被固定在土壤中。这说明,在细菌的作用下,土壤对锑的吸附能力增强。
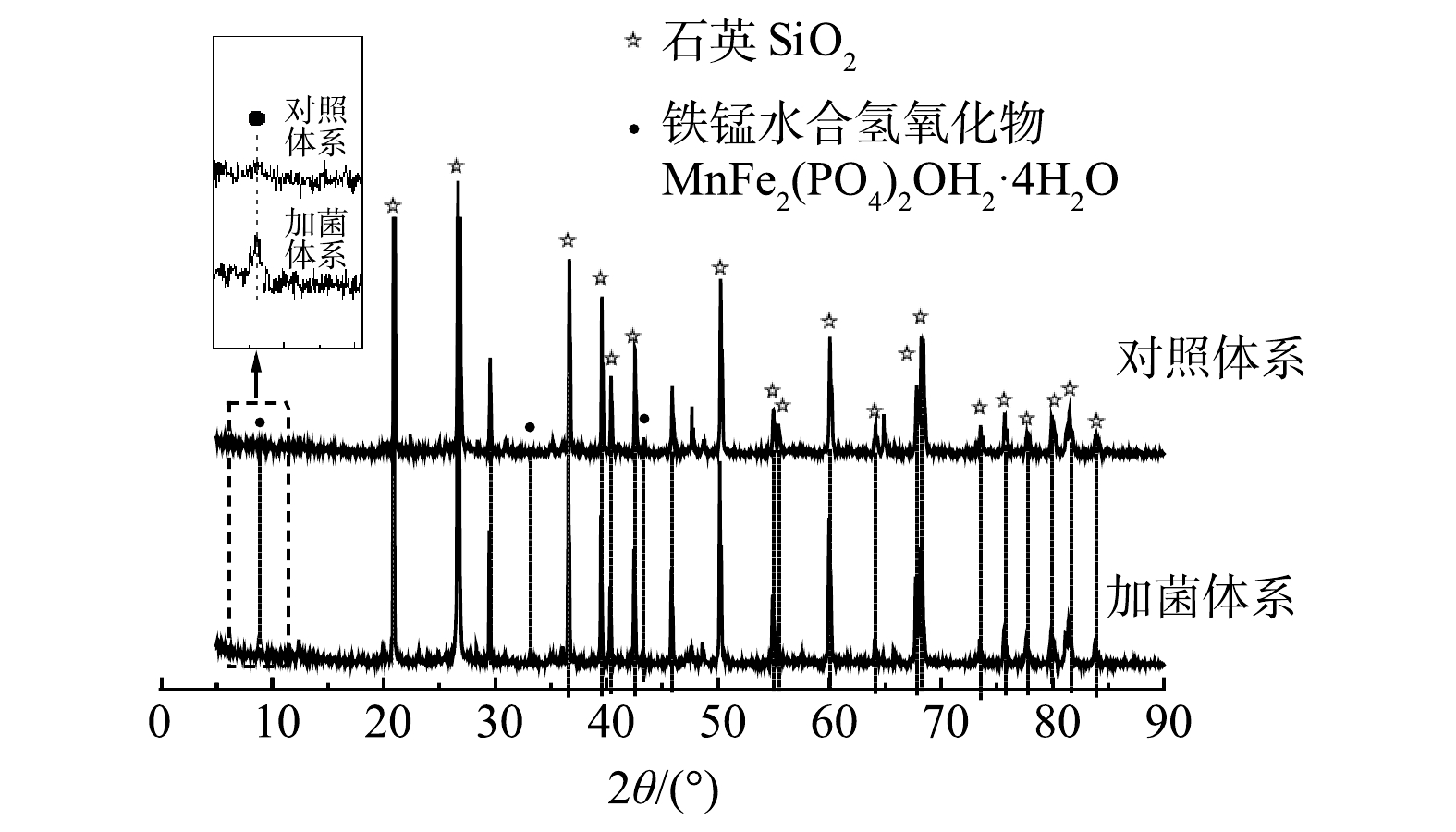
3)XRD表征。为了探究细菌对土壤中成分的影响,采用XRD手段对土壤样品中物质的晶体结构进行了分析。如图6所示,土壤中含有晶型较好的SiO2。此外,土壤中的Fe、Al、Ca含量较高,可能会存在Fe、Al、Ca化合物。但从XRD中未发现Fe、Al、Ca等元素的衍射峰,这说明土壤中的铁铝钙大部分是以无定形化合物的形态存在[22]。无定形的铁氧化物或无定形的铁、铝含水氧化物是Sb(Ⅴ)吸附的主要土壤成分,具有更大的比表面积,可与重金属离子发生共沉淀,从而增加土壤对重金属的吸附能力[23]。从XRD图谱中可发现,加菌体系中出现铁锰水合氢氧化物(MnFe2(PO4)2OH2·4H2O)的衍射峰,铁、锰氧化物是土壤中Sb吸附和氧化过程的重要物质,这方面已有较多报道[24-26]。徐伟等[26]推测,Sb(Ⅴ)在铁锰复合氧化物表面形成内层络合物,Sb(Ⅴ)吸附量随离子强度的增加而增加。然而,在研究环境中Sb的迁移转化时,必须考虑铁、锰氧化物与有机物的复合物。细菌在土壤矿物表面粘附并形成生物膜是环境中常见的过程,这个过程可能会改变这些团聚体的理化性质,从而影响团聚体与金属的结合行为[27]。
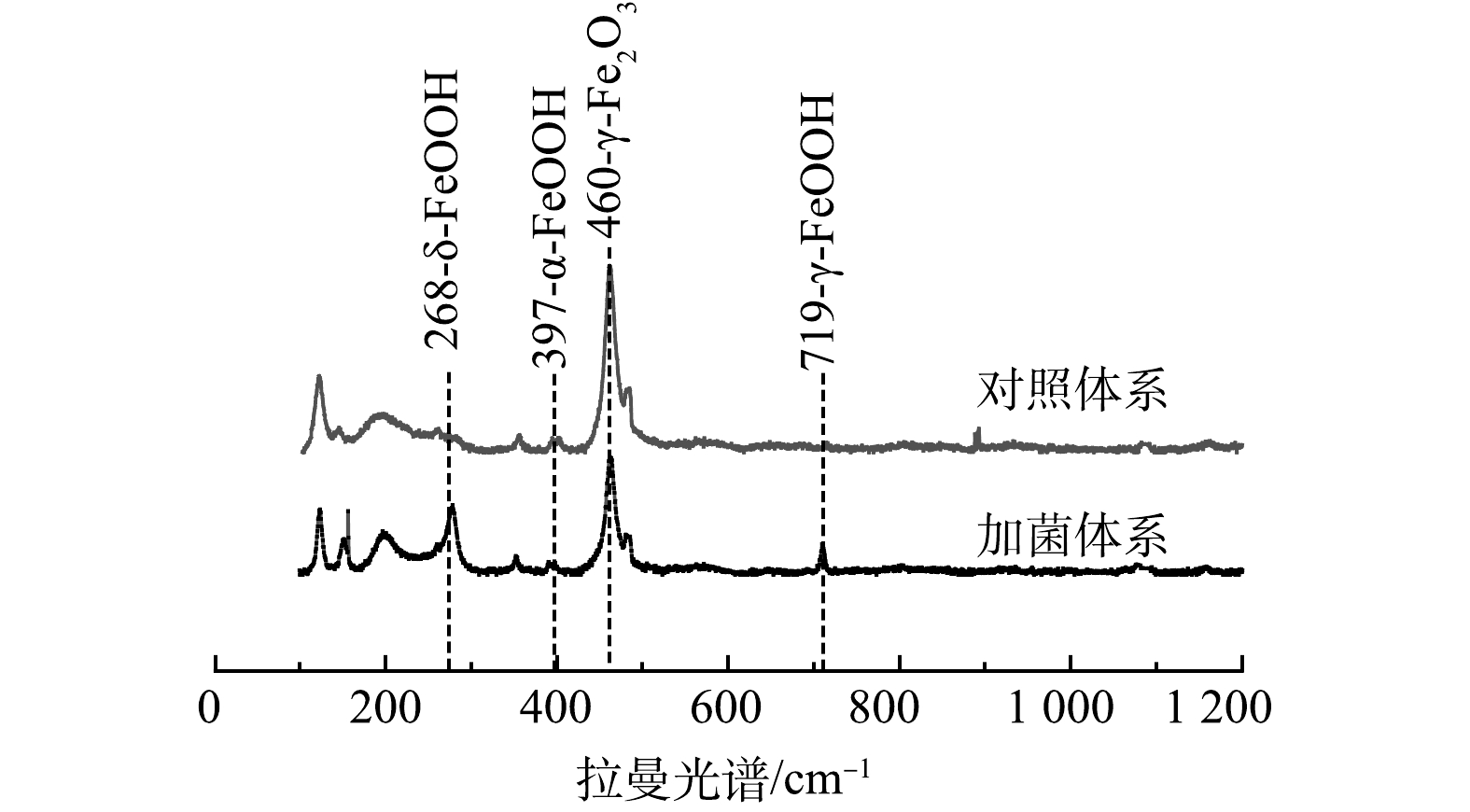
4)拉曼表征。进一步采用拉曼手段检测了土壤官能团组成,如图7所示,加菌体系中出现δ-FeOOH(六方纤铁矿)和γ-FeOOH(纤铁矿)峰[28-29]。这说明,细菌促进土壤中的铁氧化物生成无定形的羟基氧化铁。无定形的羟基氧化铁表面暴露着非常活泼的(-OH、-OH2)官能团,使其具有巨大比表面积、表面氧化还原和配位络合能力,因此一直被视为重金属的高效吸附剂。FeOOH的晶型如α-FeOOH(针铁矿)和β-FeOOH(四方纤铁矿)、δ-FeOOH(六方纤铁矿)、γ-FeOOH(纤铁矿)被视作As(Ⅴ)的良好吸附剂,加菌体系中检测出的δ-FeOOH和γ-FeOOH在作为污染水中重金属的吸附剂方面具有相当大的前景[30-31]。Sb与As处于同一主族,具有相似的化学性质,故可推测羟基氧化铁对Sb也具有较强的吸附能力。这也解释了Sb被土壤固定的原因。
-
1)从Sb污染地区分离鉴定得到1株Sb氧化细菌ZLX16,通过比对16S rDNA基因序列,鉴定为假单胞菌属Pseμdomonas。综合该细菌的生物学特性,发现该细菌对Sb有较强的抗性和氧化性。该菌株为进一步研究微生物氧化Sb的机理和生物修复锑污染土壤提供了菌种资源。
2)土壤中Sb从固相到液相的迁移以Sb(Ⅴ)为主。Sb氧化菌ZLX16能够将土壤颗粒表面的Sb(Ⅲ)氧化,生成的Sb(Ⅴ)以强吸附态的形式被固定在土壤中,从而可阻碍Sb(Ⅴ)从固相释放到液相。
3)土壤的XRD和拉曼光谱显示,菌株ZLX16促进土壤产生Fe-Mn氧化物和FeOOH,以增强对Sb的吸附能力,从而可降低土壤中Sb的流动性。
高效锑氧化菌的筛选鉴定及其对土壤中锑迁移转化的影响
Isolation and identification of a high efficiency antimony oxidizing bacterium and its effect on the migration and transformation of antimony in soil
-
摘要: 为了筛选出高抗性的锑(Antimony, Sb)氧化菌株,并阐释该细菌对土壤中Sb迁移转化的机制,从Sb污染土壤中富集培养并分离出Sb高抗性和高氧化效率的菌株,结合细菌形态、生理生化检测、16S rDNA基因序列分析等方法,确定了菌株的分类地位;通过该细菌与Sb污染土壤共孵育实验,研究了细菌对土壤中Sb迁移转化的影响。结果表明,筛选得到的菌株为假单胞菌属Pseμdomonas,命名为Pseμdomonas sp. ZLX16;菌株ZLX16能够耐受2 mol·m−3的Sb(III)以及10 mol·m−3的Sb(V),并且在3 d内可以将100 mmol·m−3 的Sb(Ⅲ)完全氧化。土壤孵育实验表明,该菌株能够显著减少Sb从固相土壤到液相中的释放量达63.5%,对土壤颗粒表面的Sb(III)有氧化作用,并且能够促进Sb(V)以强吸附态的形式固定在土壤中;该菌株对Sb的氧化速率较快,并且可以显著降低土壤中Sb的流动性,对修复Sb矿区污染土壤具有潜在的应用价值。本研究结果可为了解微生物影响土壤中污染物的迁移转化机制提供参考。Abstract: The purpose of this study was to isolate a highly efficient antimonite oxidizing strain and explore the mechanism of this strain’s the migration and transformation of antimony in soil. The taxonomic status of strain was determined by the morphological, physiological and biochemical identification, and 16S rDNA sequence analysis. The strain was incubated with Sb-contaminated soil to explore its effect on Sb mobility. The result suggested that the strain belonged to genus Pseμdomonas, named Pseμdomonas sp. ZLX16. It could tolerate 2 mol·m−3 Sb(III) and 10 mol·m−3 Sb(V). The oxidation experiment results showed that strain oxidized almost 100 mmol·m−3 Sb(Ⅲ) to Sb(V) for 3 d. Soil incubation experiment suggested that strain ZLX16 decreased the Sb release from solid to liquid phase by 63.5%. Strain oxidized adsorbed Sb(III) on the surface of soil and promoted the fixation of Sb(V) in soil in the form of strongly adsorbed Sb. Strain ZLX16 had a high oxidation rate of Sb and could significantly inhibit Sb release from soil to water. The results of this study can provide a reference for understanding the migration and transformation mechanism of microorganisms affecting pollutants in soil.
-

-
表 1 土壤中金属元素的质量分数
Table 1. Mass fraction of metal elements in soil
mg·kg−1 Sb As Fe Mn Ca Mg Al 1 677 409 10 278 98 35 229 1 909 16 688 表 2 Sb土壤中Sb的顺序萃取
Table 2. Sequential extraction of antimony from soil
步骤 萃取剂及萃取条件 萃取形态 1 1×103 mol·m-3 MgCl2,pH=8,2 h,25 ℃ 离子结合态 2 1×103 mol·m-3 NaH2PO4,pH=5,24 h,25 ℃ 强吸附态 表 3 细菌的生理生化特征
Table 3. Physiological and biochemical characteristics of strain
生理生化指标 可利用性 生理生化指标 可利用性 葡萄糖 + 甘露醇 − 果糖 + 接触酶 + 木糖 + M.R. − 蔗糖 − V.P. − 麦芽糖 + 淀粉水解 + 阿拉伯糖 + 苯丙氨酸 − 山梨醇 − 马尿酸盐 − 注:表中“+”表示阳性或者能够利用;“−”表示阴性或者不能利用。 -
[1] 许瑞, 南小龙, 蒋国清, 等. 锑污染土壤微生物修复机制研究进展[J]. 矿产保护与利用, 2020, 40(4): 23-34. [2] LI J, WANG Q, OREMLAND R S, et al. Microbial Antimony Biogeochemistry: Enzymes, Regulation, and Related Metabolic Pathways[J]. Applied and Environmental Microbiology, 2016, 82(18): 5482-5495. doi: 10.1128/AEM.01375-16 [3] CHU J W, MAO J S, HE M C. Anthropogenic antimony flow analysis and evaluation in China[J]. Science of the Total Environment, 2019, 683: 659-667. doi: 10.1016/j.scitotenv.2019.05.293 [4] WU F, FU Z, LIU B, et al. Health risk associated with dietary co-exposure to high levels of antimony and arsenic in the world's largest antimony mine area[J]. Science of the Total Environment, 2011, 409(18): 3344-51. doi: 10.1016/j.scitotenv.2011.05.033 [5] YAN L, CHAN T, JING C. Mechanistic study for stibnite oxidative dissolution and sequestration on pyrite[J]. Environmental Pollution, 2020, 262: 114309. doi: 10.1016/j.envpol.2020.114309 [6] TERRY L R, KULP T R, WIATROWSKI H, et al. Microbiological oxidation of antimony(III) with oxygen or nitrate by bacteria isolated from contaminated mine sediments[J]. Applied and Environmental Microbiology, 2015, 81(24): 8478-8488. doi: 10.1128/AEM.01970-15 [7] WANG L Y, YE L, YU Y Q, et al. Antimony redox biotransformation in the subsurface: Effect of indigenous Sb(V) respiring microbiota[J]. Environmental Science and Technology, 2018, 52(3): 1200-1207. doi: 10.1021/acs.est.7b04624 [8] 程爱华, 郑蕾. 生物铁修复Cr(Ⅵ)污染土壤的性能及机理[J]. 环境工程学报, 2018, 12(10): 2892-2898. doi: 10.12030/j.cjee.201805032 [9] LI J, WANG Q, ZHANG S, et al. Phylogenetic and genome analyses of antimony-oxidizing bacteria isolated from antimony mined soil[J]. International Biodeterioration and Biodegradation, 2013, 76: 76-80. doi: 10.1016/j.ibiod.2012.06.009 [10] 徐一芃, 黄益宗, 张利田, 等. 镉砷污染土壤修复技术的文献计量分析[J]. 环境工程学报, 2020, 14(10): 2882-2894. doi: 10.12030/j.cjee.201910125 [11] MOON E M, PEACOCK C L. Adsorption of Cu(II) to ferrihydrite and ferrihydrite-bacteria composites: Importance of the carboxyl group for Cu mobility in natural environments[J]. Geochimica Et Cosmochimica Acta, 2012, 92: 203-219. doi: 10.1016/j.gca.2012.06.012 [12] YE L, MENG X G, JING C Y. Influence of sulfur on the mobility of arsenic and antimony during oxic-anoxic cycles: Differences and competition[J]. Geochimica Et Cosmochimica Acta, 2020, 288: 51-67. doi: 10.1016/j.gca.2020.08.007 [13] 生态环境部, 国家市场监督管理总局. 土壤环境质量建设用地土壤污染风险管控标准(试行) GB 36600-2018 [S]. 北京: 中国环境出版社, 2018. [14] SHI Z, CAO Z, QIN D, et al. Correlation models between environmental factors and bacterial resistance to antimony and copper[J]. PLoS One, 2013, 8(10). [15] 杜辉辉, 刘新, 陶洁, 等. 3种耐锑土壤细菌的筛选及对锑的吸附研究[J]. 环境科学学报, 2020, 40(6): 2205-2211. [16] KEON N E, SWARTZ C H, BRABANDER D J, et al. Validation of an arsenic sequential extraction method for evaluating mobility in sediments[J]. Environmental Science and Technology, 2001, 35(16): 3396. doi: 10.1021/es0111028 [17] 胡春辉, 徐青, 孙璇, 等. 几种典型扫描电镜生物样本制备[J]. 湖北农业科学, 2016, 55(20): 5389-5392. [18] LIU W, WANG H, DU J, et al. Raman microspectroscopy of nucleus and cytoplasm for human colon cancer diagnosis[J]. Biosens Bioelectron, 2017, 97: 70-74. doi: 10.1016/j.bios.2017.05.045 [19] VAN KHANH N, LEE J U. Antimony-Oxidizing Bacteria Isolated from Antimony-Contaminated Sediment - A Phylogenetic Study[J]. Geomicrobiology Journal, 2015, 32(1): 50-58. doi: 10.1080/01490451.2014.925009 [20] LEUZ A K, MONCH H, JOHNSON C A. Sorption of Sb(III) and Sb(V) to goethite: Influence on Sb(III) oxidation and mobilization[J]. Environmental Science and Technology, 2006, 40(23): 7277-7282. doi: 10.1021/es061284b [21] ZHANG L, YE L, YIN Z, et al. Mechanistic study of antimonate reduction by Escherichia coli W3110[J]. Environmental Pollution, 2021: 118258. [22] 张林, 卢金锁. Pantoea sp. IMH介导土壤中砷锑的形态转化[J]. 环境科学, 2017, 38(9): 3937-3943. [23] 杨宾, 罗会龙, 刘士清, 等. 淹水对土壤重金属浸出行为的影响及机制[J]. 环境工程学报, 2019, 13(4): 936-943. doi: 10.12030/j.cjee.201811056 [24] BELZILE N, CHEN Y W, WANG Z J. Oxidation of antimony (III) by amorphous iron and manganese oxyhydroxides[J]. Chemical Geology, 2001, 174(4): 379-387. doi: 10.1016/S0009-2541(00)00287-4 [25] SUN Q, LIU C, ALVES M E, et al. The oxidation and sorption mechanism of Sb on delta-MnO2[J]. Chemical Engineering Journal, 2018, 342: 429-437. doi: 10.1016/j.cej.2018.02.091 [26] 徐伟, 刘锐平, 曲久辉, 等. 铁锰复合氧化物吸附去除五价锑性能研究[J]. 环境科学学报, 2012, 32(2): 270-275. [27] DU H H, QU C C, LIU J, et al. Molecular investigation on the binding of Cd(II) by the binary mixtures of montmorillonite with two bacterial species[J]. Environmental Pollution, 2017, 229: 871-878. doi: 10.1016/j.envpol.2017.07.052 [28] TARASSOV M, MIHAILOVA B, TARASSOVA E, et al. Chemical composition and vibrational spectra of tungsten-bearing goethite and hematite from Western Rhodopes, Bulgaria[J]. European Journal of Mineralogy, 2002, 14(5): 977-986. doi: 10.1127/0935-1221/2002/0014-0977 [29] NIEUWOUDT M K, COMINS J D, CUKROWSKI I. The growth of the passive film on iron in 0.05 M NaOH studied in situ by Raman micro-spectroscopy and electrochemical polarisation. Part I: near-resonance enhancement of the Raman spectra of iron oxide and oxyhydroxide compounds[J]. Journal of Raman Spectroscopy, 2011, 42(6): 1335-1339. doi: 10.1002/jrs.2837 [30] YANG X H, YAN B, LIU Y, et al. Gamma-FeOOH based hierarchically porous zeolite monoliths for As(V) removal: Characterisation, adsorption and response surface methodology[J]. Microporous and Mesoporous Materials, 2020: 308. [31] FARIA M C S, ROSEMBERG R S, BOMFETI C A, et al. Arsenic removal from contaminated water by ultrafine delta-FeOOH adsorbents[J]. Chemical Engineering Journal, 2014, 237: 47-54. doi: 10.1016/j.cej.2013.10.006 -




 下载:
下载: