-
随着水产养殖业在全球范围内的快速发展,水产养殖尾水的产生量也日益增多[1]。由于水产饲料的高氮特征,导致养殖尾水呈高氮低碳的特点[2]。近年来,为改善水环境质量和促进水产养殖业的绿色发展,各地相继出台了严格的水产养殖尾水地方排放标准,倒逼养殖尾水的有效处理。现阶段,常用的养殖尾水处理技术包括人工湿地、生态沟渠、生态浮床和生物滤池等,尽管也取得了良好的处理效果,但均存在着占地面积大、处理效果不稳定等技术问题[3-4]。因此,寻求稳定、高效的养殖尾水处理技术迫在眉睫。
生物滞留系统(bioretention system,BS)是最佳的雨水管理设施之一,因其成本低且效果好,被广泛应用于城市雨水径流污染的治理[5]。目前,有关BS的应用研究主要集中于降雨径流处理,将其跨行业应用于养殖尾水的处理还鲜有尝试。由于降雨径流和养殖尾水在水质特点和排放规律方面具有一定的匹配性,如,两者水质均呈现出高氮低碳和水量为间歇排放的特点,这使得将BS技术应用于养殖尾水处理具备了可能性。BS的脱氮性能与其填料的组成和构造形式密切相关[6-9]。如正置的BS技术主要以强致密性的介质土层置于上层,而将较好透气性的砂质过滤层及碎石排水层置于底层,通过介质的过滤、吸附、微生物作用和植物吸收达到污染物去除的效果,但仍然存在脱氮效率不稳定等问题[9]。LI等[8]为解决上述问题,设计的倒置BS构造则是与正置相反,径流被上层砾石层存储并缓慢排出,滞留的水分阻碍了氧气的扩散,使得下层介质土层创造了更好的缺氧区,NO3−-N去除高于正置的28.6%~53.9%。近年来,国内外对于正置和倒置BS的脱氮效能已有研究,但用于养殖尾水处理的效能尚未可知,且缺乏足够的证据阐述其背后的作用机理。
胞外聚合物(extracellular polymeric substances,EPS)是以蛋白质为主要功能成分的微生物分泌物,其产生可视为微生物个体的粘合剂,是形成生物膜的核心[10]。EPS包含的氧化还原介质对BS的脱氮性能至关重要,如C型细胞色素和腐殖质等[11]。有研究表明,EPS储存的氧化还原介质在电子传输过程中可有效充当电子供体和电子受体(NO3−)之间的传递桥梁,这决定了电子穿梭的效率,最终影响反硝化脱氮性能[12]。此外,EPS浓度也是影响微生物反硝化的重要因素,如WANG等[13]研究发现EPS的额外添加提高了系统1.66倍的电子传递活性(ETSA),从而提高了19%~34%的反硝化效率。基于此,解析EPS和电子传递活性对于探究BS的脱氮机制意义重大。
为此,本研究设计并构建了正置和倒置2组生物滞留系统,在不同进水条件下探究了其处理水产养殖尾水的运行规律,并通过EPS及电子传递活性分析揭示了BS的构建方式对脱氮效能的影响,旨在为应用生物滞留技术处理养殖尾水提供参考。
-
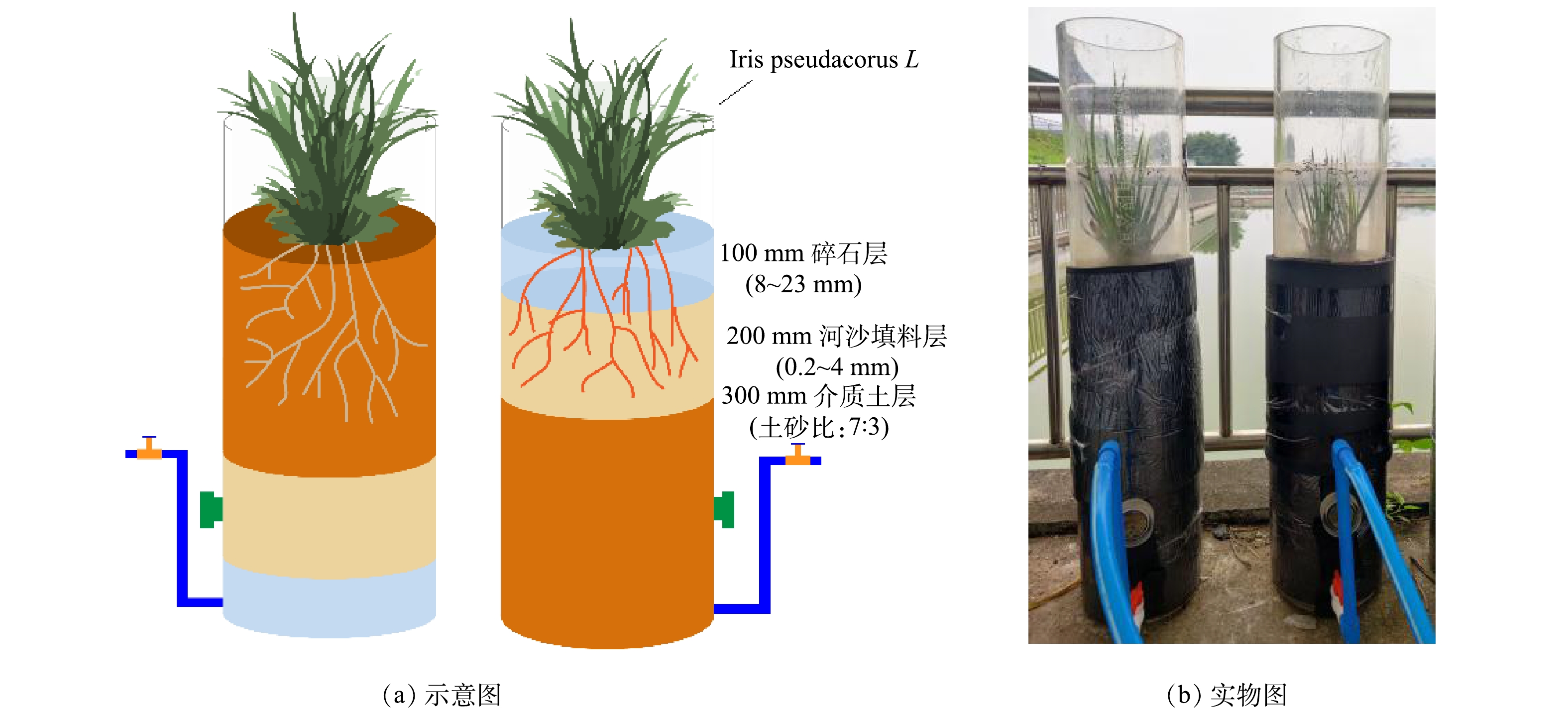
如图1所示,以直径为20 cm的圆形有机玻璃柱构建了CBS和IBS 2组生物滞留系统,CBS自上而下分为20 cm蓄水层、30 cm介质土层、20 cm填料层(0.2~4 mm河沙)和10 cm排水层(8~23 mm碎石),IBS则相反。每个系统的底部设置有内径为20 mm的穿孔管,通过将排水口抬高至底部排水层上方30 cm,形成了一个饱和区域,以增强反硝化的作用。参考WU等[14]的研究,选用根长和根密具有一定优势的黄菖蒲(Iris pseudacorus L)作为供试植物,种植前经过电子秤恒重,以确保2个系统间的生物量误差不超过1 g。土壤取自西南大学蠡园内种植土,摊开晒干后与河沙按7:3的体积比反复混合至均匀后装填。
-
为尽可能接近养殖水的水质特点,本实验采用研磨鱼粪的方法模拟养殖尾水。即,将取来的鱼粪晒干研磨,过100目筛得到鱼粪粉末。根据前期对重庆市水产养殖尾水的走访调研和LIU等[15-16]的研究,论文采取模拟3种污染物负荷浓度梯度进水的方式,以代表池塘养殖和循环养殖尾水(见表1),同时检验CBS和IBS在面临不同污染物浓度冲击下的运行效能。每个浓度梯度进行3次实验,进水方式采用洒水器进水并确保养殖水均匀喷洒至填料表层,每次进水5 L使其自然下渗,实验间隔周期为1 d。
-
为确保实验的准确性,使用等边三角形法对介质土表层以下15 cm和45 cm处取样,其中15 cm处使用20 mm的空心管进行取样,45 cm处设置有取样口(见图1),等体积混匀后采用阳离子交换树脂法进行胞外聚合物(EPS)的提取[17]。提取步骤如下:配置1.109 g·L−1 的CaCl2溶液(Ca(OH)2调节pH=7),使用该溶液与土样混匀后在4 ℃下摇晃30 min,5 100 r·min−1离心后倒掉上清液以剔除易溶性有机物。使用阳离子交换树脂和Na3PO4·12H2O (0.760 g·L−1)、NaH2PO4·H2O (0.552 g·L−1)、NaCl (0.526 g·L−1)和KCl (0.074 g·L−1)的冷冻萃取液进行沉积物的EPS提取,重悬后于4 ℃下摇晃2 h,5 850 r·min−1离心即得到含EPS的上清液。
PS采用硫酸苯酚法进行测定;PN使用BCA试剂盒法进行测定,即以牛血清蛋白作为标准溶液,在562 nm处检测吸光值,与标准曲线对比后计算出其浓度。
-
使用荧光分光光度计(F-7000FL,日本日立)的三维荧光光谱检测,对2种构建方式下的EPS主要成分进行比较分析。将上述EPS提取液过0.45 um滤膜后,以蒸馏水为空白在EEM扫描的激发波长(Ex)和发射波长(Em)均为200~550 nm、步长为5 nm、扫描速度为12000 nm·min−1的条件下进行检测。
-
ETSA的测定是基于将2-(对碘苯基)-3-(对硝基苯)-5-苯基四唑氯(INT)还原为甲瓒(INF)的原理,测定方法参考ZHENG等[18]和WAN等[19]的研究结果。取上述土样10 g,用4 mL PBS(100 mM, pH 7.4)洗涤2次后重悬于PBS溶液中,即得到悬浮样品。接下来将1 mg 的NADH和1 mL INT加入5 mL上述提取液中,在黑暗和30 ℃的条件下培育30 min。培育完成后加入1 mL甲醛终止反应,10 000 r·min−1 离心5 min后到掉上清液,加入5 mL甲醇提取甲瓒。最后在波长为490 nm处检测甲瓒的形成,ETSA由式(1)计算得到。
式中:E为ETSA,ug·(g·min)−1;A为波长在490 nm处的吸光度;15.9为INT-INF的比吸收率;V0和 V1分别为待测样初始体积和甲醇的体积,mL;t为培育时间,min;32/2为INT-INF转化为O2的系数;m为蛋白质的质量浓度,mg·mL−1。
-
NH4+-N和NO3−-N的检测先经过0.45 um滤膜抽滤,再分别使用纳氏试剂法和分光光度法进行检测,TN和TP分别使用碱性过硫酸钾消解紫外分光光度和钼酸铵分光光度法进行检测。后期数据处理和作图分别使用Excel2016和Origin2018完成,使用SPSS进行显著性分析。
-
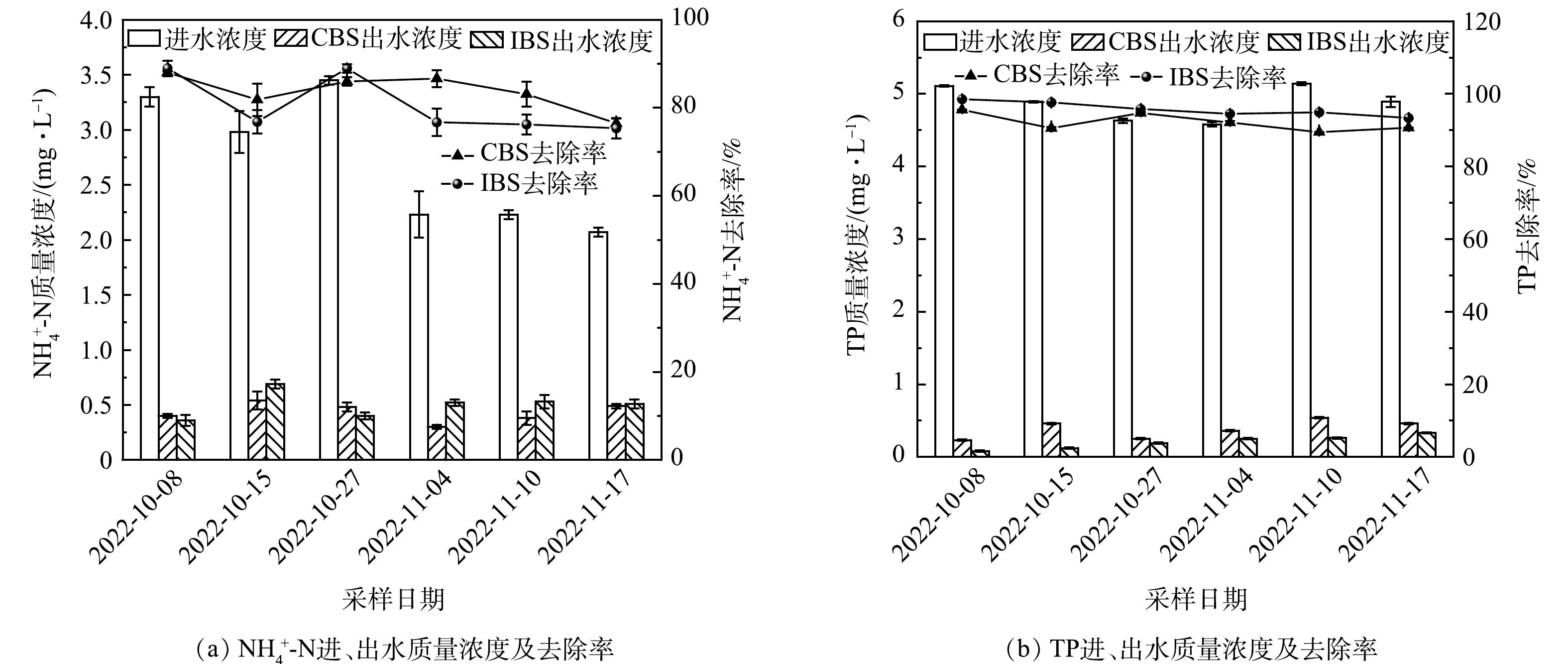
1) TN和NO3−-N的去除效果分析。由图2(a)~(b)可知,TN和NO3−-N的去除规律一致,在TN和NO3−-N的进水质量浓度分别为18.99~20.90 mg·L−1和10.58~14.40 mg·L−1的情况下,CBS的平均出水质量浓度分别为(6.60±1.87) mg·L−1、(5.08±1.91) mg·L−1,IBS则分别为(4.45±0.74) mg·L−1、(3.03±0.54) mg·L−1,IBS的TN和NO3−-N平均去除率高出CBS的10.65%、15.89%。养殖尾水中的TN主要包括NO3−-N、NH4+-N和总有机氮(TON),其去除包括NH4+-N的吸附和硝化、TON的沉降和矿化、NO3−-N的反硝化等,由于NH4+-N和TON的转化并不能有效脱氮,因此TN的去除主要依赖于微生物的反硝化。反硝化效率低或不稳定一直以来都是BS技术的一大难题,原因在于其条件的难以建立[20]。反硝化的发生依赖于电子的供给和缺氧条件的建立,电子通常是由微生物将碳源降解供给,而缺氧条件却难以建立。在过去,许多学者通过增加淹没区深度来提高NO3−-N的去除效率,因为淹没区的增加可以更好的创造厌氧条件,但这无疑增加了实际工程中的应用成本[21-22]。相对于CBS,IBS在不增加淹没区深度的情况下,NO3−-N出水质量浓度更低且稳定,这得益于倒置生物滞留系统将致密性较差的介质土层置于底层,创造了更好的缺氧空间,有利于反硝化的发生。
2) NH4+-N的去除效果分析。如图3(a)所示,在NH4+-N的进水质量浓度为2.07~3.45 mg·L−1的条件下,CBS和IBS的平均出水质量浓度分别为(0.43±0.09) mg·L−1和(0.50±0.11) mg·L−1,平均去除率为(83.66±4.22)%、(80.42±6.18)%。IBS的NH4+-N平均去除率略低于CBS,但并不具备显著性(P>0.05)。LI等[8]构建的倒置BS的NH4+-N去除率略低于正置的4.4%。本研究结果与其相似。排入系统的NH4+-N很容易经过介质土层的物理吸附、离子交换和硝化作用得以去除,因此,传统的生物滞留系统对氨氮有着较强的去除效果。如仇付国等[23]在利用传统BS技术处理城市降雨径流的研究中,NH4+-N的去除率在95%以上。然而,本研究与传统的BS相比,NH4+-N去除率明显降低。由于水产养殖动物对于饲料的不完全吸收和利用是养殖水体氮污染的主要来源,正如刘兴国[24]在氮收支平衡中指出,饲料中仅有20%~25%的有机氮被鱼类利用,其余均以粪便及代谢物排入水体。因此,养殖水体中存在大量固态和可溶态有机氮,被截留于系统的有机氮经微生物的氨化作用转化导致NH4+-N产生增加,从而导致NH4+-N去除受限。此外,实验干期较短也导致产生的NH4+-N未来得及经过硝化细菌转化,因此与传统生物滞留系统相比去除效果较低。
3)TP的去除效果分析。由图3(b)可知,尽管TP的进水质量浓度高达4.58~5.14 mg·L−1,但CBS和IBS的TP出水质量浓度均保持在较低且稳定的水平,平均出水质量浓度分别为(0.38±0.12) mg·L−1和(0.21±0.09) mg·L−1,平均去除率为(92.15±2.32)%和(95.77±1.85)%。有研究表明,BS技术已经可以实现有效的除磷,且磷去除率均在90%以上[23,25]。与降雨径流不同,由于养殖尾水中含有大量未被利用的饲料残留物和粪便,因此,TP中的颗粒性磷(PP)可能占据主要成分,而PP很容易被BS的填料经过过滤和吸附实现去除。IBS对于TP的去除仅高于CBS的3.62%,并无明显优势(P>0.05),这进一步说明BS对于TP的去除主要是靠介质驱动。CBS和IBS仅是构建方式的不同,其填料组成完全一致,因此,两者均能对TP实现有效的去除。
-
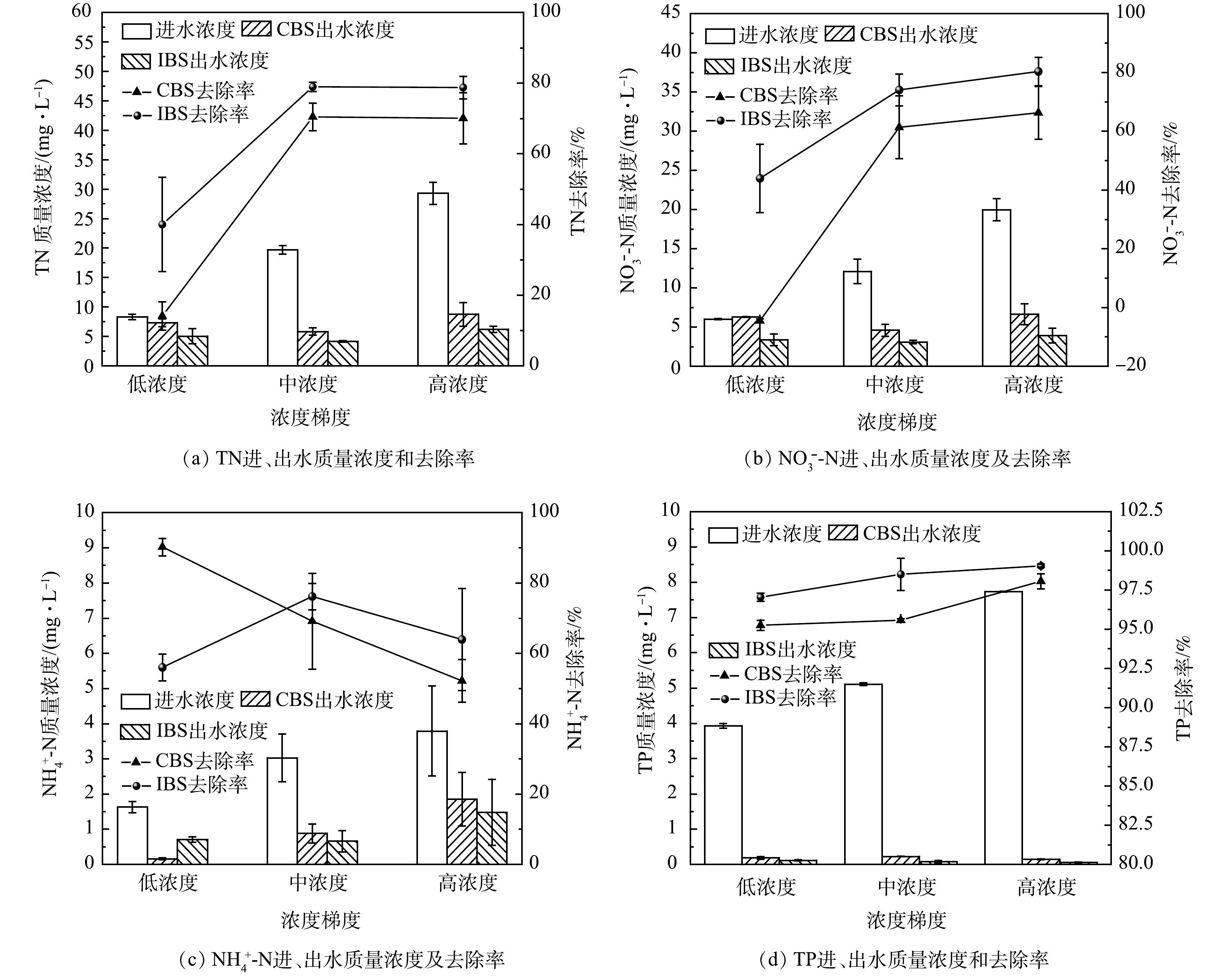
在低、中和高3种进水质量浓度条件下,分析了CBS和IBS对TN与NO3−-N的去除效果,以检验BS应对不同类型养殖尾水的抗冲击能力,结果如图4(a)~(b)所示。可见,TN与NO3−-N的去除规律一致,随着低质量浓度增加至中质量浓度时,其去除率均呈上升趋势,CBS和IBS的TN去除率分别由(14.06±4.03)%、(40.00±13.31)%增加至(70.46±3.90)%、(78.95±1.29)%,NO3−-N则是由(−4.54±0.63)%、(43.93±11.68)%提高至(61.31±10.70)%、(74.05±5.39)%。ZHANG等[26]以煤矸石为改性填料探究了不同降雨径流浓度下的运行规律,随着进水TN浓度的提高,去除率由41.9%提高到了56.1%,研究结果与其相似。相关研究也表明,在该氮质量浓度范围内可能有利于刺激微生物的快速生长,进而促进了TN的去除[27]。当进水负荷由中浓度至高浓度时,TN和NO3−-N去除率无明显变化趋势,说明即便在中浓度和高浓度负荷的冲击下,CBS和IBS的运行效能均无显著影响。而IBS对TN和NO3−-N的去除率均高于CBS,其原因在于倒置生物滞留系统将致密性较强的介质土置于底层,有利于维持缺氧条件,促进了微生物的反硝化。
由图4(c)~(d)可知,随着进水浓度的增加,CBS的NH4+-N去除率由(90.23±2.47)%逐渐降低至(52.18±6.10)%,IBS则是呈现出先略上升后降低的趋势。而对于TP的去除,CBS和IBS均较稳定,去除率分别为95.25%~98.06%、97.04%~99.22%。养殖尾水中存在大量未被利用的饲料和粪便残留物,导致了水体中的TON含量较高。随着进水浓度的升高,排入系统的TON逐渐增加,经矿化作用后NH4+-N有所增加,迫使CBS的去除率逐渐降低。与CBS的构建方式不同,IBS上层的碎石河沙填料空隙较大,因此,有着较强的复氧能力,亚硝化菌和硝化菌在此环境下能够快速繁殖,促进了NH4+-N的去除,这是IBS有着更稳定的NH4+-N去除的原因。对于TP的去除,其去除机制与氮素不尽相同,TP的去除以介质的吸附为主导。CBS和IBS系统构建形式不同,但装填填料一致,因此,除磷效果差距不大,并且在不同进水质量浓度下的去除率也无显著改变。
-
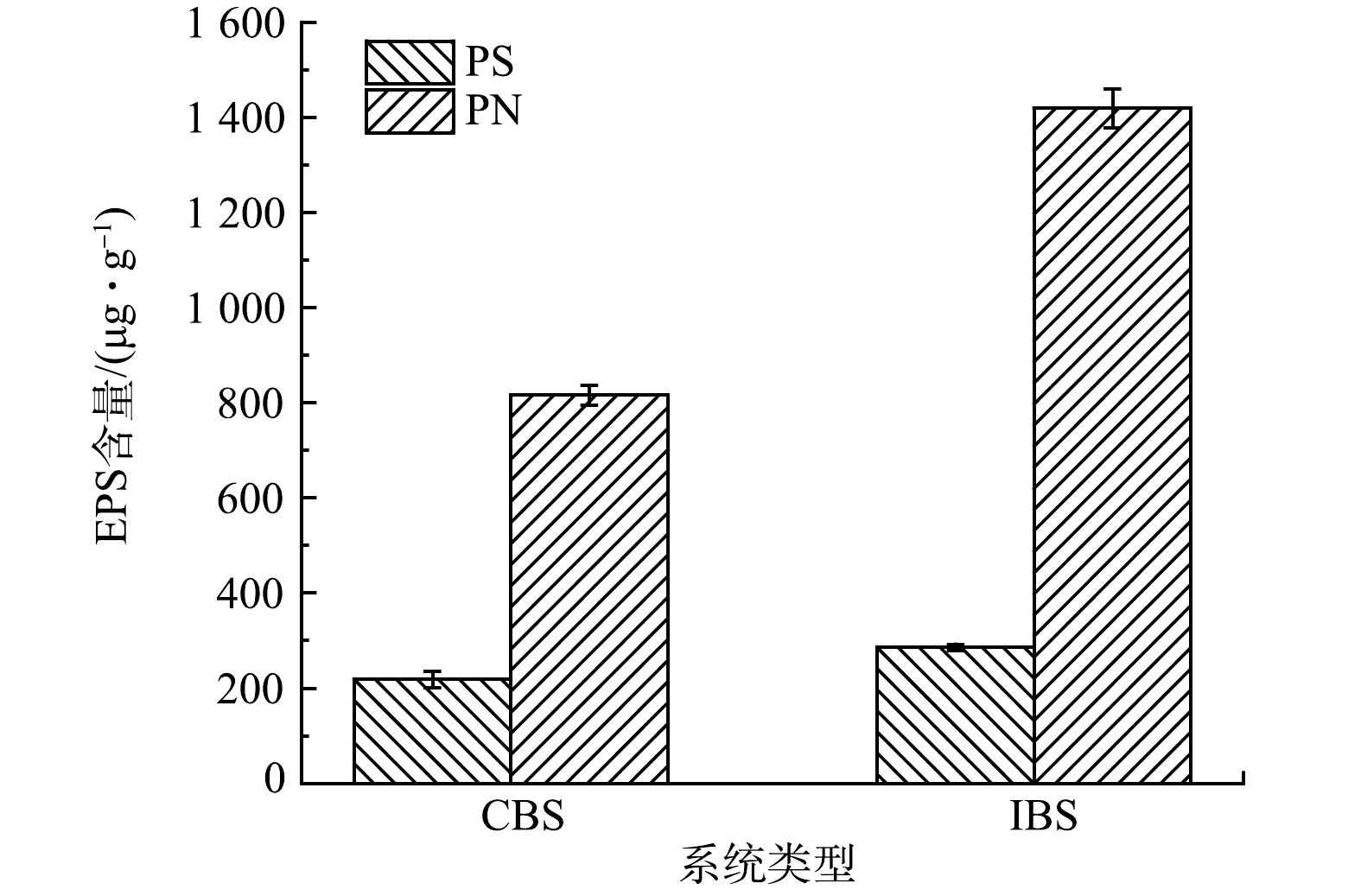
生物滞留系统的EPS含量如图5所示,IBS的EPS含量显著高于CBS(P<0.05),其中CBS和IBS的PS分别为(218.53±16.97) ug·g−1和(285.42±6.84) ug·g−1,PN为(815.95±20.97) ug·g−1、(1419.19±40.75) ug·g−1。2种系统提取的EPS高于REDMILE-GORDON[17]提取的耕地和草原土壤的3~8倍,说明在长期的养殖尾水驯化下,土壤微生物通过分泌更多的EPS来应对环境的变化。有研究表明,微生物分泌的EPS与脱氮性能密切相关[13,28]。而IBS的EPS含量显著高于CBS,这可能是IBS脱氮效果优于CBS的原因。一方面,IBS将致密性较强的介质土层置于底层创造了更好的缺氧环境,在该环境下促进了反硝化细菌的快速繁殖并分泌大量EPS来抵御氮素的冲击。另一方面,IBS较高的EPS含量提高了氮素的转化能力,这归结于EPS所储存的氧化还原活性介质[29]。因为EPS包含的氧化还原介质可以直接作为微生物电子传递的媒介[12]。HU等[30]的研究报告中也指出,EPS的增加提高了系统氧化还原活性介质的含量,最终降低了电子传递的阻力。而在反硝化过程中,由于NO3−作为电子接收体,因此,电子穿梭能力对硝酸盐的转化至关重要。
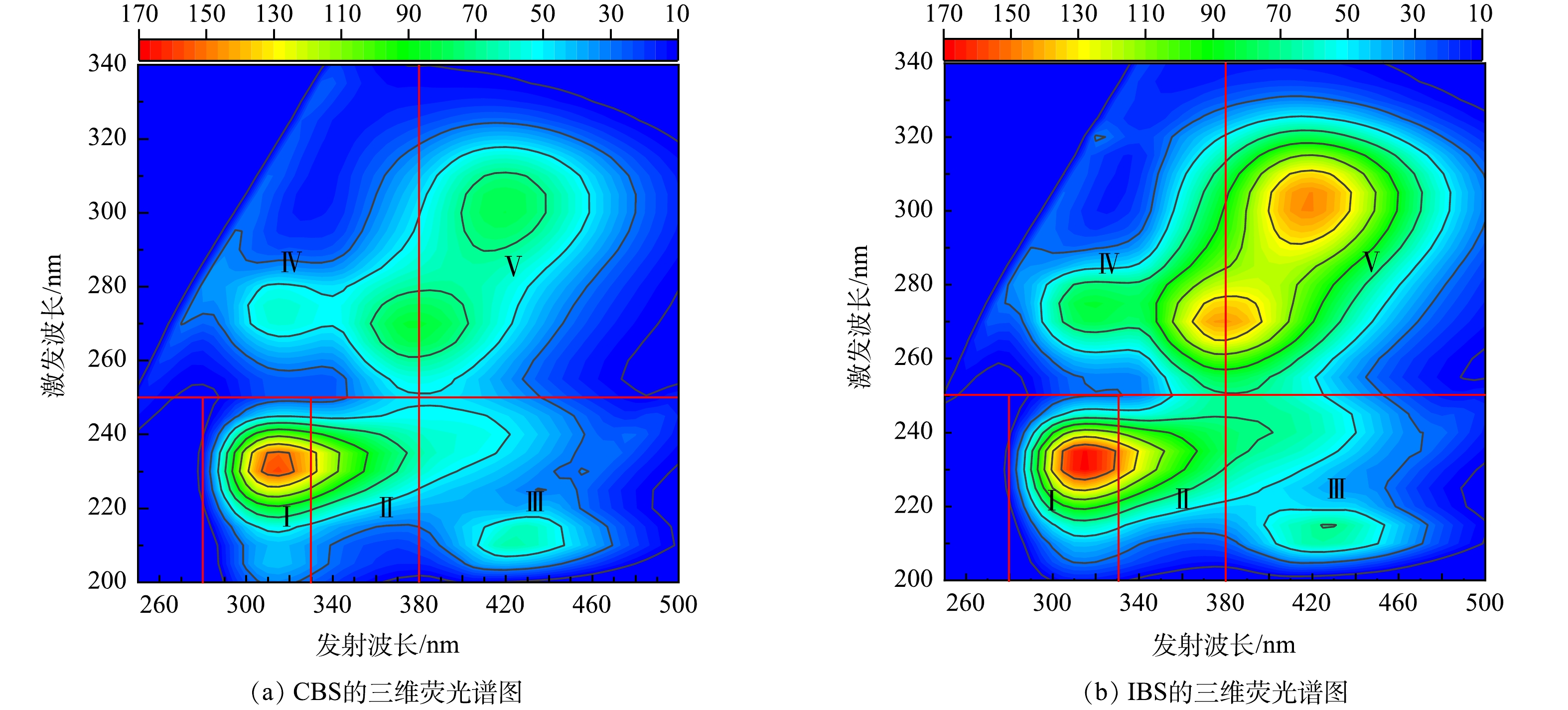
对已处理的EPS稀释10倍后进行三维荧光光谱扫描,结果如图6所示。参考SUN等[31]的研究结果将荧光分为5个区域,分别代表5种不同的有机物成分。由图6的荧光光谱位置可知,2种构建方式下BS的EPS物质组成大致相同,但荧光强度有明显的区别。相对于其他区域,代表酪氨酸和色氨酸的区域Ⅰ和区域Ⅱ荧光强度最强,且峰值更明显。区域Ⅰ和Ⅱ均为芳香类蛋白质,这表明EPS中蛋白质是最主要的物质成分。有研究表明,微生物在应对环境变化做出自我调控的机制中,PN发挥着十分重要的作用[32]。尤其是微生物在面临氮素的冲击下,其分泌的PN可作为保护蛋白并提高自身的聚集活性[28]。而在氮循环过程中,PN甚至可作为信号分子调控所要酶的产生、运输和利用[13]。
区域Ⅲ所代表的为类富里酸,其荧光强度在两系统中接近,与其他区域相比较为暗淡。类富里酸是是天然水中常见的荧光成分和典型的陆地有机物,可从区域V的类腐殖质中分离出来。当前已有研究表明类腐殖质中有许多氧化还原性官能团,可介导电子穿梭或直接作为微生物厌氧呼吸中的电子受体参与电子转移[11,33]。区域Ⅳ为微生物代谢产物,IBS的荧光强度高于对照组。微生物代谢产物由内源性产生,这表明该系统的微生物活性较强,因此在应对环境变化时也能表现出更加灵敏的自我调控能力,这可能是IBS脱氮性能强于对照的原因。
-
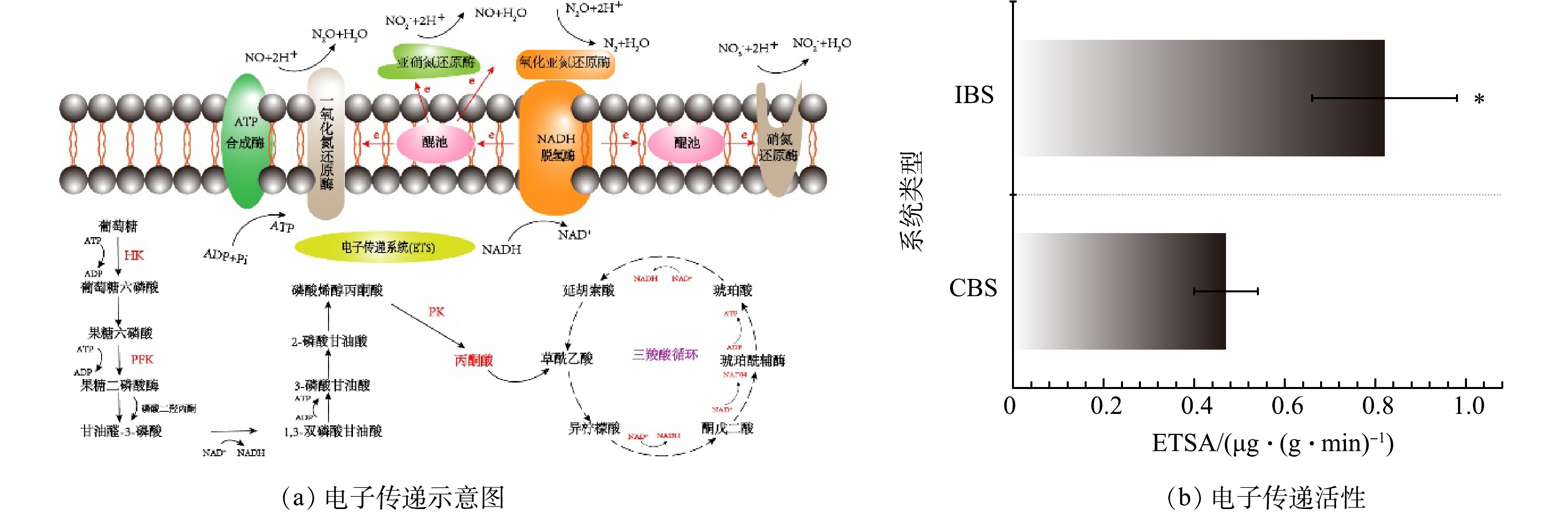
对BS的电子传递活性(ETSA)进行的分析结果如图7(b)所示。IBS的ETSA显著高于CBS,其中IBS和CBS的ETSA分别为(0.47±0.07) ug·(g·min)−1、(0.82±0.16) ug·(g·min)−1。反硝化发生的条件需要具备缺氧环境和电子的供应,其中电子由微生物的碳源代谢产生。如图7(a)所示,碳源在相关酶的逐步降解过程中产生NADH,生成的NADH被电子传递系统(ETS)转移,在NADH脱氢酶的催化作用下产生电子,最后电子被醌池传递给反硝化酶所利用。
综上所述,ETSA决定了反硝化过程中的电子传递效率,这将直接影响NO3−-N的去除。由实验结果可知,2种BS的构建方式是影响ETSA的主要原因,而ETSA将对系统的脱氮效能产生影响。IBS将介质土层置于底层,反硝化菌在此环境下快速繁殖并产生比CBS更多的EPS。EPS中芳香类蛋白质和腐殖质含有的电化学活性生物分子已被证实可介导电子穿梭[11],因此,IBS中较高含量的EPS可提高电子传递活性,这可能也是IBS脱氮效果优于CBS的原因。此外,在电子传递链中EPS还可释放碳源和提高相关酶的活性来增强硝酸盐的去除[13,34]。LIU等[35]的研究表明,当EPS发生部分解吸时会释放碳源并增强反硝化相关酶的活性,以此可提高13.6%的硝酸盐去除率。由此可知,ETSA与BS的脱氮性能密切相关,而ETSA主要由EPS中的电化学活性生物分子介导,提高ETSA是增强反硝化脱氮的有效途径。
-
1) IBS和CBS可在不同程度上实现水产养殖尾水的脱氮除磷效果。在运行周期间隔为1 d的情况下,IBS的TN和NO3−-N去除率可分别达到71.79%~82.00%和68.70%~85.84%,平均去除率分别高出对照组的10.65%和15.89%。
2) IBS的构建方式抗冲击能力较强。TN和NO3−-N去除率随进水负荷的增加呈现先升高后稳定的趋势,而IBS比CBS的抗冲击性更强;2种构建方式对TP的去除率则无显著差异,去除率均可稳定在97.04%~99.22%。
3)构建方式对EPS的组分无明显影响,但对EPS含量和ETSA影响显著。IBS的构建方式可通过促进微生物分泌更多的EPS来提高自身的调控能力,其中PS和PN分别高于CBS的66.89 ug·g−1、603.24 ug·g−1;EPS的主成分相同,但IBS的酪氨酸、色氨酸和微生物代谢产物含量明显高于对照组;此外,IBS的高PN含量可提高电子传递的活性,以此提升该系统的脱氮效能。
生物滞留系统处理水产养殖尾水的效能和机制
Efficiency and mechanism of bioretention systems for aquaculture wastewater treatment
-
摘要: 为探究生物滞留系统(bioretention system,BS)对水产养殖尾水的处理效能,设计并构建倒置(inverted bioretention system,IBS)和正置(control bioretention system,CBS)2组生物滞留系统,在不同进水条件下比较了2种BS构建方式的运行效能,通过胞外聚合物(EPS)、三维荧光光谱和电子传递活性(ETSA)等方法阐述了不同构建方式下BS的脱氮机制。结果表明:在不同进水条件下IBS的处理效能优于CBS,当运行间隔周期为1 d时,IBS的TN和NO3−-N去除率分别达到71.79%~82.00%和68.70%~85.84%,平均去除率比CBS分别高出10.65%和15.89%。CBS和IBS的TN和NO3−-N去除率随进水负荷的增加呈先升高后稳定的趋势,TP波动最小,去除率均稳定在97.04%~99.22%。构建方式对EPS的组分无明显影响,但对EPS含量和ETSA影响显著。IBS的构建方式可促进微生物分泌更多的EPS,其中EPS的多糖(PS)和蛋白质(PN)含量分别比CBS高出66.89 ug·g−1和603.24 ug·g−1,并且IBS的酪氨酸、色氨酸和微生物代谢产物明显高于CBS;此外,与CBS的ETSA为(0.47±0.07) ug·(g·min)−1,相比IBS提高了0.35 ug·(g·min)−1。以上研究结果为应用生物滞留系统技术处理养殖尾水提供参考。Abstract: In order to explore the treatment efficiency of aquaculture wastewater by bioretention system(BS), two groups of the inverted bioretention system(IBS) and control bioretention system(CBS) were designed and constructed, and their efficiency was compared under different influent conditions. The denitrification mechanism of BS under different construction methods was analyzed through extracellular polymer(EPS), three-dimensional fluorescence spectroscopy and electron transport activity(ETSA). The results showed that the treatment efficiency of IBS was better than that of CBS under different influent conditions. When running interval period was 1d, the TN and NO3-N removal rates of IBS reached 71.79%~82.00% and 68.70%~85.84%, respectively, and the average removal rates were 10.65% and 15.89% higher than those of CBS, respectively. The TN and NO3-N removal rates of CBS and IBS increased first and then stabilized with the increase of influent load, while TP fluctuated slightly, and the removal rate was stable at 97.04%~99.22%. The construction method had no significant effect on the composition of EPS, but had a significant effect on EPS content and ETSA. The construction of IBS could promote more EPS secretion by the microbial, of which the polysaccharide(PS) and protein(PN) contents in EPS were 66.89 ug·g−1 and 603.24 ug·g−1 higher than CBS, respectively, and the tyrosine, tryptophan and microbial metabolites of IBS were significantly higher than CBS. In addition, IBS improved by 0.35 ug·(g·min)−1 compared to CBS's ETSA of (0.47±0.07) ug·(g·min)−1. The results provide a theoretical reference for the application of bioretention system technology to treat aquaculture wastewater.
-

-
表 1 进水质量浓度
Table 1. Influent mass concentration
mg·L−1 类型 TN NO3−-N NH4+-N NO2−-N COD TP 池塘水(低) 7.72~8.78 5.99~6.11 1.37~1.74 0.12~0.33 92~99 1.93~2.35 循环水(中) 19.10~20.48 10.48~13.55 2.54~3.80 0.28~0.43 204~236 2.62~5.13 循环水(高) 27.13~30.15 18.65~21.46 2.32~4.67 0.34~0.9 248~308 6.03~7.8 -
[1] ZHIMIAO Z, XIAO Z, ZHUFANG W, et al. Enhancing the pollutant removal performance and biological mechanisms by adding ferrous ions into aquaculture wastewater in constructed wetland[J]. BioresourceTechnology, 2019, 293: 122003. doi: 10.1016/j.biortech.2019.122003 [2] CAO L, WANG W, YANG Y, et al. Environmental impact of aquaculture and countermeasures to aquaculture pollution in China[J]. Environmental Science and Pollution Research-International, 2007, 14: 452-462. doi: 10.1065/espr2007.05.426 [3] LIU X G, SHAO Z, CHENG G, et al. Ecological engineering in pond aquaculture: A review from the whole‐process perspective in China[J]. Reviews in Aquaculture, 2021, 13(2): 1060-1076. doi: 10.1111/raq.12512 [4] LIU J, WU Y, WU C, et al. Advanced nutrient removal from surface water by a consortium of attached microalgae and bacteria: a review[J]. Bioresource Technology, 2017, 241: 1127-1137. doi: 10.1016/j.biortech.2017.06.054 [5] WANG H W, ZHAI Y J, WEI Y Y, et al. Evaluation of the effects of low-impact development practices under different rainy types: case of Fuxing Island Park, Shanghai, China[J]. Environmental Science and Pollution Research, 2019, 26: 6706-6716. doi: 10.1007/s11356-019-04129-x [6] CHEN Y, SHAO Z, KONG Z, et al. Study of pyrite based autotrophic denitrification system for low-carbon source stormwater treatment[J]. Journal of Water Process Engineering, 2020, 37: 101414. doi: 10.1016/j.jwpe.2020.101414 [7] ZHANG W, SANG M, CHE W, et al. Nutrient removal from urban stormwater runoff by an up-flow and mixed-flow bioretention system[J]. Environmental Science and Pollution Research, 2019, 26: 17731-17739. doi: 10.1007/s11356-019-05091-4 [8] LI Y, ZHANG Y, YU H, et al. Enhancing nitrate removal from urban stormwater in an inverted bioretention system[J]. Ecological Engineering, 2021, 170: 106315. doi: 10.1016/j.ecoleng.2021.106315 [9] ALI W, TAKAIJUDIN H, YUSOF K W, et al. The common approaches of nitrogen removal in bioretention system[J]. Sustainability, 2021, 13(5): 2575. doi: 10.3390/su13052575 [10] BOLEIJ M, PABST M, NEU T R, et al. Identification of glycoproteins isolated from extracellular polymeric substances of full-scale anammox granular sludge[J]. Environmental Science & Technology, 2018, 52(22): 13127-13135. [11] XU J, LI C, SHEN Y, et al. Anaerobic ammonium oxidation (anammox) promoted by pyrogenic biochar: Deciphering the interaction with extracellular polymeric substances (EPS)[J]. Science of the Total Environment, 2022, 802: 149884. doi: 10.1016/j.scitotenv.2021.149884 [12] XIAO Y, ZHANG E, ZHANG J, et al. Extracellular polymeric substances are transient media for microbial extracellular electron transfer[J]. Science Advances, 2017, 3(7): e1700623. doi: 10.1126/sciadv.1700623 [13] WANG X, CHENT, GAO C, et al. Effect of extracellular polymeric substances removal and re-addition on the denitrification performance of activated sludge: carbon source metabolism, electron transfer and enzyme activity[J]. Journal of Environmental Chemical Engineering, 2022, 10(3): 108069. doi: 10.1016/j.jece.2022.108069 [14] WU J, CAO X, ZHAO J, et al. Performance of biofilter with a saturated zone for urban stormwater runoff pollution control: Influence of vegetation type and saturation time[J]. Ecological Engineering, 2017, 105: 355-361. doi: 10.1016/j.ecoleng.2017.05.016 [15] LIU W, KE H, XIE J, et al. Characterizing the water quality and microbial communities in different zones of a recirculating aquaculture system using biofloc biofilters[J]. Aquaculture, 2020, 529: 735624. doi: 10.1016/j.aquaculture.2020.735624 [16] LIU W, LUO G, TAN H, et al. Effects of sludge retention time on water quality and bioflocs yield, nutritional composition, apparent digestibility coefficients treating recirculating aquaculture system effluent in sequencing batch reactor[J]. Aquacultural Engineering, 2016, 72: 58-64. [17] REDMILE-GORDON M A, BROOKES P C, EVERSHED R P, et al. Measuring the soil-microbial interface: Extraction of extracellular polymeric substances (EPS) from soil biofilms[J]. Soil Biology and Biochemistry, 2014, 72: 163-171. doi: 10.1016/j.soilbio.2014.01.025 [18] ZHENG F, FANG J, GUO F, et al. Biochar based constructed wetland for secondary effluent treatment: Waste resource utilization[J]. Chemical Engineering Journal, 2022, 432: 134377. doi: 10.1016/j.cej.2021.134377 [19] WAN R, CHEN Y, ZHENG X, et al. Effect of CO2 on microbial denitrification via inhibiting electron transport and consumption[J]. Environmental Science & Technology, 2016, 50(18): 9915-9922. [20] PETERSON I J, IGIELSKI S, DAVIS A P. Enhanced denitrification in bioretention using woodchips as an organic carbon source[J]. Journal of Sustainable Water in the Built Environment, 2015, 1(4): 04015004. doi: 10.1061/JSWBAY.0000800 [21] XIONG J, ZHUO J, LI J, et al. Removal of nitrogen from rainwater runoff by bioretention cells filled with modified collapsible loess[J]. Ecological Engineering, 2020, 158: 106065. doi: 10.1016/j.ecoleng.2020.106065 [22] QIU F, ZHAO S, ZHAO D, et al. Enhanced nutrient removal in bioretention systems modified with water treatment residuals and internal water storage zone[J]. Environmental Science:Water Research & Technology, 2019, 5(5): 993-1003. [23] 仇付国, 代一帆, 卢超, 等. 基质改良和结构优化强化雨水生物滞留系统除污[J]. 中国给水排水, 2017, 33(7): 157-162. doi: 10.19853/j.zgjsps.1000-4602.2017.07.036 [24] 刘兴国. 池塘养殖污染与生态工程化调控技术研究[D]. 南京: 南京农业大学, 2011. [25] 林宏军, 王建龙, 赵梦圆, 等. 倒置生物滞留技术水量水质控制效果研究[J]. 水利水电技术, 2019, 50(6): 11-17. [26] ZHANG H, ZHANG X, LIU J, et al. Coal gangue modified bioretention system for runoff pollutants removal and the biological characteristics[J]. Journal of Environmental Management, 2022, 314: 115044. doi: 10.1016/j.jenvman.2022.115044 [27] ALAM T, BEZARES-CRUZ J C, Mahmoud A, et al. Nutrients and solids removal in bioretention columns using recycled materials under intermittent and frequent flow operations[J]. Journal of Environmental Management, 2021, 297: 113321. doi: 10.1016/j.jenvman.2021.113321 [28] LI H, ZHANG J, ZHANG C, et al. Responses of anammox and sulfur/pyrite autotrophic denitrification in one-stage system to high nitrogen load: Performance, metabolic and bacterial community[J]. Journal of Environmental Management, 2023, 332: 117427. doi: 10.1016/j.jenvman.2023.117427 [29] LI S W, SHENG G P, CHENG Y Y, et al. Redox properties of extracellular polymeric substances (EPS) from electroactive bacteria[J]. Scientific Reports, 2016, 6(1): 1-7. doi: 10.1038/s41598-016-0001-8 [30] HU A, CHENG X, WANG C, et al. Extracellular polymeric substances trigger an increase in redox mediators for enhanced sludge methanogenesis[J]. Environmental Research, 2020, 191: 110197. doi: 10.1016/j.envres.2020.110197 [31] SUN J, GUO L, LI Q, et al. Structural and functional properties of organic matters in extracellular polymeric substances (EPS) and dissolved organic matters (DOM) after heat pretreatment with waste sludge[J]. Bioresource Technology, 2016, 219: 614-623. doi: 10.1016/j.biortech.2016.08.042 [32] ZHANG M, XU Y, XIAO K Q, et al. Characterising soil extracellular polymeric substances (EPS) by application of spectral-chemometrics and deconstruction of the extraction process[J]. Chemical Geology, 2023, 618: 121271. doi: 10.1016/j.chemgeo.2022.121271 [33] PAN D, SHAO S, ZHONG J, et al. Performance and mechanism of simultaneous nitrification–denitrification and denitrifying phosphorus removal in long-term moving bed biofilm reactor (MBBR)[J]. Bioresource Technology, 2022, 348: 126726. doi: 10.1016/j.biortech.2022.126726 [34] ZUBROWSKA-SUDOL M, WALCZAK J. Effects of mechanical disintegration of activated sludge on the activity of nitrifying and denitrifying bacteria and phosphorus accumulating organisms[J]. Water Research, 2014, 61: 200-209. doi: 10.1016/j.watres.2014.05.029 [35] LIU Y, WANG H, XU Y, et al. Achieving enhanced denitrification via hydrocyclone treatment on mixed liquor recirculation in the anoxic/aerobic process[J]. Chemosphere, 2017, 189: 206-212. doi: 10.1016/j.chemosphere.2017.09.056 -



 下载:
下载: