得克隆(dechlorane plus, DP)即双(六氯环戊二烯),是一种氯代添加型阻燃剂。自20世纪70年代投入生产使用后,由于其良好的热稳定性、着色性、优异的电学性能和低生烟量等优点,被广泛用于纺织品、油漆、电路板,特别是电器的塑料高聚物(如电缆和电线、电脑连接器等产品)中,产品添加比例为10%~35%[1]。
由于主要作为添加型的阻燃剂使用,在产品的生产、使用及回收环节,DP不可避免地通过多种途径进入环境。直到2006年,才由Hoh等[2]首次在北美五大湖地区的沉积物和鱼类样品中检测到DP的残留。随后DP在全球不同区域的环境与生物介质中被广泛检出,表明其在环境中已普遍存在。毒理学研究表明,DP暴露能够引起大鼠DNA的氧化应激损伤,影响肝脏中碳水化合物、脂质和核苷酸代谢以及信号传导过程[3]。长时间高浓度的DP暴露也会对蚯蚓产生一定的氧化损伤和神经毒性[4]。DP目前已被认为是一种新的毒害性有机污染物。加拿大已将其列入受审查的化学品清单。迄今为止,已有不少文献对DP在环境及生物介质中的分布及行为进行了综述报道[5-11]。野外生物中DP的监测结果表明DP在生物中存在立体异构体选择性的富集,并且这种富集存在物种的差异性。但关于这种立体异构体选择性富集行为及其机理还较少进行全面的阐述。本文搜集近10年来报道生物(主要是动物)中DP富集的文献,对文献报道DP在生物中的物种特异性的立体异构体选择性富集结果进行了总结,对现有研究存在的问题进行了梳理,对后续的研究方向进行了展望。
1 DP产品的立体异构体组成及其变化(Isomer composition of DP commercial products and its change)
DP由美国Hooker(现为OxyChem)化学公司于20世纪60年代作为灭蚁灵的替代产品开发并生产。从1986年始,其年产量保持在450~4 500 t之间。中国江苏淮安的安邦电化有限公司从2003年起也开始生产DP,其年生产量为300~1 000 t[1]。DP是以六氯环戊二烯和1,5-环辛二烯通过Diels-Alder反应合成。其成品中存在2种立体异构体(syn-DP和anti-DP,图1)。DP工业品中syn-DP和anti-DP的比例一般为1∶3,即anti-DP的百分比(fanti=anti-DP/(anti-DP+syn-DP))为0.75。Hoh等[2]和Qiu等[12]报道的OxyChem公司DP产品的fanti值分别为0.75~0.80和0.75;罗孝俊等[8]测定了中国广州市场上购买的安邦公司3种DP产品的fanti值,结果分别为0.78、0.75和0.75;Zhu等[13]和Kang等[14]测定Cambridge同位素实验室提供的DP产品的fanti值分别为0.74~0.76和0.75。这些值与理论比例基本一致。但Tomy等[15]报道OxyChem公司DP产品的fanti值为0.65;Wu等[16]年测定中国市场上购买的一种DP工业品的fanti值为0.70;Wang等[17]报道江苏安邦公司DP产品fanti为0.60,这些报道值又低于0.75。产品中fanti值的差异可能与不同批次产品的组成不同有关。
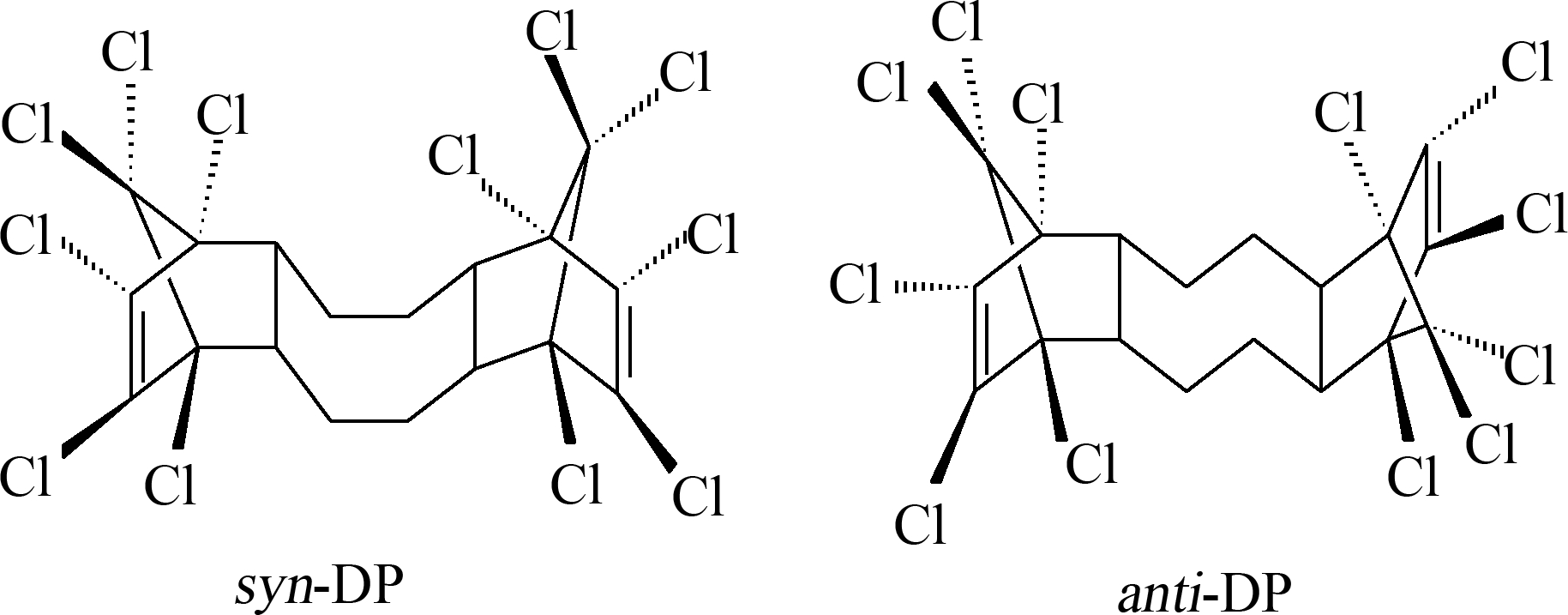
图1 得克隆(DP)的2种立体异构体化学结构
Fig. 1 Chemical structure of dechlorane plus (DP) isomers
DP的组成在其使用、释放、或长距离迁移过程中会发生改变。在近源或短距离的迁移过程中,一般认为DP的组成不会发生明显的变化,但长距离的迁移会显著改变DP的异构体组成特征[6]。Möller等[18]研究了DP组成在由欧洲经大气和海洋向南北两极长途迁移过程中的变化,发现随着迁移距离的增加,anti-DP出现明显的亏损,其fanti值从0.63降到0.37。长途迁移过程中anti-DP的紫外-可见光降解是造成这种变化的主要原因。
在对电子垃圾回收作坊与对照城、乡区室内灰尘的检测中,Zheng等[19]发现电子垃圾回收作坊室内灰尘中DP的fanti值(0.54)显著低于乡村对照区(0.70)和城市居民对照区(0.76),也低于电子垃圾回收区居民室内灰尘(0.66)。在电子垃圾回收作坊,脱氯产物(主要为anti-DP的脱1个氯的产物)与母体产物的比值(0.014)比居民室内灰尘相应的比值(0.0012)高1个数量级。上述结果表明在电子垃圾的回收处理过程中也存在anti-DP的选择性去除过程。由于DP的组成会受环境过程的影响,加上生物除了从环境中直接获得DP外,还存在从其他生物中获得DP的暴露途径,因此,在讨论生物是否存在对DP的立体异构体选择性富集时,fanti基准值的选取至关重要。同时提供生物及其环境介质或食物中DP的fanti值的文献,其得出的结论可信度高,直接与工业品的组成进行比较的文献,其结论可信度低。
2 野外生物样品中DP的组成特征(Isomer composition of DP in biota samples)
收集整理了近年来报道DP在生物样品中富集的相关文献。对于没有报道DP立体异构体组成的文献则略去不计。根据文献中是否明确给出存在DP立体异构体选择性富集的结论,将相关的文献结果分为3类:(1)认为生物存在选择性富集syn-DP,(2)认为存在选择性富集anti-DP,(3)是无法判定是否存在选择性富集。相关文献总结如下。
2.1 syn-DP在生物中的选择性富集(syn-DP enrichment in organisms)
Hoh等[2]首次报道了五大湖沉积物和鱼体中DP的浓度及组成。通过对比沉积物和鱼样品中DP的fanti值,发现伊利湖沉积柱中DP的fanti值除1个采样点外,其余均>0.75,但该湖泊采集的碧古鱼样品中DP的fanti值(均值0.61)显著低于沉积物中DP的fanti值(P<0.001)。这篇文献首次提出鱼可能选择性富集syn-DP。作者从anti-DP和syn-DP的化学结构推测这种选择性富集是因为anti-DP在生物体内更容易被生物代谢。自此以后,不断有研究证实这一发现(图1)。
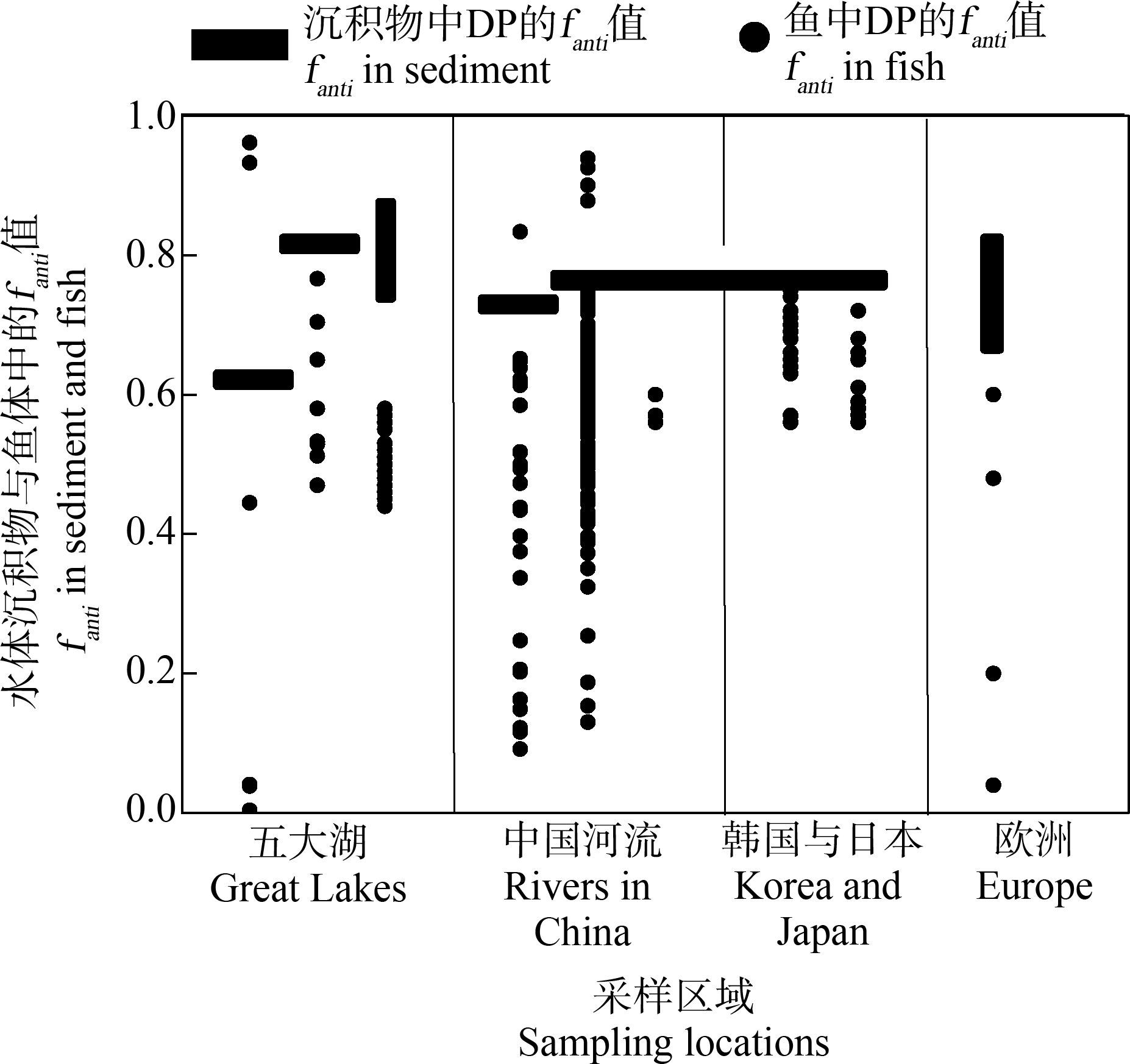
图2 不同区域沉积物及鱼体中DP的fanti值
注:fanti=anti-DP/(anti-DP+syn-DP);五大湖数据引自文献[15]、[20]和
[21];中国河流数据引自[16]、[26]、[27]和[29];韩国与日本数据引自
[14]和[33];欧洲数据引自文献[37-39];由于不能获得个体鱼样
的fanti值,欧洲区每个点位表示一类鱼的均值。
Fig. 2 Values of fanti in sediment and fish collected
from different regions
Note: fanti=anti-DP/(anti-DP+syn-DP); data in Great Lakes was cited
from reference [15], [20] and [21]; data in rivers from China was cited
from reference [16], [26], [27] and [29]; data in Korean and Japan was
cited from reference [14] and [33]; data in Europe was cited from
reference [37-39]; values of fanti in individual fish samples cannot be
obtained, so every data point in Europe represent mean of a fish species.
在北美,先后有Tomy等[15]、Shen等[20]和Guo等[21]对五大湖中水生生物中的DP进行了检测。无论是对历史样本还是当年采集的样本,均发现大部分鱼类样品中DP的fanti值小于相应水体沉积物中DP的fanti值(图2)。但偶尔也有例外,如Tomy等[15]在温伯尼湖采集的碧古鱼和金眼鱼中发现DP的fanti值(0.93和0.92)大于沉积物中DP的fanti值(0.61)。在Guo等[21]采集的安大略湖的鱼样品中DP的fanti均值为0.82,高于工业品组成,作者认为存在anti-DP的富集,但与安大略湖沉积物的fanti值(0.86)相比,这一结论并不成立。在美国旧金山湾水生生物样品中只有成年海豹样品能测定fanti值,其范围为0.43~0.49,平均0.46,明显低于沉积物中DP的fanti值(0.65),显示syn-DP的选择性富集[22]。Venier和Hites[23]检测了美国宠物狗血清及狗食物中DP的含量及组成。狗食物中DP的fanti值为0.76±0.02,4个狗血清中fanti值为0.61,表明存在一定程度的syn-DP的富集,但因为样本量太少,作者认为该结论不宜过度解读。
在亚洲,Wu等[16]报道了广东清远一电子垃圾污染池塘中虾、鲫鱼、鲮鱼、乌鳢、鲶鱼和水蛇样品中DP的浓度及组成。随后,He等[24]、Sun等[25]先后又报道了珠江三角洲河流中罗非鱼、鲮鱼和清道夫中DP的浓度与组成。上述研究中除个别样品外,DP的fanti值均低于沉积物中DP的fanti(图2),但物种间存在明显差别,可能与食性、栖息环境的差异有关。在清远采集的5种水鸟(池鹭、蓝胸秧鸡、红胸田鸡、沙锥和白胸苦恶鸟)中,Zhang等[26]测得DP在5种水鸟中总fanti均值分别为0.34、0.36、0.43、0.46和0.61,明显低于工业品组成;在该区域采集的青蛙样品中,Wu等[27]发现青蛙肌肉、肝脏与卵中DP的fanti值(平均分别为0.65、0.58和0.53)均显著低于昆虫中的fanti值(平均0.73)。在另一个电子垃圾回收区(贵屿),鱼样品中DP的fanti值(0.56~0.68,平均0.65)也低于相应土壤中DP的fanti值(0.67~0.83,平均0.76)[28]。在中国黄河三角洲采集的几种水产品(黑鲷、梭鱼、蛤仔、毛圣蛤、牡蛎和日本对虾)中DP的fanti值(0.56~0.60)低于工业品[29];中国辽宁大凌河采集的鱼类样品中DP的fanti值(0.53)低于水样、沉积物和芦苇中DP的fanti值(0.72、0.75和0.73)[30],表现为syn-DP的富集。Jia等[31]在中国大连附近海域采集了海水、沉积物和牡蛎样品。与工业品(0.75)和海水样品(0.66)相比,作者认为牡蛎(0.55)选择性富集syn-DP,但考虑到牡蛎的底栖习性与滤食性,与沉积物(0.56)相比,并不能得出上述结论。Chen等[32]采集了中国内蒙古锡林郭勒东北40 km和北部80 km这2个区域的非生物(气、水和土)及生物(植物、昆虫、爬行动物、鸟类和哺乳动物)等样品。植物样品中DP的fanti值要明显低于水、土和气中DP的fanti值,表明存在syn-DP的选择性富集。冷血动物如(蜥蜴、蟾蜍、蛇等),选择性富集syn-DP。Kang等[14]报道韩国城区及工业区河流鱼中DP的fanti值为0.67±0.06,与日本市场上购买的鱼样品中DP的fanti值(0.62±0.05)[33]相近,与典型的工业品相比(0.75),这些鱼类样品显示出syn-DP的选择性富集(图2)。
Zhang等[34]测定了一DP生产厂职工及周边对照区人群血清与头发中的DP浓度与组成。3个人群血清中DP的fanti值分别为0.54、0.60和0.61,头发中分别为0.56、0.59和0.60,与工业品的组成(0.68)相比,表现出一定的syn-DP的选择性富集。Chen等[35]采集了我国中央民族大学男、女生宿舍及教室室内灰尘和男女生头发样品,并测定了其中DP的含量及组成。发现头发中fanti均值(0.727)显著低于室内与教室灰尘中DP的fanti值(0.791和0.783)。但无法区分这种选择性的富集是来自头发从空气中直接吸附还是DP内暴露过程中的选择性代谢或传输。
在欧洲,Santín等[36]在西班牙4个代表性河流采集的鱼类样品以及Sühring等[37]在德国部分河流采集到的幼鳗、黄鳗和银鳗样品中,测得DP的fanti值均低于相应沉积物中DP的fanti值(图2)。在法国境内22个采样点采集的102条鲶鱼样品中,fanti值的变异性非常大(0.32~0.88),平均值为0.60±0.12,显示出syn-DP富集的特征,但仍有3个样品的fanti值>0.75,可能与源的组成或个体间的差异有关[38]。在南欧海域3种海洋哺乳动物(普通海豚、宽吻海豚和领航鲸)中,宽吻海豚和领航鲸的fanti值基本相似,平均值均为0.49,但普通海豚的fanti值(0.37)显著低于宽吻海豚和领航鲸。上述3种海洋哺乳动物中的fanti值均低于工业品的fanti值,表现为syn-DP的选择性富集[39]。
智利康塞普西翁海岸海洋生物初级和次级消费者的fanti值分别为0.60和0.61,与工业品组成(0.70)并无显著差异,而顶级消费者的fanti值则为0.47,显著低于工业品组成[40]。Na等[41]采集了南极菲尔德斯半岛包括藻类、帽贝、海星、钩虾、磷虾、鳕鱼、企鹅、海豹和贼鸥等生物样品。高浓度的DP主要出现在海豹、贼鸥和鳕鱼等样品中。各个生物中fanti值的范围为0.23~0.53,低于工业品组成,可能源于长距离迁移过程中的DP选择性去除或生物选择性富集syn-DP。
2.2 anti-DP在生物中的选择性富集现象(anti-DP enrichment in organisms)
除了上述少量报道鱼样品中存在anti-DP的选择性富集文献外,Sühring等[42]在德国埃姆斯河和施莱湾水域鳗鱼DP的富集与代际传递研究中发现了anti-DP选择性的富集。埃姆斯河鳗鱼性腺和肌肉中DP的fanti值分别为0.6和0.8,施莱湾水域鳗鱼性腺组织中只检测到anti-DP,肌肉组织中fanti值为0.9。这些结果与他们早期对德国河流中鳗鱼的研究结果[37]正相反,表现出anti-DP的选择性富集。DP在向鳗鱼卵和性腺组织的代际传递过程中有明显的syn-DP选择性传递,可能这一过程升高了母体中anti-DP的比例。Peng等[43]报道了中华鲟体内DP的组织分布与代际传递。中华鲟组织中fanti值范围为0.58~0.72,除心脏外,其他组织的fanti值高于工业品DP的fanti值(0.59),被认为存在anti-DP的选择性富集。由于不了解中华鲟生存环境介质中DP的组成,这一结论可能存在误判。
在对地中海西南部的2种海鸥蛋(黄脚银鸥和地中海鸥)和南极洲乔治国王岛鸟类(巴布亚企鹅、阿德利企鹅、南极贼鸥和褐贼鸥)的研究中,Mu oz-Arnanz等[44]和Kim等[45]发现上述鸟类中DP的fanti值高于工业品DP的fanti值,存在anti-DP的选择性富集(图3)。Kim等[46]又对南极洲乔治岛生态系统中各种生物(帽贝、端足类、南极鳕鱼、南极冰鱼、巴布亚企鹅、帽带企鹅、南极贼鸥和黑背鸥)中的DP进行了检测。帽贝和南极鳕鱼的fanti值分别为0.68±0.24和0.57±0.11;巴布亚企鹅和帽带企鹅的fanti值分别为0.74±0.20和0.65;南极冰鱼、黑背鸥和南极贼鸥的fanti值分别为0.71、0.10和0.79。这些值高于Na等[41]测定的南极菲尔德斯半岛生物样品中的fanti值(0.23~0.53)。DP的长距离的迁移会导致其fanti值下降[18],但由于生物富集作用,生物样品中的fanti值又接近或高于工业品的组成,说明生物的选择性富集行为使下降的fanti比值又出现回升。
oz-Arnanz等[44]和Kim等[45]发现上述鸟类中DP的fanti值高于工业品DP的fanti值,存在anti-DP的选择性富集(图3)。Kim等[46]又对南极洲乔治岛生态系统中各种生物(帽贝、端足类、南极鳕鱼、南极冰鱼、巴布亚企鹅、帽带企鹅、南极贼鸥和黑背鸥)中的DP进行了检测。帽贝和南极鳕鱼的fanti值分别为0.68±0.24和0.57±0.11;巴布亚企鹅和帽带企鹅的fanti值分别为0.74±0.20和0.65;南极冰鱼、黑背鸥和南极贼鸥的fanti值分别为0.71、0.10和0.79。这些值高于Na等[41]测定的南极菲尔德斯半岛生物样品中的fanti值(0.23~0.53)。DP的长距离的迁移会导致其fanti值下降[18],但由于生物富集作用,生物样品中的fanti值又接近或高于工业品的组成,说明生物的选择性富集行为使下降的fanti比值又出现回升。
Zheng等[47]对电子垃圾回收区村民家中饲养鸡的各个组织、鸡饲料及其活动场所中的土壤样品的DP含量进行了检测,对DP在鸡中的吸收、组织分布进行了研究,发现场地土壤是鸡中DP的主要来源。与土壤中DP的组成相比,鸡肉、鸡肝、鸡脑及鸡脂肪中的anti-DP出现了明显的富集(图3)。在对我国珠三角地区3种陆生雀鸟(白头鹎、棕背伯劳与鹊鸲)肌肉和肝脏组织[48]及4种陆生雀科(白头鹎、黄腹鹪莺、纯色山鹪莺、暗绿绣眼鸟)鸟蛋[49]中的DP及DP的脱氯产物检测分析中,Sun等[48-49]发现除纯色山鹪莺鸟蛋的fanti值(0.696±0.030)与珠三角城区灰尘中DP的fanti值(0.70)无明显差异外,其他样品中fanti值均高于灰尘中DP的fanti值(图3),且郊区鸟类中DP的fanti值(均值:0.78~0.83)高于城区(0.73~0.76)。Chen等[32]研究发现,在内蒙古草原由温血动物组成的食物链上,鸟类相比于昆虫、黄鼠狼相比于老鼠fanti值更高,表明高营养级的温血动物相对更易富集anti-DP。

图3 部分生物样品及其周围环境介质中DP的fanti值
注:水鸟数据来自文献[44]和[45],每个点表示一类鸟的平均值;
鸡及土壤数据来自文献[47];陆生雀鸟数据来自文献[48]和[49];
人体血清、头发和灰尘数据来自[19]、[50]和[51]。
Fig. 3 Values of fanti in some organisms and their
surrounding environmental matrix
Note: Data for waterbirds was cited from reference [44] and [45],
and every data point represent mean of a bird species;
data for chick and soil was cited from reference [47];
data for terrestrial birds (finch) was cited from reference [48] and [49];
data for serum, hair and dust was cited from reference [19], [50] and [51].
Chen等[50]采集了电子垃圾职业暴露工人的血清和头发样品。男、女性血清的fanti值无显著差异(均值为0.65),但显著地高于头发中的fanti值(0.47),也高于厂内灰尘中DP的fanti(0.54)。这说明,尽管所采集的人体血清样品的fanti值低于工业品的fanti,但与周边环境介质相比人体仍可能存在anti-DP的选择性富集。这也表明,Chen等[35]发现的人头发对syn-DP的选择性富集可能直接来源于头发对空气中syn-DP的选择性吸附。Yan等[51]对电子垃圾职业暴露人群血清的采样分析结果与Chen等[50]的结果有一定相似性。男女性血清中fanti平均值为0.66。Yan等[51]没有同时采集头发样品,仅与室内灰尘的fanti值进行比较(0.54),人血清表现出对anti-DP的选择性富集(图3)。Yan等[51]的结果还表现出明显的性别差异(详见第3节),这与Chen等[50]研究结果有一定差异,可能与样本量大小有关。
2.3 无清晰的选择性富集现象(No clear DP stereoselective enrichment in organisms)
在一项对波罗的海野生三纹鱼的研究中发现,三纹鱼样品中anti-DP的检出频率明显高于syn-DP,在2个异构体均检出的样品中,fanti值范围为0.56~0.94,平均值为0.71,与工业品的组成无显著性差异[52]。
对于鸟及鸟蛋样品,众多文献报道不存在DP的立体异构体选择性富集。Gauthier和Letcher[53]对北美大湖劳仑斯区域1982—2006年间的鲭鸥蛋的DP进行了分析,对DP的时空分布特征进行了调查。所有样品DP的fanti均值为0.69±0.08,与工业品组成无显著性差异。Mu oz-Arnanz等[54]对西班牙2个栖息地白鹳鸟蛋中的DP进行分析,马德里地区和多南那国家公园2个区域鸟蛋中DP的fanti均值分别0.64和0.66。如果以0.65作为工业品标准值,则无选择性富集,如果以0.75~0.80作为标准,则存在一定程度的syn-DP富集。Zheng等[55]在我国广东清远电子垃圾回收区收集了3个地点的鸡蛋样品,3个地点鸡蛋中fanti均值分别为0.70、0.74和0.63,对照区鸡蛋的fanti均值为0.75,这些值与工业品值相近。Gentes等[56]检测了加拿大圣劳仑斯河环嘴海鸥肝脏中包括DP在内的新型阻燃剂含量,发现anti-DP在100%的样品中被检出,syn-DP的检出率为93%,肝脏中DP的fanti值为0.72,与工业品的组成无明显差异。Mo等[57]检测了电子垃圾回收区和对照区翠鸟及其食物中的DP含量和组成,电子垃圾区和对照区翠鸟中DP的fanti值分别为0.65和0.76,与其食物鱼类中的fanti值并无明显差异。Peng等[58]采集了我国广东一自然保护区内7种陆生雀鸟,分析了其肌肉组织中DP的含量与组成,测得fanti值范围为0.34~0.97,不同鸟类及同种鸟类间fanti值差异巨大,无法判断是否存在选择性富集。Chen等[59]分析了我国北京猛禽救助中心6种猛禽(雀鹰、日本松雀鹰、红隼、红角鸮、长耳鸮和纵纹腹小鸮)肌肉和肝脏中的DP含量及组成,除红角鸮大部分只检测到anti-DP外,其他几种猛禽的fanti中位值为0.60~0.80。Yu等[60]也对中国北京猛禽红隼、鸮及其可能食物麻雀和老鼠的DP含量及组成进行了分析,DP在麻雀、老鼠、红隼和鸮中的fanti均值分别为0.75、0.77、0.79和0.79。捕食者与被捕食者间并无明显的差异。Zeng等[61]采集了中国汕头贵屿2个区域的鸡蛋和鹅蛋样品,2个采样点鸡蛋中的fanti均值分别为0.74和0.76,与工业品相同,而鹅蛋中的fanti值均为0.64,显著低于鸡蛋,可能是由于鹅吃鱼导致其fanti值下降。
oz-Arnanz等[54]对西班牙2个栖息地白鹳鸟蛋中的DP进行分析,马德里地区和多南那国家公园2个区域鸟蛋中DP的fanti均值分别0.64和0.66。如果以0.65作为工业品标准值,则无选择性富集,如果以0.75~0.80作为标准,则存在一定程度的syn-DP富集。Zheng等[55]在我国广东清远电子垃圾回收区收集了3个地点的鸡蛋样品,3个地点鸡蛋中fanti均值分别为0.70、0.74和0.63,对照区鸡蛋的fanti均值为0.75,这些值与工业品值相近。Gentes等[56]检测了加拿大圣劳仑斯河环嘴海鸥肝脏中包括DP在内的新型阻燃剂含量,发现anti-DP在100%的样品中被检出,syn-DP的检出率为93%,肝脏中DP的fanti值为0.72,与工业品的组成无明显差异。Mo等[57]检测了电子垃圾回收区和对照区翠鸟及其食物中的DP含量和组成,电子垃圾区和对照区翠鸟中DP的fanti值分别为0.65和0.76,与其食物鱼类中的fanti值并无明显差异。Peng等[58]采集了我国广东一自然保护区内7种陆生雀鸟,分析了其肌肉组织中DP的含量与组成,测得fanti值范围为0.34~0.97,不同鸟类及同种鸟类间fanti值差异巨大,无法判断是否存在选择性富集。Chen等[59]分析了我国北京猛禽救助中心6种猛禽(雀鹰、日本松雀鹰、红隼、红角鸮、长耳鸮和纵纹腹小鸮)肌肉和肝脏中的DP含量及组成,除红角鸮大部分只检测到anti-DP外,其他几种猛禽的fanti中位值为0.60~0.80。Yu等[60]也对中国北京猛禽红隼、鸮及其可能食物麻雀和老鼠的DP含量及组成进行了分析,DP在麻雀、老鼠、红隼和鸮中的fanti均值分别为0.75、0.77、0.79和0.79。捕食者与被捕食者间并无明显的差异。Zeng等[61]采集了中国汕头贵屿2个区域的鸡蛋和鹅蛋样品,2个采样点鸡蛋中的fanti均值分别为0.74和0.76,与工业品相同,而鹅蛋中的fanti值均为0.64,显著低于鸡蛋,可能是由于鹅吃鱼导致其fanti值下降。
哺乳动物及人体样品中也有文献报道未观察到明显的DP立体异构体选择性富集。在巴西沿海采集的海豚样本中,fanti值(0.71±0.16)与工业品的组成相当[62]。Ren等[63]测定了中国广东贵屿电子垃圾回收区与对照区濠江区居民血液中的DP,发现电子垃圾回收区工人血清中的fanti值(0.58±0.11)要显著低于对照区(0.64±0.05)。由于缺乏对应的环境样品,无法得出人体是否存在DP的立体异构体选择性富集的结论。Siddique等[64]采集了加拿大2个城市(金斯敦和希尔布鲁克)的人奶样品,人奶样品中DP的fanti均值为0.67,与工业品的组成接近。Brasseur等[65]收集了2003—2005年间48个法国人血清样品,测定了血清中的DP含量及组成。33个样品中DP的fanti值范围为0.65~0.86,均值为0.75,与工业品组成一致,认为不存在选择性富集现象。
3 影响野外生物样品中DP组成的因素(Factors affecting the isomer composition of DP in organisms)
已有文献提到了以下几个影响生物中DP组成的重要因子。首先是所选取的组织或器官。Zhang等[66]报道了DP在鲮鱼与乌鳢中的组织(肌肉、肝脏和脑)分布。肝脏中DP浓度显著的高于肌肉;在肝脏和脑组织之间,syn-DP更倾向于富集在乌鳢肝脏中,而在鲮鱼中则无差异。但anti-DP在2种鱼脑组织中浓度均显著高于肝脏组织,表明anti-DP具有较强的穿透血-脑屏障的能力而在脑组织中富集。Peng等[43]报道了中华鲟体内DP的组织分布及代际传递特征,发现DP在中华鲟体内的组织分布属脂肪趋动型,但脂肪归一化后的浓度肝脏仍然高于肌肉组织,表明肝脏对DP有较高亲和力,这与上述鱼的研究结果一致。中华鲟心脏和卵中fanti值(0.65和0.58)显著低于肝脏及肌肉组织(0.72),作者认为可能是因为anti-DP穿透肌肉、肝脏细胞膜的能力低,使其不易进入血液并通过血液转移至卵。Zheng等[47]对清远电子垃圾回收区鸡体内DP的组织分布进行了研究,发现鸡的脂肪组织、脑和肝脏比其他组织富集anti-DP的能力更强,其fanti值(分别为0.65、0.64和0.64)高于其他组织的fanti值(0.54~0.59)。该报道与鱼脑更易富集anti-DP的结果有相似之处。Wu等[27]发现青蛙卵中的fanti值显著低于肌肉和肝脏,表明在代际传递过程中存在syn-DP的选择性传递现象。这与中华鲟卵中fanti值显著低于其他母体组织的结果一致。
第2个影响因素是生物所处的营养级。Wu等[16]首先报道了fanti值在水生食物链上随营养级增加而下降的现象。随后,该课题组在同一区域的水鸟[26]和包含昆虫的水、陆生食物链[67]中均发现了fanti值与生物所处营养级之间的显著负相关关系;在珠三角不同区域采集的3种陆生雀鸟中也观察到fanti值与生物个体的稳定氮同位素之间显著的负线性关系[48]。在中国淮安一化工厂周边水体采集的由7种生物组成的食物链中,Wang等[68]发现最高的fanti值(0.81)出现在营养级最低的虾样品中,而最低的fanti值(0.51)则出现在最高营养级的蛇类样品中,fanti值与生物所处营养级之间存在显著的负线性相关性。Na等[41]报道的菲尔德斯半岛食物链中DP组成与营养级的关系与上述研究结果不同。在该食物链中,fanti值随营养级增加先增加,而后再下降。作者解释可能是由于南极的极端低温条件使得低营养级生物对DP降解能力下降,限制了选择性降解anti-DP过程。到了高营养级,降解能力提升,降解过程又成了主控因素。Chen等[32]对内蒙古草原食物链的研究结果表明,由冷血动物组成的食物链,fanti值随营养级的增加而下降,但由温血动物组成的食物链,则出现先下降后上升的现象。
第3个影响因素是DP的浓度。Mo等[57]在测定翠鸟和其食物中的DP浓度时发现,DP的fanti值与其浓度之间存在显著的负相关,提出DP浓度本身也是影响fanti值的重要因素。相似的结果在珠三角的陆生鸟蛋[49]、陆生鸟类肌肉[58]中均被发现。但Chen等[59]在北京6种猛禽中发现在肌肉和肝脏中fanti值随生物体内DP的浓度增加而增加,与前述结果不一致。
第4个影响因素是性别。Yan等[51]采集了电子垃圾回收厂70个职业暴露工人的血清样品(33个男性,37个女性),分析发现女性血清中DP总浓度(平均265 ng·L-1,以脂质量计)显著高于男性(平均121 ng·L-1),fanti值女性(平均:0.70)显著高于男性(0.64),而anti-DP的脱氯产物与母体产物的比值男性(0.017)又显著高于女性(0.010)。造成这一现象的原因作者解释为男性比女性具有更高的对DP的代谢能力,使其血清中的DP总浓度低于女性,由于anti-DP更易被代谢,导致男性的fanti值低于女性。在前述有关DP在卵生生物的代际传递研究中,青蛙卵[27]、鳗鱼卵[42]、中华鲟卵[44]与母体组织相比均选择性富集syn-DP。这种选择性的代际传递可能造成fanti值在雌性个体中比雄性高。Wu等[27]对青蛙性别差异研究发现,母蛙体内DP的浓度显著低于公蛙,而fanti值要高于公蛙,这证实了上述猜想。
4 DP生物暴露实验结果及其揭示的DP立体异构体选择性富集机理(Results from laboratory exposure and mechanisms for stereoselective enrichment of DP)
为揭示DP在生物中可能存在的立体异构体选择性富集及其机理,研究者进行了室内及野外的暴露实验。这些实验主要集中在鱼、鸟类、植物及少量的哺乳动物,将研究进展总结如下。
4.1 鱼类暴露实验(Exposure experiment of fish)
Tomy等[69]首次利用虹鳟鱼进行了DP的暴露及体外肝微粒体孵化实验,实验分为49 d的暴露期和112 d的清除期,在整个暴露期,鱼体中DP的浓度呈上升状态,没有达到平台期。Syn-DP和anti-DP在鱼体吸收速率(除肝脏外)分别为(0.045±0.005) nmol·d-1和(0.018±0.002) nmol·d-1;清除期的半衰期分别为53.3 d和30.4 d。这一实验结果证实了鱼体对syn-DP的选择性富集。在进行肝微粒体代谢实验过程中,未检测到任何脱氯、羟化、甲氧基化或甲磺基化的代谢产物,说明上述代谢的可能性较低。Zeng等[70]和Tang等[71]又先后用DP工业品和DP标准品进行了鲤鱼暴露实验,实验在暴露期和清除期时间设置、采样时间间隔和样品采集上存在一些差异。通过暴露期鱼粪与鱼食的对比,发现anti-DP在肠道吸收过程的效率稍高于syn-DP,但syn-DP的净同化效率却高于anti-DP,表明可能存在anti-DP的选择性代谢过程。DP在各组织中的浓度分布是一个动态变化过程。暴露开始,肝脏中迅速累积DP,其含量显著高于其他组织,表明肝脏对DP的优先富集。进入清除期后,肝脏与其他组织的浓度差异开始缩小,肝脏中的清除速率最快,这与肝脏作为解毒器官对DP的代谢有关。肝脏中fanti值明显高于肌肉和性腺样品,表现为anti-DP的富集,而肠道、肌肉等组织则显示syn-DP的选择性富集。鱼的整体(所有组织加和)则表现为syn-DP的选择性富集。在Tang等[71]的实验中,还同时测定了清除期鱼粪中DP组成,发现鱼粪在清除期内anti-DP的相对含量不断增加,对应的鱼整体的fanti比值逐渐下降。
上述鱼的DP暴露实验证实了syn-DP在鱼体内的选择性富集。虽然没有切实的证据表明存在anti-DP的选择性降解,但有明确的证据表明存在anti-DP的选择性排泄。因此,选择性排泄anti-DP应是鱼体表现为syn-DP富集的一个重要因素,但也不排除anti-DP选择性降解的可能。
4.2 鸟类和哺乳类暴露研究(Exposure experiment of bird and mammal)
Li等利用鹌鹑[72]和小白鼠[73]进行了3个剂量(1、10和100 mg·kg-1·d-1)90 d的DP染毒暴露实验,对于小白鼠,暴露期结束后还进行了45 d的清除,测定了鹌鹑和小白鼠肝脏、肌肉及血清样品中DP的含量与组成。结果表明,肝脏中DP浓度在3个暴露组中均高于肌肉和血清,显示DP在肝脏中的选择性富集。DP的组成在鹌鹑和小白鼠实验中均出现明显的暴露剂量差异性。在低剂量暴露组,肝脏、肌肉和血清中fanti值(0.70左右)接近用于实验的工业品的组成。而中、高暴露组肌肉、肝脏和血清中的fanti值则下降到0.3以下,最低达0.16。高浓度的DP诱发相关代谢酶的活性,anti-DP更易被代谢可能是造成fanti值显著下降的原因。小白鼠实验的清除期,肝脏与肌肉组织中fanti值与暴露期结束时的fanti值相比出现一定程度的回升,说明在清除期,syn-DP有选择性清除的过程。Li等[74]利用鸡蛋孵化和成鸡暴露实验研究了DP在鸡中的富集及可能的代谢转化。鸡蛋孵化实验结果表明,约12%和28%被吸收的syn-DP和anti-DP在小鸡孵化过程中被清除,使得小鸡组织中出现syn-DP的相对富集。由于不存在排泄途径,亏损部分只能来源于鸡的代谢过程,证实了anti-DP更易被动物代谢。在成鸡的暴露喂养过程中,暴露期鸡蛋中fanti值仅稍高于食物中的fanti值,但在清除阶段,随着清除时间的增加,鸡蛋中的fanti值出现快速增加的现象,并且清除期结束时鸡各组织中的fanti值均高于DP的原始组成。这种清除期fanti值增加的现象与Li等[73]对老鼠染毒的实验结果一致,表明存在选择性的syn-DP清除过程。由于鸡蛋孵化实验表明anti-DP相对更容易被代谢,而最后成鸡表现的却是anti-DP的选择性富集,说明syn-DP选择性排泄超过了anti-DP的优先代谢,成为鸡体内选择性富集anti-DP的主导因素。
上述暴露实验结果表明anti-DP更易在动物体内被代谢,证实了最初研究者认为anti-DP易被生物代谢的猜想。但这种选择性anti-DP降解并不一定导致动物体内出现选择性的syn-DP富集,只有在高浓度刺激下才表现为syn-DP的选择性富集,说明这些动物体内存在anti-DP选择性代谢与syn-DP选择性排泄导致fanti值变化趋势相反的2个过程。在低浓度下,选择性排泄syn-DP主导了DP在相关生物中的选择性富集;在高浓度下,代谢过程又起主导作用;如果2个过程强度相当,则观察不到明显的DP立体异构体选择性富集。如果上述设想被证明正确,则会存在鱼体选择性排泄anti-DP而鸟类选择性排泄syn-DP的物种差异性现象,这可能需要从DP与生物中大分子相互作用的角度进行更深入的研究。
4.3 植物吸收研究(Plant absorption of DP)
Zhao等[75]利用室内暴露的方式,将绿藻石莼放置于有DP的溶液中进行21 d的暴露,然后在清洁水中进行14 d的清除。在暴露和清除期间分阶段采集样品,分析DP在绿藻石莼中的富集情况。结果表明,在暴露期syn-DP的相对含量随着暴露期的增加而增加,其吸收速率(0.164±0.056) d-1显著高于anti-DP的(0.083±0.071) d-1,到了清除期,syn-DP的相对含量出现下降,其清除速率(0.337±0.057) d-1高于anti-DP的(0.236±0.095) d-1。Zhang等[76]利用电子垃圾回收区污染土壤混合一定比例的对照土壤,在实验大棚内进行水稻种植实验,研究包含DP在内的卤代有机污染物在水稻中的吸收和传递。实验结果表明,在3个处理组中水稻根、茎和叶的fanti值均显著低于原始土壤中的fanti值(土-根-茎-叶,控制组:0.68-0.64-0.61-0.58;低浓度组:0.67-0.59-0.57-0.57;高浓度组:0.75-0.69-0.68-0.67),表明植物根系存在对syn-DP的选择性吸收。类似的,Cheng等[77]利用培养箱进行了DP的水稻土培实验,结果也表明植物根和茎中fanti值(0.54和0.65)显著低于培养土中DP的fanti值(0.75),表现为syn-DP的选择性富集。Fan等[78]在清远村庄周边农地进行的野外田间种植花生和玉米的大田实验也发现,植物各个生长阶段DP的fanti值(种子初发:0.51,生长阶段:0.37~0.50)均小于土壤(0.73)和大气(0.56)中DP的fanti值,进一步证实植物中存在优先富集syn-DP的现象。
上述有关植物的吸收实验均表明植物选择性富集syn-DP,但并未能给出机理。我们推测DP的2个异构体之间溶解度的差别是造成这种现象的原因。Oxychem报道DP的2个异构体在水中的溶解度分别为207 ng·L-1和572 ng·L-1,但哪个异构体的溶解度高不清楚[16]。syn-DP具有较高的溶解度可以很好地解释植物对syn-DP的选择性富集。较高的溶解度使其更易从土壤中析出进入孔隙水从而被植物根系吸收。在Zhao等[75]的绿藻石莼实验中,清除期anti-DP的相对含量上升也可能是因为syn-DP的高溶解度使其更多分配到纯净的水溶液中。除溶解度外,植物是否会对DP的2个异构体进行选择性代谢,目前知之甚少,需要开展更多的实验研究。
除了上述体内暴露实验以外,还有部分体外肝微粒体孵化实验对DP的代谢进行了研究。Peng等[43]利用中华鲟进行体外24 h的肝微粒体孵化实验,未能检测到DP脱氯的代谢产物。Chabot-Giguère等[79]利用加拿大圣劳仑斯河一污染热点区域的环嘴海鸥肝微粒体进行DP的体外肝孵化实验,未发现明显的代谢痕迹,也未找到有关脱氯和羟化的产物,说明DP很难被代谢,也表明脱氯产物可能直接来自于环境,而非生物代谢的结果。
5 研究展望(Prospect)
综合上述文献可以得到如下几点认识:
生物对DP存在物种特异性的立体异构体选择性富集。从对已有文献的整理中可以看出,鱼类样品中普遍存在syn-DP的选择性富集,而anti-DP选择性富集的报道主要出现在鸟类中。上述差异是否可以扩推为冷血动物与温血动物的差异现有的文献还无法给出明确结论。
判断生物是否存在DP立体异构体选择性富集的方法目前并不规范,结果存在很大的不确定性。关于鱼和水生生物的文献,大多都是通过与水体沉积物DP的组成的对比来判断是否存在立体异构体的选择性富集,但也有少量文献直接使用工业品组成进行对比。考虑到工业品组成的多样性,直接与工业品比较获得的结论存在较大的不确定性。对于鸟类样品,不论是水生还是陆生鸟类,绝大部分文献都是直接与工业品组成进行对比,相关结论可信度差。大量食鱼鸟类样品中DP的组成接近工业品组成,被认为不存在对DP的立体异构体选择性富集。由于鱼类存在syn-DP的选择性富集,食鱼鸟中fanti比值接近或高于工业品组成,应该判断为存在anti-DP的选择性富集;在陆生鸟类中,植物是DP的初始来源。由于植物选择性富集了syn-DP,陆生植食性鸟类中fanti的值接近工业品组成,也应判断为anti-DP的选择性富集。因此,现有的文献可能低估了某些生物对anti-DP的选择性富集。
对于哺乳动物与人类样品,判断是否存在DP的立体异构体选择性富集现象取决于对其DP暴露源的组成与贡献的了解,仅依据部分组织或器官样品中DP的组成无法得出准确结论。由于职业暴露人群的DP更多来源于其职业活动周边的环境,因此,Yan等[51]和Chen等[50]给出人群相对易富集anit-DP的结论有较高的可信度。但同时需要注意血清可能与其他组织存在组织特异性的立体异构体选择性富集现象。
现有的室内暴露实验证实了野外观察到的生物对DP立体异构体选择性富集的现象,也在一定程度上揭示了可能的原因,但其本质机理仍不清楚。迄今为止,仍然没有检测到DP在动物中的相关代谢产物,相关脱氯产物目前均认为是环境降解的结果。野外及室内暴露实验均观察到DP在肝脏中的优先富集,但具体机理仍为猜测,无实质证据说明肝蛋白在其中起了作用。浓度效应、营养级对DP组成的影响都存在相互不一致的结果,其内在机理不明。对于浓度效应,需关注低浓度特别是接近检测限情况下,2个异构体在仪器上的响应差异。anti-DP在常用的GC-MS上的响应因子要高于syn-DP,因此往往存在anti-DP仍能被检出,但syn-DP已不能检出的情况。因此,低浓度时应尽量使用低浓度的校正标样进行化合物的定量,以减少测量造成的fanti值误差。
现有的野外调查和室内暴露实验涉及的物种少,主要是鱼类和鸟类,今后需要更多其他动物物种中DP的富集研究。在涉及是否存在立体异构体选择性富集的研究中,需要更多考虑生物DP的主要暴露源、组织和器官的选择、性别的差异,是否处于生殖期间等众多因素,才能得出较为准确的结论。有关DP的生物特别是动物的代谢转化研究目前一直未检测到相关的代谢产物,今后需要在DP的生物转化研究方向采用新的方法和手段,如高灵敏的检测仪器、非靶向的检测方法。
通讯作者简介:罗孝俊(1972—),男,博士,研究员,主要研究方向为毒害性有机污染物的生物地球化学。
[1] 罗孝俊, 麦碧娴. 新型持久性有机污染物的生物富集[M]. 北京: 科学出版社, 2017: 254-255
[2] Hoh E, Zhu L Y, Hites R A. Dechlorane plus, a chlorinated flame retardant, in the great lakes [J]. Environmental Science & Technology, 2006, 40(4): 1184-1189
[3] Wu B, Liu S, Guo X C, et al. Responses of mouse liver to dechlorane plus exposure by integrative transcriptomic and metabonomic studies [J]. Environmental Science & Technology, 2012, 46(19): 10758-10764
[4] 张刘俊. 得克隆对赤子爱胜蚓的毒性效应研究[D]. 南京: 南京大学, 2014: 17-22
Zhang L J. Comprehensive toxicity study of dechlorane plus on the earthworm Eisenia fetida [D]. Nanjing: Nanjing University, 2014: 17-22 (in Chinese)
[5] Zafar M I, Kali S, Ali M, et al. Dechlorane plus as an emerging environmental pollutant in Asia: A review [J]. Environmental Science and Pollution Research International, 2020, 27(34): 42369-42389
[6] Wang P, Zhang Q H, Zhang H D, et al. Sources and environmental behaviors of dechlorane plus and related compounds—A review [J]. Environment International, 2016, 88: 206-220
[7] Feo M L, Barón E, Eljarrat E, et al. Dechlorane plus and related compounds in aquatic and terrestrial biota: A review [J]. Analytical and Bioanalytical Chemistry, 2012, 404(9): 2625-2637
[8] 罗孝俊, 吴江平, 陈社军, 等. 多溴联苯醚、六溴环十二烷和得克隆的生物差异性富集及其机理研究进展[J]. 中国科学: 化学, 2013, 43(3): 291-304
Luo X J, Wu J P, Chen S J, et al. Species-specific bioaccumulation of polybrominated diphenyl ethers, hexabromocyclododecan and dechlorane plus in biota: A review [J]. Scientia Sinica Chimica, 2013, 43(3): 291-304 (in Chinese)
[9] 李宇霖, 孟祥周, 赵丽芳, 等. 环境中新兴有机污染物得克隆的研究进展[J]. 环境科学与技术, 2012, 35(2): 79-83
Li Y L, Meng X Z, Zhao L F, et al. Progress on dechlorane plus, an emerging organic pollutant in environment [J]. Environmental Science & Technology, 2012, 35(2): 79-83 (in Chinese)
[10] Xian Q M, Siddique S, Li T, et al. Sources and environmental behavior of dechlorane plus—A review [J]. Environment International, 2011, 37(7): 1273-1284
[11] Sverko E, Tomy G T, Reiner E J, et al. Dechlorane plus and related compounds in the environment: A review [J]. Environmental Science & Technology, 2011, 45(12): 5088-5098
[12] Qiu X H, Marvin C H, Hites R A. Dechlorane plus and other flame retardants in a sediment core from Lake Ontario [J]. Environmental Science & Technology, 2007, 41(17): 6014-6019
[13] Zhu J P, Feng Y L, Shoeib M. Detection of dechlorane plus in residential indoor dust in the city of Ottawa, Canada [J]. Environmental Science & Technology, 2007, 41(22): 7694-7698
[14] Kang J H, Kim J C, Jin G Z, et al. Detection of dechlorane plus in fish from urban-industrial rivers [J]. Chemosphere, 2010, 79(8): 850-854
[15] Tomy G T, Pleskach K, Ismail N, et al. Isomers of dechlorane plus in Lake Winnipeg and Lake Ontario food webs [J]. Environmental Science & Technology, 2007, 41(7): 2249-2254
[16] Wu J P, Zhang Y, Luo X J, et al. Isomer-specific bioaccumulation and trophic transfer of dechlorane plus in the freshwater food web from a highly contaminated site, South China [J]. Environmental Science & Technology, 2010, 44(2): 606-611
[17] Wang D G, Yang M, Qi H, et al. An Asia-specific source of dechlorane plus: Concentration, isomer profiles, and other related compounds [J]. Environmental Science & Technology, 2010, 44(17): 6608-6613
[18] Möller A, Xie Z Y, Sturm R, et al. Large-scale distribution of dechlorane plus in air and seawater from the Arctic to Antarctica [J]. Environmental Science & Technology, 2010, 44(23): 8977-8982
[19] Zheng J, Wang J, Luo X J, et al. Dechlorane plus in human hair from an e-waste recycling area in South China: Comparison with dust [J]. Environmental Science & Technology, 2010, 44(24): 9298-9303
[20] Shen L, Reiner E J, Helm P A, et al. Historic trends of dechloranes 602, 603, 604, dechlorane plus and other norbornene derivatives and their bioaccumulation potential in Lake Ontario [J]. Environmental Science & Technology, 2011, 45(8): 3333-3340
[21] Guo J H, Venier M, Salamova A, et al. Bioaccumulation of dechloranes, organophosphate esters, and other flame retardants in Great Lakes fish [J]. The Science of the Total Environment, 2017, 583: 1-9
[22] Klosterhaus S L, Stapleton H M, la Guardia M J, et al. Brominated and chlorinated flame retardants in San Francisco Bay sediments and wildlife [J]. Environment International, 2012, 47: 56-65
[23] Venier M, Hites R A. Flame retardants in the serum of pet dogs and in their food [J]. Environmental Science & Technology, 2011, 45(10): 4602-4608
[24] He M J, Luo X J, Wu J P, et al. Isomers of dechlorane plus in an aquatic environment in a highly industrialized area in Southern China: Spatial and vertical distribution, phase partition, and bioaccumulation [J]. Science of the Total Environment, 2014, 481: 1-6
[25] Sun R X, Luo X J, Tang B, et al. Persistent halogenated compounds in fish from rivers in the Pearl River Delta, South China: Geographical pattern and implications for anthropogenic effects on the environment [J]. Environmental Research, 2016, 146: 371-378
[26] Zhang X L, Luo X J, Liu H Y, et al. Bioaccumulation of several brominated flame retardants and dechlorane plus in waterbirds from an e-waste recycling region in South China: Associated with trophic level and diet sources [J]. Environmental Science & Technology, 2011, 45(2): 400-405
[27] Wu J P, Chen X Y, Si-Kang W, et al. Dechlorane plus flame retardant in a contaminated frog species: Biomagnification and isomer-specific transfer from females to their eggs [J]. Chemosphere, 2018, 211: 218-225
[28] Tao W Q, Zhou Z G, Shen L, et al. Determination of dechlorane flame retardants in soil and fish at Guiyu, an electronic waste recycling site in South China [J]. Environmental Pollution, 2015, 206: 361-368
[29] Zhang Z W, Tong X, Xing Y, et al. Polybrominated diphenyl ethers, decabromodiphenyl ethane and dechlorane plus in aquatic products from the Yellow River Delta, China [J]. Marine Pollution Bulletin, 2020, 161(Pt A): 111733
[30] Wang L, Jia H L, Liu X J, et al. Dechloranes in a river in northeastern China: Spatial trends in multi-matrices and bioaccumulation in fish (Enchelyopus elongatus) [J]. Ecotoxicology and Environmental Safety, 2012, 84: 262-267
[31] Jia H L, Sun Y Q, Liu X J, et al. Concentration and bioaccumulation of dechlorane compounds in coastal environment of Northern China [J]. Environmental Science & Technology, 2011, 45(7): 2613-2618
[32] Chen W M, Bao J S, Bu T, et al. Dechlorane plus biomagnification and transmission through prairie food webs in Inner Mongolia, China [J]. Environmental Toxicology and Chemistry, 2021, 40(2): 413-421
[33] Kakimoto K, Nagayoshi H, Yoshida J, et al. Detection of dechlorane plus and brominated flame retardants in marketed fish in Japan [J]. Chemosphere, 2012, 89(4): 416-419
[34] Zhang H D, Wang P, Li Y M, et al. Assessment on the occupational exposure of manufacturing workers to dechlorane plus through blood and hair analysis [J]. Environmental Science & Technology, 2013, 47(18): 10567-10573
[35] Chen W M, Li J Q, Dong Z, et al. Correlations between dechlorane plus concentrations in paired hair and indoor dust samples and differences between dechlorane plus isomer concentrations in hair from males and females [J]. Chemosphere, 2019, 231: 378-384
[36] Santín G, Barón E, Eljarrat E, et al. Emerging and historical halogenated flame retardants in fish samples from Iberian rivers [J]. Journal of Hazardous Materials, 2013, 263(Pt 1): 116-121
[37] Sühring R, Möller A, Freese M, et al. Brominated flame retardants and dechloranes in eels from German rivers [J]. Chemosphere, 2013, 90(1): 118-124
[38] Abdel Malak I, Cariou R, Vénisseau A, et al. Occurrence of dechlorane plus and related compounds in catfish (Silurus spp.) from rivers in France [J]. Chemosphere, 2018, 207: 413-420
[39] Barón E, Giménez J, Verborgh P, et al. Bioaccumulation and biomagnification of classical flame retardants, related halogenated natural compounds and alternative flame retardants in three delphinids from Southern European waters [J]. Environmental Pollution, 2015, 203: 107-115
[40] Barón E, Rudolph I, Chiang G, et al. Occurrence and behavior of natural and anthropogenic (emerging and historical) halogenated compounds in marine biota from the Coast of Concepcion (Chile) [J]. Science of the Total Environment, 2013, 461-462: 258-264
[41] Na G S, Yao Y, Gao H, et al. Trophic magnification of dechlorane plus in the marine food webs of Fildes Peninsula in Antarctica [J]. Marine Pollution Bulletin, 2017, 117(1-2): 456-461
[42] Sühring R, Freese M, Schneider M, et al. Maternal transfer of emerging brominated and chlorinated flame retardants in European eels [J]. The Science of the Total Environment, 2015, 530-531: 209-218
[43] Peng H, Zhang K, Wan Y, et al. Tissue distribution, maternal transfer, and age-related accumulation of dechloranes in Chinese sturgeon [J]. Environmental Science & Technology, 2012, 46(18): 9907-9913
[44] Mu oz-Arnanz J, Roscales J L, Vicente A, et al. Dechlorane plus in eggs of two gull species (Larus michahellis and Larus audouinii) from the southwestern Mediterranean Sea [J]. Analytical and Bioanalytical Chemistry, 2012, 404(9): 2765-2773
oz-Arnanz J, Roscales J L, Vicente A, et al. Dechlorane plus in eggs of two gull species (Larus michahellis and Larus audouinii) from the southwestern Mediterranean Sea [J]. Analytical and Bioanalytical Chemistry, 2012, 404(9): 2765-2773
[45] Kim J T, Son M H, Kang J H, et al. Occurrence of legacy and new persistent organic pollutants in avian tissues from King George Island, Antarctica [J]. Environmental Science & Technology, 2015, 49(22): 13628-13638
[46] Kim J T, Choi Y J, Barghi M, et al. Occurrence, distribution, and bioaccumulation of new and legacy persistent organic pollutants in an ecosystem on King George Island, maritime Antarctica [J]. Journal of Hazardous Materials, 2021, 405: 124141
[47] Zheng X B, Luo X J, Zeng Y H, et al. Sources, gastrointestinal absorption and stereo-selective and tissue-specific accumulation of dechlorane plus (DP) in chicken [J]. Chemosphere, 2014, 114: 241-246
[48] Sun Y X, Luo X J, Wu J P, et al. Species- and tissue-specific accumulation of dechlorane plus in three terrestrial passerine bird species from the Pearl River Delta, South China [J]. Chemosphere, 2012, 89(4): 445-451
[49] Sun Y X, Xu X R, Hao Q, et al. Species-specific accumulation of halogenated flame retardants in eggs of terrestrial birds from an ecological station in the Pearl River Delta, South China [J]. Chemosphere, 2014, 95: 442-447
[50] Chen K H, Zheng J, Yan X, et al. Dechlorane plus in paired hair and serum samples from e-waste workers: Correlation and differences [J]. Chemosphere, 2015, 123: 43-47
[51] Yan X, Zheng J, Chen K H, et al. Dechlorane plus in serum from e-waste recycling workers: Influence of gender and potential isomer-specific metabolism [J]. Environment International, 2012, 49: 31-37
[52] Rjabova J, Bartkevics V, Zacs D. The occurrence of dechlorane plus and related norbornene-based flame retardants in Baltic wild salmon (Salmo salar) [J]. Chemosphere, 2016, 147: 210-217
[53] Gauthier L T, Letcher R J. Isomers of dechlorane plus flame retardant in the eggs of herring gulls (Larus argentatus) from the Laurentian Great Lakes of North America: Temporal changes and spatial distribution [J]. Chemosphere, 2009, 75(1): 115-120
[54] Mu oz-Arnanz J, Sáez M, Hiraldo F, et al. Dechlorane plus and possible degradation products in white stork eggs from Spain [J]. Environment International, 2011, 37(7): 1164-1168
oz-Arnanz J, Sáez M, Hiraldo F, et al. Dechlorane plus and possible degradation products in white stork eggs from Spain [J]. Environment International, 2011, 37(7): 1164-1168
[55] Zheng X B, Wu J P, Luo X J, et al. Halogenated flame retardants in home-produced eggs from an electronic waste recycling region in South China: Levels, composition profiles, and human dietary exposure assessment [J]. Environment International, 2012, 45: 122-128
[56] Gentes M L, Letcher R J, Caron-Beaudoin É, et al. Novel flame retardants in urban-feeding ring-billed gulls from the St. Lawrence River, Canada [J]. Environmental Science & Technology, 2012, 46(17): 9735-9744
[57] Mo L, Wu J P, Luo X J, et al. Dechlorane plus flame retardant in kingfishers (Alcedo atthis) from an electronic waste recycling site and a reference site, South China: Influence of residue levels on the isomeric composition [J]. Environmental Pollution, 2013, 174: 57-62
[58] Peng Y, Wu J P, Tao L, et al. Accumulation of dechlorane plus flame retardant in terrestrial passerines from a nature reserve in South China: The influences of biological and chemical variables [J]. Science of the Total Environment, 2015, 514: 77-82
[59] Chen D, Wang Y, Yu L H, et al. Dechlorane plus flame retardant in terrestrial raptors from Northern China [J]. Environmental Pollution, 2013, 176: 80-86
[60] Yu L H, Luo X J, Zheng X B, et al. Occurrence and biomagnification of organohalogen pollutants in two terrestrial predatory food chains [J]. Chemosphere, 2013, 93(3): 506-511
[61] Zeng Y H, Luo X J, Tang B, et al. Habitat- and species-dependent accumulation of organohalogen pollutants in home-produced eggs from an electronic waste recycling site in South China: Levels, profiles, and human dietary exposure [J]. Environmental Pollution, 2016, 216: 64-70
[62] de la Torre A, Alonso M B, Martínez M A, et al. Dechlorane-related compounds in Franciscana dolphin (Pontoporia blainvillei) from southeastern and southern coast of Brazil [J]. Environmental Science & Technology, 2012, 46(22): 12364-12372
[63] Ren G F, Yu Z Q, Ma S T, et al. Determination of dechlorane plus in serum from electronics dismantling workers in South China [J]. Environmental Science & Technology, 2009, 43(24): 9453-9457
[64] Siddique S, Xian Q M, Abdelouahab N, et al. Levels of dechlorane plus and polybrominated diphenylethers in human milk in two Canadian cities [J]. Environment International, 2012, 39(1): 50-55
[65] Brasseur C, Pirard C, Scholl G, et al. Levels of dechloranes and polybrominated diphenyl ethers (PBDEs) in human serum from France [J]. Environment International, 2014, 65: 33-40
[66] Zhang Y, Wu J P, Luo X J, et al. Tissue distribution of dechlorane plus and its dechlorinated analogs in contaminated fish: High affinity to the brain for anti-DP [J]. Environmental Pollution, 2011, 159(12): 3647-3652
[67] Liu Y, Luo X J, Huang L Q, et al. Halogenated organic pollutants in aquatic, amphibious, and terrestrial organisms from an e-waste site: Habitat-dependent accumulation and maternal transfer in watersnake [J]. Environmental Pollution, 2018, 241: 1063-1070
[68] Wang D G, Guo M X, Pei W, et al. Trophic magnification of chlorinated flame retardants and their dechlorinated analogs in a fresh water food web [J]. Chemosphere, 2015, 118: 293-300
[69] Tomy G T, Thomas C R, Zidane T M, et al. Examination of isomer specific bioaccumulation parameters and potential in vivo hepatic metabolites of syn- and anti-dechlorane plus isomers in juvenile rainbow trout (Oncorhynchus mykiss) [J]. Environmental Science & Technology, 2008, 42(15): 5562-5567
[70] Zeng Y H, Luo X J, Tang B, et al. Gastrointestinal absorption, dynamic tissue-specific accumulation, and isomer composition of dechlorane plus and related analogs in common carp by dietary exposure [J]. Ecotoxicology and Environmental Safety, 2014, 100: 32-38
[71] Tang B, Luo X J, Huang C C, et al. Stereoselective bioaccumulation of syn- and anti-dechlorane plus isomers in different tissues of common carp (Cyprinus carpio) [J]. The Science of the Total Environment, 2018, 616-617: 1339-1346
[72] Li Y, Yu L H, Zhu Z C, et al. Accumulation and effects of 90-day oral exposure to dechlorane plus in quail (Coturnix coturnix) [J]. Environmental Toxicology and Chemistry, 2013: 1649-1654
[73] Li Y, Yu L H, Wang J S, et al. Accumulation pattern of dechlorane plus and associated biological effects on rats after 90 d of exposure [J]. Chemosphere, 2013, 90(7): 2149-2156
[74] Li Z R, Luo X J, Luo Y L, et al. Comparative study of dechlorane plus (DP) in adult chickens and developing embryos: Stereo-selective bioaccumulation of DP in chickens [J]. Environmental Pollution, 2019, 247: 550-555
[75] Zhao L, Gong N, Mi D, et al. Kinetics of stereoselective enrichment of dechlorane plus in Ulva pertusa [J]. Chemosphere, 2014, 111: 580-586
[76] Zhang Y, Luo X J, Mo L, et al. Bioaccumulation and translocation of polyhalogenated compounds in rice (Oryza sativa L.) planted in paddy soil collected from an electronic waste recycling site, South China [J]. Chemosphere, 2015, 137: 25-32
[77] Cheng Y, Ding J, Liang X Y, et al. Fractions transformation and dissipation mechanism of dechlorane plus in the rhizosphere of the soil-plant system [J]. Environmental Science & Technology, 2020, 54(11): 6610-6620
[78] Fan Y, Chen S J, Li Q Q, et al. Uptake of halogenated organic compounds (HOCs) into peanut and corn during the whole life cycle grown in an agricultural field [J]. Environmental Pollution, 2020, 263: 114400
[79] Chabot-Giguère B, Letcher R J, Verreault J. In vitro biotransformation of decabromodiphenyl ether (BDE-209) and dechlorane plus flame retardants: A case study of ring-billed gull breeding in a pollution hotspot in the St. Lawrence River, Canada [J]. Environment International, 2013, 55: 101-108