随着工业时代的到来,环境污染问题日益严峻,人类活动正以不可阻挡的趋势加速全球环境变化[1]。为适应环境变化,生物体被迫发生改变,如从物候学特征的进化,到芳香烃的脱敏,从污染环境下DNA突变率的增加,到表观遗传效应等。随着分子生物学的发展,越来越多的证据表明环境污染会对种群的遗传变异产生直接或间接的影响[2]。通常,有毒物质可以通过2种方式对生物体产生遗传影响,体细胞效应(somatic effect)和遗传效应(heritable effect)。前者是指暴露于污染环境中导致的体细胞突变,这些突变会在组织或器官中表达,但不会传递给下一代;而后者则是有毒物质造成的可遗传的胚胎细胞的突变[3-4]。组学技术的发展与整合,也为揭示生物对环境压力的适应机制与过程提供了有力工具[5-8],指出环境污染是驱动生物适应性进化的重要因素之一。近年来,基于环境污染条件下的生物快速进化和同步进化的研究案例[9-13]不断被报道,如采矿废水、核污染和海洋溢油等环境污染条件下的生物体进化响应相继被野外与实验室研究所证实,进化毒理学这一全新的研究视角不断走入生态毒理学研究的各个方面,其理论与研究范畴也不断被丰富与深化。
随着气候变化和环境污染问题的日益加剧、分子生物学技术的迅猛发展、进化生物学理论的不断更新,进化毒理学这一交叉学科越来越受到关注。故此,本文梳理了有关进化毒理学相关研究的理论发展,归纳总结了进化毒理学的研究范畴和主要研究内容,并对这一新兴交叉学科的研究提出了几点展望,旨在为丰富生态毒理学研究提供理论支持,也为解决日益加剧的环境污染问题提供新的研究思路与途径。
1 进化毒理学的定义和理论发展(Definition and theoretical development of evolutionary toxicology)
进化毒理学是研究污染物对自然种群遗传学特征影响的一门学科[14]。进化毒理学研究运用分子生物学和种群遗传学的方法,以进化生物学和保护遗传学的理论和概念为基础,试图描述生物体如何适应污染环境,探究生物体适应环境的基本机制和原则,确定影响生物体进化过程的环境污染物并量化其影响程度[3, 14]。
20世纪50年代,2个进化生物学的经典案例被报道:家蝇(Musca domestica)对有机氯类杀虫剂滴滴涕(dichlorodiphenyltrichloroethane, DDT)的耐药性[15]和桦尺蠖(Biston betularia)的工业黑化现象[16],即发现家蝇对杀虫剂逐渐产生耐药性并证明这一耐药性是可遗传的,以及桦尺蠖为更好地拟态于工业革命造成的变黑的桦树表皮,发生浅色个体种群数量急剧下降并被深色个体种群所替代的种群动态变化和生态适应。20世纪60年代,工业黑化事件发生后,研究人员开始关注重金属污染对各生物类群的毒性影响及其产生的耐受性问题,但当时无法确定重金属耐受性是由于生理反应还是遗传适应亦或是二者共同决定的[17]。随着对环境污染认识的深入,生态毒理学研究发现,有毒物质能作为环境选择压力驱动生物进化[18-20],由人类活动造成的环境污染也是一种选择力量,可导致自然种群发生微进化(micro-evolution)[8]。微进化是指生物对持续或反复出现的压力或胁迫产生了一定的耐受性,个体间的抗压机制发生了遗传变异,拥有变异基因的个体能有效地应对和缓解环境压力,降低胁迫的不利影响或具有快速修复损伤的能力,从而利于子代的存活与繁衍,且随环境压力的增加,这些有利于生存与繁衍的基因变异会相应增加[8]。
种群中的“敏感个体”为应对污染所产生的不利影响,会在生存策略、繁殖或行为上发生改变,这些改变可在不同世代间传递,这便是生物体进化的一种表现。Bickham和Smolen[14]通过长期对多环芳烃对鱼类的暴露实验研究,发现长期暴露可引起种群跨世代的基因变异,首次提出了进化毒理学这一概念。Bickham[3]将污染物驱动的进化结果归纳为:遗传多样性改变、生存相关位点上等位基因或基因型频率改变、扩散方式或基因流改变和DNA突变率提高等4个方面。
此后,越来越多的分子研究逐步阐明了生物体对某些有毒物质耐受性的分子机制。例如,家蝇对DDT的耐受性是由于在Cyp6g1基因的启动子中插入了一个可移动的原件,该基因的过表达可能使生物体快速代谢DDT[8],从而产生耐受性。进入21世纪,特别是近10年,组学技术得到迅猛发展,进化毒理学的研究内容不断被丰富,污染胁迫与生物体基因型的改变及其潜在机制不断被揭示,基于转录组、蛋白质组和代谢组等多组学分析推动进化毒理学研究进入了一个新的时代(表1)。
2 研究范畴与内容(Scope and content)
污染物一般分为两大类:一类直接作用于DNA,改变生物体DNA的完整性并产生后续不良影响的环境污染物,被称为基因毒物(genotoxicants);另一类则是不直接与DNA相互作用,被称为非基因毒物(non-genotoxicants),此类污染物一般会降低繁殖成功率、提高遗传漂变,并驱动基因组水平的遗传多样性的变化。进化毒理学的研究主要包括以下内容:暴露环境中污染物的赋存水平,暴露生物体内的污染物的含量、富集及代谢程度,特异性生物标志物的选取,种群遗传效应与结构。Bickham[3]回顾了进化毒理学的研究内容后提出了进化毒理学的四大核心内容(图1):基因组水平遗传多样性的改变;污染物驱动下与生存相关的等位基因或基因型频率的改变;扩散方式或基因流的改变以及影响种群间遗传结构;突变率增加,导致等位基因或基因型频率的改变。本文对近年来发表的相关研究文献资料进行整理,目前进化毒理学的主要研究内容包括污染物的耐受性与相关基因表达的研究,污染环境中种群水平的遗传变异或遗传多样性的改变,基于系统发育分析的进化毒理学研究,以及环境污染驱动下的适应性进化与快速进化等。接下来对以上内容展开介绍。
表1 进化毒理学研究的理论发展过程
Table 1 Development of evolutionary toxicology

发展阶段Period时间Time主要研究内容和研究对象Content and materials参考文献References早期研究Early research20世纪50年代1950s种群特征对环境的适应性变化(例如桦尺蠖的工业黑化现象)Adaptation of a population to the change of its environment (e.g., industrial melanism of the peppered moth)Kettlewell, 1955[16]20世纪60年代晚期Late 1960s重金属污染下,许多水生种群(细菌、真菌、藻类、贝类、甲壳动物、环节动物、昆虫和脊椎动物等)的耐受性研究被大量报道,但未能阐明耐受性是由生理反应还是遗传适应造成的The resistance of a wide variety of aquatic populations (bacteria, fungi, algae, mol-luscs, crustaceans, annelids, insects and vertebrates) to the toxic effects of heavy met-al pollution has been well studied; however, it was not possible to determine if the resistance was due to physiological acclimation or genetic adaptationKlerks and Weis, 1987[17]理论的诞生Establishment of the theory20世纪90年代1990s随着分子生物学和进化生物学理论的快速发展,Bickham和Smolen首次提出“进化毒理学”的概念It was only after the development of molecular and evolutionary methodologies that the term “evolutionary toxicology” first came into use by Bickham and SmolenBickham and Smolen, 1994[14]21世纪初2000s进化毒理学研究开始将有毒物质的影响作为一种环境选择压力Studies of evolutionary toxicology began to focus on the outcomes of toxicants as a selective pressure in contaminated environmentsMeyer, 2002[21]; Noyes et al., 2009[22]快速发展Rapid development of the theory21世纪初2000s这一交叉学科被大量应用于许多物种的环境污染效应研究Since then, this interdisciplinary approach has been used to study the effects of envi-ronmental contamination on a variety of organismsSarret et al., 1998[23]; Bickham et al., 2000[24]2010年至今From 2010s to the present组学时代的到来和多种新型污染物的报道,进化毒理学展示出重要的实践作用,广泛应用于生物体对环境变化的适应性进化研究以及环境污染对生物体影响的综合评价之中With the advent of omics world and the reports of a variety of emerging contami-nants, evolutionary toxicology has been widely used in the study of adaptive evolu-tion to the environmental changes and in the comprehensive evaluation of the impact of environmental pollution on organismsOziolor et al., 2017[6]
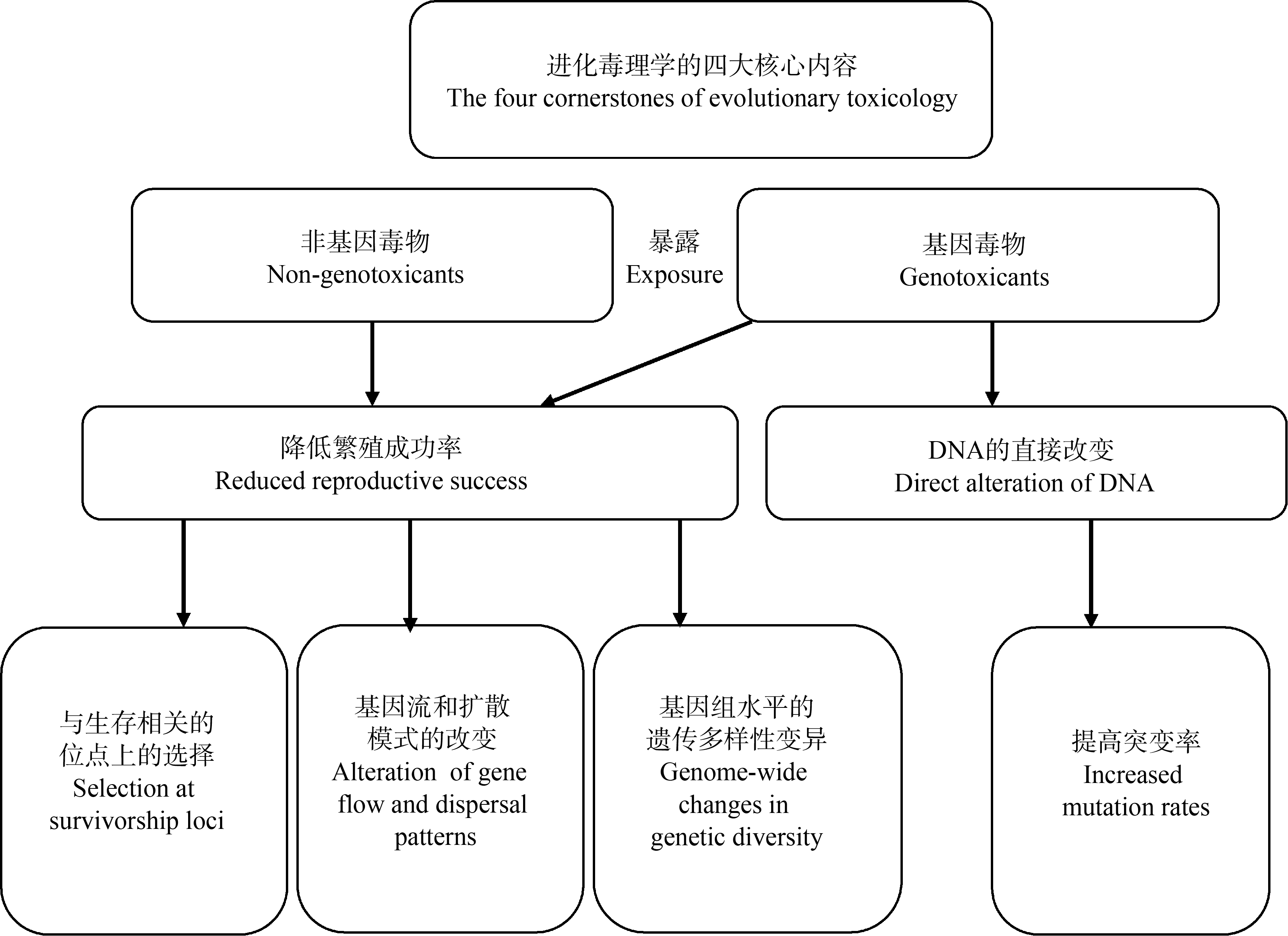
图1 进化毒理学研究的四大核心内容[3]
Fig. 1 The four cornerstones of evolutionary toxicology[3]
2.1 污染物的耐受性与基因表达
正如前文DDT的耐药性案例,实验毒理学早期阶段科学家便开展了对重金属毒性和耐性的研究[15]。但当时科学家仅关注到生物体的表型变化或对污染物产生耐受性的现象,并未明确指出其机制。随着分子生物学的发展,人们逐步意识到某些基因的改变,能够使生物体适应环境的变化,从而产生对不利环境的抵抗力。例如,具有较高光解酶活性的青蛙往往更能耐受紫外线辐射造成的影响[25],而来自高紫外线环境的青蛙种群对紫外线的DNA损伤也具有更高的抵抗力[26]。这提示我们可以利用进化的观点来解释生物体对环境污染的耐受性。目前,越来越多基因的功能在不同类群生物中得到注释和研究,这为进化毒理学研究中对有毒物质的耐受性的解释提供了重要参考。
与有毒物质耐受性相关基因在以下几种污染物中有较为深入的研究。首先,杀虫剂耐受性实验证实了某些基因存在适应性进化使得虫体对杀虫剂的抵抗力逐步提高。Poynton等[27]对一种端足类模式动物钩虾(Hyalella azteca)进行测序、组装和注释,通过对杀虫剂和其他新型污染物的暴露实验,标注了涉及解毒、氧化应激和毒物应激反应的主要基因家族。此外,相似的实验发现只有在相当高浓度的杀虫剂环境中,耐药组产生的氧化应激反应才能持续起到作用从而抵抗杀虫剂[28-29]。在黑凤蝶(Papilio polyxenes)种群中,发现细胞色素P450基因亚家族的扩增与杀虫剂中的呋喃香豆素(furancoumarin)耐受性密切相关[30]。第二类研究报道较多的污染物是重金属。金属硫蛋白是一个功能多样的大型蛋白家族,具有不同的金属结合及氧化还原能力,这些与金属结合以及运输基质的改变可能使生物体进化出对金属的耐受性,金属硫蛋白基因拷贝数的变异与重金属耐受能力相关[31]。例如,自然界许多昆虫种群金属硫蛋白的拷贝数变异极大,已被证明与重金属毒性的耐受能力相关[32];Maron等[33]发现调节柠檬酸外流的基因拷贝数的增加有助于玉米增强对铝离子的耐受能力;拟南芥通过调控金属转运蛋白和拷贝数的变异来适应不同的重金属污染环境[34-35]。最后,近年来频发的海洋漏油事件以及其他新型污染物的不断揭露,也让研究者转向更多与污染物耐受性相关的基因调控机制研究中来。例如Wirgin等[20]在暴露于多氯联苯(polychlorinated biphenyls, PCBs)中的大西洋小鳕(Microgadus tomcod)的芳香烃受体(aryl hydrocarbon receptor, AHR)基因上发现一处碱基缺失,这一现象在其他种群都未见到,这被推测是其产生PCBs耐受性的基础。这一研究也提供了受污染种群能够产生快速进化的直接证据。
2.2 遗传变异和遗传多样性的改变
遗传多样性是保护生物学研究的核心之一,生物多样性保护的关键就是保护物种的遗传多样性或进化潜能,遗传多样性的丧失一般与物种灭绝的概率成正比[36]。遗传变异是维持群落结构和生态系统功能多样性的重要来源。当一个种群最初暴露于污染环境之中时,种群数量通常会出现急剧下滑,这个过程也会导致遗传漂变以及遗传变异的丧失。例如阿塞拜疆污染工业区的沼泽蛙(Rana ridibunda)种群的单倍型多样性和核苷酸多样性相比未遭污染种群显著下降[37]。
随着分子生物学的发展,基于不同分子标记,如微卫星(SSR)、DNA指纹图谱、单核苷酸多态性位点(SNP)、简化基因组测序(RAD-seq)和全基因组测序等[4],检测污染物对种群遗传学影响的研究逐渐增多,这为评估种群遗传变异和种群动态提供了技术上的支持。Laporte等[38]通过建立RAD-seq文库对生活在不同污染环境中的欧洲鳗鲡(Anguilla anguilla)和美洲鳗鲡(A. rostrata)进行筛选,观察到由环境选择引起的多处基因位点等位基因频率的改变,表明将多基因位点选择信号、遗传变异与环境选择因子结合起来,能够共同分析基因组水平应对环境变化的选择动态。对切尔诺贝利地区50个世代的田鼠(Myodes glareolus)进行了线粒体全基因组测序,发现长期低剂量的辐射暴露可能会加速该物种的突变。环境改变造成的选择压力也可以导致单一位点发生快速进化,从而导致遗传多样性的改变[39-40]。
当然也并非所有受污染种群的遗传多样性都是下降的,具体问题还需具体分析,如种群的迁移、扩散等都会导致多样性增加[41]。另外,对于世代周期短、有效种群数量大的物种,其遗传多样性高,短期种群数量下降的遗传后果会相对减弱。例如Piňeira等[42]对石油泄漏污染区域内的萨克斯滨螺(Littorina saxatilis)进行了跟踪研究,发现污染事故发生一年半后,该螺的整体遗传多样性较未受污染地区无显著下降,推测该物种对短期污染造成的遗传多样性的丧失具有快速恢复能力。前文PCBs暴露实验中,检测大西洋小鳕基于线粒体DNA控制区序列,发现受污染种群的单倍型数量和单倍型多样性均高于其他未受污染种群,且分析种群历史动态可知种群规模与近期更新世冰期相一致,因此作者推断由于污染物而发生的大规模死亡事件不一定会导致瓶颈效应。受污染种群与对照组相比,共享单倍型也表明基因流并未受到影响[20]。以上研究也提供了新的进化毒理学研究思路:基于中性分子标记进行遗传多样性、种群结构、系统发育分析以及种群历史动态分析,有助于我们更好地理解种群遗传方面对环境污染的响应及其潜在的进化事件。
2.3 系统发生及其相关研究
系统发生(phylogeny),亦可称系统发育,是指生物形成或进化的历史。系统发生学研究物种之间的进化关系,其基本思想是比较物种的特征,认为遗传信息相似的物种在分类学上更接近。系统发育分析和比较基因组学都是识别和确认生物体分子层面响应不利环境的有效工具。受试物种之间对化学物质的敏感性的不一致直接反映在它们进化(系统发育)上的差异之中[43]。系统发育分析应用于生态毒理学研究最经典的例子就是Hahn对AHR基因家族长达20年的研究。Hahn[44]从脊椎动物和无脊椎动物的分子研究出发,综述了目前对动物物种间AHR多样性的认识和AHR信号通路的演化过程。脊椎动物和无脊椎动物的AHR基因可能有共同的祖先;而经过多拷贝和多样化,脊椎动物的AHR基因又表现出不同的适应性,多个AHR家族基因的存在可能促进了某些类群特定AHR类型的功能划分[45]。
此外,Guénard等[46]利用系统发育树来估计物种在不同系统发育水平的耐受性,发现高达83%的物种间对污染物的耐受性符合一定的系统发育结构,这证明了近缘种在应对相似的有毒物质时具有相似的耐受性。Carew等[47]通过摇蚊类和蜉蝣类的系统发育比较研究,发现污染反应具有较强的系统发育节点,即系统发育节点在物种间对环境污染物的耐受度或敏感度的区分普遍存在。以上研究也为未来污染物耐受性的风险评估提供了新思路,即通过系统发育模型来估算物种耐受性。
2.4 适应性进化与快速进化
环境的快速变化极大地改变了栖息地特征,并引入了新的压力源。这些新的环境选择压力迫使生物体做出形态上、生理上或是基因上的适应保证生存,而无法适应的物种则从这些环境中灭绝。近年来进化生物学家也拓宽了进化的概念和研究领域,将关注的进化时间尺度拉短,从过去往往预设进化是缓慢发生的,到如今实验室验证进化可能在几个世代内就能发生并对不同环境做出快速适应,进化可以在很短的时间尺度内迅速发生并能够反馈于生态特征[48]。这一观点为生态毒理学研究引入进化的观点提供了重要的理论支撑,越来越多的研究开始记录自然种群对环境变化做出的快速反应,这些适应性反应通过可塑性或自然选择作用表现出来[49]。在生态进化毒理学研究中也有越来越多的适应性进化报道。例如,Lee等[50]发现墨西哥湾漏油事件后受污染区域的真宽水蚤(Eurytemora affinis)对原油快速进化出耐受性。同样地,实验室内将耐油实验组培养约8个世代,实验组种群对原油的耐受性远高于自然种群,这表明实验组已进化出对原油的耐受性并实现了稳定的遗传。
青鳉(Oryzias latipes)作为一种重要的实验动物,对其抵抗不同化学污染物以及耐受性的产生和遗传都有着较为系统的研究。青鳉对于类二噁英化合物(dioxin-like compounds,DLCs)的毒性作用十分敏感。早期研究证明受污染种群较对照组对于DLCs的耐受性高3个数量级[51],这种耐受性被证明是可遗传的且在污染环境不同生物种群中存在着快速进化现象。Reid等[13]对采自4个城市河口重度污染区的共384尾大西洋鳉鱼(Fundulus heteroclitus)进行了全基因组测序和比较转录组分析,结果显示在污染水域生活的鳉鱼某些特定基因均发生了突变,这些突变能够阻断如二噁英、多氯联苯和重金属等有毒化学物质引起细胞死亡的信号通路。另一个实验则专注于多环芳烃(polycyclic aromatic hydrocarbons, PAHs)污染下的快速进化:长期暴露于PAHs会导致生物体进化出对PAHs的耐受性,同时降低其环境适应能力,这可能与其对外界环境应激源敏感性的增加有关。野生捕获的抗PAHs子一代幼鱼与无抗组相比,代谢需求发生了变化。这表明青鳉种群已经适应或进化到能够承受PAHs的毒性,因此改变了能量代谢或需求,这种后果可能导致耐PAHs的青鳉对其他环境和应激源的脆弱性增强[52]。
3 研究展望(Research perspective)
尽管进化毒理学这一概念自首次提出至今还不足30年的时间,但实际上以进化的角度解决生态毒理学的诸多问题已经有较长时间的实践。特别是几种“明星”污染物的耐受性研究,早已从野外调查,到实验室内机制研究,再将作用机理进一步应用于后续环境监测和风险评估中。以进化生物学的视角和方法解决生态毒理学的诸多问题,必定为日益加剧的环境问题提供新的思路。进化毒理学在生态风险评估等科学评价管理,微进化与适应成本等进化生物学重要问题,组学方法加速生态毒理学与种群遗传学的融合,以及生态进化动态理论下的毒理学与生态、进化的相互作用关系等方面具有广阔前景。
3.1 生态风险评估
进化毒理学对环境科学和管理有重要的影响,包括保护生物学、适合度成本的阐明、环境风险评估和补救等。例如,越来越多的国家标准被制定,通过受污染生物体的生理、生化特征评估环境污染的影响,这便是一些生物作为环境指示种发挥的重要作用。然而,如果没有考虑进化生物学中的适合度降低、遗传多样性下降或其他未知后果,这些生物种群或群落的污染风险很可能会被低估[53]。因此,在未来环境影响评价和生态风险评估的具体实践中,同样应从种群遗传学和进化生物学的角度考虑环境变化对遗传多样性和适合度的影响。
此外,不同世代间的遗传影响同样需要加入评估的范畴。进化毒理学将提高传统生态毒理学忽视的对体细胞效应和遗传效应的关注,填补传统生物个体生态毒理实验与化学物质对群落结构和功能多样性的影响评价之间的空白。进化毒理学关注到多个世代的长期进化及其对环境的适应,可以作出更为长久的生态风险评估[3]。例如,利用种群生态学的方法,进化毒理学可用于评估亚致死浓度条件下的跨世代(transgenerational)影响,以及评估暴露于污染物中的种群遗传变异情况[54-55]。
3.2 微进化与适应成本
过去几十年,越来越多的证据指出微进化在种群水平对化学应激源的长期反应中起到至关重要的作用[9]。能够耐受环境胁迫基因型的自然选择可能导致生物体种群水平产生可遗传的适应性进化和抵抗力的增强,从而使生物体即使在相对较高浓度的污染物环境下也能存活(又被称为微进化优势)。例如,Zhang等[56]发现一种全新的跨代遗传现象,在受到环境压力胁迫时,生物体神经元的线粒体应激通过神经到生殖腺的信号交流,诱导后代个体携带更高拷贝的线粒体DNA,进而导致机体激活线粒体未折叠蛋白反应,使得后代具有更强的抗压能力和更长的寿命。但是,这种进化优势通常也伴随着遗传多样性降低并可能造成长期的负面后果,如应对环境再次变化的能力下降。当压力源被消除时,生物体适应性也可能降低,甚至增加灭绝风险,即微进化成本[9]。上述神经元线粒体应激调控的例子,尽管后代继承了较高水平的线粒体DNA以及随之产生的线粒体未折叠蛋白反应使其具有更强的抗逆能力(包括耐热、抗病原菌感染和抗急性线粒体损伤等),但研究也发现作为代价,这些后代发育迟缓且生殖力降低[57]。即使一个种群能够在短时间内适应应激源,产生基因型的变异,但是在长期看来,不良影响也可能发生,这被称为耐受成本或适应成本[58-60]。此外,传统生态学和微进化反应之间也还缺乏定量比较的方法。因此在进化毒理学未来的研究中仍有以下问题亟待解决:何种浓度污染物造成的微进化效应可以被检测到?这些浓度与生态毒理学上的阈值浓度相比有无一致性?
当然,进化也并非都是有利的,适应新的环境压力发生进化势必要付出一定的成本损耗[19]。因此,进化毒理学另外一个关注点在于评估快速适应新环境或恶劣环境条件的短期进化(contemporary)所付出的适应成本(fitness costs)。Dutilleul等[61]以秀丽线虫(Caenorhabditis elegans)为模式动物,分别对其进行铀暴露、高盐暴露或交替处理超过22个世代,结合同质园实验(common garden experiment)和交互移植实验(reciprocal-transplant experiments),评估不同环境条件下秀丽线虫种群的进化适应成本。结果显示,秀丽线虫一旦接触到一种压力源,适应性进化就会导致其适应成本升高,相应地也获得了最基本的收益,即存活率的提高。在未来的研究中,特别是多种污染源同时作用的情况下,生物体对污染物的适应策略也值得我们进一步关注。
上述研究内容已经提示我们可以通过系统发育分析来追溯生物体对不同污染物的耐受性的进化。进化生物学理论能够帮助我们区分细微反应中的关键物种间差异,进而揭示高毒性环境下的生存问题[20, 62-63]。此外,对进化历史的关注,也可以为探究生命体对有害物质快速适应的本质提供帮助。因此,未来可尝试利用进化的观点识别对污染物特别敏感、抵抗或响应的遗传或生理机制。
3.3 组学时代下的进化毒理学研究
过去30年间,进化毒理学领域取得了巨大的进展,同时期分子生物学更是经历了跨越式发展,进化毒理学也乘分子生物学技术发展的东风,利用分子生物学方法和越来越多可获取的基因组数据资源解决生态毒理学问题。最初,传统毒理学与分子生物学的结合,大多是关注污染物驱动选择的特定情况下的适应性多态性表现与一些经典的“解毒基因”,如细胞色素P450[64]、金属硫蛋白[65]等。随着组学数据的不断完善,无需基于先前认知而偏向目标基因选择的研究方法,可以实现对污染适应的更加全面的认识[62]。基因组帮助我们更好地理解适应的机制以及种群水平的基因变异情况;转录组、蛋白质组和代谢组学则让我们更好地了解了表型与基因型的联系,并能更好地预测潜在的种群影响。
在未来,进化毒理学研究应该更好地利用各类组学方法共同探究生态毒理学中的作用机制问题,并将其应用于实际的生态风险评估中。除了一些经典的基因,与生活史相关或调控一些关键性状的基因同样应该受到关注,利用基因组数据将有助于与进化毒理学有关的靶位点的筛选并促进实验方法的多样化。转录组对于筛选污染物生物活性及揭示特定的毒性作用机制也是至关重要的。例如,转录组反映的差异特征使其成为高特异性暴露指纹,能够对诊断环境问题起到指示作用。在生理时间尺度上搜寻响应的分子途径可能是长期暴露于污染物中自然选择的目标途径,这些途径中的序列变异等可能与物种内和物种间应对环境污染的敏感性的变化有关。此外,随着二代测序的兴起,环境DNA(environmental DNA, eDNA)逐渐成为热门的生物多样性监测方法。利用eDNA扩大潜在的生物研究范围,有助于分析整个生物群落中丰度较低、濒危或难以获取标本的生物的影响[66-68]。总之,进化毒理学是一个多学科交叉、多方法汇聚和多应用的领域,它将继续发展,利用新技术来提高我们对生物种群应对污染物而产生跨代际影响的理解,增强我们对环境和生态毒理学科学的预测能力。
3.4 生态进化动态与毒理学研究
生态进化动态(eco-evolutionary dynamics)是近年来进化生物学领域逐步提出的新观点,认为进化可以短时间内完成并与生态适应相互作用[48]。进化毒理学研究也需要将生态进化动态的观点纳入普遍研究中。据报道,杀虫剂的广泛使用使得全球生态系统都已遭到杀虫剂的污染,因此有必要了解自然种群是如何应对杀虫剂以及适应性进化对生态特征的相互作用。从进化的角度看,农药的耐药性可以通过2种机制来实现:多世代的选择系耐药;表型可塑性在单一世代内诱导耐药性的产生[60, 69-71]。相比之下,后者更可能对远离农业、不经常接触杀虫剂的生物种群造成影响。虽然耐药性的产生可以提高生物接触农药的存活率,但这2种机制都可以改变生物体与其他群落内成员的相互作用关系(如竞争者、捕食者与被捕食者、寄生虫和宿主等)[69, 72-73]。因此,未来推进生态毒理学的发展,不仅要考虑生物体对污染物的进化反应如何影响某些污染物或化学品的效用,同样也需要考虑这些进化反应又是如何改变群落结构和生态系统功能等方面,即进化对生态的反馈。
全球环境污染问题的加剧,成为不同生物类群进化的重要驱动因素之一,由污染引发的生态后果日益引起人们的重视。进化毒理学主要关注生物体适应环境的基本机制和原则以及污染环境对生物体适应过程起到的重要作用,为后续环境风险评估和污染环境的修复提供了新的视角和解决方案。将进化生物学的观点同生态毒理学研究紧密结合起来,不仅是生态毒理学领域发展的必然趋势,也是全球环境变化下生物多样性保护与环境管理的必然要求,更是生态恢复即环境重建的重要保障,是直接关系到人类社会未来可持续发展的重大科学问题[74]。以进化生物学的视角和方法解决生态毒理学的诸多问题,必定为日益加剧的环境问题提供新的思路。
致谢:中国科学院水生生物研究所俞丹副研究员和湖南师范大学沈中源博士对本文进化生物学相关内容提出了宝贵意见;闽江学院魏翔莺教授对英文摘要进行了润色,在此一并致谢!
通讯作者简介:穆景利(1979—),男,博士,教授,主要研究方向为生态毒理学。
[1] Vitousek P M, Mooney H A, Lubchenco J, et al. Human domination of earth’s ecosystems [J]. Science, 1997, 277(5325): 494-499
[2] 徐立红, 张甬元, 陈宜瑜. 分子生态毒理学研究进展及其在水环境保护中的意义[J]. 水生生物学报, 1995, 19(2): 171-185
Xu L H, Zhang Y Y, Chen Y Y. The advances of molecular ecotoxicology and its significance in water environment protection [J]. Acta Hydrobiologica Sinica, 1995, 19(2): 171-185 (in Chinese)
[3] Bickham J W. The four cornerstones of evolutionary toxicology [J]. Ecotoxicology, 2011, 20(3): 497-502
[4] Shugart L R, Theodorakis C W, Bickham J W. Evolutionary Toxicology[M]// DeWoody J A, Bickham J W, Michler C H, et al. eds. Molecular Approaches in Natural Resource Conservation and Management. Cambridge: Cambridge University Press: 320-362
[5] 端正花, 朱琳. 生态毒理基因组学: 后基因组时代生态毒理学的新领域[J]. 生态毒理学报, 2007, 2(2): 136-141
Duan Z H, Zhu L. Ecotoxicogenomics: The new challenge of ecotoxicology in the post-genomic era [J]. Asian Journal of Ecotoxicology, 2007, 2(2): 136-141 (in Chinese)
[6] Oziolor E M, Bickham J W, Matson C W. Evolutionary toxicology in an omics world [J]. Evolutionary Applications, 2017, 10(8): 752-761
[7] Reid N M, Whitehead A. Functional genomics to assess biological responses to marine pollution at physiological and evolutionary timescales: Toward a vision of predictive ecotoxicology [J]. Briefings in Functional Genomics, 2015, 15(5): 358-364
[8] van Straalen N M, Janssens T K S, Roelofs D. Micro-evolution of toxicant tolerance: From single genes to the genome’s tangled bank [J]. Ecotoxicology, 2011, 20(3): 574-579
[9] Coutellec M A, Barata C. An introduction to evolutionary processes in ecotoxicology [J]. Ecotoxicology, 2011, 20(3): 493-496
[10] Coutellec M A, Barata C. Special issue on long-term ecotoxicological effects: An introduction [J]. Ecotoxicology, 2013, 22(5): 763-766
[11] Bougas B, Normandeau E, Grasset J, et al. Transcriptional response of yellow perch to changes in ambient metal concentrations: A reciprocal field transplantation experiment [J]. Aquatic Toxicology, 2016, 173: 132-142
[12] García-Balboa C, Baselga-Cervera B, García-Sanchez A, et al. Rapid adaptation of microalgae to bodies of water with extreme pollution from uranium mining: An explanation of how mesophilic organisms can rapidly colonise extremely toxic environments [J]. Aquatic Toxicology, 2013, 144-145: 116-123
[13] Reid N M, Proestou D A, Clark B W, et al. The genomic landscape of rapid repeated evolutionary adaptation to toxic pollution in wild fish [J]. Science, 2016, 354(6317): 1305-1308
[14] Bickham J W, Smolen M J. Somatic and heritable effects of environmental genotoxins and the emergence of evolutionary toxicology [J]. Infectious Diseases of Poverty, 1994, 102(Suppl.12): 25-28
[15] Harrison C M. Inheritance of resistance to DDT in the housefly, Musca domestica L. [J]. Nature, 1951, 167(4256): 855-856
[16] Kettlewell H B D. Selection experiments on industrial melanism in the Lepidoptera [J]. Heredity, 1955, 9(3): 323-342
[17] Klerks P L, Weis J S. Genetic adaptation to heavy metals in aquatic organisms: A review [J]. Environmental Pollution, 1987, 45(3): 173-205
[18] Nacci D E, Champlin D, Jayaraman S. Adaptation of the estuarine fish Fundulus heteroclitus (Atlantic killifish) to polychlorinated biphenyls (PCBs) [J]. Estuaries and Coasts, 2010, 33(4): 853-864
[19] Oziolor E M, Matson C W. Evolutionary Toxicology: Population Adaptation in Response to Anthropogenic Pollution [M]// Riesch R, Tobler M, Plath M. Extremophile FIshes. Heidelberg: Springer, Cham., 2015: 247-277
[20] Wirgin I, Roy N K, Loftus M, et al. Mechanistic basis of resistance to PCBs in Atlantic tomcod from the Hudson River [J]. Science, 2011, 331(6022): 1322-1325
[21] Meyer J N. Cytochrome P4501A (CYP1A) in killifish (Fundulus heteroclitus): Heritability of altered expression and relationship to survival in contaminated sediments [J]. Toxicological Sciences, 2002, 68(1): 69-81
[22] Noyes P D, McElwee M K, Miller H D, et al. The toxicology of climate change: Environmental contaminants in a warming world [J]. Environment International, 2009, 35(6): 971-986
[23] Sarret G, Manceau A, Cuny D, et al. Mechanisms of lichen resistance to metallic pollution [J]. Environmental Science & Technology, 1998, 32(21): 3325-3330
[24] Bickham J W, Sandhu S, Hebert P D N, et al. Effects of chemical contaminants on genetic diversity in natural populations: Implications for biomonitoring and ecotoxicology [J]. Mutation Research/Reviews in Mutation Research, 2000, 463(1): 33-51
[25] Blaustein A R, Belden L K. Amphibian defenses against ultraviolet-B radiation [J]. Evolution & Development, 2003, 5(1): 89-97
[26] Marquis O, Miaud C, Ficetola G F, et al. Variation in genotoxic stress tolerance among frog populations exposed to UV and pollutant gradients [J]. Aquatic Toxicology, 2009, 95(2): 152-161
[27] Poynton H C, Hasenbein S, Benoit J B, et al. The toxicogenome of Hyalella azteca: A model for sediment ecotoxicology and evolutionary toxicology [J]. Environmental Science & Technology, 2018, 52(10): 6009-6022
[28] Major K M, Weston D P, Lydy M J, et al. Unintentional exposure to terrestrial pesticides drives widespread and predictable evolution of resistance in freshwater crustaceans [J]. Evolutionary Applications, 2018, 11(5): 748-761
[29] Weston D P, Poynton H C, Wellborn G A, et al. Multiple origins of pyrethroid insecticide resistance across the species complex of a nontarget aquatic crustacean, Hyalella azteca [J]. Proceedings of the National Academy of Sciences of the United States of America, 2013, 110(41): 16532-16537
[30] Wen Z M, Rupasinghe S, Niu G D, et al. CYP6B1 and CYP6B3 of the black swallowtail (Papilio polyxenes): Adaptive evolution through subfunctionalization [J]. Molecular Biology and Evolution, 2006, 23(12): 2434-2443
[31] Coyle P, Philcox J C, Carey L C, et al. Metallothionein: The multipurpose protein [J]. Cellular and Molecular Life Sciences, 2002, 59(4): 627-647
[32] Maroni G, Wise J, Young J E, et al. Metallothionein gene duplications and metal tolerance in natural populations of Drosophila melanogaster [J]. Genetics, 1987, 117(4): 739-744
[33] Maron L G, Guimarães C T, Kirst M, et al. Aluminum tolerance in maize is associated with higher MATE1 gene copy number [J]. Proceedings of the National Academy of Sciences of the United States of America, 2013, 110(13): 5241-5246
[34] Hanikenne M, Talke I N, Haydon M J, et al. Evolution of metal hyperaccumulation required Cis-regulatory changes and triplication of HMA4 [J]. Nature, 2008, 453(7193): 391-395
[35] Roux M, Schwessinger B, Albrecht C, et al. The Arabidopsis leucine-rich repeat receptor-like kinases BAK1/SERK3 and BKK1/SERK4 are required for innate immunity to hemibiotrophic and biotrophic pathogens [J]. The Plant Cell, 2011, 23(6): 2440-2455
[36] Medina M H, Correa J A, Barata C. Micro-evolution due to pollution: Possible consequences for ecosystem responses to toxic stress [J]. Chemosphere, 2007, 67(11): 2105-2114
[37] van Straalen N M, Timmermans M J T N. Genetic variation in toxicant-stressed populations: An evaluation of the “genetic erosion” hypothesis [J]. Human and Ecological Risk Assessment: An International Journal, 2002, 8(5): 983-1002
[38] Laporte M, Pavey S A, Rougeux C, et al. RAD sequencing reveals within-generation polygenic selection in response to anthropogenic organic and metal contamination in North Atlantic Eels [J]. Molecular Ecology, 2016, 25(1): 219-237
[39] Baker R J, Dickins B, Wickliffe J K, et al. Elevated mitochondrial genome variation after 50 generations of radiation exposure in a wild rodent [J]. Evolutionary Applications, 2017, 10(8): 784-791
[40] Jernfors T, Kesäniemi J, Lavrinienko A, et al. Transcriptional upregulation of DNA damage response genes in bank voles (Myodes glareolus) inhabiting the Chernobyl exclusion zone [J]. Frontiers in Environmental Science, 2018, 5: 95
[41] Rolshausen G, Phillip D A, Beckles D M, et al. Do stressful conditions make adaptation difficult? Guppies in the oil-polluted environments of southern Trinidad [J]. Evolutionary Applications, 2015, 8(9): 854-870
[42] Pi eira J, Quesada H, Rolán-Alvarez E, et al. Genetic impact of the Prestige oil spill in wild populations of a poor dispersal marine snail from intertidal rocky shores [J]. Marine Pollution Bulletin, 2008, 56(2): 270-281
eira J, Quesada H, Rolán-Alvarez E, et al. Genetic impact of the Prestige oil spill in wild populations of a poor dispersal marine snail from intertidal rocky shores [J]. Marine Pollution Bulletin, 2008, 56(2): 270-281
[43] Leung M C K, Procter A C, Goldstone J V, et al. Applying evolutionary genetics to developmental toxicology and risk assessment [J]. Reproductive Toxicology, 2017, 69: 174-186
[44] Hahn M E. Aryl hydrocarbon receptors: Diversity and evolution [J]. Chemico-Biological Interactions, 2002, 141(1-2): 131-160
[45] Hahn M E, Karchner S I, Merson R R. Diversity as opportunity: Insights from 600 million years of AHR evolution [J]. Current Opinion in Toxicology, 2017, 2: 58-71
[46] Guénard G, von der Ohe P C, de Zwart D, et al. Using phylogenetic information to predict species tolerances to toxic chemicals [J]. Ecological Applications, 2011, 21(8): 3178-3190
[47] Carew M E, Miller A D, Hoffmann A A. Phylogenetic signals and ecotoxicological responses: Potential implications for aquatic biomonitoring [J]. Ecotoxicology, 2011, 20(3): 595-606
[48] Pelletier F, Garant D, Hendry A P. Eco-evolutionary dynamics [J]. Philosophical Transactions of the Royal Society of London Series B, Biological Sciences, 2009, 364(1523): 1483-1489
[49] Whitehead A. Evolutionary genomics of environmental pollution [J]. Advances in Experimental Medicine and Biology, 2014, 781: 321-337
[50] Lee C E, Remfert J L, Opgenorth T, et al. Evolutionary responses to crude oil from the Deepwater Horizon oil spill by the copepod Eurytemora affinis [J]. Evolutionary Applications, 2017, 10(8): 813-828
[51] Osterberg J S, Cammen K M, Schultz T F, et al. Genome-wide scan reveals signatures of selection related to pollution adaptation in non-model estuarine Atlantic killifish (Fundulus heteroclitus) [J]. Aquatic Toxicology, 2018, 200: 73-82
[52] Lindberg C D, Jayasundara N, Kozal J S, et al. Resistance to polycyclic aromatic hydrocarbon toxicity and associated bioenergetic consequences in a population of Fundulus heteroclitus [J]. Ecotoxicology, 2017, 26(3): 435-448
[53] di Giulio R T, Clark B W. The Elizabeth River story: A case study in evolutionary toxicology [J]. Journal of Toxicology and Environmental Health, Part B, 2015, 18(6): 259-298
[54] Oziolor E M, DeSchamphelaere K, Lyon D, et al. Evolutionary toxicology: An informational tool for chemical regulation? [J]. Environmental Toxicology and Chemistry, 2020, 39(2): 257-268
[55] van Straalen N M, Feder M E. Ecological and evolutionary functional genomics: How can it contribute to the risk assessment of chemicals? [J]. Environmental Science & Technology, 2012, 46(1): 3-9
[56] Zhang Q, Wang Z H, Zhang W F, et al. The memory of neuronal mitochondrial stress is inherited transgenerationally via elevated mitochondrial DNA levels [J]. Nature Cell Biology, 2021, 23(8): 870-880
[57] Zhang Q, Wu X Y, Chen P, et al. The mitochondrial unfolded protein response is mediated cell-non-autonomously by retromer-dependent Wnt signaling [J]. Cell, 2018, 174(4): 870-883.e17
[58] Agra A R, Soares A M V M, Barata C. Life-history consequences of adaptation to pollution. “Daphnia longispina clones historically exposed to copper” [J]. Ecotoxicology, 2011, 20(3): 552-562
[59] Fisker K V, Sørensen J G, Damgaard C, et al. Genetic adaptation of earthworms to copper pollution: Is adaptation associated with fitness costs in Dendrobaena octaedra? [J]. Ecotoxicology, 2011, 20(3): 563-573
[60] Jansen M, Coors A, Stoks R, et al. Evolutionary ecotoxicology of pesticide resistance: A case study in Daphnia [J]. Ecotoxicology, 2011, 20(3): 543-551
[61] Dutilleul M, Réale D, Goussen B, et al. Adaptation costs to constant and alternating polluted environments [J]. Evolutionary Applications, 2017, 10(8): 839-851
[62] Bélanger-Deschênes S, Couture P, Campbell P G, et al. Evolutionary change driven by metal exposure as revealed by coding SNP genome scan in wild yellow perch (Perca flavescens) [J]. Ecotoxicology, 2013, 22(5): 938-957
[63] Whitehead A, Clark B W, Reid N M, et al. When evolution is the solution to pollution: Key principles, and lessons from rapid repeated adaptation of killifish (Fundulus heteroclitus) populations [J]. Evolutionary Applications, 2017, 10(8): 762-783
[64] Zhou S F, Gao Y H, Jiang W Q, et al. Interactions of herbs with cytochrome P450 [J]. Drug Metabolism Reviews, 2003, 35(1): 35-98
[65] Posthuma L, van Straalen N M. Heavy-metal adaptation in terrestrial invertebrates: A review of occurrence, genetics, physiology and ecological consequences [J]. Comparative Biochemistry and Physiology Part C: Pharmacology, Toxicology and Endocrinology, 1993, 106(1): 11-38
[66] Bohmann K, Evans A, Gilbert M T, et al. Environmental DNA for wildlife biology and biodiversity monitoring [J]. Trends in Ecology & Evolution, 2014, 29(6): 358-367
[67] Ficetola G F, Miaud C, Pompanon F, et al. Species detection using environmental DNA from water samples [J]. Biology Letters, 2008, 4(4): 423-425
[68] Thomsen P F, Willerslev E. Environmental DNA: An emerging tool in conservation for monitoring past and present biodiversity [J]. Biological Conservation, 2015, 183: 4-18
[69] Cothran R D, Brown J M, Relyea R A. Proximity to agriculture is correlated with pesticide tolerance: Evidence for the evolution of amphibian resistance to modern pesticides [J]. Evolutionary Applications, 2013, 6(5): 832-841
[70] Fardisi M, Gondhalekar A D, Ashbrook A R, et al. Rapid evolutionary responses to insecticide resistance management interventions by the German cockroach (Blattella germanica L.) [J]. Scientific Reports, 2019, 9(1): 8292
[71] Hua J, Jones D K, Mattes B M, et al. The contribution of phenotypic plasticity to the evolution of insecticide tolerance in amphibian populations [J]. Evolutionary Applications, 2015, 8(6): 586-596
[72] Hua J, Wuerthner V P, Jones D K, et al. Evolved pesticide tolerance influences susceptibility to parasites in amphibians [J]. Evolutionary Applications, 2017, 10(8): 802-812
[73] Råberg L. How to live with the enemy: Understanding tolerance to parasites [J]. PLoS Biology, 2014, 12(11): e1001989
[74] 阎凯, 李博, 韩全保, 等. 进化生态毒理学研究进展[M]// 段昌群. 生态科学进展(第五卷). 北京: 高等教育出版社, 2010: 125-138
Yan K, Li B, Han Q B, et al. Advances in Evolutionary Ecotoxicology [M]//Duan C. Advances in Ecological Sciences (Vol. 5). Beijing: Higher Education Press, 2010: 125-138 (in Chinese)