羟基多氯联苯(hydroxylated polychlorinated biphenyls, OH-PCBs)是典型环境持久性污染物多氯联苯(polychlorinated biphenyls, PCBs)在生物体内的主要代谢产物,属于第二代环境持久性污染物[1]。 环境中广泛存在的PCBs 在生物体内经P450 单加氧化酶系统氧化氧化芳烃等中间代谢产物介导而产生OH-PCBs[2-4]。 另有证据表明,具有半挥发性的PCBs 在迁移过程中能够与大气中的羟基自由基发生反应形成 OH-PCBs[5]。 环境中的 OH-PCBs 经过雨水冲刷、大气沉降等作用,相当一部分进入到水环境中[6]。 各种水产品作为水环境中的主要栖息生物,已经成为OH-PCBs 等污染物在水环境中的蓄积库之一。 目前,在多个国家和地区开展的调查中均发现存在水产品被OH-PCBs 污染的迹象[7-9]。
我国是水产品贸易大国,据统计,2019年全国水产品总产量达6 480.36 万t,人均水产品摄入量也在逐年稳步增加[10]。 水产品已经成为人体暴露OHPCBs 等二代持久性污染物的主要途径之一[11]。 近几十年来,很多学者针对水产品摄入量较高地区的人群做了一系列调查。 在北美洲的加拿大不同沿海城市、美国加利福尼亚州居民体内均检测到OHPCBs 的存在[12-14];欧洲国家开展的一些调查发现,人体内OH-PCBs 的含量与鱼类摄入量及年龄呈正相关[15-16];东亚地区的水产品摄入同样导致OHPCBs 在当地居民体内蓄积,并发现血液中的OHPCBs 可能通过母乳传递对子代健康产生危害[11,17]。随着相关调查研究的推进,研究人员发现以鱼类等为主食的高等野生动物体也受到了不同程度的污染[18-20]。 研究表明,长期蓄积在生物体内的 OHPCBs 能够引起一系列的毒性效应,包括(抗)雌激素效应[21-22]、甲状腺激素(thyroid hormone, TH)分泌紊乱[23-24]、神经发育障碍[25]以及基因毒性[26]等危害。因此,对通过水产品摄入途径暴露于OH-PCBs 的风险进行评价尤为重要。 然而,截止到目前,以OHPCBs 等二代持久性污染物为暴露物质,探索其通过日常水产品摄食暴露后在生物体内的蓄积、分布及排泄等的研究鲜有报道。
PCB101 作为环境中常检出的一种PCBs,是7种指示性PCBs 之一[27-28]。 本课题组在前期的研究中发现,PCB101 在生物体内可代谢生成3-OHPCB101、4-OH-PCB101,并在水环境中多种水生生物体内也发现了这2 种OH-PCB101 的存在[9,29]。 本实验以小白鼠为研究对象,向鲫鱼可食性组织中添加OH-PCB101 后制备成暴露实验投喂饲料,模拟动物通过摄入水产品暴露于OH-PCBs 的过程。 本研究初步揭示环境中的OH-PCBs 通过食物链传递至哺乳动物体内后在各组织蓄积、分布及排泄规律,为OH-PCBs 代谢转化、毒理效应的深入探索及水产品食用安全控制提供基础数据支撑。
1 材料与方法(Materials and methods)
1.1 仪器与试剂
1.1.1 实验仪器
DOP-B 高通量组织研磨仪(上海万柏生物科技公司,中国);B5510E-MT 超声波清洗机(美国BRANSON 公司);Mili-Q 超纯水系统(美国Millipore公司);日立Hitachi* RX 系列多用途冷冻离心机(日本Hitachi 公司);BUCHI R-100 旋转蒸发仪(瑞士BUCHI 公司);Talboys EOFO-945616 数显型旋涡混合器(美国Talboys 公司);XYC-BDM-24 全自动氮空吹扫浓缩仪(上海析友分析技术有限公司,中国);SPE 硅胶柱(500 mg/6 mL,美国 Agela Technologies公司);Supelco 12 管固相萃取装置(美国SUPELCO公司);QM-2SP100 行星式球磨机(南京莱步科技实业有限公司,中国);Labconco Freezone-Centrivap 冷冻干燥机(美国 Labconco 公司);JA12002 天平(上海精天电子仪器有限公司,中国);DB-17MS 柱(美国 Agilent 公司);Thermo TSQ Quantum GC 气相色谱-串联质谱仪(美国 Thermo Fisher Scientific 公司)。
1.1.2 实验试剂
3-OH-2,2’,4’,5,5’-PCB101(100 μg·mL-1,纯度100%)和 4-OH-2,2’,4’,5,5’-PCB101(100 μg·mL-1,纯度99.6%)均购自美国 AccuStandard 公司;正己烷、二氯甲烷(色谱纯,美国Tedia 公司);浓硫酸、浓盐酸(优级纯,中国国药集团)。
1.2 暴露实验
1.2.1 实验动物
本实验所用模式生物为鼠龄8 周的ICR 系雄性小鼠20 只(上海实验动物研究中心,体质量(30±3) g)。 新购进小鼠4 ~5 只分为一笼,在实验室条件下(光照周期12 h,温度(20±2) ℃,湿度(50±10)%)饲养一周后开始进行暴露实验,同时设置空白对照组。每日清理饲养环境并更换鼠笼垫料,同时观察记录小鼠健康情况。
1.2.2 加标饲料的制备
从千岛湖采集的鲜活鲫鱼,去鳞去皮,取可食肉组织切碎后经真空冷冻干燥,置于球磨仪中研磨制成鱼粉。 准确称取后向每克鱼粉中添加1 mL 浓度为 1 000 ng·mL-1的 3-OH-PCB101 和 4-OH-PCB101等量混合标准溶液,持续搅拌均匀,使得鱼肉粉中2种 OH-PCB101 的含量为 1 000 ng·g-1。 以该加标鱼粉为原料,制成颗粒状加标饲料备用。 同时用未加标鱼粉以相同的步骤制作饲料,投喂空白对照组小鼠。 暴露实验前,对加标饲料和空白鱼肉饲料进行定性、定量分析,以确保暴露浓度水平,扣除鱼肉本底值干扰。
1.2.3 实验方案
实验设定平均每只小鼠每日进食5 g。 为了模拟哺乳动物通过摄入水产品暴露OH-PCBs 的真实情况,设定小鼠每天摄入的鲫鱼肉加标饲料的量占摄食总量的约10%,即平均每只小鼠每天摄入0.5 g的加标饲料和4.5 g 普通饲料,使得小鼠每日通过正常摄食的暴露量为16.7 μg·kg-1(小鼠的平均体质量按30 g 计算)。 每天早上8:00 先投喂加标饲料,观察鼠笼中的加标饲料被食尽后,再投喂普通饲料,普通饲料分早晚2 次进行投喂,向空白对照组投喂的鱼肉饲料和普通饲料与暴露组同步进行。
1.2.4 样品的采集与制备
投喂加标饲料后,分别在暴露实验的第12、24、72 和168 小时(次日投喂加标饲料之前)进行取样,以确定小鼠首次经摄食暴露后经过白天(实验室条件)一天正常摄食和活动及一段时间后OH-PCBs 在其体内蓄积分布及排泄情况。 每次取3 只小鼠作为平行,取样前2 h 将小鼠置于底部镂空的鼠笼中以便收集小鼠粪便。 眼部取血,解剖后取脑、心、肺、肝、胃、脾、小肠、大肠、肾、睾丸和肌肉共11 种组织,取样后分别将组织研磨匀浆,-40 ℃保存。 在暴露实验开始前和结束后,取空白对照组样品以排除背景干扰。
1.2.5 样品前处理与分析
本实验采用GC-MS/MS 对样品进行定性和定量分析,前处理过程和分析的仪器条件及参数均参照之前建立的方法进行[29]。
2 结果(Results)
2.1 样品中2 种OH-PCB101 的鉴定
本研究采用色谱保留时间结合二级质谱特征碎片离子的相对丰度对样品中2 种OH-PCB101 进行鉴定。 根据本课题组前期的研究成果,OH-PCB101经硅烷化试剂衍生后[30],在SRM 模式下确定3-OHPCB101 的特征子离子为m/z 399 和m/z 364,4-OHPCB101 的特征子离子为 m/z 399 和 m/z 363[29]。 2种OH-PCB101 在100 ng·g-1 的加标水平下的色谱图及其特征子离子质谱图如图1 所示。
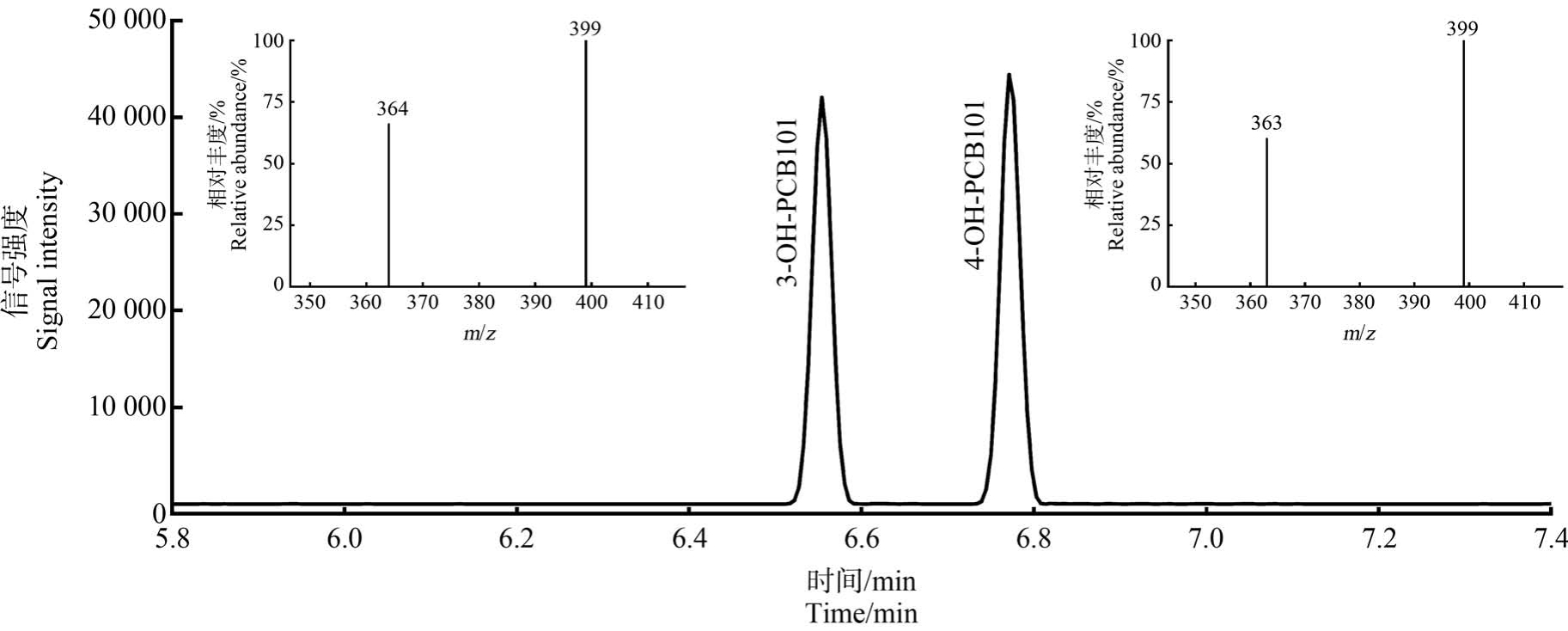
图1 2 种OH-PCB101 在100 ng·g-1的加标水平下肝脏的色谱图及其特征子离子质谱图
Fig.1 Chromatograms of two OH-PCB101 in liver with spiked levels at 100 ng·g-1 and their characteristic product ion mass spectra
以暴露24 h 的肝脏样品为例,如图2 所示,肝脏中检测到的2 种物质的保留时间分别为6.56 min和6.78 min,与3-OH-PCB101、4-OH-PCB101 的标准物质的保留时间完全一致。 肝脏中检出的物质1 对应的特征子离子m/z 364、m/z 399 的相对丰度分别为60%、100%,与3-OH-PCB101 标准物质相比(m/z 364、m/z 399 的相对丰度分别为 66%、100%),其相对丰度之差为6%(<10%),根据欧盟EU: 2002/657/EC[31]和EU:SANCO/12571/2013[32]关于采用色谱和质谱数据对物质进行鉴定的规定,确定物质1 即为3-OH-PCB101。 而肝脏中检出的物质2 对应的特征子离子m/z 363、m/z 399 的相对丰度分别为67%、100%,与 4-OH-PCB101 标准物质相比(m/z 363、m/z 399 的相对丰度分别为60%、100%),其相对丰度之差为 7%(<10%),确定物质 2 为 4-OH-PCB101。 按照该方法依次对不同样品中检出的2 种OH-PCB101进行确认,在小鼠的血液、粪便以及所取的11 种组织中均发现有不同程度的OH-PCB101 的蓄积。 采用同样的方法对未进行冷冻干燥的鲫鱼肉及空白对照组小鼠进行了分析,2 种OH-PCB101 均未检出。
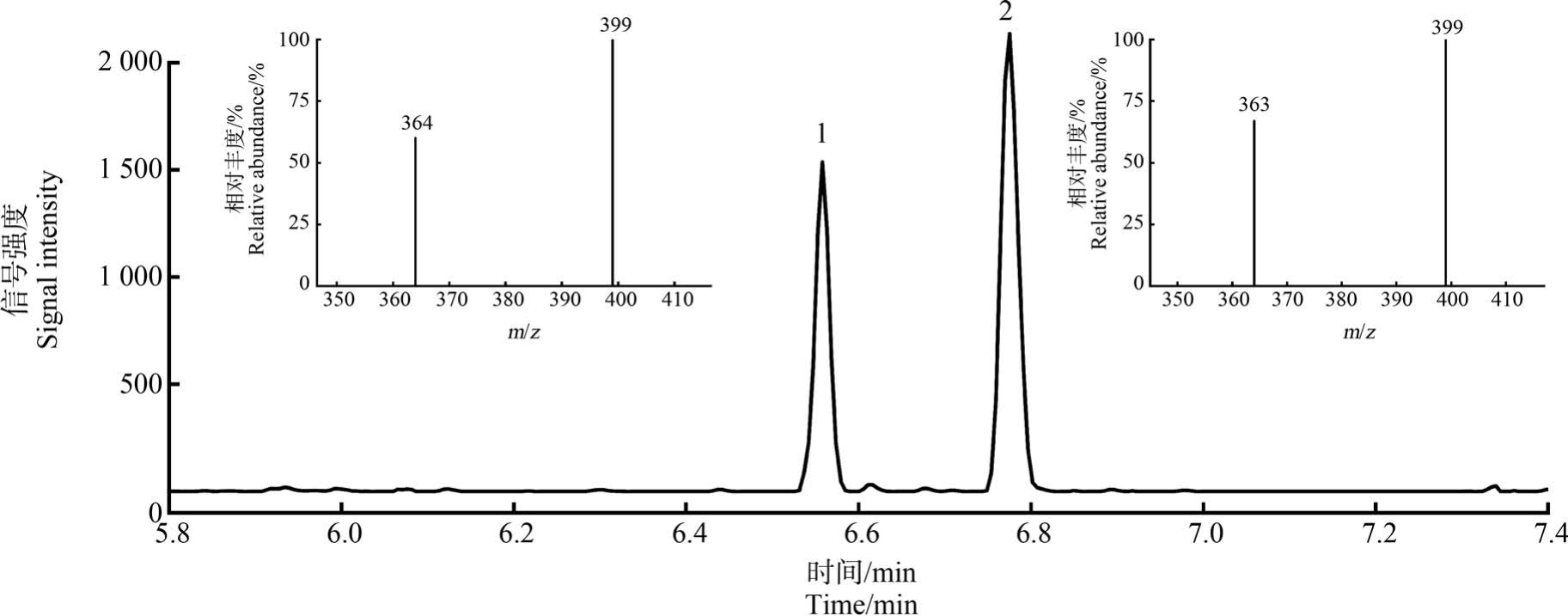
图2 暴露24 h 肝脏中检测到的2 种物质的色谱图及其特征子离子质谱图
Fig.2 Chromatograms of the two substances detected in the liver after 24 h of exposure and their characteristic product ion mass spectra
2.2 OH-PCB101 在不同组织、器官中的蓄积分布
分析12 h 所取的小鼠样品发现,3-OH-PCB101和4-OH-PCB101 在粪便中的检出浓度最高(分别为20.4 ng·g-1和 20.6 ng·g-1),其次依次为胃、大肠、脾、肝和小肠。 心脏中的4-OH-PCB101(4.34 ng·g-1)的浓度明显高于3-OH-PCB101(0.70 ng·g-1),而2 种OH-PCB101 在肾、血液、肌肉和睾丸中的浓度依次降低。 在脑组织中只有4-OH-PCB101 被检出,浓度为 1.11 ng·g-1。
在首次投喂24 h 后,相比于12 h 的样品,2 种OH-PCB101 的蓄积浓度在胃中的浓度有所降低,小肠中的浓度变化不明显,大肠中的浓度升高,粪便中的检出浓度达到最高(分别为48.51 ng·g-1 和45.78 ng·g-1),这可能说明OH-PCB101 进入小鼠体内后,一部分OH-PCB101 经消化道不断向体外迁移,并通过粪便排出体外。 同时肝、肺中仍有明显蓄积,脑、肾、睾丸、肌肉及其血液中的含量水平变化不明显。 心、脾中分别只有4-OH-PCB101、3-OH-PCB101检出。
实验进行到72 h 时,2 种OH-PCB101 在粪便中的浓度仍是所检样品中的最高值(36.49 ng·g-1),并且主要在脾、心、胃和大肠中产生蓄积(4.39 ~8.08 ng·g-1)。 小肠和肝中 2 种 OH-PCB101 的蓄积浓度有所降低,肾、血液、肌肉和睾丸的含量变化(0.65 ~1.57 ng·g-1)不明显。
在第168 小时采集的样品中,OH-PCB101 在胃、小肠、大肠和粪便中的蓄积浓度(21.40 ~61.83 ng·g-1)均显著高于其他组织(图 3)。 肝、睾丸中的蓄积浓度升高,肺、肾、心和血液中的浓度持续下降。不同暴露时间下3-OH-PCB101 和4-OH-PCB101 在小鼠各组织中的蓄积浓度如图4 所示。
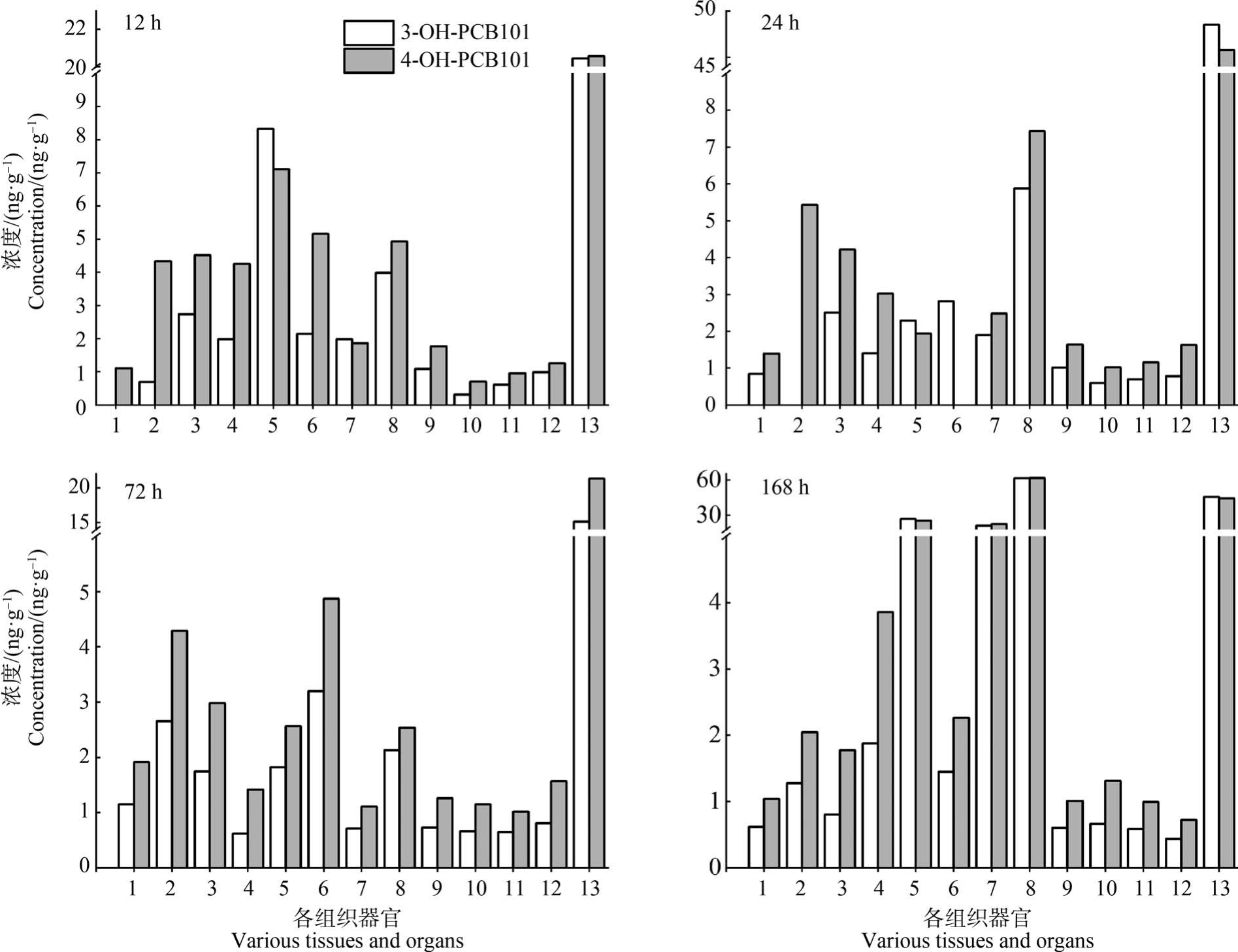
图4 不同暴露时间下3-OH-PCB101 和4-OH-PCB101 在各组织及粪便中的浓度
注:1. 脑;2. 心;3. 肺;4. 肝;5. 胃;6. 脾;7. 小肠;8. 大肠;9. 肾;10. 性腺;11. 肌肉;12. 血液;13. 粪便。
Fig.4 The concentration of 3-OH-PCB101 and 4-OH-PCB101 in various tissues and feces at different exposure times
Note:1. Brain;2. Heart;3. Lung;4. Liver;5. Stomach;6. Spleen;7. Small intestine;8. Large intestine;9. Kidney;10. Gonad;11. Muscle;12. Blood;13. Feces.
由图3 可知,在前72 h,胃、小肠和大肠组织中的蓄积浓度变化较为稳定,而在24 h 粪便样品中检测到2 种 OH-PCB101 的浓度显著高于12 h 和72 h。 与72 h 的样品相比,OH-PCB101 在脑和脾中的蓄积浓度随着时间的延长而有所降低。 分析所有的样品数据发现,OH-PCB101 在脑、血液和肌肉等样品中的浓度相对较低。 以3-OH-PCB101 为例,对小鼠体内主要的消化吸收器官、代谢器官及粪便中的含量进行了对比(图5),以初步展示OH-PCB101 经口进入小鼠体内后的归趋。 从图5 能够清楚地看出3-OH-PCB101 主要蓄积在胃、肠等消化组织器官和粪便中,其他各组织中的蓄积浓度所占比率相对较小。 并且随着暴露时间的增加,蓄积在肝脏中的OH-PCB101 的浓度虽未下降,但其在几种组织中的相对比率在逐渐减小。
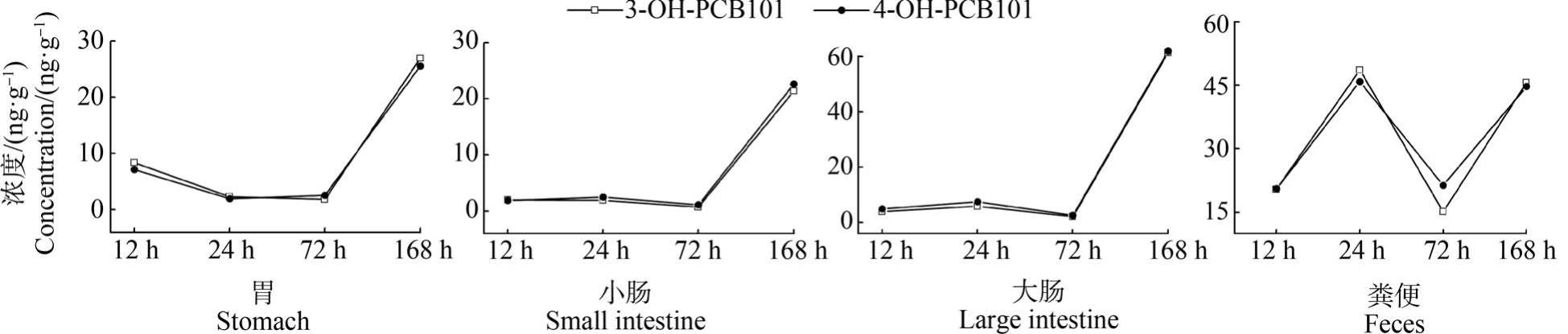
图3 消化组织器官及粪便中3-OH-PCB101 和4-OH-PCB101 的浓度-时间曲线
Fig.3 Concentration-time curves of 3-OH-PCB101 and 4-OH-PCB101 in digestive organs and feces
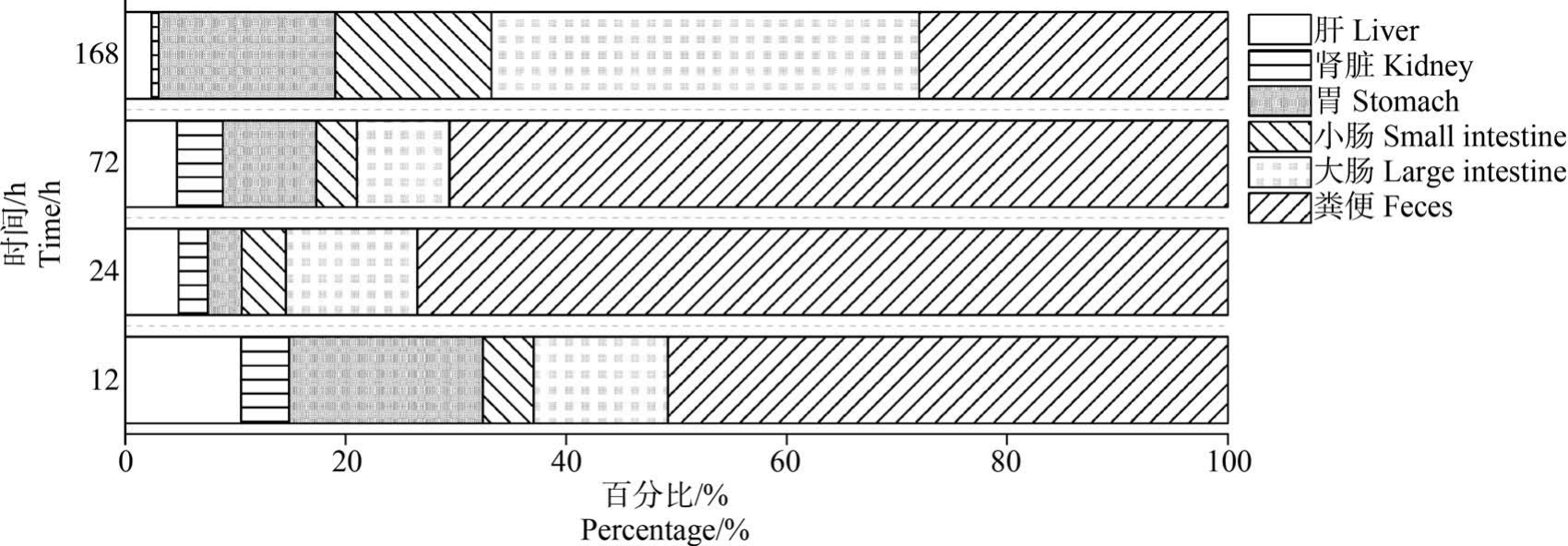
图5 不同暴露时间3-OH-PCB101 在各个组织及粪便中的含量百分比
Fig.5 The percentage of 3-OH-PCB101 in each tissue and feces at different exposure times
3 讨论(Discussion)
暴露实验期间,3-OH-PCB101 和4-OH-PCB101随着加标饲料被摄入到小鼠体内,首先进入胃、肠等消化器官。 根据暴露前24 h 样品的检测结果,小鼠在首次摄食加标饲料后随着时间的推移,OHPCB101 由消化道前段逐渐向后段迁移,随着胃组织中的含量下降,OH-PCB101 在小肠和大肠中的蓄积水平不断增大,通过粪便排出体外的量也在增加。与此同时,发现OH-PCB101 在胃、小肠和大肠中的蓄积浓度在不同时间的浓度变化规律基本一致,且3-OH-PCB101 和 4-OH-PCB101 的浓度无明显差异。 然而,在24 h 的粪便样品中的浓度显著高于12 h 和72 h 的粪便样品,这可能是由于初次暴露后,经过12 h 蓄积在小鼠消化道中的OH-PCB101 少量随着粪便被排出;到了24 h,一方面消化道中未被吸收的OH-PCB101 继续被排泄,与此同时,进入血液循环的部分OH-PCB101 可能随着新陈代谢被重新排出体外。 在持续暴露3 d 后(72 h),蓄积在小鼠体内的OH-PCB101 与随着粪便被排泄的量可能达到相对平衡状态而有所下降。 在168 h 的消化吸收器官样品中OH-PCB101 的蓄积量显著增大,在对应时间收集的粪便中的检出浓度同样显著增大。 相比于实验前3 次采集的样品,第168 小时的小鼠经过7 d的持续摄食暴露,可能是直接导致胃、肠及粪便中检出浓度增大的重要原因。
OH-PCBs 分子中—OH 的存在使得分子呈弱酸性,在胃酸及胆酸溶液中能够稳定存在。 胆汁中的胆盐分子可以把脂肪乳化成许多小的脂肪微粒,激活胰脂肪酶,促进脂肪的吸收与消化,并且能和脂肪酸结合成水溶性复合物,以促进这些亲脂性的羟基代谢产物的吸收和蓄积。 肝脏中的OH-PCB101 可能随着胆汁的分泌被储存并稳定存在于胆囊,再经胆汁被排入肠道中,一部分在肠道中被重新吸收,经门静脉返回肝脏(肝肠循环),另一部分则通过肠道随着粪便排出体外,导致肠道及粪便中的浓度增加。 以上现象说明,OH-PCB101 通过摄食暴露进入到生物体内,其中一部分会在短时间内随着体循环被排出体外。 与该结论相似的是,Ohta 等[33]研究发现PCB187 在大鼠体内经代谢产生的主要代谢产物4’-OH-PCB178,大部分也能随着粪便被排出体外。
分析所有样品的数据发现,3-OH-PCB101 和4-OH-PCB101 在心、肺和脾等含血量较高的组织中有较多的蓄积。 同时发现,2 种OH-PCB101 在消化器官及排出的粪便中的浓度没有明显差异,但在血液及脑、心、肺、肝、脾、肾、睾丸及肌肉组织中,4-OHPCB101 的检出浓度始终高于3-OH-PCB101,且在肝中差异尤为明显。 OH-PCB101 经血液循环被运送至肝脏,一方面,4-OH-PCB101 具有与三碘甲状腺原氨酸的相似结构(图6),可能与血液中的TH 受体等蛋白结合持留在血液及各组织中[34-35],而3-OH-PCB101 由于结构的不同更易被排出体外;另一方面,肝脏作为代谢外源性物质的主要器官,由于2种 OH-PCB101 结构上存在差异, 推测 3-OHPCB101 可能在肝脏中被P450 酶催化的效率更高,发生了进一步的代谢转化,致使3-OH-PCB101 在多个组织中的含量相对较低。 3-OH-PCB101 和4-OHPCB101 在生物体内是否会发生进一步的代谢转化及其代谢机制及通路有待进一步研究。
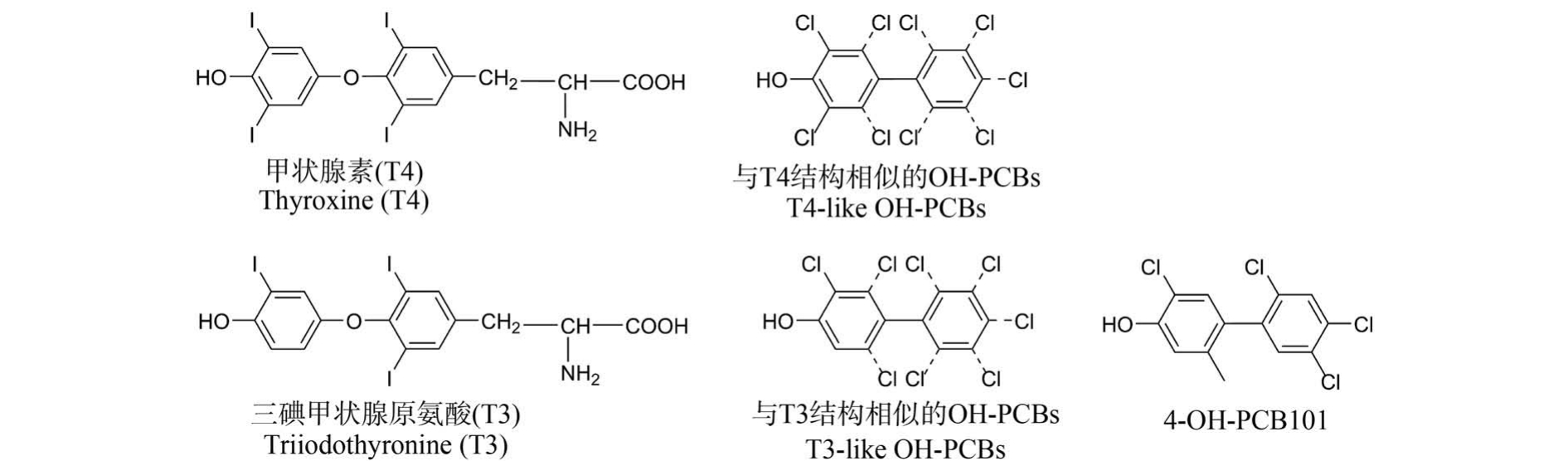
图6 甲状腺素与三碘甲状腺原氨酸的结构式及具有相似结构的OH-PCBs 的结构式对比图
Fig.6 Comparison of the structural formulas of thyroxine, triiodothyronine and OH-PCBs with similar structures
在本研究中,小鼠首次经摄食暴露12 h 后的脑组织中即发现有4-OH-PCB101 的存在。 有证据显示,OH-PCB101 能通过与TH 转运蛋白结合随血液循环运送至大脑[23,36-37],与OH-PCBs 导致的TH 紊乱及神经行为异常有关[25,36]。 Miyazaki 等[38]发现OH-PCBs 能够通过将TH 受体/视黄醇X 受体二聚体与TH 反应元件的部分分离而减弱TH 受体介导的转录,这说明大脑可能是OH-PCBs 的作用靶点。本实验所采集的不同暴露时间的脑组织中,OHPCB101 的浓度水平相对稳定,这可能与OH-PCBs结合的蛋白在血脑屏障两侧达到某种平衡状态有关。 心脏和肺中的浓度与血液中的蓄积量呈正相关,随着时间的延长均呈现下降趋势。 暴露实验前期,肝脏中的蓄积浓度较高,并随时间呈现逐渐降低的趋势,在168 h 的样品中检测到蓄积浓度增大,与消化器官中的浓度变化保持一致。 根据已有的研究,PCBs 等外源化合物在生物体内的代谢转化主要发生在肝脏,随着体内外源化合物浓度的增加,肝脏的负荷也在加重[2,39]。 在本研究中,小鼠通过摄食暴露于OH-PCB101,有可能在其体内发生了进一步的代谢转化,这需要开展进一步的实验加以证明。 肾脏中的浓度在随着时间的变化始终保持下降趋势,推测OH-PCB101 通过肾脏等循环系统存在不断向体外排出的生理过程。 OH-PCBs 由于—OH 的存在增大了分子的极性,部分蓄积在肾脏中的 OHPCB101 随着体液循环被逐渐排出体外[40]。 与肾脏中的蓄积浓度变化规律相反,暴露期间小鼠睾丸中的蓄积浓度始终保持着增长的状态,蓄积在睾丸组织中的OH-PCBs 可能与其导致的(抗)雌激素效应及生殖毒性有关。 睾丸组织中富含脂肪,相比于母体化合物,OH-PCBs 的亲脂性在—OH 介入后虽有下降,但部分仍能长期滞留在生物体内[41]。
综上所述,OH-PCB101 通过摄入水产品进入生物体后,一部分在胃、肠等消化器官中蓄积或随粪便排出体外,另一部分随营养元素进入血液循环,少量分布在肌肉和睾丸组织中,其余部分可能更倾向于蓄积在心、肺和脾等血液含量较高的组织并可透过血脑屏障进入脑组织。 由此初步推断ICR 雄性小鼠各组织对OH-PCB101 的蓄积能力大小依次为:大肠>胃>小肠>脾≈肺>心>肝>肾>血液≈脑>肌肉≈睾丸。 蓄积过程可能因OH-PCBs 的结构特异性导致与蛋白结合能力及极性强弱存在差异,从而对其在组织中的特异性分布产生影响。 另外,蓄积在生物体内的OH-PCBs 等二代持久性有机污染物,是否会被进一步代谢转化、产生何种毒性效应以及是否会向子代传递并危害子代健康,都是需要研究的科学问题。
[1]Letcher R J, Klasson-Wehler E, Bergman A. Methyl Sulfone and Hydroxylated Metabolites of Polychlorinated Biphenyls. Volume 3 Anthropogenic Compounds Part K[M]. Berlin: Springer Berlin,2000:315-359
[2]Wu X N,Zhai G S,Schnoor J L,et al.Atropselective disposition of 2,2’,3,4’,6-pentachlorobiphenyl(PCB 91)and identification of its metabolites in mice with liver-specific deletion of cytochrome P450 reductase [J]. Chemical Research in Toxicology,2020,33(6):1328-1338
[3]Uwimana E, Ruiz P, Li X S, et al. Human CYP2A6,CYP2B6, and CYP2E1 atropselectively metabolize polychlorinated biphenyls to hydroxylated metabolites [J]. Environmental Science & Technology, 2019, 53(4): 2114-2123
[4]Dhakal K, Gadupudi G S,Lehmler H J,et al.Sources and toxicities of phenolic polychlorinated biphenyls (OHPCBs) [J]. Environmental Science and Pollution Research International,2018,25(17):16277-16290
[5]Liao Z H, Zeng M, Wang L M. Atmospheric oxidation mechanism of polychlorinated biphenyls (PCBs) initiated by OH radicals [J]. Chemosphere,2020,240:124756
[6]Marek R F, Martinez A, Hornbuckle K C. Discovery of hydroxylated polychlorinated biphenyls (OH-PCBs) in sediment from a Lake Michigan waterway and original commercial aroclors [J]. Environmental Science & Technology,2013,47(15):8204-8210
[7]Nomiyama K, Uchiyama Y, Horiuchi S, et al. Organohalogen compounds and their metabolites in the blood of Japanese amberjack(Seriola quinqueradiata)and scalloped hammerhead shark (Sphyrna lewini) from Japanese coastal waters [J]. Chemosphere,2011,85(3):315-321
[8]Buckman A H, Brown S B, Small J, et al. Role of temperature and enzyme induction in the biotransformation of polychlorinated biphenyls and bioformation of hydroxylated polychlorinated biphenyls by rainbow trout (Oncorhynchus mykiss) [J]. Environmental Science & Technology,2007,41(11):3856-3863
[9]王帅, 史永富. 电子废物拆解区羟基多氯联苯的分布及传递特征研究[J]. 安徽农业科学, 2019, 47(16): 68-72,77
Wang S, Shi Y F. Study on distribution and transmitting characteristics of hydroxyl polychlorinated biphenyls in E-waste dismantling area [J]. Journal of Anhui Agricultural Sciences,2019,47(16):68-72,77 (in Chinese)
[10]农业农村部渔业渔政管理局, 全国水产技术推广总站,中国水产学会.2020 中国渔业统计年鉴[M]. 北京: 中国农业出版社,2020:144
[11]Fujii Y, Nishimura E, Kato Y, et al. Dietary exposure to phenolic and methoxylated organohalogen contaminants in relation to their concentrations in breast milk and serum in Japan [J]. Environment International,2014,63:19-25
[12]Sandau C D, Ayotte P, Dewailly E, et al. Analysis of hydroxylated metabolites of PCBs (OH-PCBs) and other chlorinated phenolic compounds in whole blood from Canadian Inuit [J].Environmental Health Perspectives,2000,108(7):611-616
[13]Sandau C D, Ayotte P, Dewailly E, et al. Pentachlorophenol and hydroxylated polychlorinated biphenyl metabolites in umbilical cord plasma of neonates from coastal populations in Québec [J].Environmental Health Perspectives,2002,110(4):411-417
[14]Park J S, Petreas M, Cohn B A, et al. Hydroxylated PCB metabolites (OH-PCBs) in archived serum from 1950-60s California mothers: A pilot study [J]. Environment International,2009,35(6):937-942
[15]Sjödin A, Hagmar L, Klasson-Wehler E, et al. Influence of the consumption of fatty Baltic Sea fish on plasma levels of halogenated environmental contaminants in Latvian and Swedish men [J]. Environmental Health Perspectives,2000,108(11):1035-1041
[16]Rylander C, Lund E, Frøyland L, et al.Predictors of PCP,OH-PCBs, PCBs and chlorinated pesticides in a general female Norwegian population [J]. Environment Interna-tional,2012,43:13-20
[17]Haraguchi K, Ito Y, Takagi M, et al. Levels, profiles and dietary sources of hydroxylated PCBs and hydroxylated and methoxylated PBDEs in Japanese women serum samples [J]. Environment International,2016,97:155-162
[18]Nomiyama K,Murata S,Kunisue T,et al.Polychlorinated biphenyls and their hydroxylated metabolites (OH-PCBs)in the blood of toothed and baleen whales stranded along Japanese coastal waters [J]. Environmental Science &Technology,2010,44(10):3732-3738
[19]Sandala G M, Sonne-Hansen C, Dietz R, et al.Hydroxylated and methyl sulfone PCB metabolites in adipose and whole blood of polar bear (Ursus maritimus) from East Greenland [J]. Science of the Total Environment, 2004,331(1-3):125-141
[20]Helgason L B, Arukwe A, Gabrielsen G W, et al. Biotransformation of PCBs in Arctic seabirds: Characterization of phase Ⅰ and Ⅱ pathways at transcriptional,translational and activity levels [J]. Comparative Biochemistry and Physiology Part C: Toxicology & Pharmacology,2010,152(1):34-41
[21]Wang T, Cook I, Leyh T S. The molecular basis of OHPCB estrogen receptor activation [J].Journal of Biological Chemistry,2021,296:100353
[22]Grimm F A, Hu D F, Kania-Korwel I, et al. Metabolism and metabolites of polychlorinated biphenyls [J]. Critical Reviews in Toxicology,2015,45(3):245-272
[23]Nomiyama K, Tsujisawa Y, Ashida E, et al.Mother to fetus transfer of hydroxylated polychlorinated biphenyl congeners (OH-PCBs) in the Japanese macaque (Macaca fuscata): Extrapolation of exposure scenarios to humans [J].Environmental Science & Technology, 2020, 54 (18):11386-11395
[24]Takaguchi K, Nishikawa H,Mizukawa H,et al.Effects of PCB exposure on serum thyroid hormone levels in dogs and cats [J].Science of the Total Environment,2019,688:1172-1183
[25]Haijima A, Lesmana R, Shimokawa N, et al. Differential neurotoxic effects of in utero and lactational exposure to hydroxylated polychlorinated biphenyl (OH-PCB 106) on spontaneous locomotor activity and motor coordination in young adult male mice [J]. The Journal of Toxicological Sciences,2017,42(4):407-416
[26]Tehrani R, van Aken B. Hydroxylated polychlorinated biphenyls in the environment: Sources, fate, and toxicities[J]. Environmental Science and Pollution Research International,2014,21(10):6334-6345
[27]Barmpas M, Vakonaki E, Tzatzarakis M, et al. Organochlorine pollutants’ levels in hair, amniotic fluid and serum samples of pregnant women in Greece.A cohort study [J].Environmental Toxicology and Pharmacology,2020,73:103279
[28]Fang S B,Cui Q,Dai X Y.Concentrations and accumulation rates of polychlorinated biphenyls in soil along an urban-rural gradient in Shanghai [J]. Environmental Science and Pollution Research International, 2020, 27(9): 8835-8845
[29]王帅,乔艺飘,黄宣运,等.2,2’,4,5,5’-五氯联苯在小鼠体内代谢产物的鉴定[J].分析化学,2019,47(12):1951-1959
Wang S,Qiao Y P,Huang X Y,et al.Identification of metabolites of 2,2’,4,5,5’-pentachlorodiphenyl in mice [J].Chinese Journal of Analytical Chemistry, 2019, 47(12):1951-1959 (in Chinese)
[30]史永富, 林洪, 黄冬梅, 等. 硅烷化衍生/气相色谱/电子捕获检测水产品中羟基多氯联苯的研究[J]. 分析测试学报,2009,28(5):568-571
Shi Y F,Lin H,Huang D M,et al.Study on determination of hydroxy-polychlorinated biphenyls in fishery products by silylation derivatization/GC/μECD [J]. Journal of Instrumental Analysis,2009,28(5):568-571 (in Chinese)
[31]European Commission. Commission Decision EC 2002/657 of 12 August 2002 implementing Council Directive 96/23/EC concerning the performance of analytical methods and the interpretation of results [EB/OL]. [2021-06-11]. https://eur-lex.europa.eu/legal-content/EN/ALL/? uri=CELEX:32002D0657
[32]European Commission.Guidance document on analytical quality control and validation procedures for pesticide residues analysis in food and feed [EB/OL]. https://eur-lex.europa. eu/legal-content/EN/ALL/? uri = CELEX:32002D0657
[33]Ohta C, Haraguchi K, Kato Y, et al. Distribution and excretion of 2,2’,3,4’,5,5’,6-heptachlorobiphenyl (CB187)and its metabolites in rats and Guinea pigs [J]. Chemosphere,2015,118:5-11
[34]Kimura-Kuroda J, Nagata I, Kuroda Y.Hydroxylated metabolites of polychlorinated biphenyls inhibit thyroid-hormone-dependent extension of cerebellar Purkinje cell dendrites [J]. Developmental Brain Research, 2005, 154(2):259-263
[35]Amano I, Miyazaki W, Iwasaki T, et al. The effect of hydroxylated polychlorinated biphenyl(OH-PCB)on thyroid hormone receptor (TR)-mediated transcription through native-thyroid hormone response element (TRE) [J].Industrial Health,2010,48(1):115-118
[36]Ucán-Marin F, Arukwe A, Mortensen A S, et al. Recombinant albumin and transthyretin transport proteins from two gull species and human: Chlorinated and brominated contaminant binding and thyroid hormones [J]. Environmental Science & Technology,2010,44(1):497-504
[37]Gutleb A C, Cenijn P, Velzen M V, et al. In vitro assay shows that PCB metabolites completely saturate thyroid hormone transport capacity in blood of wild polar bears(Ursus maritimus) [J]. Environmental Science & Technology,2010,44(8):3149-3154
[38]Miyazaki W, Iwasaki T, Takeshita A, et al. Polychlorinated biphenyls suppress thyroid hormone receptor-mediated transcription through a novel mechanism [J]. Journal of Biological Chemistry,2004,279(18):18195-18202
[39]Li X S, Wu X N, Kelly K M, et al. Toxicokinetics of chiral PCB 136 and its hydroxylated metabolites in mice with a liver-specific deletion of cytochrome P450 reductase [J]. Chemical Research in Toxicology, 2019, 32(4):727-736
[40]Quinete N, Esser A, Kraus T, et al. Determination of hydroxylated polychlorinated biphenyls (OH-PCBs) in human urine in a highly occupationally exposed German cohort: New prospects for urinary biomarkers of PCB exposure [J]. Environment International,2016,97:171-179
[41]Quinete N, Schettgen T, Bertram J, et al. Occurrence and distribution of PCB metabolites in blood and their potential health effects in humans: A review [J].Environmental Science and Pollution Research International, 2014, 21(20):11951-11972