油菜作为我国第一大油料作物,是日常生活所需食用油的主要来源之一。 同时,油菜也是一种养地作物,其根分泌的有机酸可提高土壤中磷含量,通过种植油菜能够加强土壤通透性,在一定程度上能控制土传病害[1-2]。 油菜在我国的种植面积自20 世纪80年代以来稳步攀升,每年的种植面积保持在700 万hm2 以上,主要分布在长江流域、内蒙古东部和青海等区域[3-5]。 油菜作物的常见病害有油菜菌核病、油菜病毒病和油菜霜霉病等。 其中油菜菌核病为害最重,常年株发病率高达10% ~30%,严重时达80%以上,病株一般减产70% ~100% [6-7]。 因此,油菜菌核病的防治对我国油菜产业的发展至关重要[8-9]。 从20 世纪60年代起,具有良好内吸性的多菌灵成为防治油菜菌核病的常规药剂,但其作用靶标单一,长期施用导致病原菌产生了较强的抗药性[10-11]。 腐霉利是一种新型二甲酰亚胺类低毒内吸性杀菌剂,20 世纪70年代被引入市场用于菌核病的防治[12-13],由于具有较好的防治效果,逐渐成为防治菌核病的主要药剂[14-15]。
目前,腐霉利在我国登记的产品有78 种,其中登记作物为油菜的产品有11 种,为油菜菌核病的有效防治做出了巨大贡献。 同时,腐霉利作为一种农用化学品在不合理施用的情况下也会引起一系列的生态环境健康风险。 有研究表明在一定的暴露浓度下腐霉利具有一定的内分泌干扰风险和发育毒性[16-17]。 因此,腐霉利在食品和环境中的残留情况引起了研究者的广泛关注[18-20]。 根据《食品安全国家标准食品中农药最大残留量》(GB 2763—2021),腐霉利的残留定义仅包含母体,在油菜籽上的最大残留限量为2 mg·kg-1。 近年来,一些研究者开展了腐霉利在登记作物和环境中的消解和代谢行为研究,为其合理使用提供了数据支撑。 杨莉等[22]开发了腐霉利在气相色谱上的检测方法,且田间消解动态试验表明腐霉利在三七茎叶及块根中的半衰期分别为19.27 d 和17.24 d。 黄晓春[23]研究发现腐霉利在韭菜上施用30 d 后的残留量为0.04 ~1.06 mg·kg-1,风险商值为10.77%。 陈柏[24]开展了腐霉利在番茄和土壤中的残留试验,发现腐霉利在番茄果实和土壤中的消解半衰期分别为1.9 ~3.7 d 和1.4 ~2.7 d。 Ambrus 等[25]研究发现腐霉利在大豆和黄瓜上施用后的第4 周,植株中的腐霉利降解了90%,并通过高效液相色谱-质谱联用仪发现了腐霉利在大豆和黄瓜上的代谢产物 C13H11Cl2NO3、C13H13Cl2NO3 和 C13H11Cl2NO2。 Mikami 等[26]研究发现腐霉利在pH 5 ~8 条件下水解速率较快,且高温有利于腐霉利的水解,鉴定了腐霉利的水解产物并推断出水解途径。 然而,腐霉利在油菜上的消解和代谢行为未见报道。 因此,本研究通过田间试验研究腐霉利在油菜植株不同部位的消解规律,并通过室内水培试验探究其在油菜植株和培养液中的代谢产物,为腐霉利在油菜上的科学合理使用及安全性评价提供数据参考,保障油菜产业的可持续发展。
1 材料与方法(Materials and methods)
1.1 主要仪器及试剂
Agilent 7890A GC-ECD(美国Agilent 科技有限公司);AB SCIEX Triple TOF 5600 LC-MS/MS(美国AB SCIEX 科技有限公司);R-200 型旋转蒸发仪(瑞士BUCHI 公司);BS110S 电子天平(北京塞多利斯天平有限公司);TDL-40B 台式离心机(上海安亭仪器有限公司);CQ25-12D 超声波清洗机(宁波江南仪器厂);ZQZY-BF 震荡培养箱(上海知楚仪器有限公司);RXZ 智能人工气候箱(宁波江南仪器厂);Vortex Genius 3 涡流混合器(德国 IKA 集团);0.2 μm 有机相针式滤器(上海安谱实验科技股份有限公司)。
腐霉利标准品(99.5%,北京合利顺科技有限公司);50%腐霉利可湿性粉剂(日本住友化学有限公司);乙腈(分析纯,天津科密欧化学试剂有限公司);弗罗里硅土柱(安谱科学仪器有限公司);丙酮(分析纯,上海凌峰化学试剂有限公司);无水硫酸钠、氯化钠(分析纯,广东西陇化工股份有限公司)。
1.2 田间试验
田间试验地点为江苏省句容市(N31°53′,E119°15′)、湖南省长沙县(N28°18′,E113°10′)和青海省西宁市(N36°43′,E101°45′)。 小区面积为 30 m2,3 次重复,各小区间设置2 m 的间隔带,并设置对照区(喷施清水);施药时期为花荚共存期,施药一次;施药剂量为推荐剂量的1.5 倍剂量(600 g ai·hm-2),喷雾方式施药;在施药后 2 h、1 d、2 d、3 d、5 d、7 d、14 d 和21 d 进行采样,并在对照区采集空白样品,通过五点取样法采集油菜植株的叶片、花序、荚和茎样品并通过四分法缩分至200 g 实验室样品,于-20 ℃储存,待测。
1.3 水培试验
油菜培养:挑取60 粒饱满、均匀一致的扬油1号油菜种子(购自江苏金土地种业有限公司)放入烧杯中,使用0.5% H2O2 溶液消毒15 min,超纯水冲洗5 次,在25 ℃黑暗环境中超纯水浸泡24 h 催芽。露白后,将幼苗移栽至盛有Hoagland-Amon 培养液的96 孔板中,并放置在RXZ 智能人工气候箱中培养。 RXZ 智能人工气候箱的参数为:光照周期14 h·d-1,温度为 25 ℃/18 ℃(昼/夜),湿度 75%,每隔 4天换一次培养液。
施药处理:将5 ~7 叶期、健康且长势一致的油菜幼苗移栽至盛有1 L 培养液的水培箱中,每个水培箱定植28 株,使用挡板保持幼苗直立生长,且根系全部浸没在营养液中,并防止茎叶浸入营养液中;水培箱为深色可避光,规格为60 cm×40 cm×15 cm;培养液中腐霉利的浓度为8 mg·L-1,药剂处理周期为7 d;RXZ 智能人工气候箱的参数同上。 在2 h、1 d、5 d 和7 d 采集3 株油菜植株(不含根系)和 1 mL培养液,-20 ℃保存,待高分辨质谱分析。
1.4 气相色谱分析方法
1.4.1 前处理方法
油菜叶片中腐霉利的提取:称取20.0 g 匀浆的样品于250 mL 三角瓶中,加入10 mL 超纯水和50 mL 乙腈,在恒温摇床(25 ℃)中以 250 r·min-1 振荡提取1 h,抽滤后将滤液转移到含有5 g NaCl 的100 mL 具塞量筒中,振荡5 min,静置30 min,取一半有机相过无水硫酸钠于150 mL 平底烧瓶中,浓缩至干,待净化。
净化:使用7 mL 正己烷活化弗罗里硅土柱(500 mg/6 mL),用8 mL(4 mL+4 mL)正己烷分2 次溶解待净化样品,并上样,用 10 mL 正己烷∶丙酮(99 ∶1,V/V)洗脱液分2 次洗脱并收集于150 mL 平底烧瓶中,旋转蒸发至干,2 mL 色谱纯正己烷溶解,过0.22 μm 有机滤膜,待测。
油菜茎和荚中腐霉利的提取方法与叶片相同,由于提取液中没有杂质干扰,无需过弗罗里硅土柱。
油菜花中腐霉利的提取:称取10.0 g 剪碎的油菜花(<1 cm)样品于 100 mL 离心管中,加入 5 mL 超纯水和50 mL 乙腈,2 500 r·min-1涡旋5 min;加入4 g 氯化钠和4 g 无水硫酸镁,再次涡旋5 min;4 000 r·min-1离心5 min,取全部有机相,过无水硫酸钠后旋转蒸发至干,2 mL 色谱纯正己烷溶解后定容,待测。
1.4.2 气相色谱分析条件
色谱柱:DB-1701 毛细管色谱柱(30 m×0.250 mm,0.25 μm);检测器:电子捕获检测器(ECD);纯度>99.99%的氮气作为载气,流速为1.5 mL·min-1;进样量为1.0 μL,进样模式为分流进样,分流比5 ∶1;色谱柱初始温度为100 ℃,保持1 min,25 ℃·min-1升至270 ℃,保持3 min;进样口和检测器温度分别为270 ℃和300 ℃。
1.5 液相色谱串联高分辨质谱分析方法
1.5.1 前处理方法
在液相色谱串联高分辨质谱分析方法中,油菜植株中腐霉利的提取与净化方法与气相色谱分析方法中油菜叶片的方法相同(见1.4.1),最后使用2 mL质谱乙腈溶解,过0.22 μm 有机滤膜,待测。 培养液过0.22 μm 水相滤膜后,待测。
1.5.2 液相色谱串联高分辨质谱分析条件
LC 条件:色谱柱为 Poroshell 120 EC-C18 207柱(2.7 μm, 2.1 mm×50 mm, Agilent);进样量为 5 μL;流动相由溶剂A(水+0.1%甲酸)和溶剂B(甲醇)组成,流速为0.3 mL·min-1。 梯度洗脱程序:(1) 0 ~0.5 min,10%B;0.5 ~2.5 min,10% ~60%B;2.5 ~9.0 min,60%B;9.0 ~10.0 min,60% ~95%B;10.0 ~14.0 min,95% B。 质谱条件:雾化气体(gas 1) 448.175 kPa,氮气;加热气体(gas 2) 448.175 kPa,氮气;帘幕气体(CUR) 241.325 kPa,氮气;源温度550 ℃;离子喷雾电压(ISVF)5 500 V;对样品进行正负模式下扫描。 通过对比实验样品与对照样品高分辨质谱结果筛选出腐霉利在油菜植株和培养液中的代谢产物(IDA 模式)。
1.6 标准溶液配制及标准曲线绘制
称取0.0101 g 99.5%腐霉利标准品于10 mL 容量瓶中,丙酮溶解定容至刻度,配制质量浓度为1 000 mg·L-1的腐霉利标准溶液作为母液,用色谱纯正己烷梯度稀释配制 5.0、1.0、0.5、0.1 和 0.05 mg·L-1系列标准溶液,在上述气相色谱条件下采用外标法定量测定,以腐霉利质量浓度(x)为横坐标,相应的色谱峰面积(y)为纵坐标作标准曲线。
2 结果与讨论(Results and discussion)
2.1 分析方法的线性、准确度和精密度
腐霉利在气相色谱分析方法中的保留时间为8.4 min,峰形对称,在0.05 ~5.0 mg·L-1范围内与色谱峰面积呈良好的线性关系,线性回归方程为y=42433x-1189.2,可决系数为0.9997。 在添加浓度为0.05 ~2.0 mg·kg-1 范围内,腐霉利在油菜花序中平均回收率为91.1% ~97.6%;在油菜叶片中的平均回收率为89.1% ~100.8%;茎中的平均回收率为91.7% ~ 92.5%;荚中的平均回收率为89.1% ~100.8%。 相对标准偏差均≤6%(表1)。 按3 倍信噪比计算,腐霉利的检测限为0.003 ng。 最低检测量定义为在各基质中的最小添加浓度,均为0.05 mg·kg-1。 上述结果表明该方法的精确度与准确度能够满足油菜各部位中腐霉利的检测要求。
表1 腐霉利在油菜各部位中的添加回收率
Table 1 The spiked recoveries of procymidone in each part of rape plants
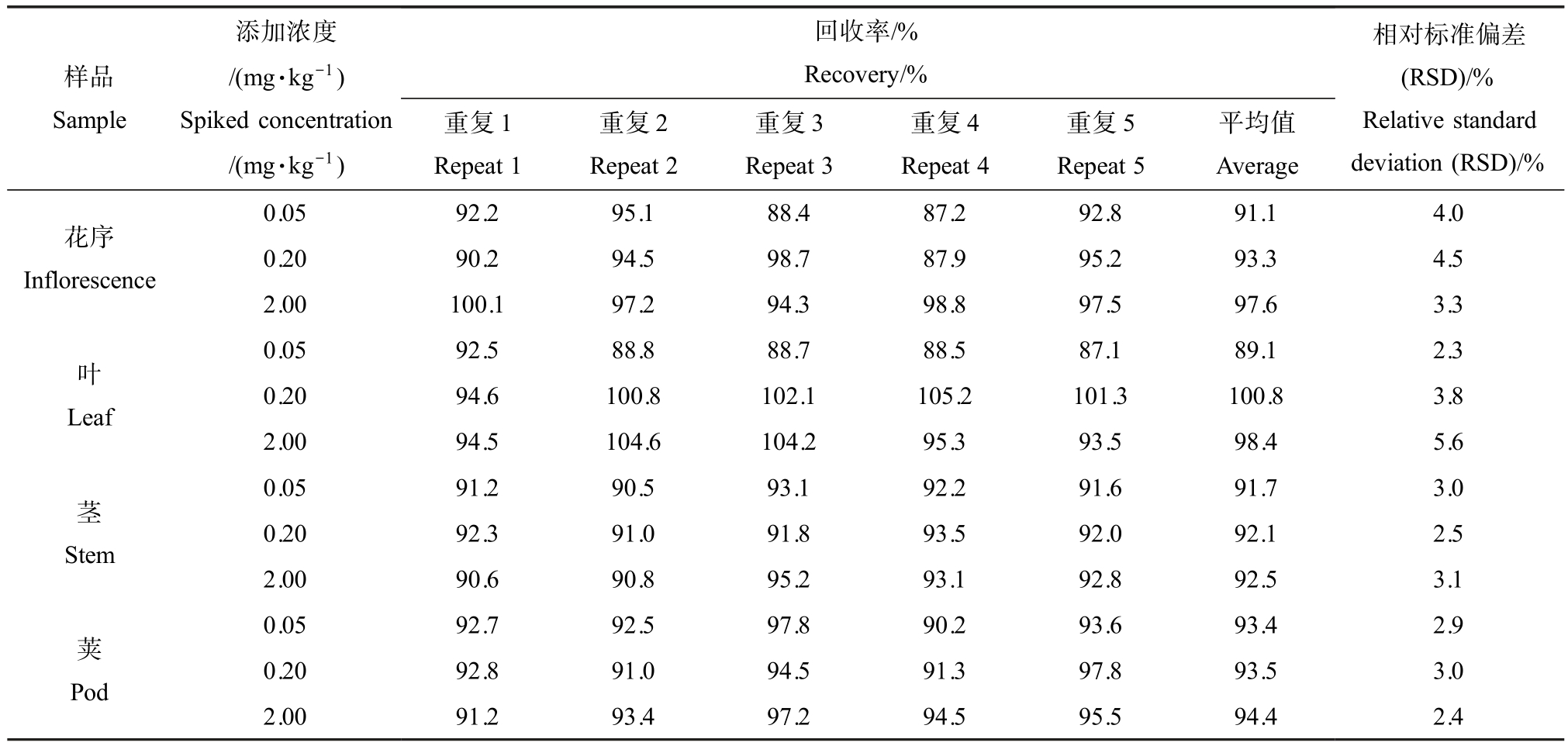
样品Sample添加浓度/(mg·kg-1)Spiked concentration/(mg·kg-1)回收率/%Recovery/%重复1 Repeat 1重复2 Repeat 2重复3 Repeat 3重复4 Repeat 4重复5 Repeat 5平均值Average相对标准偏差(RSD)/%Relative standard deviation (RSD)/%花序Inflorescence 0.05 92.2 95.1 88.4 87.2 92.8 91.1 4.0 0.20 90.2 94.5 98.7 87.9 95.2 93.3 4.5 2.00 100.1 97.2 94.3 98.8 97.5 97.6 3.3叶Leaf茎Stem 0.05 92.5 88.8 88.7 88.5 87.1 89.1 2.3 0.20 94.6 100.8 102.1 105.2 101.3 100.8 3.8 2.00 94.5 104.6 104.2 95.3 93.5 98.4 5.6 0.05 91.2 90.5 93.1 92.2 91.6 91.7 3.0 0.20 92.3 91.0 91.8 93.5 92.0 92.1 2.5 2.00 90.6 90.8 95.2 93.1 92.8 92.5 3.1荚Pod 0.05 92.7 92.5 97.8 90.2 93.6 93.4 2.9 0.20 92.8 91.0 94.5 91.3 97.8 93.5 3.0 2.00 91.2 93.4 97.2 94.5 95.5 94.4 2.4
2.2 腐霉利在油菜各部位的消解动态
江苏省、湖南省和青海省三地的结果表明,腐霉利在油菜各部位中的原始沉积量依次为叶片>花>荚>茎(表2)。 对比三地的原始沉积量,腐霉利在湖南省油菜各部位中的沉积量最高,其次是江苏省和青海省。 腐霉利在江苏省、青海省和湖南省油菜各部位中的半衰期分别为0.7 ~1.2 d、0.6 ~0.9 d 和0.6~3.7 d,消解速率总体上呈现出江苏省>湖南省>青海省。 三地的油菜种植生长情况和施药后的天气差异可能是导致其产生原始沉积量和降解差异的主要原因。 由于湖南省施药小区的种植密度较大,有效沉积量最多;且在施药后天气以阴天为主,不利于腐霉利的快速降解。 青海省试验田种植密度较小,且天气主要以晴天高温为主,有利于腐霉利的降解。江苏省所选试验田的种植密度同样相对较为密集,且在施药后无雨水冲刷,光照强度相对较强,有利于腐霉利的降解。
表2 腐霉利在油菜各部位中的消解动态
Table 2 The degradation dynamics of procymidone in each part of rape plants
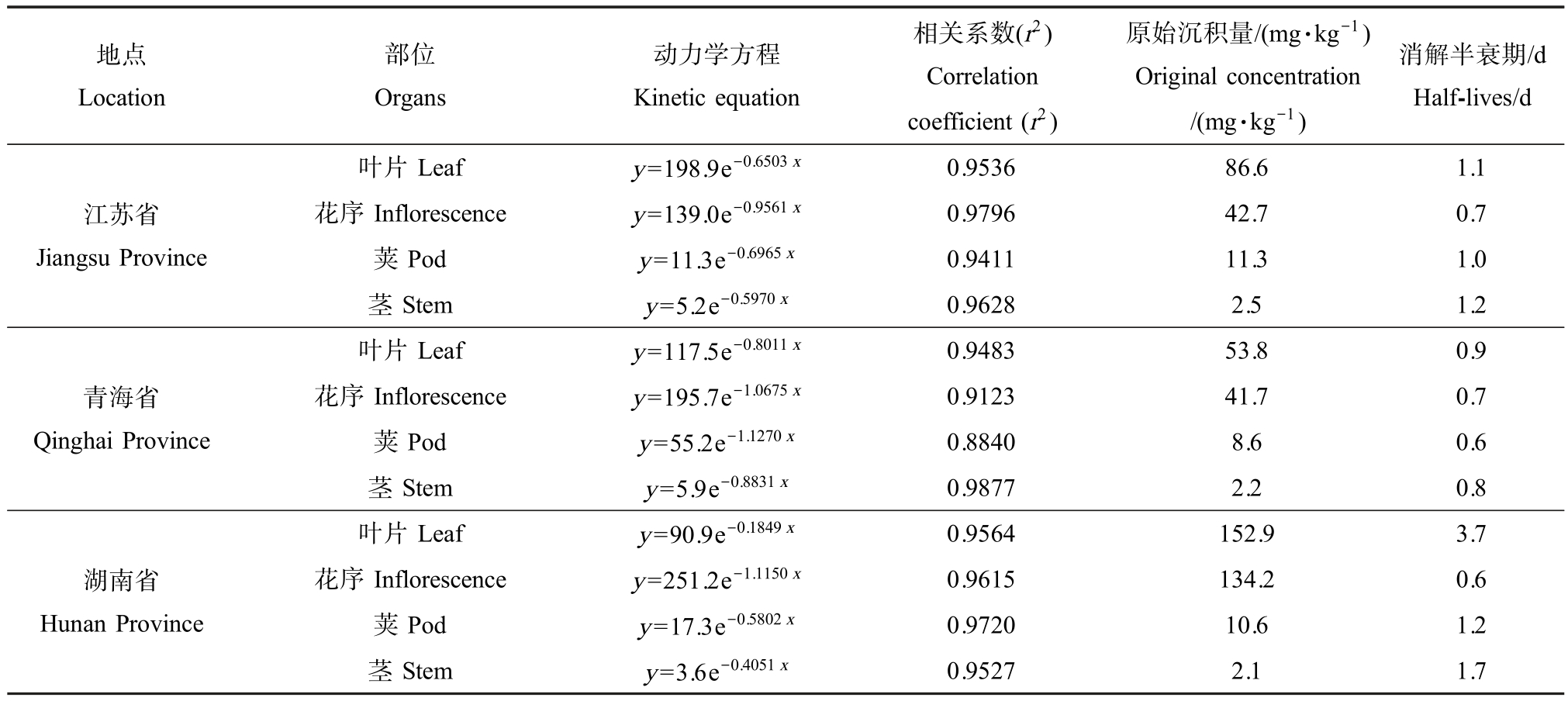
地点Location部位Organs动力学方程Kinetic equation相关系数(r2)Correlation coefficient (r2)原始沉积量/(mg·kg-1)Original concentration/(mg·kg-1)消解半衰期/d Half-lives/d江苏省Jiangsu Province叶片Leaf y=198.9e-0.6503 x 0.9536 86.6 1.1花序Inflorescence y=139.0e-0.9561 x 0.9796 42.7 0.7荚Pod y=11.3e-0.6965 x 0.9411 11.3 1.0茎Stem y=5.2e-0.5970 x 0.9628 2.5 1.2青海省Qinghai Province叶片Leaf y=117.5e-0.8011 x 0.9483 53.8 0.9花序Inflorescence y=195.7e-1.0675 x 0.9123 41.7 0.7荚Pod y=55.2e-1.1270 x 0.8840 8.6 0.6茎Stem y=5.9e-0.8831 x 0.9877 2.2 0.8湖南省Hunan Province叶片Leaf y=90.9e-0.1849 x 0.9564 152.9 3.7花序Inflorescence y=251.2e-1.1150 x 0.9615 134.2 0.6荚Pod y=17.3e-0.5802 x 0.9720 10.6 1.2茎Stem y=3.6e-0.4051 x 0.9527 2.1 1.7
2.3 腐霉利在油菜植株和培养液中代谢产物的鉴定
通过高效液相色谱串联飞行时间质谱仪检测了油菜植株和培养液样品,利用PeakView 和Master-View 软件对样品与空白对照的总离子流图进行比对,推断出1 种腐霉利在油菜植株中的代谢产物和4 种水溶液中的代谢产物(表3)。
表3 腐霉利及其代谢产物信息汇总
Table 3 Summary of procymidone and its metabolites information
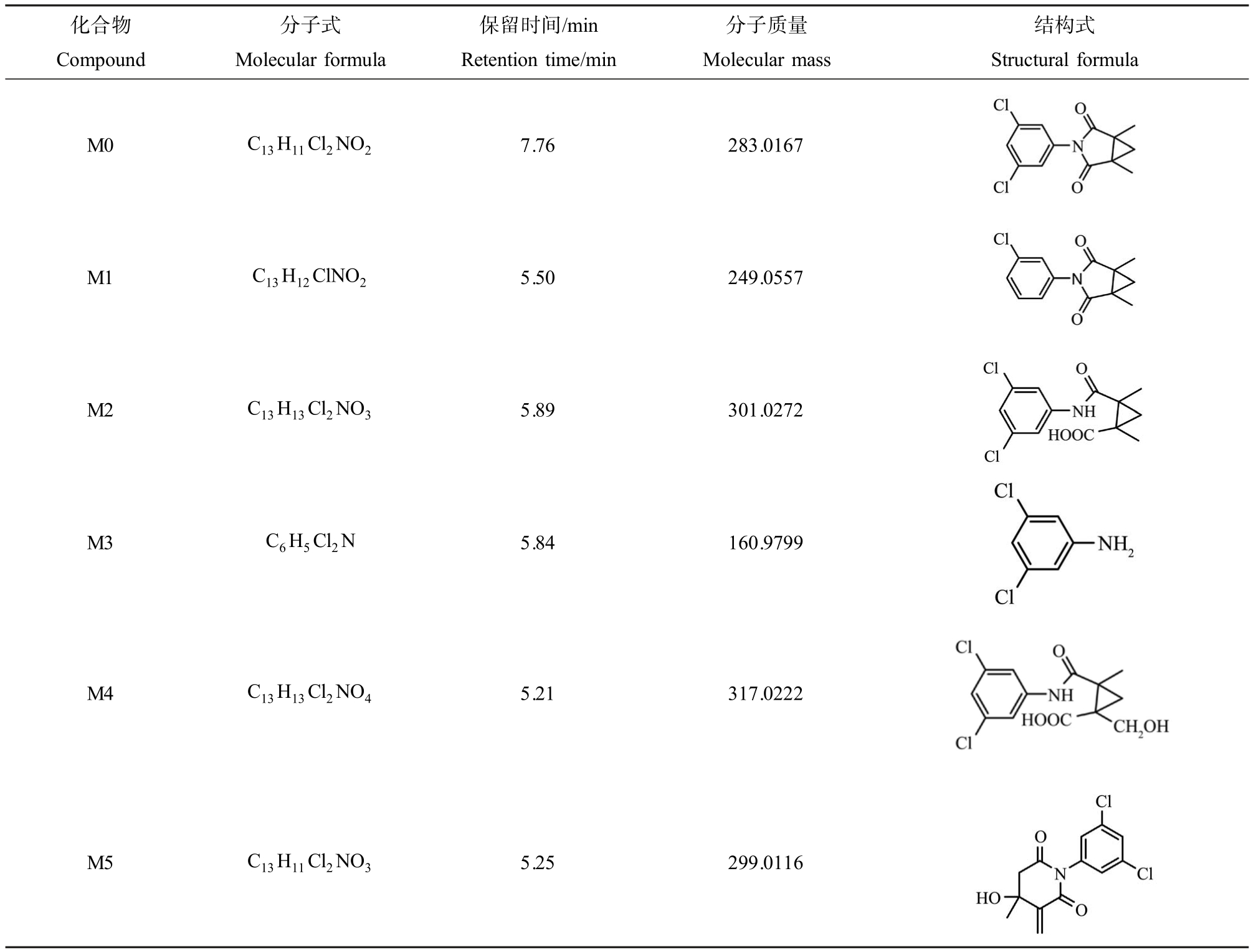
注:M0 为腐霉利母体;M1、M2、M3、M4、M5 为代谢产物。
Note: M0 represents procymidone; M1, M2, M3, M4, M5 represent metabolites.
化合物Compound分子式Molecular formula保留时间/min Retention time/min分子质量Molecular mass结构式Structural formula M0 C13H11Cl2NO2 7.76 283.0167 M1 C13H12ClNO2 5.50 249.0557 M2 C13H13Cl2NO3 5.89 301.0272 M3 C6H5Cl2N 5.84 160.9799 M4 C13H13Cl2NO4 5.21 317.0222images/BZ_138_1836_1763_2072_1922.pngimages/BZ_138_1836_1976_2072_2134.pngimages/BZ_138_1824_2180_2084_2356.pngimages/BZ_138_1836_2376_2072_2585.pngimages/BZ_138_1777_2629_2131_2816.pngM5 C13H11Cl2NO3 5.25 299.0116images/BZ_138_1806_2877_2102_3111.png
通过与空白植株样品的比对,处理组的总离子流图在5.50 min 出现了新的色谱峰(M1)。 其质核比(m/z)为 249.0557,比母体(m/z=283.0167)少 33.961。由一级质谱(图1-B1)可知,代谢产物M1 的一级质谱图中具有含单氯化合物的同位素特征丰度比3 ∶1,并对代谢产物 M1 的二级质谱(图 1-B2)进行分析,代谢产物M1 脱去2个甲基得到碎片离子m/z=222.0680,进一步断裂苯环与五元环之间的碳氮键得到碎片离子m/z=110.9995。 因此推断代谢产物M1 为腐霉利单脱氯产物C13H12ClNO2。

图1 腐霉利(A)及代谢产物(B~F)的质谱图
注:M1 m/z=249.0557 (B),M2 m/z=301.0272 (C),M3 m/z=160.9799 (D),M4 m/z=317.0222 (E)和 M5 m/z=299.0116 (F)。
Fig.1 The tandem mass spectrum of procymidone (A) and the metabolites (B~F)
Note: M1 m/z=249.0557 (B), M2 m/z=301.0272 (C), M3 m/z=160.9799 (D), M4 m/z=317.0222 (E) and M5 m/z=299.0116 (F).
通过分析培养液样品的总离子流图发现在5.89、5.84、5.21 和 5.25 min 处分别出现了新的色谱峰 M2、M3、M4 和 M5。 代谢产物 M2 的 m/z =301.0272,由一级质谱(图1-C1)可知,代谢产物M2的一级质谱图中具有含双氯化合物的同位素特征丰度比 9 ∶6 ∶1。 对代谢产物 M2 的二级质谱(图 1-C2)进行分析,代谢产物M2 断裂酰胺键得到碎片离子m/z=161.9870,进一步脱去一个氯原子,得到碎片离子m/z=127.0182;代谢产物M2 脱去三元环和2个甲基、1个羧基得到碎片离子m/z=113.0596。 因此,推断代谢产物M2 为腐霉利氧化产物C13H13Cl2NO3。代谢产物M3 的m/z=160.9799,由一级质谱(图1-D1)可知,代谢产物M3 的一级质谱图中具有双氯化合物的同位素特征丰度比9 ∶6 ∶1,对代谢产物M3 的二级质谱(图1-D2)进行分析,代谢产物M3 脱氯原子得到碎片离子m/z=127.0185。 因此,推断代谢产物 M3 为 C6H5Cl2N。 代谢产物 M4 的 m/z =317.0222,由一级质谱(图1-E1)可知,代谢产物 M4的一级质谱图中具有含双氯化合物的同位素特征丰度比 9 ∶6 ∶1,对代谢产物 M4 的二级质谱(图 1-E2)进行分析,代谢产物M4 的酰胺键断裂后可得碎片离子m/z=161.9866,再脱去羟基可得碎片离子m/z=141.0544。 因此,推断代谢产物M4 为腐霉利氧化产物 C13H13Cl2NO4。 代谢产物 M5 的 m/z=299.0116大于母体腐霉利的m/z,推断代谢产物M5 为腐霉利的氧化产物,由一级质谱(图1-F1)可知,代谢产物M5 的一级质谱图中具有含双氯化合物的同位素特征丰度比 9 ∶6 ∶1,对代谢产物 M5 的二级质谱(图 1-F2)进行分析,代谢产物M5 的酰胺键且六元环碳碳键断裂后可得碎片离子m/z=204.0218,推断代谢产物M5 为腐霉利氧化产物C13H11Cl2NO3。
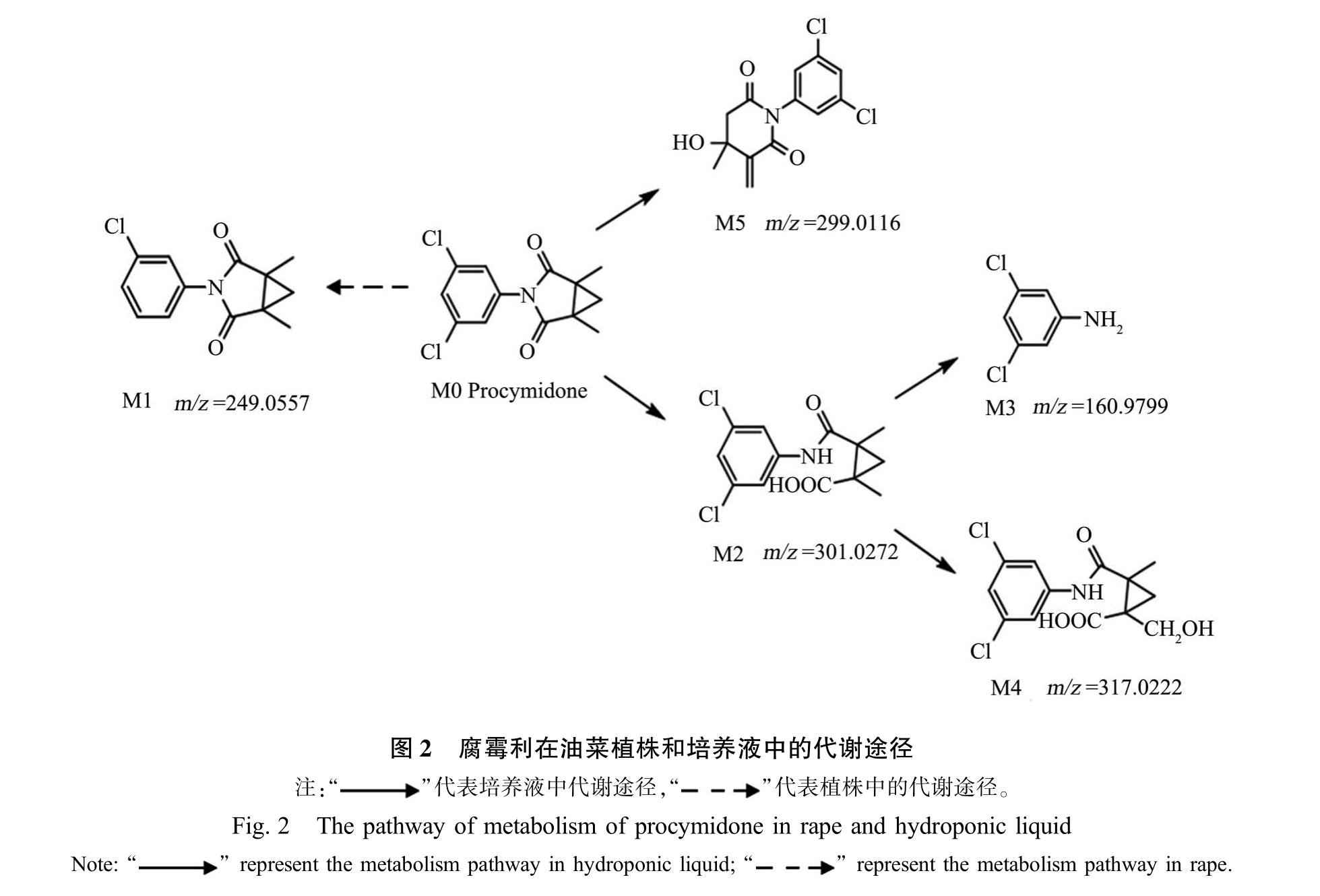
通过解析高分辨质谱可知,腐霉利在油菜植株和培养液中的代谢主要为脱氯反应和氧化反应,其代谢途径如图2 所示。 通过气质联用仪鉴定出M1为腐霉利在甲醇、丙酮和乙腈中的光解产物,此外,有研究结果表明M1 为腐霉利的水解产物和在异丙酮溶液中的光解产物[26-27]。 本研究首次发现腐霉利在油菜植株中可以被代谢为M1。 M2 和M4 为首次在水溶液中被发现。 根据报道,在动物和植物中腐霉利可以被代谢为M2,Abe 等[19]报道了腐霉利在小鼠体内可以被代谢M2,Ambrus 等[25]鉴定出其同样是腐霉利在大豆和黄瓜中的代谢产物。 农药残留联合专家会议(JMPR)列出了腐霉利在大鼠与人体中的6 种代谢产物:PCM-CH2OH、PA-CH2OH、PCM-NH-COOH、PCM-COOH、 PA-COOH 和 3,5-DCA,其中产物 PCM-NH-COOH、3,5-DCA 和 PACH2OH 分别为本文研究发现的 M2、M3 和 M4。 随着人们对环境和食品安全要求的不断提高,对农药的评价也逐渐从母体深入到代谢产物。 根据国际纯粹与应用化学联合会(IUPAC)的报道,腐霉利对水生生物鱼、藻和溞等具有中等毒性。 然而,IUPAC 毒理学数据表明3,5-DCA 对哺乳动物大鼠的毒性高于母体。 此外,Lai 等[28]的研究表明代谢产物3,5-DCA 对斑马鱼的急性毒性(LC50=1.6 mg·L-1)高于母体(LC50=2.0 mg·L-1);Racine 等[29]研究发现 3,5-DCA 对肾脏器官具有一定的损伤作用。 因此,上述结论均表明腐霉利在培养液中发生了增毒代谢。
本文建立了腐霉利在油菜植株各部位的GC 分析方法,其灵敏度、准确度和精密度均符合残留分析要求。 腐霉利施药后主要沉积在油菜花序和叶片上,半衰期在0.6 ~3.7 d 之间。 在室内模拟条件下,通过高分辨质谱技术鉴定出1 种腐霉利在油菜植株中的代谢产物(M1),以及4 种在培养液中的代谢产物(M2、M3、M4 和 M5)。 其中 M1 为首次在油菜植株中被鉴定,M2 和M4 为首次在水溶液中被发现。经分析,腐霉利在油菜植株和培养液中的代谢主要为脱氯反应和氧化反应,并推测了腐霉利在油菜植株和培养液中的代谢途径。 相关研究阐明了腐霉利在油菜植株上的沉积、消解和代谢行为,为腐霉利在油菜上的科学合理用药及安全评价提供了技术支撑。
[1]卢川, 李悦有, 翟黎芳, 等. 京津冀地区冬油菜种植现状与发展对策[J]. 现代农业科技,2018(20):43-45
Lu C,Li Y Y,Zhai L F,et al.Present situation and development countermeasures of winter rapeseed planting in Beijing-Tianjin-Hebei region [J]. Modern Agricultural Science and Technology,2018(20):43-45 (in Chinese)
[2]王璐. 中国油菜产业安全研究[D]. 武汉: 华中农业大学,2014:10-90
Wang L. Study on China’s rape industry security [D].Wuhan: Huazhong Agricultural University, 2014: 10-90(in Chinese)
[3]张宏军, 张佳, 刘学, 等. 我国油菜田农药的登记及应用概况[J]. 湖北农业科学,2008,47(7):846-851
Zhang H J,Zhang J,Liu X,et al.The review of the registration and application of pesticide of canola in China [J].Hubei Agricultural Sciences, 2008, 47(7): 846-851 (in Chinese)
[4]董章辉, 张艳丽, 王虎, 等. 我国绿肥油菜研究进展及发展前景展望[J]. 河北农业科学,2021,25(4):67-70,87
Dong Z H, Zhang Y L, Wang H, et al. Research progress and development prospect of green fertilizer rape in China[J]. Journal of Hebei Agricultural Sciences, 2021, 25(4):67-70,87 (in Chinese)
[5]陈莎莎.长江流域油菜生产规模效益研究[D].武汉:华中农业大学,2017:3-80
Chen S S.The research of rapeseed production scale profit in Yangtze River Basin [D]. Wuhan: Huazhong Agricultural University,2017:3-80 (in Chinese)
[6]王春芝. 油菜菌核病的发病规律与综合防治技术[J].农技服务,2008,25(6):55-56
[7]谷维. 油菜菌核病的发生原因及综合防治对策[J]. 黑龙江农业科学,2008(5):75-77
Gu W. The occurrence causes and integrated control measures for Sclerotinia sclerotiorum [J]. Heilongjiang Agricultural Sciences,2008(5):75-77 (in Chinese)
[8]汪雷, 刘瑶, 丁一娟, 等. 油菜菌核病研究进展[J]. 西北农林科技大学学报: 自然科学版,2015,43(10):85-93
Wang L, Liu Y, Ding Y J, et al. Advance in Sclerotinia stem rot of rapeseed [J]. Journal of Northwest A & F U-niversity:Natural Science Edition,2015,43(10):85-93 (in Chinese)
[9]冯韬. 油菜菌核病病理与防治研究进展[J]. 作物研究,2014,28(3):316-320
[10]周明国, 叶钟音, 刘经芬. 杀菌剂抗性进展[J]. 南京农业大学学报,1994,17(3):33-41
Zhou M G, Ye Z Y, Liu J F. Progress of fungicide resistance research [J].Journal of Nanjing Agricultural University,1994,17(3):33-41 (in Chinese)
[11]李红霞, 陆悦健, 周明国, 等. 油菜菌核病菌β-微管蛋白基因与多菌灵抗药性相关突变的研究[J]. 中国油料作物学报,2003,25(2):56-60
Li H X, Lu Y J, Zhou M G, et al. Mutation in β-tubulin of Sclerotinia sclerotiorum conferring resistance to carbendazim in rapeseed field isolates [J].Chinese Journal of Oil Crop Scieves,2003,25(2):56-60 (in Chinese)
[12]陈勇兵, 胡丽秋, 许美良.20%腐霉利悬浮剂防治黄瓜菌核病的田间药效试验[J]. 安徽农业科学, 2007, 25:7881-7920
Chen Y B, Hu L Q, Xu M L. Field efficacy test of 20%protrichum suspension against Sclerotinia sclerotiorum of cucumber [J]. Journal of Anhui Agricultural Sciences,2007,25:7881-7920 (in Chinese)
[13]宋晰, 肖露, 林东, 等. 番茄灰霉病菌对腐霉利的抗药性检测及生物学性状研究[J]. 农药学学报,2013,15(4):398-404
Song X, Xiao L, Lin D, et al. Detection of procymidone resistance and investigation of biological characteristics in Botrytis cinerea [J]. Chinese Journal of Pesticide Science,2013,15(4):398-404 (in Chinese)
[14]石志琦, 周明国, 叶钟音. 核盘菌对菌核净的抗药性机制初探[J]. 农药学学报,2000,2(2):47-51
Shi Z Q, Zhou M G, Ye Z Y. Study on resistance mechanism of Sclerotinia sclerotiorum to dimethachlon [J].Chinese Journal of Pesticide Science, 2000, 2(2): 47-51 (in Chinese)
[15]张夕林, 孙雪梅, 张谷丰, 等. 油菜菌核病抗药性监测与综合治理技术的研究[J]. 农药科学与管理, 2003, 24(6):18-22
Zhang X L, Sun X M, Zhang G F, et al. Preliminary report on the monitoring of the resistance of Sclerotinia libertiana to carbendazim and its integrated management [J].Pesticide Science and Administration, 2003, 24(6): 18-22(in Chinese)
[16]Kapukiran F, Firat M, Chormey D S, et al. Accurate and sensitive determination method for procymidone and chlorflurenol in municipal wastewater,medical wastewater and irrigation canal water by GC-MS after vortex assisted switchable solvent liquid phase microextraction [J].Bulletin of Environmental Contamination and Toxicology,2019,102(6):848-853
[17]Wu A Y, Yu Q X, Lu H H, et al. Developmental toxicity of procymidone to larval zebrafish based on physiological and transcriptomic analysis [J].Comparative Biochemistry and Physiology Part C: Toxicology & Pharmacology,2021,248:109081
[18]Sarmah A K,Close M E,Mason N W H.Dissipation and sorption of six commonly used pesticides in two contrasting soils of New Zealand [J]. Journal of Environmental Science and Health, Part B,2009,44(4):325-336
[19]Abe J, Tomigahara Y, Tarui H, et al.Identification of metabolism and excretion differences of procymidone between rats and humans using chimeric mice: Implications for differential developmental toxicity [J].Journal of Agricultural and Food Chemistry,2018,66(8):1955-1963
[20]周勇, 朴秀英, 廖先骏, 等. 韭菜中腐霉利的残留检测及长期膳食暴露评估[J].农药学学报,2021,23(2):373-379
Zhou Y, Piao X Y, Liao X J, et al. Residual risk verification and chronic dietary risk assessment of procymidone in Chinese chives [J]. Chinese Journal of Pesticide Science,2021,23(2):373-379 (in Chinese)
[21]中华人民共和国国家卫生健康委员会, 中华人民共和国农业农村部, 国家市场监督管理局. 食品安全国家标准食品中农药最大残留量[S]. 北京: 中华人民共和国国家卫生健康委员会, 中华人民共和国农业农村部,国家市场监督管理局,2021
[22]杨莉, 冯光泉, 张文斌, 等. 固相萃取-GC-ECD 法分析三七中腐霉利的消解动态及残留规律[J]. 农药, 2018,57(12):908-911
Yang L, Feng G Q, Zhang W B, et al. The residual dynamics and final residues of procymidone in Panax notoginseng by SPE-GC-ECD [J]. Agrochemicals, 2018, 57(12):908-911 (in Chinese)
[23]黄晓春. 腐霉利在韭菜中残留现状分析及风险评估[J].安徽农业科学,2021,49(7):188-190
Huang X C. Status analysis and risk assessment of procymidone residues in leek [J]. Journal of Anhui Agricultural Sciences,2021,49(7):188-190 (in Chinese)
[24]陈柏.15%腐霉利烟剂在保护地番茄及土壤中的消解动态与残留量[J]. 现代农药,2014,13(4):39-41
Chen B. Residue and degradation dynamic of procymidone 15% FU in tomato and soil[J].Modern Agrochemicals,2014,13(4):39-41 (in Chinese)
[25]Ambrus A, Buys M, Miyamoto J, et al. Analysis of residues of dicarboximide fungicides in food [J]. Pure and Applied Chemistry,1999,63:747-762
[26]Mikami N, Imanishi K, Yamada H, et al. Photolysis and hydrolysis of the fungicide procymidone in water [J].Journal of Pesticide Science,1984,9(2):223-228
[27]Schwack W, Bourgeois B. Fungicides and photochemistry: Iprodione, procymidone, vinclozolin 1. photodehalogenation [J]. Zeitschrift Für Lebensmittel-Untersuchung Und Forschung,1989,188(4):346-347
[28]Lai Q, Sun X F,Li L S,et al.Toxicity effects of procymidone,iprodione and their metabolite of 3,5-dichloroaniline to zebrafish [J]. Chemosphere,2021,272:129577
[29]Racine C R,Ferguson T,Preston D,et al.The role of biotransformation and oxidative stress in 3,5-dichloroaniline(3,5-DCA) induced nephrotoxicity in isolated renal cortical cells from male Fischer 344 rats [J].Toxicology,2016,341-343:47-55