大量的流行病学研究证实了大气颗粒物(particulate matter, PM)暴露与人群发病率和死亡率上升有关,尤其是呼吸系统疾病、心血管疾病和婴幼儿疾病[1-4]。 目前,学界普遍认为由活性氧自由基(reactive oxygen species, ROS)引发的氧化应激(oxidative stress)是大气颗粒物导致人体健康效应的核心机制假说[5]。 大气颗粒物进入人体后作为脂质和蛋白质的促氧化剂诱导生成过量的ROS,引起细胞氧化还原状态的改变,产生氧化应激效应,进而触发局部和全身系统性炎症,最终导致呼吸和心脏疾病(CHD)、哮喘、慢性阻塞性疾病(COPD)甚至癌症等的发生[6-7]。 ROS 通常具有一个或多个不成对电子,是一类高活性含氧分子,该术语于1945年首次提出,主要包括单线态氧分子(1O2)、超氧自由基(·O2-)、过氧化氢(H2O2)、超氧化氢(HO2)以及羟基自由基(·OH)等[8-9]。 PM 诱导 ROS 生成的能力称为氧化潜势(oxidative potential, OP),是指示大气颗粒物内在健康风险的重要参数[3]。 目前有多种基于细胞和非细胞体系评价颗粒物氧化潜势的方法,其中二硫苏糖醇(dithiothreitol, DTT)法可操作性强,能更全面地反映颗粒物的物理化学特征,被广泛地应用于大气颗粒物氧化潜势的测定(OPDTT)[10]。 本文从OPDTT的基本原理,OPDTT 与颗粒物化学组成、粒径和来源的关系,OPDTT 与健康效应的关系及其局限性和挑战等6个方面,开展基于DTT 法的大气颗粒物氧化潜势测定方法的综述,可为我国大气颗粒物健康效应的研究提供参考。
1 DTT 法的原理(General principle of OPDTT)
DTT 是一种小分子还原型醇类化合物,与细胞体系中的还原型谷胱甘肽(GSH)类似,化学式为C4H10O2S2。 DTT 在还原状态下为线性分子,被氧化后变为包含二硫键的六元环结构,DTT 的强还原性正是来自于该结构的构象稳定。 DTT 的还原能力与pH 值密切相关,仅在pH>7 时体现其还原性,这是由于只有脱去质子的硫醇盐负离子(—S—)才具有反应活性,硫醇(—SH—)则没有。
如图1 所示,大气颗粒物中具有氧化还原活性的成分可捕获 DTT 中的电子,催化 DTT 氧化为DTT 的硫代物。 颗粒物上的电子进一步转移到O2,将其还原成超氧阴离子(·O2-),·O2-进一步生成H2O2 和O2
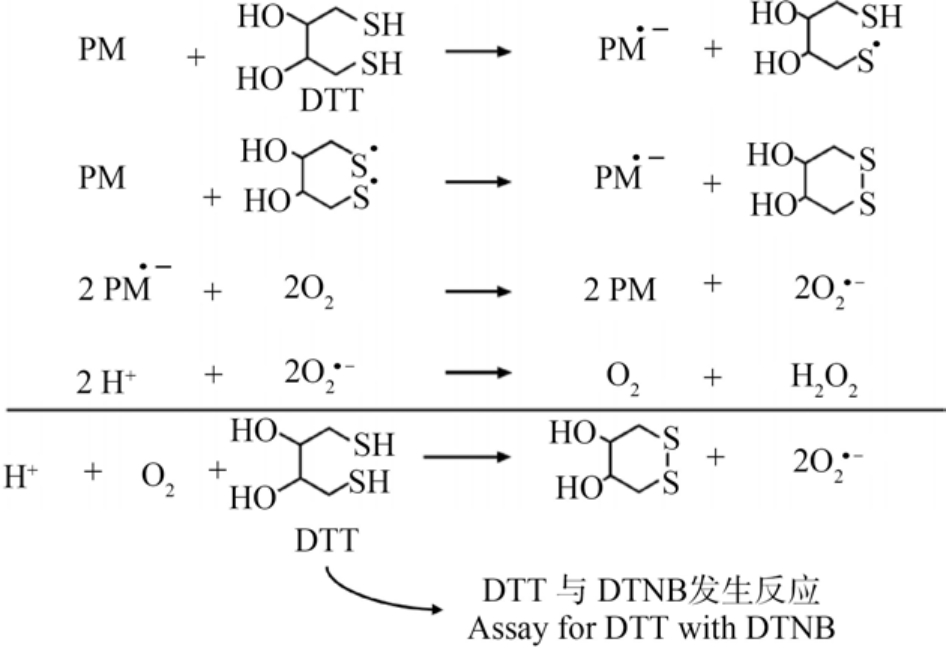
图1 二硫苏糖醇(DTT)法的反应机理[6]
注:PM 表示大气颗粒物,DTT 与5,5’-二硫双(2-硝基苯甲酸) (DTNB)反应生成黄色化合物2-硝基-5-硫代苯甲酸(TNB),该物质在412 nm 处有最大吸收波长,通过分光光度计可确定其含量。
Fig.1 The reaction mechanism of the dithiothreitol (DTT) assay[6]
Note: PM indicates particulate matter; at each designated time,5,5’-dethiobis-2-nitrobenzoic acid (DTNB) reacted with DTT to form 2-nitro-5-thiobenzoic acid (TNB); TNB has the maximum absorption at 412 nm that could be measured by UV-visible spectrophotometer.
[6]。 颗粒物在整个氧化还原过程中起到催化剂的作用,DTT 的消耗速率在一定线性范围内(DTT 的消耗量低于50%)与颗粒物的催化能力成正比,通过测定反应前后DTT 的消耗速率来评价颗粒物的氧化潜势大小[11]。
常见DTT 法检测颗粒物氧化潜势的基本流程如下[12-14]:首先配制0.1 mol·L-1磷酸盐缓冲液(77.8 mmol·L-1 Na2HPO4 和 22.2 mmol·L-1 KH2PO4;pH 7.4);以缓冲溶液分别配制 10 mmol·L-1 的 DTT 储备液和 10 mmol·L-1的 5,5’-二硫双(2-硝基苯甲酸)(5,5’-dethiobis-2-nitrobenzoic acid, DTNB)储备液(2周内使用完毕)并储存于4 ℃冰箱中待用;在测定样品之前用缓冲液分别稀释为0.1 mmol·L-1 DTT 工作液和0.1 mmol·L-1 DTNB 工作液(2 h 之内完成实验)。 测定过程中将DTT 工作液加入至颗粒物萃取液中开始计时,37 ℃下避光振荡混匀。 分别在给定时间点内加入DTNB 工作液使反应终止,然后采用分光光度计在412 nm 处检测吸光值。 以不同时间对应的DTT 浓度做出一条直线,将所得斜率扣除空白斜率,标准化后即为DTT 活性数据。
大气颗粒物氧化潜势的计算公式主要分为2 种表达形式,将DTT 的消耗速率进行质量标准化,即单位时间内DTT 消耗量与参与反应颗粒物质量的比值,以 OPm 表示,单位为 pmol DTT·min-1·μg-1 PM,表征单位质量颗粒物的氧化潜势,可类比为氧化潜势的“密度”。 将DTT 的消耗速率进行体积标准化,即单位时间内DTT 消耗量与空气采样体积的比值,以 OPv 表示,单位为 nmol DTT·min-1·m-3,该值被认为与流行病学中颗粒物暴露导致的健康效应密切相关。 此外,为了比较不同实验条件下从不同研究中所获得的OPDTT 数据,研究者常以1,4-萘醌(1,4-NQN)作为标准物质,将OPDTT 数据进行归一化处理为氧化剂生成和毒性的标准化指标(the normalized index of oxidant generation and toxicity, NIOG)[11,15]。

2002年,Kumagai 等[16]首次利用 DTT 法分析了柴油废气颗粒物诱导产生ROS 的水平,并发现颗粒物中的醌类物质能够促进生物系统中ROS 的生成。2005年,Cho 等[14]基于DTT 法分析了美国洛杉矶盆地不同站点大气颗粒物粒径(2.5 ~10 μm、<2.5 μm和<0.15 μm)、化学组成与 ROS 生成水平的关系,结果表明,颗粒物的氧化还原活性随粒径的增大而减小,元素碳、有机碳及多环芳烃与颗粒物的氧化还原活性呈现较好的相关性,而硫酸盐、硝酸盐等与氧化还原活性无显著相关关系。 此后,DTT 法被广泛应用于评价大气颗粒物、柴油尾气颗粒物和纳米颗粒物等各类颗粒物的氧化潜势。 2015年,Fang 等[17]基于DTT 法设计开发了一套半自动化系统,该系统的测定效果与手动测量结果具有很好的一致性(r2 =0.92),该系统的建立有助于未来开展大尺度环境颗粒物的氧化潜势评估。
2 颗粒物化学组成对OPDTT 的影响(Effects of PM chemical compositions on OPDTT)
大气颗粒物的化学组成是决定OPDTT 最根本的因素,目前国内外已有研究发现大气颗粒物诱导ROS 生成水平主要与过渡金属及以醌类化合物为代表的碳质组分相关。 其中过渡金属(如Fe、Cu、V和Mn)主要通过Fenton 反应诱导氧化还原反应从而生成过量的 ROS,如式(4) ~ (6),M 为金属简称[11-12]。 此外,Fe2+还可以通过还原 H2O2 生成·OH(式(5))[18]。
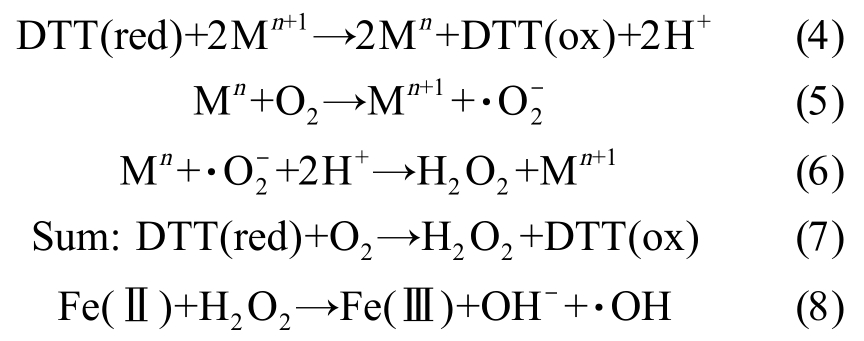
不同种类过渡金属的 OPDTT 不同(表1)。 See等[19]通过相关性分析发现,水溶性金属与OPDTT 的相关性要高于用酸提取的总金属,其中Mn 与OPDTT呈现显著正相关,其次是V 和Zn,研究还发现更易溶于水的 Cd、Co、Cu、Fe、Mn 和 Ni 等痕量金属均能够诱导 ROS 生成。 Shinyashiki 等[20]对 7 种柴油尾气颗粒物的物理化学特征进行定量分析,并采用DTT 方法测定了颗粒物的ROS 生成水平(OPDTT),估测出可溶性金属的贡献约占OPm 的45%,其中Cu 和 Fe 的贡献较为显著。 Verma 等[21]利用 Chelex树脂(金属螯合剂)调控颗粒物提取物中重金属含量,研究了重型卡车尾气中的重金属对颗粒物OPDTT 的影响,其多元线性回归模型结果显示过渡金属 Fe、Co 和 Ni 对颗粒物 OPDTT 的贡献最大。Charrier 和Anastasio[12]基于DTT 法对美国加利福尼亚州圣华金谷区域的城市及乡村PM2.5 的ROS 生成水平进行定量分析,验证了过渡金属会影响颗粒物的OPDTT,并估测过渡金属的贡献约占DTT 损失的80%以上,其中Cu 和Mn 的贡献较为显著,醌类物质约占DTT 损失的20%,此外研究还发现金属螯合剂乙二胺四乙酸(EDTA)能够抑制金属与醌类物质在DTT 实验中的响应,应当避免在DTT 实验中添加EDTA[12]。
大量研究发现醌类化合物具有较强的氧化活性(表1),其氧化还原循环与过渡金属的反应方程式相似,即式(4) ~ (6)[15,18,21-22]。 如图 2 所示,在还原剂DTT(作用同细胞内NADPH 氧化酶)存在的条件下,醌类化合物能够催化电子的转移引发氧化还原循环,从而形成半醌自由基、对苯二酚和DTT-二硫化物(DTT-disulfide)。 随后半醌自由基和对苯二酚与溶解态的O2 反应再次生成醌以及超氧阴离子,并可进一步生成H2O2。 此外,有研究者采用DTT 法测定发现,不同醌类化合物的ROS 生成水平不同。Chung 等[23]采集了美国加利福尼亚州弗雷斯诺市全年的总悬浮颗粒物样品(TSP),采用气相色谱-质谱定量分析了样品中12 种醌类化合物浓度,同时使用DTT 方法评估了样品中ROS 生成水平,研究发现醌类化合物浓度的总量与OPDTT 无相关性,其中仅1,2-萘醌、1,4-萘醌和菲醌与 OPDTT 线性相关,相关系数分别为0.73、0.39 和0.76。
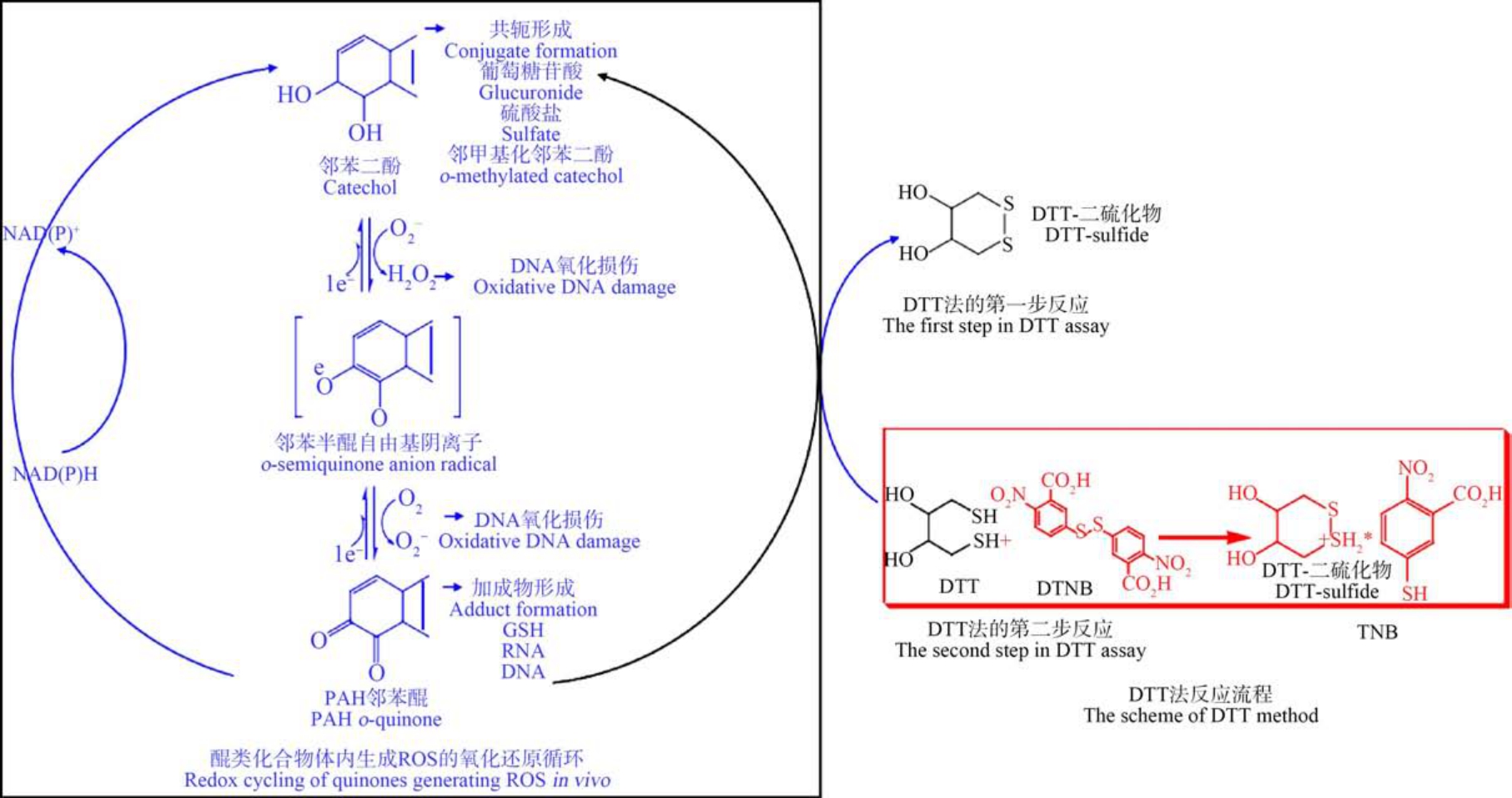
图2 醌类化合物在细胞内和DTT 实验中诱导活性氧(ROS)产生的氧化还原循环[15]
注:NAD(P)+表示烟酰胺腺嘌呤二核苷磷酸,NAD(P)H 表示还原型烟酰胺腺嘌呤二核苷酸磷酸,PAH 表示多环芳烃,GSH 表示谷胱甘肽,RNA 表示核糖核酸,DNA 表示脱氧核糖核酸。
Fig.2 The redox cycling of quinones generating reactive oxygen species (ROS) in vivo, and the similar cycling in DTT assay[15]
Note: NAD(P)+ indicates nicotinamide adenine dinucleotide phosphate, NAD(P)H indicates triphosphopyridine nucleotide, PAH indicates polycyclic aromatic hydrocarbon, GSH indicates glutathione, RNA indicates ribonucleic acid, and DNA indicates deoxyribonucleic acid.
表1 大气颗粒物中具有DTT 活性化合物汇总
Table 1 The summary of DTT responses of oxidative compounds in particulate matter
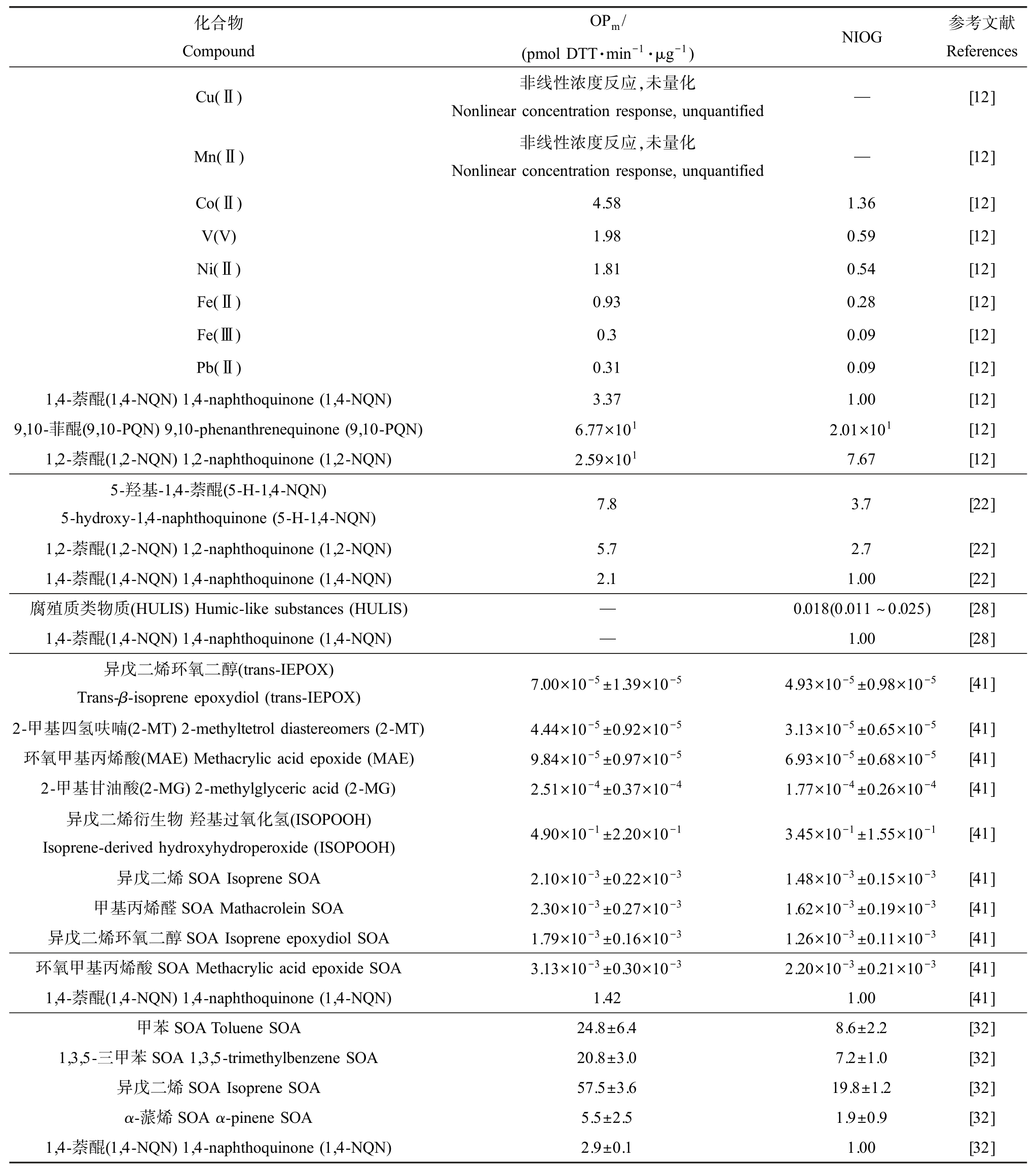
注:OPm 表示单位质量颗粒物的氧化潜势;NIOG 表示氧化剂生成和毒性的标准化指标;SOA 表示二次有机气溶胶。
Note: OPm indicates the mass normalized oxidative potential of PM; NIOG indicates the normalized index of oxidant generation and toxicity; SOA indicates secondary organic aerosol.
化合物Compound OPm/(pmol DTT·min-1·μg-1) NIOG 参考文献References Cu(Ⅱ) 非线性浓度反应,未量化Nonlinear concentration response, unquantified—[12]Mn(Ⅱ) 非线性浓度反应,未量化Nonlinear concentration response, unquantified—[12]Co(Ⅱ) 4.58 1.36 [12]V(V) 1.98 0.59 [12]Ni(Ⅱ) 1.81 0.54 [12]Fe(Ⅱ) 0.93 0.28 [12]Fe(Ⅲ) 0.3 0.09 [12]Pb(Ⅱ) 0.31 0.09 [12]1,4-萘醌(1,4-NQN)1,4-naphthoquinone (1,4-NQN) 3.37 1.00 [12]9,10-菲醌(9,10-PQN)9,10-phenanthrenequinone (9,10-PQN) 6.77×101 2.01×101 [12]1,2-萘醌(1,2-NQN)1,2-naphthoquinone (1,2-NQN) 2.59×101 7.67 [12]5-羟基-1,4-萘醌(5-H-1,4-NQN)5-hydroxy-1,4-naphthoquinone (5-H-1,4-NQN) 7.8 3.7 [22]1,2-萘醌(1,2-NQN)1,2-naphthoquinone (1,2-NQN) 5.7 2.7 [22]1,4-萘醌(1,4-NQN)1,4-naphthoquinone (1,4-NQN) 2.1 1.00 [22]腐殖质类物质(HULIS) Humic-like substances (HULIS) — 0.018(0.011 ~0.025) [28]1,4-萘醌(1,4-NQN)1,4-naphthoquinone (1,4-NQN) — 1.00 [28]异戊二烯环氧二醇(trans-IEPOX)Trans-β-isoprene epoxydiol (trans-IEPOX) 7.00×10-5±1.39×10-5 4.93×10-5±0.98×10-5 [41]2-甲基四氢呋喃(2-MT)2-methyltetrol diastereomers (2-MT) 4.44×10-5±0.92×10-5 3.13×10-5±0.65×10-5 [41]环氧甲基丙烯酸(MAE) Methacrylic acid epoxide (MAE) 9.84×10-5±0.97×10-5 6.93×10-5±0.68×10-5 [41]2-甲基甘油酸(2-MG)2-methylglyceric acid (2-MG) 2.51×10-4±0.37×10-4 1.77×10-4±0.26×10-4 [41]异戊二烯衍生物羟基过氧化氢(ISOPOOH)Isoprene-derived hydroxyhydroperoxide (ISOPOOH) 4.90×10-1±2.20×10-1 3.45×10-1±1.55×10-1 [41]异戊二烯 SOA Isoprene SOA 2.10×10-3±0.22×10-3 1.48×10-3±0.15×10-3 [41]甲基丙烯醛 SOA Mathacrolein SOA 2.30×10-3±0.27×10-3 1.62×10-3±0.19×10-3 [41]异戊二烯环氧二醇 SOA Isoprene epoxydiol SOA 1.79×10-3±0.16×10-3 1.26×10-3±0.11×10-3 [41]环氧甲基丙烯酸 SOA Methacrylic acid epoxide SOA 3.13×10-3±0.30×10-3 2.20×10-3±0.21×10-3 [41]1,4-萘醌(1,4-NQN)1,4-naphthoquinone (1,4-NQN) 1.42 1.00 [41]甲苯 SOA Toluene SOA 24.8±6.4 8.6±2.2 [32]1,3,5-三甲苯 SOA 1,3,5-trimethylbenzene SOA 20.8±3.0 7.2±1.0 [32]异戊二烯 SOA Isoprene SOA 57.5±3.6 19.8±1.2 [32]α-蒎烯 SOA α-pinene SOA 5.5±2.5 1.9±0.9 [32]1,4-萘醌(1,4-NQN)1,4-naphthoquinone (1,4-NQN) 2.9±0.1 1.00 [32]
多环芳烃(PAHs)是醌类化合物在大气中的重要前体物,Ntziachristos 等[24]对美国加利福尼亚地区大气颗粒物不同化学组分与OPDTT 进行相关性分析,发现PAHs 与OPDTT 具有很高的正相关性,并提出PAHs 浓度是 OPDTT 的良好指示物。 Verma 等[25]通过对美国洛杉矶地区大气颗粒物中半挥发性组分OPDTT 的研究也得到了类似的结论。 事实上PAHs自身几乎没有氧化还原活性,但其能够与大气中的氧化物质(如·OH、NO3 和O3)发生光化学氧化还原反应或在颗粒物上发生多相反应转化为醌,从而与OPDTT 呈现较好的相关性[14,26]。 Verma 等[27]采用DTT 法对比了大气颗粒物中水溶性有机物和非水溶性有机物(甲醇相)以及亲水性组分和憎水性组分之间的ROS 生成水平,发现颗粒物的OPDTT 与棕色碳(BrC)的含量呈现明显的正相关关系,而BrC 主要由腐殖质类物质(HULIS)组成。 Lin 和Yu[28]对中国珠江三角洲大气颗粒物中HULIS 的研究也得到了相似的结论。 HULIS 本身的氧化还原活性很低,但是在1,4-萘醌或大气颗粒物中其他无氧化还原活性有机组分(如吡啶、咪唑及其烷基衍生物)的催化作用下,会增加其对DTT 的消耗,原因是未质子化的氮原子可作为氢键的接收者,在ROS 的生成过程中促进氢原子的转移[29]。
二次有机气溶胶(SOA)是大气颗粒物中的重要组成部分,它的生成会加剧与颗粒物污染相关的人群健康危害(尤其是婴儿和儿童),由于SOA 化学组成极其复杂,对SOA 进行有效的识别和健康效应评估一直是国际气溶胶研究领域的热点和难点[30-31]。相关研究发现相较于生物源 SOA(如异戊二烯SOA、α-蒎烯 SOA 和 β-石竹烯 SOA),人为源 SOA(如间二甲苯SOA、甲苯SOA 和萘SOA)通常具有更高的OPm,同时研究者还指出该类由芳香族前体物产生的人为源SOA 中的醌含量几乎可以忽略不计,并推测SOA 主要通过非催化途径消耗DTT[32-33]。这种推测随后被研究者证实,并提出芳香族SOA 中的 Michael 受体(如 CHO、COR、COOH 和 COOR)可通过亲核加成或共轭加成与DTT 反应并形成DTT的加合物,从而消耗 DTT[34-35]。 此外,Gant 等[36]使用体外肝细胞实验,揭示了醌类也可与DTT 上的硫醇基发生芳构化反应,即通过非氧化还原途径消耗DTT。 McWhinney 等[22]采用 DTT 法评估了低浓度NOx 下,·OH 和萘的光化学反应体系下生成 SOA的ROS 生成水平,结果表明,1,2-萘醌、1,4-萘醌和5-羟基-1,4-萘醌的贡献仅占萘SOA 的OPDTT 的(30±5)%,研究同时发现除上述3 种醌类化合物外还存在大量未知的具有氧化还原活性的萘SOA 组分。Tobias 和Ziemann[37]向烟雾箱中通入三亚乙基四胺、烯烃、酸类和臭氧,充分反应后,在生成的颗粒物中检测到了有机过氧化物,同时采用热解析-气相色谱-质谱检测验证了该类反应产物,研究同时发现生成的有机过氧化物更易附着于颗粒相中;并推测大气有机物可作为气溶胶成核核心,同时产生有机活性氧物质。 Wang 等[38]采用烟雾箱实验模拟α-蒎烯和β-蒎烯的臭氧化反应及其甲苯光化学反应,他们将生成的SOA 通入水相中,并使用液相色谱-荧光检测器检测到了大量H2O2 的存在。 Docherty 等[39]通过实验室模拟发现在1-丙醇、环己烯和甲醛存在条件下,单萜烯与臭氧可生成SOA 和过氧化物,其中过氧化物占气溶胶质量分数的47% ~85%,在大气中的半衰期为1 周。 上述研究揭示了SOA 通过非氧化还原途径消耗DTT,同时大量的毒理学研究证实了SOA 中的过氧化物可通过结合生物分子上的亲核试剂或亲核试剂位点,来导致DNA 损伤及对蛋白质和脂质的修饰[35,40]。 因此未来关于SOA 的ROS 生成水平研究可从非催化性途径进行深入探究。
3 颗粒物粒径对OPDTT 的影响(Effects of PM size on OPDTT)
颗粒物粒径不同,空气动力学行为不同,对于身体内屏障的穿透力也不同,较大的颗粒物进入人体后会停留在支气管上,较小的颗粒物则会穿透呼吸屏障进入肺部,而一些超细颗粒物则更可能进入呼吸系统深部甚至参与血液循环[42-43]。 目前关于颗粒物粒径大小与OPDTT 的关系,大多数研究都表明,OPm 伴随着颗粒物粒径的减小而增大。 例如,Li等[44]利用DTT 法研究了美国加利福尼亚地区不同粒径大气颗粒物的ROS 生成水平,结果表明超细颗粒物(<0.1 μm)的 OPm 分别是粗颗粒物(2.5 ~10 μm)和细颗粒物(<2.5 μm)OPm 的 21.7 倍和 8.6 倍。 另外,研究人员在美国弗吉尼亚州[45]和佐治亚州[46]开展的相关研究也取得相似的结论。
然而,另外一些研究也表明,与超细颗粒物相比,亚微米级颗粒物具有更高的OPm。 例如,Samara[47]在希腊塞萨洛尼基的研究发现,单位质量亚微米级颗粒物(0.49 ~1.0 μm)的DTT 活性高于超细颗粒物(<0.49 μm),这种差异性可能来自于亚微米级颗粒物上富集了更多具有DTT 活性的化学组分。此外,一些研究发现,与人类暴露水平密切相关的OPv,其峰值通常出现在颗粒物粒径范围为1 ~10 μm 左右[46,48],其中颗粒物水溶性组分OPv 呈单峰态,而非水溶性组分OPv 则呈双峰态分布,这种分布的差异性主要与颗粒物中金属元素与含氧有机物的相对含量有关[4]。
4 颗粒物排放源对OPDTT 的影响(Effects PM emission sources on OPDTT)
近年来流行病学的研究也发现,大气颗粒物的健康效应与其来源密切相关,并且一些特殊来源的颗粒物具有更高的毒性。 已有研究发现,短期暴露于交通源会引起哮喘患者肺功能下降,增加过敏源的反应[49-50],也会影响健康人群的血管功能[51]。 木柴燃烧排放的颗粒物会加剧肺功能恶化[52]。 燃油和燃煤飞灰排放的颗粒物也表现出毒性效应[53-54]。Wang 等[55]研究发现,SOA、柴油车尾气和生物柴油车尾气产生的颗粒物的ROS 生成水平与环境大气颗粒物相当,甚至高于环境大气颗粒物。 Charrier等[56]通过特制的源导向型采样系统采集不同来源的颗粒,使用DTT 法测定了不同来源颗粒物的ROS生成水平,结果表明不同来源颗粒物的OPm 具有显著差异:香烟>焚香>机动车尾气>室外大气颗粒物样品>餐饮源>室内颗粒物样品。 Daellenbach 等[57]通过评估瑞士多地大气颗粒物的化学组成和OPDTT,并结合欧洲空气质量模型,提出欧洲大气颗粒物质量浓度来源与OPDTT 来源并不相同,即降低颗粒物浓度的政策并不一定能降低颗粒物的氧化潜势。 因此,对OPDTT 的排放源进行识别和定量是制定区域和城市人体健康保护措施的前提。
随着近年来机动车保有量的不断增加,以机动车排放颗粒物为代表的道路交通排放正日益受到全球的普遍关注。 大量的实验室模拟和外场观测表明,柴油机颗粒(DEP)对OPDTT 具有显著贡献(表2)。McWhinney 等[61]基于 DTT 法测定了 DEP 颗粒与城市背景点大气颗粒物的ROS 生成水平,结果表明,DEP 颗粒的DTT 消耗速率比环境颗粒物的DTT 消耗速率高一个数量级,且DEP 颗粒上81% ~92%的引发DTT 反应的活性组分存在于水不溶相。 Shinyashiki 等[20]也报道了DEP 中水不溶性成分贡献了DTT 活性的90%以上。 DEP 颗粒含有PAHs、硝基-PAHs(NPAHs)及含 S、N、O 杂原子的 PAHs 衍生物,一般认为DEP 颗粒的氧化性和毒性来源于此,此外研究还发现,DEP 的颗粒提取物具有致突变性和致癌性[15,63]。 根据 Bates 等[4]的综述,DEP 颗粒的OPDTT 主要与发动机参数、行驶工况、尾气的光化学老化及燃料类型密切相关。 Fox 等[64]基于DTT 法对比了不同发动机负荷对DEP 颗粒的ROS 生成能力的影响,结果表明降低发动机负荷可以显著降低颗粒的 OPDTT。 Li 等[15]采用 DTT 法对比了通入臭氧前后烟雾箱中DEP 颗粒的ROS 生成水平,发现新鲜和老化的颗粒物都具有引发ROS 生成的能力,且老化的OPDTT 更高。 Verma 等[65]研究了美国洛杉矶地区夏季昼夜变化对道路交通大气颗粒物OPDTT的影响,结果表明,下午(11:00—14:00,太平洋夏季时间)收集到的颗粒物OPDTT 明显高于早晨(6:00—9:00,太平洋夏季时间),颗粒物中水溶性有机碳(WSOC)和OPDTT 呈显著相关,而WSOC 主要来自于大气的二次反应产物或生物质燃烧。 Karavalakis等[66]也尝试探索不同混合燃料对DEP 颗粒的ROS生成水平的影响,结果表明使用生物柴油混合燃料可以显著降低排放颗粒的OPDTT。
表2 不同排放源颗粒物的DTT 活性汇总
Table 2 The summary of DTT responses of PM from various emission sources

排放源Emission source采样点Sampling site OPm/(pmol DTT·min-1·μg-1)参考文献References生物质燃烧有机气溶胶(BBOA)Biomass burning organic aerosol (BBOA) 场地 Field 151±20 [58]烹饪有机气溶胶(COA)Cooking organic aerosol (COA) 场地 Field 90±51 [58]环境大气颗粒物Ambient PM 场地Field 10 ~70 [58]交通路口 Traffic intersection 场地Field 50.9±27.8 [59]船舶排放Ship emissions柴油机颗粒(DEP)Diesel exhausted particles (DEP) 7.1±0.2 [29]卡罗拉汽油机 Corolla gasoline DEP 12±1 [60]高尔夫柴油机 Golf diesel DEP 18±3 [60]高尔夫生物柴油机 Golf biodiesel DEP 25±3 [60]雅阁柴油机 Accord diesel DEP 23±2 [60]加柴油颗粒过滤器的雅阁柴油机Accord diesel with particle filter DEP 19±2 [60]重型发动机 High engine load DEP 61±12 [61]中型发动机 Medium engine load DEP 23±15 [61]轻型发动机 Low engine load DEP 46±15 [61]木柴燃烧烟雾 Wood smoke 烟雾箱 Chamber 25.2±0.9 [32]稻草1&2 Rice straw 1&2 场地 Field 21±3 [62]大麦秸秆1&2 Barley straw 1&2 场地Field 8.9±1.0 [62]小麦秸秆1 Wheat straw 1 场地Field 30±1.4 [62]稻壳1 Rice husk 1 场地 Field 7.2±1.6 [62]小麦秸秆2 Wheat straw 2 场地Field 30±2.1 [62]稻壳2 Rice husk 2 场地 Field 20±1.0 [62]陆地化石燃料燃烧Land fossil fuel combustion 基于PMF 模型解析Ambient PMF-derived 113 [13]船舶排放Ship emissions 基于PMF 模型解析Ambient PMF-derived 196 [13]生物质燃烧Biomass burning 基于PMF 模型解析Ambient PMF-derived 17 [13]二次硫酸盐Secondary sulfate 基于PMF 模型解析Ambient PMF-derived 39 [13]
此外,道路交通排放和汽油车排放也常与OPDTT 呈现明显的相关关系。 Shirmohammadi 等[67]在美国洛杉矶盆地(3 条具有代表性的道路上和背景点南加利福尼亚大学内)利用移动采样平台采集大气颗粒物,结果显示公路上颗粒物的OPDTT 最大,高于背景点2.1 倍,且OPDTT 与机动车磨损排放的示踪物具有强相关性。 Verma 等[68]发现美国亚特兰大地区大气颗粒物的污染来源与其OPDTT 呈线性关系,并利用正定矩阵因子分解法(PMF)将OPDTT 与其他颗粒物的化学组分浓度相结合,解析出机动车排放对全年OPDTT 均有贡献,所占比例为12% ~25%。 Yu 等[69]将我国北京市大气细颗粒物的PMF源解析结果与OPDTT 以及多元线性回归模型相结合,有效地解析出4个OPDTT 的贡献源和贡献率,分别为机动车排放(35.4% ~63.7%)、二次硫酸盐和工业排放(3.5% ~11.9%)、煤燃烧(13.8% ~32.8%)和扬尘(3.5% ~40.6%)。 Bates 等[70]利用化学质量平衡法(CMB)解析出不同来源对美国亚特兰大地区大气细颗粒物的贡献,再结合多元线性统计分析探讨不同来源的颗粒物与OPDTT 的相关性,结果表明轻型汽油车的OPm 最高,其次是生物质燃烧和重型柴油车。 以上研究表明,道路交通排放是OPDTT 的重要来源,其中不同机动车尾气排放的OPDTT 具有较大差异,因此未来工作可聚焦于机动车燃料类型、道路车辆构成及机动车排放标准等方面对OPDTT 影响的综合评价上。
生物质燃烧是OPDTT 的另一类重要来源。 生物质是仅次于煤炭、石油和天然气的第四大能源,其燃烧过程可产生或伴生大量有毒有机污染物(如PAHs和醛类)[71]。 Verma 等[58]发现生物质燃烧排放的有机气溶胶(BBOA)与氧化程度较高的有机气溶胶(MO-OOA),与 DTT 活性最相关。 Saffari 等[72]分别采集了2012年和2013年冬季希腊塞萨洛尼基地区的细颗粒物样品,并分析了颗粒物上的化学成分与ROS 生成水平的关系,受2012年希腊经济危机影响,当地居民在2012年取暖季时选择了价格更为廉价的木柴来代替燃料油,研究结果表明,塞萨洛尼基地区2013年生物质燃烧示踪物(左旋葡聚糖和半乳聚糖)的浓度比2013年升高了2 倍~3 倍,颗粒物的ROS 生成水平与生物质燃烧示踪物线性相关,证实了大量使用生物质燃料会增加颗粒物的ROS 生成水平。 Verma 等[73]比较了美国南加利福尼亚州山林大火期间和火灾后大气颗粒物中生物质燃烧示踪物(钾离子和左旋葡聚糖)以及OPDTT 的差异,也得到了类似的结论。 然而,Fushimi 等[62]发现不同生物质(稻草、大麦秸秆、小麦秸秆和稻壳)燃烧排放颗粒物的OPm 明显低于机动车排放来源。 此外,Vreeland等[74]发现路边垃圾焚烧可显著增加大气细颗粒物的OPv,但该来源对颗粒物的OPm 无明显影响。
一些研究显示扬尘源也可能是OPDTT 的重要来源。 Verma 等[68]发现夏季和秋季道路扬尘对美国东南部地区大气细颗粒物OPDTT 的贡献约为12%。Liu 等[75]对中国北京市沙尘天气前后大气颗粒物OPDTT 对比研究发现,沙尘天气发生时颗粒物中水溶性金属元素增加,从而导致颗粒物的OPDTT 显著增加。 Secrest 等[76]研究了中国内蒙古和四川地区使用家庭固体燃料排放的大气细颗粒物对农村妇女颗粒物暴露的影响,结果显示扬尘、生物质燃烧和煤炭燃烧是室内细颗粒物的主要来源,其中仅有扬尘与OPm 呈显著正相关,而后两者则与OPm 无相关性。 然而,Chirizzi 等[77]研究发现撒哈拉沙漠沙尘爆发对意大利东南部城市背景点(莱切环境气候观测站)大气颗粒物OPDTT 无显著贡献。 上述研究中,扬尘源对颗粒物OPDTT 影响的差异性主要与颗粒物的化学组成和老化程度有关,首先撒哈拉沙漠沙尘对大气颗粒物质量浓度的贡献可能主要集中于地壳元素、海盐和胺类等不易产生氧化性的化学物质,因此不会对OPDTT 产生显著贡献[6];其次,颗粒物老化会有助于硫酸铵等酸性物质的形成,进而加速金属元素的溶解度增加 OPDTT[48],因此,Chirizzi 等[77]收集到的这次颗粒物可能较之于其他研究较为特殊。 此外,一些采样点因其独特的地理位置及产业模式,也会有一些显著影响 OPDTT 的其他排放源。 Wang等[13]基于PMF 法和多元线性回归模型解析出泰国曼谷地区不同来源的颗粒物对OPDTT 的贡献,发现船舶排放对OPDTT 的贡献最高可达28%。 值得注意的是,Samake 等[78]发现生物气溶胶也能够显著影响粗颗粒物的OPDTT,其中真菌孢子的ROS 生成水平是细菌的10 倍。 但考虑生物气溶胶中包含来自化石燃料燃烧所产生的黑碳(BC)[4],且研究已证实黑碳具有较高的氧化还原活性[63],因此这种生物气溶胶的源分担可能并不准确。
5 OPDTT 与健康效应的关系(Relationship between health effect and OPDTT)
研究者发现利用模型估算的和实测的大气颗粒物OPDTT,均与心肺系统健康效应终点相关[1,3,70]。同时研究者也指出,相同健康效应终点下,OPDTT 表现出的相关性比颗粒物质量浓度的相关性更强[1,3,70,79],且有研究发现颗粒物质量浓度未表现出与效应终点的相关性[70]。 这佐证了氧化应激是大气颗粒物导致人体健康效应的核心机制假说[4]。 目前在流行病学中,使用呼出气NO(fractional exhaled nitric oxide, FENO)作为OPDTT 生物标记物的研究越来越多,FENO 通常作为临床上判断呼吸系统炎性效应以及急性呼吸系统疾病(如哮喘)诊断的辅助指标[2,79-80]。
在流行病学中,通常使用土地回归模型和源-效应多元回归模型来估算大尺度和长时间的OPDTT。其估算过程如下:假设研究区域内OPm(区域内某一点测量值)在时间或空间上无显著变化,该研究OPDTT 即为该区域内大气颗粒物质量浓度均值与OPm 的乘积[4]。 Janssen 等[79]利用土地回归模型估计了荷兰境内OPDTT,并选择31 名健康成年人于境内不同区域大气颗粒物中暴露4 h,结果显示4 h 内OPDTT 与 FENO 存在显著正相关性。 Yang 等[2]利用2009—2010年荷兰与比利时的颗粒物组分观测数据及土地回归模型估算的OPDTT 建立时间序列分析模型,结果发现,OPDTT 与哮喘发病率、哮喘患病率和鼻炎发病率呈显著相关,且对上述健康效应终点来说,颗粒物每增加一个四分位距(μg·m-3)对应的发病率分别增加1.10%、1.08%和1.15%,在多污染物模型中OPDTT 与上述健康终点的相关性依然存在。 Bates 等[70]利用1998—2009年美国亚特兰大的颗粒物组分连续观测数据与相应OPDTT 及具体疾病效应终点建立时间序列分析模型,发现OPDTT 与呼吸医院就诊率、心血管疾病医院就诊率密切相关,且这种相关性也体现在双污染物模型中。
6 使用OPDTT 评估颗粒物健康效应的局限性与挑战(Limitations and challenges of OPDTT to evaluate PM health effects)
颗粒物诱导的氧化应激是颗粒物驱动下游一系列信号途径的起始事件,是其引发健康效应的源头。OPDTT 仅体现了一种ROS 生成的化学机理,代表了颗粒物的化学氧化潜势,并不能代表总的胞内或胞外 ROS 生成量[81]。
颗粒物进入呼吸系统后,对人体ROS 累积的贡献可分为内源性ROS(PM-induced ROS)和外源性ROS(PM-bound ROS)[82]。 其中内源性 ROS 是指颗粒物沉积在呼吸系统中,进入人体后通过参与机体内的生物化学反应(即酶促反应或免疫反应),诱导细胞产生过量ROS,其浓度水平反映了颗粒物的生物氧化性[11,83],因此该部分ROS 的评估通常基于动物细胞模型开展,目前3 种最常见的细胞模型包括生长在气管和肺泡部分的表皮细胞、巨噬细胞和树状细胞。 但基于细胞模型的氧化潜势测定方法通常表现出周期长、稳定性差、测定结果易受细胞状态和细胞类型的影响等缺点,受环境影响不可控。
外源性ROS 主要是指具有氧化活性的成分(如过渡金属及醌类等物质)随颗粒物直接进入机体靶器官,在O2 存在下通过Fenton 反应及半醌自由基的氧化还原过程而产生过量的ROS,其浓度水平反映了颗粒物的化学氧化性。 而DTT 法正是基于非细胞体系评价颗粒物化学氧化潜势的方法,它的出现使得研究者能够快速灵敏地检测颗粒物组分的氧化性能[6]。 此外颗粒物本身还可能携带一定量的ROS,该部分ROS 也属于外源性ROS,如木材燃烧与机动车尾气等一次排放以及烃类前体物发生的光化学氧化反应等二次排放均能产生一定量的ROS[83-84],最近瑞士保罗谢勒研究所的研究者利用高分辨率X 射线显微镜观察到这些ROS 可以在干燥环境下(相对湿度低于60%,20 ℃)稳定沉积于颗粒物中,加剧大气颗粒物暴露风险[85]。 但由于大部分ROS的反应活性极强,半衰期非常短,直接测定较为困难,通常采用荧光探针对该部分ROS(颗粒物本身携带的ROS)进行捕获,并通过测定氧化副产物的光谱实现对ROS 浓度的估测,常见的荧光探针主要有二氯二氢荧光素(DCFH)探针、氨基苯基荧光胺(APF)探针和10-乙酰基-3,7-二羟基吩嗪(Amplex Red)探针等[4,86]。
因此,OPDTT 与生物学效应指标(如细胞毒性、炎症响应和氧化应激标志物等)之间的关系存在不太统一甚至完全对立的观点。 例如,Akhtar 等[81]采用DTT 法评估了加拿大多伦多市区大气颗粒物的ROS 生成水平,并分别进行了人肺泡上皮细胞(A549)的细胞存活率和白细胞介素-8(IL-8)含量测试,结果显示OPDTT 与上述2个生物学效应指标之间相关性较差。 然而,Velali 等[87]通过对希腊塞萨洛尼基地区大气颗粒物的氧化性及细胞毒性研究发现OPDTT 与细胞存活率及乳酸脱氢酶(LDH)活性呈显著相关性。 颗粒物在细胞水平上产生的毒性和人体健康的负面效应在一定程度上是由于颗粒物上存在较强的催化生成ROS 的能力。 然而OPDTT 仅代表大气颗粒物与硫醇之间的孤立化学反应,而细胞测定法则更多涉及颗粒物暴露后的生理过程。
可以预见,未来颗粒物氧化潜势的评估将会从内源性ROS 和外源性ROS 整体出发,集合细胞及非细胞方法(DTT 法、荧光探针等),从而实现对颗粒物健康效应的源头把控,因此在我国开展大气颗粒物氧化潜势的研究,定量不同排放源的OPDTT 及其对环境大气颗粒物OPDTT 的贡献,对于制定保护人体健康的源头减排政策,具有重要的现实意义。 目前国内外DTT 标准化流程尚不统一(反应温度、反应时间和颗粒物萃取方式等),难以对全球范围内不同研究获得大气颗粒物OPDTT 观测结果进行系统比较,因此未来亟需制定标准化方法,保证OPDTT 数据的可比性[11]。 此外,OPDTT 指标对颗粒物的健康效应解释远比颗粒物质量浓度更直接,但是在大尺度区域及长时间序列的调查背景下,往往需要相应的模型来估算OPDTT,而该类相关研究在国内开展较少[4]。
[1]Abrams J Y, Weber R J, Klein M, et al. Associations between ambient fine particulate oxidative potential and cardiorespiratory emergency department visits [J]. Environmental Health Perspectives,2017,125(10):107008
[2]Yang A, Janssen N A H, Brunekreef B, et al. Children’s respiratory health and oxidative potential of PM2.5: The PIAMA birth cohort study [J].Occupational and Environmental Medicine,2016,73(3):154-160
[3]Fang T, Verma V, Bates J T, et al. Oxidative potential of ambient water-soluble PM2.5 in the southeastern United States: Contrasts in sources and health associations between ascorbic acid (AA) and dithiothreitol (DTT) assays[J]. Atmospheric Chemistry and Physics, 2016, 16(6):3865-3879
[4]Bates J T, Fang T, Verma V, et al.Review of acellular assays of ambient particulate matter oxidative potential:Methods and relationships with composition, sources, and health effects [J]. Environmental Science & Technology,2019,53(8):4003-4019
[5]Perrone M G, Zhou J, Malandrino M, et al. PM chemical composition and oxidative potential of the soluble fraction of particles at two sites in the urban area of Milan,Northern Italy[J].Atmospheric Environment,2016,128:104-113
[6]Ayres J G, Borm P, Cassee F R, et al.Evaluating the toxicity of airborne particulate matter and nanoparticles by measuring oxidative stress potential: A workshop report and consensus statement [J]. Inhalation Toxicology,2008,20(1):75-99
[7]Rahman I, MacNee W. Oxidative stress and regulation of glutathione in lung inflammation [J]. European Respiratory Journal,2000,16(3):534-554
[8]Alfadda A A, Sallam R M. Reactive oxygen species in health and disease [J].Journal of Biomedicine & Biotechnology,2012,2012:936486
[9]Datta K, Sinha S, Chattopadhyay P.Reactive oxygen species in health and disease [J]. The National Medical Journal of India,2000,13(6):304-310
[10]Xiong Q S, Yu H R, Wang R R, et al. Rethinking dithiothreitol-based particulate matter oxidative potential: Measuring dithiothreitol consumption versus reactive oxygen species generation [J]. Environmental Science & Technology,2017,51(11):6507-6514
[11]Jiang H,Ahmed C M S,Canchola A,et al.Use of dithiothreitol assay to evaluate the oxidative potential of atmospheric aerosols [J]. Atmosphere,2019,10(10):571
[12]Charrier J G, Anastasio C. On dithiothreitol (DTT) as a measure of oxidative potential for ambient particles: Evidence for the importance of soluble transition metals [J].Atmospheric Chemistry and Physics,2012,12(5):11317-11350
[13]Wang J Q,Jiang H Y,Jiang H X,et al.Source apportionment of water-soluble oxidative potential in ambient total suspended particulate from Bangkok: Biomass burning versus fossil fuel combustion [J]. Atmospheric Environment,2020,235:117624
[14]Cho A K, Sioutas C, Miguel A H, et al. Redox activity of airborne particulate matter at different sites in the Los Angeles Basin[J].Environmental Research,2005,99(1):40-47
[15]Li Q F, Wyatt A, Kamens R M. Oxidant generation and toxicity enhancement of aged-diesel exhaust [J]. Atmospheric Environment,2009,43(5):1037-1042
[16]Kumagai Y,Koide S,Taguchi K,et al.Oxidation of proximal protein sulfhydryls by phenanthraquinone, a component of diesel exhaust particles [J]. Chemical Research in Toxicology,2002,15(4):483-489
[17]Fang T,Verma V,Guo H,et al.A semi-automated system for quantifying the oxidative potential of ambient particles in aqueous extracts using the dithiothreitol (DTT) assay:Results from the Southeastern Center for Air Pollution and Epidemiology (SCAPE) [J]. Atmospheric Measurement Techniques,2015,8(1):471-482
[18]Lin M F, Yu J Z. Effect of metal-organic interactions on the oxidative potential of mixtures of atmospheric humiclike substances and copper/manganese as investigated by the dithiothreitol assay [J]. Science of the Total Environment,2019,697:134012
[19]See S W, Wang Y H, Balasubramanian R.Contrasting reactive oxygen species and transition metal concentrations in combustion aerosols [J]. Environmental Research,2007,103(3):317-324
[20]Shinyashiki M, Eiguren-Fernandez A, Schmitz D A, et al.Electrophilic and redox properties of diesel exhaust parti-cles [J]. Environmental Research,2009,109(3):239-244
[21]Verma V, Shafer M M, Schauer J J, et al. Contribution of transition metals in the reactive oxygen species activity of PM emissions from retrofitted heavy-duty vehicles [J].Atmospheric Environment,2010,44(39):5165-5173
[22]McWhinney R D, Zhou S, Abbatt J P D. Naphthalene SOA: Redox activity and naphthoquinone gas-particle partitioning [J]. Atmospheric Chemistry and Physics,2013,13(19):9731-9744
[23]Chung M Y, Lazaro R A, Lim D, et al. Aerosol-borne quinones and reactive oxygen species generation by particulate matter extracts [J]. Environmental Science &Technology,2006,40(16):4880-4886
[24]Ntziachristos L, Froines J R, Cho A K, et al.Relationship between redox activity and chemical speciation of sizefractionated particulate matter [J].Particle and Fibre Toxicology,2007,4:5
[25]Verma V, Pakbin P, Cheung K L, et al. Physicochemical and oxidative characteristics of semi-volatile components of quasi-ultrafine particles in an urban atmosphere [J].Atmospheric Environment,2011,45(4):1025-1033
[26]Alam M S, Delgado-Saborit J M, Stark C, et al. Using atmospheric measurements of PAH and quinone compounds at roadside and urban background sites to assess sources and reactivity [J].Atmospheric Environment,2013,77:24-35
[27]Verma V,Rico-Martinez R,Kotra N,et al.Contribution of water-soluble and insoluble components and their hydrophobic/hydrophilic subfractions to the reactive oxygen species-generating potential of fine ambient aerosols [J].Environmental Science & Technology, 2012, 46 (20):11384-11392
[28]Lin P, Yu J Z. Generation of reactive oxygen species mediated by humic-like substances in atmospheric aerosols[J]. Environmental Science & Technology, 2011, 45(24):10362-10368
[29]Dou J, Lin P, Kuang B Y, et al. Reactive oxygen species production mediated by humic-like substances in atmospheric aerosols: Enhancement effects by pyridine, imidazole, and their derivatives [J]. Environmental Science &Technology,2015,49(11):6457-6465
[30]Anderson H R,Atkinson R W,Peacock J L,et al.Meta-analysis of time-series studies and panel studies of particulate matter (PM) and ozone (O3): Report of a WHO task group [R]. Geneva: WHO,2004
[31]Cao J J, Xu H M, Xu Q, et al. Fine particulate matter constituents and cardiopulmonary mortality in a heavily polluted Chinese City [J]. Environmental Health Perspectives,2012,120(3):373-378
[32]Jiang H H, Jang M, Sabo-Attwood T, et al.Oxidative potential of secondary organic aerosols produced from photooxidation of different hydrocarbons using outdoor chamber under ambient sunlight [J]. Atmospheric Environment,2016,131:382-389
[33]Tuet W Y,Chen Y L,Xu L,et al.Chemical oxidative potential of secondary organic aerosol (SOA) generated from the photooxidation of biogenic and anthropogenic volatile organic compounds [J]. Atmospheric Chemistry and Physics,2017,17(2):839-853
[34]Chen J Y, Jiang H H, Chen S J, et al. Characterization of electrophilicity and oxidative potential of atmospheric carbonyls [J]. Environmental Science Processes & Impacts,2019,21(5):856-866
[35]Jiang H H, Jang M. Dynamic oxidative potential of atmospheric organic aerosol under ambient sunlight [J]. Environmental Science & Technology,2018,52(13):7496-7504
[36]Gant T W,Ramakrishna Rao D N,Mason R P,et al.Redox cycling and sulphydryl arylation; their relative importance in the mechanism of quinone cytotoxicity to isolated hepatocytes [J].Chemico-Biological Interactions,1988,65(2):157-173
[37]Tobias H J, Ziemann P J. Thermal desorption mass spectrometric analysis of organic aerosol formed from reactions of 1-tetradecene and O3 in the presence of alcohols and carboxylic acids [J]. Environmental Science & Technology,2000,34(11):2105-2115
[38]Wang Y,Kim H,Paulson S E.Hydrogen peroxide generation from α- and β-pinene and toluene secondary organic aerosols [J]. Atmospheric Environment, 2011, 45(18):3149-3156
[39]Docherty K S, Jaoui M, Corse E, et al. Collection efficiency of the aerosol mass spectrometer for chamber-generated secondary organic aerosols [J]. Aerosol Science and Technology,2013,47(3):294-309
[40]Lazzé M C, Pizzala R, Savio M, et al. Anthocyanins protect against DNA damage induced by tert-butyl-hydroperoxide in rat smooth muscle and hepatoma cells [J].Mutation Research/Genetic Toxicology and Environmental Mutagenesis,2003,535(1):103-115
[41]Kramer A J,Rattanavaraha W,Zhang Z F,et al.Assessing the oxidative potential of isoprene-derived epoxides and secondary organic aerosol [J]. Atmospheric Environment,2016,130:211-218
[42]Cai Y T, Schikowski T, Adam M, et al. Cross-sectional associations between air pollution and chronic bronchitis:An ESCAPE meta-analysis across five cohorts [J]. Thorax,2014,69(11):1005-1014
[43]Kang I G, Ju Y H, Jung J H, et al.The effect of PM10 on allergy symptoms in allergic rhinitis patients during spring season [J]. International Journal of Environmental Research and Public Health,2015,12(1):735-745
[44]Li N, Sioutas C, Cho A, et al. Ultrafine particulate pollutants induce oxidative stress and mitochondrial damage[J]. Environmental Health Perspectives, 2003, 111(4):455-460
[45]Jeng H A. Chemical composition of ambient particulate matter and redox activity [J]. Environmental Monitoring and Assessment,2010,169(1-4):597-606
[46]Fang T, Zeng L H, Gao D, et al. Ambient size distributions and lung deposition of aerosol dithiothreitol-measured oxidative potential: Contrast between soluble and insoluble particles [J]. Environmental Science & Technology,2017,51(12):6802-6811
[47]Samara C.On the redox activity of urban aerosol particles:Implications for size distribution and relationships with organic aerosol components[J].Atmosphere,2017,8(12):205
[48]Fang T, Guo H Y, Zeng L H, et al.Highly acidic ambient particles, soluble metals, and oxidative potential: A link between sulfate and aerosol toxicity [J]. Environmental Science & Technology,2017,51(5):2611-2620
[49]McCreanor J, Cullinan P, Nieuwenhuijsen M J, et al. Respiratory effects of exposure to diesel traffic in persons with asthma [J]. The New England Journal of Medicine,2007,357(23):2348-2358
[50]Pourazar J, Mudway I S,Samet J M,et al.Diesel exhaust activates redox-sensitive transcription factors and kinases in human airways [J]. American Journal of Physiology Lung Cellular and Molecular Physiology, 2005, 289(5):L724-L730
[51]Bräuner E V,Forchhammer L,Møller P,et al.Indoor particles affect vascular function in the aged: An air filtrationbased intervention study [J]. American Journal of Respiratory and Critical Care Medicine,2008,177(4):419-425
[52]Zelikoff J T,Chen L C,Cohen M D,et al.The toxicology of inhaled woodsmoke [J].Journal of Toxicology and Environmental Health, Part B,2002,5(3):269-282
[53]Ghio A J, Silbajoris R, Carson J L, et al. Biologic effects of oil fly ash [J]. Environmental Health Perspectives,2002,110(Suppl 1):89-94
[54]Borm P J A. Toxicity and occupational health hazards of coal fly ash (CFA). A review of data and comparison to coal mine dust [J]. The Annals of Occupational Hygiene,1997,41(6):659-676
[55]Wang Y, Arellanes C, Curtis D B, et al. Probing the source of hydrogen peroxide associated with coarse mode aerosol particles in southern California [J]. Environmental Science & Technology,2010,44(11):4070-4075
[56]Charrier J G, Richards-Henderson N K, Bein K J, et al.Oxidant production from source-oriented particulate matter: Part 1: Oxidative potential using the dithiothreitol(DTT) assay [J]. Atmospheric Chemistry and Physics,2015,15(5):2327-2340
[57]Daellenbach K R,Uzu G,Jiang J,et al.Sources of particulate-matter air pollution and its oxidative potential in Europe [J]. Nature,2020,587(7834):414-419
[58]Verma V,Fang T,Xu L,et al.Organic aerosols associated with the generation of reactive oxygen species (ROS) by water-soluble PM2.5[J]. Environmental Science & Technology,2015,49(7):4646-4656
[59]Fujitani Y, Furuyama A, Tanabe K, et al. Comparison of oxidative abilities of PM2.5 collected at traffic and residential sites in Japan. Contribution of transition metals and primary and secondary aerosols [J]. Aerosol and Air Quality Research,2017,17(2):574-587
[60]Cheung K L, Polidori A, Ntziachristos L, et al. Chemical characteristics and oxidative potential of particulate matter emissions from gasoline, diesel, and biodiesel cars [J]. Environmental Science & Technology,2009,43(16):6334-6340
[61]McWhinney R D,Badali K,Liggio J,et al.Filterable redox cycling activity:A comparison between diesel exhaust particles and secondary organic aerosol constituents [J]. Environmental Science & Technology,2013,47(7):3362-3369
[62]Fushimi A, Saitoh K, Hayashi K, et al. Chemical characterization and oxidative potential of particles emitted from open burning of cereal straws and rice husk under flaming and smoldering conditions [J]. Atmospheric Environment,2017,163:118-127
[63]Li Q,Shang J,Zhu T.Physicochemical characteristics and toxic effects of ozone-oxidized black carbon particles [J].Atmospheric Environment,2013,81:68-75
[64]Fox J R, Cox D P, Drury B E, et al. Chemical characterization and in vitro toxicity of diesel exhaust particulate matter generated under varying conditions [J].Air Quality,Atmosphere & Health,2015,8(5):507-519
[65]Verma V,Ning Z,Cho A K,et al.Redox activity of urban quasi-ultrafine particles from primary and secondary sources [J]. Atmospheric Environment, 2009, 43 (40):6360-6368
[66]Karavalakis G, Gysel N, Schmitz D A, et al. Impact of biodiesel on regulated and unregulated emissions, and redox and proinflammatory properties of PM emitted from heavy-duty vehicles [J]. Science of the Total Environment,2017,584-585:1230-1238
[67]Shirmohammadi F, Wang D B, Hasheminassab S, et al.Oxidative potential of on-road fine particulate matter(PM2.5) measured on major freeways of Los Angeles,CA,and a 10-year comparison with earlier roadside studies [J].Atmospheric Environment,2017,148:102-114
[68]Verma V, Fang T, Guo H, et al. Reactive oxygen species associated with water-soluble PM2.5 in the southeastern U-nited States: Spatiotemporal trends and source apportionment [J]. Atmospheric Chemistry and Physics, 2014, 14(23):12915-12930
[69]Yu S Y,Liu W J,Xu Y S,et al.Characteristics and oxidative potential of atmospheric PM2.5 in Beijing: Source apportionment and seasonal variation [J].Science of the Total Environment,2019,650:277-287
[70]Bates J T, Weber R J, Abrams J, et al. Reactive oxygen species generation linked to sources of atmospheric particulate matter and cardiorespiratory effects [J].Environmental Science & Technology,2015,49(22):13605-13612
[71]Shen H Z,Huang Y,Wang R,et al.Global atmospheric emissions of polycyclic aromatic hydrocarbons from 1960 to 2008 and future predictions [J]. Environmental Science& Technology,2013,47(12):6415-6424
[72]Saffari A, Daher N, Samara C, et al. Increased biomass burning due to the economic crisis in Greece and its adverse impact on wintertime air quality in Thessaloniki [J].Environmental Science & Technology, 2013, 47 (23):13313-13320
[73]Verma V, Polidori A, Schauer J J, et al. Physicochemical and toxicological profiles of particulate matter in Los Angeles during the October 2007 southern California wildfires [J]. Environmental Science & Technology, 2009, 43(3):954-960
[74]Vreeland H, Schauer J J, Russell A G, et al. Chemical characterization and toxicity of particulate matter emissions from roadside trash combustion in urban India [J].Atmospheric Environment,2016,147:22-30
[75]Liu Q Y, Baumgartner J, Zhang Y X, et al.Oxidative potential and inflammatory impacts of source apportioned ambient air pollution in Beijing [J]. Environmental Science & Technology,2014,48(21):12920-12929
[76]Secrest M H,Schauer J J,Carter E M,et al.The oxidative potential of PM2.5 exposures from indoor and outdoor sources in rural China [J]. Science of the Total Environment,2016,571:1477-1489
[77]Chirizzi D, Cesari D, Guascito M R, et al. Influence of Saharan dust outbreaks and carbon content on oxidative potential of water-soluble fractions of PM2.5 and PM10[J].Atmospheric Environment,2017,163:1-8
[78]Samake A, Uzu G, Martins J M F, et al. The unexpected role of bioaerosols in the Oxidative Potential of PM [J].Scientific Reports,2017,7(1):10978
[79]Janssen N A H, Strak M, Yang A, et al. Associations between three specific a-cellular measures of the oxidative potential of particulate matter and markers of acute airway and nasal inflammation in healthy volunteers [J].Occupational and Environmental Medicine,2015,72(1):49-56
[80]Dweik R A, Boggs P B, Erzurum S C, et al. An official ATS clinical practice guideline: Interpretation of exhaled nitric oxide levels (FENO) for clinical applications [J].A-merican Journal of Respiratory and Critical Care Medicine,2011,184(5):602-615
[81]Akhtar U S,McWhinney R D,Rastogi N,et al.Cytotoxic and proinflammatory effects of ambient and source-related particulate matter (PM) in relation to the production of reactive oxygen species (ROS) and cytokine adsorption by particles [J].Inhalation Toxicology,2010,22(sup2):37-47
[82]Carolina M, Richard T A, Manzano C A, et al. Airborne aerosols and human health: Leapfrogging from mass concentration to oxidative potential [J].Atmosphere,2020,11(9):917
[83]Zhang Y X, Schauer J J, Shafer M M, et al. Source apportionment of in vitro reactive oxygen species bioassay activity from atmospheric particulate matter [J]. Environmental Science & Technology,2008,42(19):7502-7509
[84]Gallimore P J, Mahon B M, Wragg F P H, et al. Multiphase composition changes and reactive oxygen species formation during limonene oxidation in the new Cambridge Atmospheric Simulation Chamber (CASC) [J]. Atmospheric Chemistry and Physics,2017,17(16):9853-9868
[85]Alpert P A,Dou J,Corral Arroyo P,et al.Photolytic radical persistence due to anoxia in viscous aerosol particles[J]. Nature Communications,2021,12:1769
[86]Venkatachari P, Hopke P K. Development and laboratory testing of an automated monitor for the measurement of atmospheric particle-bound reactive oxygen species (ROS)[J].Aerosol Science and Technology,2008,42(8):629-635
[87]Velali E, Papachristou E, Pantazaki A, et al.Redox activity and in vitro bioactivity of the water-soluble fraction of urban particulate matter in relation to particle size and chemical composition [J]. Environmental Pollution, 2016,208:774-786