水是地球上所有生物赖以生存的基础。 随着全球经济的快速发展,科学技术水平的不断提高,人口数量的迅速增长,工业化与城市化步伐的加速前进,人类对水资源的使用量急剧增加,污水排放量也相应增加,使得水体污染和水资源短缺等问题日益严重[1]。 水体污染的来源主要有工业废水、农业废水和生活污水三大类,各类污染物进入水体后随食物链(网)传递,对生态环境健康造成危害,并最终制约人类的可持续发展。 传统的污水治理方法以微生物法、物理法和化学法为主,这些方法虽已较为成熟但仍存在成本较高、或不完全去除而易造成二次污染等缺点。 近年来,研究者们致力于探寻能实现人类社会、经济与自然和谐统一的污水治理方法,植物修复技术因其独特优势得到了广泛关注。 植物修复技术是指利用植物及其相关微生物特有的生理生化反应过程,如光合作用、挥发转化作用、稳定生态作用和植物根系微生物的生物降解转化作用等,对大气、土壤和水体中污染物进行有效去除的技术手段[2-3]。植物修复技术因具有成本低廉、环境友好等特性而广泛应用于水体中各类污染物的去除[4]。 已有研究表明,植物修复技术在去除或降解如氮磷营养盐、重金属和有机污染物等多种有毒有害污染物上都表现出了较强的应用潜力[2,5]。
浮萍是一种水生漂浮植物,其因具有较强的适应能力和较好的污水修复能力而吸引了大量研究者的关注。 浮萍属于被子植物门,单子叶植物纲,属于天南星科浮萍亚科(Lemnoideae),包含5个属,分别为紫萍属(Spirodela)、少根紫萍属(Landoltia)、青萍属(Lemna)、扁无根萍属(Wolffiella)和芜萍属(Wolffia),共有36个种;其中,芜萍属是世界上最小的开花植物[6-7]。 与大型水生植物(如水葫芦、水花生等)相比,浮萍个体微小且结构简单,由叶状体和假根(紫萍属、少根紫萍属和青萍属)或仅由叶状体组成(扁无根萍属和芜萍属);易于培养,无性繁殖生长速度快;因其形状体积小且漂浮于水面,易于收获。 浮萍营养价值高,低纤维,富含淀粉、蛋白质、叶黄素和赖氨酸等,是良好的食品、饲料和生物质基质来源。 此外,浮萍广泛分布于世界各类淡水生境中,对环境适应能力强,是生态毒理研究和污染水体修复研究中的常用模式生物[8]。 本文针对浮萍在污染水体修复领域中的研究进展及其应用现状进行综述,分别阐述了浮萍对氮磷营养盐、重金属和有机污染物的吸收积累研究概况,为浮萍在污染水体修复中的应用提供科学依据。
1 浮萍对氮磷营养盐吸收的研究(Uptake of nitrogen and phosphorus by duckweed)
随着工农业的快速发展,大量含氮、磷元素的废水未经处理就直接进入各类水体,导致水体中氮、磷等营养元素含量不断增加,使得藻类及其他浮游生物大量繁殖,进而造成水体富营养化,对人类健康和生态环境造成严重危害。 针对水体富营养化的治理,目前常用的脱氮除磷方法有厌氧-缺氧-好氧法、氧化沟工艺和序批式活性污泥法等;这些方法主要是利用微生物的代谢去除水中的氮磷营养盐,其应用范围均受到一定的限制,且运行成本较高[9]。 而浮萍不仅对废水中的氮磷具有较高的耐受性,而且能够有效吸收水体中的氮、磷等营养元素,并将其转化为自身的生物量积累[10]。 此外,浮萍因具有生长繁殖速度快、生物量高、光合效率高和易于收获等优点,广泛应用于各种水生生态系统的污染修复中[11]。与传统的脱氮除磷方法相比,利用浮萍去除水中的氮磷营养盐具有绿色环保,不易造成二次污染,且处理过程所需能耗低、成本低等特点。 大量研究表明,浮萍能有效去除废水中的氮磷,改善水体富营养化状况,约0.3 ~1.0 g·L-1的浮萍就可以去除城市污水中 20 ~50 mg·L-1的总溶解无机氮[10]。 常规污水处理中,污水中生化需氧量和磷酸盐含量经过一次和二次处理过程均仅能降低约50%,而Priya 等[12]利用青萍(Lemna minor)对印度一学生宿舍产生的生活污水进行处理,结果显示,生活污水经浮萍处理后生化需氧量和正磷酸盐水平分别能够降低94.45%和79.39%。 李琪等[13]利用少根紫萍(Landoltia punctata)处理微污染地表水体,经处理的Ⅴ类、劣Ⅴ类水体中氨氮和总磷含量在3 d 内能够达到地表Ⅱ类水标准,且对氮、磷去除率均达到98.5%和82.9%以上。 用于污水处理的浮萍不仅能够高效富集氮磷,改善水体富营养化状况,还能快速繁殖并累积淀粉;因此,需要加强其管理,及时打捞浮萍,并将其资源化利用,以防打捞不及时或处理不当造成水体二次污染。
研究者通过对浮萍吸收废水中氮磷营养盐的大量研究发现,多种浮萍具有去除水体中氮磷营养盐的能力,且不同种类浮萍对氮磷的吸收能力存在一定的差异。 谢朦等[14]在实验室条件下探究了紫萍(S. polyrhiza)、稀脉浮萍(L. aequinoctialis)和少根紫萍(L. punctata)这3 种浮萍对富营养化水体的修复效果,结果显示,上述3 种浮萍对总氮的去除率分别为80.3%、73.7%和83.8%,对总磷的去除率分别为98.8%、96.4% 和 99.3%。 Yilmaz 和 Akbulut[15]研究发现,青萍(L. minor)对普通废水的净化能力比卵叶青萍(L. gibba)强,且L. minor 对养猪废水的净化能力比 L. punctata 和 S. polyrhiza 强。 此外,水体中氮磷的浓度和存在形态都会影响浮萍对其吸收效果。顾新娇等[16]探究了L.minor 对不同浓度猪场养殖废水中氮的去除能力,结果显示,当废水浓度按体积分数用自来水稀释至1%时L. minor 对氨氮的去除率高达97.48%,然而当废水浓度按体积分数用自来水稀释至5%和10%时L. minor 对氨氮的去除率仅为70%左右。 通常,废水中的氮主要以铵态氮![]() N)和硝态氮
N)和硝态氮![]() 的形式存在;其中
的形式存在;其中![]() 是植物中最重要的氮源,但当水体中
是植物中最重要的氮源,但当水体中![]() 浓度过高时,会降低植物的光合效率,从而减缓其生长速率。有研究表明,浮萍对废水中不同形式氮的吸收能力不同[17]。 沈根祥等[18]通过吸收动力学实验发现,少根紫萍(S. oligorrhiza)对
浓度过高时,会降低植物的光合效率,从而减缓其生长速率。有研究表明,浮萍对废水中不同形式氮的吸收能力不同[17]。 沈根祥等[18]通过吸收动力学实验发现,少根紫萍(S. oligorrhiza)对![]() 的亲和力大于对
的亲和力大于对![]() 的亲和力;且当水体中氮浓度较低时,S. oligorrhiza 会优先吸收净化
的亲和力;且当水体中氮浓度较低时,S. oligorrhiza 会优先吸收净化![]()
相比于单独培养,共培养体系对部分废水的修复能力更强,其中包括不同种类浮萍、浮萍与其他水生植物、浮萍与微生物共培养等多种方式。 有研究者建立了多种浮萍混合培养的共培养体系,并发现2 种或2 种以上的浮萍组合对水体中氮磷营养盐的去除效果最好[19]。 浮萍共培养体系对部分水体中氮磷去除效果具有一定促进作用的原因可能是:(1)通过共培养的方式,有效增强了浮萍对不利环境的抵抗能力[20];(2)鉴于不同种类浮萍对氮磷的吸收能力有差异,通过共培养能发挥个体的优势,实现资源互补和生态位分化,从而达到最优化效果[21]。 李阳等[22]将 L. aequinoctialis LC33、L. punctata LC06 和S. polyrhiza LC15 这3 种浮萍分别进行单独培养和共培养,发现这3 种浮萍组成的共培养体系对水中![]() 的去除效果最佳,去除率高达 98.17%。Zhao 等[23] 研 究 发 现, L. minor、 L. punctata 和S. polyrhiza 这3 种浮萍组成的共培养体系对养猪废水的修复能力优于单一培养的浮萍。 由于不同植物物种对污染物的适应能力存在差异,部分研究者开始探讨浮萍与其他植物共培养对水体中氮磷的净化效果,以期寻求最优组合,为浮萍在实际水体修复中的应用提供新思路。 邓鸿杨[24]探讨了不同类型水生植物组合去除氮磷效果,发现“浮萍+茭白”组合对氮磷的去除效果优于“金鱼草+黄花鸢尾”和“睡莲+黄花鸢尾”组合。 此外,浮萍与部分微生物的相互作用对水体中氮磷的去除具有协同作用。 与浮萍共生的微生物群落包括植物生长促进菌(PGPB)和植物生长抑制菌(PGIB),接种对浮萍生长具有促进作用的菌群能够显著提高水体中浮萍的生物量,从而增强浮萍对水体中氮磷的净化效果[25]。 Chen等[26]通过添加微生物强化浮萍处理系统,该系统的启动时间大大缩短了,且其对
的去除效果最佳,去除率高达 98.17%。Zhao 等[23] 研 究 发 现, L. minor、 L. punctata 和S. polyrhiza 这3 种浮萍组成的共培养体系对养猪废水的修复能力优于单一培养的浮萍。 由于不同植物物种对污染物的适应能力存在差异,部分研究者开始探讨浮萍与其他植物共培养对水体中氮磷的净化效果,以期寻求最优组合,为浮萍在实际水体修复中的应用提供新思路。 邓鸿杨[24]探讨了不同类型水生植物组合去除氮磷效果,发现“浮萍+茭白”组合对氮磷的去除效果优于“金鱼草+黄花鸢尾”和“睡莲+黄花鸢尾”组合。 此外,浮萍与部分微生物的相互作用对水体中氮磷的去除具有协同作用。 与浮萍共生的微生物群落包括植物生长促进菌(PGPB)和植物生长抑制菌(PGIB),接种对浮萍生长具有促进作用的菌群能够显著提高水体中浮萍的生物量,从而增强浮萍对水体中氮磷的净化效果[25]。 Chen等[26]通过添加微生物强化浮萍处理系统,该系统的启动时间大大缩短了,且其对![]() 和总氮(TN)的去除率超过了普通浮萍处理系统,分别达到80.02%和56.42%。 Ishizawa 等[27]选择不动杆菌株 P23 作为PGPB 对浮萍体系进行培养,结果表明,添加PGPB 的实验组中浮萍生物量是对照组(不添加PGPB)的1.9 倍~2.3 倍,且其对水体中氮磷的去除效果更好。
和总氮(TN)的去除率超过了普通浮萍处理系统,分别达到80.02%和56.42%。 Ishizawa 等[27]选择不动杆菌株 P23 作为PGPB 对浮萍体系进行培养,结果表明,添加PGPB 的实验组中浮萍生物量是对照组(不添加PGPB)的1.9 倍~2.3 倍,且其对水体中氮磷的去除效果更好。
2 浮萍对重金属吸收的研究(Uptake of heavy metals by duckweed)
在工业生产过程中产生的重金属会随工厂固体废弃物、废水和废气等直接或间接地进入受纳环境中,通过一系列迁移转化进而污染河流、湖泊等水体环境[28]。 与其他有机物相比,重金属因其具有难降解、强毒性以及可生物积累等特性,进入水体环境后容易在水生生物体内富集,影响水生生物的正常生理代谢活动,进而通过食物链(网)对人体健康造成威胁,对生态环境造成严重的影响。 目前,重金属已成为我国水体中主要污染物之一,水体中主要存在的重金属有铅(Pb)、汞(Hg)、砷(As)、镉(Cd)、铬(Cr)、铜(Cu)、锌(Zn)和镍(Ni)等[29]。 污水处理厂中使用的常规处理技术如混凝沉淀、氧化还原、化学沉淀和离子交换等工艺能够一定程度去除水体中的重金属元素,但会对环境造成不利影响且处理成本较高[30]。而植物修复技术因其具有成本低廉、无二次污染等优点,已成为国内外学者的研究热点。 浮萍作为漂浮植物的一种,由于其特殊的形态和较高的生长速率,对重金属有较高的吸收效率[29]。 此外,浮萍还可通过螯合作用和液泡的区室化作用来抵御重金属的毒性作用[31],并通过生物吸附和细胞内积累等方式有效去除水中重金属[32]。 在过去30 多年里,研究者们进行了大量浮萍去除水中重金属的研究,研究表明,浮萍可以有效吸收水中低浓度且不易去除的重金属,对 Ni、Cu、Cd、Zn、锰(Mn)、As 和铀(U)等多种重金属具有较好的吸收富集效果[33-35]。 本研究对近年来浮萍去除重金属的研究情况进行了总结,如表1 所示。 Chen 等[36]对中国南方不同种源的30 种浮萍进行了Cd 的毒性和累积效应研究,结果表明,不同种类浮萍对Cd 的耐受性不同,且其生物量、光合色素和抗氧化酶活性均存在较大差异。 重金属对浮萍的毒性作用是限制浮萍应用的主要因素,因此筛选对特定重金属适应能力强、生物积累能力佳且抗逆性好的浮萍种类将有利于提高浮萍对重金属污染水体的修复效果。
浮萍在重金属修复方面的应用已在许多研究中获得较好的效果,有研究者发现,将不同种类的浮萍混养、将浮萍与微生物或其他大型植物共培养均会对重金属的吸收效果产生不同程度的影响。 Zhao等[37]将 L. punctata 和 L. minor 这 2 种浮萍分别单独暴露和混合暴露于含不同浓度Cu 的培养基中,研究发现,低浓度和高浓度条件下,2 种浮萍均可以耐受和累积一定量的Cu,且低浓度条件下,混合培养体系对Cu 的累积量高于单独培养体系;高浓度条件下,混合培养体系对Cu 的累积量低于单独培养体系,浮萍通过增强抗氧化酶的活性抵御高浓度Cu的毒性作用,限制了对Cu 的吸收。 由于不同种类浮萍对重金属毒性的耐受性和富集能力存在差异,将不同种类的浮萍混养能在一定程度提高其生物量和抗氧化酶的活性,有效降低重金属对浮萍的毒性,从而提高浮萍对水体中重金属的修复效果[38]。 此外,当与植物根系相关的微生物存在时,浮萍对体系中重金属的吸收会受微生物影响。 Stout 等[39]从浮萍根中分离得到多种细菌,并对比分析了无菌浮萍与附着有细菌的浮萍对Cd 的吸收效果,意外发现细菌的存在促进了浮萍根的生长,但在一定程度上抑制了浮萍对Cd 的累积。 研究者推测,细菌的存在对浮萍起到了一定的保护作用,通过抑制有害Cd进入浮萍细胞内,有效降低Cd 对浮萍的毒性作用[39]。 由此可见,浮萍与其他水生植物或微生物混合培养,有利于充分发挥不同水生植物对不同种重金属的吸收能力,提高水体修复效果,具有一定的应用前景。
另外,还有部分研究发现,浮萍对重金属的吸收能力受重金属的化学形态、初始浓度和不同重金属间相互作用的影响。 彭赟和严彬[40]探讨了浮萍对不同浓度Cd2+的去除效果,研究发现,当Cd(NO3)2 溶液浓度为3 mg·L-1 时,浮萍对其去除率可高达87%;但随着Cd(NO3)2 溶液浓度的进一步升高,浮萍对其去除率有所降低。 分析其原因,过高浓度的Cd2+会对浮萍产生毒性作用,影响其正常生长繁殖,进而影响其对Cd2+的去除效果[40]。 在自然界中,重金属污染水体一般为多种重金属复合污染。 多种重金属的共存,既有可能通过协同作用加剧其对浮萍的毒性作用,也可能通过拮抗作用降低其对浮萍的毒性作用,进而促进浮萍对重金属的吸收积累[41]。王秀娟[42]分别探究了Cu 和Ni 单一暴露和联合暴露对紫萍(L. polyrhiza)生长的影响,结果表明,Cu2+和 Ni2+在较低浓度联合(0.2 mg·L-1+5 mg·L-1和 0.6 mg·L-1+10 mg·L-1)暴露时,对 L. polyrhiza 生长表现出拮抗作用;而在高浓度联合(1 mg·L-1+20 mg·L-1)暴露时则表现为协同作用,对L. polyrhiza 叶绿素含量的抑制率高达73%。
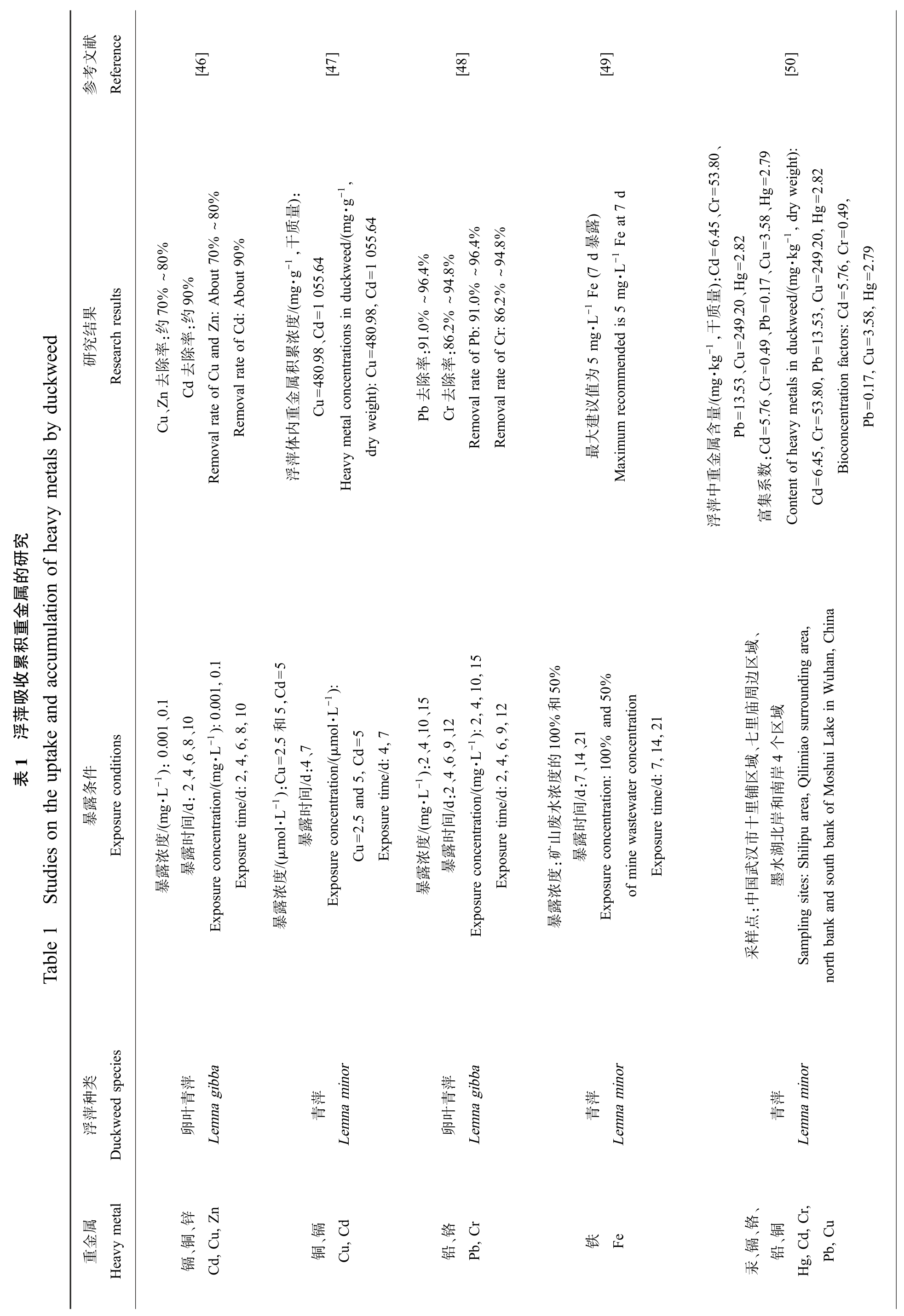
eedmetals by duckw究eavy研f h的属金重积ulation o累收吸萍浮1表n the uptake and accum S tudies oTable 1参Reference献文考果结究研R esearch results件条露暴E xposure conditions类种萍浮Duckweed species属etal金重Heavy m[46]~80%% ~80%%bout 70%90bout 90%:约7:约0n: A d: A率除率除u and Z、Zn 去Cd 去Cu Removal rate of C Removal rate of C-1):0.001、0.1-1)::2、4、6、8、100.001,0.1 108,6,4,2,/(mg·L /(mg·L/d e/d:间度时浓露露暴暴Exposure concentration Exposure tim萍青叶卵Lemna gibba、锌n、铜镉Cd, C u, Z[47]):-1,量质g·g.64-1,干eed/(m/(mg·g .64 1 0551 055 d=, C浓、C度d=480.98积累.98u=属金重Cu=480内etal concentrations in duckw eight): C体萍dry w浮Heavy m 5,Cd=5-1):2.5 和/(μmol·L 5d=74,-1):C u=/d:4、7, Ce/d:间ol·L 时露.5 and 5/(μm 暴=2Cu Exposure tim度浓露Exposure concentration暴inor萍青L em na m、镉铜Cu, C d[48]~96.4%~94.8%~96.4%~94.8%.0%91.2%86:91.0%b:.2%r:率率:86除除Pb 去Cr 去Removal rate of P Removal rate of C 15、15,10,-1):2、4、10-1):2:2、4、6、9、12,4129,6,4,2,/(mg·L /d /(mg·L e/d:间度时浓露露暴暴Exposure concentration Exposure tim萍青叶卵Lemna gibba、铬r铅Pb, C[49])露-1 Fe (7 d 暴-1 F e at 7 dg·L g·L5 m为m ended is 5 m值议建大最Maximum recom%50和100%,21度:7、14、21% and 50%的147,浓/d e/d:水间废时astewater concentration:矿山露暴度ine w Exposure tim浓of m露暴Exposure concentration:100 inor萍青Lemna m铁Fe[50]、、Cr=53.80.79、Hg=2-1, dry w eight):2.82g=,.45.58, H 0.49=62.82=3r=):Cd g·kg 249.20, C 2.79量、H g=、Cu.17u=5.76 g=质.20、Pb eed/(m=0, C d=, H-1,干.53133.58/(mg·kg =2 0.49 49 b=u=量=13.53、Cu , C、C r=etals in duckw, P.80.17=0含Pb 5.7653r=Pb属:C d=, C金重数.45 Bioconcentration factors: C中系=6萍集Cd浮 富Content of heavy m、hina域, C区边uhan周庙域、七里区域4个iao surrounding area,ake in W区岸ilim铺南oshui L里和十岸市北汉湖武水hilipu area, Q国墨:中点样采Sampling sites: S north bank and south bank of M inor萍青Lemna m、r,、铬u、镉、铜d, C铅, C汞Hg, C Pb
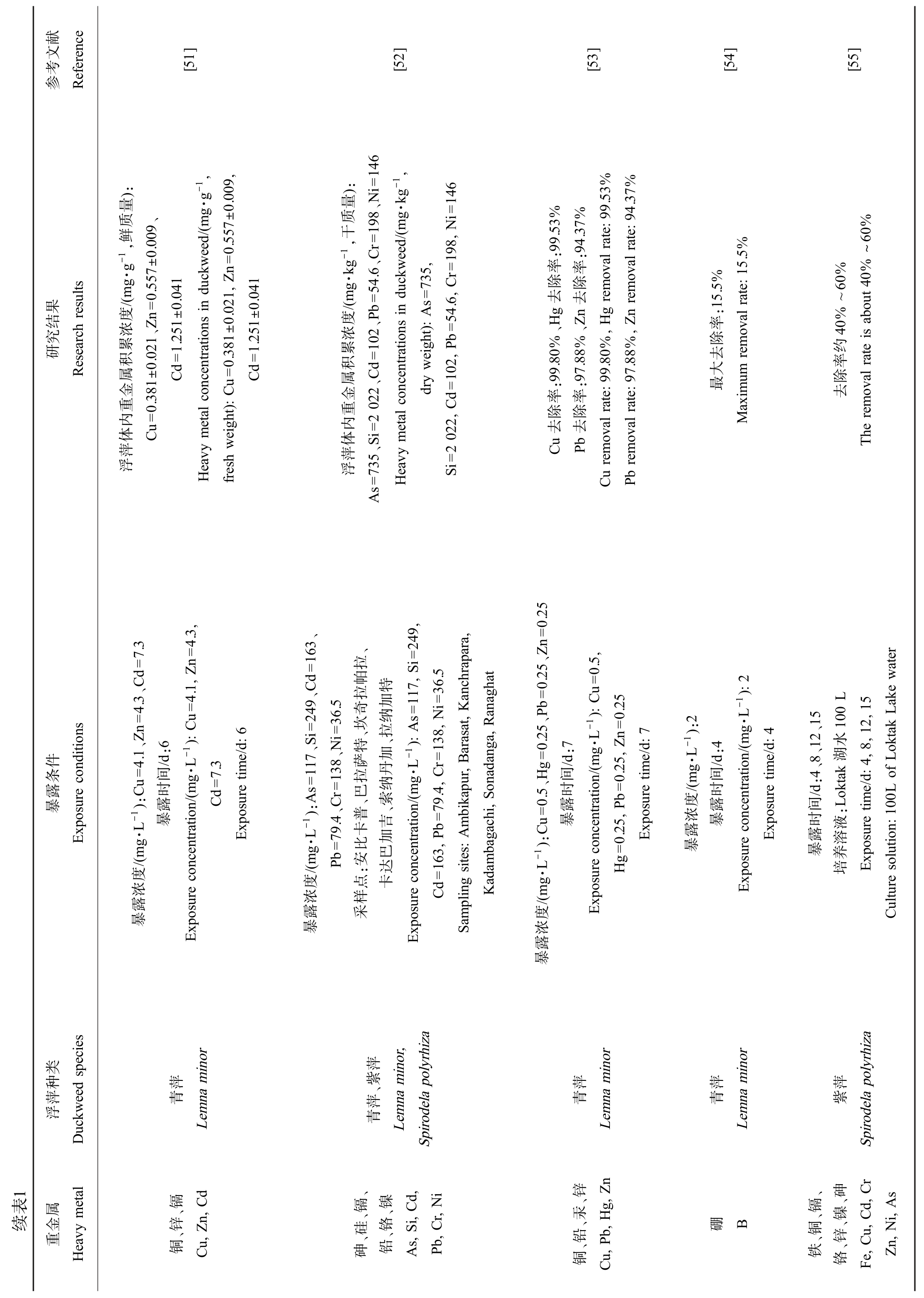
1表续参Reference献文考果结究研R esearch results件条露暴E xposure conditions类种萍浮Duckweed species属etal金重Heavy m[51]):g·-g 1,量质-1,鲜eed/(m 0.557±0.009,/(mg·g.557±0.009、0.381±0.021, Z.251±0.041 etal concentrations in duckw n=度.381±0.021、Zn=0浓累.251±0.041积=1=1属Cd Cd金u=重内体Cu=0 eight): C萍浮Heavy m fresh w.34.3,.3、Cd=7n=4.1, Z.1、Zn=4-1): C u=6/d:6.3e/d:-1):Cu=4间时=7露/(mg·L Cd/(mg·L 暴Exposure tim度浓露暴Exposure concentration inor萍青Lemna m、镉d、锌铜Cu, Z n, C[52]):量、Ni=146 g·-kg 1,146质i=-1,干/(mg·kg=54.6、Cr=198 eed/(m 735,198, N r=度、Pb etal concentrations in duckw s=.6, C累=10254浓b=属、Cd积eight): A体、Si=2 022102, P金dry w d=重内, C萍浮=735 Si=2 022 As Heavy m、、249,i=、Cd=163拉帕特.5 117、Si=249、Ni=36.5拉奇加117, S 36i=anchrapara,、坎纳anaghat特s=、拉138, N萨加-1): A arasat, K r=-1):A s=、巴拉丹纳onadanga, R=79.4、Cr=138普、索/(mg·L.4, C79/(mg·L 卡吉b=mbikapur, B Pb 比加, P:安巴达度 点卡=163浓 样Cd Kadambagachi, S露 采暴Exposure concentration Sampling sites: A、紫萍inor,萍青Lemna m Spirodela polyrhiza、、镉、镍d,i、硅、铬i, C r, N, C砷铅As, S Pb[53]%%%.53.37 99%94:99.53:94.37率率oval rate:oval rate:%、Hg 去除除%、Zn 去g rem%, H n rem%, Z:99.80:97.88.8099.8897率率除除Cu 去Pb 去oval rate:Cu rem oval rate:Pb rem.25、Zn =0.25 0.5,-1): C=0u=、P b.25 0.25n=7.5、Hg=0:7/d , Z e/d:间/(mg·L 0.25b=时-1):Cu=0露暴, P.25=0Exposure tim/(mg·L Hg度Exposure concentration浓露暴inor萍青Lemna m、锌n、汞g, Z、铅铜Cu, P b, H[54].5%15:15.5%率oval rate:除去大最Maximum rem-1):2-1):2/(mg·L:44/d e/d:间时浓暴度露露暴Exposure concentration/(mg·L Exposure tim inor萍青Lemna m硼B[55]~60%去%oval rate is about 40%60% ~40约率除The rem ater、15,15ake w:4、8、12100 L水8,12间:Loktak 湖4,oktak L/d e/d:of L时液100L暴养露溶培Exposure tim Culture solution:萍紫Spirodela polyrhiza、r s、镉、砷d, C i, A、铜、镍铁、锌铬Fe, C u, C Zn, N
基于浮萍对重金属具有较强的吸收富集潜力,现已有大量利用浮萍修复实际污水的研究。Bokhari 等[43]调查了L. minor 对城市污水和工业废水出水中重金属的修复情况,发现L. minor 对这2类水体均有较强的修复能力,浮萍对其中各重金属的去除率如下:Cd(94.3%和94.7%)、Cu(92.2%和94.5%)、Pb(89% 和 97.4%)、Ni(84.2% 和 99%)。 此外,还有研究者把浮萍制成干粉,因其拥有较大比表面积和较高的孔隙率,可用作水中重金属去除的有效生物吸附剂[7]。 陈兰钗等[44]以稀脉浮萍(L. aequinoctialis)干粉作为生物吸附剂探讨其对重金属Pb 的吸附动力学及主要影响因素,研究发现,L. aequinoctialis 干粉对Pb 的吸附符合二级动力学方程,其吸附量在高达56.79 mg·g-1 时仍未达到吸附饱和点,说明L. aequinoctialis 干粉对Pb 的吸附容量大;同时,溶液初始pH、吸附剂颗粒大小和重金属Pb 的初始浓度是影响吸附效果的主要因素。 李阳等[45]探究了多根紫萍(S. polyrhiza) 干粉和少根紫萍(L. punctata)干粉对水环境中Cd2+的吸附作用,结果表明,2 种浮萍干粉对Cd(50 mg·L-1)的去除率分别为83.15%(L. punctata)和95.72%(S. polyrhiza),且其吸附动力学过程均可用二级速率方程进行描述。
3 浮萍对有机污染物吸收的研究(Uptake of organic pollutants by duckweed)
目前,水环境中有机物污染已成为一个全球性问题。 随着农业、工业和经济的不断发展,大量有机污染物随农用灌溉废水,化工、制药、造纸等工业废水,或生活污水等直接或间接进入受纳水环境;其中,一部分通过地表径流流入地表水源中,而另一部分渗入地下水源中。 据不完全统计,全球范围内的有机污染物种类繁多、总量庞大,现有的有机污染物已多达700 万种,其中人工合成的有机污染物种类也有10 万余种,且每年仍以较高速度不断递增[56]。部分有机污染物,不仅具有难生物降解、易在环境中随食物链积累等特性,还具有使动物和人类致畸、致癌和致突变的作用,严重威胁生态环境安全和人类健康。 因此,亟需寻求能够高效、经济去除水环境中有机污染物的可持续性发展技术。
已有研究发现,浮萍对水中有机污染物的胁迫具有较高的耐受能力且具有一定的恢复能力,可以有效去除部分有机污染物。 刘娥等[57]探究了L. minor 对有机污染胁迫的耐受能力以及胁迫解除后浮萍的恢复规律,研究发现,当水中化学需氧量(COD)<400 mg·L-1 时,L. minor 并未受到氧化胁迫;当水中 COD 达 800 mg·L-1时,L. minor 体内活性氧和抗氧化物质含量升高,但其仍可继续生长,当胁迫去除后,L. minor 的抗氧化防御系统能够恢复正常水平;当水中COD 过高时(≥1 000 mg·L-1),活性氧急剧上升,抗氧化防御系统遭受不可逆伤害。 鉴于浮萍对有机污染具有较强的耐受能力,不少研究者开始针对浮萍吸收水中有机污染物展开研究,以期利用浮萍对有机污染水体进行修复。 现有研究发现,浮萍能够吸附或吸收水体中的多种有机污染物,如农用化学品[58]、药物和个人护理产品(PPCPs)[59]以及其他工业化合物[60]等。
与不可生物降解的重金属相比,浮萍不仅能够有效吸收积累农用化学品,还能将其降解转化为自身生长发育可利用的有效组分[61]。 Dosnon-Olette等[62]以10 μg·L-1的异丙隆和80 μg·L-1的草甘膦对L. minor 进行为期4 d 的暴露实验,探讨L.minor 对异丙隆和草甘膦等2 种除草剂的去除效果,发现L. minor 对异丙隆和草甘膦的去除率分别为25%和8%,其对2 种除草剂去除效果的差异可能与化合物的正辛醇-水分配系数(logKow)相关。 Olette 等[63]比较了L. minor,伊乐藻(Elodea canadensis)和黄金鱼草(Cabomba aquatica)这3 种水生植物对硫酸铜和烯酰吗啉(2 种杀菌剂)和啶嘧磺隆(除草剂)的去除效果,研究发现,3 种水生植物均能吸收一定量的农药,去除率范围为2.5% ~50%;相比于其他2 种水生植物,L. minor 对3 种农药的去除效果较好,分别为 50%、11.5% 和 42% 。 Yılmaz 和 Taş[64]评价分析了L.minor 对氯氰菊酯的修复潜力发现,L.minor 对氯氰菊酯的去除率为35.4% ~95.9%。 大量研究证明,多种浮萍具有去除农药的潜力,但不同种类的浮萍对于同种农药的吸收能力存在差异。 Dosnon-Olette 等[65]对 2 种浮萍(L.minor 和 S.polyrhiza)去除废水中烯酰吗啉的能力进行了评估,结果显示L. minor 和S. polyrhiza 对污染物的最大去除量分别为 41 μg·g-1和26 μg·g-1(鲜质量),且浮萍对污染物的吸收量与其初始暴露浓度呈正相关。 Prasertsup 和Ariyakanon[66]在温室中探究L. minor 和水浮莲(P. stratiotes)对不同浓度毒死蜱的去除能力,结果显示,低浓度(0.1 mg·L-1 和 0.5 mg·L-1)暴露对L. minor 和P. stratiotes 的生长无显著影响,高浓度(1 mg·L-1)暴露会抑制其生长;且当毒死蜱暴露浓度为 0.5 mg·L-1时,L.minor 和 P.stratiotes 对其去除率最高,分别为87%和82%。 此外,有研究者发现,通过添加生物刺激剂或安全剂能够提高浮萍对农药的耐受性并增强其吸收能力。 Panfili 等[67]研究发现,与未经处理的L. minor 相比,经生物刺激剂和安全剂处理的L. minor 对水中除草剂特丁津的去除率均有所提高。
PPCPs 是一类新型污染物,主要包括抗生素、止痛药、消炎药、消毒剂和芳香剂等,因其使用量较大且现有的污水处理工艺难以将其完全去除,导致部分PPCPs 类污染物随污水处理厂出水直接或间接排放入水环境中。 目前,已在多种水环境介质中检出PPCPs 残留,且其残留浓度一般为 ng·L-1到 μg·L-1之间[68-69]。 已有研究证明,多种浮萍具有去除废水中 PPCPs 的潜力。 Singh 等[59]研究发现,阿莫西林在S. polyrhiza 处理组和非生物对照组中的去除率分别为 84.6% ~ 100% 和 62.1% ~ 73%,说明S. polyrhiza 对阿莫西林具有一定的去除能力。 Iatrou 等[70]探究了L. minor 对4 种抗菌剂的去除效果及其机制,研究表明L. minor 对4 种抗菌剂的去除效率分别为头孢羟氨苄(100%)、甲硝唑(96%)、甲氧苄氨嘧啶(59%)和磺胺甲恶唑(73%),且甲硝唑、甲氧苄氨嘧啶和磺胺甲恶唑3 种化合物的去除机制以植物吸收占主导。 由此可见,浮萍对多种PPCPs 具有去除潜力,且具有一定的化合物特异性。 此外,当抗生素浓度水平较高时会导致浮萍代谢过程发生变化,进而影响其对抗生素的去除能力。 Gomes 等[71]通过研究发现,高浓度的环丙沙星会损害L. minor呼吸电子传递链中正常的电子流,诱导过氧化氢的产生,从而改变浮萍的光合作用、呼吸途径和氧化应激能力,进而影响其对环丙沙星的去除能力。
鉴于浮萍对于农药、PPCPs 等有机污染物的去除效果较好,研究者们试图探讨浮萍是否能有效去除其他有机污染物。 Gatidou 等[60]利用L. minor 去除水体中的5 种苯并三唑类化合物(苯并三唑、4-甲基-1H-苯并三唑、5-甲基-1H-苯并三唑、甲苯并三唑和5-氯苯并三唑),结果表明,在连续流系统中,L. minor 对这5 种化合物的去除率为26% ~72%,依次为5-氯苯并三唑<甲苯并三唑<5-甲基-1H-苯并三唑<苯并三唑<4-甲基-1H-苯并三唑;且植物吸收是浮萍去除苯并三唑类化合物的主要机制。 Zhang和Liang[72]比较了曝气情况下L. minor 对8 种全氟烷酸的去除效果,研究结果表明,L. minor 对十一氟已酸、全氟庚酸、全氟辛酸和全氟辛基磺酸等长链全氟烷酸的去除率超过95%,而对全氟丁酸、全氟戊酸、全氟丁烷磺酸和全氟己烷磺酸等短链全氟烷酸的去除效果不明显;且暴露2 周后,L. minor 胞内全氟辛基磺酸的积累量可达14.4%。 随后,研究者们进一步探讨了L. minor 对全氟烷基化合物中间产物的吸收积累效果,结果表明,暴露14 d 后,浮萍对200 μg·L-1 全氟辛基磺酰胺的吸收积累量为86.7 μg·kg-1,而对 200 μg·L-1氟调聚物磺酸盐的吸收积累量可达 1 226 μg·kg-1[73]。 Can-Terzi 等[74]探讨了L. minor 对亚甲基蓝的植物修复能力,结果表明,L. minor 可以有效地去除废水中的亚甲基蓝,去除率高达98%;当亚甲基蓝浓度为25 mg·L-1 时,L. minor 对其吸收能力达到饱和。 还有研究表明,浮萍可以有效去除或降解石油中各类碳氢化合物。Ekperusi 等[75]以人工湿地为生态系统,对比分析添加三叶浮萍(L. paucicostata)对原油污染水域中石油烃的去除能力,研究表明,经过120 d 处理后,与对照组湿地相比(11.46%),添加L. paucicostata 的湿地对石油烃类化合物的去除率高达97.91%。 然而,当前关于浮萍对污染物的吸收转化研究普遍局限于实验室内研究,且多侧重于污染物的去除效率方面,其内在吸收转化机制尚不清楚。 因此,有必要加强浮萍对污染物的吸收转化机制研究,并扩大其在大规模水环境中的应用。
4 展望(Prospect)
浮萍因其环境适应能力强,对氮磷营养盐、重金属和有机污染物等均具有较强的富集能力,常用于环境监测和水体污染修复方面的研究。 近年来,针对浮萍开展的基础研究和应用基础研究取得了较大的进展,在污染水体的生态修复方面发挥了多方面的作用。 在国外,已有一些污水处理公司致力于浮萍污水处理系统的开发和利用,并拥有了一系列利用浮萍进行污水处理的专利技术;浮萍处理系统更是被美国环境保护局列为污水处理的替代技术之一[76]。 利用浮萍处理污水和修复水体已成为生态处理和环境修复的一个重要的发展方向,但到目前为止浮萍在相关领域中应用的研究仍存在很多挑战,有待进一步研究。
(1)目前,国内外均已建立用于污染水体修复的浮萍塘,但现阶段大多数浮萍塘处于管理不善状态;存在浮萍打捞不及时,或被打捞的浮萍随意丢弃,腐烂后污染物再次进入水体造成污染等现象。 对此,今后需注重加强浮萍处理系统的全过程管理,探寻绿色环保与资源化的方式处理吸收污染物后的浮萍,实现经济与环保效益的有效统一。
(2)鉴于部分重金属对浮萍具有较大的毒性作用,因此在未来的研究中应注重筛选对特定重金属适应能力强、生物积累能力佳且抗逆性好的浮萍种类,还可利用浮萍与其他水生植物混合培养,充分发挥不同水生植物对不同种重金属的吸收能力,提高水体修复效果。 此外,研究者还可尝试通过基因工程和组织培养技术,提高浮萍对重金属的超富集能力。
(3)目前针对浮萍修复有机污染物方面的研究仍相对较少,且主要侧重于浮萍对有机污染物的吸收积累能力方面,而其吸收转化迁移机制尚未明晰。因此,有必要深入探究有机污染物在浮萍中的吸收、迁移及转化机制,这对于阐明各类有机污染物的潜在生态风险具有重要意义,同时也能够为污水治理提供了科学依据。
(4)针对浮萍修复污染水体的研究大多局限于实验室内研究,由于室内浮萍暴露的环境条件与实际污水情况存在较大差异,因此这些研究不足以准确评估浮萍对于实际污水的修复能力。 在未来有必要利用实际污水对浮萍的修复能力进行进一步的探究,这将有助于研究者更好地了解浮萍在实际生活污水和工业废水处理中的应用潜力。
[1]Kookana R S, Drechsel P, Jamwal P, et al. Urbanisation and emerging economies: Issues and potential solutions for water and food security [J].Science of the Total Environment,2020,732:139057
[2]Hu H, Li X, Wu S H, et al. Sustainable livestock wastewater treatment via phytoremediation: Current status and future perspectives [J].Bioresource Technology,2020,315:123809
[3]呼尔西旦·吾斯曼. 植物修复技术及其在环境保护中的应用[J]. 皮革制作与环保科技,2020,1(24):29-31
[4]王庆海, 却晓娥. 治理环境污染的绿色植物修复技术[J]. 中国生态农业学报,2013,21(2):261-266
Wang Q H, Que X E. Phytoremediation: A green approach to environmental clean-up [J]. Chinese Journal of Eco-Agriculture,2013,21(2):261-266 (in Chinese)
[5]Markou G, Wang L, Ye J F, et al. Using agro-industrial wastes for the cultivation of microalgae and duckweeds:Contamination risks and biomass safety concerns [J].Biotechnology Advances,2018,36(4):1238-1254
[6]Donald H L, Daniel J C, Elias L, et al. Phylogeny and systematics of Lemnaceae, the duckweed family [J]. Systematic Botany,2002,27(2):221-240
[7]杨晶晶, 赵旭耀, 李高洁, 等. 浮萍的研究及应用[J]. 科学通报,2021,66(9):1026-1045
Yang J J, Zhao X Y, Li G J, et al. Research and application in duckweeds: A review [J]. Chinese Science Bulletin,2021,66(9):1026-1045 (in Chinese)
[8]Ali S, Abbas Z, Rizwan M, et al. Application of floating aquatic plants in phytoremediation of heavy metals polluted water: A review [J]. Sustainability,2020,12(5):1927
[9]李燕. 污水处理脱氮除磷工艺的研究进展[J]. 中国资源综合利用,2020,38(6):105-107
Li Y. Research progress of nitrogen and phosphorus removal processes in wastewater treatment [J]. China Resources Comprehensive Utilization, 2020, 38(6): 105-107(in Chinese)
[10]Toyama T, Hanaoka T, Tanaka Y, et al.Comprehensive evaluation of nitrogen removal rate and biomass, ethanol,and methane production yields by combination of four major duckweeds and three types of wastewater effluent[J]. Bioresource Technology,2018,250:464-473
[11]Liu Y, Xu H, Yu C J, et al. Multifaceted roles of duckweed in aquatic phytoremediation and bioproducts synthesis [J]. GCB Bioenergy,2021,13(1):70-82
[12]Priya A,Avishek K,Pathak G.Assessing the potentials of Lemna minor in the treatment of domestic wastewater at pilot scale[J].Environmental Monitoring and Assessment,2012,184(7):4301-4307
[13]李琪, 方扬, 许亚良, 等. 少根紫萍对微污染地表水的净化及淀粉积累能力[J]. 应用与环境生物学报, 2018,24(6):1324-1329
Li Q,Fang Y,Xu Y L,et al.Duckweed Landoltia punctata purifies micro-polluted surface water and produces starch [J]. Chinese Journal of Applied and Environmental Biology,2018,24(6):1324-1329 (in Chinese)
[14]谢朦, 张飞, 章莹颖, 等.3 种浮萍对富营养化水体的修复[J]. 环境工程学报,2016,10(5):2447-2453
Xie M, Zhang F, Zhang Y Y, et al. Effect of three duckweed species on remediation of eutrophic water [J]. Chinese Journal of Environmental Engineering, 2016, 10(5):2447-2453 (in Chinese)
[15]Yilmaz D D, Akbulut H. Effect of circulation on wastewater treatment by Lemna gibba and Lemna minor(floating aquatic macrophytes) [J].International Journal of Phytoremediation,2011,13(10):970-984
[16]顾新娇, 杨闯, 王文国, 等. 不同浓度养殖废水对青萍生长能力的影响[J]. 环境工程学报, 2015, 9(3): 1103-1108
Gu X J, Yang C, Wang W G, et al. Influence of livestock wastewater concentration on growth of common duckweed (Lemna minor) [J].Chinese Journal of Environmental Engineering,2015,9(3):1103-1108 (in Chinese)
[17]Jayashree M, Muthukumar B, Arockiasamy D I. Efficiency of Spirodela polyrhiza (L.) Schleiden in absorbing and utilizing different forms of nitrogen [J]. Journal of Environmental Biology,1996,17(3):227-233
[18]沈根祥, 姚芳, 胡宏, 等. 浮萍吸收不同形态氮的动力学特性研究[J]. 土壤通报,2006,37(3):505-508
Shen G X,Yao F,Hu H,et al.The kinetics of ammonium and nitrate uptake by duckweed (Spirodela oligorrhiza)plant [J]. Chinese Journal of Soil Science, 2006, 37(3):505-508 (in Chinese)
[19]van Echelpoel W,Boets P,Goethals P L M.Functional response (FR) and relative growth rate (RGR) do not show the known invasiveness of Lemna minuta (Kunth) [J].PLoS One,2016,11(11): e0166132
[20]Griffith A P, Epplin F M, Fuhlendorf S D, et al. A comparison of perennial polycultures and monocultures for producing biomass for biorefinery feedstock [J]. Agronomy Journal,2011,103(3):617-627
[21]Crawford K M, Whitney K D.Population genetic diversity influences colonization success [J]. Molecular Ecology,2010,19(6):1253-1263
[22]李阳, 成家杨, 钟钰, 等. 浮萍多样性对富营养化水体净化效果的影响[J]. 南方农业学报, 2017, 48(2): 259-265
Li Y, Cheng J Y, Zhong Y, et al. Effects of duckweed diversity on purifying eutrophic water [J].Journal of Southern Agriculture,2017,48(2):259-265 (in Chinese)
[23]Zhao X, Moates G K, Wellner N, et al. Chemical characterisation and analysis of the cell wall polysaccharides of duckweed (Lemna minor) [J]. Carbohydrate Polymers,2014,111:410-418
[24]邓鸿杨. 不同类型水生植物组合去除氮磷效果[J]. 绿色科技,2018(10):73-76,84
[25]Ishizawa H, Kuroda M, Morikawa M, et al. Differential oxidative and antioxidative response of duckweed Lemna minor toward plant growth promoting/inhibiting bacteria[J]. Plant Physiology and Biochemistry, 2017, 118: 667-673
[26]Chen G K, Huang J, Fang Y, et al. Microbial community succession and pollutants removal of a novel carriers enhanced duckweed treatment system for rural wastewater in Dianchi Lake Basin [J]. Bioresource Technology, 2019,276:8-17
[27]Ishizawa H, Ogata Y, Hachiya Y, et al.Enhanced biomass production and nutrient removal capacity of duckweed via two-step cultivation process with a plant growth-promoting bacterium, Acinetobacter calcoaceticus P23 [J].Chemosphere,2020,238:124682
[28]马继. 重金属污染现状及新形势下的环境污染治理方法研究[J]. 中国资源综合利用,2019,37(10):148-150
Ma J. Research on the current situation of heavy metal pollution and the method of environmental pollution control under the new situation [J].China Resources Comprehensive Utilization,2019,37(10):148-150 (in Chinese)
[29]Rezania S, Taib S M, Md Din M F, et al. Comprehensive review on phytotechnology: Heavy metals removal by diverse aquatic plants species from wastewater [J]. Journal of Hazardous Materials,2016,318:587-599
[30]Martín-Lara M A, Blázquez G, Trujillo M C, et al. New treatment of real electroplating wastewater containing heavy metal ions by adsorption onto olive stone [J].Journal of Cleaner Production,2014,81:120-129
[31]崔姜伟, 崔卫华, 郝春博. 浮萍在环境保护领域的应用研究进展[J]. 环境工程,2015,33(S1):306-309
Cui J W,Cui W H,Hao C B.The research progress in application of duckweed in environmental preservation [J].Environmental Engineering, 2015, 33(S1): 306-309 (in Chinese)
[32]Zhou Q, Lin Y,Li X,et al.Effect of zinc ions on nutrient removal and growth of Lemna aequinoctialis from anaerobically digested swine wastewater [J]. Bioresource Technology,2018,249:457-463
[33]Guimaraes F P, Aguiar R, Oliveira J A, et al. Potential of macrophyte for removing arsenic from aqueous solution[J]. Planta Daninha,2012,30(4):683-696
[34]Uysal Y, Taner F. Bioremoval of cadmium by Lemna minor in different aquatic conditions [J]. CLEAN -Soil, Air,Water,2010,38(4):370-377
[35]焦轶男, 朱宏. 水体重金属污染植物修复研究进展[J].生物学杂志,2014,31(1):71-74
Jiao Y N, Zhu H. Research progress in phytoremediation for heavy metal pollution [J].Journal of Biology,2014,31(1):71-74 (in Chinese)
[36]Chen D Q,Zhang H,Wang Q L,et al.Intraspecific variations in cadmium tolerance and phytoaccumulation in giant duckweed (Spirodela polyrhiza) [J]. Journal of Hazardous Materials,2020,395:122672
[37]Zhao Z, Shi H J, Duan D Z, et al.The influence of duckweed species diversity on ecophysiological tolerance to copper exposure [J]. Aquatic Toxicology, 2015, 164: 92-98
[38]Zhao Z, Shi H J, Liu C Q, et al. Duckweed diversity decreases heavy metal toxicity by altering the metabolic function of associated microbial communities [J]. Chemosphere,2018,203:76-82
[39]Stout L M,Dodova E N,Tyson J F,et al.Phytoprotective influence of bacteria on growth and cadmium accumulation in the aquatic plant Lemna minor [J].Water Research,2010,44(17):4970-4979
[40]彭赟, 严彬. 浮萍对重金属离子的吸附作用研究[J]. 生物学教学,2010,35(10):68-70
[41]冯丹, 谭艾娟, 杨贵利, 等. 浮萍在重金属污染水体方面的应用[C]// 中国环境科学学会环境工程分会. 中国环境科学学会2019年科学技术年会.环境工程技术创新与应用分论坛论文集(三).西安:中国环境科学学会,2019:7
[42]王秀娟. 铜、镍和铬单一和联合作用对植物的影响[D].青岛: 青岛科技大学,2005:61-65
Wang X J. Effect of copper, chromium and nickel single and combined pollution on several plants [D]. Qingdao:Qingdao University of Science & Technology, 2005: 61-65 (in Chinese)
[43]Bokhari S H, Ahmad I, Mahmood-Ul-Hassan M, et al.Phytoremediation potential of Lemna minor L. for heavy metals [J]. International Journal of Phytoremediation,2016,18(1):25-32
[44]陈兰钗,方扬,靳艳玲,等.浮萍(Lemna aequinoctialis)干粉对Pb2+的吸附[J].应用与环境生物学报,2013,19(6):1046-1052
Chen L C, Fang Y, Jin Y L, et al. Biosorption of Pb2+ by dried powder of duckweed (Lemna aequinoctialis) [J].Chinese Journal of Applied and Environmental Biology,2013,19(6):1046-1052 (in Chinese)
[45]李阳,成家杨,钟钰,等.2 种浮萍干粉对Cd2+的吸附性能[J]. 江苏农业科学,2017,45(15):248-254
[46]Megateli S, Semsari S, Couderchet M. Toxicity and removal of heavy metals (cadmium, copper, and zinc) by Lemna gibba [J]. Ecotoxicology and Environmental Safety,2009,72(6):1774-1780
[47]Cvjetko P, Tolic' S, Sikic' S, et al. Effect of copper on the toxicity and genotoxicity of cadmium in duckweed (Lemna minor L.)[J].Archives of Industrial Hygiene and Toxicology,2010,61(3):287-296
[48]Abdallah M A M.Phytoremediation of heavy metals from aqueous solutions by two aquatic macrophytes, Ceratophyllum demersum and Lemna gibba L. [J]. Environmental Technology,2012,33(13-15):1609-1614
[49]Teixeira S, Vieira M N, Espinha Marques J, et al. Bioremediation of an iron-rich mine effluent by Lemna minor[J].International Journal of Phytoremediation,2014,16(7-12):1228-1240
[50]王凤珍, 宋新娟, 徐俊辉, 等. 墨水湖湖滨带水生植物重金属富集能力研究[J]. 武汉理工大学学报, 2014, 36(11):114-118
Wang F Z,Song X J,Xu J H,et al.Absorption and accumulation of heavy metals by aquatic plants in lakeside zone of Moshui Lake [J].Journal of Wuhan University of Technology,2014,36(11):114-118 (in Chinese)
[51]Török A, Gulyás Z, Szalai G, et al. Phytoremediation capacity of aquatic plants is associated with the degree of phytochelatin polymerization [J]. Journal of Hazardous Materials,2015,299:371-378
[52]Singh N K, Raghubanshi A S, Upadhyay A K, et al. Arsenic and other heavy metal accumulation in plants and algae growing naturally in contaminated area of West Bengal, India [J]. Ecotoxicology and Environmental Safety,2016,130:224-233
[53]Romero-Hernández J A, Amaya-Chávez A, Balderas-Hernández P, et al. Tolerance and hyperaccumulation of a mixture of heavy metals (Cu, Pb, Hg, and Zn) by four aquatic macrophytes [J]. International Journal of Phytoremediation,2017,19(3):239-245
[54]Liu C G, Gu W C, Dai Z, et al. Boron accumulation by Lemna minor L. under salt stress [J]. Scientific Reports,2018,8(1):8954
[55]Rai P K. Heavy metals/metalloids remediation from wastewater using free floating macrophytes of a natural wetland [J]. Environmental Technology & Innovation,2019,15:100393
[56]张灿. 水体有机污染现状及其治理对策 [J]. 科技风,2017(8):148
[57]刘娥, 张建, 魏榕, 等. 有机污染胁迫对人工湿地中浮萍抗氧化系统的影响[J]. 环境工程学报, 2013, 7(9):3296-3300
Liu E, Zhang J, Wei R, et al. Effect of organic pollutants stresses on antioxidant defense system of duckweed(Lemna minor) [J].Chinese Journal of Environmental Engineering,2013,7(9):3296-3300 (in Chinese)
[58]Sikorski Ł,Baciak M,Bęs' A,et al.The effects of glyphosate-based herbicide formulations on Lemna minor,a nontarget species [J]. Aquatic Toxicology,2019,209:70-80
[59]Singh V, Pandey B,Suthar S.Phytotoxicity of amoxicillin to the duckweed Spirodela polyrhiza: Growth, oxidative stress, biochemical traits and antibiotic degradation [J].Chemosphere,2018,201:492-502
[60]Gatidou G, Oursouzidou M, Stefanatou A, et al. Removal mechanisms of benzotriazoles in duckweed Lemna minor wastewater treatment systems [J].The Science of the Total Environment,2017,596-597:12-17
[61]Ekperusi A O, Sikoki F D, Nwachukwu E O.Application of common duckweed (Lemna minor) in phytoremediation of chemicals in the environment: State and future perspective [J]. Chemosphere,2019,223:285-309
[62]Dosnon-Olette R, Couderchet M, Oturan M A, et al. Potential use of Lemna minor for the phytoremediation of isoproturon and glyphosate [J]. International Journal of Phytoremediation,2011,13(6):601-612
[63]Olette R, Couderchet M, Biagianti S, et al. Toxicity and removal of pesticides by selected aquatic plants [J].Chemosphere,2008,70(8):1414-1421
[64]Yılmaz Ö, Taş B. Feasibility and assessment of the phytoremediation potential of green microalga and duckweed for zeta-cypermethrin insecticide removal [J].Desalination and Water Treatment,2021,209:131-143
[65]Dosnon-Olette R, Couderchet M, El Arfaoui A, et al. Influence of initial pesticide concentrations and plant population density on dimethomorph toxicity and removal by two duckweed species [J]. Science of the Total Environment,2010,408(10):2254-2259
[66]Prasertsup P, Ariyakanon N. Removal of chlorpyrifos by water lettuce (Pistia stratiotes L.) and duckweed (Lemna minor L.) [J]. International Journal of Phytoremediation,2011,13(4):383-395
[67]Panfili I, Bartucca M L, del Buono D. The treatment of duckweed with a plant biostimulant or a safener improves the plant capacity to clean water polluted by terbuthylazine [J]. Science of the Total Environment, 2019, 646:832-840
[68]Wang H, Xi H, Xu L L, et al. Ecotoxicological effects,environmental fate and risks of pharmaceutical and personal care products in the water environment: A review[J]. Science of the Total Environment,2021,788:147819
[69]Peng F J, Pan C G, Zhang M, et al. Occurrence and ecological risk assessment of emerging organic chemicals in urban rivers:Guangzhou as a case study in China[J].Science of the Total Environment,2017,589:46-55
[70]Iatrou E I, Gatidou G, Damalas D, et al. Fate of antimicrobials in duckweed Lemna minor wastewater treatment systems [J]. Journal of Hazardous Materials, 2017, 330:116-126
[71]Gomes M P,Gonçalves C A,de Brito J C M,et al.Ciprofloxacin induces oxidative stress in duckweed (Lemna minor L.): Implications for energy metabolism and antibiotic-uptake ability [J]. Journal of Hazardous Materials,2017,328:140-149
[72]Zhang W L, Liang Y N. Removal of eight perfluoroalkyl acids from aqueous solutions by aeration and duckweed[J]. Science of the Total Environment,2020,724:138357
[73]Zhang W L, Liang Y N. Interactions between Lemna minor (common duckweed) and PFAS intermediates: Perfluorooctanesulfonamide (PFOSA) and 6:2 fluorotelomer sulfonate (6:2 FTSA) [J]. Chemosphere, 2021, 276:130165
[74]Can-Terzi B, Goren A Y,Okten H E,et al.Biosorption of methylene blue from water by live Lemna minor [J]. Environmental Technology & Innovation,2021,22:101432
[75]Ekperusi A O, Nwachukwu E O, Sikoki F D. Assessing and modelling the efficacy of Lemna paucicostata for the phytoremediation of petroleum hydrocarbons in crude oilcontaminated wetlands [J].Scientific Reports,2020,10(1):8489
[76]韩玉洁, 杨琳, 赵玲, 等. 浮萍植物在水体净化中的研究及展望[J]. 生物学通报,2016,51(6):4-7