对羟基苯甲酸酯(parabens, PBs),又名尼泊金酯,是对羟基苯甲酸酯类化合物的总称。根据碳链碳原子数和结构的不同,可将其分为对羟基苯甲酸甲酯、乙酯、丙酯、丁酯和异丁酯等,是目前世界上用途最广、用量最大、应用频率最高的防腐剂之一。因其杀菌力强、成本低廉、对酸碱稳定等优点,PBs被广泛应用于医药、食品和化妆品等行业中[1-3]。相关研究表明,对羟基苯甲酸酯类物质的酯链越长,通过皮肤的能力越强,吸收越多[4]。虽然研究表明,对羟基苯甲酸酯类物质可经胃肠道完全吸收、代谢并排泄,无论是对羟基苯甲酸酯类物质或其代谢物均不在体内蓄积[5],但Darbre等[6]研究发现在人乳腺癌组织中可以检测到对羟基苯甲酸酯类物质,人的血液、尿液、乳汁和组织均被证实可检测出该类物质[7-9],并且PBs可以通过胎盘屏障从而可能造成胚胎宫内暴露[10]。这说明在化妆品、食品以及药物中添加的对羟基苯甲酸酯类物质至少有一部分可以被人体组织吸收并保留,且不能被组织中的醋酶水解成普通的对羟基苯甲酸代谢物。随着对羟基苯甲酸酯类物质在各个领域使用的日益广泛,其中羟苯丙酯和羟苯丁酯在化妆品中的使用频率较高,化妆品作为人体经常使用的化学物质导致人体对羟苯丙酯和羟苯丁酯的暴露机会和吸收水平也很频繁,再考虑到其可能在体内蓄积,因而对羟苯丙酯和羟苯丁酯安全性的评价受到学者们的普遍关注。研究证实羟苯丙酯和羟苯丁酯具有类雌激素作用,因而它们被认定为是一种内分泌干扰素(endocrine disrupting chemicals, EDCs)[11],而且认为其不利于健康的原因,也与其雌激素样活性有关。研究还表明,羟苯丙酯和羟苯丁酯可使未成熟雌鼠的子宫质量增加[12-13],并对雄鼠具有生殖毒性,引起雄性动物附睾质量降低[14-15],同时,羟苯丙酯和羟苯丁酯能抑制精子的形成[16]。
肝脏是药物生物转化的重要器官,含有参与药物代谢的酶系,其中细胞色素P450 (CYP)是催化多种内、外源性物质包括菌体类化合物、药物、环境污染物和化学致癌物进行Ⅰ相氧化代谢的重要酶系。而由CYP酶介导的代谢性相互作用在临床上发生率最高。通过酶的抑制和诱导作用,使底物药物的药代动力学行为发生改变,从而引起药效下降或毒副作用增高,影响临床用药的有效性和安全性。对大鼠、兔、狗和猫等的研究表明,对羟基苯甲酸酯类物质可经胃肠道迅速的吸收、代谢并排泄,在肝脏代谢为葡萄糖醛酸、硫磺酸等结合物,其安全每日容许摄入量(allowable daily intake, ADI)为0~5 mg·kg-1[17]。由于对羟基苯甲酸酯类物质被广泛应用于医药、食品和化妆品等行业中,人体会经常吸收对羟基苯甲酸酯类物质,而代谢酶可以被诱导或抑制而导致代谢性药物相互作用,所以本研究的目的是选择使用频率较高的对羟基苯甲酸酯类物质对羟基苯甲酸丙酯(羟苯丙酯;propylparaben, PP)和对羟基苯甲酸丁酯(羟苯丁酯;butylparaben, BP)作为研究对象,考察它们是否对肝脏细胞色素P450存在抑制或诱导作用,从而来说明对羟基苯甲酸酯类物质是否存在药物相互作用的可能。
1 材料与方法(Materials and methods)
1.1 仪器与试剂
羟苯丙酯和羟苯丁酯(Sigma公司),CYP探针底物非那西丁、安非他酮、甲苯磺丁脲、咪达唑仑、香豆素、右美沙芬和氯唑沙宗(BD Gentest公司),代谢产物对乙酰氨基酚、羟基安非他酮、4’-羟基甲苯磺丁脲、1-羟基咪达唑仑、7-羟基香豆素、右啡烷和6-羟基氯唑沙宗(BD Gentest公司),混合人肝微粒体(BD Gentest公司),混合雄性SD大鼠肝微粒体(20只)为实验室自制,NADPH(Roche公司)。
DIONEX Ultimate 3000超高效液相色谱仪(Thermo Fisher公司),Thermo Q EXACTIVE质谱仪(Thermo Fisher公司),C18 (1.7 μm,2.1 mm×100 mm)色谱柱(Thermo Syncronis公司),Milli-Q AdvantageA10型超纯水仪(Millipore公司,美国),KQ-250超声波清洗器(昆山市超声仪器有限公司,中国),X-30R离心机(Sigma公司,德国)。甲酸(色谱纯)、甲酸铵(色谱纯)、甲醇(色谱纯)和乙腈(色谱纯)均购自美国Thermo Fisher公司。
1.2 羟苯丙酯和羟苯丁酯毒性终点预测
利用预测软件ACD/Tox suite 2.95和ACD/ADME suite 5.0筛查羟苯丙酯和羟苯丁酯的毒性终点,重点关注主要的毒性终点,包括Eye irritation、Skin irritation、P450 Inhibitors、P450 Substrate和Oral Acute Toxicity Hazard Categories (OECD ranges)等,可以快速筛选出羟苯丙酯和羟苯丁酯的主要毒性终点。
1.3 肝微粒体孵育抑制试验
反应体系为200 μL磷酸钾缓冲液(pH 7.4),内含2 mmol·L-1 NADPH和3.3 mmol·L-1氯化镁,HLM或RLM(蛋白含量0.2 mg·mL-1)、CYP酶探针底物、不同浓度的受试化学物(0、0.15、0.5、1.5、5、15、50、100、200和500 μmol·L-1)。在各探针底物Km附近选择孵育浓度[18]:非那西丁(100 μmol·L-1)、安非他酮(100 μmol·L-1)、甲苯磺丁脲(100 μmol·L-1)、氯唑沙宗(200 μmol·L-1)、香豆素(100 μmol·L-1)、右美沙芬(10 μmol·L-1)和咪达唑仑(5 μmol·L-1)。通过定量检测对乙酰氨基酚、羟基安非他酮、4-羟基甲苯磺丁脲、6-羟基氯唑沙宗、7-羟基香豆素、右啡烷和1’-羟基咪达唑仑生成量,评价不同浓度的受试化学物对CYP同工酶活性的抑制作用。孵育试验前将肝微粒体、探针底物和受试化学物混匀,37 ℃水浴预孵5 min,加入同样预孵5 min的NADPH启动反应,实验平行3组,37 ℃孵育60 min后,移至冰上并加入500 μL含内标普萘洛尔(100 ng·mL-1)和甲苯磺丁脲(100 ng·mL-1)的甲醇-乙腈(V∶V =1∶1)终止反应,涡旋,10 000 r·min-1,4 ℃离心15 min,取上清进样分析,测定探针产物的生成量,计算相对酶活性和对应的IC50。在相同反应体系条件下,与不同浓度的底物(10、50、100、200和300 μmol·L-1)反应,测定探针代谢产物的生成量,计算不同底物浓度生成代谢产物的速率,对酶动力学数据进行非线性曲线拟合确定抑制类型,计算Ki值。
1.4 探针代谢产物的质谱定量分析
色谱条件:A为水(含0.1%甲酸和2.5 mmol·L-1甲酸铵),D为乙腈;梯度洗脱,梯度洗脱程序为0~0.5 min,30% D;0.5~1.5 min,30%~95% D;1.5~2.5 min,95%~95% D;2.5~3.5 min,95%~70% D;3.5~3.6 min,70%~30% D;3.6~6.0 min,30% D。分析时间0~6 min,每次进样5 μL,流速为0.3 mL·min-1。色谱柱为Thermo Hypersil Gold C18 1.7 μm,2.1 mm×100 mm,色谱柱温度为30 ℃,自动进样器的温度保持在4 ℃。在电喷雾离子源(ESI)正负离子PRM模式下采集数据,喷雾电压为3 500V(+)、2 500V(-);蒸发温度为350 ℃;鞘气流速为40 Arb;辅助气流速为10 Arb;毛细管温度为320 ℃;S-lens RF为50;NCE为40。对乙酰氨基酚(152.07061/110.05973)、羟基安非他酮(256.10988/238.09824)、4-羟基甲苯磺丁脲(287.10600/89.03831)、7-羟基香豆素(161.02442/133.02922)、右啡烷(258.18524/133.06422) 、1’-羟基咪达唑仑(342.08039/324.06836)、6-羟基氯唑沙宗(183.98069/120.00903);正内标普萘洛尔(260.16451/116.10709);负内标甲苯磺丁脲(269.09654/170.02777)。不同代谢产物色谱图如图1所示。
1.5 分子对接
为了研究羟苯丙酯和羟苯丁酯与大鼠和人细胞色素P4501A2的作用模式,利用AutodockTools 1.5.6[19-20]把小鼠和人细胞色素P4501A2与羟苯丙酯和羟苯丁酯均转化为PDBQT格式,然后利用Autodock vina 1.1.2[21]进行分子对接研究。大鼠细胞色素氧化酶CYP1A2的三维结构由建模服务器SWISS-MODEL构建得到,模板选择人细胞色素氧化酶CYP1A2 (PDB ID:2HI4);人细胞色素氧化酶CYP1A2 (PDB ID:2HI4,分辨率:0.195 nm)是从RCSB Protein Data Bank (http://www.rcsb.org/)下载得到。大鼠和人CYP1A2活性口袋的坐标均设置为:center_x = 2.674,center_y = 18.041,center_z = 19.672;size_x=15,size_y=15,size_z=15。为了增加计算的精确度,将参数exhaustiveness设置为20。除了特别说明,其他参数均采用默认值。最后,选取打分值最高的构象用PyMoL 1.7.6进行绘图。
图1 不同代谢产物的色谱图
Fig. 1 Chromatograms of different metabolites
1.6 数据处理与分析
羟苯丙酯和羟苯丁酯的IC50值计算如下:通过测定扑热息痛生成量计算CYP1A2的活性,由式(1)计算羟苯丙酯和羟苯丁酯作用下的相对酶活性,式中Erel为相对酶活性,Ci(n)为不同浓度羟苯丙酯和羟苯丁酯组测得的代谢产物生成量,Ci(0)为空白对照组的代谢产物生成量。数据处理软件为GraphPad Prism 5,以相对酶活性Erel为纵坐标,化学物浓度的对数值为横坐标,由抑制曲线计算IC50值。采用SPSS12.0软件进行数据处理,试验数据用平均值±标准偏差(Mean±SD)表示。
Erel=Ci(n)/Ci(0)×100%
(1)
2 结果(Results)
2.1 利用软件预测的方法对羟苯丙酯和羟苯丁酯进行毒性终点筛查
由表1可知,羟苯丙酯和羟苯丁酯都对CYP1A2具有抑制作用,同时主要通过CYP1A2代谢,由于CYP450酶介导的代谢性相互作用发生率最高,通过酶的抑制作用引起药效下降或毒副作用增高,特别是在我国中、西药合并使用相当普遍的情况下,其可能存在药物相互作用的风险,由表1可知,羟苯丙酯和羟苯丁酯具有眼刺激和皮肤刺激作用,同时按照OECD的分类危险范围,它们的等级较低,但口服具有毒性,还是需要加强对它们的安全性研究。
2.2 羟苯丙酯和羟苯丁酯对大鼠和人肝微粒体CYP450酶的抑制作用
如图2所示,在大鼠肝微粒体中,加入系列浓度的羟苯丙酯孵育60 min,得到抑制CYP1A2酶的IC50值为(8.85±0.38) μmol·L-1,对其他CYP450酶无抑制作用,加入系列浓度的羟苯丁酯孵育60 min,得到抑制CYP1A2酶的IC50值为(19.43±3.03) μmol·L-1,对其他CYP450酶无抑制作用。在人肝微粒体中,加入系列浓度的羟苯丙酯孵育60 min,得到抑制CYP1A2酶的IC50值为(1.63±0.34) μmol·L-1,对其他CYP450酶无抑制作用,加入系列浓度的羟苯丁酯孵育60 min,得到抑制CYP1A2酶的IC50值为(7.97±0.82) μmol·L-1,对其他CYP450酶无抑制作用(表2)。继续实验测得,在大鼠肝微粒体中,羟苯丙酯和羟苯丁酯对CYP1A2酶都是非竞争性抑制,Ki值分别为8.44 μmol·L-1和16.30 μmol·L-1。在人肝微粒体中,羟苯丙酯和羟苯丁酯对CYP1A2酶都是非竞争性抑制,Ki值分别为2.28 μmol·L-1和5.86 μmol·L-1。按照通用的CYP酶抑制剂强度分级规则[22],对2个受试化学物的抑制强度进行分级:IC50<1 μmol·L-1强抑制剂,1 μmol·L-1
表1 羟苯丙酯和羟苯丁酯的毒性终点
Table 1 Toxicity endpoints of propylparaben and butylparaben

化学物质Compound眼刺激Eye irritation 皮肤刺激Skin irritationCYP450酶抑制种类P450 inhibitiorsCYP450酶代谢种类P450 substrate口服急性毒性危险范围(OECD分级)Oral acute toxicity hazard categories (OECD)人每日的最大给药剂量(MRDD)/(mg·kg-1)Maximum daily human dose (MRDD)/(mg·kg-1)羟苯丙酯Propylparaben阳性Positive阳性PositiveCYP1A2 CYP1A2 Cat.47羟苯丁酯Butylparaben阳性Positive阳性PositiveCYP1A2 CYP1A2 Cat.46
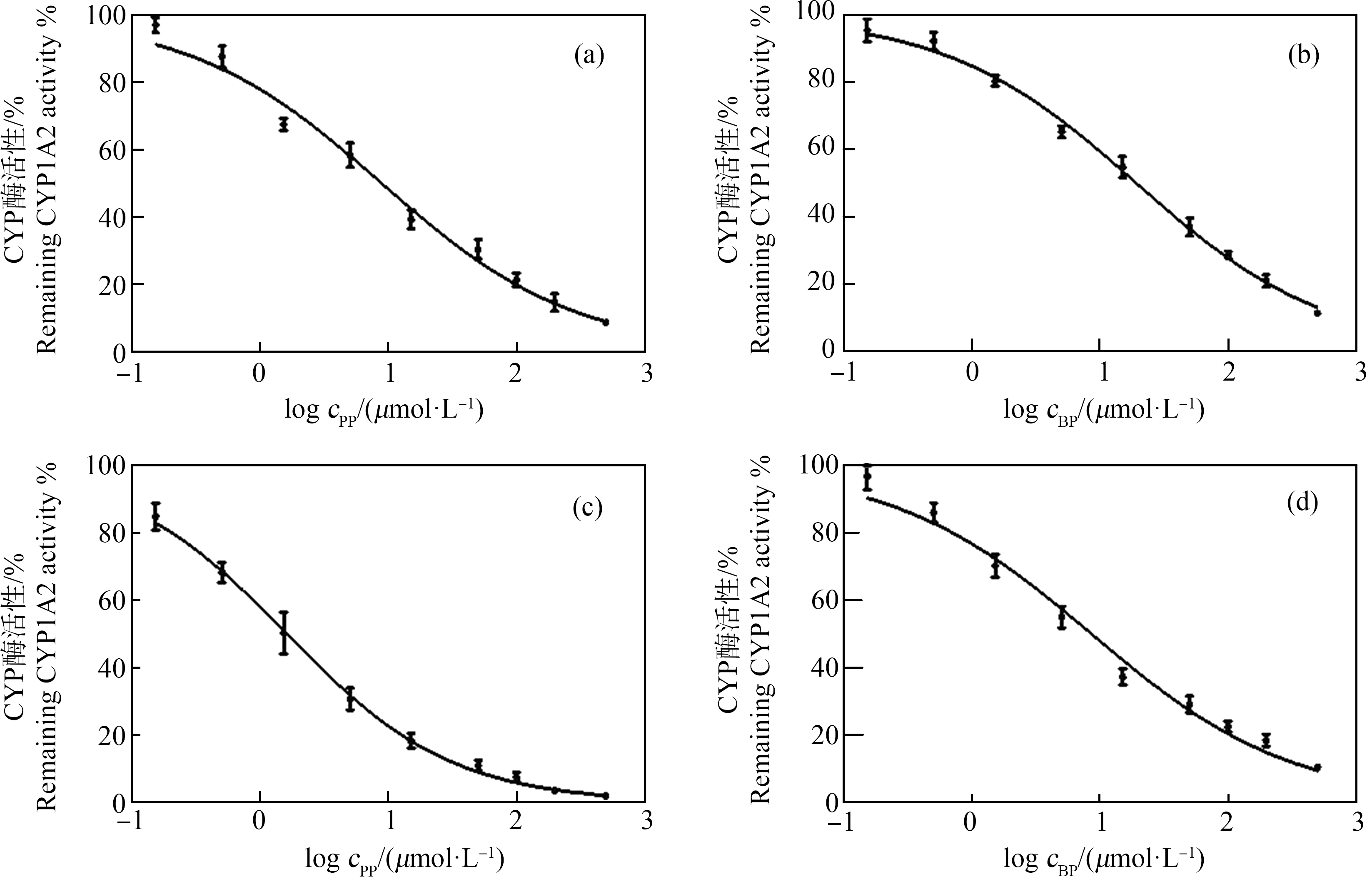
图2 羟苯丙酯(PP)和羟苯丁酯(BP)对大鼠和人CYP1A2的抑制曲线
注:(a)羟苯丙酯-大鼠CYP1A2;(b)羟苯丁酯-大鼠CYP1A2;(c)羟苯丙酯-人CYP1A2;(d)羟苯丁酯-人CYP1A2。
Fig. 2 Inhibition curves of propylparaben (PP) and butylparaben (BP) on CYP1A2 in rats and human
Notes: (a) Propylparaben-CYP1A2 in rats; (b) Butylparaben-CYP1A2 in rats; (c) Propylparaben-CYP1A2 in human; (d) Butylparaben-CYP1A2 in human.
表2 羟苯丙酯和羟苯丁酯对大鼠和人肝微粒体中主要CYP450酶活性的抑制作用
Table 2 Inhibitory effects of propylparaben and butylparaben on major CYP450 enzyme activities in rat and human liver microsomes
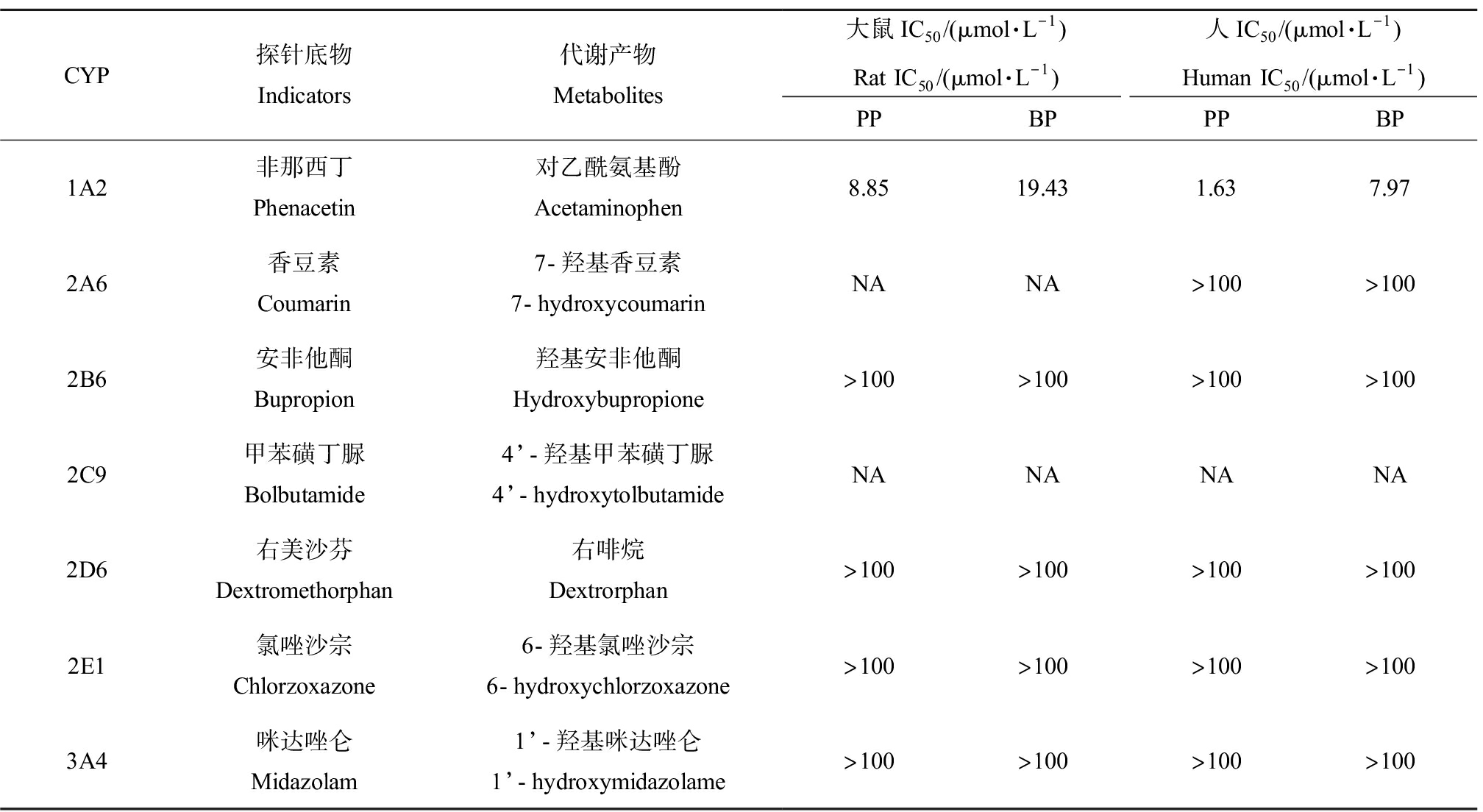
CYP探针底物Indicators代谢产物Metabolites大鼠IC50/(μmol·L-1)Rat IC50/(μmol·L-1)人IC50/(μmol·L-1)Human IC50/(μmol·L-1)PPBPPPBP1A2非那西丁Phenacetin对乙酰氨基酚Acetaminophen8.8519.431.637.972A6香豆素Coumarin7-羟基香豆素7-hydroxycoumarinNANA>100>1002B6安非他酮Bupropion羟基安非他酮Hydroxybupropione>100>100>100>1002C9甲苯磺丁脲Bolbutamide4’-羟基甲苯磺丁脲4’-hydroxytolbutamideNANANANA2D6右美沙芬Dextromethorphan右啡烷Dextrorphan>100>100>100>1002E1氯唑沙宗Chlorzoxazone6-羟基氯唑沙宗6-hydroxychlorzoxazone>100>100>100>1003A4咪达唑仑Midazolam1’-羟基咪达唑仑1’-hydroxymidazolame>100>100>100>100
2.3 羟苯丙酯和羟苯丁酯与CYP1A2的分子对接结果
为了进一步验证羟苯丙酯和羟苯丁酯对CYP1A2的抑制作用,对它们进行了分子对接,羟苯丙酯与CYP1A2分子对接结果显示,羟苯丙酯紧凑地结合至大鼠和人CYP1A2的活性口袋中(图3(a)和3(b)),其亲和力都为-7.4 kcal·mol-1。羟苯丙酯分别位于由大鼠氨基酸残基Phe-124、Phe-225、Phe-259、Ala-315、Val-380和Leu-49与人氨基酸残基Phe-125、Phe-226、Val-227、Phe-256、Phe-260、Ala-317和Leu-497所组成的疏水性腔袋,形成强烈的疏水性相互作用。由图3(c)和3(d)可知,羟苯丙酯的苯环分别可以与大鼠氨基酸残基Phe-124、Phe-225和人氨基酸残基Phe-125、Phe-226的侧链形成CH-π相互作用和π-π堆积作用。此外,羟苯丙酯的苯环可以与大鼠氨基酸残基Asp-311和人氨基酸残基Asp-320形成阴离子-π相互作用。重要的是,羟苯丙酯可以与大鼠氨基酸残基Asn-310 (键长0.22 nm)形成氢键相互作用(图3(c)),同时与人氨基酸残基Asp-320(键长0.22 nm)和Ala-317(键长0.26 nm)形成双重氢键作用(图3(d)),这是羟苯丙酯与大鼠和人CYP1A2之间主要的作用力。可能正是由于这样特殊的结合模式,使得羟苯丙酯与大鼠和人CYP1A2形成稳定的复合物,从而起到抑制CYP1A2的作用。
羟苯丁酯与CYP1A2分子对接结果显示,羟苯丁酯紧凑地结合至大鼠和人CYP1A2的活性口袋中(图4(a)和4(b)),其亲和力都为-7.7 kcal·mol-1。羟苯丁酯分别位于由大鼠氨基酸残基Phe-124、Phe-225、Phe-259、Ala-315、Val-380、Ile-384和Leu-495与人氨基酸残基Phe-125、Phe-226、Val-227、Phe-256、Phe-260、Ala-317和Leu-497所组成的疏水性腔袋,形成强烈的疏水性相互作用。由图4(c)和4(d)可知,羟苯丁酯的苯环分别可以与大鼠氨基酸残基Phe-124、Phe-225和人氨基酸残基Phe-125、Phe-226的侧链形成CH-π相互作用和π-π堆积作用。此外,羟苯丁酯的苯环可以与大鼠氨基酸残基Asp-311和人氨基酸残基Asp-320形成阴离子-π相互作用。重要的是,羟苯丁酯可以与大鼠氨基酸残基Asn-310(键长0.22 nm)形成氢键相互作用(图4(c)),同时与人氨基酸残基Asp-320(键长0.21 nm)和Ala-317(键长0.27 nm)形成双重氢键作用(图4(d)),这是羟苯丁酯与大鼠和人CYP1A2之间主要的作用力。可能正是由于这样特殊的结合模式,使得羟苯丁酯与大鼠和人CYP1A2形成稳定的复合物,从而起到抑制CYP1A2的作用。
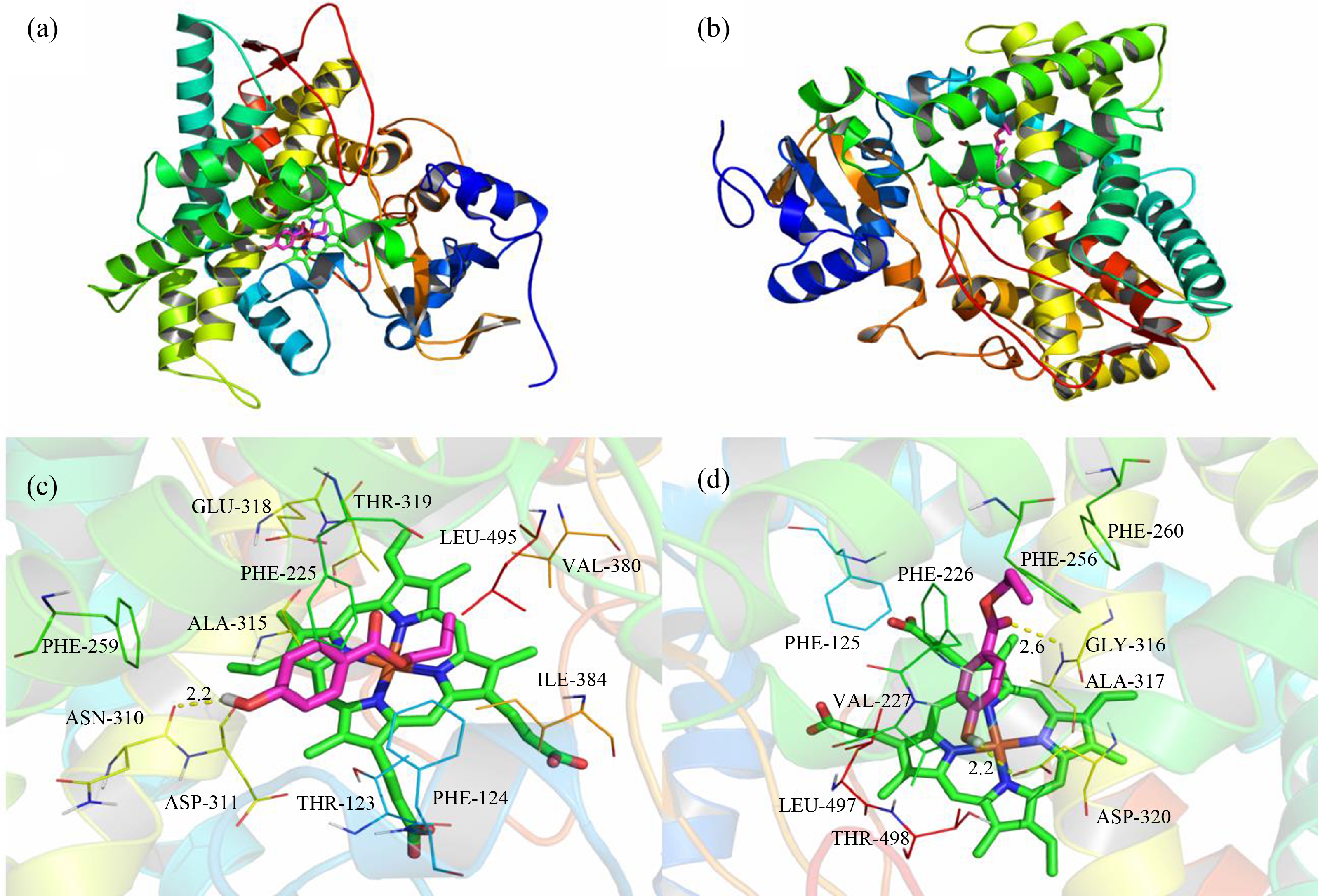
图3 羟苯丙酯与大鼠和人CYP1A2分子对接
注:(a)大鼠CYP1A2 (整体图);(b)人CYP1A2 (整体图);(c)大鼠CYP1A2 (细节图);(d)人CYP1A2 (细节图)
Fig. 3 Docking of propylparaben with rat and human CYP1A2
Notes: (a) Rats CYP1A2 (overall); (b) Human CYP1A2 (overall); (c) Rats CYP1A2 (detail); (d) Human CYP1A2 (detail).
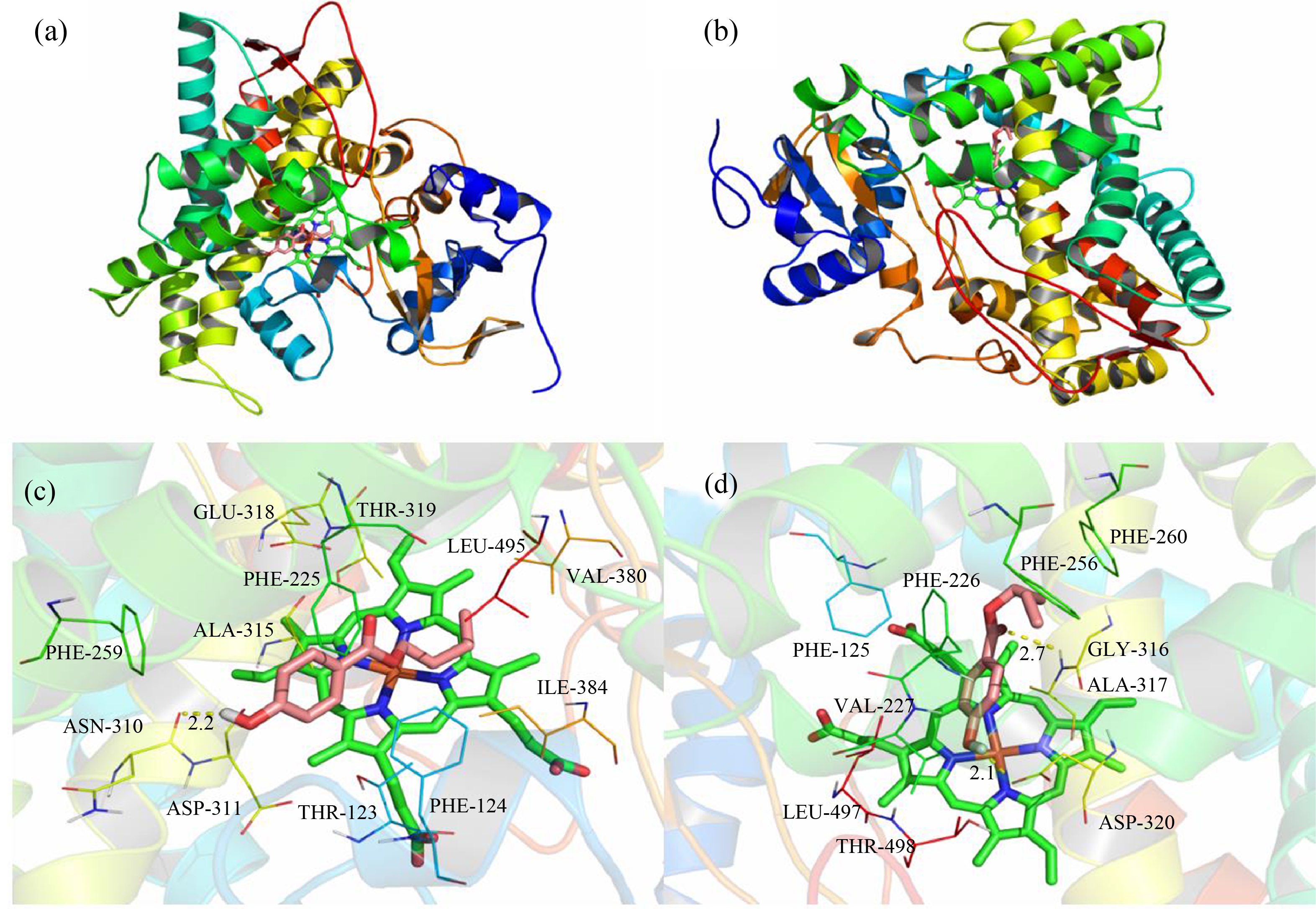
图4 羟苯丁酯与大鼠和人CYP1A2分子对接
注:(a)大鼠CYP1A2(整体图);(b)人CYP1A2(整体图);(c)大鼠CYP1A2(细节图);(d)人CYP1A2 (细节图)。
Fig. 4 Docking of butylparaben with rat and human CYP1A2
Notes: (a) Rats CYP1A2 (overall); (b) Human CYP1A2 (overall); (c) Rats CYP1A2 (detail); (d) Human CYP1A2 (detail).
3 讨论(Discussion)
参与人类药物代谢的CYP同工酶主要有CYP1A2、2B6、2C9、2C19、2D6和3A4等,其中CYP1A2是介导药物氧化代谢主要酶系,约占CYP总量的13%[23],它们介导了大部分药物的代谢,是基于CYP酶药物相互作用的研究重点[24]。本研究在体外大鼠和人肝微粒体孵育体系中,选用美国食品药品监督管理局(US FDA)推荐的探针底物[25],系统评价了羟苯丙酯和羟苯丁酯对7种常见CYP酶的抑制作用,通过IC50的测定评价它们对CYP450酶的抑制活性,发现大鼠和人肝微粒体中羟苯丙酯是CYP1A2酶的中等强度抑制剂,羟苯丁酯在大鼠肝微粒体中是CYP1A2酶的弱抑制剂,羟苯丁酯在人肝微粒体中是CYP1A2酶的中等强度抑制剂,观察到对其他CYP450酶无抑制作用,这与用软件预测的羟苯丙酯和羟苯丁酯对CYP450酶的抑制种类结果一致,分子对接的结果也印证了羟苯丙酯和羟苯丁酯对CYP1A2酶活性的抑制作用,而且羟苯丙酯和羟苯丁酯对肝脏CYP1A2酶活性的抑制还存在种属差异,这与文献报道的CYP450酶存在种属差异一致[26]。因此,为了评价受试化学物对CYP酶抑制的临床相关性,应首选人肝微粒体,动物研究的结果外推至人时,也应充分考虑CYP酶种属差异所致的抑制活性和机制的差异。羟苯丙酯和羟苯丁酯是对羟基苯甲酸酯类物质,它们被广泛应用于医药、食品和化妆品等行业中,很容易被人体接触和吸收,可能与CYP1A2底物药物华法林、咖啡因、安替比林、对乙酰氨基酚、维拉帕米和硝苯地平等临床药物产生药-药相互作用,从而影响药物的疗效或增加毒副作用,所以使用含对羟基苯甲酸酯类物质产品的人群需要关注自身的用药安全,避免出现药-药相互作用。但由于肝微粒体只是亚细胞结构中的组分,没有整体细胞中其他酶(如N-乙酰转移酶)及辅酶,因此,一些代谢反应需要通过Ⅱ相酶参与的,在该体系中就不会进行,由于药物及其代谢产物在体外肝微粒体孵育体系中很容易接近药物代谢酶,而不可能完全反映体内的ADME情况,同时由于肝微粒体富含CYP450s和UGTs,而不像体内和整体细胞那样有其他的酶竞争性参与药物代谢,所以可能导致其生物转化率远远高于体内或肝细胞,不符合真实的代谢情况。总之,本研究从软件预测、肝微粒体抑制和分子对接3个方面来确证羟苯丙酯和羟苯丁酯对CYP1A2酶的抑制作用以及种属差异,下一步还需要进行动物或肝细胞水平的研究来确证该研究结果,保证将肝微粒孵育体系中的实验结果外推到人体内的准确性。
[1] Soni M G, Taylor S L, Greenberg N A, et al. Evaluation of the health aspects of methyl paraben: A review of the published literature [J]. Food and Chemical Toxicology, 2002, 40(10): 1335-1373
[2] Soni M G, Burdock G A, Taylor S L, et al. Safety assessment of propyl paraben: A review of the published literature [J]. Food and Chemical Toxicology, 2001, 39(6): 513-532
[3] Elder R L. Final report on the safety assessment of methylparaben, ethylparaben, propylparaben, and butylparaben [J]. International Journal of Toxicology, 1984, 3(5): 147-209
[4] Lee C H, Kim H J. A study on the absorption mechanism of drugs through biomembranes [J]. Archives of Pharmacal Research, 1994, 17(3): 182-189
[5] Routledge E J, Parker J, Odum J, et al. Some alkyl hydroxy benzoate preservatives (parabens) are estrogenic [J]. Toxicology and Applied Pharmacology, 1998, 153(1): 12-19
[6] Darbre P D, Aljarrah A, Miller W R, et al. Concentrations of parabens in human breast tumours [J]. Journal of Applied Toxicology: JAT, 2004, 24(1): 5-13
[7] Aker A M, Johns L, McElrath T F, et al. Associations between maternal phenol and paraben urinary biomarkers and maternal hormones during pregnancy: A repeated measures study [J]. Environment International, 2018, 113: 341-349
[8] Spanier A J, Fausnight T, Camacho T F, et al. The associations of triclosan and paraben exposure with allergen sensitization and wheeze in children [J]. Allergy and Asthma Proceedings, 2014, 35(6): 475-481
[9] Souza I D, Melo L P, Jardim I C S F, et al. Selective molecularly imprinted polymer combined with restricted access material for in-tube SPME/UHPLC-MS/MS of parabens in breast milk samples [J]. Analytica Chimica Acta, 2016, 932: 49-59
[10] Towers C V, Terry P D, Lewis D, et al. Transplacental passage of antimicrobial paraben preservatives [J]. Journal of Exposure Science & Environmental Epidemiology, 2015, 25(6): 604-607
[11] B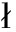 ędzka D, Gromadzińska J, Wąsowicz W. Parabens. From environmental studies to human health [J]. Environment International, 2014, 67: 27-42
ędzka D, Gromadzińska J, Wąsowicz W. Parabens. From environmental studies to human health [J]. Environment International, 2014, 67: 27-42
[12] Darbre P D, Byford J R, Shaw L E, et al. Oestrogenic activity of benzylparaben [J]. Journal of Applied Toxicology: JAT, 2003, 23(1): 43-51
[13] Oishi S. Effects of propyl paraben on the male reproductive system [J]. Food and Chemical Toxicology, 2002, 40(12): 1807-1813
[14] Oishi S. Effects of butyl paraben on the male reproductive system in mice [J]. Archives of Toxicology, 2002, 76(7): 423-429
[15] Oishi S. Effects of butylparaben on the male reproductive system in rats [J]. Toxicology and Industrial Health, 2001, 17(1): 31-39
[16] Oishi S. Lack of spermatotoxic effects of methyl and ethyl esters of p-hydroxybenzoic acid in rats [J]. Food and Chemical Toxicology, 2004, 42(11): 1845-1849
[17] 刘钟栋. 食品添加剂[M]. 南京: 东南大学出版社, 2006: 34
[18] Zhang D L, Zhu M S, Humphreys W G. Drug Metabolism in Drug Design and Development: Basic Concepts and Practice [M]. Hoboken, NJ: Wiley-Interscience, 2008
[19] Sanner M F. Python: A programming language for software integration and development [J]. Journal of Molecular Graphics & Modelling, 1999, 17(1): 57-61
[20] Morris G M, Huey R, Lindstrom W, et al. AutoDock4 and AutoDockTools4: Automated docking with selective receptor flexibility [J]. Journal of Computational Chemistry, 2009, 30(16): 2785-2791
[21] Trott O, Olson A J. AutoDock Vina: Improving the speed and accuracy of docking with a new scoring function, efficient optimization, and multithreading [J]. Journal of Computational Chemistry, 2010, 31(2): 455-461
[22] Testa B, van de Waterbeemd H. Preface to volume 5 [M]//Comprehensive Medicinal Chemistry Ⅱ. Amsterdam: Elsevier, 2007: 246
[23] Gonzalez F J, Nebert D W, Hardwick J P, et al. Complete cDNA and protein sequence of a pregnenolone 16 alpha-carbonitrile-induced cytochrome P-450. A representative of a new gene family [J]. Journal of Biological Chemistry, 1985, 260(12): 7435-7441
[24] Fowler S, Zhang H J. In vitro evaluation of reversible and irreversible cytochrome P450 inhibition: Current status on methodologies and their utility for predicting drug-drug interactions [J]. The AAPS Journal, 2008, 10(2): 410-424
[25] United States Food and Drug Administration (US FDA). Guidance for industry: Drug interaction studies—Study design, data analysis, implications for dosing, and labeling recommendations [EB/OL]. (2012-02-01) [2021-08-12]. www. fda. gov/downloads/Drugs/Guidance Compliance Regulatory Information/Guidances/UCM292362. Pdf.
[26] Martignoni M, Groothuis G M M, de Kanter R. Species differences between mouse, rat, dog, monkey and human CYP-mediated drug metabolism, inhibition and induction [J]. Expert Opinion on Drug Metabolism & Toxicology, 2006, 2(6): 875-894