1 背景介绍(Background information)
2004年Richard Thompson等首次阐述了微塑料(microplastics, MPs)这一概念。微塑料通常被认为是直径<5 mm的塑料碎片、颗粒。按照其化学组成主要可分为:聚对苯二甲酸乙二酯(PET)、聚丙烯(PP)、聚乙烯(PE)、聚苯乙烯(PS)、聚氯乙烯(PVC)、聚酰胺(PA)和丙烯腈-丁二烯-苯乙烯共聚合物(ABS)等。其分别产生于材料加工行业、包装行业、产品制造行业、纺织和服装业、化妆品行业、海运和渔业、旅游业等[1]。按照其来源分,微塑料可分为2类:一是化妆品、洗涤剂等商品中加入的塑料微珠等初级微塑料;二是较大的塑料经过一定外力作用(海浪冲刷、海洋涡旋、紫外线照射、环境风化、空气氧化、生物降解和复融过程等)产生的次级微塑料[2-3]。自20世纪50年代开始大规模生产塑料产品以来,短短几十年时间里,塑料碎片已经在陆地环境以及海洋各层甚至南北极区域中逐渐积累[4-5]。Jambeck等[6]指出2010年192个沿海国家产生了2.75亿t塑料垃圾,其中480万t~1 270万t流入海洋。预计到2025年,可从陆地进入海洋的塑料废物的累积数量将增加1个数量级。
通常将粒径在100~1 000 nm的塑料称作纳米塑料(nano-plastics, NPs)[7],其来源于塑料制品的释放或微塑料的进一步降解。近年来,大量研究集中在微塑料上,而对于纳米塑料的研究较少。与微塑料相比,纳米塑料尺寸更小,比表面积更大,细胞的亲和力也更高[8]。纳米塑料可能穿过生物屏障进入生物组织、血液和细胞,可能会对生物体造成更大的危害[9]。
微塑料广泛存在于各个环境介质中,如水环境、土壤环境以及大气环境。目前已有研究表明,微塑料会在各个环境介质中迁移转化,并对环境介质造成一定影响。在水环境中,王薪杰等[10]研究指出微塑料在河流与海洋中会产生聚沉、重悬、水平运输和潜流交换等迁移过程,水环境中微塑料暴露产生的影响具体表现在:对水生生物个体的毒性、对人类健康的危害、对生态系统结构与功能的影响[11]。在土壤环境中,张秀玲等[12]指出微塑料会对土壤有机碳矿化产生影响,低量微塑料与秸秆混施会显著促进有机碳矿化。土壤中的微塑料暴露产生的影响具体表现在:对土壤中有毒物质的吸附、对土壤中微生物的毒性、土壤有机碳矿化、土壤物理性质的改变、影响土壤生态功能和安全等[13]。相比于水环境、土壤环境中微塑料的相关研究,大气环境中微塑料的研究起步最晚,但大气环境是全球微塑料迁移的重要介质,微塑料可通过大气沉降对人类及其他生物产生潜在的毒性效应。Vianello等[14]指出在室内环境中,24 h内一人可吸入272个微塑料颗粒;Zhang等[15]指出微塑料吸入量与年龄大致呈反比关系。基于此,本文整理归纳了大量国内外相关研究结论,主要通过关键词、主题词检索、摘要检索、相关领域著名学者检索和参考综述检索等方法有针对性地收集相关信息,并按照营养级与物种的不同进行分类归纳。
当前已有的相关综述,多为微塑料对单一营养级或单一物种的毒理学研究归纳,且目前国内外关于微塑料毒性沿营养级传递的定量研究成果较少,暂无统一的标准,无法建立起科学有效的生态风险评估体系。本文更全面地总结归纳了微塑料对不同营养级生物的毒理学研究进展,包括微塑料对微生物、藻类、鱼类和哺乳动物类的毒性效应,并对其中的空白研究领域提出自己的思路见解,分析了现阶段尚存的不足之处,将有利于今后相关领域的进一步拓展。
2 微塑料对微生物的毒性效应(Toxic effects of microplastics on microorganisms)
微生物是水生态系统中常见的类群,包括细菌、放线菌、原生动物、微藻和浮游生物等。近年来针对微塑料的生物毒理学研究大多集中于细菌、微藻和浮游生物这3类。本章节首先聚焦于细菌和浮游动物研究的近况,藻类将会在本文后续章节单独讨论。
2.1 微塑料对细菌的毒性效应
微塑料对微生物特别是细菌的毒理学效应与细菌本身的种类和尺寸,微塑料微粒的粒径、种类和添加剂种类,微生物与塑料微粒接触时间的长短等因素有关,所引发生物生理反应的机制也随生物群落构成的不同而有所不同。现有的大部分研究以描述微塑料对细菌的影响为目标,关注在污泥、土壤中细菌受微塑料环境影响的表现[16-17]。一些学者利用聚合酶链式反应(PCR)、蛋白质分析、转录组分析等技术做了深入研究,所得结论大多揭示出微塑料对细菌产生负面影响[18]。
宏观上看,微塑料的存在会影响环境中菌落群落的组成和总量。史文超等[16]发现好氧反硝化菌群受水体中典型塑料PS、PA纳米颗粒的抑制作用强度有所不同,但其脱氮性能均会受到抑制;同时,微塑料的存在也改变了菌群的构成比例和优势种,在PS胁迫下的菌群中,红螺菌科成为了优势种群;在PA的胁迫下,红杆菌科成为了好氧反硝化菌群中的优势种群。付茜茜等[19]进一步研究了城市红树林系统水体微塑料表面的附着菌落后发现,微塑料表面附着菌落的组成、生物膜总量与微塑料的种类、大小均有关;同时,微塑料表面的优势菌种与水环境中优势菌种的组成有较大的区别。类似地,在杜嘉烯[20]的研究中也发现,堆肥过程中PP微塑料表面菌群的结构也与堆肥环境中显著不同;微塑料的加入使堆肥环境中的厚壁菌门(Firmicutes)的相对丰度降低了27.20%~40.47%,堆肥结束后,微塑料表面主要以拟杆菌(Bacteroidetes)为优势菌门。刘玮婷等[21]的研究表明,微塑料还会改变近岸多环芳烃降解菌群结构,进而可能影响菌落降解污染物的能力;添加了微塑料的体系中,优势菌种为冰居菌(Glaciecola),而与之对照的环境中优势菌群则为小红卵菌(Rhodovulum)。由此可见,在许多环境中,微塑料均会影响其中的菌落结构,研究微塑料对菌落结构的影响对农业堆肥、海上石油污染治理等都有重要意义。
合成橡胶如顺丁橡胶、丁苯橡胶等,作为人类三大合成高分子材料之一,与人类的生活密切相关。由于橡胶本身的高分子结构,以及耐磨性、高弹性、稳定性等特点,使其在使用和废弃过程中也会产生微纳米尺度的碎片或颗粒。尽管橡胶与塑料的区分主要在于其力学性能上差异,但是作为广泛使用的稳定的高分子材料,环境中微纳米级的橡胶颗粒或碎片也被当作一类微塑料污染物而进行研究。Wang等[22]的研究结果表明,轮胎源微塑料(tire microplastics, TMPs)作为一种新兴的环境污染物,是细菌特别是有害微生物定植和繁殖的载体。随着这种新污染物越来越多地进入城市水系统,轮胎微塑料上的细菌定植丰度会随着时间的推移而增加,尤其是致病菌,且与新陈代谢和降解相关的细菌功能也随着时间的推移而增强,这可能会危及水生生物甚至是人类的健康。
Liu等[23]将天蓝色链霉菌(Streptomyces coelicolor)M145置于不同浓度、粒径范围在20~100 nm纳米塑料环境中,培养后发现,20 nm的塑料颗粒致死率最高,微塑料均对抗生素的产生起到抑制作用,且纳米塑料毒性更强。Wang等[24]通过实验探究PVC、PA、PS和PE共4种微塑料颗粒对好氧颗粒污泥氨氧化性能的影响,发现微塑料对硝化作用有可逆的抑制作用,氨氧化细菌的活性受其抑制,同时微塑料颗粒还会富集亚硝化细菌,导致部分硝化功能失去稳定性;另外,相较于PE,PVC、PA和PS对抗生素抗性基因(AGS)的负面影响更大。上述研究表明,微塑料对细菌的毒理学影响具有选择性。
2.2 微塑料对浮游生物的毒性效应
水体环境是微塑料污染最主要的富集场所,浮游动物是水体环境中分布广、对环境变化较为敏感的一类生物,探究浮游生物受微塑料的影响情况对研究微塑料的毒理学效应具有重要意义。Sun等[25]有关黄海微塑料分布的调查表明,浮游生物是环境中微塑料的汇。在浮游生物中,水蚤是当下研究的热点,许多学者就水蚤摄食、生长和繁殖等生理活动受微塑料环境的影响做了进一步的研究。
水蚤是一种小型浮游生物,在环境中广泛分布,在水生生态系统中占有十分重要的地位,水蚤易于饲养,生长周期快,遗传信息明确,是毒理学研究中常用的一种模式生物。Besseling等[26]首次发现纳米塑料会对大型溞(Daphnia magna)的生活史产生巨大的影响,暴露在纳米塑料环境下的水蚤体型变小,繁殖能力受到影响;暴露在不同浓度、老化程度的纳米塑料中的水蚤均呈现产出的子代体型小、数量低的特性,且新生蚤中畸形蚤的比例较未暴露的群体均有所上升。老化程度越高,新生蚤为畸形个体的比例越高。Liu等[27]将新生水蚤暴露在纳米塑料环境下培养为成体后,利用转录组分析其遗传物质,发现与未暴露在纳米塑料环境下的水蚤相比,二者存在200多个基因的差异表达,纳米塑料暴露环境可能会导致新生蚤的氧化应激、免疫防御和糖代谢紊乱;而在Liu等[28]的另一项有关纳米塑料环境对蚤状溞的生殖毒性影响途径的研究中分析了蚤状溞的蛋白质组,利用分子和生化分析,建立起了纳米塑料影响蚤状溞的有害结局路径(AOP),最终得到纳米塑料积累会对蚤状溞后代形成生长抑制,导致繁殖量减少的结论。在摄食方面,刘全斌[29]研究发现在高于环境浓度1倍的10 μm微塑料环境下,培养日本虎斑猛水蚤48 h后,PS微粒并未影响水蚤对微藻的摄入,同时PS微粒并不会在水蚤体内停留过长时间。
2.3 微塑料对微生物的毒性影响机制
2.3.1 微塑料影响相关基因的表达
卢萍等[30]研究发现,微塑料会影响沉积物中与硝化有关的功能基因的丰度,其中聚乳酸(PLA)微塑料会导致amoA和nirS丰度提高,nirK丰度降低,而PVC微塑料则导致上述3种基因的丰度均降低;最终,这种基因丰度的变化与酶的活性等因素结合,共同影响氮循环的方式。Liu等[27]的研究表明,生活在纳米塑料环境下的水蚤后代的基因发生较大改变,这种改变可能会导致水蚤后代的畸形、影响其繁殖能力。在Liu等[28]的另一项研究表明,纳米塑料对水蚤子代基因的改变可能会通过产生差异表达蛋白(DEPs)等方式作用于水蚤子代的生活史。
2.3.2 微塑料对细胞氧化应激的刺激作用
Liu等[27]的研究表明,纳米级PS塑料会诱导水蚤产生氧化应激,从而影响水蚤的繁殖能力,但目前对于塑料微粒刺激水蚤产生氧化应激的机制研究还十分欠缺。张晨[31]通过对日本虎斑猛水蚤的研究得出,微塑料对乙醇脱氢酶、谷胱甘肽转移酶和蛋白酶体激活子复合物亚基-4的改变可能是微塑料引起其氧化应激的原因;而氧化应激可以提高暴露在胁迫环境下生物的代谢成本,从而可能促使该生物将用于繁殖的能量转移至代谢,影响其繁殖能力。
2.3.3 微塑料影响活性氧(ROS)的产生
张晨[31]在研究微塑料对日本虎斑猛水蚤的影响效应中发现,微塑料在猛水蚤世代中的积累会促进其后代ROS的产生,最终可能会导致氧化系统的失调。同样的现象也发生在细菌中,在Liu等[23]对天蓝色链霉菌(Streptomyces coelicolor)M145的研究中也得出,微塑料的加入会显著提高其ROS水平和细胞膜通透性,进一步影响了放线菌素的产率;同时该研究还发现,纳米塑料对该菌的影响远大于微塑料对该菌的影响。
2.3.4 微塑料改变环境透氧量
卢萍等[30]通过对氮循环的研究发现,微塑料能够改变沉积物的孔隙度,从而增大沉积物中养分通量以及硝化细菌与氧气的接触,最终促进硝化作用的发生。
2.4 小结
尽管有关微塑料对菌落结构影响的研究有所增多,但目前大部分研究仍未深入探究微塑料影响机制及其与影响程度的相关度。目前,微塑料刺激微生物氧化应激的机制、微塑料如何影响相关基因的表达都尚未有明确的答案;不同环境下微塑料种类与微生物的优势种的对应关系等都需要学者们的进一步研究。在应用层面上,学者们可以更多探讨微塑料种类对菌落代谢能力、繁殖规模等的影响,从而转化入实际生产应用,帮助改进农业堆肥和促进环境中污染物的降解。
3 微塑料对藻类的毒性效应(Toxic effects of microplastics on algae)
藻类是海洋食物网中的主要生产者,也是给生物提供氧气的重要来源;目前关于微塑料对藻类产生影响的毒理学模式和机制的了解较为有限。在本章节中,主要综述微塑料自身的物理化学性质对藻细胞的影响。
3.1 微塑料对藻类的毒性效应
微塑料对藻类的影响与其种类、浓度和大小等多方面因素有关。殷岑[32]研究了高浓度的PE(200~250 μm)、PVC(200~250 μm)和PS(200~250 μm)对斜生栅藻(Scenedesmus obliquus)的生长抑制效应,针对每种塑料进行96 h的暴露实验后,可以发现PE的抑制效果最为显著,PVC相较PE的抑制效果要小,而PS则基本没有影响。Sjollema等[33]的研究表明,在不同尺寸PS(0.05、0.5和6 μm)的实验设置浓度下暴露72 h,特氏杜氏藻(Dunaliella tertiolecta)生长受到明显抑制,并且这种负面影响随着PS粒径的减小而增加。Davarpanah和Guilhermino[34]发现在PE(1~5 μm)较低的浓度下暴露96 h后,对海洋微藻周氏扁藻(Teraselmis chuii)的平均生长率没有显著影响。Zhang等[35]研究微塑料对海洋微藻中肋骨条藻(Skeletonema costatum)的毒性效应,通过藻类生长抑制实验发现,微米级PVC(1 μm)对微藻的生长有明显的抑制作用,暴露96 h后最大生长抑制率达到39.7%;然而,毫米级PVC(1 mm)对微藻的生长没有影响。此外,Zhang等[35]的研究表明高浓度微米级PVC(1 μm)对藻类光合作用也有负面影响,在PVC处理下叶绿素含量和光合效率均下降;但在Sjollema等[33]的研究中,PS(0.5 μm)并未对光合作用产生影响。由此可见,受制于不同种类、浓度和大小的塑料碎片,藻细胞所受到的影响各不相同。
3.2 微塑料对藻类的毒性影响机制
3.2.1 遮蔽效应及物理吸附
Schwab等[36]研究发现,藻类生长减少的主要原因可能是遮蔽效应导致的光的可用性降低。在Zhang等[35]研究微塑料对海洋微藻中肋骨条藻(Skeletonema costatum)的毒性效应中发现,与非接触遮光效应相比,微塑料的吸附和聚集可能是对海洋微藻产生毒性效应的潜在原因。Bhattacharya等[37]研究发现了纳米塑料对小球藻(Chlorella)和栅藻(Scenedesmus)的物理吸附,这种吸附普遍存在于带正电的纳米塑料中,其原因是纳米塑料和细胞膜、细胞壁间的静电吸引。这种吸附对小球藻(Chlorella)和栅藻(Scenedesmus)的影响格外明显,并且和这2种藻类的形态和运动性相关。吸附阻碍藻类的光合作用,可能是通过纳米颗粒对光和空气流动的物理阻塞造成的。由于微塑料与自然介质的不同,塑料上附着藻类中的叶绿素a含量明显减少,进而影响藻类的生长[38]。另外,微塑料团聚形成的聚集体,同样会影响藻类的生长[39-40]。
3.2.2 ROS损伤
在光合生物中,ROS作为线粒体、叶绿体和过氧化物酶体的各种代谢途径的副产物持续产生(ROS损伤机理如图1所示),并响应诸如病原体、干旱、光照强度和污染等环境胁迫[37]。塑料吸附会促进藻细胞中ROS的产生[37],这一效应归因于藻细胞内的氧化应激。抗氧化酶水平发生变化,破坏了氧化和抗氧化之间的平衡。因此,藻类受到ROS积累的破坏,导致脂质氧化,抑制藻类生长[40]。Mao等[41]的研究表明PS(0.1 μm和1 μm)除了会使小球藻(Chlorella)光合作用效率降低外,还会导致藻细胞的类囊体扭曲和细胞膜受损,其原因在于微塑料造成的物理损伤和氧化胁迫,最终影响藻类的生长。
3.2.3 物理损伤
微塑料可能穿过细胞壁和细胞膜进入细胞内部,并有可能对其造成破损[38,40]。这种损伤机制在高等植物中同样得到了证实,Sun等[42]的研究表明羧基改性聚苯乙烯纳米塑料(PS-COOH, 200 nm)可以吸附在拟南芥(Arabidopsis thaliana)根尖区的细胞上,严重影响了其生长和幼苗发育。此外,Mao等[41]还指出这种物理损伤也会进一步诱导藻细胞类囊体扭曲以及细胞膜受损,最终导致藻细胞死亡。
3.3 小结
目前,关于微塑料对藻类的毒性影响的研究以微藻居多,大多呈现出对其生长的抑制作用,但不同种类微塑料对不同藻的影响程度大相径庭;特别地,在Canniff和Hoang[43]的研究中绿色荧光聚乙烯微珠(直径63~75 μm,颗粒密度为0.99~1.01 g·cm-3)对羊角月牙藻(Raphidocelis subcapitata)的生长起到了促进作用。已有的研究中并未发现其规律,这在未来的研究中需要进一步探索。此外,大多数实验都是针对单一藻类,而在实际的环境中是多种藻类并存;同时为了放大微塑料的影响效应,选取的浓度也超过环境中的微塑料浓度,这2点都是与现实环境中不相符的地方。因此,在以后的实验中,针对这2点无论在实验的设计还是在实验材料的选择都需要着重考虑。
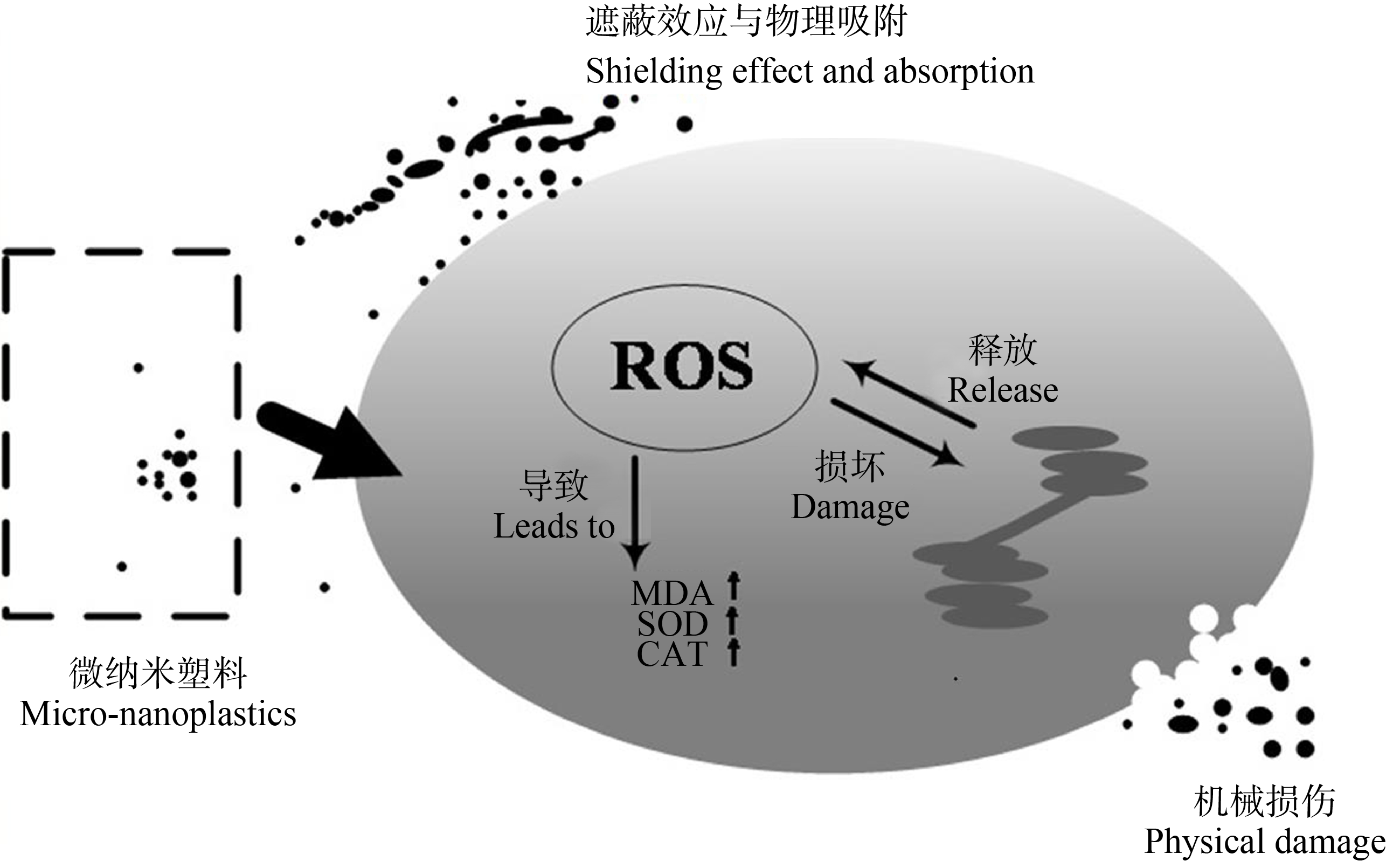
图1 微纳塑料对藻细胞的毒性机理(活性氧损伤)
注:ROS表示活性氧物种;MDA表示过氧化产物丙二醛;SOD表示过氧化物歧化酶;CAT表示过氧化氢酶。
Fig. 1 The toxic mechanism of micro-nanoplastics on algae cells (reactive oxygen damage)
Note: ROS stands for reactive oxygen species; MDA stands for malondialdehyde; SOD stands for superoxide dismutase; CAT stands for catalase.
4 微塑料对鱼类的毒性效应(Toxic effects of microplastics on fish)
4.1 微塑料对鱼类的危害
针对鱼的毒理学研究,大多通过将鱼类直接暴露于一定浓度的微塑料环境下进行,微塑料通过皮肤直接摄取、鱼类腮部的开合或者吸附到鱼类所摄取的食物上(食物链传递)转移到鱼类身体中[44]。
由于微塑料粒径小和对有毒物质吸附性高的特性,其对鱼类造成的危害总体分为2类:机械物理损伤和复合物毒性引起的化学损伤[45]。其损伤、危害程度因微塑料的种类、形状、粗糙度、颜色、对有毒化学物质的亲和性等的不同也有很大区别[46]。Choi等[44]指出在相同实验条件下,暴露在形状不规则的微塑料环境的羊头鲦鱼(Cyprinodon variegatus)比暴露在球形微塑料环境下的游泳移动距离更短,即游泳能力更差;此外,研究还指出不规则微塑料的粗糙度可能导致鱼类炎症增加。Ory等[47]发现鱼优先捕获类似于食物颗粒的黑色微塑料,而其他颜色(蓝色、半透明和黄色)的微塑料大多在其之后被共同捕获。关于微塑料对于有毒化合物或重金属吸附的联合毒性机制极为复杂,国内外研究尚处于起步状态,Barboza等[48]发现汞与微塑料之间存在显著的相互作用,导致欧洲鲈鱼幼体的神经毒性、氧化应激和损伤,以及能量相关酶活性的变化。Haghi和Banaee[49]研究指出,鲤鱼接触百草枯和/或微塑料后,肌酐水平升高,结果表明,水中微塑料剂量的增加显著增加了百草枯对鱼类的毒性作用。Wik等[50]研究了轮胎源微塑料(TMPs)渗滤液毒性对斑马鱼等的毒理效应,发现斑马鱼在暴露48 h之内死亡,根据毒性鉴定评价发现此为TMPs联合锌与有机化合物引起。有毒物质与微纳塑料的联合毒性研究任务繁重且联合毒理机制复杂,需要进一步的研究。
4.2 微塑料对鱼类的毒性影响机制
4.2.1 微塑料对鱼类的行为产生影响
已有研究发现鱼类暴露在微纳塑料环境中会出现摄食、游泳等行为异常,具体表现为游泳速度变慢,游泳范围、距离变小以及停止进食。Cedervall等[51]将测试鱼暴露在纳米塑料环境中,鱼通过吞咽食物的方式摄取纳米塑料,在18、21、24、27和30 d时观察鱼的活动,发现受试鱼的移动速度比对照鱼慢得多,移动范围也小得多,而且在捕食过程中,测试鱼群不再捕食浮游动物。此外,研究人员将水蚤放入测试鱼口中,鱼群并没有吞咽行为。这些数据表明,鱼类在食用含有纳米塑料颗粒的食物后会出现强烈的行为紊乱。Choi等[44]研究了羊头鲦鱼幼鱼的游泳行为,也发现受试鱼暴露在微塑料环境中出现总移动距离变短,游泳能力下降的现象。相似地,Mattsson等[52]的研究也证明了这一点。
4.2.2 微塑料对鱼类的代谢产生影响
鱼类的自身脂质代谢会受到微塑料摄入的干扰。Brandts等[53]探究了短期暴露于45 nm聚甲基丙烯酸甲酯(PMMA)纳米塑料环境中的金头鲷(Sparus aurata),指出测试鱼暴露于纳米塑料环境后,与脂质代谢相关的关键基因转录水平升高,血浆胆固醇和甘油三酯水平发生变化,研究表明,金头鲷短时间暴露于PMMA后,脂质通路发生了改变,脂质代谢受到严重影响。Choi等[44]的研究中也提到了鱼类的脂质代谢受微塑料的影响。
4.2.3 微塑料引起鱼类的氧化应激反应
微塑料通过影响并调控基因刺激鱼类出现氧化应激反应。Qiao等[54]研究了微塑料对于Cu的吸附,发现随着时间积累,微塑料和Cu在斑马鱼肝脏和肠道内累积,Cu通过影响DNA的方式间接引起鱼群的氧化应激反应,且会促进细胞凋亡。Brandts等[53]得出结论,鱼接触PMMA(0、0.001、0.01、0.1、1和10 mg·L-1)后,与脂代谢相关的关键基因(如载脂蛋白A1和视黄酮X受体)的mRNA水平普遍上调。金头鲷抗氧化相关基因(如谷胱甘肽过氧化物酶Ⅰ)在暴露24 h后表达上调,总抗氧化能力(TAC)不断增加,抗氧化状态相关基因的早期上调,表明鱼类能够激活抗氧化防御,这与TAC值的升高相一致。其原因在于PMMA激活了机体的抗氧化防御,诱导了脂质代谢途径的改变和血细胞的遗传毒性[55]。
4.2.4 微塑料引起鱼类炎症反应
Lei等[55]研究了鱼类在0.001 mg·L-1的微塑料暴露10 d所受到的影响。PA、PE、PP和/或PVC微塑料会造成肠道损伤,包括绒毛破裂和肠上皮细胞分裂。健康的斑马鱼成鱼暴露于微塑料环境会导致其肝细胞空泡化甚至坏死,引起肝脏部分炎症[56]。
4.2.5 微塑料抑制鱼类的体质量增长
长期暴露于微塑料环境下的鱼类呈现体质量增长缓慢甚至下降的现象。蓝益添等[57]的实验结果表明,微塑料浓度>0.12 g·L-1时能显著抑制淡水鱼体质量的增长,微塑料的浓度>0.18 g·L-1时能显著抑制淡水鱼体长的增长。
4.2.6 微塑料对鱼类的神经毒性
Chen等[58]的研究表明,双酚A(BPA)可在斑马鱼内脏、鳃、头和肌肉中积累;研究还发现,纳米塑料颗粒也会在鱼的不同组织中积累。该研究组发现BPA或纳米塑料均可引起中枢神经系统髓鞘碱性蛋白(MBP)基因上调;同时,2种污染物均表现出明显的乙酰胆碱酯酶(AChE)活性抑制,而AChE是具有代表性的神经毒性生物标志物。此外,在共暴露处理下,微管蛋白基因表达、多巴胺含量以及中脑星形胶质细胞源性神经营养因子(MANF)mRNA表达均显著上调,这表明对中枢神经系统和多巴胺的神经毒性作用均增强。
4.3 小结
在微塑料对鱼类影响的毒理学研究要注意的是:现阶段在实验室中探究微塑料对鱼类的毒理学危害时,部分研究人员为了放大其效应,加快实验进程并获得更明显的结果,会使微塑料实验浓度远高于实际环境的微塑料浓度。这不利于毒性产生临界值标准的确定,也无法建立科学的生态风险评估体系。在未来研究中还应进一步探究实际环境中微(纳米)塑料浓度的危害;微塑料吸附有毒物质(包括重金属)的联合毒性研究较少,更广泛的微塑料联合有毒化合物和重金属对鱼类的毒理学研究需要研究人员的长期研究与大量积累;受试物种单一化的问题使得众多研究人员尚不能广泛统一地确定微塑料的毒理学效应,应在未来使受试物种广泛化。
5 微塑料对哺乳动物的毒性效应(Toxic effects of microplastics on mammals)
5.1 微塑料的暴露途径
人类等哺乳动物可以通过消化道、呼吸道以及皮肤接触的方式摄入微塑料,并在体内发生转运和吸收等过程,从而对哺乳动物和人体健康产生不良影响(图2)。
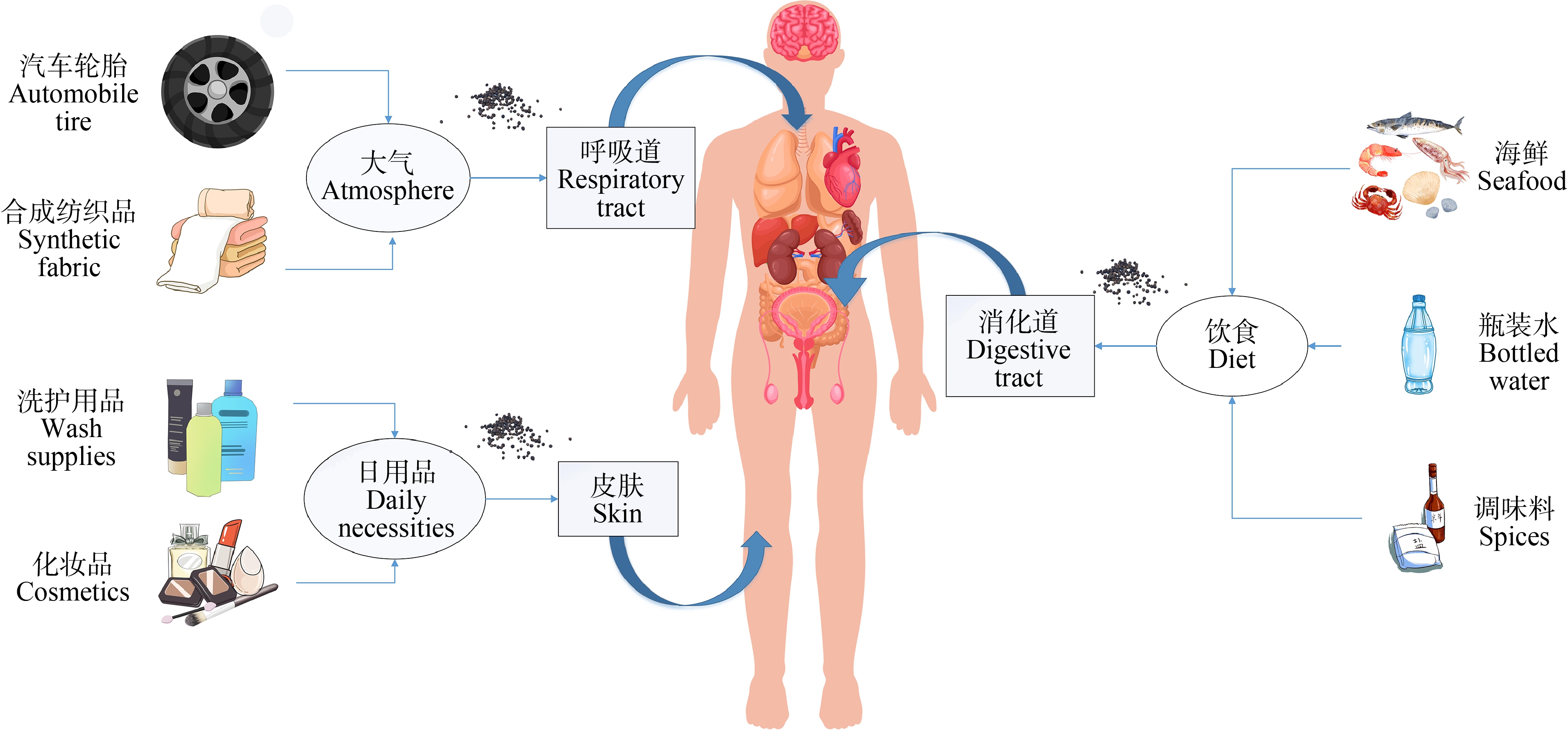
图2 微塑料关于哺乳动物(人)的暴露途径
Fig. 2 Exposure pathways of microplastics in mammals (humans)
5.1.1 通过消化道暴露
目前,通过消化道摄入含有微塑料的食物被认为是人类接触微塑料的主要途径[59]。随着塑料制品的大量使用,许多鱼类、贝类和虾类等海洋生物都摄入了不同浓度的微塑料[60],而位于食物链顶端的人类,则会因为富集作用而增大摄入微塑料的风险。更加值得注意的是,研究人员在人类日常饮用的瓶装水中也发现了一定浓度的微塑料,成人和儿童的每日估计摄入量(EDI)分别为40.1 μg·kg-1·d-1和87.8 μg·kg-1·d-1[61]。此外,国内外研究者在食盐、糖等食品调味料中,同样检测到了微塑料的踪迹[62]。
Carr等[63]的实验结果表明,微塑料的尺寸越小,肠道对塑料颗粒的吸收率越高,并且尺寸小的塑料颗粒对肠道的危害更大[64-65]。对于纳米塑料,它们穿透肠道上皮细胞的能力更强,该能力取决于纳米塑料尺寸的大小与表面电荷,其能够通过肠道屏障转运后而到达整个循环系统[66],进而对生物体产生更深远的影响。虽然到目前为止,还没有研究能够有效建立起纳米塑料的大小、组成和摄取之间的联系,但研究表明,不同的体外肠道模型对于不同尺寸、表面修饰和化学成分的塑料颗粒(50~500 nm)测定的吸收率范围为1.5%~10%[67-69]。
5.1.2 通过呼吸道暴露
在空气中传播的微塑料来源非常广泛,包括合成纺织品、材料(例如汽车轮胎,建筑物)的磨损以及微塑料在表面的重悬浮等[59]。据估计,每人每天通过呼吸摄入空气中的微塑料数量约为26~130个[70]。Vianello等[14]采取人体模型结合空气采样,估计轻度活动的成年男性每人每天可吸入272个微塑料颗粒。相关实验表明,塑料颗粒的性质(例如大小和密度)会影响它们在呼吸系统内的沉积,密度较小和尺寸较小的颗粒能够到达肺部更深处[66]。
5.1.3 通过皮肤暴露
与通过消化道、呼吸道摄入相比,通过皮肤接触摄入的微塑料所占比重较小。然而,目前许多研究已经在磨砂膏、洗发露等个人护理用品以及化妆品中检测到了微塑料,当人们使用其进行洗涤时,可能发生皮肤接触[71]。
Hernandez等[72]通过顺序过滤分级分离的方法,证实了在包含PE微珠的商业磨砂膏中纳米塑料的存在。研究表明,尺寸大小在100 nm以上的微塑料由于受到角质层的限制,不太可能通过皮肤被吸收,而纳米塑料颗粒(<100 nm)接触皮肤之后,能够穿过上皮组织进入生物体内部[73-74]。因此,皮肤暴露这一摄入途径同样应当引起科学家们的关注。
5.2 微塑料对哺乳动物的毒性效应
微塑料通过上述暴露途径进入到哺乳动物体内后,会对生物体不同部位产生各种毒性效应。本章节分别阐述了微塑料对哺乳动物消化系统、呼吸系统、免疫系统、神经系统和生殖系统的毒性效应(图3)。

图3 微塑料对哺乳动物的毒性效应
Fig. 3 Toxic effects of microplastics on mammals
5.2.1 微塑料对消化系统的毒性效应
研究发现,小鼠摄入高浓度PE微塑料后,其肠道(结肠和十二指肠)显示出明显的炎症,并且Toll样受体4(toll-like receptor 4, TLR4)、转录因子激活蛋白-1(activating protein-1, AP-1)和干扰素调节因子5(interferon regulatory factor5, IRF5)的表达更高[75]。PS微塑料颗粒还会引起小鼠肠道粘液分泌减少、肠道菌群失调、肠屏障功能障碍和代谢异常[76-77]。Hans等[78]发现肠道内的微塑料能通过其表面电荷促进吸附反应,与腔内复杂的物质相互作用,比如更大的蛋白质和糖蛋白会被吸附到微塑料颗粒的表面,这可能会影响肠道的免疫系统,并引起局部炎症[79];反之,炎症可能又会促进肠道对塑料微粒的吸收[80],形成一种正反馈机制。Liu等[81]采用体外消化过程转化100 nm和5 μm的PS微塑料颗粒,发现消化过程不会改变PS的化学组成,但会在PS的表面形成冠状物,进而可能造成毒性的改变,且100 nm PS的肠道毒性高于5 μm PS。Luo等[82]指出,通过食物与水体摄入是TMPs的潜在接触途径,因此胃肠道可能是TMPs的主要作用靶点,TMPs可能在此穿过肠绒毛,进入血管,形成蛋白质-塑料复合物(被称为蛋白冠)。此外,TMPs可能会对胃肠道的消化过程产生负面影响,当TMPs不受自身免疫系统控制时,将会参与体内循环,从而在细胞和分子水平产生毒性。
目前关于纳米塑料对胃肠道毒性的实验研究还较少。Forte等[83]用44 nm和100 nm的PS纳米颗粒对胃腺癌(AGS)细胞进行实验,发现纳米塑料颗粒的毒性与其大小、浓度和作用时间有关,并且PS纳米颗粒能够影响细胞活力和细胞形态、改变炎症基因的表达,且44 nm的颗粒比100 nm的颗粒更能强烈诱导炎症因子IL-6和IL-8基因的上调。
5.2.2 微塑料对呼吸系统的毒性效应
人体吸入的纤维微塑料大部分可能会被肺部黏液和纤毛清除,有些可能会在肺部持续性存在,引起局部的生物反应,尤其是在清除机制受损的个体中[84]。PS微塑料颗粒可以通过诱导ROS的形成而在人肺上皮细胞中引起细胞毒性和炎症,尽管低浓度的PS微塑料颗粒通过消耗ZO-1(zonula occluden-1)蛋白只能引起保护性肺屏障的损伤,但它们也可能增加患慢性阻塞性肺疾病的风险[85]。
此外,PS纳米塑料颗粒会显著影响人肺上皮细胞的活性、细胞周期和细胞凋亡过程,改变相关的基因转录以及蛋白质表达,并且PS对人肺上皮细胞的影响取决于其大小、暴露时间和浓度[86]。Lim等[87]的研究表明,PS纳米塑料颗粒暴露会导致细胞自噬和内质网应激相关的代谢变化,例如氨基酸和三羧酸循环中间代谢产物的增加,该过程在调节细胞抵抗毒性效应中起着关键作用。
5.2.3 微塑料对免疫系统的毒性效应
近年来,微塑料对免疫系统的毒性效应研究大多选取小鼠作为哺乳动物模型和人体细胞系为实验对象进行。免疫系统在微塑料的入侵下可能产生的免疫毒性,主要表现为免疫抑制、免疫激活和炎症反应。
Park等[88]使用PE微塑料进行实验,给小鼠灌喂PE(0.125、0.5和2 mg·d-1)90 d,发现雄性小鼠体质量增加明显减少,雌雄小鼠体内中性粒细胞在血液中的比例均明显增加。此外在该实验中还发现,食用PE的小鼠血液中IgA水平显著升高,脾脏内淋巴细胞亚群发生改变。一些研究表明小肠上皮中的巨噬细胞在微塑料颗粒>0.5 μm时会发生吞噬作用,内吞作用的粒径上限通常为0.5 μm[89]。然而,尽管>0.2 μm的颗粒可通过脾滤过系统清除,但也有研究表明发现内皮细胞也可内吞较大的5 μm颗粒[90-91]。Li等[75]的研究表明用不同剂量的PE微塑料(6、60和600 μg·d-1)连续5周处理C57 BL/6小鼠时,高浓度微塑料饲喂组与空白组(未处理组)相比,各饲喂组血清白细胞介素-1α水平均显著高于空白组,且Th17细胞和Treg细胞在CD4细胞中的比例降低。
Prietl等[92]选取人外周血细胞、单核细胞和巨噬细胞中分离的白细胞,采用尺寸为20~1 000 nm的羧基聚苯乙烯(CPS)颗粒作为模型颗粒,发现尺寸≥500 nm的CPS颗粒仅对巨噬细胞有细胞毒性,500 nm和1 000 nm CPS颗粒刺激单核细胞和巨噬细胞分泌IL-6和IL-8,促进巨噬细胞对细菌的吞噬和趋化作用,并引起粒细胞的氧化爆发。20 nm CPS颗粒对所有吞噬细胞均有细胞毒性,且会刺激人单核细胞分泌IL-8并诱导单核细胞氧化破裂。
以上一些研究结果表明微塑料对吞噬细胞产生了毒性效应,但目前微塑料对免疫系统的研究仍然比较少,对人体的免疫系统影响仍待深入探究。
5.2.4 微塑料对神经系统的毒性效应
不仅微塑料会对呼吸、消化和免疫系统产生不良毒性,纳米塑料还能穿过血脑屏障在中枢神经系统中引起毒性效应[93]。目前人们关于微塑料对神经系统带来的影响的研究还较少,有研究发现人脑胶质瘤细胞T98G在微塑料影响下会产生大量的ROS,引起氧化应激反应[94],从而对神经细胞产生毒性作用。另外在一些类似的研究中,还存在对神经系统毒性效应的结论不一致的现象[95-96],这为之后更多的研究提供了借鉴,需要注意在实验中保证微塑料有相同的化学性质、相同的粒径大小,实验对象为相同的物种等。
5.2.5 微塑料对生殖系统的毒性效应
Park等[88]研究发现,暴露于PE微塑料颗粒的小鼠,每只雌鼠的活产数、幼崽的性别比例和幼崽的体质量都发生了显著变化。此外,PE的存在会影响后代脾脏内淋巴细胞的亚群。Xie等[97]将健康的雄性C57BL/6小鼠暴露于生理盐水或不同剂量的直径为5.0~5.9 μm的微塑料颗粒中6周,其结果表明,微塑料会导致小鼠的精子数量和活性均显著下降,且精子的畸形率显著升高。此外,田坤明和陈秋[98]以小鼠为对象,对其进行28 d剂量为5 mg·kg-1不同粒径微塑料颗粒的灌喂染毒处理,结果显示亚急性染毒微塑料也可能会对雄性生殖功能造成潜在毒性。最近有相关人体胎盘灌注模型研究显示240 nm PS能穿过胎盘屏障,并且不影响胎盘外植体的生存能力[99]。与此同时,另一项体外培养人胎盘滋养细胞实验中并未发现微塑料在胎盘屏障转运的现象[100]。
5.3 小结
在之后的关于微塑料对哺乳动物的毒性效应研究中需要关注如下问题:第一,目前在试验生物的选择上较为单一,实验对象局限于模式生物及体外细胞,主要关注了对小鼠体内各器官的毒性作用,但实验结果难以代表所有的哺乳动物种类,也不完全适用于评价微纳米塑料对人体健康的危害,因此,其结论需要进一步的验证。第二,现有研究在微塑料的选取上也比较局限,其材质多为PS和PE,而现实环境中的微塑料品种则更加多样化,且其表面存在各种类型的添加剂和其他污染物,这使得实际生活中微塑料的毒性效应和作用机制更加复杂,有待进一步的研究。其中,尤其TMPs与其他污染物(如重金属和有机化合物以及其他微塑料)的相互作用对人体产生联合毒性的研究很少,TMPs联合毒性的相应分子机制尚不清楚,而TMPs又是日常生活中人体接触率较高的一类微塑料,因此,建议对轮胎微塑料与其他污染物、不同的轮胎微塑料本身以及与其他微塑料进行联合毒性试验[82]。第三,目前对微塑料毒性机制的研究主要集中于炎症反应和氧化应激等层面,对于更深入的分子层面上的机制原理仍涉及较少,今后需要采取更先进的技术手段或方法进行更深入的实验探究。
6 微塑料在食物链中的迁移转化(Migration and transformation of microplastics via food chain)
微塑料不仅通过直接作用对生物个体造成危害,食物链传递同样也是微塑料暴露的重要途径。在水生食物链中,Murray和Cowie[101]通过给龙虾喂食带有PP纤维的鱼,首次证明了微塑料可以沿食物链从食物转移到捕食者。Farrell和Nelson[102]则记录了PS微球从蓝贻贝转移到青蟹的过程。Setälä等[103]的研究显示了塑料在浮游动物食物网中的营养转移:糠虾在摄食各种桡足类和多毛类幼虫物种后,其肠道内含有微塑料。Cedervall等[51]研究了商业制造的PS纳米塑料颗粒沿着海洋食物链的传输情况,发现纳米塑料(24 nm)可以沿着斜生栅藻—大型水蚤—鲫鱼的水生食物链发生迁移转运,最终影响鲫鱼的脂质代谢和行为活动。该项研究中,对照组和实验组的鲫鱼至少有3个独立的不同代谢参数:体质量数值、血清中胆固醇的比例以及胆固醇在肌肉和肝脏中的分布,基本可保证全面地评价鲫鱼的生理状态。
在陆地食物链中,土壤中的微塑料也可通过转移、富集作用而给更多的生物带来健康风险。Huerta Lwanga等[104]首次提出了庭院土壤环境中的微塑料可通过土壤—蚯蚓—鸡的食物链进行传递,发现微塑料从土壤到蚯蚓粪的富集系数为12.7,从土壤到鸡粪的富集系数高达105。该研究同时也检测到鸡砂囊中微塑料的富集系数为5.1,而砂囊作为食材可能导致微塑料进入人体从而危害人体健康[101]。事实上,Li等[105]的研究也为农作物(小麦和生菜)通过裂缝进入的方式来吸收和积累PS提供了证据,结果表明微塑料有可能通过植物进入食物链传递,最终对人类健康造成影响。此外,对于与人类具有相同生活环境的宠物(猫和狗等),其宠物食品和粪便中均被检测到了一定浓度的微塑料,这也间接证明了微塑料已经在食物链中传递[106]。
当前,对于微塑料在食物链中的累积效应,以及微塑料沿着食物链进入人体所产生的潜在危害,尚缺乏系统的研究。未来还需要对食物链中不同营养级的生物进行微塑料污染特征调查,并进一步开展微塑料的人体健康风险评价。
7 总结与展望(Summary and prospects)
由于微生物、藻类、鱼类、哺乳动物的物种、生活习性和所处营养级位置的差异性,微塑料对不同生物的毒理效应也有很大差别。但总结微塑料对生物体的毒性机制大致可分为2类,即机械物理损伤与生物化学毒性损伤。
微塑料对生物的机械物理损伤,在细菌和水蚤等微生物层面尚未体现,对于藻类则表现为遮蔽效应、物理吸附以及穿透细胞壁和细胞膜的物理损害,而鱼类摄入微塑料会造成对消化系统和呼吸系统的物理损伤,例如导致肠道绒毛破裂从而造成物理损伤以及微塑料累积,对鱼类消化系统产生不利影响。这些都是机械物理损伤机制的体现。
微塑料对生物的生化毒性损伤,在细菌层面体现为对氨氧化细菌的活性抑制、对反硝化菌群的脱氮性能抑制等,纳米塑料甚至可以对部分细菌(如天蓝色链霉菌)产生致死性危害;在浮游生物层面则体现为导致对新生蚤的氧化应激、代谢紊乱、生长抑制以及繁殖能力下降等;微塑料还通过破坏活性氧平衡的方式导致脂质氧化,从而抑制藻类的生长。对于鱼类而言,微塑料的生化毒性会造成其行为紊乱、代谢异常和生长迟缓,影响DNA和基因表达,促进细胞凋亡,引发氧化应激反应、炎症反应以及神经毒性。微塑料对哺乳动物的生物化学毒性机制除了包括以上几点之外,还体现在影响细胞活性、细胞形态和细胞周期等分子层面,以及免疫抑制、免疫激活和生殖功能的毒性方面。
总而言之,微塑料对微生物的毒性机制主要表现为生化毒性损伤方面,而对于藻类、鱼类和哺乳动物而言不仅体现在生物化学毒性损伤上,还体现在机械物理损伤方面,这是由于高级生物结构往往更加复杂,摄入微塑料所产生的毒性效应也就相对更多、更复杂。
当前,国内外针对微塑料的相关毒理学机制研究仍相对匮乏,特别是针对长期的环境低浓度微塑料对生物造成的影响,尚未有成熟的实验和手段来进行探究。为了更加真实地理解微塑料带来的生态与健康风险,今后还应当从以下几个方面予以考虑。
(1)注重微塑料的多样性。需要理解不同来源、化学成分、形状和大小的微塑料对生物的影响,由于微塑料本身组成的复杂性,形状的多样性,来源的广泛性,微塑料这些理化性质的差异如何影响环境中的生物,进而产生毒性效应,仍需深入研究和探讨。特别是同种微塑料在不同研究中针对同一种生物所发现的截然不同的效应,这可能与微塑料本身组成、添加剂成分等密切相关,但仍需大量对比实验(包括实验室实验和野外实验)来验证。
(2)注重微塑料的环境贴合性。应该尽可能选用模拟自然条件得到微塑料或者从自然环境中提取的微塑料作为暴露材料,避免研究人员为了放大其效应,使得微塑料实验浓度远高于实际环境的微塑料浓度,强化对长期处于环境低浓度微塑料暴露下生物毒理学效应的研究;加强对微塑料与有机污染物和微生物致病菌联合毒性的研究。
(3)注重受试物种的多样性。受试物种单一化的问题使得众多研究人员尚不能广泛统一地确定微塑料的毒理学效应,应在未来使受试物种广泛化,有目的地开展微塑料对人体危害的研究,而不仅限于围绕着海洋生物以及小鼠等模式生物开展。
(4)注重毒理学指标的量化统一。应进一步开展微塑料与污染物的复合毒理学机制及其影响因素的研究,设定毒理学指标,建立更加系统的毒性效应评价和检测系统。
(5)注重整个生态系统的整体影响。应加强微塑料在食物链传递过程中毒性蓄积与变化的研究,而不是仅仅停留在生物个体水平,从更为全面的多角度进行综合评判。
[1] 李征. 海州湾近岸海域海水及表层沉积物中微塑料种类及分布特征研究[D]. 上海: 上海海洋大学, 2020: 11-18
Li Z. Types and distribution characteristics of microplastics in seawater and surface sediments in the coastal waters of Haizhou Bay [D]. Shanghai: Shanghai Ocean University, 2020: 11-18 (in Chinese)
[2] Zarfl C, Matthies M. Are marine plastic particles transport vectors for organic pollutants to the Arctic? [J]. Marine Pollution Bulletin, 2010, 60(10): 1810-1814
[3] 朱莹, 曹淼, 罗景阳, 等. 微塑料的环境影响行为及其在我国的分布状况[J]. 环境科学研究, 2019, 32(9): 1437-1447
Zhu Y, Cao M, Luo J Y, et al. Distribution and potential risks of microplastics in China: A review [J]. Research of Environmental Sciences, 2019, 32(9): 1437-1447 (in Chinese)
[4] Barnes D K A, Galgani F, Thompson R C, et al. Accumulation and fragmentation of plastic debris in global environments [J]. Philosophical Transactions of the Royal Society of London Series B, Biological Sciences, 2009, 364(1526): 1985-1998
[5] Barnes D K A, Walters A, Gonçalves L. Macroplastics at sea around Antarctica [J]. Marine Environmental Research, 2010, 70(2): 250-252
[6] Jambeck J R, Geyer R, Wilcox C, et al. Plastic waste inputs from land into the ocean [J]. Science, 2015, 347(6223): 768-771
[7] Chae Y, Kim D, Kim S W, et al. Trophic transfer and individual impact of nano-sized polystyrene in a four-species freshwater food chain [J]. Scientific Reports, 2018, 8: 284
[8] 王超云, 董晓菲, 邵青娜, 等. 纳米塑料的污染行为与毒理效应研究进展[J]. 广东化工, 2019, 46(9): 138-139
Wang C Y, Dong X F, Shao Q N, et al. Research progress on pollution behavior and toxicological effects of nanoplastics [J]. Guangdong Chemical Industry, 2019, 46(9): 138-139 (in Chinese)
[9] Zhang B, Chao J Y, Chen L, et al. Research progress of nanoplastics in freshwater [J]. Science of the Total Environment, 2021, 757: 143791
[10] 王薪杰, 王一宁, 赵俭, 等. 河流水沙运动对微塑料运移过程影响研究进展[J]. 中国环境科学, 2022, 42(2): 863-877
Wang X J, Wang Y N, Zhao J, et al. Recent progress of the effect of suspended sediment movement on the transport of microplastics in rivers [J]. China Environmental Science, 2022, 42(2): 863-877 (in Chinese)
[11] 姚泓钰. 水环境中微塑料的污染特征、迁移转化及应对措施[J]. 农村经济与科技, 2021, 32(10): 15-17
Yao H Y. Pollution characteristics, migration and transformation of microplastics in water and countermeasures [J]. Rural Economy and Science-Technology, 2021, 32(10): 15-17 (in Chinese)
[12] 张秀玲, 鄢紫薇, 王峰, 等. 微塑料添加对橘园土壤有机碳矿化的影响[J]. 环境科学, 2021, 42(9): 4558-4565
Zhang X L, Yan Z W, Wang F, et al. Effects of microplastics addition on soil organic carbon mineralization in citrus orchard [J]. Environmental Science, 2021, 42(9): 4558-4565 (in Chinese)
[13] 杨玲, 张玉兰, 康世昌, 等. 中国土壤微塑料污染[J]. 自然杂志, 2021, 43(4): 267-273
Yang L, Zhang Y L, Kang S C, et al. Microplastic pollution in soil in China [J]. Chinese Journal of Nature, 2021, 43(4): 267-273 (in Chinese)
[14] Vianello A, Jensen R L, Liu L, et al. Simulating human exposure to indoor airborne microplastics using a Breathing Thermal Manikin [J]. Scientific Reports, 2019, 9: 8670
[15] Zhang J J, Wang L, Kannan K. Microplastics in house dust from 12 countries and associated human exposure [J]. Environment International, 2020, 134: 105314
[16] 史文超, 桂梦瑶, 杜俊逸, 等. 典型微塑料对好氧反硝化菌群脱氮特性及反硝化相关基因的影响[J]. 环境工程学报, 2021, 15(4): 1333-1343
Shi W C, Gui M Y, Du J Y, et al. Effects of typical microplastics on the denitrification characteristics and denitrification related genes of aerobic denitrifying bacteria [J]. Chinese Journal of Environmental Engineering, 2021, 15(4): 1333-1343 (in Chinese)
[17] Iqbal S, Xu J C, Allen S D, et al. Unraveling consequences of soil micro- and nano-plastic pollution on soil-plant system: Implications for nitrogen (N) cycling and soil microbial activity [J]. Chemosphere, 2020, 260: 127578
[18] Wu C, Guo W B, Liu Y Y, et al. Perturbation of calcium homeostasis and multixenobiotic resistance by nanoplastics in the ciliate Tetrahymena thermophila [J]. Journal of Hazardous Materials, 2021, 403: 123923
[19] 付茜茜, 李大圳, 章宇晴, 等. 城市红树林系统中微塑料表面细菌群落结构特征分析[J]. 热带作物学报, 2021(12): 3692-3698
Fu Q Q, Li D Z, Zhang Y Q, et al. Microbial colonization and communities on microplastics in urban mangrove system [J]. Chinese Journal of Tropical Crops, 2021(12): 3692-3698 (in Chinese)
[20] 桂嘉烯. 微塑料在农村生活垃圾好氧堆肥中的分布变化及对堆肥效果的影响研究[D]. 杭州: 浙江大学, 2021: 18-20
Du J X. Study on the distribution changes of microplastics in the aerobic composting of rural domestic waste and the influence on the composting effect [D]. Hangzhou: Zhejiang University, 2021: 18-20 (in Chinese)
[21] 刘玮婷, 郭楚玲, 刘沙沙, 等. 微塑料对近岸多环芳烃降解菌群结构及其降解能力的影响[J]. 环境科学学报, 2018, 38(10): 4052-4056
Liu W T, Guo C L, Liu S S, et al. Effect of microplastic on the community structure and biodegradation potential of PAHs-degrading bacterial consortium in coastal environment [J]. Acta Scientiae Circumstantiae, 2018, 38(10): 4052-4056 (in Chinese)
[22] Wang L Y, Luo Z X, Zhen Z, et al. Bacterial community colonization on tire microplastics in typical urban water environments and associated impacting factors [J]. Environmental Pollution, 2020, 265: 114922
[23] Liu X M, Ma J K, Yang C L, et al. The toxicity effects of nano/microplastics on an antibiotic producing strain - Streptomyces coelicolor M145 [J]. Science of the Total Environment, 2021, 764: 142804
[24] Wang Z Q, Gao J F, Dai H H, et al. Microplastics affect the ammonia oxidation performance of aerobic granular sludge and enrich the intracellular and extracellular antibiotic resistance genes [J]. Journal of Hazardous Materials, 2021, 409: 124981
[25] Sun X X, Liang J H, Zhu M L, et al. Microplastics in seawater and zooplankton from the Yellow Sea [J]. Environmental Pollution, 2018, 242: 585-595
[26] Besseling E, Wang B, Lürling M, et al. Nanoplastic affects growth of S. obliquus and reproduction of D. magna [J]. Environmental Science & Technology, 2014, 48(20): 12336-12343
[27] Liu Z Q, Li Y M, Pérez E, et al. Polystyrene nanoplastic induces oxidative stress, immune defense, and glycometabolism change in Daphnia pulex: Application of transcriptome profiling in risk assessment of nanoplastics [J]. Journal of Hazardous Materials, 2021, 402: 123778
[28] Liu Z Q, Li Y M, Sepúlveda M S, et al. Development of an adverse outcome pathway for nanoplastic toxicity in Daphnia pulex using proteomics [J]. Science of the Total Environment, 2021, 766: 144249
[29] 刘全斌. 微塑料在我国渤、黄海浮游动物体内的分布特征及其生物富集和排出过程研究[D]. 大连: 大连海事大学, 2020: 54-58
Liu Q B. Distribution of microplastics and their uptake and elimination in zooplankton in the Bo Sea and the Yellow Sea [D]. Dalian: Dalian Maritime University, 2020: 54-58 (in Chinese)
[30] 卢萍, 闫振华, 陆光华. 微塑料对环境介质中氮循环的影响研究进展[J]. 环境科学研究, 2021, 34(11): 2563-2570
Lu P, Yan Z H, Lu G H. Influence of microplastics on nitrogen cycle in different environments [J]. Research of Environmental Sciences, 2021, 34(11): 2563-2570 (in Chinese)
[31] 张晨. 长期多世代下海洋桡足类日本虎斑猛水蚤对微塑料污染的生理响应及其机理[D]. 厦门: 厦门大学, 2019: 67-75
Zhang C. Physiological and molecular mechanism involved in marine copepod Tigriopus japonicus in response to microplastics multigenerational exposure [D]. Xiamen: Xiamen University, 2019: 67-75 (in Chinese)
[32] 殷岑. 微塑料和有机污染物对水生生物的联合毒性效应研究[D]. 南京: 南京理工大学, 2018: 32-64
Yin C. The combined toxic effect of microplastic and organic contaminants on aquatic organisms [D]. Nanjing: Nanjing University of Science and Technology, 2018: 32-64 (in Chinese)
[33] Sjollema S B, Redondo-Hasselerharm P, Leslie H A, et al. Do plastic particles affect microalgal photosynthesis and growth? [J]. Aquatic Toxicology, 2016, 170: 259-261
[34] Davarpanah E, Guilhermino L. Single and combined effects of microplastics and copper on the population growth of the marine microalgae Tetraselmis chuii [J]. Estuarine, Coastal and Shelf Science, 2015, 167: 269-275
[35] Zhang C, Chen X H, Wang J T, et al. Toxic effects of microplastic on marine microalgae Skeletonema costatum: Interactions between microplastic and algae [J]. Environmental Pollution, 2017, 220: 1282-1288
[36] Schwab F, Bucheli T D, Lukhele L P, et al. Are carbon nanotube effects on green algae caused by shading and agglomeration? [J]. Environmental Science & Technology, 2011, 45(14): 6136-6144
[37] Bhattacharya P, Lin S J, Turner J P, et al. Physical adsorption of charged plastic nanoparticles affects algal photosynthesis [J]. The Journal of Physical Chemistry C, 2010, 114(39): 16556-16561
[38] 李晨曦, 高雨萱, 张佳祺, 等. 附着在不同微塑料表面的藻类结构与群落组成[J]. 中国环境科学, 2020, 40(8): 3360-3366
Li C X, Gao Y X, Zhang J Q, et al. Structure and community composition of algae attached to different microplastic substrates [J]. China Environmental Science, 2020, 40(8): 3360-3366 (in Chinese)
[39] Li F M, Liang Z, Zheng X, et al. Toxicity of nano-TiO2 on algae and the site of reactive oxygen species production [J]. Aquatic Toxicology, 2015, 158: 1-13
[40] Zhang C, Chen X H, Wang J T, et al. Toxicity of zinc oxide nanoparticles on marine microalgae possessing different shapes and surface structures [J]. Environmental Engineering Science, 2018, 35(8): 785-790
[41] Mao Y F, Ai H N, Chen Y, et al. Phytoplankton response to polystyrene microplastics: Perspective from an entire growth period [J]. Chemosphere, 2018, 208: 59-68
[42] Sun X D, Yuan X Z, Jia Y B, et al. Differentially charged nanoplastics demonstrate distinct accumulation in Arabidopsis thaliana [J]. Nature Nanotechnology, 2020, 15(9): 755-760
[43] Canniff P M, Hoang T C. Microplastic ingestion by Daphnia magna and its enhancement on algal growth [J]. Science of the Total Environment, 2018, 633: 500-507
[44] Choi J S, Jung Y J, Hong N H, et al. Toxicological effects of irregularly shaped and spherical microplastics in a marine teleost, the sheepshead minnow (Cyprinodon variegatus) [J]. Marine Pollution Bulletin, 2018, 129(1): 231-240
[45] 张士春, 庞美霞, 赵洪雅, 等. 海产食品微纳塑料污染现状与危害[J]. 食品安全质量检测学报, 2019, 10(9): 2689-2696
Zhang S C, Pang M X, Zhao H Y, et al. Situation and harm of micro-nano plastic pollution in seafood [J]. Journal of Food Safety & Quality, 2019, 10(9): 2689-2696 (in Chinese)
[46] Llorca M, Vega-Herrera A, Schirinzi G, et al. Screening of suspected micro(nano)plastics in the Ebro Delta (Mediterranean Sea) [J]. Journal of Hazardous Materials, 2021, 404: 124022
[47] Ory N C, Gallardo C, Lenz M, et al. Capture, swallowing, and egestion of microplastics by a planktivorous juvenile fish [J]. Environmental Pollution, 2018, 240: 566-573
[48] Barboza L G A, Vieira L R, Branco V, et al. Microplastics cause neurotoxicity, oxidative damage and energy-related changes and interact with the bioaccumulation of mercury in the European seabass, Dicentrarchus labrax (Linnaeus, 1758) [J]. Aquatic Toxicology, 2018, 195: 49-57
[49] Haghi B N, Banaee M. Effects of micro-plastic particles on paraquat toxicity to common carp (Cyprinus carpio): Biochemical changes [J]. International Journal of Environmental Science and Technology, 2017, 14(3): 521-530
[50] Wik A, Nilsson E, Källqvist T, et al. Toxicity assessment of sequential leachates of tire powder using a battery of toxicity tests and toxicity identification evaluations [J]. Chemosphere, 2009, 77(7): 922-927
[51] Cedervall T, Hansson L A, Lard M, et al. Food chain transport of nanoparticles affects behaviour and fat metabolism in fish [J]. PLoS One, 2012, 7(2): e32254
[52] Mattsson K, Ekvall M T, Hansson L A, et al. Altered behavior, physiology, and metabolism in fish exposed to polystyrene nanoparticles [J]. Environmental Science & Technology, 2015, 49(1): 553-561
[53] Brandts I, Barría C, Martins M A, et al. Waterborne exposure of gilthead seabream (Sparus aurata) to polymethylmethacrylate nanoplastics causes effects at cellular and molecular levels [J]. Journal of Hazardous Materials, 2021, 403: 123590
[54] Qiao R X, Lu K, Deng Y F, et al. Combined effects of polystyrene microplastics and natural organic matter on the accumulation and toxicity of copper in zebrafish [J]. Science of the Total Environment, 2019, 682: 128-137
[55] Lei L L, Wu S Y, Lu S B, et al. Microplastic particles cause intestinal damage and other adverse effects in zebrafish Danio rerio and nematode Caenorhabditis elegans [J]. Science of the Total Environment, 2018, 619-620: 1-8
[56] Lu Y F, Zhang Y, Deng Y F, et al. Uptake and accumulation of polystyrene microplastics in zebrafish (Danio rerio) and toxic effects in liver [J]. Environmental Science & Technology, 2016, 50(7): 4054-4060
[57] 蓝益添, 陈星霖, 刘漫琳, 等. 微塑料对淡水鱼生长的影响研究[J]. 生物学通报, 2019, 54(5): 50-52
Lan Y T, Chen X L, Liu M L, et al. Effect of microplastics on the growth of freshwater fish [J]. Bulletin of Biology, 2019, 54(5): 50-52 (in Chinese)
[58] Chen Q Q, Yin D Q, Jia Y L, et al. Enhanced uptake of BPA in the presence of nanoplastics can lead to neurotoxic effects in adult zebrafish [J]. Science of the Total Environment, 2017, 609: 1312-1321
[59] Prata J C, da Costa J P, Lopes I, et al. Environmental exposure to microplastics: An overview on possible human health effects [J]. Science of the Total Environment, 2020, 702: 134455
[60] Smith M, Love D C, Rochman C M, et al. Microplastics in seafood and the implications for human health [J]. Current Environmental Health Reports, 2018, 5(3): 375-386
[61] Zuccarello P, Ferrante M, Cristaldi A, et al. Exposure to microplastics (<10 μm) associated to plastic bottles mineral water consumption: The first quantitative study [J]. Water Research, 2019, 157: 365-371
[62] Karami A, Golieskardi A, Choo C K, et al. The presence of microplastics in commercial salts from different countries [J]. Scientific Reports, 2017, 7: 46173
[63] Carr K E, Smyth S H, McCullough M T, et al. Morphological aspects of interactions between microparticles and mammalian cells: Intestinal uptake and onward movement [J]. Progress in Histochemistry and Cytochemistry, 2012, 46(4): 185-252
[64] Wu B, Wu X M, Liu S, et al. Size-dependent effects of polystyrene microplastics on cytotoxicity and efflux pump inhibition in human Caco-2-cells [J]. Chemosphere, 2019, 221: 333-341
[65] Thubagere A, Reinhard B M. Nanoparticle-induced apoptosis propagates through hydrogen-peroxide-mediated bystander killing: Insights from a human intestinal epithelium in vitro model [J]. ACS Nano, 2010, 4(7): 3611-3622
[66] Revel M, Ch tel A, Mouneyrac C. Micro(nano)plastics: A threat to human health? [J]. Current Opinion in Environmental Science & Health, 2018, 1: 17-23
tel A, Mouneyrac C. Micro(nano)plastics: A threat to human health? [J]. Current Opinion in Environmental Science & Health, 2018, 1: 17-23
[67] Kulkarni S A, Feng S S. Effects of particle size and surface modification on cellular uptake and biodistribution of polymeric nanoparticles for drug delivery [J]. Pharmaceutical Research, 2013, 30(10): 2512-2522
[68] des Rieux A, Fievez V, Théate I, et al. An improved in vitro model of human intestinal follicle-associated epithelium to study nanoparticle transport by M cells [J]. European Journal of Pharmaceutical Sciences, 2007, 30(5): 380-391
[69] Walczak A P, Kramer E, Hendriksen P J M, et al. Translocation of differently sized and charged polystyrene nanoparticles in in vitro intestinal cell models of increasing complexity [J]. Nanotoxicology, 2015, 9(4): 453-461
[70] Prata J C. Airborne microplastics: Consequences to human health? [J]. Environmental Pollution, 2018, 234: 115-126
[71] Zitko V, Hanlon M. Another source of pollution by plastics: Skin cleaners with plastic scrubbers [J]. Marine Pollution Bulletin, 1991, 22(1): 41-42
[72] Hernandez L M, Yousefi N, Tufenkji N. Are there nanoplastics in your personal care products? [J]. Environmental Science & Technology Letters, 2017, 4(7): 280-285
[73] Sykes E A, Dai Q, Tsoi K M, et al. Nanoparticle exposure in animals can be visualized in the skin and analysed via skin biopsy [J]. Nature Communications, 2014, 5: 3796
[74] Schirinzi G F, Pérez-Pomeda I, Sanchís J, et al. Cytotoxic effects of commonly used nanomaterials and microplastics on cerebral and epithelial human cells [J]. Environmental Research, 2017, 159: 579-587
[75] Li B Q, Ding Y F, Cheng X, et al. Polyethylene microplastics affect the distribution of gut microbiota and inflammation development in mice [J]. Chemosphere, 2020, 244: 125492
[76] Lu L, Wan Z Q, Luo T, et al. Polystyrene microplastics induce gut microbiota dysbiosis and hepatic lipid metabolism disorder in mice [J]. Science of the Total Environment, 2018, 631-632: 449-458
[77] Jin Y X, Lu L, Tu W Q, et al. Impacts of polystyrene microplastic on the gut barrier, microbiota and metabolism of mice [J]. Science of the Total Environment, 2019, 649: 308-317
[78] Hans B, Hollman Peter C H, Peters Ruud J B. Potential health impact of environmentally released micro- and nanoplastics in the human food production chain: Experiences from nanotoxicology [J]. Environmental Science & Technology, 2015, 49(15): 8932-8947
[79] Powell J J, Thoree V, Pele L C. Dietary microparticles and their impact on tolerance and immune responsiveness of the gastrointestinal tract [J]. The British Journal of Nutrition, 2007, 98(Suppl.1): S59-S63
[80] Handy R D, Henry T B, Scown T M, et al. Manufactured nanoparticles: Their uptake and effects on fish—A mechanistic analysis [J]. Ecotoxicology, 2008, 17(5): 396-409
[81] Liu S, Wu X M, Gu W Q, et al. Influence of the digestive process on intestinal toxicity of polystyrene microplastics as determined by in vitro Caco-2 models [J]. Chemosphere, 2020, 256: 127204
[82] Luo Z X, Zhou X Y, Su Y, et al. Environmental occurrence, fate, impact, and potential solution of tire microplastics: Similarities and differences with tire wear particles [J]. Science of the Total Environment, 2021, 795: 148902
[83] Forte M, Iachetta G, Tussellino M, et al. Polystyrene nanoparticles internalization in human gastric adenocarcinoma cells [J]. Toxicology in Vitro, 2016, 31: 126-136
[84] Gasperi J, Wright S L, Dris R, et al. Microplastics in air: Are we breathing it in? [J]. Current Opinion in Environmental Science & Health, 2018, 1: 1-5
[85] Dong C D, Chen C W, Chen Y C, et al. Polystyrene microplastic particles: in vitro pulmonary toxicity assessment [J]. Journal of Hazardous Materials, 2020, 385: 121575
[86] Xu M K, Halimu G, Zhang Q R, et al. Internalization and toxicity: A preliminary study of effects of nanoplastic particles on human lung epithelial cell [J]. Science of the Total Environment, 2019, 694: 133794
[87] Lim S L, Ng C T, Zou L, et al. Targeted metabolomics reveals differential biological effects of nanoplastics and nanoZnO in human lung cells [J]. Nanotoxicology, 2019, 13(8): 1117-1132
[88] Park E J, Han J S, Park E J, et al. Repeated-oral dose toxicity of polyethylene microplastics and the possible implications on reproduction and development of the next generation [J]. Toxicology Letters, 2020, 324: 75-85
[89] Yoo J W, Doshi N, Mitragotri S. Adaptive micro and nanoparticles: Temporal control over carrier properties to facilitate drug delivery [J]. Advanced Drug Delivery Reviews, 2011, 63(14-15): 1247-1256
[90] Gratton S E A, Ropp P A, Pohlhaus P D, et al. The effect of particle design on cellular internalization pathways [J]. Proceedings of the National Academy of Sciences of the United States of America, 2008, 105(33): 11613-11618
[91] Muro S, Garnacho C, Champion J A, et al. Control of endothelial targeting and intracellular delivery of therapeutic enzymes by modulating the size and shape of ICAM-1-targeted carriers [J]. Molecular Therapy, 2008, 16(8): 1450-1458
[92] Prietl B, Meindl C, Roblegg E, et al. Nano-sized and micro-sized polystyrene particles affect phagocyte function [J]. Cell Biology and Toxicology, 2014, 30(1): 1-16
[93] Seltenrich N. New link in the food chain? Marine plastic pollution and seafood safety [J]. Environmental Health Perspectives, 2015, 123(2): A34-A41
[94] Schirinzi G F, Pérez-Pomeda I, Sanchís J, et al. Cytotoxic effects of commonly used nanomaterials and microplastics on cerebral and epithelial human cells [J]. Environmental Research, 2017, 159: 579-587
[95] Prata J C, da Costa J P, Lopes I, et al. Environmental exposure to microplastics: An overview on possible human health effects [J]. Science of the Total Environment, 2020, 702: 134455
[96] Rafiee M, Dargahi L, Eslami A, et al. Neurobehavioral assessment of rats exposed to pristine polystyrene nanoplastics upon oral exposure [J]. Chemosphere, 2018, 193: 745-753
[97] Xie X M, Deng T, Duan J F, et al. Exposure to polystyrene microplastics causes reproductive toxicity through oxidative stress and activation of the p38 MAPK signaling pathway [J]. Ecotoxicology and Environmental Safety, 2020, 190: 110133
[98] 田坤明, 陈秋. 不同粒径微塑料颗粒亚急性染毒对雄性小鼠生殖毒性的影响[J]. 毒理学杂志, 2020, 34(6): 492-496
Tian K M, Chen Q. The effect of sub-acute exposure of microplastics on the male mice reproductive function [J]. Journal of Toxicology, 2020, 34(6): 492-496 (in Chinese)
[99] Wick P, Malek A, Manser P, et al. Barrier capacity of human placenta for nanosized materials [J]. Environmental Health Perspectives, 2010, 118(3): 432-436
[100] 曹腾瑞, 屈艾彬, 郭会彩, 等. 微塑料毒性的研究进展[J]. 河北医科大学学报, 2021, 42(1): 107-111
Cao T R, Qu A B, Guo H C, et al. Research progress of toxicity of microplastics [J]. Journal of Hebei Medical University, 2021, 42(1): 107-111 (in Chinese)
[101] Murray F, Cowie P R. Plastic contamination in the decapod crustacean Nephrops norvegicus (Linnaeus, 1758) [J]. Marine Pollution Bulletin, 2011, 62(6): 1207-1217
[102] Farrell P, Nelson K. Trophic level transfer of microplastic: Mytilus edulis (L.) to Carcinus maenas (L.) [J]. Environmental Pollution, 2013, 177: 1-3
[103] Setälä O, Fleming-Lehtinen V, Lehtiniemi M. Ingestion and transfer of microplastics in the planktonic food web [J]. Environmental Pollution, 2014, 185: 77-83
[104] Huerta Lwanga E, Mendoza Vega J, Ku Quej V, et al. Field evidence for transfer of plastic debris along a terrestrial food chain [J]. Scientific Reports, 2017, 7: 14071
[105] Li L Z, Luo Y M, Li R J, et al. Effective uptake of submicrometre plastics by crop plants via a crack-entry mode [J]. Nature Sustainability, 2020, 3(11): 929-937
[106] Zhang J J, Wang L, Kannan K. Polyethylene terephthalate and polycarbonate microplastics in pet food and feces from the United States [J]. Environmental Science & Technology, 2019, 53(20): 12035-12042