随着全球逐步禁止使用溴系阻燃剂,新型有机磷系阻燃剂(organophosphate flame retardants, OPFRs)在国内外得到越来越广泛的应用[1]。由于OPFRs主要以掺杂混合而非化学键合方式加入材料,且部分OPFRs具有半挥发性,较容易进入土壤、水和大气环境中[2]。磷酸三(2-丁氧基乙基)酯(tris(2-butoxyethyl) phosphate, TBOEP)是目前环境暴露的主要的OPFRs之一,在环境介质和生物体内广泛检出,含量最高可达mg·kg-1级别。如欧洲国家、新西兰、科威特和中国北京的粉尘样品TBOEP含量范围为0.36~6 836 ng·g-1[3-7],珠江淡水鱼样本中检测到的TBOEP浓度范围则达1 647~8 840 ng·g-1[8]。
目前TBOEP对生物的内分泌系统、神经系统等以及遗传和基因表达的影响逐渐成为当前TBOEP生物毒性研究的主要内容,其潜在毒性是目前的研究热点。当前关于TBOEP的毒代实验主要分为体内代谢和体外代谢实验。体内实验方面,Völkel等[9]探究了人体单次口服给药TBOEP后的毒代动力学。体外代谢的研究主要集中在细胞清除率、代谢物及其影响等方面,如经试验观察,TBOEP在干细胞的光滑线粒体的体外清除率存在物种差异,人类的体外代谢速率最快,鱼类次之,最后是鸟类。当前有关于TBOEP的毒代动力学数据研究还比较缺乏,其研究对象样本单一、暴露时间短,数据不足以探究其毒代动力学规律[10]。毒物排泄研究是构成毒代动力学的关键。为此,本研究以雄性SD大鼠为观察对象,建立液相色谱-三重四极杆串联质谱仪测定尿液和粪便中TBOEP及其代谢物含量的方法,探究TBOEP及其代谢物在尿液、粪便中的排泄规律,为其毒代动力学研究提供参考。
1 材料与方法(Materials and methods)
1.1 试剂与仪器
磷酸三(2-丁氧基乙基)酯(tris(2-butoxyethyl) phosphate, TBOEP)和双(2-丁氧基乙基)-2-(3-羟丁氧基)乙基磷酸三酯(tris(2-(3-hydroxy)butoxyethyl) phosphate, 3-OH-TBOEP)标准品购于德国Dr. Ehrenstorfer公司。双(2-丁氧基乙基)-2-羟基乙基磷酸三酯(bis(2-butoxyethyl)-(2-hydroxyethyl) phosphate, BBOEHEP)、双(丁氧基乙基)磷酸酯(bis(2-butoxyethyl) phosphate, BBOEP)标准品和回收率指示物磷酸三正丁酯-d27(tri-n-butyl phophate-d27, TBP-d27)购于加拿大Toronto Research Chemicals Inc.公司。
1260-6460液相色谱仪-三重四极杆串联质谱仪(美国Agilent公司);固相萃取装置(24位,CNW,中国);Milli-Q Direct8超纯水仪(美国Millipore公司);微量注射器(1 000 μL、100 μL、10 mL,CNW);WAX Plus固相萃取柱(3 mg, OASIS,美国)。标准品、甲醇和乙腈(色谱纯,默克,德国),甲酸、亲水PTFE针式滤器(双层膜)0.22 μm和1 mL无菌连针注射器均购于上海安谱实验科技股份公司(中国)。
1.2 实验动物
健康雄性SD大鼠42只,SPF级;体质量范围为(100±25) g;动物来源于北京维通利华实验动物技术有限公司,生产许可证及动物质量合格证号为11400700270978。实验动物喂养环境:温度22~24 ℃,相对湿度60%~65%。
1.3 实验动物暴露剂量与染毒
SD大鼠21只,雄性,分别置于21只代谢笼中,给药前12 h禁食,不禁水,收集空白尿液、粪便。而后灌胃染毒,剂量为750 mg·kg-1 TBOEP。
1.4 取材
染毒后,分别收集0~24 h、24~48 h、48~72 h、72~96 h、96~120 h、120~144 h和144~168 h的尿液和粪便,共设7个采样时间段。
1.5 样品前处理
1.5.1 样品预处理
新鲜尿液经采集后冰上运输,送回实验室-80 ℃冰箱保存。将尿液完全解冻后,取1 mL于特氟龙管中,加入标准替代物,使其浓度为50 ng·mL-1。
新鲜粪便经采集后冰上运输,送回实验室-80 ℃冰箱保存。而后经冷冻干燥、研磨后,取0.5 g粪便于离心管中,加入标准替代物,使其浓度为150 ng·g-1,将加标后的粪便放置在-20 ℃冰箱冷冻过夜,次日对粪便样品进行前处理;在样品中加入0.5 mL甲醇,1粒陶瓷均质子,涡旋振荡5 min后,离心分离取上清液,将上清液转移至干净试管中,再重复上述步骤2次,将3次的上清液合并,并用纯水稀释至3 mL。
1.5.2 固相萃取
对经过前处理的样品尿液/粪便提取液进行固相萃取,步骤如下。在固相萃取装置上将WAX Plus萃取小柱安装好后,将2 mL含5%的氨水甲醇溶液加入小柱,让溶液自然滴落,待溶液与小柱内物质持平,再加入2 mL含8‰的甲酸的超纯水进行同样的操作。而后将已经过前处理的样品过已活化好的小柱,流出液弃去。用2 mL含有8‰甲酸的超纯水淋洗小柱。淋洗后,用真空泵抽吸约15 min左右,保证固相萃取小柱干燥。对干燥后的小柱,依次用300 μL(粪便0.75 mL)含5%氨水的甲醇溶液,700 μL(粪便0.75 mL)乙腈洗脱,洗脱液先浸泡柱子2 min,再使洗脱液自然滴落,收集洗脱液。用超纯水定容至1 mL(粪便1.5 mL),冷冻后过0.22 μm滤膜,上机检测。
1.6 标准溶液配制
1.6.1 给药TBOEP溶液的配制
量取适量TBOEP液体,溶于食用油,配制浓度为750 mg·mL-1的溶液,临用前配制。
1.6.2 标准溶液的配制
准确称量各目标化合物、回收率指示物,分别溶解于甲醇中,各配制成浓度为10 mg·L-1的标准使用溶液。
1.7 色谱质谱条件
使用Agilent 1260系列液相色谱用于目标化合物的分离,色谱柱为Agilent ZORABX SB-C18,柱温35 ℃,进样量10 μL,流动相为甲醇(A)和0.002 mol·L-1的乙酸铵溶液(B),流动相流量250 μL·min-1。流动相梯度洗脱如表1所示。
质谱条件:电喷雾电离源(ESI);多反应监测模式(MRM);离子源电离模式Positive。毛细管电压为3 500 V,雾化器压力为310.2 kPa,载气为高纯氮气,载气温度为330 ℃,流量9.5 L·min-1,用MRM检测,分析物的浓度均配制为50 μg·L-1。通过连接注射针泵注入离子源(注射流量为10 μL·min-1,色谱泵流量200 μL·min-1),样品带电后进入质量分析器,通过总离子流图和相应的质谱图结果确定每种化合物的母离子和子离子,并根据响应情况优化碰撞能和碎裂电压,每种分析物的保留时间、监测离子、输入电压和碰撞能如表2所示。
1.8 数据处理
按如下公式计算结果:每24 h尿液(粪便)排泄量=每24 h尿液(粪便)总量×尿液(粪便)中浓度;累积排泄量=0~24 h、24~48 h、48~72 h、72~96 h、96~120 h、120~144 h、144~168 h共7个采样时间段的排泄量之和;排泄速率=每个采样时间段排泄量/进入体内化学品总量×100%;累积排泄率=累积采样时间段排泄量/进入体内化学品总量×100%。
表1 流动相梯度洗脱
Table 1 Gradient elution of mobile phase
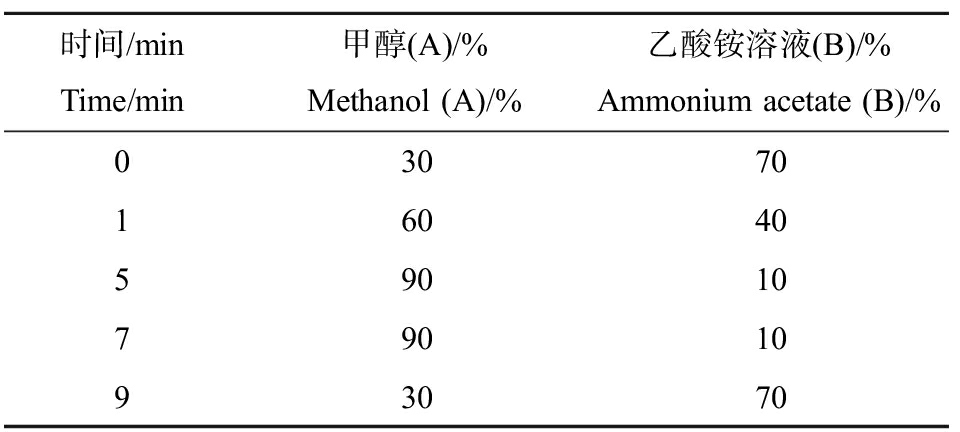
时间/minTime/min甲醇(A)/%Methanol (A)/%乙酸铵溶液(B)/%Ammonium acetate (B)/%0307016040590107901093070
2 结果(Results)
2.1 标准曲线与检出限
利用TBP-d27作为标准替代物,配制2、5、10、50、100和500 μg·L-1曲线点,绘制配制浓度的目标物标准曲线。目标化合物的线性回归方程、相关系数和检出限如表3所示。
2.2 加标回收率与基质效应
制备样品基质加标样(混标浓度10 μg·L-1(样品基质))各6个,不加标基质样品3个,超纯水不加标空白对照样品3个,按照1.5节方法进行前处理,计算加标回收率。各目标物回收率范围在65%~126%之间,平行样的相对标准偏差<15%。
2.3 尿液样品的排泄情况
大鼠经口灌胃750 mg·kg-1 TBOEP后,尿液中TBOEP及其代谢物不同时间段排泄量测定数据如图1所示,累积排泄速率数据如图2所示。由图1可知,0~168 h,母体化合物尿液排泄量为(3.61±0.92) μg,代谢物BBOEP为(5.88±1.41) μg,BBOEHEP为(9.86±1.53) μg,代谢物BBOEHEP主要经过尿液排泄。大鼠经口染毒后,随着时间的增加而排泄量增加,母体化合物TBOEP暴露后24 h在尿液中排泄量最大,168 h后依然可以检出。可知,母体化合物TBOEP在第1天排泄量较高,证明通过饮食途径摄入的TBOEP可以被大鼠通过循环系统和泌尿系统快速排出体外,而后续的波动可能说明了大鼠排除体内TBOEP的速度受到多重因素的影响,具体的影响则需要结合器官中的毒物残留数据来进行分析。代谢物方面,除3-HO-TBOEP在尿液中未检出外,BBOEP和BBOEHEP在尿液中均能检测到。由图1可知,代谢物BBOEP在0~24 h的排泄量为(1.01±0.21) μg,第2天(24~48 h)的排泄量升至(2.74±0.52) μg,之后的数据呈下降趋势。代谢物BBOEHEP在0~24 h的排泄量最大,达到了(8.67±1.22) μg,第2天(24~48 h)的排泄量出现了大幅度下降,仅为(0.039±0.013) μg,呈现了较大的波动,在第3天(48~72 h)和第5天(96~120 h)出现比前日样本读数高的情况,分别为(0.88±0.23) μg和(0.23±0.05) μg,可以看出BBOEHEP在大鼠体内生成的速率较快,因此第1天的尿液中检出量远高于后续检出量。
表2 ESI-MS/MS保留时间、监测离子、碎裂电压和碰撞能
Table 2 ESI-MS/MS retention time, monitoring ion, fragment and collision energy
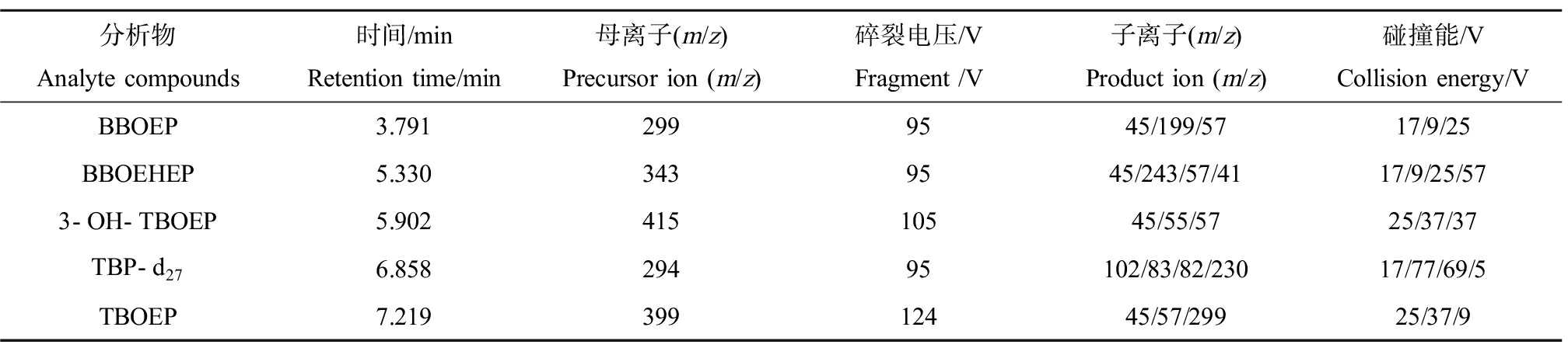
分析物Analyte compounds时间/minRetention time/min母离子(m/z)Precursor ion (m/z)碎裂电压/VFragment /V子离子(m/z)Product ion (m/z)碰撞能/VCollision energy/VBBOEP3.7912999545/199/5717/9/25BBOEHEP5.3303439545/243/57/4117/9/25/573-OH-TBOEP5.90241510545/55/5725/37/37TBP-d276.85829495102/83/82/23017/77/69/5TBOEP7.21939912445/57/29925/37/9
注:BBOEP、BBOEHEP、3-OH-TBOEP、TBP-d27和TBOEP分别指双(丁氧基乙基)磷酸酯、双(2-丁氧基乙基)-2-羟基乙基磷酸三酯、双(2-丁氧基乙基)-2-(3-羟丁氧基)乙基磷酸三酯、磷酸三正丁酯-d27和磷酸三(2-丁氧基乙基)酯。
Note: BBOEP, BBOEHEP, 3-OH-TBOEP, TBP-d27 and TBOEP stand for bis(2-butoxyethyl) phosphate, bis(2-butoxyethyl)-(2-hydroxyethyl) phosphate, tris(2-(3-hydroxy)butoxyethyl) phosphate, tri-n-butyl phophate-d27 and tris(2-butoxyethyl) phosphate.
表3 目标化合物的线性回归方程、相关系数和检出限
Table 3 Linear regression equations, correlation coefficients and limit of detection for analyte compounds
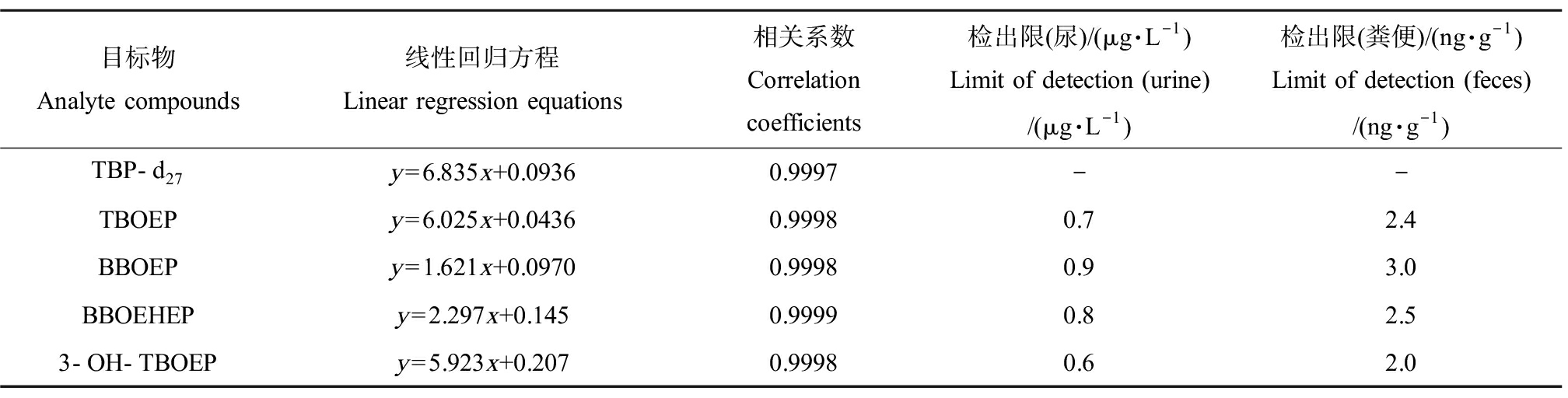
目标物Analyte compounds线性回归方程Linear regression equations相关系数Correlation coefficients检出限(尿)/(μg·L-1)Limit of detection (urine)/(μg·L-1)检出限(粪便)/(ng·g-1)Limit of detection (feces)/(ng·g-1)TBP-d27y=6.835x+0.09360.9997--TBOEPy=6.025x+0.04360.99980.72.4BBOEPy=1.621x+0.09700.99980.93.0BBOEHEPy=2.297x+0.1450.99990.82.53-OH-TBOEPy=5.923x+0.2070.99980.62.0
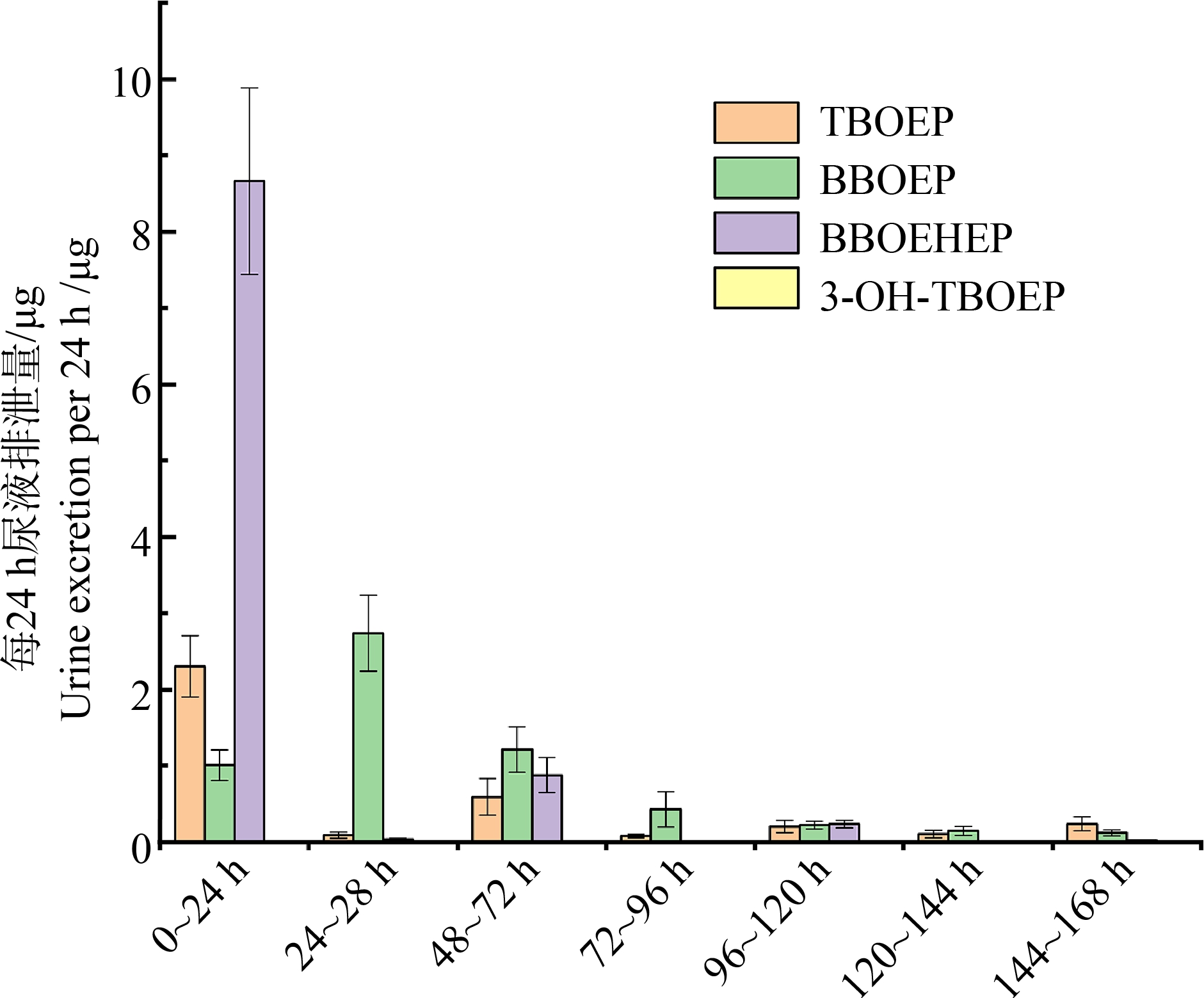
图1 不同时间段TBOEP及其代谢物尿液排泄量
Fig. 1 Urine excretion of TBOEP and its metabolites at different time periods

图2 大鼠灌胃750 mg·kg-1 TBOEP后尿液中TBOEP及其代谢物排泄率
Fig. 2 The excretion rate of TBOEP and its metabolites in the urine of rats after intragastric administration of 750 mg·kg-1 TBOEP
168 h内TBOEP及其代谢物BBOEP、BBOEHEP的尿液累积排泄率分别为0.0043%、0.0069%和0.0114%。根据图2尿液中TBOEP及其代谢物不同时间段的排泄率可知,在TBOEP的代谢物中BBOEP和BBOEHEP的生成量明显多于3-HO-TBOEP。根据van den Eede等[11]的研究,人类肝细胞在体外实验的情况下,将TBOEP转化为BBOEHEP的速率约为2 560 pmol·min-1·mg-1(蛋白质),而BBOEP的转化速率则会根据TBOEP的浓度发生改变[12]。本研究发现染毒初期大鼠体内BBOEHEP的生成速率非常快,但是相应的代谢速度也较快,第2天的大鼠尿样相比第1天的尿样的BBOEHEP的排泄率降低了90%以上。这与Völkel等[9]探究了人体单次口服给药TBOEP后的毒代动力学(选取3名男性和女性志愿者单次口服TBOEP),发现尿液样品中7 h尿液中BBOEHEP的含量最高,本文与其结论一致。而BBOEP的浓度在前3 d的大鼠尿样中都未呈现出明显的下降趋势,直到暴露第5天才出现降低。由此来看,BBOEP在大鼠体内不仅生成速率较慢,还会受到TBOEP浓度的影响,但是排出体外的速度也相对较慢。由图2可知。尿液内母体物质TBOEP和代谢产物BBOEHEP呈现了一定程度同步的峰谷趋势,出现了较为统一的变化趋势。可能是由于BBOEHEP作为TBOEP较为主要的代谢产物和TBOEP存在着最高的相关性,当某一组织内TBOEP浓度高时,产生的BBOEHEP也较多,而这些母体化合物和代谢产物被同时排出,因此出现这种情况。
2.4 粪便样品中的排泄情况
大鼠经口灌胃750 mg·kg-1 TBOEP后,粪便中TBOEP及其代谢物粪便排泄量如图3所示,粪便排泄率数据如图4所示。由图3可知,0~168 h,母体化合物粪便排泄量为(65.71±6.5) μg,代谢物BBEOP为(89.13±25.58) μg,BBOEHEP为(5.87±2.25) μg,母体化合物TBOEP主要通过老鼠粪便排泄。大鼠经口染毒168 h后,在粪便中均能检测到母体化合物TBOEP的存在,且在0~24 h内排泄量最大,在第3天呈现快速下降,说明母体化合物TBOEP在体内排泄快。代谢物方面,3-HO-TBOEP在0~24 h的粪便有所检出之外,其余均未检出,虽然并不是最主要的代谢产物,却是重要的代谢路径。由图3可知,代谢物BBOEP排泄量的峰值在第2天(24~48 h),达到(50.98±11.38) μg,代谢物BBOEHEP的排泄量峰值在0~24 h,之后呈下降趋势,可以看出BBOEP和BBOEHEP在大鼠体内生成的速率较快。
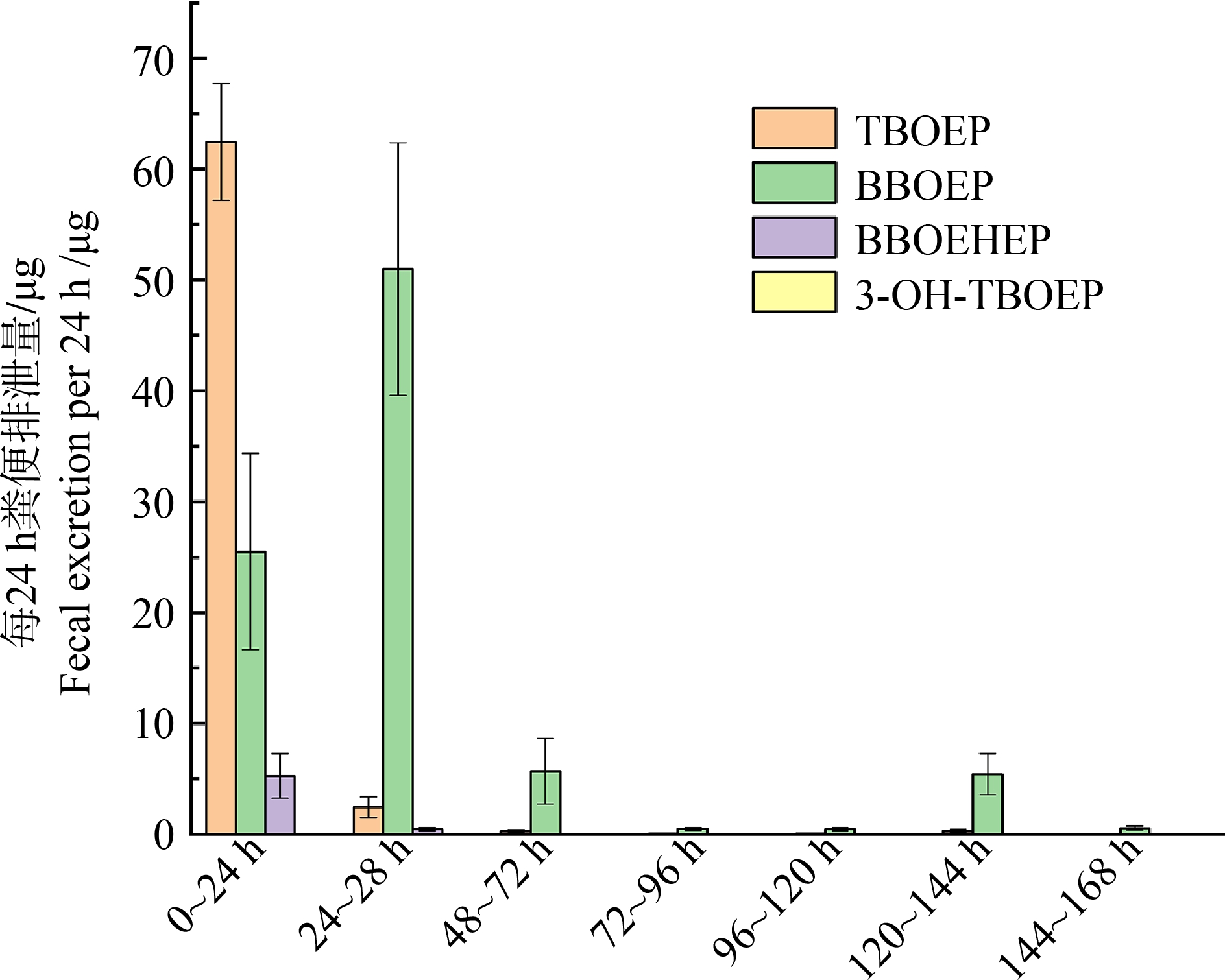
图3 不同时间段TBOEP及其代谢物粪便排泄量
Fig. 3 Fecal excretion of TBOEP and its metabolites at different time periods
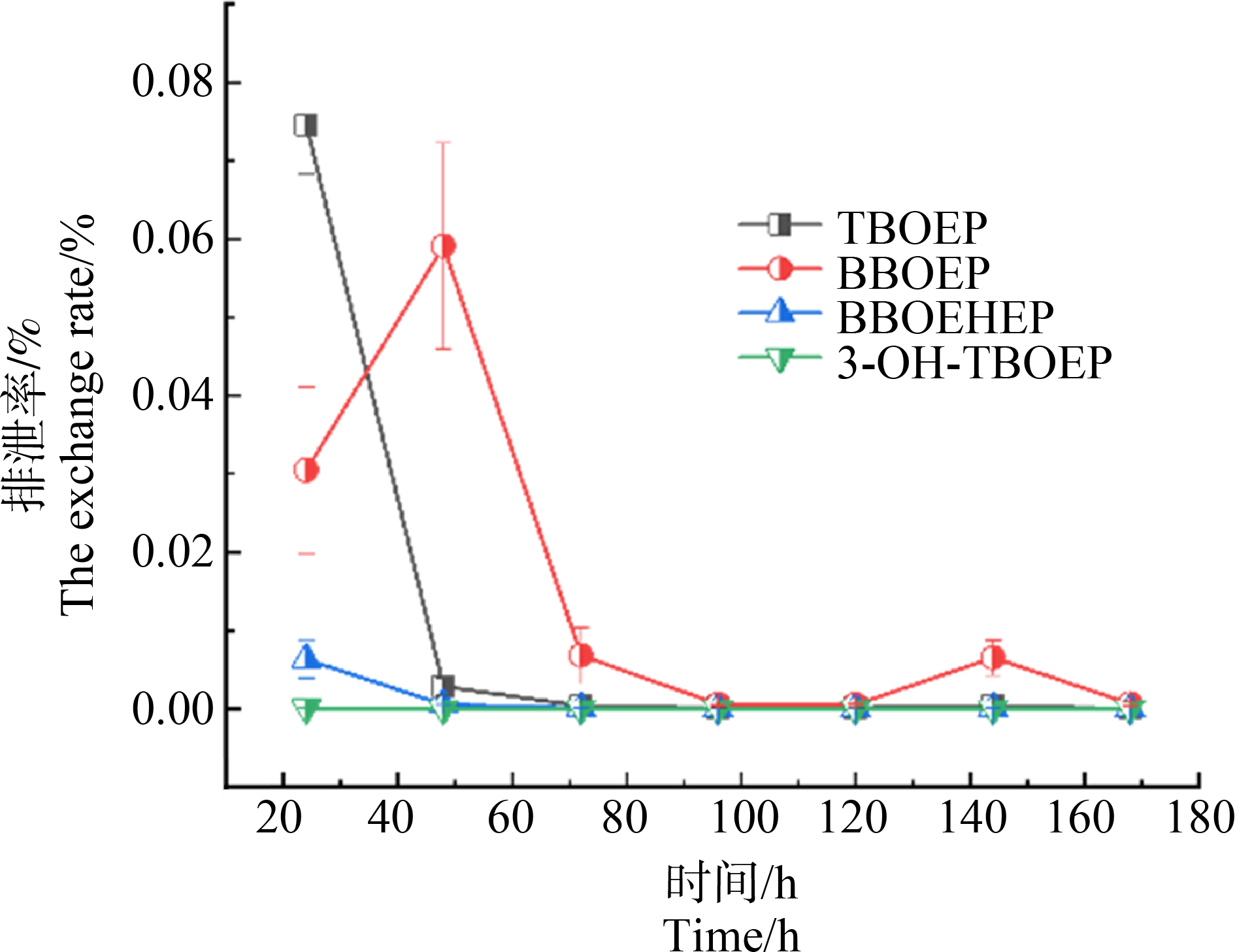
图4 大鼠灌胃750 mg·kg-1 TBOEP后粪便中TBOEP及其代谢物排泄率
Fig. 4 The excretion rate of TBOEP and its metabolites in the feces of rats after intragastric administration of 750 mg·kg-1 TBOEP
通过实验发现,168 h内TBOEP及其代谢物BBOEP、BBOEHEP的粪便累积排泄率分别为0.4221%、0.3931%和0.0434%。与尿液排泄不同的是,染毒初期粪便中BBOEP的生成速率较快,0~24 h的排泄率远高于BBOEHP。由图4可知,与尿液一样,粪便中BBOEP排泄率的峰谷与母体化合物TBOEP相比,有一定的滞后性,可能是由于TBOEP在大鼠体内转换为BBOEP需要一定的转化时间,导致排出体外的时间较慢。此外,与尿液一致,尿液内母体物质TBOEP和代谢产物BBOEHEP出现了较为统一的变化趋势。
3 讨论(Discussion)
本试验建立了大鼠粪便、尿液中TBOEP及其代谢物BBOEP、BBOEHEP、3-OH-TBOEP的LC-MS/MS测定方法。TBOEP及其代谢物BBOEP、BBOEHEP、3-OH-TBOEP在2~500 μg·L-1浓度范围内呈良好的线性关系(r>0.99),回收率范围在65%~126%之间。方法的选择性、残留、精密度、准确度、基质效应和样品稳定性等均符合生物样品分析要求,表明本方法适合于粪便、尿液中TBOEP及其代谢物BBOEP、BBOEHEP、3-OH-TBOEP的分析。
本研究表明,除代谢物3-OH-TBOEP仅在粪便样品中0~24 h时间段检出外,TBOEP及其代谢物BBOEP、BBOEHEP均在尿液和粪便样品中有较高检出。大鼠经口灌胃单次染毒750 mg·kg-1 TBOEP后,0~168 h,母体化合物尿液排泄量为(3.61±0.92) μg,代谢物BBOEP为(5.88±1.41) μg,BBOEHEP为(9.86±1.53) μg,而母体化合物粪便排泄量为(65.71±6.5) μg,代谢物BBOEP为(89.13±25.58) μg,BBOEHEP为(5.87±2.25) μg,代谢物BBOEHEP主要经过尿液排泄。染毒后168 h内,TBOEP尿液和粪便累积排泄率为0.004%、0.422%。BBOEP尿液和粪便累积排泄率为0.007%、0.3931%。BBOEHEP尿液和粪便累积排泄率为0.011%、0.0434%。在0~168 h内,TBOEP和代谢物BBOEP主要通过粪便排泄,BBOEHEP通过尿液和粪便排泄。根据尿液和粪便中TBOEP及其代谢物的不同时间点的排泄量分布,BBOEP和BBOEHEP在TBOEP的代谢物中生成量明显多于3-HO-TBOEP。由此推测,BBOEP和BBOEHEP是TBOEP在大鼠体内主要的代谢产物。TBOEP在大鼠体内仅有极少部分转化成了3-HO-TBOEP,除了尿液和粪便排泄外可能存在其他的生物转化途径。该结果对TBOEP尿液和粪便的排泄规律研究有一定意义,可为阐明TBOEP体内的代谢过程提供一定依据。
[1] van der Veen I, de Boer J. Phosphorus flame retardants: Properties, production, environmental occurrence, toxicity and analysis [J]. Chemosphere, 2012, 88(10): 1119-1153
[2] 汪国威. 有机磷酸酯阻燃剂在鱼体内的富集、分布和代谢及其机制[D]. 南京: 南京大学, 2017: 5
Wang G W. Accumulation, distribution and transformation of organophosphate flame retardants in fish and their underlying mechanism [D]. Nanjing: Nanjing University, 2017: 5 (in Chinese)
[3] Ali N, Dirtu A C, Eede N V D, et al. Occurrence of alternative flame retardants in indoor dust from New Zealand: Indoor sources and human exposure assessment [J]. Chemosphere, 2012, 88(11): 1276-1282
[4] Ali N, Ali L, Mehdi T, et al. Levels and profiles of organochlorines and flame retardants in car and house dust from Kuwait and Pakistan: Implication for human exposure via dust ingestion [J]. Environment International, 2013, 55: 62-70
[5] Wu M, Yu G, Cao Z G, et al. Characterization and human exposure assessment of organophosphate flame retardants in indoor dust from several microenvironments of Beijing, China [J]. Chemosphere, 2016, 150: 465-471
[6] van den Eede N, Dirtu A C, Neels H, et al. Analytical developments and preliminary assessment of human exposure to organophosphate flame retardants from indoor dust [J]. Environment International, 2011, 37(2): 454-461
[7] García M, Rodríguez I, Cela R. Optimisation of a matrix solid-phase dispersion method for the determination of organophosphate compounds in dust samples [J]. Analytica Chimica Acta, 2007, 590(1): 17-25
[8] Ma Y Q, Cui K Y, Zeng F, et al. Microwave-assisted extraction combined with gel permeation chromatography and silica gel cleanup followed by gas chromatography-mass spectrometry for the determination of organophosphorus flame retardants and plasticizers in biological samples [J]. Analytica Chimica Acta, 2013, 786: 47-53
[9] Völkel W, Fuchs V, Wöckner M, et al. Toxicokinetic of tris(2-butoxyethyl) phosphate (TBOEP) in humans following single oral administration [J]. Archives of Toxicology, 2018, 92(2): 651-660
[10] Hou R, Xu Y P, Wang Z J. Review of OPFRs in animals and humans: Absorption, bioaccumulation, metabolism, and internal exposure research [J]. Chemosphere, 2016, 153: 78-90
[11] van den Eede N, Erratico C, Exarchou V, et al. In vitro biotransformation of tris(2-butoxyethyl) phosphate (TBOEP) in human liver and serum [J]. Toxicology and Applied Pharmacology, 2015, 284(2): 246-253
[12] 徐怀洲, 王智志, 张圣虎, 等. 有机磷酸酯类阻燃剂毒性效应研究进展[J]. 生态毒理学报, 2018, 13(3): 19-30
Xu H Z, Wang Z Z, Zhang S H, et al. Research progress on toxicity effects of organophosphate flame retardants [J]. Asian Journal of Ecotoxicology, 2018, 13(3): 19-30 (in Chinese)