一直以来,学术界均认为富营养化通常是由于河塘湖泊等水体接纳了过多氮(N)、磷(P)等营养物质,使初级生产力水平大幅增加,导致藻类等浮游植物大量繁殖,叶绿素a含量增加,水体透明度和溶解氧降低[1]从而导致的水质及水生态恶化。但在日益加剧的人类活动影响下,工业、农业生产活动以及生活污水的大量排放,除了使N、P等营养元素进入水体,也使大量重金属在水体中不断积累,从而加快了河湖塘库水体的富营养化演变速度。尤其是工矿行业排放的废水中往往富含有各类重金属(如Cu、Zn、Cd和Pb等)[2],经在多介质多界面环境中进行传输后进入自然水体。而作为水体重要污染内源的富含N、P和重金属的沉积物,在一定的条件下也会向水体持续释放N、P等营养元素以及重金属等污染物[3-5],由此形成外源和内源的复合污染,导致水环境及水生态的日益恶化[6-7]。因此,水体富营养化以及重金属污染已成为当前全球水生态系统的2个主要问题[8]。但在受重金属及较高浓度N、P复合污染的水体中,重金属对水体富营养化进程中不同关键食物链环节的影响至今未明。
在富营养化水体的治理和修复中,生态修复可通过恢复和重建水生生态系统来调整河塘湖泊水体的稳定性[9]。正常的水生态系统需要完整的生物链,作为联系初级生产者(藻类)和次级消费者(鱼类)的关键性环节的初级消费者(浮游动物),浮游动物对毒害物质(如重金属)极其敏感且易中毒死亡,由此导致水生食物链中断。铜作为环境中使用较为广泛的重金属之一,是生物机体细胞代谢的重要元素,但过量的铜会对生物体产生不同程度的毒性[10-12],且易积累在水生生物体内,通过水生食物链进入人体[13],最终危害人体健康[14],所以铜成为潜在风险最大的重金属元素之一[15-17]。为了探究在受重金属及高浓度N、P复合污染的水体中,重金属在富营养化进程中对水体关键食物链环节的变化中所起的作用,本研究选取Cu2+为重金属的代表,通过构建受重金属及高浓度N、P复合污染的水体中生产者(斜生栅藻Scenedesmus obliquus)-初级消费者(隆线溞Daphnia carinata)-次级消费者(斑马鱼Danio rerio)的微宇宙实验体系进行单向多级围隔试验,记录和分析试验开始第1、3、5、7、9和11天时不同试验阶段体系内不同围隔区域中斜生栅藻藻密度与叶绿素a含量、水体CODCr值与浊度、隆线溞与斑马鱼的存活、摄食活动及死亡率等的变化规律,研究了不同浓度Cu2+在高浓度N、P条件下对水体富营养化进程中系统内“斜生栅藻—隆线溞—斑马鱼”3个不同等级食物链环节生物效应的影响,相关研究结果可为水生生态系统的重金属污染和水体富营养化的科学治理及环境生态风险评价提供理论参考依据。
1 材料与方法(Materials and methods)
1.1 试验材料
1.1.1 试验药品及试剂
CuSO4·5H2O、HgSO4、K2Cr2O7、Ag2SO4、H2SO4(ρ=1.84 g·mL-1)、H6N2O4S、C6H12N4和95%乙醇,均分析纯。
H2SO4-Ag2SO4试剂:取10 g Ag2SO4,加入到1 000 mL H2SO4(ρ=1.84 g·mL-1)中,静置1~2 d,搅拌,使其溶解。0.1225 g·mL-1 K2Cr2O7标准溶液:将6.1250 g在105 ℃干燥120 min的K2Cr2O7溶解于去离子水中,定容至500 mL。H6N2O4S溶液:称取1.000 g H6N2O4S溶于水中,定容至100 mL。C6H12N4溶液:称取10.000 g C6H12N4溶于水中,定容至100 mL。浊度标准溶液:吸取5.00 mL H6N2O4S溶液与5.00 mL C6H12N4溶液于100 mL容量瓶中;置于(25±3) ℃静置反应24 h,冷却后稀释至标线,混匀,此溶液浊度为400 NTU。
1.1.2 生物培养用水
斜生栅藻培养用水采用水生4号培养基[18]。隆线溞培养用水为用气泵充分曝气48 h以上的脱氯自来水,DO≥8 mg·L-1,氯化物30~32 mg·L-1,以CaCO3计的总硬度和总碱度分别为328.1~339.6 mg·L-1和83.28~85.19 mg·L-1,主要水质参数为:水温23~25 ℃,电导率716~721 μS·cm-1,pH 7.62~7.87。斑马鱼的培养用水同隆线溞培养用水。
1.1.3 试验用水
试验用水采用改进的水生4号培养基。在斜生栅藻生长过程中,培养体系pH随着时间的延长,呈现跳跃式升高而偏碱性,并与培养基中![]() 发生反应,产生具有较强生物毒性的非离子氨-氮。非离子氨-氮(NH3-Nm)是由总氨-氮(NH3-Nt)通过下列公式计算:
发生反应,产生具有较强生物毒性的非离子氨-氮。非离子氨-氮(NH3-Nm)是由总氨-氮(NH3-Nt)通过下列公式计算:
CNH3-Nm=CNH3-Nt×fNH3-Nm
(1)
fNH3-Nm=100/[1+antilog(pKa-pH)]
(2)
式中:fNH3-Nm为NH3-Nm在NH3-Nt中所占百分比,Ka为NH4+的电离常数,pKa=-logKa。
基于水生4号培养基中NH4+对隆线溞及斑马鱼的生物毒性[19],将(NH4)2SO4替换为相同氮浓度的NaNO3。在以改进的水生4号培养基为试验用水的体系中,TP含量为1.04 mg·L-1,TN含量为42.38 mg·L-1,按照目前的富营养化分类标准为重度富营养化条件。改进的水生4号培养基成分(1 000 mL)如表1所示。
1.1.4 试验生物及其培养
斜生栅藻的培养:斜生栅藻购自中国科学院水生生物研究所,培养条件及培养方法参见国标(GB/T 13266—1991)附录B[18]。斜生栅藻的培养条件为(21±0.5) ℃,光照周期14 h·d-1,光照强度为4 000 lx。
表1 改进的水生4号培养基成分
Table 1 Composition of improved aquatic No.4 medium
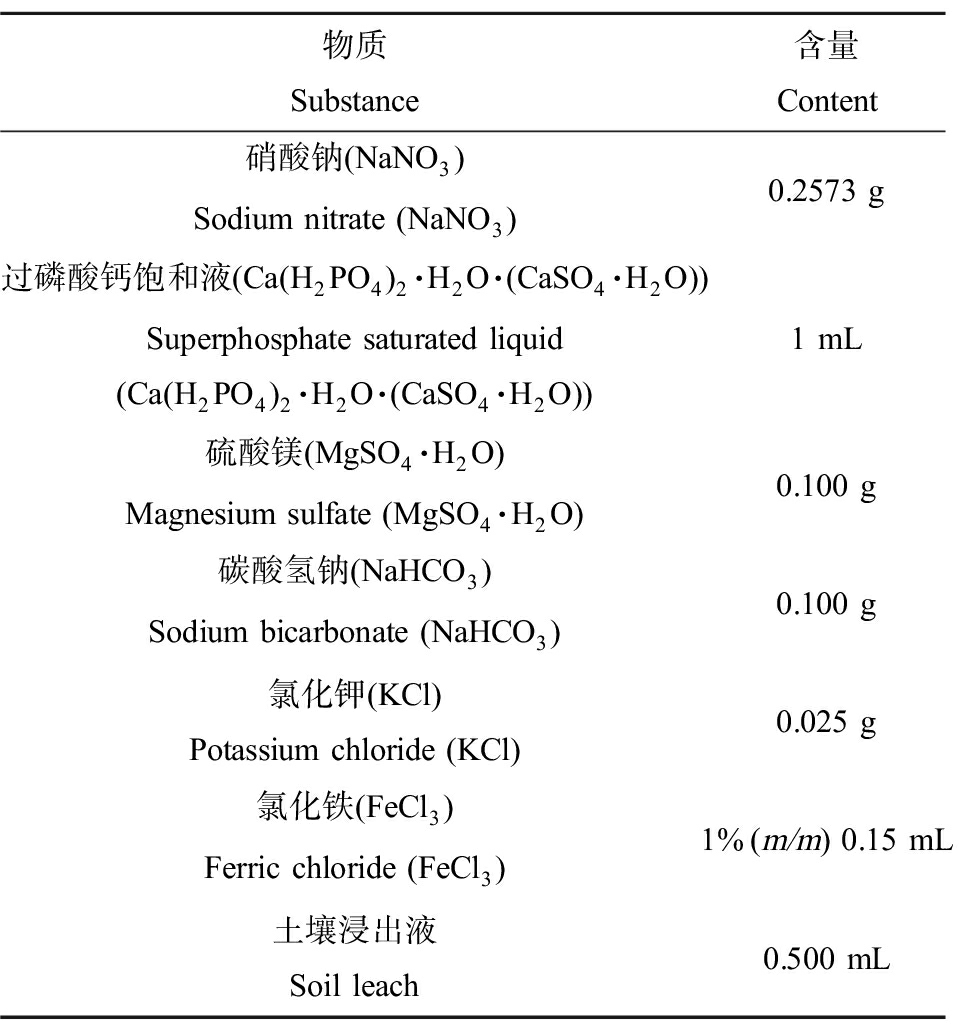
物质Substance含量Content硝酸钠(NaNO3)Sodium nitrate (NaNO3)0.2573 g过磷酸钙饱和液(Ca(H2PO4)2·H2O·(CaSO4·H2O))Superphosphate saturated liquid (Ca(H2PO4)2·H2O·(CaSO4·H2O))1 mL硫酸镁(MgSO4·H2O)Magnesium sulfate (MgSO4·H2O)0.100 g碳酸氢钠(NaHCO3)Sodium bicarbonate (NaHCO3)0.100 g氯化钾(KCl)Potassium chloride (KCl)0.025 g氯化铁(FeCl3)Ferric chloride (FeCl3)1%(m/m) 0.15 mL土壤浸出液Soil leach0.500 mL
隆线溞的培养:隆线溞经多代孤雌生殖,分离、纯化和筛选的单克隆纯生物株Dc42在试验室经多代培养后,在试验前20~25 d用橡胶头玻璃吸管吸取龄期一致的幼溞在温度(21±0.5) ℃、光照周期14 h·d-1、光强1 800 lx的环境下纯培养。在培养期间,每周用强制曝气48 h以上的自来水换水2次,每次换掉培养容器中水量的1/3,每日需定时投喂新鲜斜生栅藻浓缩液,浓度为1.5×105~2.0×105 个·mL-1[20]。
斑马鱼的培养:斑马鱼体质量(0.28±0.10) g,平均体质量0.22 g。试验前在室内驯养14 d以上,饲养期间自然死亡率<0.5%,试验前1 d停止喂食,试验期间不喂食。
1.1.5 单向多级围隔构建的微宇宙实验体系试验装置
单向多级围隔构建的微宇宙实验体系试验装置如图1所示[21]。该实验装置由3部分构成:最内层围隔是由孔径为30目的工业滤布缝制的圆柱形围隔装置,直径为10 cm;中间层围隔是由孔径为200目的工业滤布制作,直径为14 cm;最外层是直径为18 cm的圆柱形玻璃缸。由工业滤布缝制的围隔底部都用相应的滤布密封,骨架采用市售PVC扁平包扎带制作。
所构建的单向多级围隔微宇宙试验系统中,外层的生产者(斜生栅藻)可充分摄取体系内水体中的N、P营养并有充分的光照和生长发育繁殖空间,且能自如通过中层和内层的均匀扩散至整个实验体系;中间层的初级消费者(隆线溞)实验区中,隆线溞可在该区域自由摄取体系内的斜生栅藻,并拥有适合的光照和生长发育繁殖空间,且能自如通过内层的围隔均匀扩散至除外层斜生栅藻实验区的中层和内层水体中;而最内层的次级消费者(斑马鱼)实验区中,斑马鱼可在该区域自由摄取体系内经中层围隔自由出入的隆线溞,并拥有适合的光照和生长发育繁殖空间,但不能通过内层的围隔进入中层的隆线溞实验区及最外层的斜生栅藻实验区。整个系统中,斜生栅藻可自由通过所有体系内围隔均匀扩散或分布于整个实验水体中,而隆线溞仅可进入下一级食物链(斑马鱼)区域,斑马鱼则仅限于其所在的区域。参考自然广域水体中各食物链环节间空间间距相对较大、个体之间也较为分散的实际,按生态系统中物质和能量传递方向和规律设计的该单向多级围隔微宇宙试验系统,可有效避免在小容积试验体系下,各休戚相关的食物链环节因显得过于“亲密接触”导致在较小容积的体系内,行动敏捷的次级消费者(斑马鱼)对行动迟缓的初级消费者(浮游动物隆线溞)产生的快速捕食(同理,初级消费者的隆线溞对初级生产者藻类的快速滤食)造成试验系统中初级消费者(隆线溞)或初级生产者(藻类)等食物链关键环节的快速消失,从而保障实验体系的有序开展。
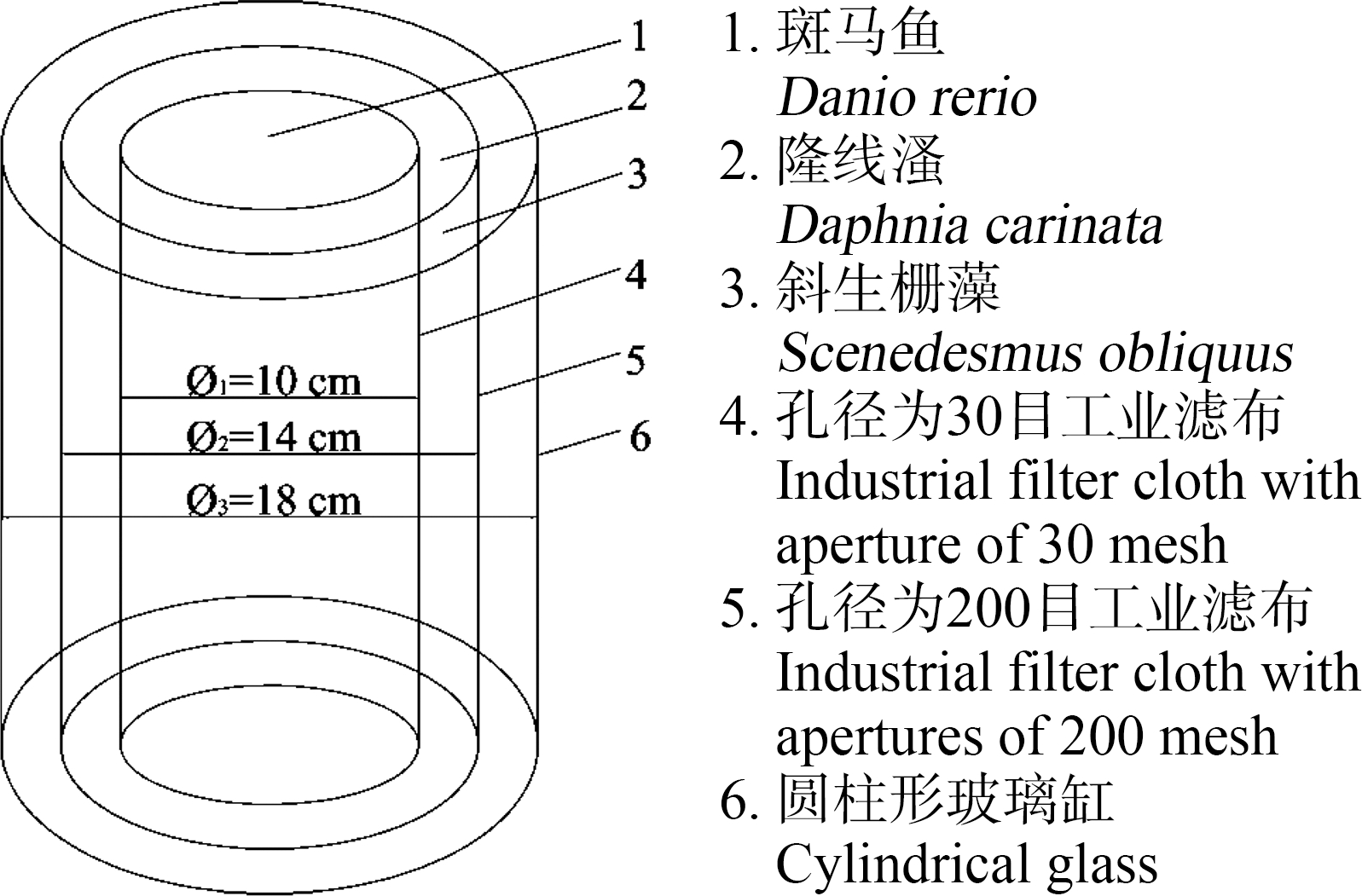
图1 单向多级围隔构建的微宇宙实验体系试验装置示意图
Fig. 1 Schematic diagram of microcosmic experimental system test device constructed by unidirectional multistage enclosure
1.2 试验方法
1.2.1 单向多级围隔微宇宙试验方法
本试验主要研究在单向多级围隔试验条件下,在高N、P条件和重金属Cu2+复合作用下,对由斜生栅藻—隆线溞—斑马鱼三级食物链构成的水生态系统的影响。依据Cu2+对斜生栅藻、隆线溞、斑马鱼以及三者共存条件下的毒性试验结果[21],试验设置3组不同浓度处理组和1组空白组,浓度依次为0、0.01、0.04和0.16 mg·L-1,试验设置的Cu2+浓度范围在斑马鱼的耐受范围内[22],但远超过隆线溞的耐受范围[19];藻、溞、鱼3组试验组放置围隔装置后,放入处于对数生长期的斜生栅藻,起始藻密度为5×104 个·mL-1[20],斜生栅藻能够自由通过体系内所有围隔孔径,到达在整个体系内各试验区域内生长;对于溞、鱼2个试验组,把约300只隆线溞放入用200目滤布制成的围隔内,隆线溞能够在由其形成的空间内自由活动并有可自由出入内层围隔进入斑马鱼试验区;而对于鱼试验组,在最内层30目的围隔内放入1条斑马鱼。试验共进行11 d,取样时间分别为第1、3、5、7、9和11天。
1.2.2 试验指标观测
本试验观测以下指标:分别为水样CODCr、浊度、藻密度(O484)、叶绿素a(Chl a);隆线溞与斑马鱼的存活、摄食活动及死亡率。CODCr测定参照唐红梅[23]的方法。浊度测量采用分光光度法[24]。藻密度(O484)在484 nm波长测定吸光度。叶绿素a(Chl a)采用热乙醇法测定[25-26]。
隆线溞的存活、摄食活动及死亡率:隆线溞的死亡以“沉入水底,轻转容器无任何反应”为死亡判断标准。试验开始后,观察并记录在第1、3、5、7、9和11天隆线溞的摄食活动及死亡数量,得出死亡率,试验过程中及时剔除死亡个体。
斑马鱼的存活、摄食活动及死亡率:斑马鱼的死亡以“鳃盖停止活动,对外界刺激无任何反应,丧失游泳能力且沉入水底”为死亡判断标准。试验开始后,观察并记录在第1、3、5、7、9和11天斑马鱼的摄食活动及存活情况,得出死亡率,并及时清理死鱼。
1.3 数据统计处理与分析
为保证实验数据可靠性,采用狄克逊(Dixon)检验法对试验结果进行检验。处理间平均数差异显著性的多重比较采用Duncan’s新复极差法,并采用OriginPro 2018绘制相关曲线图。
2 结果(Results)
2.1 不同浓度Cu2+在高N、P条件下对水生态系统中藻密度的影响
如图2所示,空白组斜生栅藻藻密度在0~5 d内基本保持稳定,至第3天仅有极小幅度的下降,随着时间的推移,在5~9 d和11 d内藻密度开始有一定幅度的上升,此后至试验结束,藻密度基本保持不变,此条件下体系内水体藻密度的吸光度(O484)为0.036。较低浓度(0.01 mg·L-1)的Cu2+试验组藻密度变化规律和空白组的变化规律相似,试验结束时,藻密度的吸光度(O484)为0.041,且空白试验组和低浓度(0.01 mg·L-1)Cu2+试验组初级消费者的隆线溞与次级消费者的斑马鱼都未受到明显影响(隆线溞死亡率为0%、斑马鱼死亡率为0%)。特别值得注意的是,一定浓度(0.04 mg·L-1)的Cu2+存在条件下,试验组斜生栅藻的生长速度及藻密度与0、0.01和0.16 mg·L-1 Cu2+浓度组相比呈快速增加趋势,且隆线溞开始陆续死亡(死亡率高达80%),但斑马鱼的存活率未受明显影响(死亡率为0%),在5~11 d的整个试验周期内藻密度持续快速上升,水体颜色逐渐变得浓绿,至试验结束时0.04 mg·L-1 Cu2+试验组的藻密度(O484)的吸光度高达0.125。
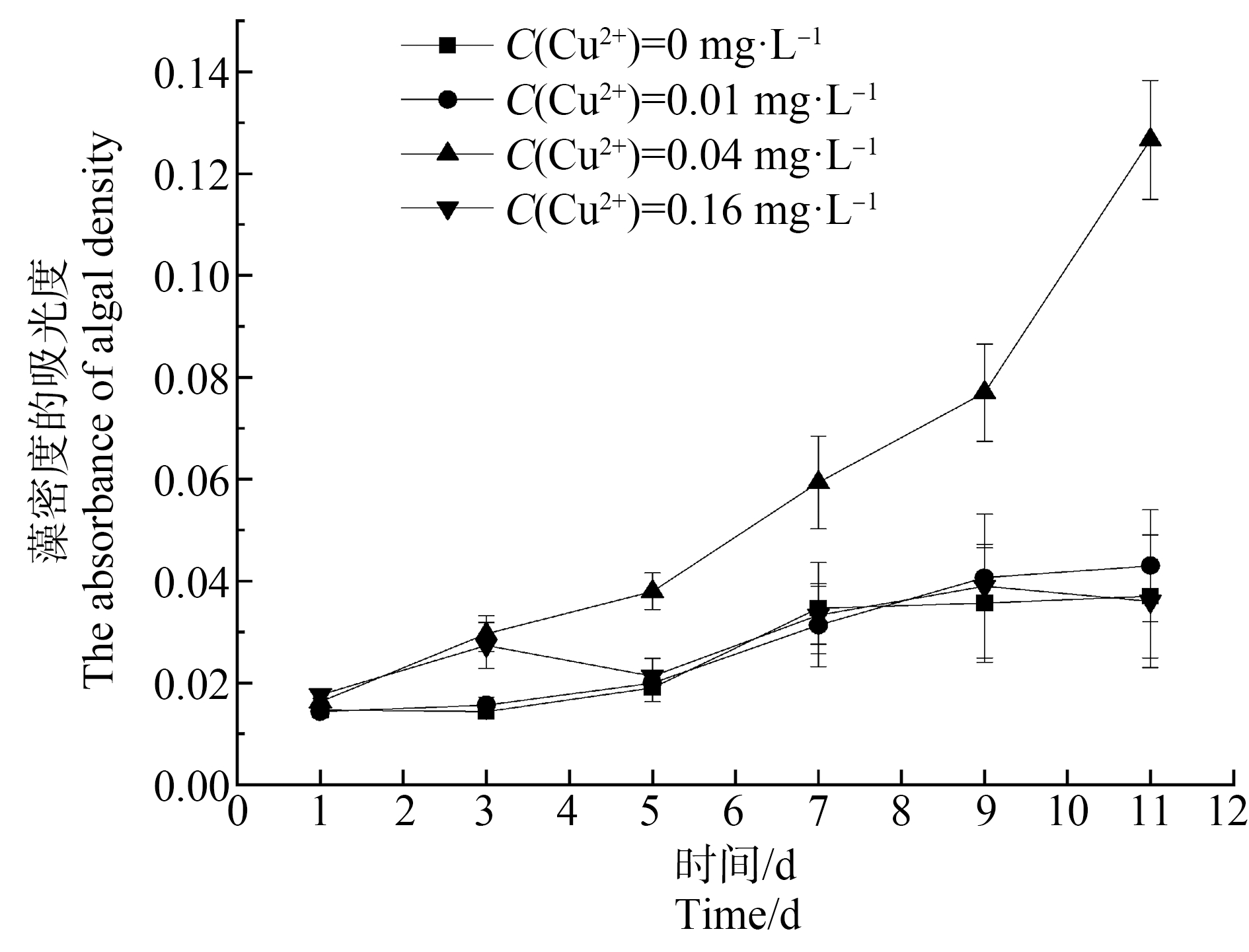
图2 高浓度N、P条件下不同浓度Cu2+的存在
对系统中斜生栅藻藻密度的影响
Fig. 2 Effects of different concentrations of Cu2+ on the density of Scenedesmus obliquus in the system under high concentrations of N and P
较高浓度(0.16 mg·L-1)的Cu2+试验组在0~5 d藻密度略有波动且呈现体系水体颜色有变深的现象,但在此浓度下的斜生栅藻在5 d及后期均受到较高浓度Cu2+的毒害,表现为从第5天至第7天藻密度有小幅上升,但至试验结束时藻密度的吸光度(O484)开始降低,藻密度的吸光度(O484)为0.035,并且在该浓度下隆线溞全部死亡(死亡率达100%),斑马鱼尚未受到明显毒害,死亡率为0%。
2.2 不同浓度Cu2+在高N、P条件下对水生态系统内叶绿素a的影响
不同浓度Cu2+在高N、P条件下对水生态系统内叶绿素a的影响与对斜生栅藻藻密度的变化具有相似的趋势(图3),空白组体系中包括斜生栅藻、隆线溞及斑马鱼等各级食物链环节的数量和存活情况相对较为稳定和正常,其中,叶绿素a在1~7 d有小幅上升,随后至试验结束时均保持稳定,此时叶绿素a含量为173.6 μg·L-1,隆线溞死亡率为0%,斑马鱼死亡率为0%。较低浓度(0.01 mg·L-1)的Cu2+试验组叶绿素a在1~3 d内变化不大,在3~11 d逐渐上升,且对体系中的隆线溞及斑马鱼未产生明显的毒性作用,至试验结束时,叶绿素a含量为395.25 μg·L-1,隆线溞死亡率为0%,斑马鱼死亡率为0%。
同0.04 mg·L-1 Cu2+试验组显著促进藻密度增加的趋势一样,该浓度的Cu2+存在条件下体系中叶绿素a含量在1~5 d内有一定幅度的增加,在5~11 d叶绿素a含量迅速上升,但体系中的隆线溞此时已表现出明显的中毒死亡现象,因此,此浓度条件下体系中藻密度及叶绿素a含量同步激增,试验结束时体系内叶绿素a含量高达874.7 μg·L-1,隆线溞死亡率为80%,斑马鱼死亡率为0%。同前述较高浓度(0.16 mg·L-1)Cu2+试验组对体系藻密度变化的影响规律相似,叶绿素a在1~5 d内基本保持稳定且总体上叶绿素a含量较低;在5~7 d叶绿素a有一定幅度上升,7~11 d有小幅上升;至试验结束时,体系叶绿素a含量为378.04 μg·L-1,隆线溞在试验开始不久后24 h内死亡率达100%,斑马鱼死亡率为0%。
2.3 不同浓度Cu2+在高N、P条件下对水生态系统CODCr的影响
如图4所示,空白组CODCr在1~5 d内有小幅度的下降,随着试验时间的延长,CODCr逐渐上升,至11 d的试验结束时CODCr值为20.5 mg·L-1,仅比试验开始时略有增加,在此期间,作为初级消费者的隆线溞和次级消费者的斑马鱼存活状况良好,隆线溞和斑马鱼的死亡率均为0%,水质、水色等也较为稳定。0.01 mg·L-1 Cu2+试验组对水体CODCr变化的影响总体也不明显,在1~3 d内水体CODCr呈下降趋势,幅度较小;在3~11 d水体CODCr缓慢上升,至11 d的试验结束时水体的CODCr值为22.7 mg·L-1。
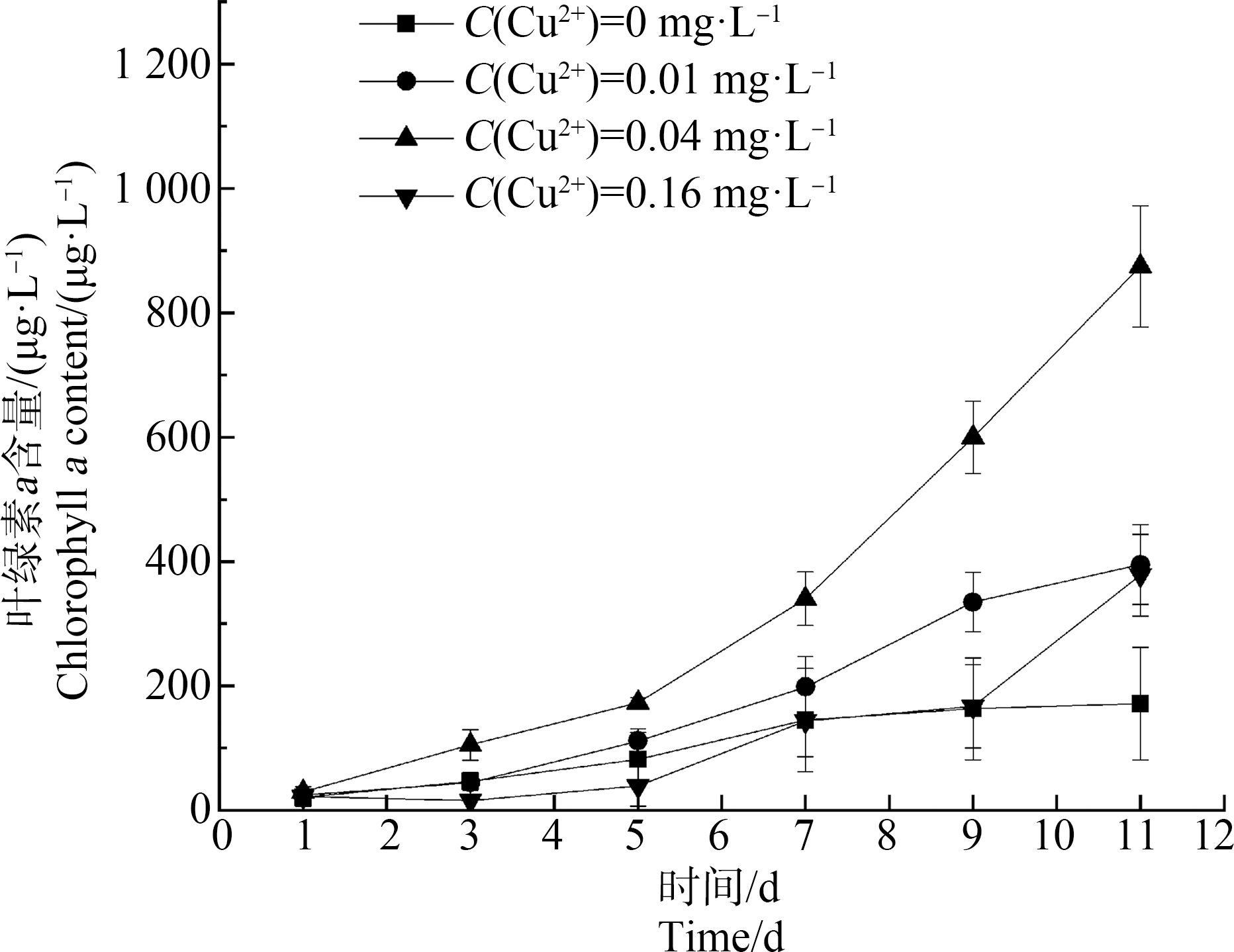
图3 高N、P条件下不同浓度Cu2+的存在对系统内斜生栅藻叶绿素a的影响
Fig. 3 Effects of different concentrations of Cu2+on chlorophyll a changes in Scenedesmusobliquus under high N and P conditions
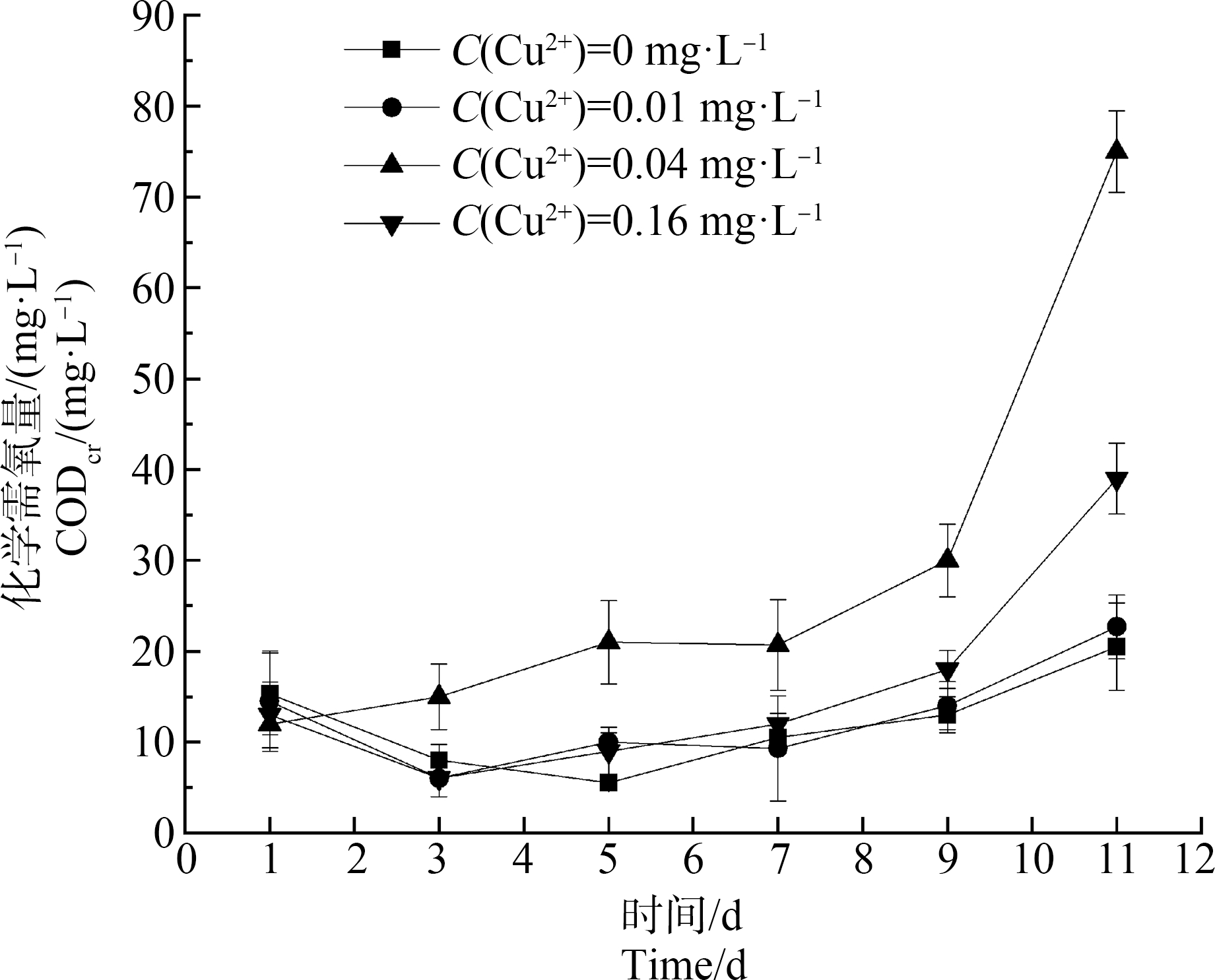
图4 高N、P条件下不同浓度Cu2+对体系中水体CODCr变化的影响
Fig. 4 Effects of different concentrations of Cu2+ on CODCr changes in water body under high N and P conditions
0.04mg·L-1 Cu2+试验组CODCr在1~5 d内小幅上升且在5~7 d内基本保持稳定,随着试验进行至第9天时CODCr有较大幅度上升,试验结束的11 d时CODCr值已高达75 mg·L-1(此浓度条件下隆线溞死亡率为80%,斑马鱼死亡率为0%)。而更高浓度(0.16 mg·L-1)的Cu2+试验组CODCr在试验周期内变化趋势与0.01 mg·L-1 Cu2+试验组较为相似,在试验结束时,CODCr值为39 mg·L-1,隆线溞死亡率为100%,斑马鱼死亡率为0%。
2.4 不同浓度Cu2+在高N、P条件下对水生态系统浊度的影响
如图5所示,空白组浊度在第1~5天内基本保持稳定,第5天较第3天略有上升,此后直至试验结束期间,空白浓度组浊度有一定幅度上升后保持稳定,浊度为11.5 NTU。0.01 mg·L-1 Cu2+试验组浊度变化趋势、受试生物存活状况与空白浓度组变化趋势较为一致(浊度为13.6 NTU,隆线溞死亡率为0%,斑马鱼死亡率为0%)。而较高浓度(0.16 mg·L-1)Cu2+试验组浊度在11 d的实验期内总体上与较低浓度(0.01 mg·L-1) Cu2+及空白组的变化规律相似,其中在1~5 d内先上升后下降;从第5天开始浊度逐渐上升至在第9天时浊度达到最大值,第11天时浊度较第9天略微下降(浊度为9.8 NTU),但与较低浓度(0.01 mg·L-1)Cu2+及空白组完全不同的是,较高浓度(0.16 mg·L-1)Cu2+试验组的隆线溞死亡率为100%。
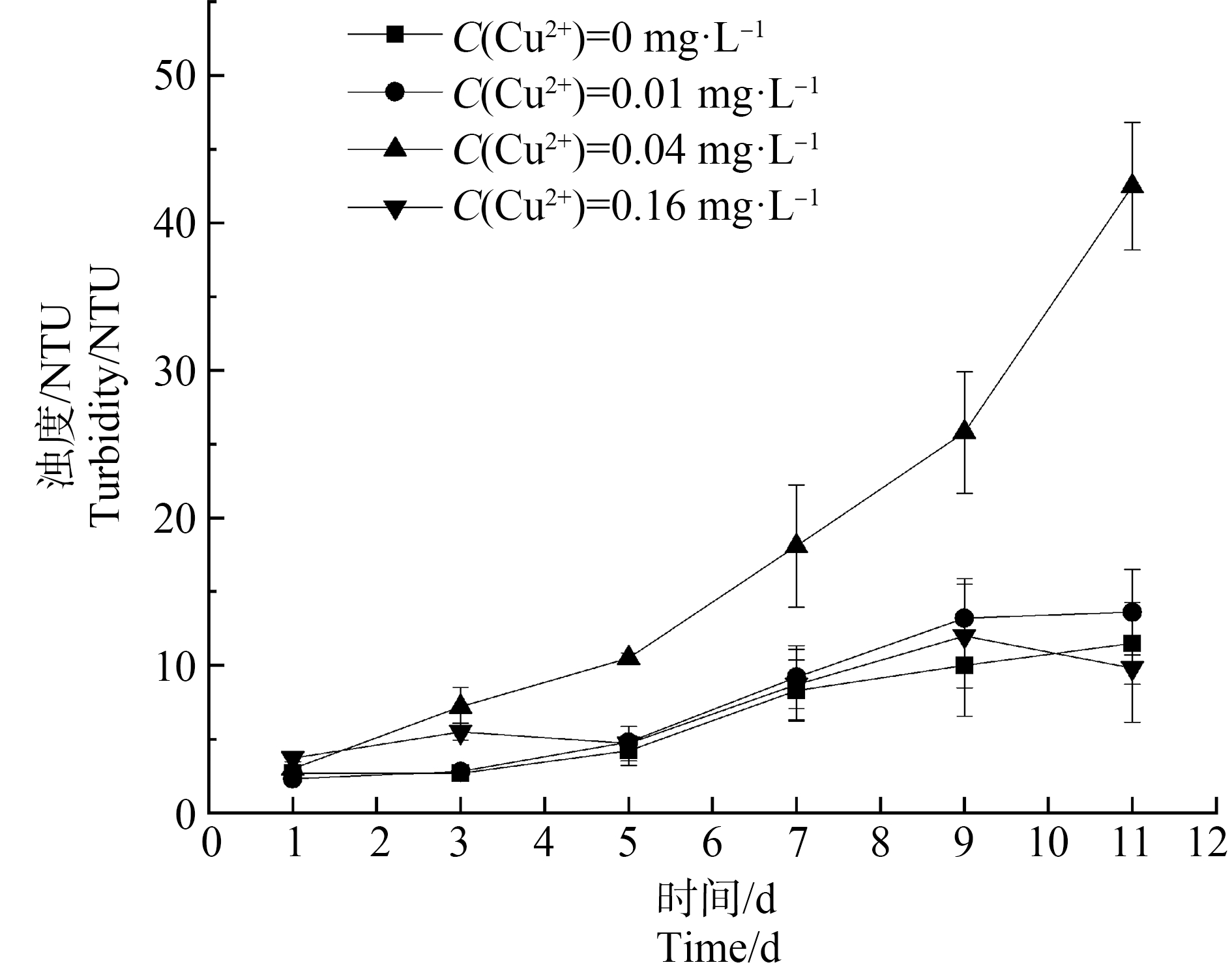
图5 高N、P条件下不同浓度Cu2+对系统内水体浊度的影响
Fig. 5 Effects of different concentrations of Cu2+ on turbidity of water in the system under high N and P conditions
与0、0.01和0.16 mg·L-1 Cu2+试验组浊度相比,0.04 mg·L-1 Cu2+试验组浊度差异非常明显,在试验周期内,逐渐上升,最终在第11天达最大值42.5 NTU(此时隆线溞死亡率高达80%,斑马鱼死亡率为0%)。
3 讨论(Discussion)
通过分析比较构建的水生生态微宇宙实验系统运行第1、3、5、7、9和11天时不同试验阶段体系内藻密度(O484)与叶绿素a含量、水体CODCr值与浊度、隆线溞与斑马鱼的存活、摄食活动及死亡率等的变化规律,发现不同浓度Cu2+在高浓度N、P复合污染模拟高富营养化的水体中,对水生生态系统食物链各环节尤其是初级消费者(隆线溞)的毒性是造成水生食物链断裂的关键性因素,继而对水生生态系统带来不同的环境生态效应并由此触发水体富营养化的爆发。试验设置的Cu2+浓度在斑马鱼耐受范围内[22],所以在试验期内,斑马鱼死亡率为0%。
空白试验组中,由于单向多级围隔装置限制隆线溞对斜生栅藻的滤食且无其他毒害物质,至试验结束时藻密度基本保持不变,因斜生栅藻的繁殖消耗了水中有机碳的同时,其光合放氧作用也会导致水体CODCr呈下降趋势,所以即使在高浓度N、P条件下,生产者(斜生栅藻)在无机环境中所获得的营养物质以及通过光合作用所固定的能量能够通过食物链传递到初级消费者(隆线溞),通过单向多级围隔装置,使斑马鱼对隆线溞的捕食受到限制,从而确保斜生栅藻—隆线溞—斑马鱼三级食物链的完整而没有发生中断,系统水体各项水质指标较好。在本试验中,初级消费者(隆线溞)对控制水生态系统的富营养化有重要作用,表明健全的水生生态系统能够消纳高浓度N、P带来的压力而不易发生水体富营养化。
在0.01 mg·L-1 Cu2+试验组中,初级消费者(隆线溞)没有表现出较强的急性毒性反应(死亡率为0%)。首先,0.01 mg·L-1 Cu2+小于隆线溞96 h-EC50[21];其次,试验时所用300只隆线溞并不是出生仅24 h隆线溞,而是随机捞取,个体较大,其对Cu2+敏感性较幼溞较弱;最后,斜生栅藻对重金属有一定的吸收作用[27-28],可降低水体中Cu2+浓度,从而降低Cu2+对隆线溞的毒性。生产者(斜生栅藻)也没有表现出明显的毒性反应,相反,表现出一定的毒性兴奋效应[29],0.01 mg·L-1 Cu2+明显促进斜生栅藻的生长[30]。但初级消费者(隆线溞)通过滤食生产者(斜生栅藻),且在初期溞的摄食率速度较高[31],即使维持体系中高浓度的N、P但仍能自行控制生产者(斜生栅藻)的数量处于较低水平[32],此条件下水生生态系统未发生水体富营养化。
在0.04 mg·L-1 Cu2+试验组中,Cu2+对初级消费者(隆线溞)显示较强毒性而导致初级消费者(隆线溞)数量大为减少(隆线溞死亡率达80%),未死的个体显示活动能力及滤食能力显著减弱,对天敌的敏感性降低[33],试验结束时CODCr值已高达75 mg·L-1,推测原因与此时体系中的隆线溞大量死亡腐解有直接关系。这表明在0.04 mg·L-1 Cu2+条件下,隆线溞作为关键性食物链环节,无法完成生产者(斜生栅藻)从水环境中吸收的N、P以及通过光合作用积累的物质和能量的传递,系统内“斜生栅藻—隆线溞—斑马鱼”3个不同等级食物链环节近乎中断,导致体系内生产者(斜生栅藻)因为失去天敌(隆线溞),而未被滤食且在高浓度氮磷刺激下大量繁殖,物质和能量累积在初级生产者这一营养级,导致初级生产力很大,生产者数量远高于初级消费者数量,最终显示水生态系统形成生产者(斜生栅藻)占绝对优势的重度富营养化现象。
在0.16 mg·L-1 Cu2+试验组中,体系水体颜色有变深的现象,估计与所加铜离子的颜色有关,在该浓度的Cu2+影响下CODCr值维持较低水平与前期隆线溞死亡速度快、打捞死溞相对较为集中和及时,且与高浓度Cu2+的杀菌灭菌作用导致死亡的隆线溞或部分藻类的腐烂受到一定程度的抑制有关。生产者(斜生栅藻)在此浓度Cu2+下受到一定的毒害,在试验的1~5 d受到明显的抑制作用(图2),由于部分死亡藻类颗粒导致0.16 mg·L-1 Cu2+试验组藻密度曲线在1~5 d时是先升高后降低的外凸曲线(图3),0.16 mg·L-1 Cu2+试验组叶绿素a曲线在1~5 d时是内凹曲线,表明斜生栅藻受到Cu2+的抑制,使叶绿素a呈略微下降趋势。段晨雪等[34]的研究表明浓度高于50 μmol·L-1的Cd2+会抑制叶绿素a的合成。作为联系初级生产者(斜生栅藻)和次级消费者(斑马鱼)物质和能量流动纽带的水生食物链关键环节的所有初级消费者(隆线溞)在该浓度试验开始不久后24 h内的死亡率达100%,而此时的次级消费者(斑马鱼)由于仍然具有较强的耐受性存活率几乎没有受到明显影响,但水生食物链发生中断,由此将导致次级消费者(鱼类)食物(物质和能量)的缺失而最终死亡,也将会导致初级生产者(藻类)因缺乏必要的摄食者而失控泛滥,并逐渐显现出水色浓绿的富营养化特征。值得注意的是,在该微宇宙体系中,供试材料(硫酸铜)中的二价铜离子除了对系统中的藻-溞-鱼各级食物链的代表性生物自身具有不同程度的直接毒性作用外,由于铜物种敏感度分布法(SSD)计算得到的HC5(即在铜的物种敏感度分布曲线中保护95%以上物种的浓度水平)主要针对的物种是微生物和藻类,因此本研究所用的铜离子还可通过减少或清除水生生态系统中分解者(微生物)和生产者(藻类)的方式改变系统中食物链的构成,继而影响到水生生态系统的物质循环和能量传递,从而导致水生生态系统的加速恶化。
综上所述:(1)在高浓度N、P条件下无重金属的空白试验组及低浓度的Cu2+试验组中,初级生产者(斜生栅藻)、初级消费者(隆线溞)和次级消费者(斑马鱼)总体发展较为均衡,水生食物链未发生断裂,各项水质指标良好,表明在无毒害物质或少量毒害物质(如重金属)存在条件下,健全的水生生态系统能够消纳高浓度N、P带来的压力而不易发生水体富营养化。(2)较高浓度的重金属Cu2+对水体富营养化进程具有明显的促进作用。在水生生态系统中,当重金属Cu2+浓度超过敏感的关键食物链环节(如初级消费者的浮游动物)毒性阈值时,对初级消费者产生的毒害作用(隆线溞死亡率达80%)明显大于对水生食物链初级生产者(藻类)以及次级消费者(鱼类)时,将导致水生食物链中断,继而造成初级生产者(藻类)未被滤食且在高浓度N、P供给下的大量繁殖,最终形成初级生产者(藻类)占绝对优势的重度富营养化现象。(3)在遭受毒害物质(如重金属)及高浓度N、P复合污染的水体中,毒害物质(如重金属)是造成体系中敏感性关键性食物链环节(如初级消费者的浮游动物)断裂或消失及水生生态系统崩溃、继而导致富营养化进程加剧的关键性因素之一,需要引起足够重视。在水环境治理或水生生态系统修复过程中,应严格限制包括重金属在内的有毒有害持久性污染物排放至自然水体中。
[1] Wang J Z, Jiang X, Zheng B H, et al. Effect of algal bloom on phosphorus exchange at the sediment-water interface in Meiliang Bay of Taihu Lake, China [J]. Environmental Earth Sciences, 2016, 75(1): 57
[2] Saha N, Rahman M S, Ahmed M B, et al. Industrial metal pollution in water and probabilistic assessment of human health risk [J]. Journal of Environmental Management, 2017, 185: 70-78
[3] Zheng X L, Liu G X, Yang W, et al. Dominant contribution of a lake’s internal pollution to eutrophication during rapid urbanization [J]. Bulletin of Environmental Contamination and Toxicology, 2021, 107(5): 904-910
[4] Wang F, Dong W Y, Zhao Z L, et al. Heavy metal pollution in urban river sediment of different urban functional areas and its influence on microbial community structure [J]. Science of the Total Environment, 2021, 778: 146383
[5] 杨颖, 孙文, 刘吉宝, 等. 北运河流域沙河水库沉积物重金属分布及生态风险评估[J]. 环境科学学报, 2021, 41(1): 217-227
Yang Y, Sun W, Liu J B, et al. Distribution and ecological risk assessment of heavy metals in sediments of Shahe Reservoir in Northern Canal Basin [J]. Acta Scientiae Circumstantiae, 2021, 41(1): 217-227 (in Chinese)
[6] Alexander T J, Vonlanthen P, Seehausen O. Does eutrophication-driven evolution change aquatic ecosystems? [J]. Philosophical Transactions of the Royal Society of London Series B, Biological Sciences, 2017, 372(1712): 20160041
[7] Wang H, García Molinos J, Heino J, et al. Eutrophication causes invertebrate biodiversity loss and decreases cross-taxon congruence across anthropogenically-disturbed lakes [J]. Environment International, 2021, 153: 106494
[8] Le Moal M, Gascuel-Odoux C, Ménesguen A, et al. Eutrophication: A new wine in an old bottle? [J]. Science of the Total Environment, 2019, 651: 1-11
[9] Zhang Y, Luo P P, Zhao S F, et al. Control and remediation methods for eutrophic lakes in the past 30 years [J]. Water Science and Technology: A Journal of the International Association on Water Pollution Research, 2020, 81(6): 1099-1113
[10] VandKhanghah M M, Hedayati A, Nazeri S, et al. Biomagnification of copper along the aquatic food chain (Artemia franciscana, Danio rerio, and Astronotus ocellatus) [J]. Biological Trace Element Research, 2022, 200(4): 1854-1860
[11] 王振, 金小伟, 王子健. 铜对水生生物的毒性: 类群特异性敏感度分析[J]. 生态毒理学报, 2014, 9(4): 640-646
Wang Z, Jin X W, Wang Z J. Taxon-specific sensitivity differences of copper to aquatic organisms [J]. Asian Journal of Ecotoxicology, 2014, 9(4): 640-646 (in Chinese)
[12] Donnachie R L, Johnson A C, Moeckel C, et al. Using risk-ranking of metals to identify which poses the greatest threat to freshwater organisms in the UK [J]. Environmental Pollution, 2014, 194: 17-23
[13] Hu C Y, Shui B N, Yang X L, et al. Trophic transfer of heavy metals through aquatic food web in a seagrass ecosystem of Swan Lagoon, China [J]. Science of the Total Environment, 2021, 762: 143139
[14] Gao Y F, Wang R Y, Li Y Y, et al. Trophic transfer of heavy metals in the marine food web based on tissue residuals [J]. Science of the Total Environment, 2021, 772: 145064
[15] Fu Z Y, Wu F C, Chen L L, et al. Copper and zinc, but not other priority toxic metals, pose risks to native aquatic species in a large urban lake in Eastern China [J]. Environmental Pollution, 2016, 219: 1069-1076
[16] 李强, 刘云庆, 陈望香, 等. 新疆地表水体质量金属生态风险评估[J]. 中国环境科学, 2018, 38(5): 1913-1922
Li Q, Liu Y Q, Chen W X, et al. Ecological risk assessment of heavy metals in water of Xinjiang Area [J]. China Environmental Science, 2018, 38(5): 1913-1922 (in Chinese)
[17] 张旭, 付卫强, 冯承莲, 等. 我国淡水中铜的水质基准及生态风险评估研究[J]. 环境工程, 2016, 34(5): 156-160
Zhang X, Fu W Q, Feng C L, et al. Water quality criteria and ecological risk assessment of copper in Chinese freshwaters [J]. Environmental Engineering, 2016, 34(5): 156-160 (in Chinese)
[18] 国家环境保护总局. 水质 物质对蚤类(大型蚤)急性毒性测定方法: GB/T 13266—1991[S]. 北京: 中国标准出版社, 1991
[19] 吴永贵, 熊焱, 林初夏, 等. 不同氮形态对重金属Cu Zn Cd生物毒性效应的影响[J]. 农业环境科学学报, 2006, 25(6): 1560-1565
Wu Y G, Xiong Y, Lin C X, et al. The joint-biotoxicity effect of different forms of nitrogen on heavy metals in water by the phototacti behavior of Daphnia [J]. Journal of Agro-Environment Science, 2006, 25(6): 1560-1565 (in Chinese)
[20] 吴永贵, 袁玲, 黄建国. Cr6+的隆线溞趋光指数与LC50急性毒性的比较[J]. 环境科学学报, 2004, 24(5): 905-909
Wu Y G, Yuan L, Huang J G. Comparison of phototaxis index with acute toxicity test (LC50) using Daphnia carinata [J]. Acta Scientiae Circumstantiae, 2004, 24(5): 905-909 (in Chinese)
[21] 王良韬, 吴永贵, 廖芬, 等. Cu2+对水生食物链关键环节生物的毒性效应[J]. 贵州农业科学, 2011, 39(5): 226-230, 234
Wang L T, Wu Y G, Liao F, et al. Study on biotoxicity of Cu2+ to organisms of key link in aquatic ecosystems food chain [J]. Guizhou Agricultural Sciences, 2011, 39(5): 226-230, 234 (in Chinese)
[22] 汪红军, 李嗣新, 周连凤, 等. 5种重金属暴露对斑马鱼呼吸运动的影响[J]. 农业环境科学学报, 2010, 29(9): 1675-1680
Wang H J, Li S X, Zhou L F, et al. The effect of exposure to five kinds of heavy metals on respiratory movement of Zebra fish (Brachydanio rerio) [J]. Journal of Agro-Environment Science, 2010, 29(9): 1675-1680 (in Chinese)
[23] 唐红梅. 微回流比色法测定CODCr的试剂配方及测定方法[J]. 化工技术与开发, 2005, 34(5): 30-31
Tang H M. Determination of CODCr by micro-reflux colormetry with self-made agent [J]. Guangxi & Development of Chemical Industry, 2005, 34(5): 30-31 (in Chinese)
[24] 国家技术监督局, 国家环境保护局. 水质 浊度的测定: GB 13200—1991[S]. 北京: 中国标准出版社, 1992
[25] 张丽彬, 王启山, 徐新惠, 等. 乙醇法测定浮游植物叶绿素a含量的讨论[J]. 中国环境监测, 2008, 24(6): 9-10
Zhang L B, Wang Q S, Xu X H, et al. Discussion on measurement of chlorophyll-a in phytoplankton with ethanol [J]. Environmental Monitoring in China, 2008, 24(6): 9-10 (in Chinese)
[26] 陈宇炜, 陈开宁, 胡耀辉. 浮游植物叶绿素a测定的“热乙醇法”及其测定误差的探讨[J]. 湖泊科学, 2006, 18(5): 550-552
Chen Y W, Chen K N, Hu Y H. Discussion on possible error for phytoplankton chlorophyll-a concentration analysis using hot-ethanol extraction method [J]. Journal of Lake Sciences, 2006, 18(5): 550-552 (in Chinese)
[27] 刘璐, 闫浩, 夏文彤, 等. 镉对铜绿微囊藻和斜生栅藻的毒性效应[J]. 中国环境科学, 2014, 34(2): 478-484
Liu L, Yan H, Xia W T, et al. Toxic effect of cadmium on Microcysis aeruginosa and Scenedesmus obliquus [J]. China Environmental Science, 2014, 34(2): 478-484 (in Chinese)
[28] Shang Y X, Yu X F, Romero-González M E. Screening of algae material as a filter for heavy metals in drinking water [J]. Algal Research, 2015, 12: 258-261
[29] Kendig E L, Le H H, Belcher S M. Defining hormesis: Evaluation of a complex concentration response phenomenon [J]. International Journal of Toxicology, 2010, 29(3): 235-246
[30] 王丽平, 郑丙辉, 孟伟. 重金属Cu对两种海洋微藻的毒性效应[J]. 海洋环境科学, 2007, 26(1): 6-9
Wang L P, Zheng B H, Meng W. Toxicity effects of heavy metal copper on two marine microalgae [J]. Marine Environmental Science, 2007, 26(1): 6-9 (in Chinese)
[31] 王图锦, 周富春, 潘瑾, 等. 大型溞与富营养化水体中藻类的相互作用研究[J]. 环境污染与防治, 2019, 41(7): 767-771
Wang T J, Zhou F C, Pan J, et al. Study on the interaction between Daphnia magna and algae in eutrophic water [J]. Environmental Pollution & Control, 2019, 41(7): 767-771 (in Chinese)
[32] 刘煌, 曹琳, 许国静, 等. 大型溞强化生物操纵修复富营养化水体研究[J]. 环境科学与技术, 2020, 43(2): 156-161
Liu H, Cao L, Xu G J, et al. Study on the remediation of eutrophic water by enhanced biomanipulation of Daphnia magna [J]. Environmental Science & Technology, 2020, 43(2): 156-161 (in Chinese)
[33] 王茜, 郭鹄飞, 王兰. 镉对大型溞摄食能力和相关生理指标的影响[J]. 水生生物学报, 2018, 42(3): 616-621
Wang Q, Guo H F, Wang L. Effect of cadmium on the feeding capacity and physiological status of Daphnia magna [J]. Acta Hydrobiologica Sinica, 2018, 42(3): 616-621 (in Chinese)
[34] 段晨雪, 张宝玉, 伍松翠, 等. 重金属镉对斜生栅藻光合作用的影响[J]. 海洋与湖沼, 2015, 46(2): 351-356
Duan C X, Zhang B Y, Wu S C, et al. Effect of cadmium on photosynthesis of Scenedesmus obliquus [J]. Oceanologia et Limnologia Sinica, 2015, 46(2): 351-356 (in Chinese)