砷(arsenic, As),是一种地壳中常见具有金属和非金属化学特征的类金属元素,以多种有机和无机形式存在于自然界中[1]。在我国砷中毒具有类型多、发生省份多的特点,其中贵州、内蒙古、吉林、山西和青海等省份(自治区)均有过砷中毒报告[2]。近年来,砷中毒的情况得到明显改善,但部分地区居民依旧长期接触低水平砷所污染的饮用水和食物。大量研究表明,长期低中浓度(10~100 μg·L-1)砷暴露与多种不良健康结果有关,包括心血管和神经系统疾病、癌症、自身免疫性疾病等[3-4]。在人体内,影响砷生物转化和毒性效应的因素很多,包括性别、宿主遗传、营养状况、饮食和生活方式等[5]。近年来,研究发现肠道微生物和砷之间的相互作用也可成为了解砷毒性的一个重要因素。
肠道微生态由肠道菌群及肠道内环境构成,参与多项人体正常的生理代谢活动并维持肠道内外稳态平衡。肠道菌群数量巨大、种类极其丰富[6];同时,与许多疾病的发生发展相关,如糖尿病、肥胖、脂肪肝和炎症性肠病等[7-9]。有研究发现砷通过细胞膜离子通道被肠道菌群吸收,肠道微生物群的存在可以显著影响砷在体内的代谢和吸收[10],Gokulan等[11]研究发现有机砷向有毒无机砷的重要转化是由肠道菌群所调节,而Chi等[12]发现砷也可改变肠道菌群的结构和代谢功能,特别是丙酮酸发酵、短链脂肪酸合成,进而改变肠道内多种重要的细菌功能途径[13]。因此,肠道菌群和砷暴露之间的关系密不可分。机体长期接触受砷污染的饮用水和食品[14],生活在低砷环境中会严重影响人体的健康,然而低砷水平与肠道菌群之间关系的相关研究较少。本文通过构建亚慢性低剂量砷暴露SD大鼠模型,探究低剂量砷暴露对肠道及菌群的影响,以期为低砷污染造成的人体危害发现特定的菌群标志物,为砷中毒的防治提供新的视角。
1 材料与方法(Materials and methods)
1.1 试剂与仪器
亚砷酸钠(Sigma公司,美国,序列号C1386-50G,纯度98.9%);显色基质鲎试剂盒(厦门鳌试剂生物科技股份有限公司,中国);AxyPrep DNA Gel Extraction Kit (Axygen Biosciences,美国);硼氢化钾和盐酸为优级纯,其余试剂均为国产分析纯。
ZT-12P2组织脱水机(上海华岩仪器设备有限公司,中国);μQuant Max200超级酶标仪(Bio-Tek公司,美国);LEICA RM2135旋转式超薄切片机(徕卡公司,德国);HI1220徕卡烘片机(徕卡公司,德国);AF-630A原子荧光光谱仪(北京瑞利分析仪器有限公司,中国)。
1.2 实验动物与分组
从贵州医科大学实验动物中心购买18只SPF级SD雄鼠(许可号SCXK(Liao)2020-0001),体质量约(160±20) g,于SPF级动物房,笼子饲养,自由摄食和饮水,人工照明,光照明暗交替12 h·d-1。实验前饲养7 d以适应环境。正常给予常规饲料及纯净水。本研究方案均严格按照动物伦理程序和规范处理(动物伦理审批号1800828)。将18只SD大鼠按照体质量随机分为3组,每组6只,分为NC组(正常饲料对照组)、AS1组(砷组)、AS2组(砷组)。NC组给予去离子水灌胃,AS1组给予亚砷酸钠1 mg·kg-1灌胃,持续染毒12周,AS2组给与亚砷酸钠1 mg·kg-1灌胃,持续染毒16周,一周6 d,每天一次,灌胃量20 mL·kg-1。
1.3 盲肠内容物高通量测序分析
盲肠内容物中菌群分析采用高通量测序仪Illumina Miseq对16S rRNA基因进行检测。根据AxyPrep DNA Gel Extraction Kit (Axygen Biosciences,美国)说明书进行微生物群落总DNA抽提,使用1%的琼脂糖凝胶电泳检测DNA的提取质量,使用NanoDrop2000测定DNA浓度和纯度;使用338F(5’-ACTCCTACGGGAGGCAGCAG-3’)和806R(5’-GGACTACHVGGGTWTCTAAT-3’)对16S rRNA基因V3~V4可变区进行PCR扩增,扩增程序如下:95 ℃预变性3 min,27个循环(95 ℃变性30 s,55 ℃退火30 s,72 ℃延伸30 s),然后72 ℃稳定延伸10 min,最后在4 ℃进行保存(ABI GeneAmp® 9700型PCR仪)。PCR反应体系为:5×TransStart FastPfu缓冲液4 μL,dNTPs (2.5 mmol·L-1) 2 μL,上游引物(5 μmol·L-1) 0.8 μL,下游引物(5 μmol·L-1) 0.8 μL,TransStart FastPfu DNA聚合酶0.4 μL,模板DNA 10 ng,ddH2O补足至20 μL。采用Illumina公司的Miseq PE300平台进行测序。
1.4 结肠组织病理学分析
取结肠用于组织病理学分析。取结肠远端1 cm处,取材后用10%中性福尔马林固定,经75%、80%、95%和100%乙醇脱水透明,石蜡包埋,按照标准程序切厚度为4 μm薄片,进行HE染色,使用徕卡显微镜Aperio versa 8拍摄图像。
1.5 结肠组织砷含量的测定
分别取各组大鼠结肠组织0.10~0.12 g,加入适量硝酸,利用高温高压消解罐充分消化后,定容,待测。采用非完全消化-火焰原子吸收光谱法(FAAS)测定组织中砷元素含量。
1.6 细菌移位和内毒素的检测
在严格无菌条件下取肠系膜淋巴结(MLN)组织于无菌EP管中,称量后按1∶9 (g∶mL)比例加入无菌PBS。用灭菌匀浆器研磨,取200 μL涂匀于麦康凯培养液平皿,37 ℃、5% CO2培养箱中孵育24 h,观察细菌生长情况。采用显色基质鲎试剂盒检测肝门静脉内毒素(LPS)水平,严格按照试剂盒说明书进行操作。
1.7 数据统计分析
采用SPSS 25.0统计软件进行分析,计量资料以Mean±SME表示,多样本均数比较,方差齐时采用one-way ANOVA分析,方差不齐时采用welch检验分析;进一步两两比较采用LSD法,若方差不齐时采用Dunnett-t检验法,P<0.05差异有统计学意义,采用Graphpad prism 8.0软件进行作图。
2 结果(Results)
2.1 一般情况和体质量
NC组大鼠发育正常,精神良好,毛发有光泽,无脱毛现象;模型组大鼠生长良好,毛发色泽较暗淡,个别大鼠有脱毛,稀便的状况,精神一般,行走正常,活动量减少。饲喂相同的时间,与对照组相比,模型组体质量变化不大(图1)。
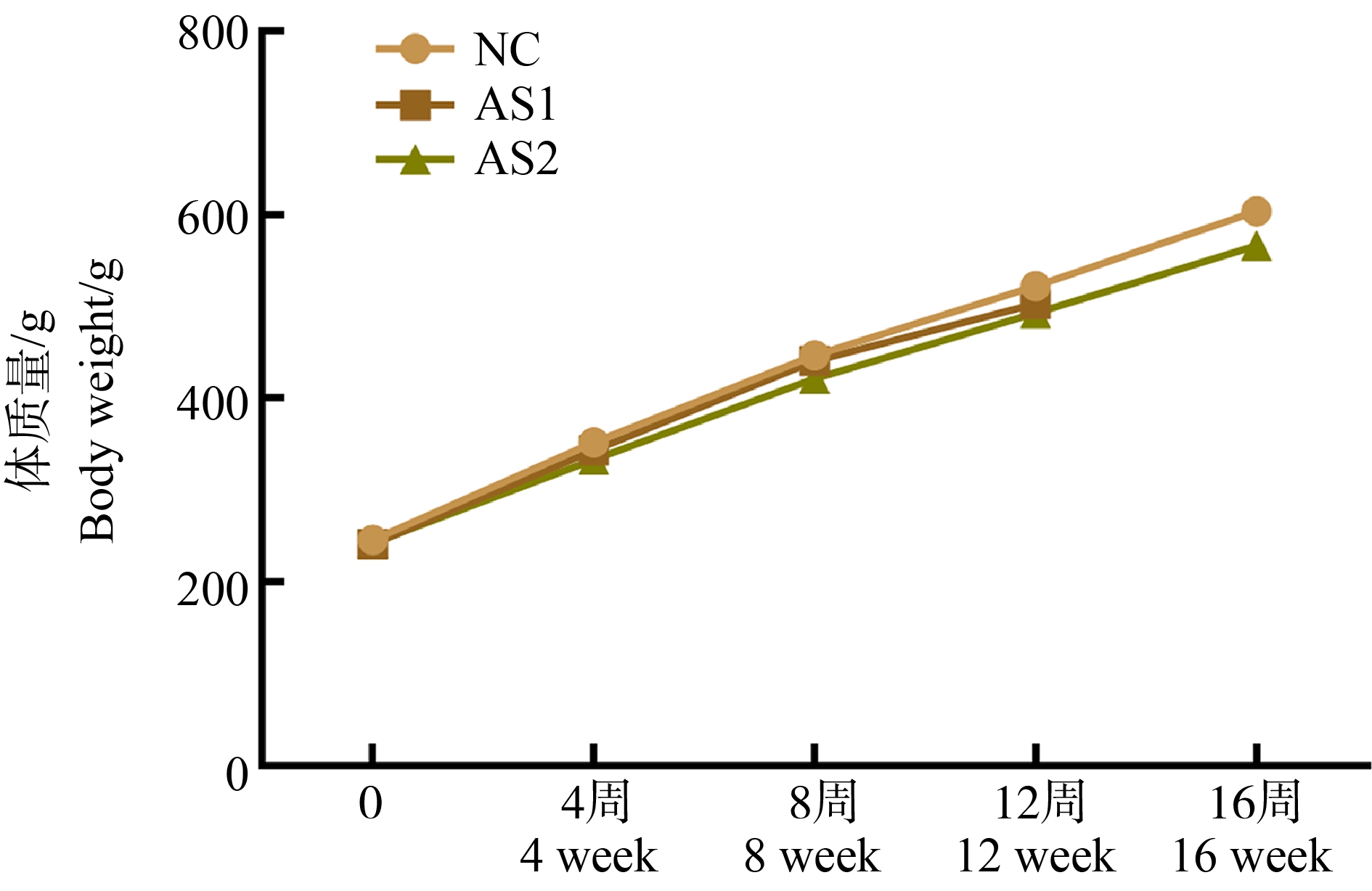
图1 大鼠体质量变化
注:NC表示正常组;AS1表示砷组(12周);AS2表示砷组(16周)。
Fig. 1 Changes in body weight of rats
Note: NC represents control group; AS1 represents arsenic group (12 weeks); AS2 represents arsenic group (16 weeks).
2.2 低砷对大鼠结肠的影响
结肠组织病理切片结果显示,NC组大鼠的结肠结构完整,肠绒毛排列紧密,无缺损,无炎性细胞浸润;AS1组可见肠绒毛排列稀疏,空隙较大,部分出现断裂;AS2组明显可见炎性细胞浸润,肠绒毛间隙大,杯状细胞减少,如图2所示。从结肠的长度结果可知,与NC组相比,AS1组和AS2组的长度缩短,随着低砷暴露的时间增加,结肠的长度逐渐变短,差异有统计学意义(P<0.05),如图3(a)~(d)所示。与NC组相比,AS1组和AS2组的砷含量随暴露时间增加,组织中砷含量逐渐增加,差异有统计学意义(P<0.05),如图3(e)所示。
2.3 低砷对细菌移位的影响
如图4(a)~(c)所示,NC组未出现革兰氏阴性菌细菌菌落,在AS1组可看出有少数的革兰氏阴性菌移位到肠系膜淋巴结,与AS1组相比,AS2组革兰氏阴性菌数量增加。检测肝门静脉中的LPS含量,与正常组相比,随砷暴露时间增加,LPS含量显著增加,差异有统计学意义(P<0.05),如图4(d)所示。
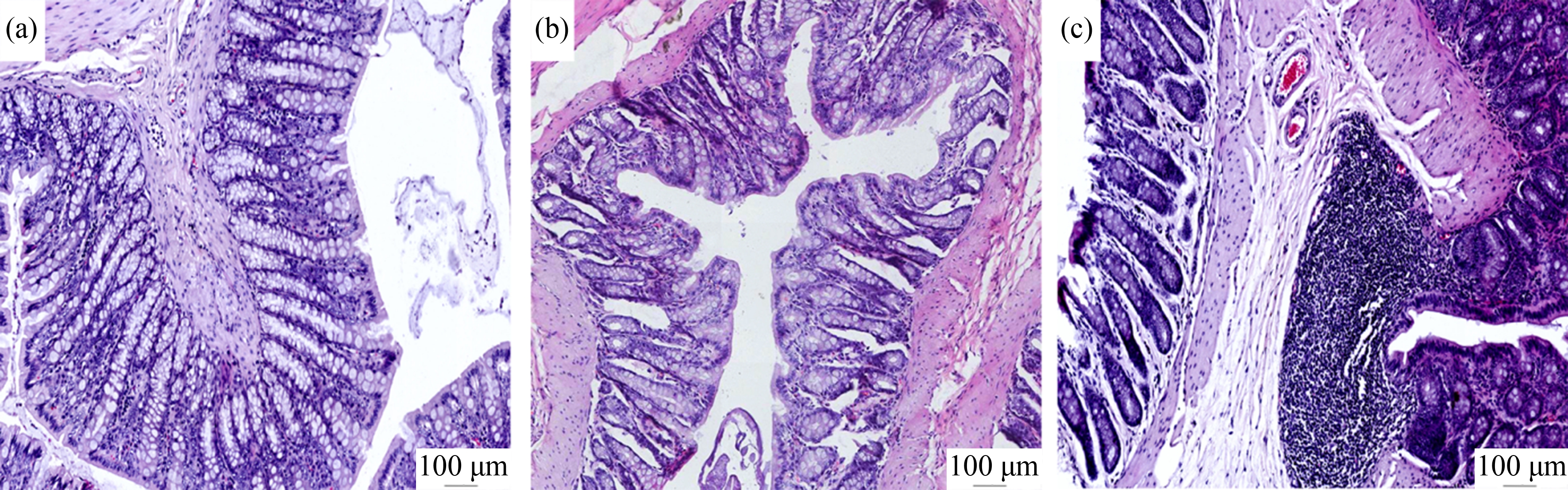
图2 大鼠结肠HE染色(×100)
注:(a) 对照组;(b) AS1组;(c) AS2组。
Fig. 2 HE staining of rat colon (×100)
Note: (a) The control group; (b) The AS1 group; (c) The AS2 group.

图3 大鼠结肠长度及肠砷含量的变化
注:(a) AS2组,(b) AS1组,(c) 对照组,(d) 结肠长度,(e) 肠砷含量;*表示与对照组相比P<0.05。
Fig. 3 Changes of colon length and the arsenic content of colon tissue in rats
Note: (a) The AS2 group, (b) The AS1 group, (c) The control group, (d) The length of colon, (e) Arsenic contents of colon; *represents P<0.05 vs. control group.
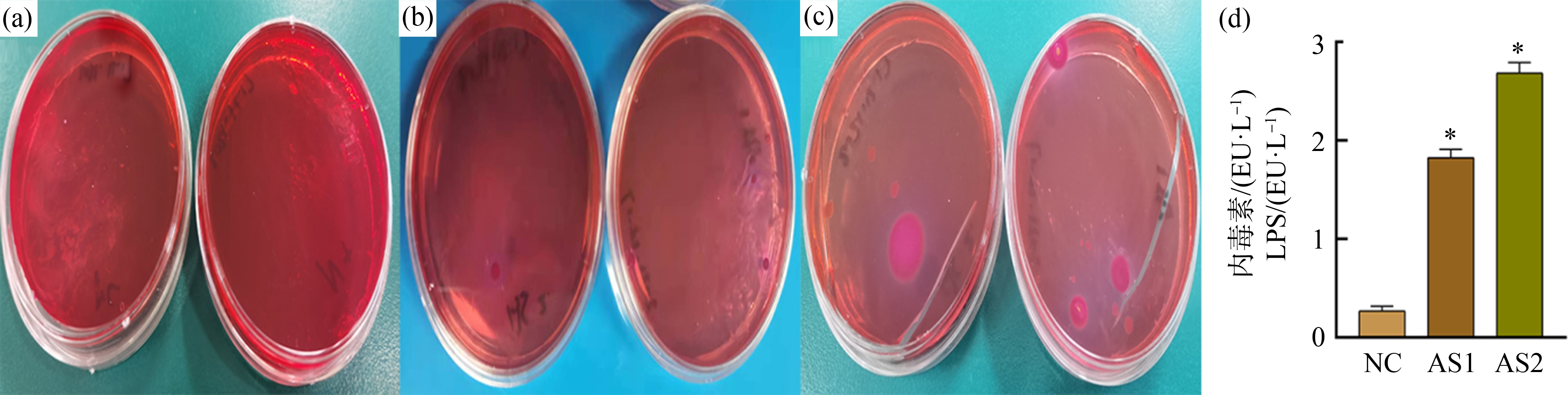
图4 细菌移位及内毒素的水平
注:(a) 对照组,(b) AS1组,(c) AS2组,(d) 内毒素(LPS)含量;*表示与对照组相比P<0.05。
Fig. 4 Bacterial translocation and endotoxin contents
Note: (a) The control group, (b) The AS1 group, (c) The AS2 group, (d) lipopolysaccharide (LPS) contents; *represents P<0.05 vs. control group.
2.4 低砷对大鼠肠道菌群多样性的影响
通常用Chao指数和ACE指数来体现群落丰富度,用Shannon指数和Simpson指数来体现群落均匀度。Chao或ACE越大,表明群落的丰富度越高;Simpson指数值越大,群落多样性越低,Shannon值越大,群落多样性越高。如图5(a)和(b)所示,结合4个指数结果可知,砷组的群落多样性比NC组高,但差异无统计学意义(P>0.05)。从每组样本中随机抽样测定单个样品序列数,绘制稀释性曲线,预测当前样本的物种多样性水平,随着抽样测序数加大,横轴样本序列数2.2万之后,曲线斜率越来越小,趋于与横轴平行,即每组样本获得了足够的测序数据的支持,如图5(e)所示。对各组肠道菌群差异性分析采取了主坐标分析法(PCoA)和偏最小二乘法判别分析(PLS-DA),在正常组和AS1组之间显示出明显的聚类趋势,表明微生物组成存在很大差异。随着砷暴露时间增加,尽管存在个体差异,大鼠AS2中的微生物群也发生明显分离,如图6所示。
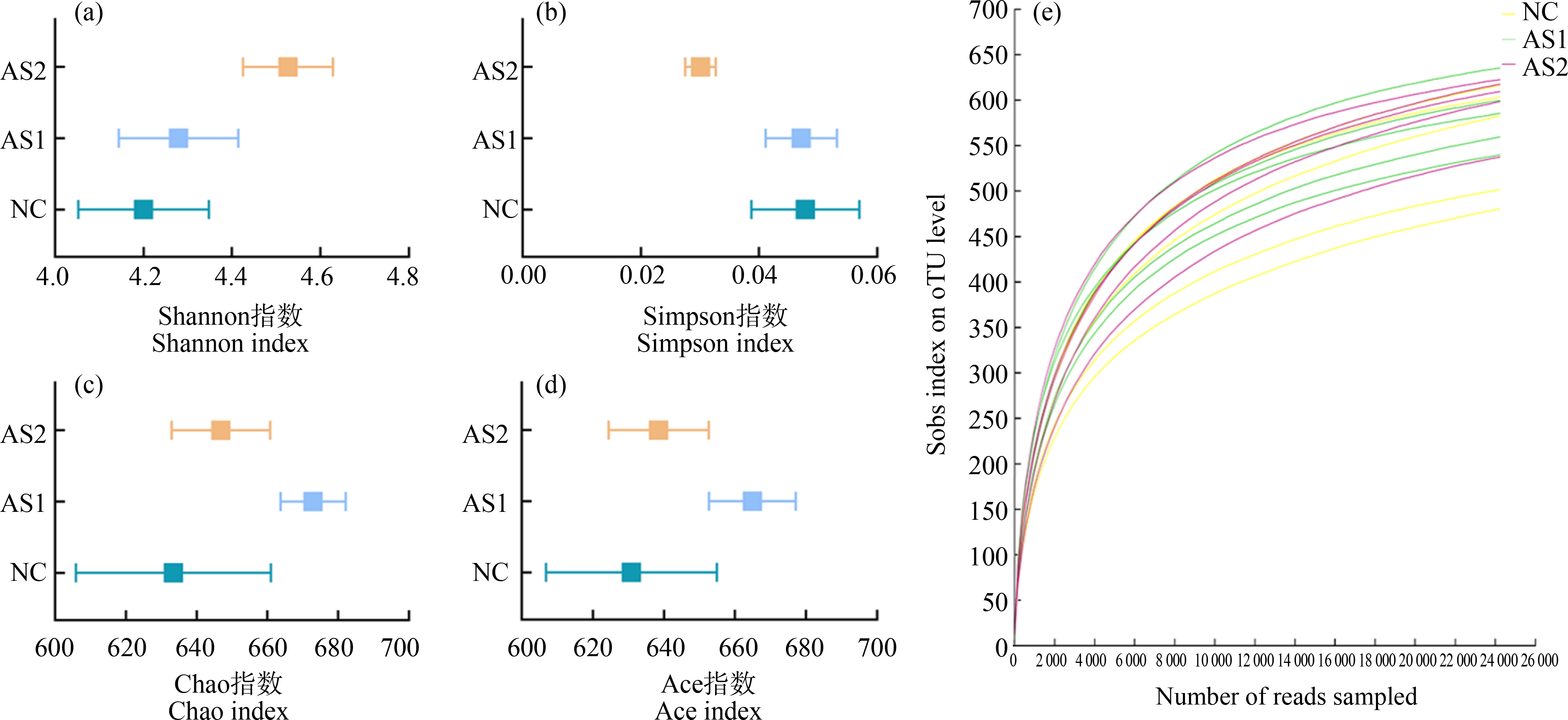
图5 大鼠肠道菌群多样性指数分析
注:(a) Shannon指数;(b) Simpson指数;(c) Chao指数;(d) Ace指数;(e) 稀释性曲线。
Fig. 5 Analysis of the diversity index of intestinal microflora in rats
Note: (a) Shannon index; (b) Simpson index; (c) Chao index; (d) Ace index; (e) Rarefaction curve.
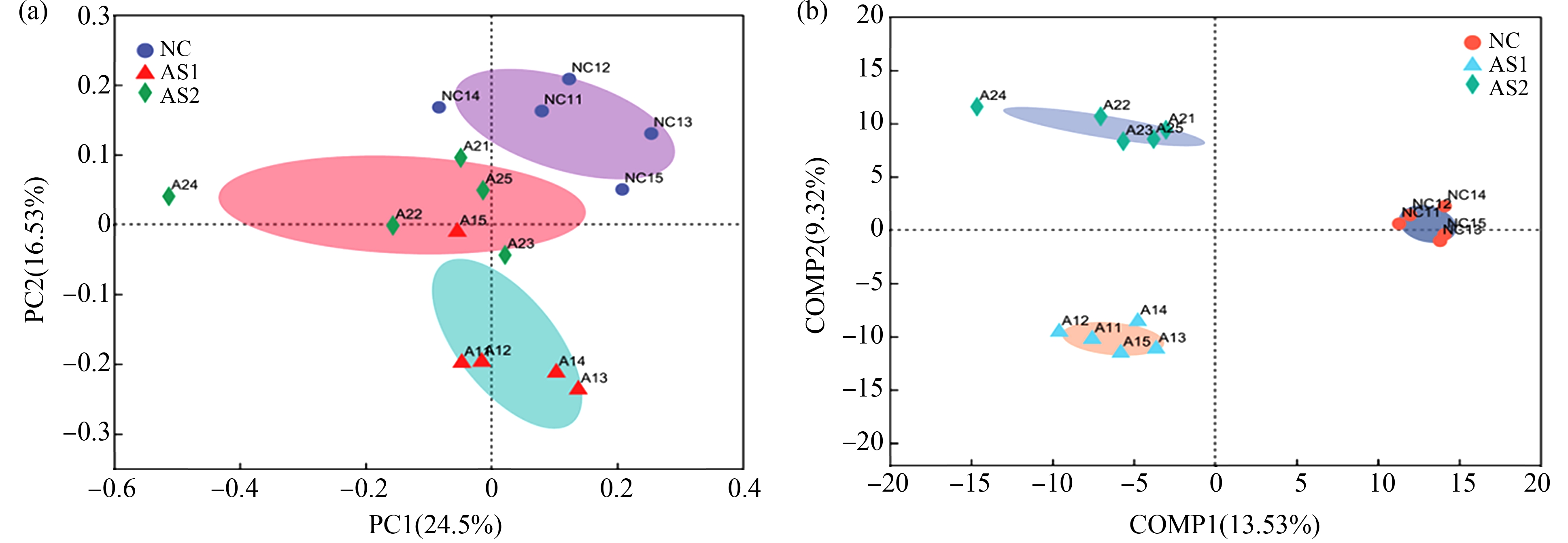
图6 大鼠肠道菌群PCoA和PLS-DA分析
注:(a) PCoA分析;(b) PLS-DA分析。
Fig. 6 Analysis of the PCoA and PLS-DA of intestinal microflora in rats
Note: (a) Analysis of the PCoA; (b) Analysis of the PLS-DA.
2.5 低砷对大鼠肠道菌群门水平组成的影响
所有样品均包含厚壁菌门(Firmicutes)、拟杆菌门(Bacteroidota)、Patescibacteria、放线菌门(Actinobacteriota),其中Firmicutes在各组肠道菌群含量最高,由图7(a)可知,3组中厚壁菌门的丰度逐渐减少,且具有时间依赖性,差异有统计学意义(P<0.05),AS1组与AS2组分别占90.31%和86.97%,低于NC组的96.65%;拟杆菌门的丰度随砷暴露时间增加,但差异无统计学意义(P>0.05);放线菌门在AS1组最高,占比2.13%,随着砷暴露的时间增加,丰度减少,占比0.50%,如图7(b)~(d)所示。
2.6 低砷对大鼠肠道菌群属水平组成的影响
大鼠肠道菌群主要由梭菌属(Clostridia)、Romboustia、脱硫弧菌属(Desulfovibrio)、丹毒丝菌(Erysipelotrichaceae)和Roseburia等组成。其中Roseburia、Anaerovoracaceae和Blautia的丰度随砷暴露的时间增加而显著下降(P<0.05);在AS1组中双歧杆菌(Bifidobacterium)、Romboutsia的丰度有升高的趋势,但砷暴露时间增加,其丰度显著降低(P<0.05);与NC组相比较,Erysipelotrichaceae、Quinella、Muribaculaceae、Desulfovibrio、Faecalibaculum、Clostridium_sensu_stricto_1和Lachnoclostridium的丰度有升高的趋势,随着砷暴露时间的增加,AS2组中Erysipelotrichaceae、Quinella和Faecalibaculum的丰度显著增加,差异有统计学意义(P<0.05),如图8所示。各组大鼠肠道菌群结构存在差异,均有表达具有明显差异的菌群。LEfSe采用线性判别分析(LDA)来估算每个组分丰度对差异效果影响的大小。因此,本研究以LDA>3为筛选标准,其中,对照组有16个差异明显的菌群,主要以Firmictes、Lachnospirales为主;AS1组有15个表达具有明显差异的菌群,包括Actinobacteria、Bifidobacterium和Faecalibaculum等菌群;AS2组有差异的菌群10个,包括Quinella、Selenomonadaceae和Erysipelotrichaceae等,如图9所示。
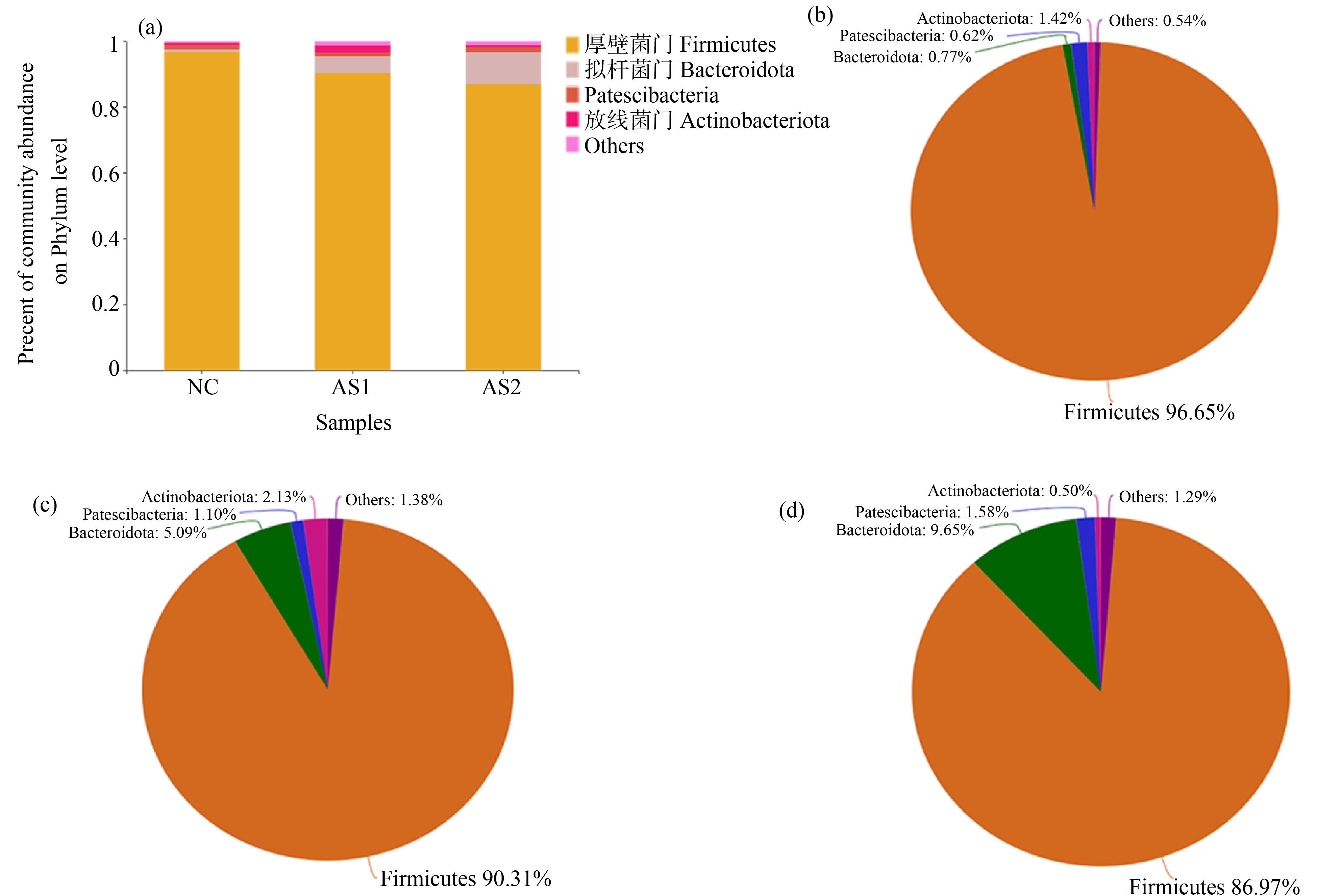
图7 大鼠肠道菌群在门水平的组成
注:(a) 各组菌群门水平的组成;(b) 对照组菌群的占比;(c) AS1组菌群的占比;(d) AS2组菌群的占比。
Fig. 7 Composition of the rat gut microbiota at the phylum level
Note: (a) The composition of the microbiota in each group at the phylum level; (b) The proportion of the microbiota in the control group; (c) The proportion of the microbiota in the AS1 group; (d) The proportion of the microbiota in the AS2 group.

图8 大鼠肠道菌群在属水平的组成
注:(a) Romboustia和Roseburia菌的丰度,(b) Bifidobacteriu和Anaerovoracaceae菌的丰度,(c) Clostridium _sensu _stricto _1和Lachnoclostridium
菌的丰度,(d) Muribaculaceae和Blautia菌的丰度,(e) Quinella和Faecalibaculum菌的丰度,(f) Erysipelotrichaceae和Desulfovibrio菌的丰度;*表示与对照组相比P<0.05,**表示与对照组相比P<0.01。
Fig. 8 Composition of the rat gut microbiota at the genus level
Note: (a) Abundance of Romboustia and Roseburia, (b) Abundance of Bifidobacteriu and Anaerovoracaceae, (c) Abundance ofClostridium_sensu_stricto_1 and Lachnoclostridium, (d) Abundance of Muribaculaceae and Blautia, (e) Abundance of Quinella and Faecalibaculum, (f) Abundance of Erysipelotrichaceae and Desulfovibrio; *represents P<0.05 vs. control group, **represents P<0.01 vs. control group.
3 讨论(Discussion)
由于人类接触低水平砷污染的饮用水和食物,长期暴露在低砷环境中,从而引发疾病,同时关于肠道菌群的大量研究已经发现菌群与许多疾病的发生发展密切相关,因此,本研究采用亚慢性低剂量浓度亚砷酸钠染毒健康SD大鼠12周、16周,发现砷组的肠绒毛排列紊乱,间隙大,随着砷暴露时间的增加,有炎性细胞的浸润,并且结肠的长度显著缩短,结肠自身吸收的砷含量逐渐升高,这与肠炎的症状和体征相类似[15],提示低砷暴露随着时间的增加,导致结肠病理结构的改变,并伴有炎性反应的发生,这与孙宇婷等[16]的研究结果一致。然而,肠道经常暴露于酸、蛋白水解酶、饮食中的内源性化合物和微生物中,由于自身的防御和修复机制,仍保持强大的生理代谢功能[17],但当肠道定植抗力被破坏,或者肠道屏障被削弱时,发生细菌移位(肠道内活的细菌穿过肠道黏膜层进入固有层,侵入肠道以外的部位),可使有害微生物及其代谢产物从肠道进入血液,进而加重炎症和组织损伤[18]。肠系膜淋巴结是发生细菌移位最近的器官,因此,将肠系膜的淋巴结进行革兰氏阴性细菌培养,提示有细菌移位的现象发生,同时检测肝门静脉中内毒素的含量,随着砷暴露的时间增加,内毒素的含量显著增加,提示低砷暴露会导致肠道屏障削弱,加重结肠组织的损伤,发生肠漏现象。
内毒素本质是一种脂多糖,主要存在于革兰氏阴性菌的细胞壁中,革兰氏阴性菌裂解后,其通过细胞壁成分来发挥对宿主致病作用[19],在Mosca等[20]的研究中,发现某些基因敲除或基因缺陷的小鼠在无菌环境中处于健康状态,然而,当肠道菌群灌肠后发生肠道炎性反应。因此,肠道炎性反应与菌群失调有着密切的关系。本研究中低砷暴露大鼠12周、16周,肠道菌群的整体物种多样性无显著性差异,提示大鼠微生物群落可能对低浓度砷暴露不敏感,与Dheer等[21]的研究结果相同。根据PCoA和PLS-DA分析结果可知,砷暴露组和对照组之间有明显的聚类趋势,3组之间的菌群构成有显著差异,提示低砷暴露对大鼠的肠道菌群的构成是有影响的。从门水平上看,厚壁菌门是人体肠道微生态的优势菌门,是产生短链脂肪酸的能源生产原料。研究发现砷暴露组厚壁菌门的丰度均显著下降,而Potera[22]给小鼠喂含砷饮用水也导致厚壁菌门显著性减少。本研究还发现拟杆菌门的丰度与正常组相比逐渐升高,产生这一现象的原因可能是因为拟杆菌门中存在耐砷性菌群,当砷暴露时促使该类菌群丰度增加,相对厚壁菌门适应性抗砷能力提高,导致拟杆菌门数量增加。然而在Man等[23]的研究中发现拟杆菌门数量的增加,与革兰氏阴性细菌的LPS合成途径密切相关。

图9 LEfSe多级物种差异判别分析和LDA评分
注:(a) LEfSe多级物种差异判别分析;(b) LDA评分。
Fig. 9 Lefse multilevel species difference discriminant analysis and LDA score
Note: (a) Analysis of Lefse multilevel species difference discriminant; (b) LDA score.
丹毒丝菌(Erysipelotrichaceae)属于厚壁菌门,研究发现该菌群在疾病活动期的人体内呈上升的趋势,并且与促炎因子TNF-α呈正相关[24],Zagato等[25]的研究已证明Faecalibaculum菌能够促进肠道疾病的发生,在本研究中砷暴露组中的丹毒丝菌和Faecalibaculum菌丰度显著增加,呈时间依赖性。Wu等[26]构建的小鼠结肠炎模型中,脱硫弧菌(Desulfovibrio)的丰度增加,促进结肠炎症因子分泌增加,而在本实验中砷暴露后脱硫弧菌属的丰度显著升高,与文献结果一致。在疾病活动期,炎症性肠病患者的主要标志物Clostridium多样性降低,并且Quinella菌和梭菌属的关系密切[27],本研究结果显示,条件致病菌Clostridium_sensu_stricto_1、Lachnoclostridium和Quinella菌的丰度随砷暴露时间呈上升的趋势,结合LDA评分发现在砷暴露组中Faecalibaculum、Erysipelotrichaceae和Quinella菌的表达有明显的差异,提示肠道损伤及炎性反应的发生,可能和该类菌群有密切关系,其数量的增加促进了促炎因子的分泌水平。Roseburia、Anaerovoracaceae和Blautia等菌群均被认为是有益于肠道健康的菌群,能促进丁酸、乙酸等短链脂肪酸的产生[28],本研究发现砷暴露后该类菌群的丰度逐渐下降,随着暴露时间的增加,下降越明显。然而双歧杆菌是众所周知的有益菌,有趣的是,在本研究中AS1组双歧杆菌的丰度显著升高,随着暴露时间的增加,其丰度随之降低,提示双歧杆菌可能是耐砷性菌群,受到砷刺激后,数量大幅度增加,产生了调节砷毒性作用的代谢物来维护菌群的稳态,随着砷暴露时间的增加,肠道中砷含量增多,超出自我调节范围,病原菌丰度增加,双歧杆菌的丰度也随之降低,但双歧杆菌是否具有耐砷性还需进一步验证。
综上所述,本文通过低砷暴露模型初步探讨了亚慢性砷暴露对大鼠肠道菌群的影响,发现低砷可以扰乱肠道菌群的原有结构,使保护性菌群的丰度如Roseburia、Anaerovoracaceae和Blautia减少,增加Faecalibaculum、Erysipelotrichaceae和Quinella等条件致病菌的丰度,呈现时间依赖性增高,加剧肠道损伤,导致炎症反应的易发。然而在低砷暴露时间不长的情况下,肠道中可能含有耐砷性菌群,可以调节砷毒性来抵消轻微的炎症反应。
[1] Palma-Lara I, Martínez-Castillo M, Quintana-Pérez J C, et al. Arsenic exposure: A public health problem leading to several cancers [J]. Regulatory Toxicology and Pharmacology, 2020, 110: 104539
[2] 王宇泽, 谭超, 罗勇军, 等. 我国砷中毒的医学地理分布特点及防治措施研究进展[J]. 解放军预防医学杂志, 2020, 38(1): 103-105
[3] Erdei E, Shuey C, Pacheco B, et al. Elevated autoimmunity in residents living near abandoned uranium mine sites on the Navajo Nation [J]. Journal of Autoimmunity, 2019, 99: 15-23
[4] Ferrario D, Gribaldo L, Hartung T. Arsenic exposure and immunotoxicity: A review including the possible influence of age and sex [J]. Current Environmental Health Reports, 2016, 3(1): 1-12
[5] Yu H Y, Wu B, Zhang X X, et al. Arsenic metabolism and toxicity influenced by ferric iron in simulated gastrointestinal tract and the roles of gut microbiota [J]. Environmental Science & Technology, 2016, 50(13): 7189-7197
[6] 岳宏宇, 丛春莉, 李艳梅. 肠道微生态与肠道疾病关系的研究进展[J]. 中国真菌学杂志, 2020, 15(4): 240-243
[7] Ma Q T, Li Y Q, Wang J K, et al. Investigation of gut microbiome changes in type 1 diabetic mellitus rats based on high-throughput sequencing [J]. Biomedecine & Pharmacotherapie, 2020, 124: 109873
[8] Han Y, Park H, Choi B R, et al. Alteration of microbiome profile by D-allulose in amelioration of high-fat-diet-induced obesity in mice [J]. Nutrients, 2020, 12(2): 352
[9] Wang H Y, Zhou C L, Huang J X, et al. The potential therapeutic role of Lactobacillus reuteri for treatment of inflammatory bowel disease [J]. American Journal of Translational Research, 2020, 12(5): 1569-1583
[10] Chi L, Xue J C, Tu P C, et al. Gut microbiome disruption altered the biotransformation and liver toxicity of arsenic in mice [J]. Archives of Toxicology, 2019, 93(1): 25-35
[11] Gokulan K, Arnold M G, Jensen J, et al. Exposure to arsenite in CD-1 mice during juvenile and adult stages: Effects on intestinal microbiota and gut-associated immune status [J]. mBio, 2018, 9(4): e01418-e01418
[12] Chi L, Bian X M, Gao B, et al. The effects of an environmentally relevant level of arsenic on the gut microbiome and its functional metagenome [J]. Toxicological Sciences: An Official Journal of the Society of Toxicology, 2017, 160(2): 193-204
[13] Khanna S, Raffals L E. The microbiome in Crohn’s disease: Role in pathogenesis and role of microbiome replacement therapies [J]. Gastroenterology Clinics of North America, 2017, 46(3): 481-492
[14] Yu H N, Guo Z Z, Shen S R, et al. Effects of taurine on gut microbiota and metabolism in mice [J]. Amino Acids, 2016, 48(7): 1601-1617
[15] Pandurangan A K, Mohebali N, Norhaizan M E, et al. Gallic acid attenuates dextran sulfate sodium-induced experimental colitis in BALB/c mice [J]. Drug Design, Development and Therapy, 2015, 9: 3923-3934
[16] 孙宇婷, 徐焕华, 聂窈, 等. 雄黄及三氧化二砷对小鼠肠道菌群的初步探究[J]. 中国中药杂志, 2020, 45(1): 142-148
Sun Y T, Xu H H, Nie Y, et al. Preliminary study of Realgar and arsenic trioxide on gut microbiota of mice [J]. China Journal of Chinese Materia Medica, 2020, 45(1): 142-148 (in Chinese)
[17] Nicholson J K, Holmes E, Kinross J, et al. Host-gut microbiota metabolic interactions [J]. Science, 2012, 336(6086): 1262-1267
[18] Chi L, Lai Y J, Tu P C, et al. Lipid and cholesterol homeostasis after arsenic exposure and antibiotic treatment in mice: Potential role of the microbiota [J]. Environmental Health Perspectives, 2019, 127(9): 97002
[19] Lema tre N, Liang X F, Najeeb J, et al. Curative treatment of severe Gram-negative bacterial infections by a new class of antibiotics targeting LpxC [J]. mBio, 2017, 8(4): e00674-e00617
tre N, Liang X F, Najeeb J, et al. Curative treatment of severe Gram-negative bacterial infections by a new class of antibiotics targeting LpxC [J]. mBio, 2017, 8(4): e00674-e00617
[20] Mosca A, Leclerc M, Hugot J P. Gut microbiota diversity and human diseases: Should we reintroduce key predators in our ecosystem? [J]. Frontiers in Microbiology, 2016, 7: 455
[21] Dheer R, Patterson J, Dudash M, et al. Arsenic induces structural and compositional colonic microbiome change and promotes host nitrogen and amino acid metabolism [J]. Toxicology and Applied Pharmacology, 2015, 289(3): 397-408
[22] Potera C. Clues to arsenic’s toxicity: Microbiome alterations in the mouse gut [J]. Environmental Health Perspectives, 2014, 122(3): A82
[23] Man S M, Kaakoush N O, Mitchell H M. The role of bacteria and pattern-recognition receptors in Croh’s disease [J]. Nature Reviews Gastroenterology & Hepatology, 2011, 8(3): 152-168
[24] Kaakoush N O. Insights into the role of Erysipelotrichaceae in the human host [J]. Frontiers in Cellular and Infection Microbiology, 2015, 5: 84
[25] Zagato E, Pozzi C, Bertocchi A, et al. Endogenous murine microbiota member Faecalibaculum rodentium and its human homologue protect from intestinal tumour growth [J]. Nature Microbiology, 2020, 5(3): 511-524
[26] Wu F, Lei H, Chen G, et al. In vitro and in vivo studies reveal that hesperetin-7-glucoside a naturally occurring monoglucoside, exhibits strong anti-inflammatory capacity [J]. Journal of Agricultural and Food Chemistry, 2021, 69: 12753-12762
[27] Hamana K, Itoh T, Sakamoto M, et al. Covalently linked polyamines in the cell wall peptidoglycan of the anaerobes belonging to the order Selenomonadales [J]. The Journal of General and Applied Microbiology, 2012, 58(4): 339-347
[28] Xu F H, Cheng Y, Ruan G C, et al. New pathway ameliorating ulcerative colitis: Focus on Roseburia intestinalis and the gut-brain axis [J]. Therapeutic Advances in Gastroenterology, 2021, 14: 1-14