近年来,随着纳米科学技术的发展,纳米氧化铝(alumina nanoparticles, AlNPs)广泛应用于日常生活中,如生物医学[1]、涂料[2]和食品包装[3]等领域。由于使用的广泛性,含有AlNPs的材料在生产、加工和使用中会直接或间接地排入生产生活环境中,因此它们的毒性也备受关注。有研究发现,AlNPs可以穿过血脑屏障,在脑中蓄积且难以排出,对中枢神经系统造成损伤[4],AlNPs会引起仔鼠脑组织氧化应激及脑胆碱能神经递质的改变[5],鼻腔滴注AlNPs后对大鼠脑组织造成结构损伤,导致氧化应激和免疫炎症反应[6]。其他一些金属纳米颗粒也具有毒性,如早期暴露于纳米二氧化钛会通过抑制运动神经元轴突生长而对神经系统产生损伤[7],纳米二氧化硅作用于PC12细胞后可以降低细胞活力,诱导神经细胞死亡[8],提示纳米二氧化硅暴露可能对神经发育产生毒性。
Ⅱ型髓系细胞触发受体(triggering receptor expressed on myeloid cells 2, TREM2)是TREM2家族的一种免疫球蛋白样孤儿受体,该受体与配体结合后会激活一系列与免疫功能相关的下游细胞内信号级联反应[9]。全基因组测序发现编码蛋白质TREM2的基因点突变,特别是TREM2 R47H的变异与阿尔茨海默病(Alzheimer Disease, AD)、额颞叶痴呆(frontotemporal dementia, FTD)、帕金森病(Parkinson Disease, PD)和散发性肌萎缩侧索硬化症(amyotrophic lateral sclerosis, ALS)等疾病都高度相关。除了与神经退行性疾病的关联外,TREM2还被证明对大脑发育至关重要。TREM2具有免疫调节作用,在中枢神经系统中只表达于小胶质细胞,参与神经元存活、凋亡、突触修剪、甚至神经回路形成等生理活动[10]。最近的研究发现,TREM2缺陷小鼠突触密度增加,表明TREM2控制小胶质细胞的突触修剪,TREM2缺失的3月龄小鼠,神经元连接改变,出现自闭症谱系疾病样行为表现[11]。但关于TREM2是否在生命早期的神经发育中起作用还不清楚,为了阐明AlNPs的神经毒性以及trem2基因在早期神经发育中的作用,本研究通过敲低trem2基因,并在此基础上暴露AlNPs,观察斑马鱼幼鱼的行为学、基因改变和生化指标等,初步探讨trem2基因在AlNPs致神经发育障碍中的作用,为后续研究提供依据。
1 材料与方法(Materials and methods)
1.1 试剂和仪器
1.1.1 主要试剂
50 nm粒径AlNPs购自美国Sigma公司(分析纯,纯度为99.7%),TREM2 RNAi慢病毒试剂购自上海吉凯基因科技有限公司,超纯RNA提取试剂盒购自康为世纪有限公司,反转录试剂盒、荧光定量PCR试剂盒购自Takara公司(日本),基因引物序列购自赛默飞世尔科技有限公司。超氧化物歧化酶(superoxide dismutase, SOD)测定试剂盒购自南京建成生物工程研究所,BCA(bicinchonininc acid)蛋白定量试剂盒、鱼乙酰胆碱酯酶(acetylcholinesterase, AChE)试剂盒购自上海江莱生物技术有限公司。
1.1.2 主要仪器
ESEN-AW-SS1斑马鱼养殖系统(北京爱生,中国),RO5O循环净水机(Heal Force,中国香港),Nano-ZS90纳米粒度仪(Malvern Paralytical,英国),JEM-100CX透射电子显微镜(日本电子株式会社),ZXSR-1090真彩触摸屏生化培养箱(上海智城,中国),EthoVison XT10动物运动跟踪系统(Noldus Information Technology,荷兰),SYS-820显微注射系统、P-97型玻璃微电极拉制仪(WPI公司,美国),SZX7体视显微镜、BX51倒置荧光屏数码显微镜(OLYMPUS,日本),5424 R低温高速离心机(Eppendorf,德国),SB25-12DTDN超声波清洗机(宁波新芝生物,中国),Image-Pro Plus图像分析软件(Media Cybernetics,美国),SpectraMax M 2全自动酶标仪(Bio Tek Instruments公司,美国),QuantStudio 3实时荧光定量PCR仪(ABI公司,美国)。
1.2 纳米颗粒的表征
将AlNPs溶于斑马鱼胚胎E3培养液(5 mmol·L-1 NaCl、0.17 mmol·L-1 KCl、0.33 mmol·L-1 CaCl2和0.33 mmol·L-1 MgSO4·7H2O,pH为7.2),悬浊液经过30 min超声混匀后,吸取少量液体滴到有炭膜的铜网上,待铜网干燥后,在透射电镜(transmission electron microscope, TEM)下观察粒子分散情况,加速电压为80 kV,用图像分析软件对图像进行平均粒径分析,用纳米粒度仪检测Zeta电位。
1.3 实验方法
1.3.1 实验动物
Tu系野生型斑马鱼购买于中国科学院水生生物研究所国家斑马鱼资源中心(武汉,中国)。斑马鱼养殖系统环境为:水温(28±1) ℃,导电率500~550 μS·cm-1,pH值为7.0~7.5,光照周期为光照14 h,黑暗10 h。每天规律喂食活体丰年虾2次。实验前一天晚上将亲鱼按比例(雌∶雄=1∶2)放入交配缸中,并加入养殖系统中的水。实验当天早晨开灯后拔去挡板,使雌鱼和雄鱼自然交配产卵并收集。
1.3.2 染毒液的配制
用天平称取(50.000±0.0001) mg的AlNPs溶于1 L配制好的E3胚胎培养液中,制备AlNPs悬浊液,所得染毒液的浓度为50 mg·L-1。使用超声波振动仪(100 W,30 kHz)将制备的染毒液超声30 min使其混匀备用。
1.3.3 显微注射及分组
收集1~4细胞期的斑马鱼胚胎于培养皿内,使用P-97型玻璃微电极拉制仪制备玻璃毛细管针,打开显微注射系统,在体视显微镜下将慢病毒注入胚胎的卵黄内(注射浓度为0.5×108 TU·mL-1,注射体积为500 pL,阴性对照组注射TREM2阴性对照慢病毒载体作为溶剂对照组)。将注射后的胚胎放入六孔板中,分为5组,每组30颗,每组设置3个平行,每天更换染毒液,共暴露144 h。实验分组分别为对照组(control)、阴性对照组(negative con)、TREM2敲低组(TREM2-)、纳米氧化铝组(AlNPs)和TREM2敲低+纳米氧化铝组(TREM2-/+AlNPs)。
1.3.4 形态学和生殖毒性实验
在 6 hpf(hours post-fertilization)时开始进行暴露,每天更换染毒液,染毒至144 hpf。染毒结束后记录斑马鱼的发育形态变化以及计数孵化、畸形和死亡情况。
1.3.5 行为学检测
自发运动实验:144 hpf暴露结束后,将24条幼鱼随机放入24孔板中,每孔随机放入一条正常发育的幼鱼。将24孔板放入行为学轨迹跟踪系统内,黑暗状态下适应1 min后开始实验,通过红外摄像机实时拍摄幼鱼3 min的运动视频。通过软件计算平均速度、移动距离、外圈停留时间时间百分比、绝对转角。通过分析上述指标的改变来说明幼鱼的运动能力。
惊恐逃避反射实验:144 hpf暴露结束后,将装有幼鱼的24孔板放入行为学轨迹跟踪系统内,黑暗状态下适应1 min后开始实验,通过红外摄像机实时拍摄幼鱼7 min的运动视频(设置光照周期为3 min黑暗期-1 min光照期-3 min黑暗期)。通过软件计算幼鱼光照期的速度变化来分析幼鱼的对光惊恐反应能力。
1.3.6 荧光定量PCR检测
144 hpf暴露结束后,每组取30条幼鱼置于2 mL的EP管中,使用Trizol法提取斑马鱼RNA,再用反转录试剂盒合成cDNA,按照荧光定量PCR试剂盒的操作步骤进行基因定量检测。引物序列如表1所示。
1.3.7 神经递质检测
144 hpf 暴露结束后,每组取30条斑马鱼幼鱼,用生理盐水制备匀浆上清液,BCA法进行蛋白定量,按试剂盒说明书测定幼鱼组织中乙酰胆碱酯酶(AChE)的活性。重复测定3次。
表1 基因引物序列信息
Table 1 The sequence information of gene primer

1.3.8 氧化应激检测
144 hpf暴露结束后,每组取30条斑马鱼幼鱼,用生理盐水制备匀浆上清液,BCA法进行蛋白定量,按试剂盒说明书测定幼鱼组织中超氧化物歧化酶(SOD)的活性。重复测定3次。
1.4 统计学分析
应用统计学软件SPSS26.0对数据进进行分析处理,实验结果采用均数±标准误(X±SEM)。使用Shapiro-Wilk test和Levene分别对数据进行正态性检验和方差齐性检验,采用单因素方差分析One-Way ANOVA和Tukey对数据进行分析比较。P<0.05为差异有统计学意义。
2 结果(Results)
2.1 AlNPs及其表征
如图1所示,AlNPs经超声混匀30 min后,将AlNPs在透射电子显微镜下观察,发现其呈球形且无明显大颗粒聚集现象,平均粒径为(67.46±14.70) nm,平均Zeta电位为(45.4±8.13) mV。

图1 纳米氧化铝颗粒(AlNPs)溶液在
透射电镜(TEM)下的分散情况
Fig. 1 Dispersion of alumina nanoparticles (AlNPs) solution under a transmission electron microscope (TEM)
2.2 斑马鱼幼鱼形态学和生殖毒性结果
144 hpf暴露结束后统计各组幼鱼的死亡率、孵化率和畸形率。结果发现各处理组不同时间段发育情况无明显差异。如图2所示,各处理组均出现畸形情况,畸形类型有:脊柱弯曲、尾部畸形、心包水肿和卵黄囊水肿等。如图3所示,各处理组的死亡率、孵化率和畸形率无统计学差异(P>0.05)。
2.3 AlNPs暴露影响斑马鱼幼鱼的自发运动能力
斑马鱼幼鱼在黑暗状态下的运动行为如图4所示。与对照组和阴性对照组相比,TREM2-组的平均速度降低(P=0.001)、移动距离减小(P=0.001)、外圈停留时间百分比降低(P=0.02)、绝对转角增大(P=0.01),差异显著;AlNPs组的平均速度降低(P=0.02)、移动距离减小(P=0.001)、外圈停留时间百分比降低(P=0.01)、绝对转角增大(P=0.002),差异显著;TREM2-/+AlNPs组的平均速度降低(P=0.001)、移动距离减小(P=0.001)、外圈停留时间百分比降低(P=0.001)、绝对转角增大(P=0.001),差异显著。与AlNPs组相比,TREM2-/+AlNPs组的平均速度降低(P=0.016)、移动距离减小(P=0.007)、外圈停留时间百分比降低(P=0.013)、绝对转角增大(P=0.041),差异显著。斑马鱼的运动轨迹如图5所示,在黑暗状态下,对照组表现出对周围环境进行探索性游动,而TREM2-组,AlNPs组和TREM2-/+AlNPs组表现出停滞,焦虑样行为,轨迹变得杂乱,没有规律。
2.4 AlNPs暴露导致斑马鱼幼鱼惊恐反应能力下降
斑马鱼幼鱼对光刺激的惊恐反射表现如表2所示。当受到光刺激时,各组幼鱼的速度(mm·s-1)均发生不同程度的降低。与对照组相比,TREM2-组、AlNPs组和TREM2-/+AlNPs组的速度明显降低(P=0.001),差异显著,具有统计学意义。
2.5 斑马鱼幼鱼TREM2基因表达下降
不同处理组的斑马鱼幼鱼体内TREM2基因的表达量如图6所示。通过计算得trem2基因的抑制率约为47%。与对照组和阴性对照组相比,TREM2-组(P=0.001,P=0.003),AlNPs组(P=0.001,P=0.024),TREM2-/+AlNPs组(P=0.001)的基因表达量都显著下降,具有统计学差异。与AlNPs组相比,TREM2-/+AlNPs组的基因表达量降低,差异显著,具有统计学意义(P=0.008)。

图2 斑马鱼幼鱼的畸形类型
注:SC表示脊柱弯曲;TM表示尾巴畸形;PE表示心包水肿;YSE表示卵黄囊水肿。
Fig. 2 Different types of malformations of zebrafish larvae
Note: SC indicates spinal curvature; TM indicates tail malformation; PE indicates pericardium edema; YSE indicates yolk sac edema.

图3 斑马鱼幼鱼死亡率、孵化率和畸形率(N=12)
Fig. 3 Hatching rate, mortality rate and deformity rate of zebrafish larvae (N=12)
表2 斑马鱼幼鱼对光惊恐反射的速度变化(N=24,X±SEM)
Table 2 Changes of panic escape reflex velocity of zebrafish larvae under illumination (N=24, X±SEM)

组别Group黑暗期(3 min)/(mm·s-1)Dark period (3 min)/(mm·s-1)光照期(1 min)/(mm·s-1)Illumination period (1 min)/(mm·s-1)黑暗期(3 min)/(mm·s-1)Dark period (3 min)/(mm·s-1)Control4.27±0.252.14±0.163.69±0.21Negative con3.91±0.201.68±0.093.58±0.15TREM2-2.39±0.171.33±0.16a3.55±0.19AlNPs2.91±0.131.32±0.11a3.63±0.19TREM2-/+AlNPs2.10±0.161.05±0.13ab2.93±0.21
注:a表示与对照组相比,P<0.05;b表示与阴性对照组相比,P<0.05。
Note: a, compared with control group, P<0.05; b, compared with negative control group, P<0.05。

图4 斑马鱼幼鱼的运动行为
注:a表示与对照组相比,P<0.05;b表示与阴性对照组相比,P<0.05;c表示与AlNPs组相比,P<0.05。
Fig. 4 The motor behavior of zebrafish larvae
Note: a, compared with control group, P<0.05; b, compared with negative control group, P<0.05; c, compared with AlNPs group, P<0.05.

图5 斑马鱼幼鱼自发运动轨迹图
Fig. 5 Trajectory of spontaneous movement behavior of zebrafish larvae
2.6 斑马鱼幼鱼神经发育相关基因表达下降
不同处理组的斑马鱼幼鱼的神经发育基因的表达如图7所示。与对照组相比和阴性对照组相比,TREM2-组(P=0.001),AlNPs组(P=0.002,P=0.006)和TREM2-/+AlNPs(P=0.001)组的α1-tubulin基因的表达下降,差异显著;TREM2-组(P=0.001),AlNPs组(P=0.005,P=0.006)和TREM2-/+AlNPs(P=0.001)组的mbp基因表达下降,差异显著;TREM2-组(P=0.001),AlNPs组(P=0.005,P=0.006)和TREM2-/+AlNPs(P=0.001)组的syn2a基因表达下降,差异显著。与AlNPs组相比,TREM2-/+AlNPs组的α1-tubulin基因(P=0.018)、mbp基因(P=0.009)表达下降,差异显著,具有统计学意义。
2.7 斑马鱼幼鱼神经递质水平降低
不同处理组中斑马鱼幼鱼体内AChE活性如图8所示,与对照组和阴性对照组相比,TREM2-组、AlNPs组和TREM2-/+AlNPs组的AChE活性均有所下降,差异显著(P=0.001),具有统计学意义。与AlNPs组相比,TREM2-/+AlNPs组的AChE活性显著下降,差异显著(P=0.001),具有统计学意义。
2.8 斑马鱼幼鱼体内SOD活性降低
斑马鱼幼鱼体内SOD活性如图9所示。与对照组和阴性对照组相比,TREM2-组(P=0.001)、AlNPs组(P=0.046)和TREM2-/+AlNPs组(P=0.001)的SOD活性下降,差异有统计学意义。而与AlNPs组相比,TREM2-/+AlNPs组的活性降低(P=0.005),差异显著,具有统计学意义。
3 讨论(Discussion)
斑马鱼在生物医学研究中是一种重要的脊椎动物模型,作为替代传统哺乳动物实验的方法学尝试,因其和人类基因有着高度的同源性,且具有易于繁殖、快速的生长周期以及光学透明性等优点,斑马鱼已被用于毒理学[12-14]、遗传学[15-16]和药理学[17-18]等领域的研究。近年来,斑马鱼被广泛应用于神经毒性的研究[7, 19-21]。本研究以斑马鱼早期发育阶段为研究模型,探索AlNPs对斑马鱼幼鱼早期神经发育的影响以及TREM2基因在神经发育中的作用。
金属氧化物纳米颗粒的安全性一直备受关注,它的靶器官涉及人体各个组织器官,其中脑为主要的靶器官之一,它可以穿透血脑屏障,在脑内蓄积。有研究显示,氧化锌纳米颗粒可以对肝脏造成损伤[22];纳米氧化钕会导致心肌细胞凋亡而导致心脏毒性[23];纳米二氧化钛会抑制神经发育和运动神经元轴突生长[7]等。关于AlNPs的毒性研究发现,AlNPs可以引起大鼠脑内氧化应激损伤以及炎症反应[24]。AlNPs还可以降低大鼠的神经细胞活力,诱发神经细胞坏死[25]。本课题组研究发现,AlNPs可以诱导神经细胞发生凋亡,发生过度自噬、氧化损伤及多巴胺传递受损,影响学习记忆能力[26-30]。
近年来,TREM2成为神经退行性疾病的研究热点。研究发现TREM2的突变可能会导致小胶质细胞的功能异常,它能够通过调节小胶质细胞的吞噬能力,介导神经突触的重塑[31-32]进而引起神经系统疾病,说明其在脑组织损伤和修复过程中发挥着重要作用。在疾病状态下,TREM2介导小胶质细胞的吞噬功能受损,神经细胞零星的死亡过程中释放凋亡物质,组织碎片清除延迟,小胶质细胞产生的促炎因子增加,导致组织内环境稳态受破坏[33]。有研究指出TREM2与AD、FTD、PD和ALS等疾病都具有关联,在多囊性脂膜性骨发育不良伴硬化性白质脑病(polycystic lipomembranous osteodysplasia with sclerosing leukoencephalopathy, PLOSL)病人的脑中可以观察到轴突和髓鞘丢失,发现TREM2功能缺失突变会导致PLOSL病[34-36]。在PD模型中,TREM2缺陷会加重α-突触核蛋白诱导的细胞炎症反应以及神经元丢失[37]。上述研究表明TREM2在中枢神经系统稳定及神经发育中起着重要的作用。

图6 斑马鱼幼鱼体内TREM2基因的表达情况
注:a表示与对照组相比,P<0.05;b表示与阴性对照组相比,P<0.05;c表示与AlNPs组相比,P<0.05。
Fig. 6 Expression of TREM2 gene in zebrafish larvae
Note: a, compared with control group, P<0.05; b, compared with negative control group, P<0.05; c, compared with AlNPs group, P<0.05.

图7 斑马鱼幼鱼神经发育基因的表达情况
注:a表示与对照组相比,P<0.05;b表示与阴性对照组相比,P<0.05;c表示与AlNPs组相比,P<0.05。
Fig. 7 Expression of neural development genes in zebrafish larvae
Note: a, compared with control group, P<0.05; b, compared with negative control group, P<0.05; c, compared with AlNPs group, P<0.05.

图8 斑马鱼幼鱼神经递质水平
注:a表示与对照组相比,P<0.05;b表示与阴性对照组相比,P<0.05;c表示与AlNPs组相比,P<0.05。
Fig. 8 Neurotransmitter level in zebrafish larvae
Note: a, compared with control group, P<0.05; b, compared with negative control group, P<0.05; c, compared with AlNPs group, P<0.05.
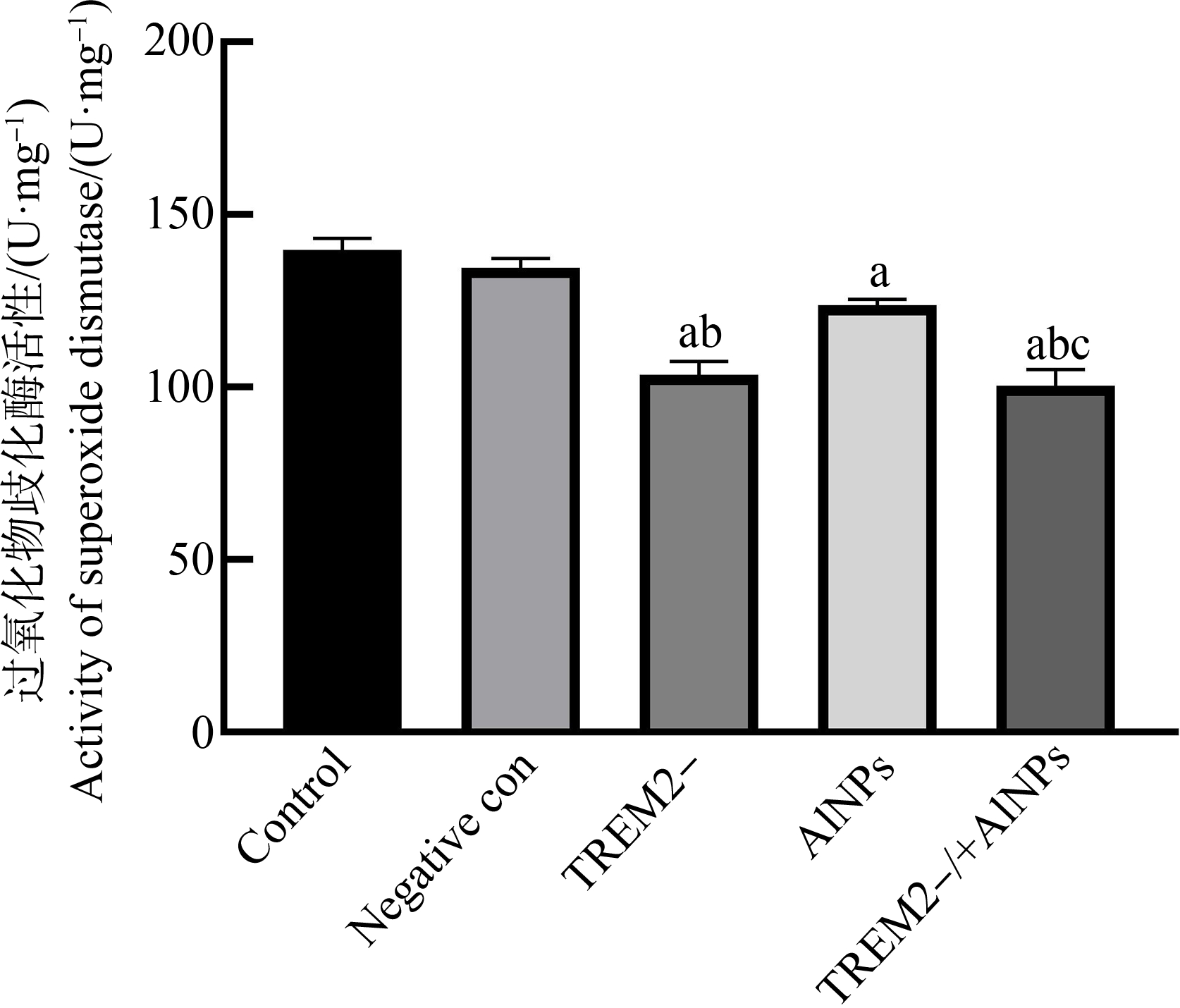
图9 斑马鱼幼鱼超氧化物歧化酶(SOD)活性
注:a表示与对照组相比,P<0.05;b表示与阴性对照组相比,P<0.05;c表示与AlNPs组相比,P<0.05。
Fig. 9 Superoxide dismutase (SOD) activity in zebrafish larvae
Note: a, compared with control group, P<0.05; b, compared with negative control group, P<0.05; c, compared with AlNPs group, P<0.05.
目前关于TREM2在疾病中作用的研究多是从疾病病理角度观察TREM2干预效果,因此,本研究从trem2基因干预角度出发,探索trem2基因对早期神经发育的影响,为进一步研究TREM2在中枢神经系统疾病中的作用提供依据。斑马鱼运动行为检测能够整体反映斑马鱼的运动及神经发育状况,通常通过平均速度、移动距离、外圈停留时间百分比、绝对转角和活跃度等指标进行综合性评估,在进入新环境中斑马鱼会对周围环境进行探索性游动,惊恐反应能力一般通过明暗交替刺激来评估,通常以运动速度来表示其反映能力,反映神经功能的调节作用。本研究结果显示,AlNPs会导致斑马鱼神经行为运动迟缓,运动速度和移动距离有明显的下降,对强光刺激的惊恐反应能力也出现下降,而trem2基因的缺失导致神经运动行为障碍变严重,这些结果与胡占英和张靖溥[38]的结果一致,表明trem2基因的敲低可能会加重AlNPs导致的神经发育毒性,造成幼鱼运动能力失调。髓鞘碱性蛋白(myelin basic protein, MBP)是髓鞘形成的标志物,α1微管蛋白(α1-tubulin)在轴突和树突的发育和再生中起着重要作用[39-41],而突触蛋白(synapsin, SYN)是一种神经磷蛋白质,在突触形成和神经递质释放过程中发挥重要作用,何梦婷等[42]发现暴露于溴乙酰胺后斑马鱼α1-tubulin、mbp和syn2a基因表达有不同程度的降低,Fu等[43]也发现斑马鱼暴露于双酚A后mbp和syn2a的基因和蛋白表达明显下调,本研究敲低trem2基因后发现这些基因的表达出现了不同程度的降低,表明trem2基因可能影响斑马鱼的神经发育功能。乙酰胆碱酯酶(AChE)是胆碱能神经传递的重要调节酶,它能水解递质乙酰胆碱(ACh),终止其作用,许多研究已经证明了胆碱能外周标记物在伴有神经功能障碍的疾病中的重要性,我们发现trem2基因的敲低及AlNPs会降低AChE的活性,提示机体的胆碱能神经传递受到了干扰。氧化应激是体内氧化与抗氧化作用失衡的一种状态,被认为是导致衰老和疾病的一个重要因素,当氧化损伤发生时,SOD的活性会受到抑制,H2O2和O2失衡,生成的H2O2不能被及时清除且与其他金属反应生成毒性更大的羟基,加重机体的氧化应激损伤[44]。本研究结果表明,AlNPs会诱导斑马鱼机体SOD活性下降,trem2基因的缺失也会导致SOD活性下降,表明机体清除自由基的能力下降,机体发生了氧化损伤。
综上所述,本研究通过行为学、神经发育相关基因、AChE活性及SOD活性,探讨了TREM2及AlNPs对斑马鱼神经发育毒性的作用,结果表明AlNPs可以通过氧化应激抑制斑马鱼幼鱼神经发育相关基因的表达和神经递质活性而引起神经发育毒性,而trem2基因的缺失会加重AlNPs对机体的氧化损伤和神经发育障碍,影响斑马鱼的发育。但本研究尚存在不足之处,如trem2基因与神经发育的具体分子作用机制还需进一步研究。
[1] 马小艺, 陈海斌. 纳米材料在生物医学领域的应用与前景展望[J]. 中国医药导报, 2006, 3(32): 13-15
[2] 咸才军, 郭保文, 关延涛. 纳米材料及其技术在涂料产业中的应用[J]. 新型建筑材料, 2001, 28(5): 3-5
[3] 杨龙平, 章建浩, 黄明明, 等. 纳米材料在食品包装中的应用及安全性评价[J]. 包装工程, 2015, 36(1): 19-23, 56
Yang L P, Zhang J H, Huang M M, et al. Application and safety evaluation of nanomaterial in food packaging [J]. Packaging Engineering, 2015, 36(1): 19-23, 56 (in Chinese)
[4] Shrivastava R, Raza S, Yadav A, et al. Effects of sub-acute exposure to TiO2, ZnO and Al2O3 nanoparticles on oxidative stress and histological changes in mouse liver and brain [J]. Drug and Chemical Toxicology, 2014, 37(3): 336-347
[5] 丁勇. 纳米氧化铝致小鼠神经发育毒性及其机制初探[D]. 太原: 山西医科大学, 2015: 29-32
Ding Y. The research of the developmental neurotoxicity and its mechanism induced by nano-alumina [D]. Taiyuan: Shanxi Medical University, 2015: 29-32 (in Chinese)
[6] 刘焕亮, 林本成, 房彦军, 等. 纳米氧化铝致中枢神经系统和多巴胺能神经元的毒性效应研究[C]. 银川: 中国毒理学会第四届中青年学者科技论坛, 2014: 18-19
[7] Gu J, Guo M, Huang C X, et al. Titanium dioxide nanoparticle affects motor behavior, neurodevelopment and axonal growth in zebrafish (Danio rerio) larvae [J]. The Science of the Total Environment, 2021, 754: 142315
[8] Wang F, Jiao C P, Liu J W, et al. Oxidative mechanisms contribute to nanosize silican dioxide-induced developmental neurotoxicity in PC12 cells [J]. Toxicology in Vitro, 2011, 25(8): 1548-1556
[9] Kleinberger G, Yamanishi Y, Suárez-Calvet M, et al.TREM2mutations implicated in neurodegeneration impair cell surface transport and phagocytosis [J]. Science Translational Medicine, 2014, 6(243): 243ra86
[10] 朱婷, 孙桂波, 孟祥宝, 等. 小胶质细胞/巨噬细胞的极化及在脑卒中修复中的作用[J]. 中国药理学通报, 2019, 35(8): 1046-1050
Zhu T, Sun G B, Meng X B, et al. Polarization of microglia/macrophages and its role in ischemic stroke repair [J]. Chinese Pharmacological Bulletin, 2019, 35(8): 1046-1050 (in Chinese)
[11] Jadhav V S, Lin P B C, Pennington T, et al. Trem2 Y38C mutation and loss of Trem2 impairs neuronal synapses in adult mice [J]. Molecular Neurodegeneration, 2020, 15(1): 62
[12] Coe T S, Hamilton P B, Griffiths A M, et al. Genetic variation in strains of zebrafish (Danio rerio) and the implications for ecotoxicology studies [J]. Ecotoxicology, 2009, 18(1): 144-150
[13] Cao Z G, Su M L, Wang H L, et al. Carboxyl graphene oxide nanoparticles induce neurodevelopmental defects and locomotor disorders in zebrafish larvae [J]. Chemosphere, 2021, 270: 128611
[14] Dai Y J, Jia Y F, Chen N, et al. Zebrafish as a model system to study toxicology [J]. Environmental Toxicology and Chemistry, 2014, 33(1): 11-17
[15] Driever W, Stemple D, Schier A, et al. Zebrafish: Genetic tools for studying vertebrate development [J]. Trends in Genetics, 1994, 10(5): 152-159
[16] Liu K L, Petree C, Requena T, et al. Expanding the CRISPR toolbox in zebrafish for studying development and disease [J]. Frontiers in Cell and Developmental Biology, 2019, 7: 13
[17] Barros T P, Alderton W K, Reynolds H M, et al. Zebrafish: An emerging technology for in vivo pharmacological assessment to identify potential safety liabilities in early drug discovery [J]. British Journal of Pharmacology, 2008, 154(7): 1400-1413
[18] van Dycke J, Cuvry A, Knickmann J, et al. Infection of zebrafish larvae with human norovirus and evaluation of the in vivo efficacy of small-molecule inhibitors [J]. Nature Protocols, 2021, 16(4): 1830-1849
[19] Zhu J S, Xia R, Liu Z W, et al. Fenvalerate triggers Parkinson-like symptom during zebrafish development through initiation of autophagy and p38 MAPK/mTOR signaling pathway [J]. Chemosphere, 2020, 243: 125336
[20] Wu C H, Lu C W, Hsu T H, et al. Neurotoxicity of fipronil affects sensory and motor systems in zebrafish [J]. Pesticide Biochemistry and Physiology, 2021, 177: 104896
[21] Kim J, Kim C Y, Song J H, et al. Trimethyltin chloride inhibits neuronal cell differentiation in zebrafish embryo neurodevelopment [J]. Neurotoxicology and Teratology, 2016, 54: 29-35
[22] 陈晓菲. 纳米ZnO对斑马鱼肝损伤及相关基因影响的研究[D]. 宁波: 宁波大学, 2013: 19-25
Chen X F. Damage effect of nano-ZnO on gene change of liver tissue of zebrafish (Danio rerio) [D]. Ningbo: Ningbo University, 2013: 19-25 (in Chinese)
[23] 陈昱, 舒凡, 许迎春, 等. 纳米氧化钕对斑马鱼胚胎发育的毒性效应[J]. 环境与健康杂志, 2020, 37(2): 122-125, 188
Chen Y, Shu F, Xu Y C, et al. Toxic effects of nano-neodymium oxide on embryo development of zebrafish [J]. Journal of Environment and Health, 2020, 37(2): 122-125, 188 (in Chinese)
[24] 李晓波. 金属氧化物纳米颗粒的神经毒性研究[D]. 武汉: 华中科技大学, 2008: 38-51
Li X B. Neurotoxicity of metal oxide nanoparticles [D]. Wuhan: Huazhong University of Science and Technology, 2008: 38-51 (in Chinese)
[25] 张勤丽, 李美琴, 徐丽, 等. 纳米氧化铝对动物神经行为改变的影响及神经细胞生存状态研究[C]. 大连: 全国生化/工业与卫生毒理学学术会议论文集, 2010: 268
[26] 葛翠翠, 李伟庆, 张勤丽, 等. 不同粒径纳米氧化铝对体外培养神经细胞凋亡的影响[J]. 环境与职业医学, 2012, 29(2): 72-76
Ge C C, Li W Q, Zhang Q L, et al. In vitro study on the effects of nano-aluminum oxide particles with various sizes on apoptosis of neuron cells [J]. Journal of Environmental & Occupational Medicine, 2012, 29(2): 72-76 (in Chinese)
[27] 陈金, 范蓉, 张萍, 等. 纳米氧化铝对斑马鱼幼鱼的神经毒性及mTOR基因的作用[J]. 环境与职业医学, 2019, 36(5): 431-437
Chen J, Fan R, Zhang P, et al. Al2O3 nanoparticles induced neurotoxicity and role of mTOR gene in zebrafish larvae[J]. Journal of Environmental and Occupational Medicine, 2019, 36(5): 431-437 (in Chinese)
[28] 王艳红. mTOR基因在纳米氧化铝诱导的斑马鱼生长发育障碍中的作用研究[D]. 太原: 山西医科大学, 2021: 16-31
Wang Y H. Role of mTOR gene in the growth and development of zebrafish induced by aluminum oxide nanoparticles [D]. Taiyuan: Shanxi Medical University, 2021: 16-31 (in Chinese)
[29] 陈金. 纳米氧化铝胚胎暴露致成年斑马鱼的学习和记忆能力进行性损伤[D]. 太原: 山西医科大学, 2020: 15-32
Chen J. Progressive impairment of learning and memory in adult zebrafish treated by Al2O3 nanoparticles when in embryos [D]. Taiyuan: Shanxi Medical University, 2020: 15-32 (in Chinese)
[30] 黄涛. PIK3C3/Vps34基因调控的自噬在纳米氧化铝致斑马鱼幼鱼神经发育毒性中的作用[D]. 太原: 山西医科大学, 2021: 13-26
Huang T. Role of autophagy regulated by PIK3C3/Vps34 gene in neurodevelopmental toxicity of zebrafish larvae induced by AlNPs [D]. Taiyuan: Shanxi Medical University, 2021: 13-26 (in Chinese)
[31] Wang Y M, Cella M, Mallinson K, et al.TREM2lipid sensing sustains the microglial response in an Alzheimer’s disease model [J]. Cell, 2015, 160(6): 1061-1071
[32] 李凌杰, 于晓琳, 刘瑞田. 胶质细胞介导的神经突触修剪在阿尔茨海默病中的作用[J]. 药学学报, 2021, 56(2): 383-390
Li L J, Yu X L, Liu R T. Synaptic pruning mediated by glia in Alzheimer’s disease [J]. Acta Pharmaceutica Sinica, 2021, 56(2): 383-390 (in Chinese)
[33] Neumann H, Takahashi K. Essential role of the microglial triggering receptor expressed on myeloid cells-2 (TREM2) for central nervous tissue immune homeostasis [J]. Journal of Neuroimmunology, 2007, 184(1-2): 92-99
[34] Paloneva J, Autti T, Raininko R, et al. CNS manifestations of Nasu-Hakola disease: A frontal dementia with bone cysts [J]. Neurology, 2001, 56(11): 1552-1558
[35] Paloneva J, Manninen T, Christman G, et al. Mutations in two genes encoding different subunits of a receptor signaling complex result in an identical disease phenotype [J]. The American Journal of Human Genetics, 2002, 71(3): 656-662
[36] Paloneva J, Kestilä M, Wu J, et al. Loss-of-function mutations in TYROBP (DAP12) result in a presenile dementia with bone cysts [J]. Nature Genetics, 2000, 25(3): 357-361
[37] Guo Y, Wei X B, Yan H, et al.TREM2deficiency aggravates α-synuclein-induced neurodegeneration and neuroinflammation in Parkinson’s disease models [J]. FASEB Journal: Official Publication of the Federation of American Societies for Experimental Biology, 2019, 33(11): 12164-12174
[38] 胡占英, 张靖溥. 长春新碱对斑马鱼神经发育和行为的影响[J]. 毒理学杂志, 2014, 28(2): 98-103
Hu Z Y, Zhang J P. Effects of vincristine on zebrafish neurodevelopment and behavior [J]. Journal of Toxicology, 2014, 28(2): 98-103 (in Chinese)
[39] Song Y Y, Kirkpatrick L L, Schilling A B, et al. Transglutaminase and polyamination of tubulin: Posttranslational modification for stabilizing axonal microtubules [J]. Neuron, 2013, 78(1): 109-123
[40] Jung S H, Kim S, Chung A Y, et al. Visualization of myelination in GFP-transgenic zebrafish [J]. Developmental Dynamics: An Official Publication of the American Association of Anatomists, 2010, 239(2): 592-597
[41] Fan C Y, Cowden J, Simmons S O, et al. Gene expression changes in developing zebrafish as potential markers for rapid developmental neurotoxicity screening [J]. Neurotoxicology and Teratology, 2010, 32(1): 91-98
[42] 何梦婷, 王伟, 许洁, 等. 氧化应激参与溴乙酰胺致斑马鱼胚胎神经发育毒性[J]. 环境与职业医学, 2021, 38(6): 586-592
He M T, Wang W, Xu J, et al. Role of oxidative stress in neurodevelopmental toxicity of bromoacetamide in zebrafish embryos [J]. Journal of Environmental and Occupational Medicine, 2021, 38(6): 586-592 (in Chinese)
[43] Fu J J, Guo Y Y, Yang L H, et al. Nano-TiO2 enhanced bioaccumulation and developmental neurotoxicity of bisphenol A in zebrafish larvae [J]. Environmental Research, 2020, 187: 109682
[44] 张立敏, 顾超, 安红梅. 氧化应激介导的细胞凋亡在阿尔茨海默病中的作用[J]. 医学综述, 2021, 27(9): 1685-1690
Zhang L M, Gu C, An H M. Role of oxidative stress-mediated apoptosis in Alzheimer’s disease [J]. Medical Recapitulate, 2021, 27(9): 1685-1690 (in Chinese)