本土模式生物(native model organisms)是用于实验研究的本土生物[1]。由于环境因素影响和地理区系分布的不同,同一物种的个体间可能会产生潜在的敏感性差异。以本土模式生物为实验对象,获得相关毒理学数据,能够评价化学品对本土生物可能造成的影响,确定适合当地的环境保护目标,体现环境保护的区域针对性[1]。因此,本土模式生物在环境保护领域的应用和推广受到越来越多国家的重视。在我国的化学品管理行业,也指明了主要的本土模式生物(如稀有鮈鲫、家蚕等),这对于保护区域生态环境具有重大意义。花翅摇蚊(Chironomus striatipennis Kieffer)隶属于双翅目(Diptera)摇蚊科(Chironomidea)摇蚊亚科(Chironominae Macquart)摇蚊属(Chironomus),适应于多种水域,广泛分布于我国各地[2],但经济合作与发展组织(Organisation for Economic Co-operation and Development, OECD)和美国环境保护局(United States Environmental Protection Agency, US EPA)等国外权威机构颁布的摇蚊水-沉积物毒性测试方法中尚未包含花翅摇蚊。此外,相对于其他摇蚊物种而言,花翅摇蚊的生命周期较短,实验室培养条件下(25 ℃),生命周期约为25 d,其生活史各阶段形态特征明显,物种的鉴定和遗传信息完备,已在国内多家实验室进行纯种培养。
作为本土模式生物,花翅摇蚊在相关研究领域中应用较为普遍。在生态毒理学研究方面,陈菲[3]研究汞和镉对花翅摇蚊幼虫的联合毒性发现在Hg2+和Cd2+的联合暴露可以诱导花翅摇蚊幼虫颏部的中间齿和侧齿均有不同程度的缺失,且对幼虫化蛹率有一定的抑制作用。钟文钰等[4]研究发现沉积物中五氯酚对花翅羽摇蚊幼虫的羽化具有延滞作用,而且对雌性摇蚊羽化的延滞作用大于雄性,最终导致羽化摇蚊的性别失衡。吴自豪等[5]研究证明沉积物中的全氟辛烷磺酸(PFOS)对花翅摇蚊的毒性效应显著,其96 h、10 d和21 d毒性试验中LC50分别为0.894、0.770和0.536 μg·g-1(以干质量计)。此外,Al-Shami等[6]研究重金属镉(Cd,0.1、1和10 mg·L-1)、铜(Cu,0.2、2和20 mg·L-1)和锌(Zn,0.5、5和50 mg·L-1)对四龄期花翅摇蚊的遗传毒性,幼虫处理24 h后,采用彗星试验对花翅摇蚊遗传毒性进行评价,结果表明,相对于Cu和Zn,最高浓度的Cd对花翅摇蚊幼虫的DNA损伤更大,三者对花翅摇蚊幼虫潜在遗传毒性为Cd>Cu>Zn。尽管前人的研究数据很多,但是针对花翅摇蚊的全生命周期毒性测试方法和多代繁殖毒性测试方法的相关研究还很有限,尚未形成标准化的测试体系。其中,上覆水类型有过滤自来水、暴晒除氯自来水、蒸馏水、M7和M4等,沉积物类型包括天然采集的沉积物和人工制备的沉积物[4, 7-10],饲喂摇蚊的食物有绿藻、螺旋藻粉和鱼食等[4, 7, 11],缺乏统一规范的标准化人工系统为研究结果的重现性作保障。另外,对于环境条件如温度、光照强度和湿度等对花翅摇蚊羽化、发育和繁殖等的影响,前人也做了详细的研究[12]。因此,推动和建立花翅摇蚊的标准化毒性测试体系具有一定的基础。
此外,2020年,我国新化学物质申报登记指南中规定常规登记需要提供的特殊要求数据中也增加了底栖生物慢性毒性试验(例如,沉积物-水体中摇蚊毒性试验:沉积物加标法等)[13]。因此,为了更好地服务于国家对新化学物质的管控,评估化学品的水-沉积物毒性,立足化学品对本土生物的生态效应,更好地保护区域生态环境,建立本土模式生物花翅摇蚊的水-沉积物标准化毒性测试体系很有必要。
本研究以花翅摇蚊为实验生物,以OECD标准方法中推荐的人工沉积物为试验基质,以去离子水为上覆水,以磨碎的鱼食粉末和绿藻为食物,重点关注水-沉积物系统中的耗时较长,且是幼虫羽化和发育的重要场所的人工沉积物。采用经平衡的人工沉积物和未经平衡的人工沉积物对花翅摇蚊一龄期幼虫的发育和羽化进行比较研究。此外,OECD标准方法中未涉及到雌雄性别比率的控制方法,由于雌雄性别比率的平衡在物种的生态和进化上具有重要意义,因此,研究通过对受精卵孵化初期幼虫的不同生长密度对摇蚊性别分化影响进行研究,得到适合花翅摇蚊卵串孵化初期的生长密度。最后,选取工农业生产中常用的典型的杀生剂敌草隆进行该测试体系中花翅摇蚊水-沉积物毒性的评估。敌草隆能够抑制植物光合作用发生,且具有一定的生物毒性,能够通过喷洒、涂刷后经地表径流进入河流,进而转运至沉积物中,在水-沉积物系统中普遍存在[14],具有一定的代表性。因此,通过加标上覆水法开展敌草隆对2代花翅摇蚊的生命周期毒性研究,对该系统能否满足标准方法的质控要求进行验证,为建立本土模式生物花翅摇蚊的水-沉积物毒性标准化测试方法系列奠定基础。
1 材料与方法(Materials and methods)
1.1 材料和试剂
草炭(德国大汉)、石英砂(70~140目)、高岭土(阿拉丁),无嘴烧杯(600 mL,定制),培养皿(底径18 cm),多孔道曝气装置(定制);搅拌机(KMM700,KENWOOD,英国),体式显微镜(Lumar V12,蔡司,德国),超高效液相色谱仪(UPLC)(AcquityTM H-class/PDA eλ Detection,Waters,美国),快速溶剂萃取仪(ASE350,DIONEX,美国),高速离心机(J-26XP,BECKMAN,美国)等;花翅摇蚊(来自上海市化工研究院,经上海市野生动植物鉴定中心鉴定)、饵料(O.S.I. Staple Granules微细颗粒);敌草隆(纯度98.0%,Sigma)、甲醇(色谱纯,Sigma)等。
1.2 水-沉积物中摇蚊毒性测试体系的建立
在参考《沉积物-水体中摇蚊生命周期毒性试验—水体加标法或沉积物加标法》(OECD No. 233)的基础上,本研究构建了花翅摇蚊毒性测试体系。该测试体系主要组成部分包括:水-沉积物人工系统、繁育装置、卵串孵化皿、曝气装置和加湿装置等(图1)。
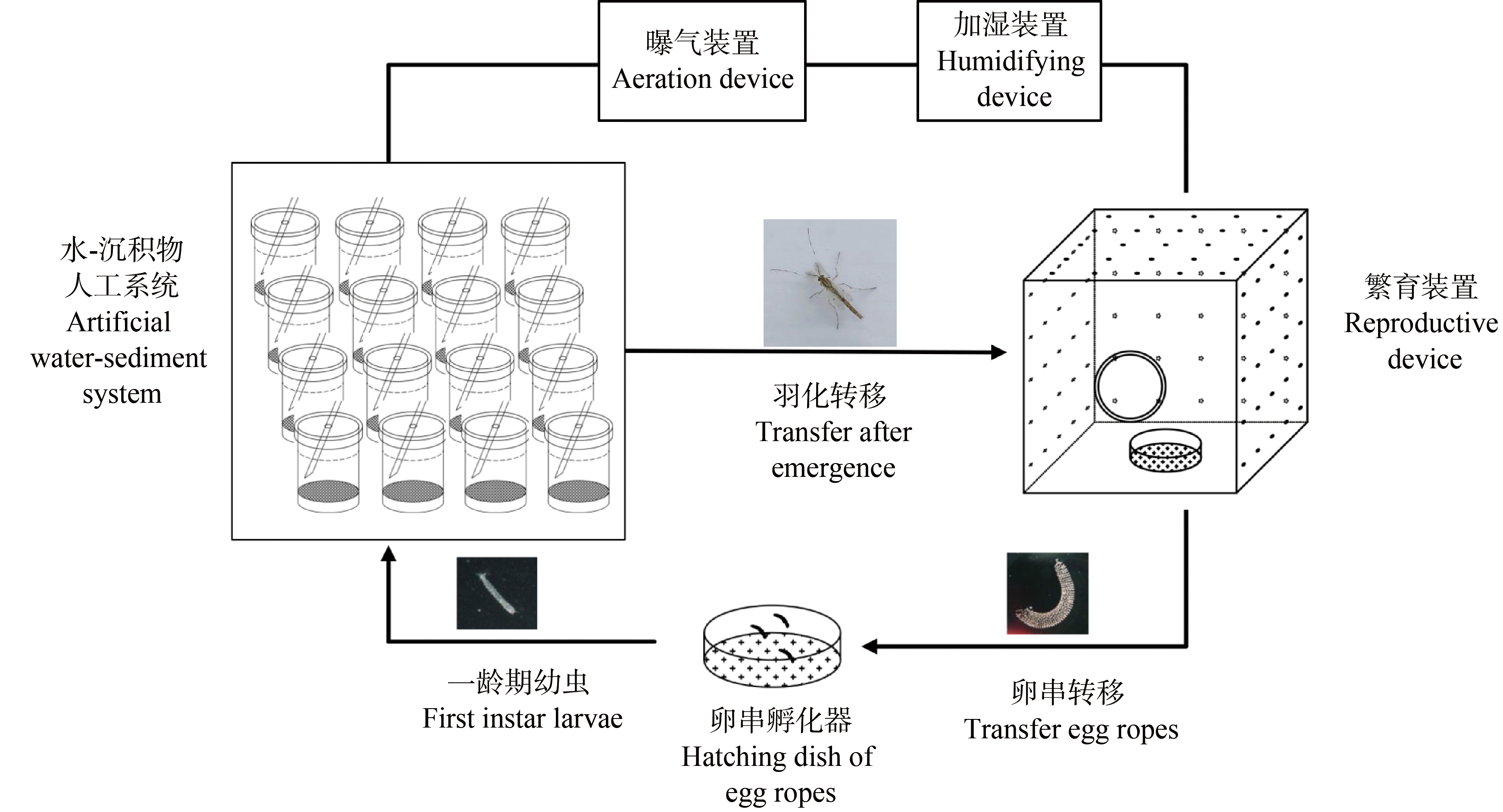
图1 水-沉积物中花翅摇蚊标准化毒性测试体系
Fig. 1 Standardised toxicity test system for Chironomus striatipennis Kieffer in water-sediment
在上述测试体系中,水-沉积物人工系统适用于花翅摇蚊一龄期至蛹的生长发育阶段;繁育装置(三面透气)能够满足成蚊婚飞、交配和产卵;卵串受精后将卵串移出至装有M4∶水=1∶1的培养液的培养皿中,按OECD推荐的标准量进行喂食,温和曝气,可以满足卵串的正常孵化[15]。
环境条件如下:温度为(25±1) ℃,环境湿度不小于60%,产卵期达到80%左右[12]。光暗时间比为16 h∶8 h,光照强度500~1 000 lx[15]。
针对水-沉积物系统制备过程中耗时较长的人工沉积物以及OECD标准方法中未涉及的受精卵孵化初期幼虫的不同生长密度对摇蚊性别分化的影响进行如下研究。
1.2.1 人工沉积物类型对花翅摇蚊羽化和发育的影响研究
配制A、B这2种不同类型的人工沉积物用于研究。
(1)A组人工沉积物的制备:将草炭置于玻璃蓝盖瓶内,按占沉积物总干质量40%的含水量加入一定体积的去离子水,制成草炭悬浮液,加盖搅拌48 h。按比例依次加入石英砂和高岭土,并搅拌均匀[15]。混合物的pH经测定满足6.5~7.5范围后注入适量去离子水,温和曝气,平衡一周弃去上覆水,测试沉积物含水量约为41%。将沉积物分装至无嘴烧杯中并加入新的上覆水,温和曝气,制成沉积物经平衡的人工沉积物组。
(2)B组人工沉积物的制备:按与A组沉积物相同含水量(占沉积物干质量比为41%)将人工沉积物各成分按比例搅拌均匀[15],混合物的pH经测定满足6.5~7.5范围后分装600 mL的无嘴烧杯中,注入适量上覆水,温和曝气,制成沉积物未经平衡的人工沉积物组。
将同一卵串孵化出的处于一龄期的花翅摇蚊幼虫转移至上述2组不同类型沉积物烧杯中,每组设置6个烧杯,每个烧杯转移20只。停止曝气24 h后继续曝气,每只幼虫每天喂食鱼食粉末0.5~1.0 mg[5]。每天观察并记录摇蚊幼虫的发育时间和羽化数量。同时在试验开始至羽化结束期间测试上覆水的pH。
此外,为评估2种类型的人工沉积物的均一性,随机选取5个点位适量取样,分别置于105 ℃下烘干1 h,冷却至室温后,测试各样品的总有机碳含量(total organic carbon, TOC)。
1.2.2 受精卵孵化初期的生长密度对摇蚊幼虫性别分化的影响研究
选取同一时间产出的、长度大小接近的摇蚊受精卵,体式显微镜下计数每条卵串均约含有430粒卵,分别将1/4条卵串(低密度组,0.42颗卵·cm-2)、1/2条卵串(中密度组,0.85颗卵·cm-2)、1条卵串(高密度组,1.69颗卵·cm-2)放进3个装有稀释的M4培养液的培养皿(底径18 cm)中,轻微曝气。24 h后,每个培养皿每天加入4 mL绿藻悬液。待幼虫发育至一龄期,将摇蚊幼虫转移至新配制的经平衡后的水-沉积物人工系统中,每个烧杯转移20只,轻微曝气,每只幼虫每天喂食鱼食粉末0.5~1.0 mg[15],观察羽化成蚊的雌雄性别比率。
1.3 敌草隆对花翅摇蚊毒性测试体系的评估
1.3.1 试验方法
依据《沉积物-水体中摇蚊生命周期毒性试验—水体加标法或沉积物加标法》(OECD No. 233)进行敌草隆对花翅摇蚊生命周期毒性试验,试验采用加标上覆水法进行。通过标准配方配制人工沉积物,平衡一周后弃上覆水,分装至每个饲养烧杯内,加入上覆水使得沉积物层与水层高度比为1∶4,每只烧杯移入20只幼虫,温和曝气,每隔一天喂食一次,饲喂标准为每只幼虫每天0.2~0.5 mg磨碎鱼食粉末。试验温度为(25±1) ℃,光暗时间比为16 h∶8 h,湿度不小于60%,产卵期达到80%左右[12]。敌草隆的试验暴露浓度依次为1.22、1.94、3.08、4.88、7.74和12.26 mg·L-1,每个浓度组设置4个平行,另设一个不引入实验生物的平行供试验开始化学分析。移入一龄期(孵化后2~3 d)摇蚊幼虫24 h后,根据浓度设置吸出相应量的上覆水,并加入等量的样品母液,亲代暴露开始。待摇蚊羽化时,每天至少转移一次成蚊至繁育箱内,并记录雌雄摇蚊的发育时间和羽化数量。箱内四角各放置一块蘸有饱和蔗糖水溶液的棉球供成年摇蚊吸食,每天转移成蚊产出的卵串(子一代)。卵串置于对应受试浓度的试验溶液中,轻微曝气,孵化后记录每串卵的孵化数量和卵串受精情况。子一代受精卵发育至一龄期时转移至新配制的水-沉积物系统中,以同样的方法进行相同暴露浓度下的生命周期毒性试验[15]。
试验开始时,取最低浓度组(1.22 mg·L-1)、中间浓度组(4.88 mg·L-1和7.74 mg·L-1)以及最高浓度组(12.26 mg·L-1)上覆水样,UPLC进样分析。试验结束后对相应浓度组上覆水、间隙水和沉积物进行取样分析。
1.3.2 敌草隆水-沉积物中摇蚊毒性测试体系中的分析研究
1.3.2.1 样品的采集与前处理
(1)上覆水样品的采集与前处理
取上述浓度组的上覆水样品,先后经过0.45 μm和0.22 μm的硝酸纤维滤膜过滤,每种孔径滤膜各过滤3次。
(2)间隙水样品的采集与前处理
将移除上覆水的沉积物转移至大号离心杯中,置于4 ℃的离心机内,以3 000 r·min-1的转速进行离心30 min,取出间隙水,先后经过0.45 μm和0.22 μm的微孔滤膜过滤,每种孔径滤膜各过滤3次。
(3)沉积物样品的采集与前处理
沉积物经离心去除间隙水后,取适量沉积物与无水硫酸钠混合,研磨并搅拌均匀后装入萃取池中,萃取池底部先放入一新的垫片,并装入一层薄薄的硅藻土。按照设定好的萃取程序进行快速溶剂萃取。
ASE萃取程序如下:系统压力1.03×107 Pa;温度40~200 ℃;加热时间15 min;静态时间5~25 min;溶剂为甲醇;冲洗体积80~150 mL;N2吹扫时间60~90 s;静态循环为2次。
由于温度是影响萃取效率的主要因素之一[16],故萃取条件的优化主要探索不同萃取温度对样品萃取效率的影响。设置萃取样品的温度分别为100 ℃、85 ℃和75 ℃,每个萃取温度下萃取2个沉积物制样品。
将最适萃取温度下萃取得到的敌草隆甲醇溶液,先后经过0.45 μm和0.22 μm的硝酸纤维滤膜过滤,每种孔径滤膜各过滤3次。
1.3.2.2 UPLC分析条件
超高效液相色谱分析条件:二级管阵列检测器(Acquity PDA eλ Detection);色谱柱为Waters UPLCTM BEH C18(50 mm×2.1 mm,1.7 μm);柱温为40 ℃;进样体积2 μL;流速0.4 mL·min-1;流动相A为超纯水,B为20%乙醇。梯度洗脱程序:0~0.5 min,B为20%;0.5~2.5 min,B由20%上升至100%,保持1 min;3.5~5.0 min,B由100%下降至20%;检测波长250 nm。
1.4 数据处理
试验观察获取花翅摇蚊的羽化率、发育速率、性别比例、繁殖力和孵化率,计算公式参见OECD No. 233。利用GraphPad Prism 5.0进行作图;通过SPSS17.0进行t检验(t-test)分析2组人工沉积物对花翅摇蚊羽化和发育的结果,分别进行显著性分析;利用单因素方差分析(one way-ANOVA)法对3种生长密度下摇蚊的性别比率进行组间显著性分析。
2 结果(Results)
2.1 水-沉积物中摇蚊毒性测试体系的建立
2.1.1 不同类型人工沉积物对花翅摇蚊幼虫羽化发育的影响
根据发育速率和羽化率的计算方法[15],统计2种人工沉积物中摇蚊幼虫的发育情况。2种人工沉积物中摇蚊幼虫发育和羽化结果统计如表1所示。
表1 花翅摇蚊羽化情况统计表
Table 1 The emergence number of Chironomus striatipennis Kieffer
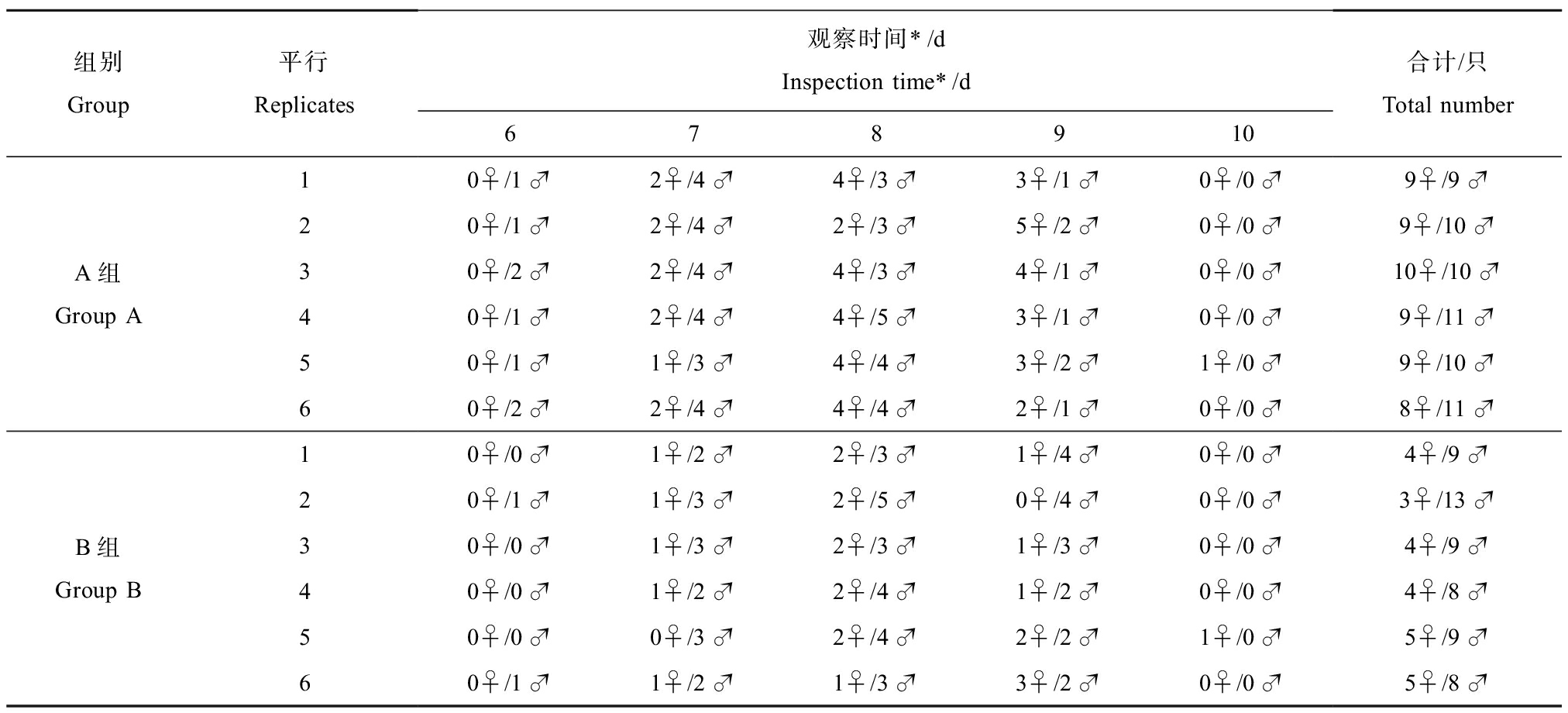
组别Group平行Replicates观察时间*/dInspection time*/d678910合计/只Total numberA组Group A10♀/1♂2♀/4♂4♀/3♂3♀/1♂0♀/0♂9♀/9♂20♀/1♂2♀/4♂2♀/3♂5♀/2♂0♀/0♂9♀/10♂30♀/2♂2♀/4♂4♀/3♂4♀/1♂0♀/0♂10♀/10♂40♀/1♂2♀/4♂4♀/5♂3♀/1♂0♀/0♂9♀/11♂50♀/1♂1♀/3♂4♀/4♂3♀/2♂1♀/0♂9♀/10♂60♀/2♂2♀/4♂4♀/4♂2♀/1♂0♀/0♂8♀/11♂B组Group B10♀/0♂1♀/2♂2♀/3♂1♀/4♂0♀/0♂4♀/9♂20♀/1♂1♀/3♂2♀/5♂0♀/4♂0♀/0♂3♀/13♂30♀/0♂1♀/3♂2♀/3♂1♀/3♂0♀/0♂4♀/9♂40♀/0♂1♀/2♂2♀/4♂1♀/2♂0♀/0♂4♀/8♂50♀/0♂0♀/3♂2♀/4♂2♀/2♂1♀/0♂5♀/9♂60♀/1♂1♀/2♂1♀/3♂3♀/2♂0♀/0♂5♀/8♂
注:* 表示移入一龄期摇蚊幼虫之后的时间。
Note: *is the time after the first instar larve transferred.
2组人工沉积物对花翅摇蚊羽化和发育的结果分别进行显著性分析,结果如图2所示。
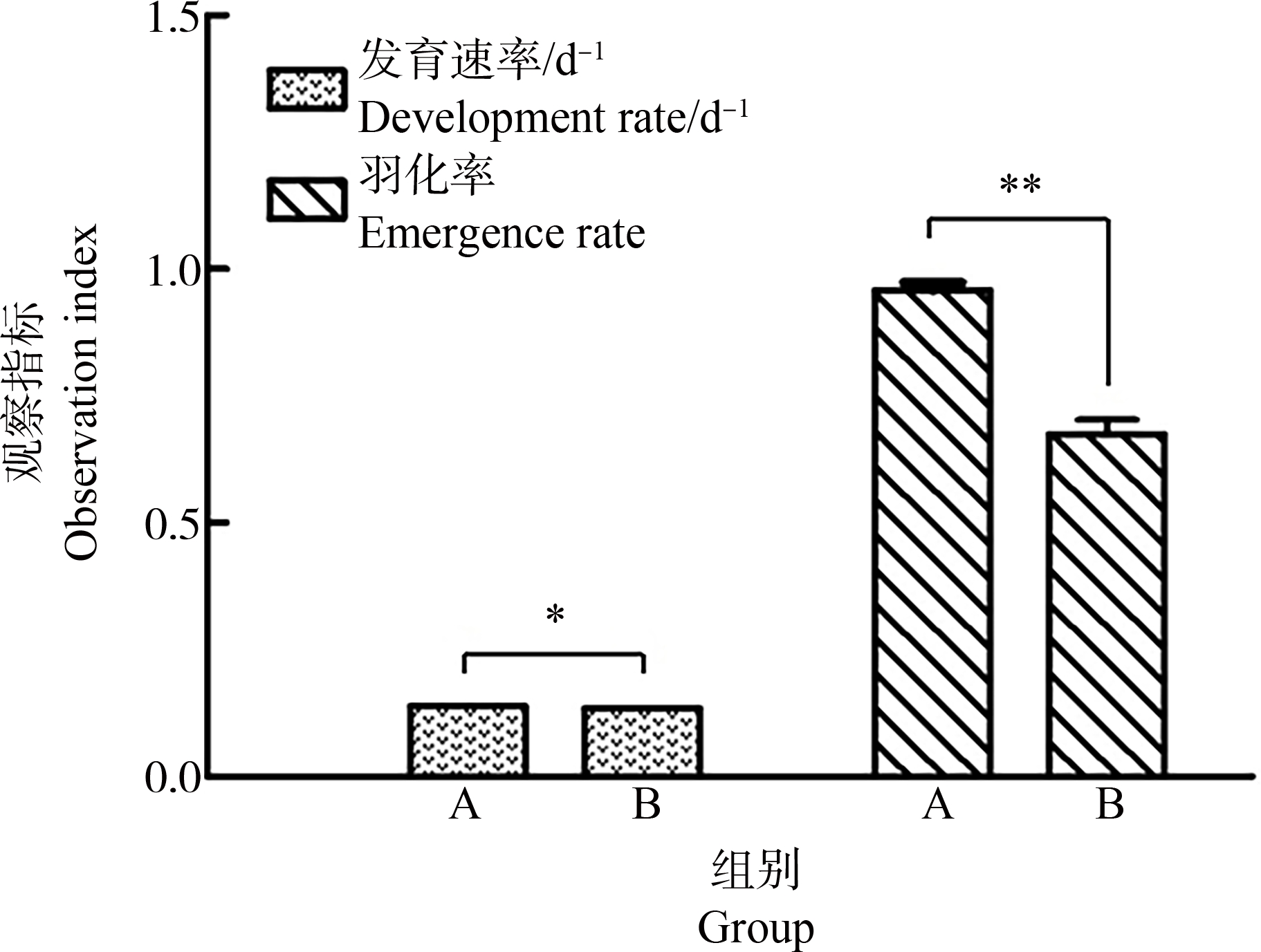
图2 不同类型人工沉积物对花翅摇蚊发育情况的影响
注:*表示P<0.05,**表示P<0.01。
Fig. 2 The influence of different types of artificial sediments on the development of Chironomus striatipennis Kieffer
Note: *represents P<0.05, **represents P<0.01.
由图2可知,A组人工沉积物中摇蚊幼虫的平均羽化率达95.8 %,显著(P=4.87×10-6)高于B组人工沉积物的67.5%,表明平衡后的人工沉积物更有利于摇蚊的羽化。此外,A组沉积物中摇蚊幼虫的平均发育速率同样显著(P=0.015)高于B组人工沉积物,分别为0.1387 d-1和0.1343 d-1,平均羽化时间分别为7.2 d和7.4 d。
2.1.2 上覆水pH及人工沉积物TOC测试结果
试验过程中水-沉积物体系中上覆水的pH及2种人工沉积物TOC测试结果如表2所示。
由表2可知,试验过程中A组上覆水的pH的变化范围为7.82~7.94,B组上覆水的pH的变化范围为6.70~7.85。尽管2种体系上覆水的pH变化满足标准方法中要求的6~9的范围,但是经平衡后的人工沉积物体系中上覆水的pH更加稳定,未经平衡的人工沉积物体系中上覆水的pH变化较大。TOC测试结果显示,2种人工沉积物TOC均满足方法要求的(2±0.5)%的有机碳含量范围,且经平衡后的人工沉积物TOC测试结果更加稳定,质地更加均一。
表2 上覆水pH与人工沉积物总有机碳(TOC)测试结果
Table 2 pH of overlying water and total organic carbon (TOC) test results of artificial sediment
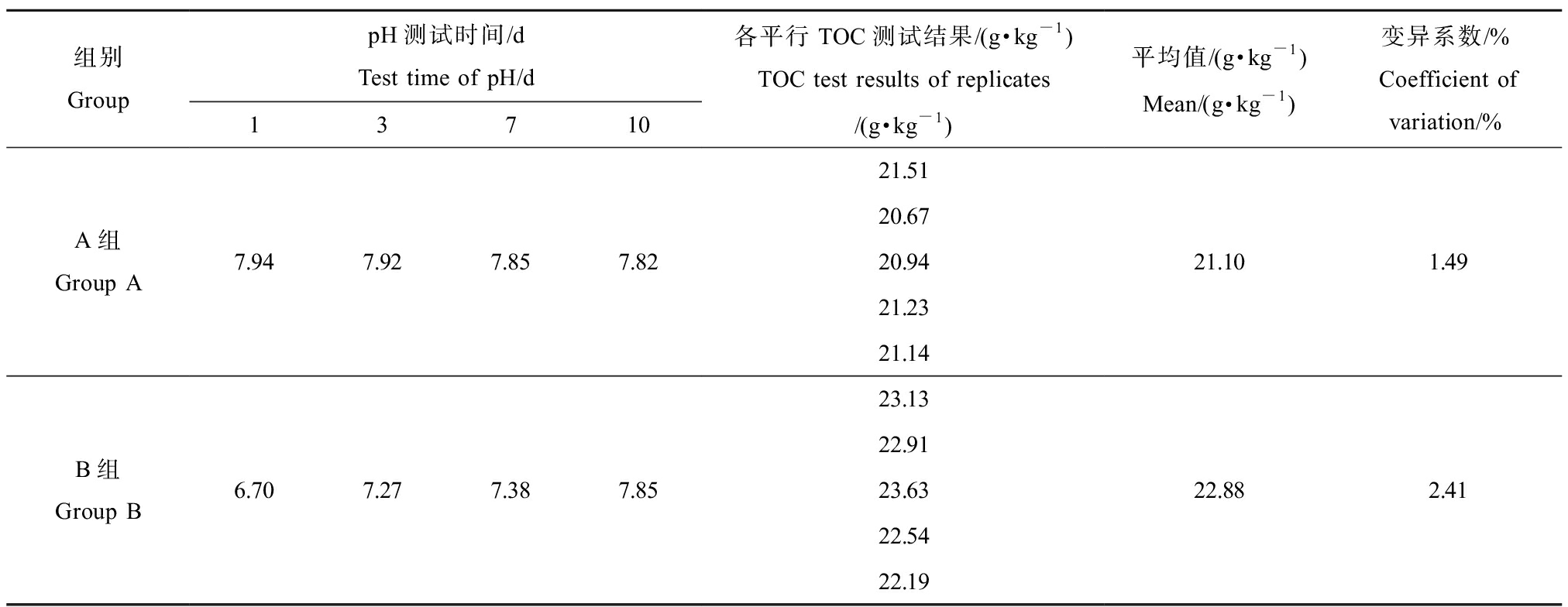
组别GrouppH测试时间/dTest time of pH/d13710各平行TOC测试结果/(g·kg-1)TOC test results of replicates/(g·kg-1)平均值/(g·kg-1)Mean/(g·kg-1)变异系数/%Coefficient ofvariation/%A组Group A7.947.927.857.8221.5120.6720.9421.2321.1421.101.49B组Group B6.707.277.387.8523.1322.9123.6322.5422.1922.882.41
2.1.3 卵串孵化初期生长密度对摇蚊幼虫性别分化的影响
研究结果表明,在受精卵孵化初期,随着摇蚊幼虫生长密度的增加,其雌雄性别比率逐渐降低,幼虫性别发育会向着能量消耗更低的雄蚊发育。卵串孵化初期生长密度对摇蚊幼虫性别分化的影响如表3所示。由表3可知,低密度组、中密度组和高密度组中的摇蚊雌雄性别平均比率分别为1.11、0.95和0.56,其中高密度组显著低于低密度和中密度组(P=0.002),表明摇蚊幼虫生长密度过高会显著影响其雌雄性别比率。
表3 孵化初期生长密度对摇蚊幼虫性别分化的影响
Table 3 Effects of growth density on sex differentiation of chironomid larvae at the beginning of hatching

组别Group各平行羽化摇蚊数量Number of emergence midges in four replicates1234雌蚊总数Total numberof female midges雄蚊总数Total numberof male midges雌雄性别平均比率Sex ratio (♀:♂)低密度组Low density group11♀/9♂10♀/10♂11♀/8♂9♀/10♂41371.11中密度组Medium density group10♀/9♂10♀/10♂9♀/11♂9♀/10♂38400.95高密度组High density group7♀/13♂6♀/13♂8♀/12♂7♀/12♂28500.56
2.2 敌草隆对摇蚊毒性测试体系的评估2.2.1 不同温度下敌草隆萃取结果
通过比较加速溶剂萃取过程中不同温度对萃取效率的影响结果可知,随着温度上升,敌草隆的回收率下降,尤其当温度达到100 ℃,回收率仅为48.6%(表4)。Tomlin[17]证明敌草隆在常温下(25 ℃)的蒸气压为1.1×10-7 MPa,说明其在常温下较稳定,推测是高温造成饱和蒸气压增大的缘故。因此,选取75 ℃作为萃取温度。
表4 不同温度下敌草隆萃取结果
Table 4 Extraction results of diuron in different temperature

受试物Chemical加标量/ngNominal amount/ng萃取温度/℃Extraction temperature/℃平均回收率/%Mean of recovery ratio/%相对标准偏差(RSD)/%Relative standard deviation (RSD)/%敌草隆Diuron50010048.64.55008580.75.25007594.94.8
2.2.2 方法验证
以20%甲醇配制敌草隆标准溶液,标准曲线范围为50 μg·L-1~10 mg·L-1,线性方程为Y=1.26e2X+2.59e3,相关系数(r)为0.99957。仪器的检出限为0.0500 μg·mL-1,信噪比为4.60。仪器的定量限为0.200 mg·L-1,信噪比为12.3。
对试验用水(空白)进行样品加标回收测试,空白无干扰。0.200 mg·L-1和8.00 mg·L-1加标样品的平均回收率分别为97.7%和95.4%,相对标准偏差(RSD)值分别为3.00%和1.29%。
对沉积物(空白)进行样品加标回收测试,空白无干扰。9.91 mg·kg-1和494 mg·kg-1加标样品的平均回收率分别为98.9%和86.9%,RSD值分别为8.50%和4.43%。
2.2.3 敌草隆在水-沉积物摇蚊毒性测试体系中的浓度分析结果及回收率
化学分析结果表明,敌草隆在试验终点时主要分布在上覆水和沉积物中,且沉积物中的敌草隆浓度高于上覆水中的浓度(表5)。
由表5可知,1.22、4.88、7.74和12.26 mg·L-1等试验组在试验开始时在水相的回收率分别为95.1%、96.7%、95.5%和97.5%。试验结束时,各组敌草隆在水-沉积物测试体系中的回收率分别为74.9%、87.1%、90.3%和94.3%。随着敌草隆加标浓度的逐渐增大,其在水-沉积物人工系统各相中浓度也逐渐增加,且样品的回收率逐渐增大。水-沉积物中摇蚊毒性测试体系中敌草隆的回收率基本达到85%以上。
表5 试验终点敌草隆在各相中的浓度
Table 5 Concentrations of diuron in each phase at endpoint

浓度组/(mg·L-1)Test group/(mg·L-1)平行Replicates上覆水/(μg·L-1)Overlying water/(μg·L-1)间隙水/(μg·L-1)Interstitial water/(μg·L-1)沉积物/(μg·kg-1)Sediment/(μg·kg-1)1.221439.232.161 4602420.333.981 5704.8812 486.9586.75 72022 498.5636.65 6607.7414 1061 189.38 83324 3791 198.39 06712.2617 430.32 403.113 60027 405.22 369.313 800
2.2.4 敌草隆对水-沉积物中花翅摇蚊的2代生命周期毒性研究结果
利用研究中构建的水-沉积物摇蚊毒性测试体系进行敌草隆对水-沉积物中花翅摇蚊的2代生命周期毒性研究。结果表明,在暴露结束后,2代花翅摇蚊在空白对照组的平均羽化率均为100%,>70%;空白对照组的2代花翅摇蚊完全羽化且存活的成蚊(雌性/雄性)性别比率分别为0.412/0.588(亲代)和0.4/0.6(子一代),满足平均性别比率0.4~0.6的范围;母代对照组中花翅摇蚊繁殖力以及卵串的受精率分别为0.848和0.893,均不低于0.6。各生物学试验终点均满足标准方法质控要求[16]。
敌草隆对水-沉积物中花翅摇蚊的2代生命周期毒性试验结果表明,敌草隆对花翅摇蚊生活史各阶段均能造成不利影响。敌草隆对2代花翅摇蚊羽化率的EC50值分别为7.56 mg·L-1和5.24 mg·L-1;敌草隆对2代花翅摇蚊发育率产生抑制效应的EC50分别为5 mg·L-1和4.33 mg·L-1。另外,经敌草隆暴露后,2代花翅摇蚊所产卵的孵化率均下降,EC50分别为2.53 mg·L-1和10.4 mg·L-1;敌草隆对2代花翅摇蚊的繁殖力均有抑制作用,亲代EC50值为1.99 mg·L-1,子一代EC50为2.68 mg·L-1[18]。
3 讨论(Discussion)
3.1 水-沉积物摇蚊毒性测试体系的研究
与未经平衡的水-沉积物体系相比,平衡后的体系中花翅摇蚊的羽化率和发育速率均有显著提高。分析2种体系之间的差异主要在于上覆水的pH和基质的均一性。有文献称草炭的温和搅拌能够稳定基质的pH值并建立稳定的微生物群[19]。试验过程中pH测试结果表明,2种水-沉积物体系中上覆水的pH在幼虫引入至羽化结束期间的变化范围均满足方法要求的上覆水pH 6~9的范围,这可能与人工沉积物成分明确、微生物类群单一有关系[16],但是未经平衡的人工沉积物体系在试验过程中上覆水的pH变化较大,经平衡的人工沉积物体系在试验过程中上覆水的pH基本上能维持稳定,说明草炭的悬浮对水-沉积物体系的平衡有一定的影响,平衡后的人工沉积物体系更加稳定。此外,草炭经悬浮后再与其他组分混匀制备成的人工沉积物,质地更加均一,在一定程度上能够降低对移入水-沉积物人工系统的一龄期摇蚊幼虫发生机械损伤的可能性,且花翅摇蚊幼虫有筑巢的习性,它们利用唾液腺分泌物将前原足收集来的植物碎屑、微细的砂粒等粘合起来建成“管型穴”,且摇蚊属幼虫喜爱软淤泥底质,均一的质地更有利于摇蚊幼虫在沉积物表面的筑巢和觅食行为[20]。因此,采用平衡后的人工沉积物构建的水-沉积物体系更有利于花翅摇蚊的羽化、发育以及筑巢行为。
在花翅摇蚊受精卵孵化初期,随着摇蚊幼虫生长密度的增加,其雌雄性别比率逐渐降低,幼虫性别发育会向着能量消耗更低的雄蚊发育,羽化出的成蚊雄性占比逐渐增加。Dawson等[21]对伸展摇蚊卵串初始密度开展研究发现,摇蚊雌雄性别比率随着卵串密度的增大而降低,适宜的卵串初始密度为1.0颗卵·cm-2,接近本研究中的中密度组(0.85颗卵·cm-2)。类似地,Devlin和Nagahama[22]研究认为,种群密度、食物资源和生态位可利用度等行为控制因素均会影响鱼的性别分化。Wernerus和Tessari[23]的研究结果表明,随着种群密度的增大,地中海原雌鱼类孔雀锦鱼中会产生初始阶段为雄性的个体。由此可见,在个体分化进程中的特殊阶段,种群密度对生物性别分化具有一定的影响。
3.2 敌草隆对摇蚊毒性测试体系的评估
敌草隆在水-沉积物摇蚊毒性测试体系中各相的浓度分析结果表明,敌草隆在试验终点时主要分布在上覆水和沉积物中,且沉积物中的敌草隆浓度高于上覆水中的浓度。从敌草隆的理化性质来看,敌草隆的亨利常数为5.1×10-5 Pa·m2·mol-1,表明其在水或者沉积物中是不挥发的。在土壤和沉积物中,敌草隆较低的挥发性和较高的土壤沉积物中有机组分分配常数(Koc),表明其具有较高的土壤和沉积物吸附能力[24]。另外,有研究表明敌草隆主要存在于海水中,最终归趋是海洋沉积物[25]。本研究所得结论与前人的研究结果是基本一致的[26-27]。此外,以平衡后的人工沉积物作为实验基质,采用快速溶剂萃取技术,经UPLC定量检测分析出敌草隆在水-沉积物系统中水相和沉积物相中的浓度,不仅简化了敌草隆在天然沉积物中复杂的前处理过程,同时,水-沉积物人工系统的建立,使得化学品的沉积物毒性研究日趋规范。敌草隆在水-沉积物测试体系中的回收率基本可达到85%以上,能够满足其在水-沉积物人工系统中的准确定量。
此外,加标上覆水法进行敌草隆对2代摇蚊生命周期毒性研究结果显示,敌草隆暴露对花翅摇蚊羽化、发育和繁殖等各阶段均能造成不利影响,其中在羽化和发育阶段可观察到敌草隆毒性的代际累积效应。其中,敌草隆对亲代花翅摇蚊羽化率的EC50值为7.56 mg·L-1,幼虫100%死亡浓度为12.26 mg·L-1。有研究表明,在没有人工沉积物的环境中,水体中敌草隆对伸展摇蚊一龄期幼虫发育10 d的LC50为3.3 mg·L-1,幼虫100%死亡浓度≥7.1 mg·L-1[28]。与作为OECD颁布的摇蚊水-沉积物毒性测试方法中推荐物种之一的伸展摇蚊(Chironomus tentans)相比,花翅摇蚊对敌草隆的敏感性与伸展摇蚊相差不大,因为本研究中所用的试验体系为水-沉积物体系,样品通过加标上覆水引入试验体系后,在水相和沉积物相的物质运输会逐渐稀释上覆水中敌草隆的浓度,最高暴露浓度组(12.26 mg·L-1)在试验结束时在上覆水中的实测浓度仅为7.4 mg·L-1。因此,在评价敌草隆对摇蚊的水-沉积物毒性时,花翅摇蚊的毒性数据同样具有重要的参考价值。花翅摇蚊作为本土模式生物,其相关毒理学数据更能够评价化学品对本土生物可能造成的影响,更加有利于本土环境的保护。此外,试验期间,空白对照组的羽化率、繁殖力以及卵串的受精率指标均满足OECD No. 233方法的质控要求,在化学品对花翅摇蚊的水-沉积物毒性评估方面能够逐步应用推广。
综上所述,经平衡后的人工沉积物适宜本土模式生物花翅摇蚊的繁育;卵串孵化初期生长密度为0.85颗卵·cm-2时能够适用于花翅摇蚊生命周期毒性测试。花翅摇蚊水-沉积物毒性标准化测试体系稳定可靠,可用于化学品对底栖生物的水-沉积物毒性评估。
[1] 周红, 郭琳琳, 卢玲, 等. 中国化学品环境管理对本土模式生物的需求和应用[J]. 生态毒理学报, 2017, 12(2): 11-19
Zhou H, Guo L L, Lu L, et al. Needs and application of native model organisms for Chinese chemical management [J]. Asian Journal of Ecotoxicology, 2017, 12(2): 11-19 (in Chinese)
[2] 姜永伟. 中国摇蚊属系统学研究[D]. 天津: 南开大学, 2011: 37-40
Jiang Y W. A systematic study on chironomid genus in China [D]. Tianjin: Nankai University, 2011: 37-40 (in Chinese)
[3] 陈菲. 汞和镉对花翅摇蚊幼虫(Chironomus kiinensis)的毒性效应[D]. 哈尔滨: 东北林业大学, 2017: 10-22
Chen F. Toxic effects of mercury and cadmium on Chironomus kiinensis larval [D]. Harbin: Northeast Forestry University, 2017: 10-22 (in Chinese)
[4] 钟文珏, 张瑜, 韩雨薇, 等. 沉积物中五氯酚对底栖生物的急慢性毒性效应[J]. 生态毒理学报, 2015, 10(1): 297-304
Zhong W J, Zhang Y, Han Y W, et al. Acute and chronic toxic effects of pentachlorophenol on the benthic organisms in sediments [J]. Asian Journal of Ecotoxicology, 2015, 10(1): 297-304 (in Chinese)
[5] 吴自豪, 张彦峰, 陈心悦, 等. 根据SSD推导PFOS沉积物质量基准及其在生态风险评估中的应用[J]. 环境科学研究, 2019, 32(9): 1448-1455
Wu Z H, Zhang Y F, Chen X Y, et al. Derivation of sediment quality criteria of PFOS based on SSD and its application in ecological risk assessment [J]. Research of Environmental Sciences, 2019, 32(9): 1448-1455 (in Chinese)
[6] Al-Shami S A, Rawi C S, Ahmad A H, et al. Genotoxicity of heavy metals to the larvae of Chironomus kiiensis Tokunaga after short-term exposure [J]. Toxicology and Industrial Health, 2012, 28(8): 734-739
[7] 赵燕, 汤保华, 蔡磊明, 等. 杀菌剂戊唑醇对花翅摇蚊(Chironomus kiiensis)幼虫的急性毒性和抗氧化酶系统的影响[J]. 农药, 2012, 51(6): 445-448, 460
Zhao Y, Tang B H, Cai L M, et al. The acute toxicity of tebuconazole to Chironomus kiiensis larval and its responses of antioxidant enzyme system [J]. Agrochemicals, 2012, 51(6): 445-448, 460 (in Chinese)
[8] 牛芳, 谢菲, 张健, 等. 2种取代苯对花翅摇蚊毒性和细胞色素P450酶活性的影响[J]. 安徽农业科学, 2015, 43(12): 113-116
Niu F, Xie F, Zhang J, et al. Toxicity of two substituted benzenes and their effects on cytochrome P450 activity of Chironomus kiinensis [J]. Journal of Anhui Agricultural Sciences, 2015, 43(12): 113-116 (in Chinese)
[9] 张丹, 陈增菊, 李谨谨, 等. 3种农药对花翅摇蚊毒力和AChE活性影响[J]. 安徽农业科学, 2014, 42(12): 3565-3567
Zhang D, Chen Z J, Li J J, et al. Study on toxicity and the effects of three pesticides on acetylcholinesterase activity of Chironomus kiinensis [J]. Journal of Anhui Agricultural Sciences, 2014, 42(12): 3565-3567 (in Chinese)
[10] 邓鑫, 台培东, 夏娜, 等. Cu2+对伸展摇蚊及黄色羽摇蚊幼虫的急性毒性研究[J]. 喀什师范学院学报, 2015, 36(3): 32-35
[11] 周素锐, 张文萍, 李少南, 等. 利用N-乙酰-β-D-氨基葡萄糖苷酶含量评价农药对花翅摇蚊种群发育的影响[J]. 生态毒理学报, 2015, 10(1): 288-296
Zhou S R, Zhang W P, Li S N, et al. Assessing the impact of pesticides on population development of Chironomus kiiensis based on content of β-N-acetyl-D-glucosaminidase [J]. Asian Journal of Ecotoxicology, 2015, 10(1): 288-296 (in Chinese)
[12] 孙兴滨. 摇蚊幼虫生态学特征及其在水处理过程中去除技术研究[D]. 哈尔滨: 哈尔滨工业大学, 2006: 44-50
Sun X B. Ecological characteristics of chironomid larvae and study on its removal in water treatment process [D]. Harbin: Harbin Institute of Technology, 2006: 44-50 (in Chinese)
[13] 中华人民共和国生态环境部. 新化学物质环境管理登记指南 [S]. 北京: 中华人民共和国生态环境部, 2020
[14] Bureau of Land Management. Diuron Ecological Risk Assessment [M]. Washingtong DC: Bureau of Land Management, 2005: 106
[15] Organisation for Economic Co-operation and Development (OECD). OECD 233. OECD Guidelines for Testing of Chemical, Sediment-Water Chironomid Life-Cycle Toxicity Test Using Spiked Water or Spiked Sediment [S]. Paris: OECD, 2010
[16] 唐晓伟, 何红巨, 宋曙辉, 等. 紫山药中花色苷的快速溶剂萃取[J]. 北方园艺, 2011(18): 144-147
Tang X W, He H J, Song S H, et al. Extraction of anthocyanin in purple yam by accelerated solvent [J]. Northern Horticulture, 2011(18): 144-147 (in Chinese)
[17] Tomlin C D S. The epesticide manual [DB/CD]. 13th ed. Alton (UK): British Crop Production Council (2005-2006), 2006
[18] 刘亚楠, 陈晓倩, 刘敏, 等. 防污漆活性物质敌草隆对两代摇蚊的生命周期毒性[J]. 生态毒理学报, 2017, 12(1): 193-200
Liu Y N, Chen X Q, Liu M, et al. Life-cycle toxicity of two generation Chironomus kiiensis induced by diuron used in antifouling paints [J]. Asian Journal of Ecotoxicology, 2017, 12(1): 193-200 (in Chinese)
[19] 王蕾, 张怡婷, 张圣新, 等. 环境条件对伸展摇蚊实验种群繁育的影响[J]. 生态学报, 2017, 37(21): 7152-7160
Wang L, Zhang Y T, Zhang S X, et al. Effects of environmental conditions on the reproduction and development of Chironomus tentans (Diptera) [J]. Acta Ecologica Sinica, 2017, 37(21): 7152-7160 (in Chinese)
[20] 王俊才, 王新华. 中国北方摇蚊幼虫[M]. 北京: 中国言实出版社, 2011: 30-31, 220
[21] Dawson T D, Jenson J J, Norberg-King T J. Laboratory culture of Chironomus tentans for use in toxicity testing: Optimum initial egg-stocking densities [J]. Hydrobiologia, 2000, 438(1-3): 251-256
[22] Devlin R H, Nagahama Y. Sex determination and sex differentiation in fish: An overview of genetic, physiological, and environmental influences [J]. Aquaculture, 2002, 208(3-4): 191-364
[23] Wernerus F M, Tessari V. The influence of population density on the mating system of Thalassoma pavo, a protogynous Mediterranean labrid fish [J]. Marine Ecology, 1991, 12(4): 361-368
[24] Giacomazzi S, Cochet N. Environmental impact of diuron transformation: A review [J]. Chemosphere, 2004, 56(11): 1021-1032
[25] Voulvoulis N, Scrimshaw M D, Lester J N. Partitioning of selected antifouling biocides in the aquatic environment [J]. Marine Environmental Research, 2002, 53(1): 1-16
[26] Barlas N, Akbulut N, ![]() M. Assessment of heavy metal residues in the sediment and water samples of Uluabat Lake, Turkey [J]. Bulletin of Environmental Contamination and Toxicology, 2005, 74(2): 286-293
M. Assessment of heavy metal residues in the sediment and water samples of Uluabat Lake, Turkey [J]. Bulletin of Environmental Contamination and Toxicology, 2005, 74(2): 286-293
[27] Dauval’ter V A. Effect of atmospheric emissions of the Vorkuta Industrial Region on the chemical composition of lake sediments [J].Water Resources, 2004, 31(6): 668-672
[28] Nebeker A V, Schuytema G S. Chronic effects of the herbicide diuron on freshwater cladocerans, amphipods, midges, minnows, worms, and snails [J]. Archives of Environmental Contamination and Toxicology, 1998, 35(3): 441-446