紫外线吸收剂广泛应用于个人护理用品,还被用于制造杀虫剂、农用化学品和药品,以及作为塑料、涂料和黏合剂的添加剂等[1],使用量较大,通过直接或间接排放,直接进入海洋环境,由于其高亲脂性,紫外线吸收剂很容易在生物体中积累,并可以通过食物链积累,对海洋生物造成潜在的影响。二苯甲酮(benzophenone-3, BP-3)是应用最为广泛的最常用一类紫外线吸收剂,据文献报道,在中国安徽巢湖及其入湖河水中,以BPs为主的紫外线吸收剂的总含量为162~587 ng·L-1[1]。西班牙大加那利岛周围6个海滩的沿海水域中,BP-3的浓度可达3 316.7 ng·L-1[2]。珊瑚礁区是人类海洋旅游活动的主要场所,其间生活有大量的小型雀鲷科热带鱼类。而黄尾蓝魔鱼(Chrysiptera parasema)生活在近岸岩石和珊瑚礁之间,是海南岛东岸珊瑚礁区的优势种[3]。典型紫外线吸收剂对珊瑚礁热带鱼类的生态毒性效应尚未见文献报道。
本研究以珊瑚礁鱼类黄尾蓝魔鱼为研究对象,通过环境水平的BP-3暴露,研究BP-3对黄尾蓝魔鱼的肝脏的生态毒理效应及其潜在的机制,筛选敏感的生物标志物,为评估紫外线吸收剂对珊瑚礁鱼类的潜在毒性及生态风险提供科学依据。
1 材料与方法(Materials and methods)
1.1 试剂
BP-3购自Sigma公司(纯度>99.8%)。超氧化物歧化酶(SOD)、过氧化氢酶(CAT)、丙二醛(MDA)、考马斯亮兰总蛋白和标准蛋白试剂盒均由南京建成生物工程研究所提供;逆转录试剂PrimeScript RT reagent Kit购自Takara公司,荧光定量PCR试剂FastStart Essential DNA Green Master购自Roche公司。
1.2 实验材料
选择颜色和体型相近,活泼健康的成年黄尾蓝魔鱼作为实验鱼,于缸中驯养1周。鱼体长(3.35±0.26) cm,体质量为(0.58±1.2) g,体表无伤痕、鳞片完整、体色鲜艳且体质健壮。将其装入容积为10 L玻璃缸中暂养,每缸放置15条鱼,水温(25.7±1) ℃,盐度为(36.85±1)‰,含氧量>5.41 mg·L-1,24 h曝气,光周期为14 h光,10 h暗;每日8:00和18:00点2次投喂鱼体质量1.5%的海水鱼配合饲料(粗蛋白质≥55.0%,粗脂肪>10.0%,粗纤维≤3.0%,粗灰分≤15.0%,总磷1.5%~3.0%,赖氨酸≥2.5%,水分≤10.0%,主要原料组成为磷虾粉、白鱼粉、鱼油、维生素、矿物质等),投喂30 min后,吸净鱼缸底部粪便并更换鱼缸内1/3水。
1.3 实验设计与样本采集
实验共分为3组,每组3个平行,每个平行15尾鱼,使用无水乙醇配制BP-3溶液,BP-3浓度分别设置为溶剂对照组CK (0.1%乙醇)、1 μg·L-1和10 μg·L-1,暴露时长为7 d,暴露期间用充氧泵24 h持续充氧。取样时将鱼使用冰水麻醉,待鱼无反应后,用蒸馏水冲洗鱼身3次,然后在冰上进行解剖取样,每个浓度3个平行,每个平行内随机选取3条黄尾蓝魔鱼肝脏,根据不同的实验要求分别存储。用于组织切片的完整肝脏置于4%多聚甲醛组织固定液中,抗氧化酶活性和基因测定的肝脏组织,于液氮中速冻,放入超低温冰箱保存以进行后续实验。
1.4 肝脏组织抗氧化酶的检测
称取肝脏组织0.1 g,按质量体积比加入9倍体积的冰冷生理盐水,用组织匀浆机10 000~15 000 r·min-1充分研磨,然后3 800 r·min-1离心15 min,吸取上清液备用。采用南京建成试剂盒测定SOD活性、CAT活性和MDA的含量。
1.5 肝脏组织结构观察
采集黄尾蓝魔鱼肝脏组织经4%多聚甲醛固定24 h后,梯度酒精脱水,二甲苯透明,石蜡包埋处理,切片,HE染色,观察肝脏显微结构变化。
1.6 肝脏组织总RNA的提取和定量测定
按照Trizol说明书提取肝脏组织的总RNA,提取的RNA保存于-40 ℃低温冰箱中,或立即用于反转录。反转录时,按照Takara Prime Script TM RT reagent Kit反转录试剂盒说明书,取2.0 μg上述纯化的总RNA加入2×RT Buffer 10 μL、20×RT Enzyme Mix 1 μL、Nuclease-free H2O补足至20 μL,置于PCR仪内37 ℃ 15 min,95 ℃反转录灭活15 s,反应结束后所得cDNA用于定量PCR。按照FastStart Essential DNA Green Master定量试剂盒说明书,依次往定量PCR管加入下列试剂(20 μL体系):H2O 0.8 μL、引物(正向引物和反向引物共8.2 μL)、cDNA 1 μL、Master mix 2×conc 10 μL,混匀离心后在Real-time PCR仪上反应检测,反应程序如下:95 ℃变性5 min,95 ℃ 30 s,75 ℃ 20 s,60 ℃ 10 s,重复45个循环;反应结束绘制熔解曲线。利用2-△△Ct法对基因表达进行相对定量,试验中所用引物序列如表1所示。
表1 黄尾蓝魔鱼抗氧化基因引物序列
Table 1 Primer sequences for antioxidant genes in Chrysiptera parasema
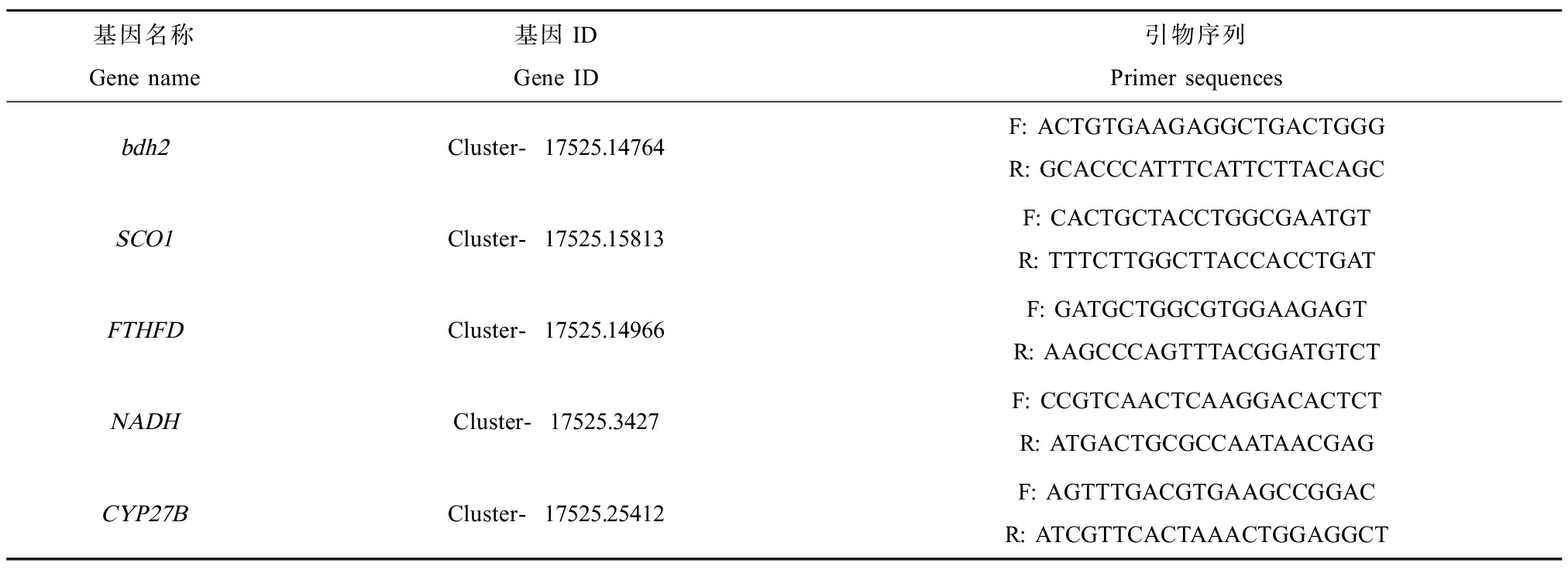
基因名称Gene name基因IDGene ID引物序列Primer sequencesbdh2Cluster-17525.14764F: ACTGTGAAGAGGCTGACTGGGR: GCACCCATTTCATTCTTACAGCSCO1Cluster-17525.15813F: CACTGCTACCTGGCGAATGTR: TTTCTTGGCTTACCACCTGATFTHFDCluster-17525.14966F: GATGCTGGCGTGGAAGAGTR: AAGCCCAGTTTACGGATGTCTNADHCluster-17525.3427F: CCGTCAACTCAAGGACACTCTR: ATGACTGCGCCAATAACGAGCYP27BCluster-17525.25412F: AGTTTGACGTGAAGCCGGACR: ATCGTTCACTAAACTGGAGGCT
1.7 数据统计分析
各组数据均采用平均数±标准误(Mean±SEM)表示,数据采用SPSS 22.0单因素方差分析(ANOVA),Tukey比较,P<0.05为差异显著,P<0.01为差异显著。采用GraphPad Prism 8软件绘图。
2 结果(Results)
2.1 BP-3胁迫对黄尾蓝魔鱼肝脏组织结构的影响
肝脏组织结构变化如图1所示,对照组肝细胞大小均匀,排列规则,肝小叶结构正常,肝脏中脂泡规则(图1(a))。经过BP-3胁迫后,低浓度组(1 μg·L-1)肝细胞体积显著扩大,肝脏脂泡变小逐渐不规则化,细胞核移向细胞边缘,出现少量肝固缩、核碎裂的现象(图1(b))。高浓度组(10 μg·L-1)肝细胞分布不均匀,细胞核破裂和固缩细胞增多,肝部出现充血现象,组织染色加深,脂泡面积显著减少,部分已溶解(图1(c)),肝脏受损程度随染毒浓度增加而加大。
2.2 BP-3胁迫对黄尾蓝魔鱼肝脏抗氧化酶活性的影响
BP-3对肝脏抗氧化酶的影响如图2所示。由图2(a)可知,染毒7 d后,与对照组相比,不同浓度处理组(1 μg·L-1和10 μg·L-1)SOD酶活性呈下降的趋势,并表现出一定剂效关系,但与对照组相比均没有显著性差异(P>0.05)。
染毒7 d后,低浓度暴露组(1 μg·L-1)CAT酶的活性没有受到明显影响,如图2(b)所示。而高浓度暴露组(10 μg·L-1)CAT酶的活性受到抑制,但与对照组相比没有显著性差异(P>0.05)。
MDA含量染毒后呈现出不同的反应模式,如图2(c)所示,呈现“先升后降”的趋势。在低浓度暴露组(1 μg·L-1),MDA含量被显著诱导(P<0.01),高浓度暴露组(10 μg·L-1),MDA含量也明显升高(P>0.05)。
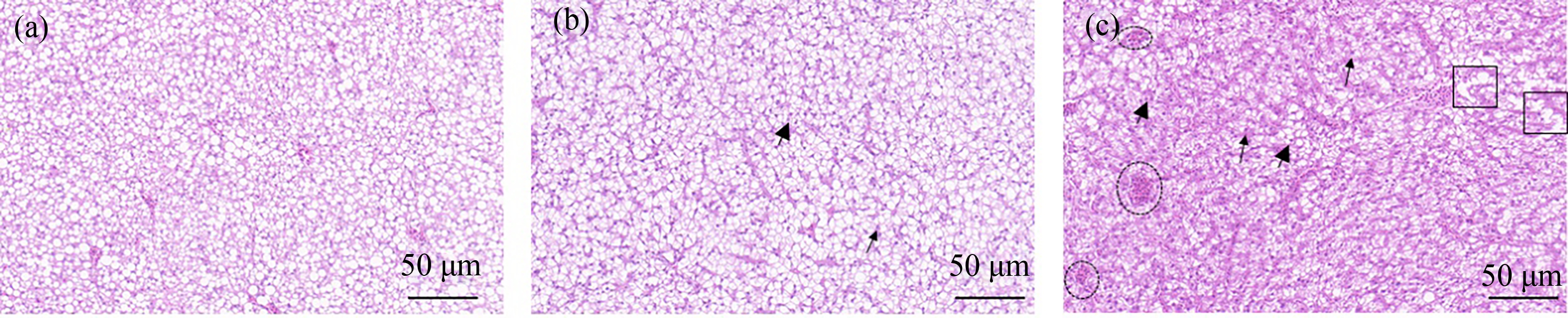
图1 不同浓度二苯甲酮(BP-3)暴露7 d后黄尾蓝魔鱼肝脏组织结构的变化
注:(a) 对照组,(b) 1 μg·L-1 BP-3组,(c) 10 μg·L-1 BP-3组,大箭头为肝固缩,小箭头为核破裂;虚线框为充血,方形框为脂泡溶解。
Fig. 1 Liver histology in Chrysiptera parasema exposed to benzophenone-3 (BP-3) of different concentrations for 7 d
Note: (a) Control group, (b) 1 μg·L-1 BP-3 exposure group, (c) 10 μg·L-1 BP-3 exposure group; large arrow for hepatic consolidation, small arrow for nuclear rupture; dashed box for congestion; square box for lipid vesicle lysis.
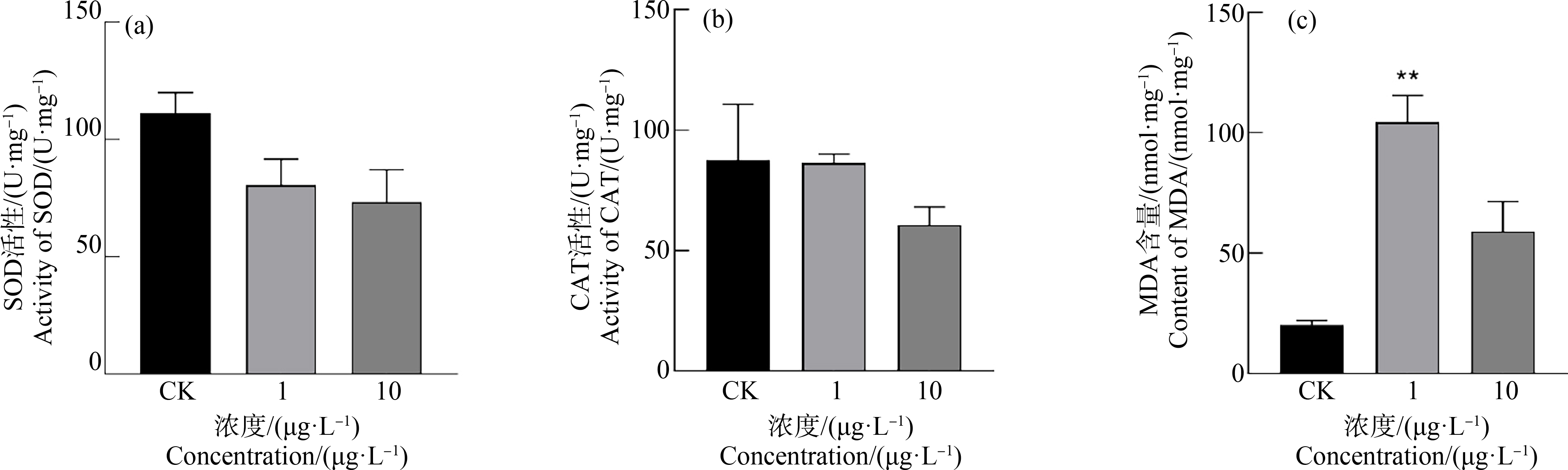
图2 暴露7 d后不同BP-3浓度下黄尾蓝魔鱼肝脏抗氧化酶指标
注:(a) 超氧化物歧化酶(SOD)活性,(b) 过氧化氢酶(CAT)活性,(c) 丙二醛(MDA)含量;数值用Mean±SEM表示,n=3,*表示P<0.05,**表示P<0.01
Fig. 2 Liver antioxidant enzyme indices of Chrysiptera parasema at different BP-3 concentrations after 7 d exposure
Note: (a) Superoxide dismutase (SOD) activity, (b) Catalase (CAT) activity; (c) Malondialdehyde (MDA) content; values are expressed by the Mean±SEM, n=3, *P<0.05,**P<0.01.
2.3 BP-3胁迫对黄尾蓝魔鱼抗氧化相关基因表达的影响
根据前期转录组的结果,从差异基因中筛选出与抗氧化酶活性有关的基因进行mRNA表达量的分析。
(1)bdh2基因。由图3(a)可知,BP-3胁迫后肝脏中bdh2基因的表达量呈“先升后降”的趋势。低浓度暴露组(1 μg·L-1),bdh2基因表达水平接近显著性水平(P=0.068),随着染毒浓度的增加,基因表达水平受到一定抑制,与对照组相比未达到显著性差异(P>0.05)。
(2)SCO1基因。由图3(b)可知,SCO1基因的表达呈“先降后升”的趋势,与bdh2基因“先升后降”的趋势相反。低浓度暴露组(1 μg·L-1),SCO1基因表达水平接近显著性水平(P=0.068),随着染毒浓度的增加,基因表达水平有一定升高,但与对照组相比,未达到显著性差异(P>0.05)。
(3)CYP27B基因。由图3(e)可知,BP-3胁迫7 d后,CYP27B基因的表达量受到明显抑制与对照组相比,呈下降的趋势。低浓度暴露组(1 μg·L-1)CYP27B基因的表达量下降了16.7%(P<0.05),高浓度暴露组(10 μg·L-1)CYP27B基因的表达量下降了19.7%(P<0.05)。
(4)FTHFD和NADH基因。由图3(c)和图3(d)可知,不同浓度的BP-3胁迫后,FTHFD和NADH这2个基因的表达量虽表现出一定上升的趋势,但与对照组相比差异不显著(P>0.05)。
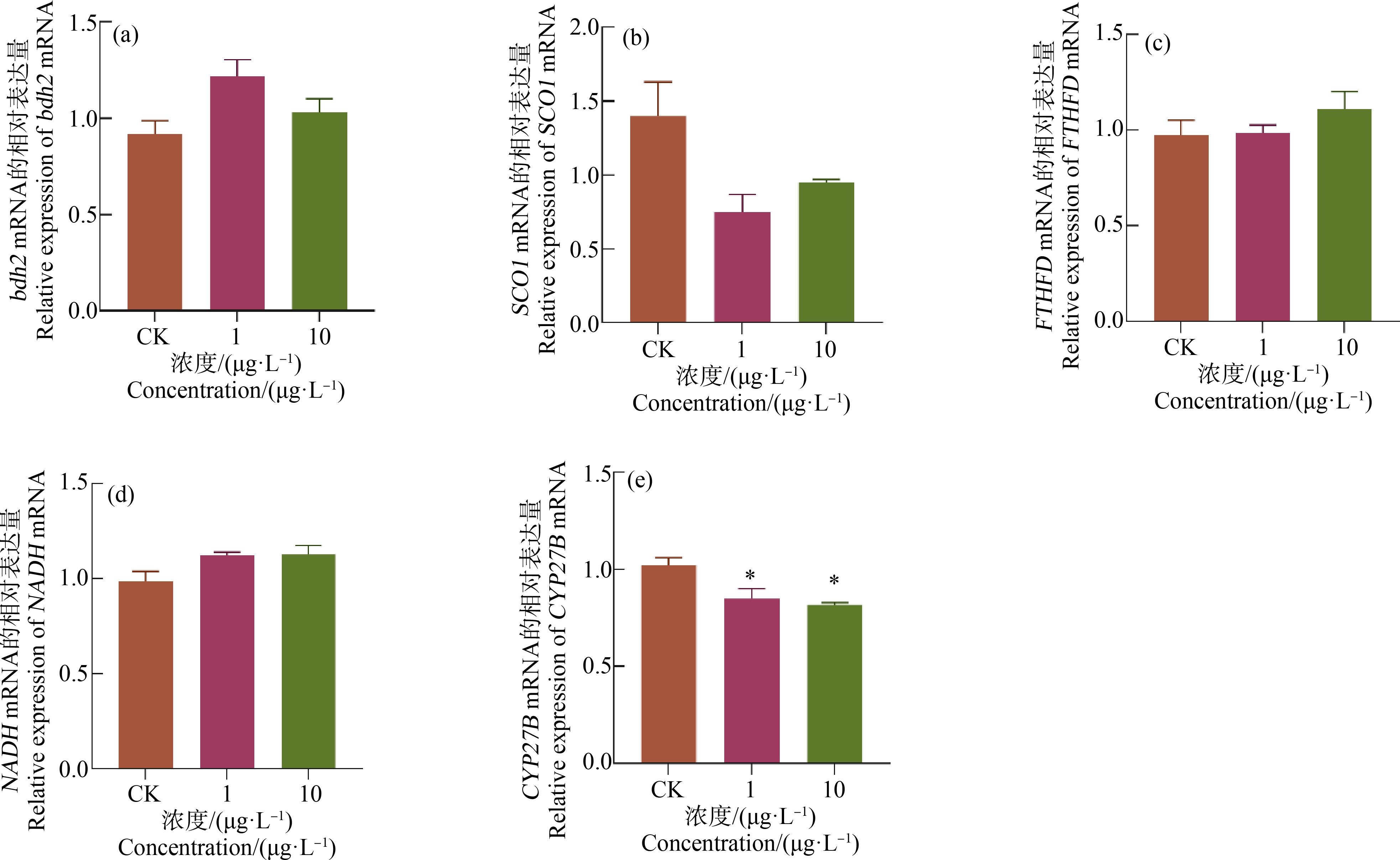
图3 BP-3处理对黄尾蓝魔鱼肝脏抗氧化酶相关基因的mRNA相对表达量的影响
注:(a) bdh2 mRNA,(b) SCO1 mRNA,(c) FTHFD mRNA,(d) NADH mRNA,(e) CYP27B mRNA;数值用Mean±SEM表示,n=3,*表示P<0.05,**表示P<0.01
Fig. 3 Effect of BP-3 treatment on the relative mRNA expression of liver antioxidant enzyme-related genes in Chrysiptera parasema
Note: (a) bdh2 mRNA,(b) SCO1 mRNA,(c) FTHFD mRNA,(d) NADH mRNA,(e) CYP27B mRNA; values are expressed by the Mean±SEM, n=3, *P<0.05,**P<0.01.
3 讨论(Discussion)
有研究表明肝脏脂肪组织是海水鱼主要的储脂组织之一[4]。核固缩是肝细胞内核固缩的状态,可能是由于脂质和糖原的沉积所致[5]。有研究报道,BP-3在暴露于500 μg·L-1的BP-3 28 d后,可引起鲫鱼(Carassius auratus)肝脏固缩和核破裂等退行性改变[5]。本研究发现,在低浓度BP-3暴露组(1 μg·L-1),胁迫7 d后,黄尾蓝魔鱼肝脏组织的脂泡发生改变,出现细胞核的固缩和细胞核溶解,高浓度胁迫组对肝组织结构的影响会更严重,这与上述报道的研究结果一致。脂肪变性是暴露于BP-3 96 h的孔雀鱼(Poecilia reticulata)肝脏中观察到的主要退行性肝组织病理学改变之一[5],本研究也发现了1 μg·L-1和10 μg·L-1 浓度胁迫后引起了脂泡的进一步减小,10 μg·L-1组的部分脂泡已被溶解,表明BP-3诱导的脂质代谢发生了改变。另外,BP-3胁迫能使孔雀鱼肝脏细胞充血,胁迫96 h后,BP-3增加了肝脏的血流量,出现充血和血窦扩张等现象,使孔雀鱼的肝脏的循环系统发生障碍[5]。笔者的研究也得到了相似的结果,也证实了BP-3胁迫对热带鱼类肝脏组织有明显影响。
在鱼类中,BP-3能够诱导氧化应激[5]。过度的胁迫条件下,细胞会产生大量的活性氧(ROS),生物体最终会进化出一系列的反应机制来适应ROS的胁迫,并将其用作信号分子[6]。SOD在鱼类抗氧化酶系统中起重要作用,是氧化应激的关键指示物,早已作为一种酶学标志物用于水环境污染风险评估[7]。通过对肝脏抗氧化酶活性的测定,本研究发现BP-3胁迫能够导致黄尾蓝魔鱼肝脏中SOD酶活性下降,这可能是因为BP-3暴露后,黄尾蓝魔鱼肝脏内短期产生了大量ROS,机体无法在短期内消除这些ROS,最终抑制了SOD的活性,且BP-3浓度越高,抑制程度越强,这与其他紫外线吸收剂暴露,如BP-4和氨基苯甲酸酯(OD-PABA)与溶解有机物(DOM)混合暴露对斑马鱼(Danio rerio)[8]和鲫鱼[9]影响的研究结果基本一致。
CAT作为清除ROS的第一道防线,且CAT是过氧化物酶体的标志酶,能催化H2O2的分解,从而使细胞免于遭受ROS和H2O2的毒害,是生物防御体系的关键酶之一[10]。本研究发现,BP-3暴露后,黄尾蓝魔鱼肝脏中CAT活性呈下降的趋势,有可能是在BP-3的胁迫下,机体产生的ROS一部分被SOD转化为H2O2,短期产生大量H2O2,从而降低了CAT的活性,从而导致其含量的下降。
MDA是脂质过氧化作用的产物,是细胞膜系统损伤的重要指标之一,其水平可用于评估组织受损伤程度[11-12]。经BP-3暴露后,黄尾蓝魔鱼肝脏中MDA含量随着BP-3浓度增加呈现出显著的“先升后降”趋势。这说明低浓度BP-3胁迫对MDA含量有影响。随着染毒浓度的增加,MDA含量受到的影响程度增大。有研究发现,DOM和OD-PABA联合胁迫鲫鱼,对MDA含量无显著影响,本研究的结果与之有差异[9],但与2-苯基苯甲酰唑-5-磺酸(PBSA)胁迫14 d对斑马鱼MDA含量的影响结果一致[8]。
氧化还原过程在所有生物体的细胞中起着关键作用[13]。bdh2基因是具有广泛底物特异性的氧化还原酶基因,其作用于供体CH—OH上,以NAD+或NADP+为受体,以抵抗外界带来的氧化损伤。有研究表明,bdh2通过调节细胞质氧化还原状态,促进细胞增殖,以减少外界带来的氧化应激[14];同时,bdh2可促进Nrf2的泛素化从而增加了ROS的积累[15]。BP-3胁迫7 d后,发现肝脏中bdh2基因的表达量与对照组相比接近显著性差异,这可能是在低浓度时黄尾蓝魔鱼通过迅速提高肝脏bdh2的表达量来对抗外界的胁迫。NADH是细胞抗氧化系统中的关键组分,其可催化还原氧气形成H2O2[16]。在受到胁迫的同时,通过对NADH mRNA表达量的上调来抵御外界带来的胁迫。维生素D(VD)是一种众所周知的抗氧化剂和抗炎激素。CYP27B是负责VD激活的α-羟基酶。CYP27B下降说明了BP-3抑制了肝脏VD的合成。而低VD状态可能是炎症状态的触发因素之一[17]。在经过BP-3胁迫后,从组织学上看出,低浓度组(1 μg·L-1)和高浓度组(10 μg·L-1)黄尾蓝魔鱼的肝细胞分布不均匀,出现了肝固缩、核碎裂的现象,高浓度组(10 μg·L-1)肝部出现脂泡缩小、溶解甚至出现充血等炎症反应,说明了肝脏VD合成受到抑制,所以触发了肝脏的炎症状态。而氧化应激是炎症过程中的伴随现象,通过氧化加重炎症反应,炎症通过炎症介质促进氧化,所以诱导了黄尾蓝魔鱼出现了氧化损伤。
综上所述,不同浓度BP-3胁迫黄尾蓝魔鱼,能引致肝组织损伤,表现为肝细胞肿大,核偏离和细胞核固缩,并有明显的剂效关系。BP-3胁迫后,对肝脏抗氧化酶活性有一定影响。低浓度(1 μg·L-1)BP-3胁迫能明显提高MDA含量。不同基因的表达水平对BP-3胁迫的响应程度有差异,bdh2基因、NADH基因表达明显上升,CYP27B基因表达受到抑制,而FTHFD和NADH基因表达量没有变化。MDA含量和CYP27B基因表达可以作为敏感的生物标志物来反映BP-3胁迫对黄尾蓝魔鱼的生态毒性效应。
[1] Tang Z W, Han X, Li G H, et al. Occurrence, distribution and ecological risk of ultraviolet absorbents in water and sediment from Lake Chaohu and its inflowing rivers, China [J]. Ecotoxicology and Environmental Safety, 2018, 164: 540-547
[2] Sánchez Rodríguez A, Rodrigo Sanz M, Betancort Rodríguez J R. Occurrence of eight UV filters in beaches of Gran Canaria (Canary Islands). An approach to environmental risk assessment [J]. Chemosphere, 2015, 131: 85-90
[3] 吴钟解, 陈石泉, 陈敏, 等. 海南岛造礁石珊瑚资源初步调查与分析[J]. 海洋湖沼通报, 2013(2): 44-50
Wu Z J, Chen S Q, Chen M, et al. Preliminary survey and analysis of the resources of hermatypic corals in Hainan Island [J]. Transactions of Oceanology and Limnology, 2013(2): 44-50 (in Chinese)
[4] Liu H, Sun P, Liu H X, et al. Hepatic oxidative stress biomarker responses in freshwater fish Carassius auratus exposed to four benzophenone UV filters [J]. Ecotoxicology and Environmental Safety, 2015, 119: 116-122
[5] Liu H, Sun P, Liu H X, et al. Hepatic oxidative stress biomarker responses in freshwater fish Carassius auratus exposed to four benzophenone UV filters [J]. Ecotoxicology and Environmental Safety, 2015, 119: 116-122
[6] He L, He T, Farrar S, et al. Antioxidants maintain cellular redox homeostasis by elimination of reactive oxygen species [J]. Cellular Physiology and Biochemistry: International Journal of Experimental Cellular Physiology, Biochemistry, and Pharmacology, 2017, 44(2): 532-553
[7] Farombi E O, Adelowo O A, Ajimoko Y R. Biomarkers of oxidative stress and heavy metal levels as indicators of environmental pollution in African cat fish (Clarias gariepinus) from Nigeria Ogun River [J]. International Journal of Environmental Research and Public Health, 2007, 4(2): 158-165
[8] Huang X X, Li Y Y, Wang T T, et al. Evaluation of the oxidative stress status in zebrafish (Danio rerio) liver induced by three typical organic UV filters (BP-4, PABA and PBSA) [J]. International Journal of Environmental Research and Public Health, 2020, 17(2): 651
[9] Ma B N, Lu G H, Yang H H, et al. The effects of dissolved organic matter and feeding on bioconcentration and oxidative stress of ethylhexyl dimethyl p-aminobenzoate (OD-PABA) to crucian carp (Carassius auratus) [J]. Environmental Science and Pollution Research International, 2018, 25(7): 6558-6569
[10] Rajeshkumar S, Liu Y, Ma J G, et al. Effects of exposure to multiple heavy metals on biochemical and histopathological alterations in common carp, Cyprinus carpio L. [J]. Fish & Shellfish Immunology, 2017, 70: 461-472
[11] Tsikas D. Assessment of lipid peroxidation by measuring malondialdehyde (MDA) and relatives in biological samples: Analytical and biological challenges [J]. Analytical Biochemistry, 2017, 524: 13-30
[12] Gawe S, Wardas M, Niedworok E, et al. Malondialdehyde (MDA) as a lipid peroxidation marker [J]. Wiadomosci Lekarskie, 2004, 57(9-10): 453-455
S, Wardas M, Niedworok E, et al. Malondialdehyde (MDA) as a lipid peroxidation marker [J]. Wiadomosci Lekarskie, 2004, 57(9-10): 453-455
[13] Bilan D S, Lukyanov S A, Belousov V V. Genetically encoded fluorescent redox sensors [J]. Bioorganicheskaia Khimiia, 2015, 41(3): 259-274
[14] Yang B, Hou S H, Zhao J J, et al. 3-hydroxy butyrate dehydrogenase 2 deficiency aggravates systemic lupus erythematosus progression in a mouse model by promoting CD40 ligand demethylation [J]. Bioengineered, 2022, 13(2): 2685-2695
[15] Liu J Z, Hu Y L, Feng Y, et al. BDH2 triggers ROS-induced cell death and autophagy by promoting Nrf2 ubiquitination in gastric cancer [J]. Journal of Experimental & Clinical Cancer Research, 2020, 39(1): 123
[16] Niimura Y. The NADH oxidase-prx system in Amphibacillus xylanus [J]. Sub-Cellular Biochemistry, 2007, 44: 195-205
[17] Jonas M I, Kury owicz A, Bartoszewicz Z, et al. Vitamin D receptor gene expression in adipose tissue of obese individuals is regulated by miRNA and correlates with the pro-inflammatory cytokine level [J]. International Journal of Molecular Sciences, 2019, 20(21): E5272
owicz A, Bartoszewicz Z, et al. Vitamin D receptor gene expression in adipose tissue of obese individuals is regulated by miRNA and correlates with the pro-inflammatory cytokine level [J]. International Journal of Molecular Sciences, 2019, 20(21): E5272