随着社会经济的不断发展,塑料凭借其耐用性高、造价低等特性在日常生活中被广泛利用。然而,随着塑料产量大幅提升,塑料垃圾在土壤、海洋中不断累积,目前为止,蓄积在环境中的塑料垃圾共有近4.9亿t[1]。微塑料作为小颗粒的塑料碎片,其粒径<5 mm[2]。微塑料污染已经成为一类亟待关注和解决的环境问题。微塑料的来源主要分为原生和次生2类。原生微塑料是指人工制造的小粒径微塑料,次生微塑料是指大块塑料经过物理、化学和生物过程分裂成微塑料颗粒,可以直接从海岸线或通过河流进入海洋。微塑料凭借其低密度轻质量的特性,极易借助水流、风力等外力作用迁移到多种环境介质中,在海洋、土壤和空气中均有它的蓄积[3]。
老化微塑料是指环境中的塑料经过紫外线、辐射、物理磨损和生物降解等一系列过程后形成的塑料碎片,由于其物理化学特性发生改变,从而导致其生物效应发生变化[4-5]。具体说来,经过老化的微塑料颗粒表面粗糙度明显增加,同时出现裂纹或颗粒状剥脱等改变,进而呈现出更为复杂的表面形貌[6],提高了微塑料的比表面积。微塑料物化性质的改变一方面增加微塑料对其他物质的吸附性[7-9]。有研究发现微塑料与重金属混合暴露后,重金属有效浓度可达其单独暴露时的4倍[10-11]。另一方面,在光照、臭氧等老化因子的作用下,老化微塑料表面羟基、羧基等含氧官能团水平上升,其表面极性、亲水性和表面电荷水平也发生改变[12],造成的生物效应也不同。
近年来,微塑料的健康效应逐渐成为一个研究热点。然而大多数研究使用的暴露材料为商业公司提供的标准微塑料,它们的理化性质与环境中的老化微塑料不同。老化微塑料和标准微塑料引起的健康效应之间的差异值得进一步探讨。
由于微塑料经口暴露后,首先影响的是消化系统,因此目前微塑料肠道毒性效应研究逐渐增多。人体肠道是一个包含1 000多种微生物的复杂生态系统[13],而肠道菌群就是依赖于这个生态系统并通过产生代谢产物帮助宿主完成多种生理生化功能的微生物的总称,其细胞数量大概是人体细胞的1.3倍[14-15]。肠道菌群可以参与人体多种正常生理活动,如帮助机体合成维生素、降解不易消化的植物多糖和草酸盐、为人类宿主提供无法获得的营养等[16],而肠道菌群紊乱可以影响宿主的生理功能,人类各种慢性疾病尤其是能量代谢性疾病可能与肠道菌群失调有关[17-18]。
能量代谢是指体内物质代谢过程中所伴随的能量释放、转移、贮存和利用的过程[19]。能量代谢激素是指可以调节体内能量平衡,调节体内能量物质的摄取与利用,促进体内各种物理化学反应[20]。已有研究表明肠道菌群代谢产物(如脂多糖和短链脂肪酸)的改变可以影响肠内内分泌细胞激素的分泌,进而影响GLP-1、CCK和PYY等能量代谢相关激素的分泌[21]。肠道菌群和能量激素可以作为微塑料对机体能量代谢干扰的观察终点。目前,对于微塑料与肠道菌群及能量代谢相关激素影响的主要研究对象为水体生物如斑马鱼、蚌模型[21-23]。有关微塑料暴露对哺乳动物肠道菌群及能量代谢影响的研究还不多,大多以标准微塑料为暴露材料。而老化微塑料由于其理化性状的改变,比表面积更大,可以假设其对肠道菌群影响更大。因此,本研究采用标准聚苯乙烯微塑料与老化聚苯乙烯微塑料对C57BL/6小鼠进行经口暴露,收集小鼠粪便进行肠道菌群分析,收集血清进行能量代谢相关激素检测。通过比较标准和老化微塑料的引起毒性效应的差异,研究肠道菌群在老化微塑料干扰能量代谢中的潜在作用,为今后微塑料毒性研究暴露材料的选择提供依据。
1 材料与方法(Materials and methods)
1.1 实验材料
1.1.1 实验动物
本研究使用的实验动物为8周龄C57BL/6雄性小鼠,购买与饲养于南京医科大学实验动物中心SPF级屏障实验室(SYXK(苏)2014-0009)。实验室温度为(20±2) ℃;相对湿度为50%~60%;光照为150~200 lx;噪音<50 dB;12 h/12 h光照黑暗交替环境;小鼠自由饮水和进食。小鼠在实验室适应7 d后根据南京医科大学实验动物福利伦理委员会的要求进行所有实验操作(IACUC-2006027)。
1.1.2 实验试剂
PS塑料板(苍南县逸昕亚克力制品厂,中国)、10 μm标准品聚苯乙烯(大鹏科技有限公司,天津,中国)、玉米油(山东三星玉米产业科技有限公司,中国);H&E(hematoxylin and eosin)染色试剂盒(碧云天,上海,中国);AB-PAS(Alcian blue-periodic acid Schiff)染色试剂盒(南京森贝伽生物科技有限公司,南京,中国);小鼠胰高血糖素样肽(glucagon-like peptide-1, GLP-1)、胆囊收缩素(cholecystokinin, CCK)、YY肽(peptide YY, PYY)和小鼠饥饿素(ghrelin)酶联免疫分析(ELISA)试剂盒(武汉贝茵莱生物科技有限公司,武汉,中国)。
1.1.3 实验仪器
粉碎机(中国泰斯特,FW135);全自动样品组织研磨仪(中国上海净信,Tissuelyser-48);臭氧发生器(中国奥浦发,OGP-S910GC);扫描电子显微镜(scanning electron microscope, SEM;日本JEOL,JSM-7900F);傅里叶变换衰减全反射红外光谱(Fourier transform attenuated total reflection infrared spectroscopy, FTIR-ATR;美国Thermo Fisher,Nicolet Summit);电子顺磁共振谱(electron paramagnetic resonance, EPR;德国布鲁克,ESR5000);超声波清洗器(中国昆山,KQ-500B);切片扫描仪(匈牙利3DHISTECH,Pannoramic MIDI);多功能酶标仪(瑞士TECAN,InfiniteM200)。
1.2 方法
1.2.1 老化PS-MPs的制备
从塑料加工厂收集PS塑料板,经初步切割后用粉碎机和研磨仪进行粉碎,然后过50 μm筛网,制得粒径<50 μm的PS-MPs。PS-MPs先用70%乙醇冲洗3次,再用去离子水冲洗2次,50 ℃烘干。将PS-MPs放入厌氧瓶内,采用臭氧发生器以0.4 mg·min-1的速率通入臭氧9 h对PS-MPs进行老化处理后,收集老化PS-MPs并放置于50 ℃烘干保存。
1.2.2 老化PS-MPs的表征分析
将老化微塑料配制成悬浮液,超声30 min将其分散均匀,于扫描电子显微镜下分析老化微塑料的分散情况、形状和粒径。使用傅里叶变换衰减全反射红外光谱分析技术进行谱图分析并确定老化微塑料主要官能团,确定微塑料成分。用电子顺磁共振谱检测老化PS-MPs自由基团。
1.2.3 小鼠微塑料暴露和样本收集
小鼠适应1周后,将15只小鼠随机分为标准聚苯乙烯微塑料组(standard polystyrene microplastics, s PS-MPs)、老化聚苯乙烯微塑料(aged polystyrene microplastics, a PS-MPs)组和对照组(玉米油)。小鼠每天灌胃0、20 μg·g-1·d-1标准PS-MPs或20 μg·g-1·d-1老化PS-MPs,持续7 d。灌胃微塑料浓度根据实验室前期研究结果决定[24]。暴露结束后收集小鼠的粪便(每个样品100 mg)。小鼠禁食8 h后,用乙醚麻醉,快速收集尾静脉血,在4 ℃下,使用离心机3 000 r·min-1离心15 min取上清,然后将血清保存在-80 ℃冰箱内备用。颈椎脱臼处死小鼠,快速收集结肠,一部分放置4%(m∶V)多聚甲醛中固定,剩余部分放置冻存管中置于液氮中速冻,然后保存在-80 ℃冰箱内备用。
1.2.4 结肠组织病理学分析
将固定在多聚甲醛溶液中的结肠切取部分(1 cm)用梯度乙醇脱水,在二甲苯中进行透明化,并在56 ℃下包埋在石蜡块中。然后,将来自每组不同小鼠的5个结肠样品切成5 μm厚的切片,并进行H&E染色和AB-PAS染色。
1.2.5 粪便DNA的提取和PCR扩增
小鼠粪便进行微生物群DNA提取。首先使用E.Z.N.A.® soil DNA试剂盒(Omega Bio-tek,美国)以及NanoDrop 2000紫外分光光度计(Thermo Scientific,美国)提取粪便中微生物基因组DNA并确定最终分析的DNA浓度及纯度,然后再对提取到的DNA进行质量检测。随后使用引物338F(5’-ACTCCTACGGGAGGCAGCAG-3’)及806R(5’-GGACTACHVGGGTWTCTAAT-3’),利用Thermocycler PCR系统(GeneAmp 9700,美国)对肠道微生物16S rRNA基因的V3-V4高变区进行扩增,然后使用2%(V∶V)的琼脂糖凝胶及AxyPrep DNA Gel Extraction Kit(Axygen Biosciences,美国)提取PCR产物并进行进一步纯化,最后按照使用指南进行定量。所有测序数据在美吉生物云网站(http://www.majorbio.com/)中进行处理分析。
1.2.6 能量代谢激素检测
取小鼠血清,按照试剂盒要求测定小鼠血清肠道激素GLP-1、CCK、PYY和ghrelin水平,4种激素的检测限分别为:GLP-1 2~160 pmol·L-1;CCK 12.5~1 000 pg·mL-1;PYY 12.5~1 000 pg·mL-1;ghrelin 0.4~32 ng·mL-1。
1.3 统计分析
应用GraphPad Prism 9软件分析数据与绘制图形。首先使用Kolmogorov-Smirnov单样本检验和Levene检验对所有数据进行方差的正态性和均一性评估。在符合相应分析方法基本条件时,先进行单因素方差分析(ANOVA),然后进行Dunnett或LSD检验,评估组间差异。不满足条件的数据选择使用Wilcoxon法或Kruskal-Wallis法检验。P<0.05被认为差异显著。
2 结果(Results)
2.1 微塑料表征分析
扫描电子显微镜图片显示,相比标准PS-MPs,老化PS-MPs粒径较小、表面粗糙不平,其比表面积较大(图1(a))。傅里叶变换衰减全反射红外光谱分析显示,在1 740 cm-1附近的羰基特征吸收峰峰强在老化PS-MPs中较强(图1(b)),电子顺磁共振图显示,老化PS-MPs表面出现较显著的共振峰,表明其表面自由基数量增加(图1(c))。

图1 标准PS-MPs(s PS)与老化PS-MPs(a PS)表征分析
注:(a)为标准PS-MPs(左栏:上图为放大500倍图;下图为放大1 000倍图)和老化PS-MPs(右栏:上图为放大500倍图;下图为放大1 000倍图)扫描电子显微镜照片;(b)为标准PS-MPs(蓝色)与老化PS-MPs(红色)傅里叶衰减全放射红外光谱;(c)为标准PS-MPs(蓝色)与老化PS-MPs(红色)电子顺磁共振光谱。
Fig. 1 Characterization of standard PS microplastics (s PS) and aged PS microplastics (a PS)
Note: (a) Scanning electron microscopy photographs of standard PS microplastics (Left column: the picture above is a 500× magnification; the bottom picture is a 1 000× magnification) and aged PS microplastics (Right column: the picture above is a 500× magnification; the bottom picture is a 1 000× magnification); (b) Fourier decay full-radiation infrared spectra of standard PS microplastics (blue) and aged PS microplastics (red); (c) Electron paramagnetic resonance spectra of standard PS microplastics (blue) and aged PS microplastics (red).
2.2 小鼠脏器系数
对小鼠体质量数据及脏器系数分析发现,与对照组相比,标准PS-MPs暴露组的小鼠肝脏的脏器系数明显下降(P<0.05),而老化PS-MPs暴露后肝脏的脏器系数有升高趋势,但两组间没有显著差异(图2(a))。微塑料暴露未引起小鼠肾脏和肠道的脏器系数改变(图2(b)~图2(d))。
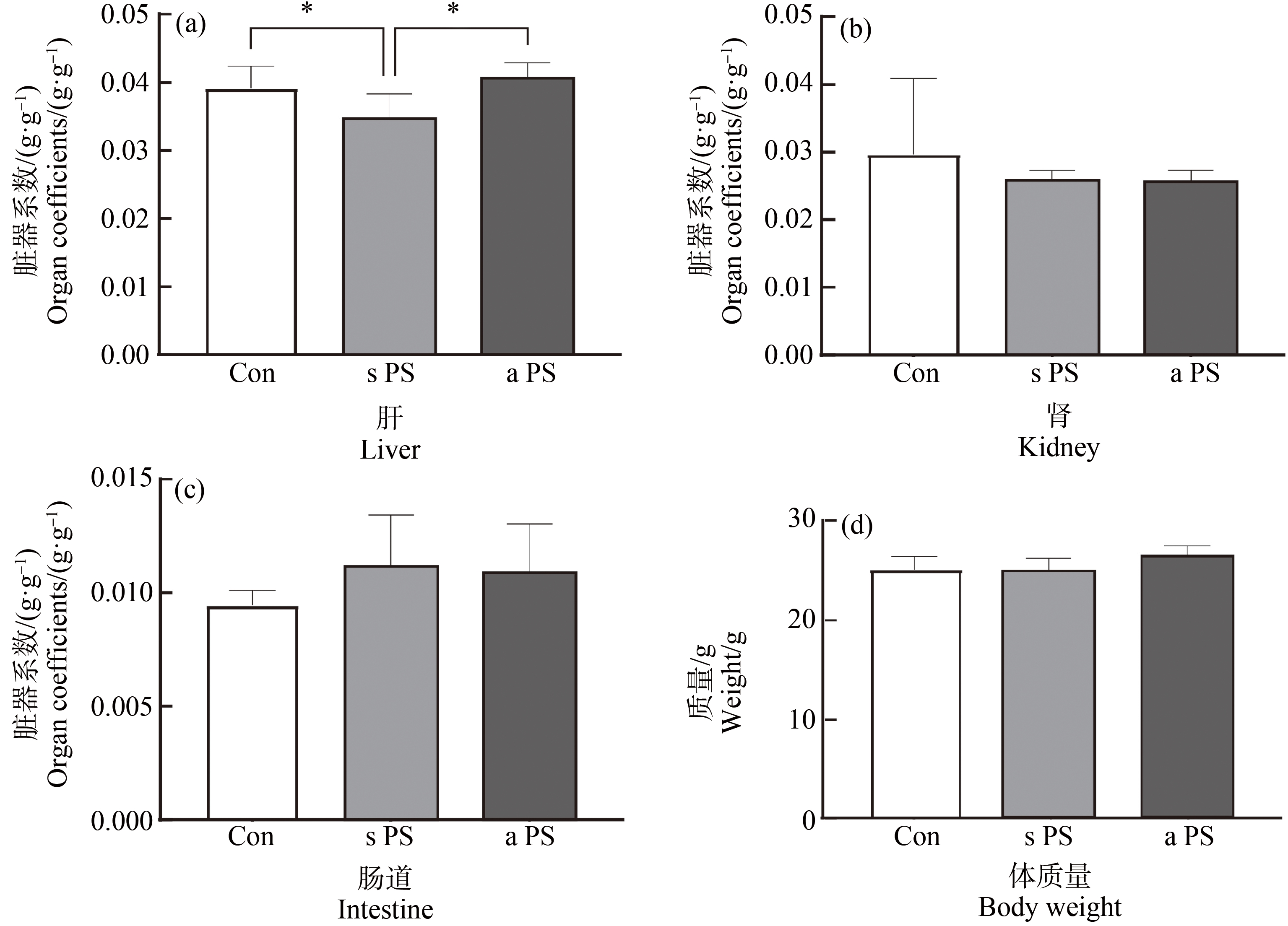
图2 7 d微塑料经口暴露后标准PS-MPs(s PS)组、老化PS-MPs(a PS)组和对照组(Con)小鼠脏器系数和体质量
注:(a)肝;(b)肾;(c)肠道;(d)体质量;*P<0.05。
Fig. 2 Organ coefficients and body weight of standard PS microplastics (s PS) group, aged PS microplastics (a PS) group and control (Con) mice after 7 d oral exposure to microplastics
Note: (a) Liver; (b) Kidney; (c) Intestine; (d) Body weight; *P<0.05.
2.3 能量代谢激素水平
与标准PS-MPs相比,老化PS-MPs暴露显著提高小鼠能量代谢激素GLP-1与ghrelin水平(P<0.05,P<0.05),但PYY和CCK没有显著变化(图3)。
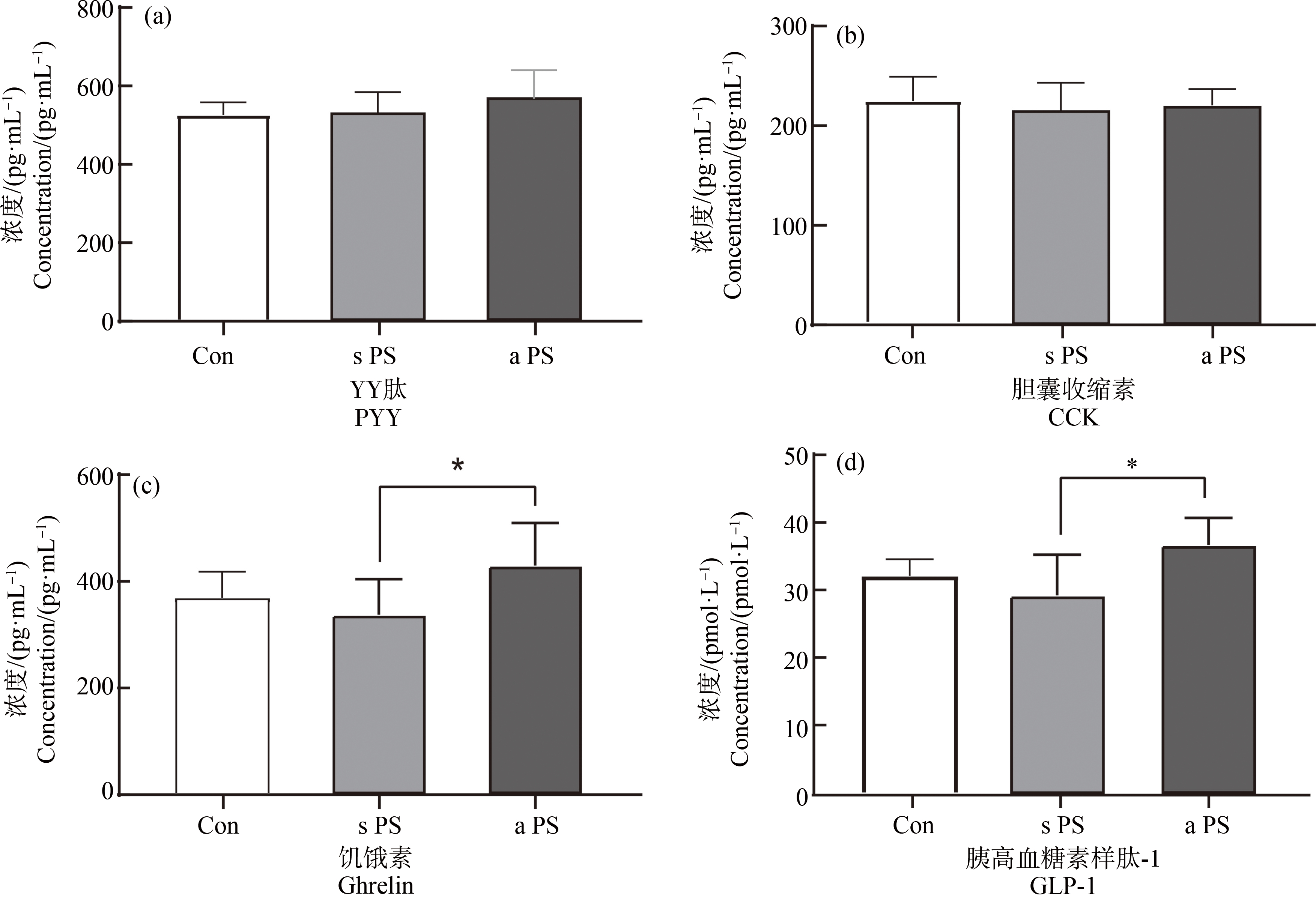
图3 7 d微塑料经口暴露后标准PS-MPs(s PS)组、老化PS-MPs(a PS)组和对照组(Con)小鼠能量代谢激素水平
注:(a)YY肽(PYY);(b)胆囊收缩素(CCK);(c)饥饿素(ghrelin);(d)胰高血糖素样肽-1;*P<0.05。
Fig. 3 Energy metabolism hormone levels in standard PS microplastic (s PS) group, aged PS microplastic (a PS) group and control (Con) mice after 7 d oral exposure
Note: (a) YY peptide (PYY); (b) Cholecystokinin (CCK); (c) Hunger hormone (ghrelin); (d) Glucagon-like peptide-1 (GLP-1); *P<0.05.
2.4 小鼠肠道结构损伤
通过对H&E染色图片比较观察发现,与对照组相比,标准PS-MPs和老化PS-MPs组的C57BL/6小鼠的肠道都出现隐窝结构受损,杯状细胞数量均相对减少。AB-PAS染色图片比较观察发现,2组微塑料处理后小鼠肠道酸性黏液分泌上升,杯状细胞分泌的黏蛋白水平下降。并且老化PS-MPs暴露组隐窝结构受损更严重,杯状细胞数量减少更多,酸性黏液分泌更多,黏蛋白水平更低(图4)。
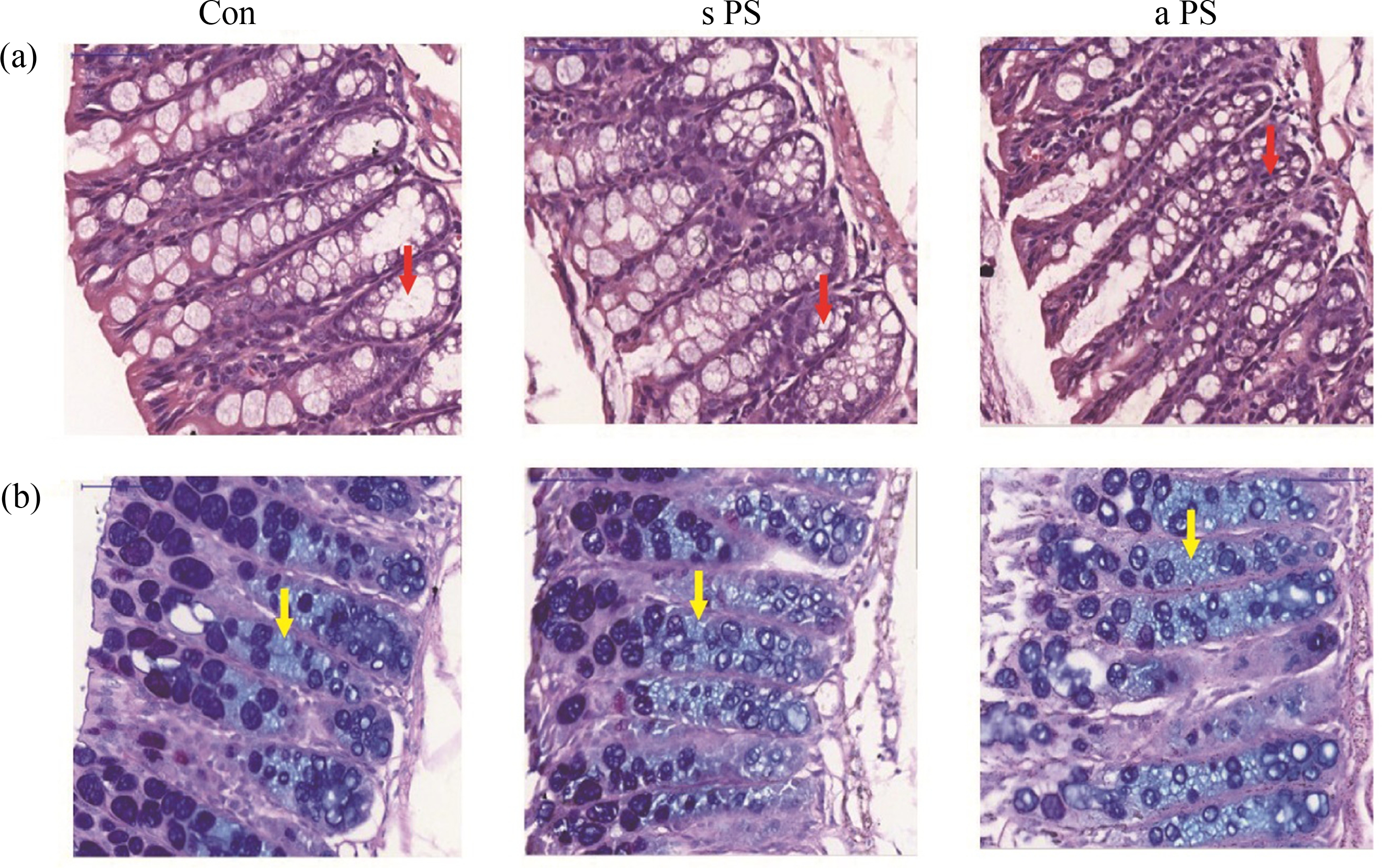
图4 7 d微塑料经口暴露后标准PS-MPs(s PS)组、老化PS-MPs(a PS)组和对照组(Con)小鼠结肠H&E染色(a)和AB-PAS染色(b)代表性图片
注:红色箭头为隐窝结构,黄色箭头为酸性黏液。
Fig. 4 Representative images of H&E staining (a) and AB-PAS staining (b) of mice colon in the standard PS microplastic (s PS) group, aged PS microplastic (a PS) group and control (Con) group after 7 d oral exposure to microplastics
Note: The red arrows show the crypt structure and yellow arrows show the acidic mucus.
2.5 小鼠粪便中肠道菌群分析
2.5.1 肠道菌群alpha与beta多样性
小鼠粪便进行的16S测序结果显示,随着测序数量的增加,Shannon指数和Chao指数稀释曲线逐渐平缓,表明测序数据量足以反映所有分类群测序深度,足以覆盖绝大多数分类群,且曲线趋于饱和(图5(a)~图5(b))。Rank丰度曲线表明,老化PS-MPs Rank曲线变窄,呈急剧下降趋势,说明老化PS-MPs暴露组小鼠的肠道菌群多样性较低(图5(c))。图5(d)是主成分分析(principal component analysis, PCA)图,PCA使用方差分析探究每个样本在OTU水平之间的差异,其中老化PS-MPs暴露组的组成差异性低于对照组和标准PS-MPs暴露组。进一步分析发现,老化PS-MPs暴露组的Shannon指数显著低于对照组及标准PS-MPs,老化PS-MPs暴露显著降低了肠道菌群的多样性(P<0.05)(图5(f));标准PS-MPs暴露组小鼠肠道菌群的Chao指数显著低于对照组(P<0.05)(图5(g)),老化PS-MPs暴露组略低于对照组,但没有有统计学意义差异(图5(f))。
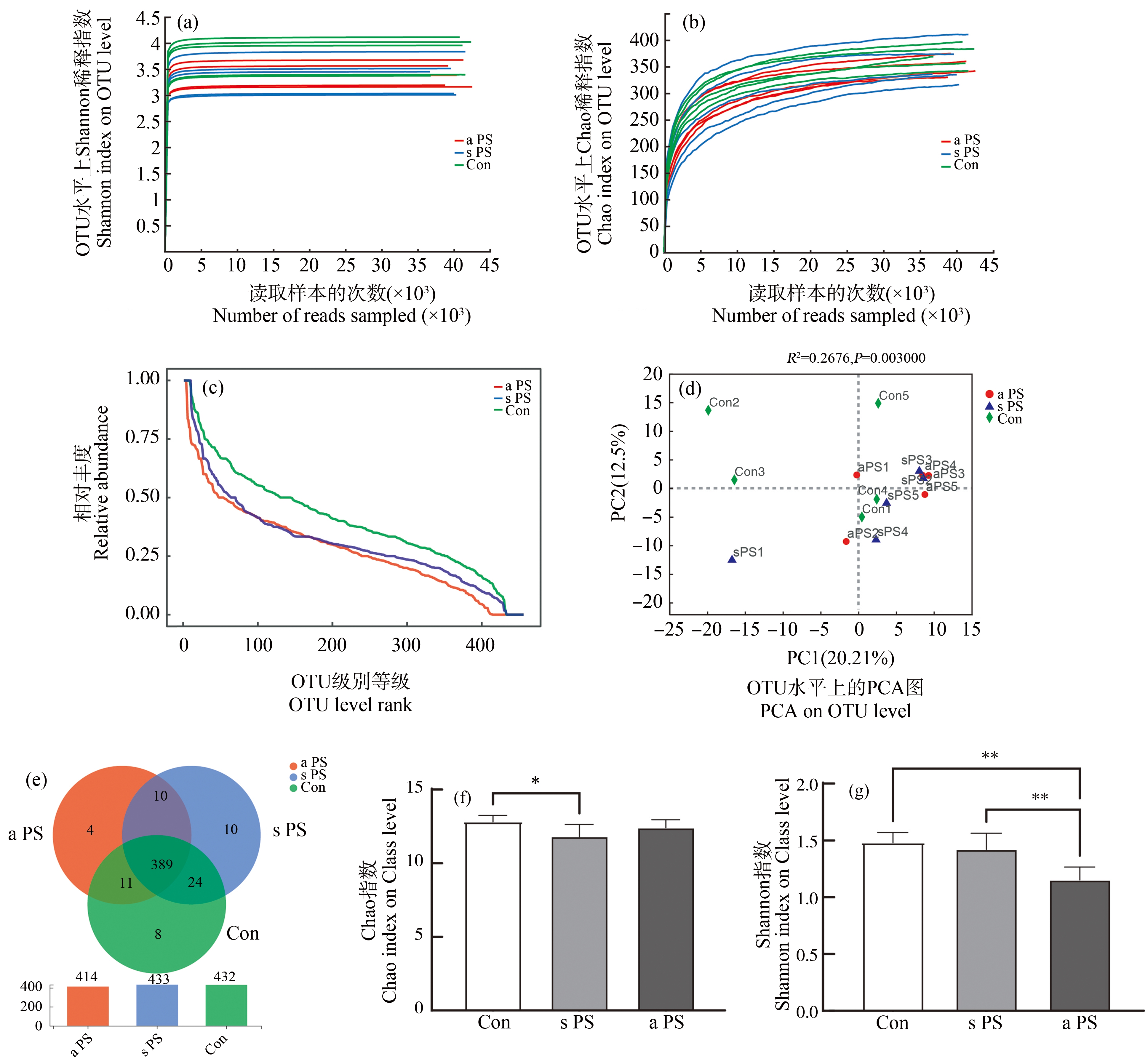
图5 7 d微塑料经口暴露后标准PS-MPs(s PS)组、老化PS-MPs(a PS)组和对照组(Con)小鼠粪便稀释曲线及菌群多样性
注:(a) (b)为稀释曲线;(c)为Rank相对丰度曲线;(d)为PCA图;(e)为维恩图;(f)为Chao指数;(g)为Shannon指数;*P<0.05,**P<0.01。
Fig. 5 Fecal dilution curves and flora diversity of standard PS microplastics (s PS) group, aged PS microplastics (a PS) group and control (Con) mice after 7 d oral exposure to microplastics
Note: (a) (b) Dilution curves; (c) Rank relative abundance curves; (d) PCA plots; (e) Venn diagrams; (f) Chao index; (g) Shannon index; *P<0.05, **P<0.01.
2.5.2 肠道菌群结构分析
本次测序一共发现456个分类操作单元(operational taxonomic unit, OTU),具体分布如图5(e)所示,老化PS-MPs暴露组共检出414个OTU,其中与标准PS-MPs、对照组共有的OTU分别有399个和400个,分别占总数的96.38%和96.62%;其中与标准PS-MPs暴露组共有但不与对照组共有的为10个,占共有数的2.5%。具体来说,在门水平,各组样本的OTU主要由拟杆菌门(Bacteroidetes)、厚壁菌门(Firmicutes)、放线菌门(Actinobacteria)和疣微菌门(Verrucomicrobia)等组成(图6(a)~图6(b)),其中拟杆菌门和厚壁菌门占主导。从科水平分析,各组样本的OTU主要由Muri菌科(Muribaculaceae)、毛螺旋菌科(Lanchnospiraceae)和双歧杆菌科(Bifidobacteriaceae)组成(图6(e)~图6(f)),其中Muri菌科的占比远高于其他菌。拟杆菌门相对丰度在老化PS-MPs暴露组中显著提高(P<0.001),厚壁菌门相对丰度显著降低(P<0.05)(图6(c)~图6(d))。与对照组相比,老化PS-MPs暴露组中乳杆菌科显著减少(P<0.05),鼠杆菌科、普雷沃氏菌显著增多(P<0.05,P<0.01)(图6(g))。
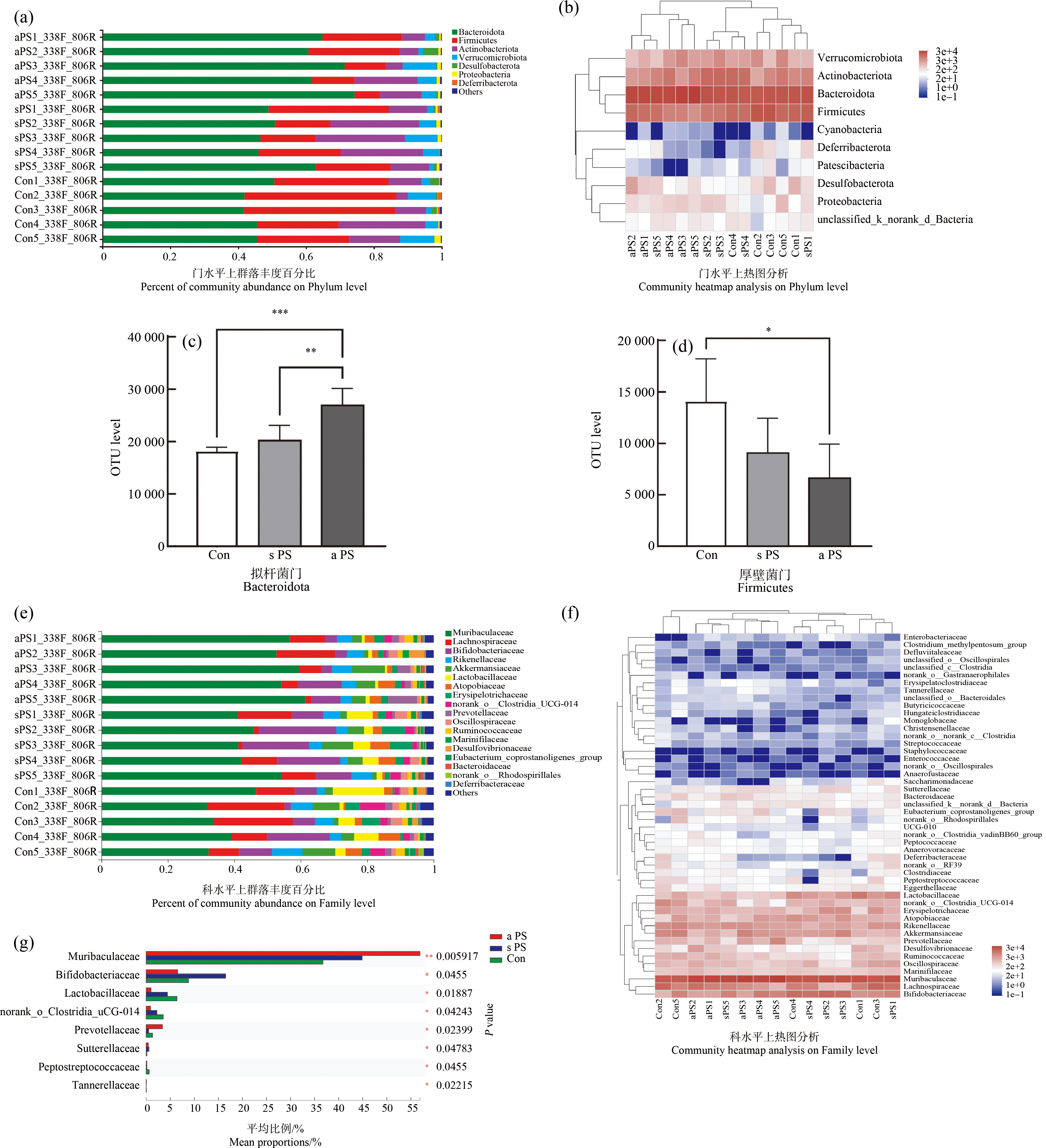
图6 7 d微塑料经口暴露后标准PS-MPs(s PS)组、老化PS-MPs(a PS)组和对照组(Con)小鼠粪便菌群组成与结构改变
注:(a)~(d)为门水平上分析菌群丰度变化;(e)~(g)为科水平上分析菌群丰度变化;*P<0.05,**P<0.01,***P<0.001。
Fig. 6 Changes in fecal flora composition and structure in standard PS microplastics (s PS) group, aged PS microplastics (a PS) group and control (Con) mice after 7 d oral exposure to microplastics
Note: (a)~(d) for analysis of changes in flora abundance at the Phylum level; (e)~(g) for analysis of changes in flora abundance at the Family level; *P<0.05, **P<0.01, ***P<0.001.
3 讨论(Discussion)
本研究对7 d经口暴露标准PS-MPs或老化PS-MPs后的小鼠的结肠形态学结构、血清能量代谢激素和粪便菌群进行了观察、分析和比较,发现短期微塑料暴露即可破坏肠道结构,并改变肠道菌群结构。老化PS-MPs,相比标准PS-MPs,更能干扰能量代谢激素水平,并引起更显著的肠道菌群结构变化。
本研究检测了4种能量代谢激素。胰高血糖素样肽-1,是由肠道内分泌细胞合成和分泌的肠促胰素,主要促进糖代谢[25]。胆囊收缩素可以促进肝胆汁分泌,调节小肠、结肠运动,并作为饱感因素抑制摄食[26]。PYY是一种胃肠道肽类激素,可以收缩血管,减少胰腺外分泌,抑制胃肠运动和胃酸分泌等,抑制摄食[27]。胃饥饿素促进食物摄取[28]。本研究发现,相比标准PS-MPs暴露组,老化PS-MPs暴露组胰高血糖素样肽-1和胃饥饿素显著升高,说明老化PS-MPs暴露促进进食,这与长期标准PS-MPs暴露促进进食结果一致[29]。
已有研究发现,微塑料进入生物体后,在肠道聚集并改变肠道主要微生物的组成和丰度[30]。在水生生物中,微塑料暴露可以显著降低斑马鱼和孔雀鱼肠道菌群的多样性和特殊菌如变形杆菌、葡萄球菌相对丰度[31-32]。关于微塑料暴露影响哺乳动物肠道菌群的研究相对较少。有研究发现ICR小鼠在经过高浓度(100 μg·L-1、1 000 μg·L-1)PS-MPs暴露后,肠道的厚壁菌门、变形菌门等菌群相对丰度显著降低[33-34]。在本研究中,低浓度老化微塑料短期暴露(20 μg·L-1, 7 d)后也观察到菌群多样性下降、丰度改变,而且老化微塑料的影响要大于标准微塑料,这也验证了老化微塑料暴露对菌群的影响大于标准微塑料暴露的推测。
肠道菌群组成及结构的改变可以影响宿主的生理功能,肠道菌群结构改变已被发现与各种慢性代谢疾病存在关联[16]。本研究发现小鼠经过微塑料暴露后,厚壁菌门丰度显著降低。厚壁菌门菌可以增加机体对营养物质尤其是短链脂肪酸的吸收,因此厚壁菌门丰度的降低显示机体能量吸收下降,这可能会通过反馈机制通过升高能量代谢相关激素(GLP-1, ghrelin)以提高进食量[35-37]。这个科学假说有待进一步证明。拟杆菌门相对丰度在老化PS-MPs暴露组中显著提高,增加了拟杆菌和非杆菌的相对比例。肠道中拟杆菌与非杆菌比例提高,与机体碳水化合物代谢增加以及脂肪代谢速率降低相关[38]。同时,拟杆菌相对丰度增加也提高其代谢产物如脂多糖(lipopolysaccharide),通过诱发炎症,破坏肠黏膜屏障,提高糖脂代谢[39]。此外,本研究同时发现老化PS-MPs暴露显著降低乳杆菌科,乳杆菌科可以抑制革兰阴性杆菌(拟杆菌门)活力,而乳杆菌科丰度的下降可以进一步引起革兰阴性杆菌(拟杆菌门)水平的上升[40],升高能量代谢相关水平。本研究发现老化PS-MPs暴露后,鼠杆菌科、普雷沃菌等相对丰度显著增加。研究发现普氏菌、鼠杆菌科等肠道微生物相对丰度提高与机体内短链脂肪酸的水平增加,单糖等糖类物质利用率上升,能量代谢激素水平上升相关,这与本研究的发现一致[41]。因此,老化PS-MPs短期暴露引起的肠道菌群改变会提高机体能量代谢。但这种现象没有在标准PS-MPs组观察到。
综上所述,本研究发现短期的老化微塑料暴露相比标准微塑料,显著降低肠道菌群结构多样性,改变小鼠肠道菌群的菌种组成,干扰能量代谢激素水平。由于环境中微塑料大多是老化微塑料,老化微塑料和环境微塑料的生物效应差异提示在进行微塑料毒性研究时,应当慎重选择暴露材料。微塑料暴露是否通过影响肠道菌群的结构及肠道微生物代谢产物的分泌进而干扰能量代谢还需要进一步研究。
[1] Geyer R, Jambeck J R, Law K L. Production, use, and fate of all plastics ever made [J]. Science Advances, 2017, 3(7): e1700782
[2] Thompson R C, Olsen Y, Mitchell R P, et al. Lost at sea: Where is all the plastic? [J]. Science, 2004, 304(5672): 838
[3] 杨婧婧, 徐笠, 陆安祥, 等. 环境中微(纳米)塑料的来源及毒理学研究进展[J]. 环境化学, 2018, 37(3): 383-396
Yang J J, Xu L, Lu A X, et al. Research progress on the sources and toxicology of micro (nano) plastics in environment [J]. Environmental Chemistry, 2018, 37(3): 383-396 (in Chinese)
[4] Jahnke A, Arp H P H, Escher B I, et al. Reducing uncertainty and confronting ignorance about the possible impacts of weathering plastic in the marine environment [J]. Environmental Science & Technology Letters, 2017, 4(3): 85-90
[5] Guo X, Wang J L. The chemical behaviors of microplastics in marine environment: A review [J]. Marine Pollution Bulletin, 2019, 142: 1-14
[6] Tang C C, Chen H I, Brimblecombe P, et al. Textural, surface and chemical properties of polyvinyl chloride particles degraded in a simulated environment [J]. Marine Pollution Bulletin, 2018, 133: 392-401
[7] 唐海辉, 周世帆, 邹小明, 等. 不同老化条件对聚酰胺6微塑料吸附磺胺噻唑的影响[J]. 环境污染与防治, 2022, 44(2): 154-159
Tang H H, Zhou S F, Zou X M, et al. Effects of different aging condition on the adsorption of sulfathiazole by polyamide 6 microplastic [J]. Environmental Pollution & Control, 2022, 44(2): 154-159 (in Chinese)
[8] 王琼杰, 张勇, 张阳阳, 等. 老化微塑料对水体中重金属铜和锌的吸附行为研究[J]. 环境科学学报, 2021, 41(7): 2712-2726
Wang Q J, Zhang Y, Zhang Y Y, et al. Adsorption of heavy metal ions Cu2+ and Zn2+ onto UV-aged microplastics in aquatic system [J]. Acta Scientiae Circumstantiae, 2021, 41(7): 2712-2726 (in Chinese)
[9] 马思睿, 李舒行, 郭学涛. 微塑料的老化特性、机制及其对污染物吸附影响的研究进展[J]. 中国环境科学, 2020, 40(9): 3992-4003
Ma S R, Li S X, Guo X T. A review on aging characteristics, mechanism of microplastics and their effects on the adsorption behaviors of pollutants [J]. China Environmental Science, 2020, 40(9): 3992-4003 (in Chinese)
[10] Lu K, Qiao R X, An H, et al. Influence of microplastics on the accumulation and chronic toxic effects of cadmium in zebrafish (Danio rerio) [J]. Chemosphere, 2018, 202: 514-520
[11] Rummel C D, Jahnke A, Gorokhova E, et al. Impacts of biofilm formation on the fate and potential effects of microplastic in the aquatic environment [J]. Environmental Science & Technology Letters, 2017, 4(7): 258-267
[12] Zhang H B, Wang J Q, Zhou B Y, et al. Enhanced adsorption of oxytetracycline to weathered microplastic polystyrene: Kinetics, isotherms and influencing factors [J]. Environmental Pollution, 2018, 243(Pt B): 1550-1557
[13] Sender R, Fuchs S, Milo R. Revised estimates for the number of human and bacteria cells in the body [J]. PLoS Biology, 2016, 14(8): e1002533
[14] Gilbert J A, Blaser M J, Caporaso J G, et al. Current understanding of the human microbiome [J]. Nature Medicine, 2018, 24(4): 392-400
[15] Jin M C, Qian Z Y, Yin J Y, et al. The role of intestinal microbiota in cardiovascular disease [J]. Journal of Cellular and Molecular Medicine, 2019, 23(4): 2343-2350
[16] Hobby G P, Karaduta O, Dusio G F, et al. Chronic kidney disease and the gut microbiome [J]. American Journal of Physiology-Renal Physiology, 2019, 316(6): 1211-1217
[17] Rajendiran E, Ramadass B, Ramprasath V. Understanding connections and roles of gut microbiome in cardiovascular diseases [J]. Canadian Journal of Microbiology, 2021, 67(2): 101-111
[18] Zeng S L, Li S Z, Xiao P T, et al. Citrus polymethoxyflavones attenuate metabolic syndrome by regulating gut microbiome and amino acid metabolism [J]. Science Advances, 2020, 6(1): eaax6208
[19] 李米环, 李国强. 能量代谢指标与肥胖评价方法关系分析[J]. 中国组织工程研究与临床康复, 2008, 12(24): 4763-4766
Li M H, Li G Q. Correlation between metabolism indexes and obesity assessment [J]. Journal of Clinical Rehabilitative Tissue Engineering Research, 2008, 12(24): 4763-4766 (in Chinese)
[20] 罗琥捷, 杨宜婷, 宁嘉玲, 等. 与体重、体脂、摄食行为及能量代谢特异相关的生物激素研究进展[J]. 中国民族民间医药, 2016, 25(3): 28-29
[21] Marana M H, Poulsen R, Thormar E A, et al. Plastic nanoparticles cause mild inflammation, disrupt metabolic pathways, change the gut microbiota and affect reproduction in zebrafish: A full generation multi-omics study [J]. Journal of Hazardous Materials, 2022, 424(Pt D): 127705
[22] Li L L, Amara R, Souissi S, et al. Impacts of microplastics exposure on mussel (Mytilus edulis) gut microbiota [J]. The Science of the Total Environment, 2020, 745: 141018
[23] Huang J N, Wen B, Xu L, et al. Micro/nano-plastics cause neurobehavioral toxicity in discus fish (Symphysodon aequifasciatus): Insight from brain-gut-microbiota axis [J]. Journal of Hazardous Materials, 2022, 421: 126830
[24] Sun H Q, Chen N, Yang X N, et al. Effects induced by polyethylene microplastics oral exposure on colon mucin release, inflammation, gut microflora composition and metabolism in mice [J]. Ecotoxicology and Environmental Safety, 2021, 220: 112340
[25] Kelsey M D, Nelson A J, Green J B, et al. Guidelines for cardiovascular risk reduction in patients with type 2 diabetes [J]. Journal of the American College of Cardiology, 2022, 79(18): 1849-1857
[26] Yue J T Y, Duca F A, Lam T K T. Silencing gut CCK cells alters gut reaction to sugar [J]. Nature Neuroscience, 2022, 25(2): 136-138
[27] Huang H H, Wang T Y, Yao S F, et al. Gastric mobility and gastrointestinal hormones in older patients with sarcopenia [J]. Nutrients, 2022, 14(9): 1897
[28] Qin J, Cai Y, Xu Z, et al. Molecular mechanism of agonism and inverse agonism in ghrelin receptor [J]. Nature Communications, 2022, 13(1): 300
[29] Anbumani S, Kakkar P. Ecotoxicological effects of microplastics on biota: A review [J]. Environmental Science and Pollution Research, 2018, 25(15): 14373-14396
[30] 袁鹏, 胡献刚, 周启星. 微塑料在肠道的蓄积毒性及其生态危害研究进展[J]. 徐州工程学院学报: 自然科学版, 2019, 34(4): 54-58
Yuan P, Hu X G, Zhou Q X. Progress on cumulative toxicity and ecological hazards of microplastics in intestinal tract [J]. Journal of Xuzhou Institute of Technology: Natural Sciences Edition, 2019, 34(4): 54-58 (in Chinese)
[31] Qiao R X, Sheng C, Lu Y F, et al. Microplastics induce intestinal inflammation, oxidative stress, and disorders of metabolome and microbiome in zebrafish [J]. The Science of the Total Environment, 2019, 662: 246-253
[32] Huang J N, Wen B, Zhu J G, et al. Exposure to microplastics impairs digestive performance, stimulates immune response and induces microbiota dysbiosis in the gut of juvenile guppy (Poecilia reticulata) [J]. The Science of the Total Environment, 2020, 733: 138929
[33] Jin Y X, Lu L, Tu W Q, et al. Impacts of polystyrene microplastic on the gut barrier, microbiota and metabolism of mice [J]. The Science of the Total Environment, 2019, 649: 308-317
[34] Scherer C, Brennholt N, Reifferscheid G, et al. Feeding type and development drive the ingestion of microplastics by freshwater invertebrates [J]. Scientific Reports, 2017, 7(1): 17006
[35] Moreno J. Prevotella copri and the microbial pathogenesis of rheumatoid arthritis [J]. Reumatologia Clinica, 2015, 11(2): 61-63
[36] 毛微波. Ghrelin. 一个促生长激素分泌及调节能量代谢的新多肽[J]. 国外医学 内分泌学分册, 2002, 22(3): 174-177
[37] Everard A, Cani P D. Gut microbiota and GLP-1 [J]. Reviews in Endocrine and Metabolic Disorders, 2014, 15(3): 189-196
[38] Turnbaugh P J, Ley R E, Mahowald M A, et al. An obesity-associated gut microbiome with increased capacity for energy harvest [J]. Nature, 2006, 444(7122): 1027-1031
[39] Cheesman S E, Neal J T, Mittge E, et al. Epithelial cell proliferation in the developing zebrafish intestine is regulated by the Wnt pathway and microbial signaling via Myd88 [J]. Proceedings of the National Academy of Sciences of the United States of America, 2011, 108(Suppl 1): 4570-4577
[40] 李惠, 王学红, 马臻棋, 等. 短链脂肪酸与代谢相关性疾病的研究进展[J]. 中国医刊, 2022, 57(4): 367-371
Li H, Wang X H, Ma Z Q, et al. Progress of short-chain fatty acids and metabolic related diseases [J]. Chinese Journal of Medicine, 2022, 57(4): 367-371 (in Chinese)
[41] van der Hee B, Wells J M. Microbial regulation of host physiology by short-chain fatty acids [J]. Trends in Microbiology, 2021, 29(8): 700-712