近年来随着我国工业化、城镇化的快速推进,以及大量化肥和农药的使用,加之污水灌溉、固体垃圾堆积及矿山开采冶炼等多种原因,导致重金属特别是镉污染日趋严重。镉(cadmium, Cd)是环境中常见的重金属元素,却并非植物生长发育所需的必需元素。相反,当镉累积到一定浓度时,植物的生长发育与生理活动会受到不同程度的影响。镉对植物毒害的表现形式多种多样[1],游离镉毒害使植物细胞骨架组装紊乱[2],超微结构表现异常[3],叶绿体膜系统崩溃及类囊体结构退化[4],组织完整性受损直至植株死亡[5]。水体中的镉污染可导致水生植物氮代谢紊乱、氮素积累量下降[6];游离镉可推动水体中藻类群落演替[7],使水体中浮游植物多样性下降[8]。环境中的镉还在水稻等植物中富集[9],通过食物链进入人体,严重影响人类健康[10]。吸收入植物体内游离镉,易与酶活性中心或蛋白质中的巯基结合,取代原本位于活性中心的其他二价金属离子,使酶失去原有功能而失活变性,含有Zn、Mg和Fe的酶及光合磷酸化和呼吸电子传递链等生理活动都将受到抑制和破坏[11]。
植物的镉逆境胁迫响应是多个代谢酶系统共同参与的整体调控反应[12]。镉胁迫影响植物内生激素平衡,光合能力受损[13];镉胁迫烟草各项激素与膜质过氧化系统呈现低浓度下合成上升而高浓度时下降的特征[14];过氧化酶系统对清除镉毒害产生的活性氧具有重要作用[15];植株整体可借助自身结构将所吸收的镉钝化并转移,减少外环境中镉毒害影响[16];小麦根系在镉胁迫下会改变氨基酸分泌物以减轻镉危害[17]。植物防御素类似物蛋白调控基因CAL1可指导重金属螯合物的合成,借此定向调控镉在植株体中的积累过程[18]。细胞自噬过程中可能通过调节活性氧应答镉胁迫[19]。植物的不同器官对镉耐受程度有所区别,镉在水稻不同部位累积为根>茎叶鞘>叶片[20]。镉胁迫可能通过影响微管蛋白组装而扰乱正常的染色体聚合与分配过程,并引发染色体畸变[21]。徐萍[22]发现在10-5 mol·L-1镉浓度下大蒜(Allium sativum L.)根尖分裂间期微管会出现异常条纹、断片和碎片化;分裂期微管会出现异常的微管凝结现象。目前对于植物吸收镉机理的生物学研究大多集中在模式植物和常见农作物,对植物悬浮细胞在重金属胁迫下力学参数变化的研究目前报道较少,我们对砷胁迫[23]和镉胁迫下植物悬浮细胞的整体黏弹性与应力变化进行了初步的探索。
1 材料与方法(Materials and methods)
1.1 供试材料
Lifeact-EGFP烟草悬浮细胞:自行构建的增强型绿色荧光蛋白标记微丝[24](Lifeact-EGFP)的转基因本氏烟草(Nicotiana benthamiana)(以下简称Lifeact-EGFP烟草)。在含有100 mg·L-1潮霉素(上海生工)的1/2 MS培养基平板上播种Lifeact-EGFP烟草,待种子萌芽未出真叶时,将萌芽转移到BY-2培养基平板(MS+3.0 mg·L-1 2,4-D+1.0 mg·L-1 6-BA+30 g·L-1 Sucrose+15 g·L-1 Agar)上诱导愈伤组织,愈伤组织长出后再传代3~4次,挑取色泽淡黄、质地松散的愈伤组织转入BY-2细胞液体培养基(MS+3.0 mg·L-1 2,4-D+1.0 mg·L-1 6-BA+30 g·L-1 Sucrose)中扩增,每2周继代一次,继代时取少量细胞悬浮液镜检,直至得到离散程度较高的烟草悬浮细胞。
1.2 实验方法
1.2.1 镉胁迫下烟草细胞微丝组装程度变化实时监测
配制含镉BY-2液体培养基:将CdCl2·2.5H2O晶体(国药化学试剂有限公司,分析纯)溶解于BY-2液体培养基中,配制10-2 mol·L-1培养基母液,梯度稀释至10-8 mol·L-1。
静电黏附界面修饰:与动物上皮细胞不同,植物悬浮细胞不具备贴壁效应,需要一个被修饰的界面使之形成基本同一的单层,以备后续观察及监测。聚二烯丙基二甲基氯化铵(poly dimethyl diallyl ammonium chloride, PDADMAC)是一种高分子强阳性电解质,工业生产中常用于捕捉带负电的物质,此处用于植物细胞的静电黏附修饰[25]。ITO小池为实验室自制,底部为氧化铟锡(indium tin oxide, ITO)镀层玻片(珠海凯为光电股份有限公司),小池最大容量1 000 μL,实验中所用最大容量为500 μL。将ITO小池置于超净台内,紫外线照射灭菌不少于30 min。向ITO小池中加入200 μL经过滤灭菌的1%(V∶V)PDADMAC(Sigma-Aldrich,德国)溶液,遮光修饰不少于30 min,然后吸去多余的1% PDADMAC溶液,在超净工作台内以超纯氮气(长沙鑫湘气体分析仪器经营部)吹干,使ITO表面形成一层静电修饰膜。完成后以小块封板膜密封池口保持内部洁净无菌。
在ITO玻底小池中黏附细胞:将Lifeact-EGFP烟草悬浮细胞过筛,提取100~500目之间即短轴径在25~165 μm的悬浮细胞为待黏附的细胞,适当调整细胞浓度至每毫升500~1 000个。吸取过筛后细胞悬液500 μL加入到已修饰的ITO小池内,小块透明封板膜密封池口,静置遮光黏附约30 min,使悬浮细胞被静电吸引至ITO镀层表面。
胁迫实时观察:将黏附细胞的ITO小池置于LumascopeTM720全自动活细胞成像系统(Etaluma,美国)的载物台上,观察细胞黏附情况,选取荧光信号鲜明、生长状态良好的Lifeact-EGFP烟草悬浮细胞视野。从小池中替换实验组浓度的含镉培养基250 μL,使小池中镉离子浓度为所加入的含镉培养基的1/2。迅速开启延时拍摄程序,设置总时长5 h,间隔时长1 min。进行空白对照实时观察时,沿用上述操作,将加入的含镉培养基更换为无镉的BY-2液体培养基。
基于图像的荧光半定量分析:选取最具代表性的样本,将胁迫实时观察采集的图像导入软件ImageJ中。Image → Color → Split Channels将三色场分离,选取绿场灰度图像;Image → Adjust → Threshold选择Default计量模式,勾选Dark background识别暗底背景,设置量程为40~255;Analyze → Set Measurement,勾选Area、Mean gray value、Standard deviation、Limit to threshold这4项;最后Analyze → Measure,测得该绿场图像整体的平均灰度强度值(mean gray value, Mean)与荧光区域面积值(Area),并以公式:荧光强度总和(integrated density, IntDen) = 平均荧光强度(Mean)×荧光区域面积(Area)求得图像的总体荧光强度值。每一胁迫观察取样31张,即每10 min一帧,取样时长5 h。数据处理:使用Origin2018制作基于图像的荧光半定量数据变化图。
1.2.2 在QCM-922A多通道石英晶体微天平上实时监测镉胁迫下烟草细胞黏弹性变化
该法所用Teflon®模块池为实验室自行设计,由Teflon®块经机床切削制造,规格适配所用ITO镀层9 MHz AT切石英晶体传感器芯片 (仁路晶体) (以下简称传感器芯片)。完成组装的传感器芯片-Teflon测试池,设计最大容量250 μL,实验所用最大容量200 μL。测试池清洁消毒、黏附界面修饰方法同1.2.1。连通测试模块与QCM-922A多通道石英晶体微天平(AMETEK Scientific Instruments Ltd.,美国),在QCM调制界面上调整所测传感器芯片相关参数,设置采样时间为1 s,从空池开始实时监测。待所示曲线平稳后,向测试池加液口中加入BY-2液体培养基200 μL,继续运行不少于6~8 h,观察所显示的图形;运行至平稳后,从池中替换100 μL细胞悬浮液,即向测试池中加入细胞3 000~5 000个;继续运行4~6 h,使悬浮细胞完全黏附在传感器芯片表面;待运行至平稳,从小池中替换实验组浓度的含镉培养基100 μL,使小池中镉离子浓度为所加入的含镉培养基的一半,继续运行不少于5 h,停机并保存数据。进行空白对照组细胞黏弹性监测时,沿用上述操作,将替换的含镉培养基变更为无镉的BY-2液体培养基。
收集在石英晶体微天平上所测定数据,以公式CVI=ΔR/ΔF计算细胞黏弹性指数。式中:CVI即细胞黏弹性指数(cell viscoelastic index)[26],ΔR为扣除基础的电阻变化值,ΔF为扣除基础的频率变化值。完成计算后,在Origin2018上绘制CVI随时间变化图。
1.2.3 镉胁迫下5 h内烟草悬浮细胞过氧化氢酶(CAT)活力测定
准备样品:将烟草悬浮细胞经100目过筛,抽样以血球计数板法计数并估算细胞浓度。将过筛的悬浮细胞等体积分装至10 mL小离心管中,每管6 mL。
胁迫处理:1 000 r·min-1离心10 min使细胞沉淀在底部,将管中一半体积(3 mL)的培养基上清替换为含镉离子BY-2液体培养基,使管中镉离子浓度为所加入的含镉培养基的一半,重悬细胞并开始计时;在开始计时后第1、2、3、4和5小时以去尖移液器吸取细胞悬浮液1 mL转入1.5 mL离心管中,4 000 r·min-1离心弃去含镉培养基后,等体积pH 7.4的PBS(北京索莱宝科技有限公司)溶液重悬细胞,迅速浸入液氮中速冻10 min。
测试取样:将速冻的样品在4 ℃环境中解冻后摇匀,3 000 r·min-1离心15 min,取上清为样品,按过氧化酶微量样品试剂盒(南京建成生物工程研究所)说明书操作制样,用酶标仪(Multiskan skyhigh全波长酶标仪,赛默飞世尔科技有限公司)测定。
数值统计:计算酶活力时,根据试剂盒说明书所述原理公式,根据实验所需将组织浓度改为细胞浓度,定义酶活力单位为单位时间内每个细胞分解相应底物量(U·cell-1),公式如下:
UCAT=(空白对照OD+自身对照OD-测定OD)×![]() 待测样本细胞浓度(cell·mL-1)
待测样本细胞浓度(cell·mL-1)
每样本重复3次以校正偏差,完成计算后在Origin2018上绘制酶活力随时间变化图。
2 结果(Results)
2.1 镉胁迫下烟草细胞微丝组装程度变化实时监测
如图1和图4所示,Lifeact-EGFP烟草悬浮细胞在10-4~10-7 mol·L-1镉离子胁迫下,细胞具有的平均荧光强度、荧光区域面积与荧光强度总和均在胁迫观察早期就开始下降;荧光信号的上述3个参数在10-4 mol·L-1组别下降最快;在10-4~10-6 mol·L-1组别,胁迫处理所用镉离子浓度越大,细胞荧光信号下降的速度越快;在10-7 mol·L-1组别,细胞荧光信号在胁迫开始早期下降得很快,但在后期下降速度很慢,并且直到观察结束时,细胞内还有残余的荧光信号。在10-8 mol·L-1组别中,细胞具有的平均荧光强度、荧光区域面积与荧光强度总和在胁迫观察早期呈现上升,荧光强度总和高于胁迫观察开始时的值,并在高于初始值的范围内保持近1 h,而后缓慢下降(图2和图4(e))。Lifeact-EGFP烟草悬浮细胞在无镉离子胁迫时,微丝荧光强度缓慢下降(图3和图4(f))。

图1 Lifeact-EGFP烟草悬浮细胞在10-4~10-7 mol·L-1镉离子胁迫下的荧光实时观察图像
注: (a) 10-4 mol·L-1,(b) 10-5 mol·L-1,(c) 10-6 mol·L-1,(d) 10-7 mol·L-1;从左至右分别为0 s、10 min、1 h和2 h时的
细胞荧光强度实时变化,标尺为100 μm。
Fig. 1 Real-time fluorescence images of Lifeact-EGFP tobacco suspension cells observed under
the stress of 10-4~10-7 mol·L-1 cadmium ion
Note: (a) 10-4 mol·L-1, (b) 10-5 mol·L-1, (c) 10-6 mol·L-1, (d) 10-7 mol·L-1; from left to right are the real-time changes of cells’ fluorescence
intensity at 0 s, 10 min, 1 h and 2 h; bar is 100 μm.
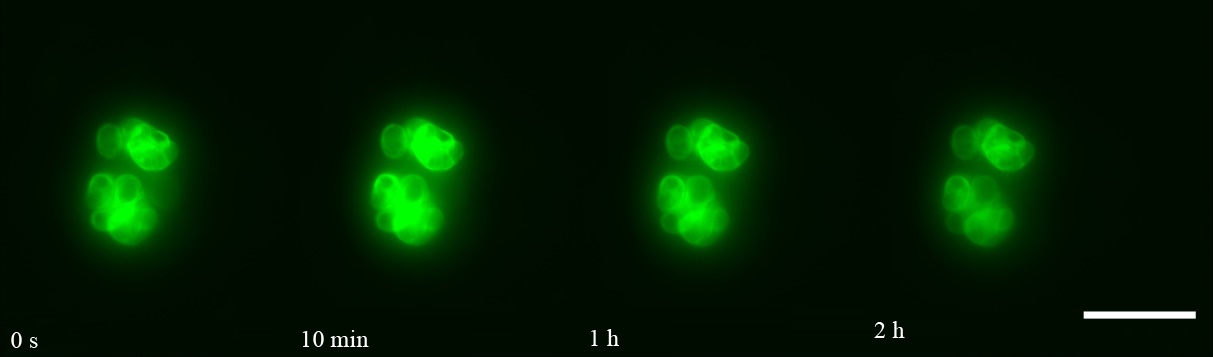
图2 Lifeact-EGFP烟草悬浮细胞在10-8 mol·L-1镉离子胁迫下不同时间的荧光实时观察图像
注:标尺为100 μm。
Fig. 2 Real-time fluorescence images of Lifeact-EGFP tobacco suspension cells observed under the stress
of 10-8 mol·L-1 cadmium ion at different time
Note: Bar is 100 μm.
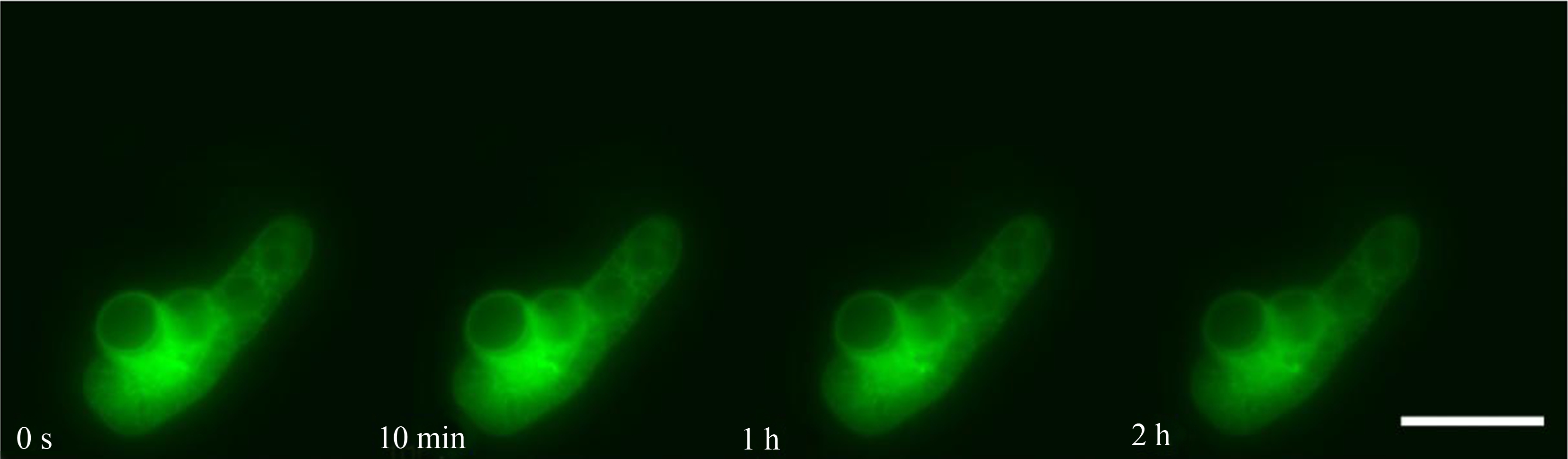
图3 Lifeact-EGFP烟草悬浮细胞在无镉离子胁迫下不同时间的荧光实时观察图像
注:标尺为100 μm。
Fig. 3 Real-time fluorescence images of Lifeact-EGFP tobacco suspension cells in the absence
of cadmium ion (blank control) at different time
Note: Bar is 100 μm.

图4 Lifeact-EGFP烟草悬浮细胞在不同浓度镉离子胁迫下0~5 h的荧光强度总和(IntDen)实时变化
注:(a) 10-4 mol·L-1;(b) 10-5 mol·L-1;(c) 10-6 mol·L-1;(d) 10-7 mol·L-1;(e) 10-8 mol·L-1;(f) 空白对照。
Fig. 4 Real-time changes of the total fluorescence intensity (IntDen) of Lifeact-EGFP tobacco suspension cells under
the stress of different concentrations of cadmium ion for 0~5 h
Note: (a) 10-4 mol·L-1; (b) 10-5 mol·L-1; (c) 10-6 mol·L-1; (d) 10-7 mol·L-1; (e) 10-8 mol·L-1; (f) blank control.
2.2 QCM-922A多通道石英晶体微天平上实时监测镉胁迫下烟草细胞黏弹性变化
PDADMAC静电修饰方法将烟草悬浮细胞黏附在传感器芯片表面,通过QCM技术实时监测不同浓度镉离子胁迫下烟草悬浮细胞的黏弹性变化。结果显示,烟草悬浮细胞在10-4~10-7 mol·L-1镉离子浓度范围胁迫下,细胞黏弹性在监测时间内呈现早期短暂上升,总体趋势下降的变化(图5(a)~(d));在10-8 mol·L-1镉离子胁迫下,细胞黏弹性在监测时间内呈现先降后升的变化(图5(e));在无镉离子的空白对照中,在更换培养基早期细胞黏弹性下降,后期保持不变(图5(f))。

图5 烟草悬浮细胞在不同浓度镉离子胁迫下5 h内细胞黏弹性指数(CVI)变化
注:(a)10-4 mol·L-1;(b)10-5 mol·L-1;(c)10-6 mol·L-1;(d)10-7 mol·L-1;(e)10-8 mol·L-1;(f)空白对照。
Fig. 5 Changes of cell viscoelasticity index (CVI) of tobacco suspension cells under the stress of different concentrations
of cadmium ion within 5 h
Note: (a) 10-4 mol·L-1; (b) 10-5 mol·L-1; (c) 10-6 mol·L-1; (d) 10-7 mol·L-1; (e) 10-8 mol·L-1; (f) blank control.
2.3 镉胁迫下5 h内烟草悬浮细胞过氧化氢酶活力测定
如图6所示,所有实验组别CAT酶活力均高于空白对照,并呈现出先升后降的整体变化趋势。其中10-8 mol·L-1组别的酶活力波动程度最小。
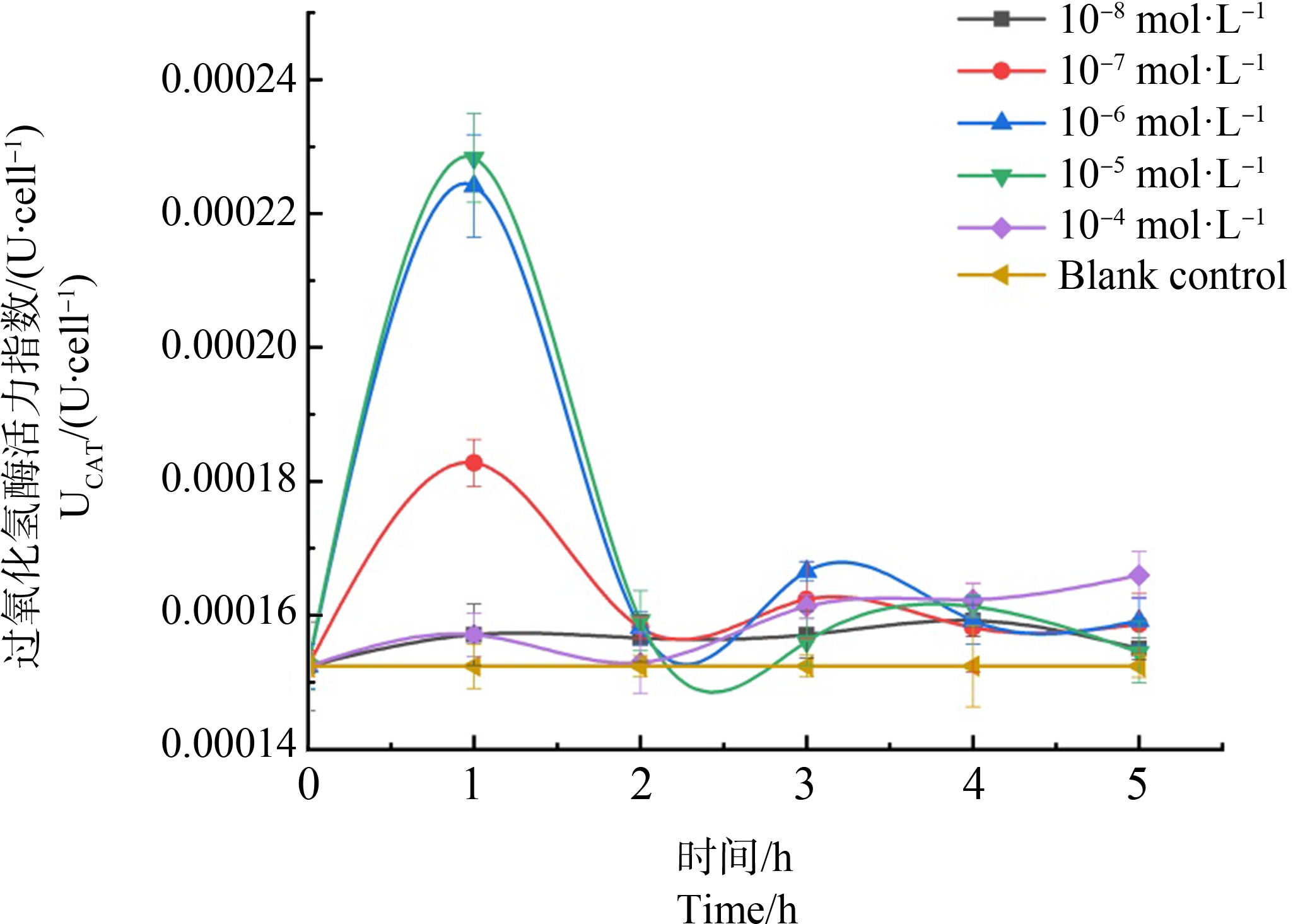
图6 过氧化氢酶(CAT)在不同浓度梯度镉离子胁迫下5 h内酶活力变化
Fig. 6 Catalase (CAT) activity changes within 5 h under different concentration gradient of cadmium ion stress
3 讨论(Discussion)
悬浮细胞本身具有分化程度低、代谢较旺盛、与相邻细胞粘连程度低等特点,这使得我们能够从细胞层次探索镉逆境胁迫过程中植物细胞生理效应的变化。通过绿色荧光蛋白标记细胞微丝,本研究首先监测了不同浓度镉离子胁迫下细胞微丝形态的变化。采用本课题组建立的植物细胞力学方法[23, 25-26],本研究探索了镉逆境胁迫对烟草悬浮细胞黏弹性指数的影响。我们认为镉胁迫下植物细胞黏弹性变化的主要影响因素包括细胞壁的侵蚀与交联程度变化、细胞内膜系统的崩解、细胞骨架的聚合和解聚等3个方面。
细胞壁是重金属离子跨膜进入细胞质的第一道屏障结构。一方面,细胞壁对重金属离子的固定、吸收和转运过程起着重要的作用。另一方面,环境中的镉离子在细胞壁两侧化学势差的推动下,可从外至内逐渐侵蚀破坏细胞壁结构[27],使细胞壁逐渐解体。细胞壁外侧受侵蚀同时,胞内过氧化物累积促使酚类化合物和糖蛋白作用促进细胞壁交联[28];而在后期过氧化物积累形成的羟自由基[29]将切割细胞壁结构中糖键,促进细胞壁结构的解体。目前由于实验条件的限制,本研究无法区分细胞壁黏弹性与细胞膜黏弹性变化。本文也从细胞力学角度首次发现了在10-4~10-7 mol·L-1镉离子浓度范围胁迫下,细胞黏弹性短暂上升(细胞变硬)的现象。
在镉侵蚀细胞壁同时,极少量的镉离子通过细胞膜上钙离子通道[30]进入细胞内,扰乱细胞内钙调蛋白信号通路调控[31]的一系列原有生理活动,细胞内生理反应活动失控。游离镉可诱发细胞膜电位去极化与超极化[32]。细胞内膜系统将从线粒体等高代谢率部位开始大量累积膜质过氧化物等自由基[33],伴随着细胞内膜结构系统上膜脂过氧化物的大量累积[34],原有生物膜磷脂双分子结构破坏并扩散为整个细胞内膜系统结构的解体[35]。细胞内膜系统的崩解是本研究监测到的CVI后续降低(细胞变软)重要影响因素。
镉逆境胁迫对细胞内微丝骨架的动态结构的影响呈现多态性。本研究观测到了微丝骨架在镉胁迫下普遍的解聚和在极低浓度镉离子(10-8 mol·L-1)胁迫下的早期聚合现象(图1和图2)。一种可能的解释是极微量的胞内游离二价镉取代原有钙调蛋白介导信号通路,不可逆地促进肌动蛋白单体合成[36]。然而在本文所涉整个镉逆境胁迫中,细胞内促进肌动蛋白合成与微丝组装的因素,其效力远低于破坏细胞肌动蛋白合成与微丝组装的各种因素。在镉离子胁迫下,胞内肌动蛋白单体结构异常及变性[37];细胞内膜系统结构塌陷解体使与膜结构相连的微丝结构与膜系统一同解体[38],表现为所观测到的微丝标记荧光信号的不断下降(图1和图4)。
本文从细胞力学角度为植物重金属逆境胁迫生理生化的研究提供了新的视角。目前对植物细胞黏弹性监测的研究方法尚不完备,无法全面地解释镉逆境下植物细胞结构成分的详细动态响应过程与生物力学参数变化,如需详细探索重金属胁迫对植物细胞结构稳定性的影响机制,尚待细胞力敏传感技术、高分辨率成像工具与细胞内示踪技术的进一步发展。
[1] 张军, 束文圣. 植物对重金属镉的耐受机制[J]. 植物生理与分子生物学学报, 2006, 32(1): 1-8
Zhang J, Shu W S. Mechanisms of heavy metal cadmium tolerance in plants [J]. Journal of Plant Physiology and Molecular Biology, 2006, 32(1): 1-8 (in Chinese)
[2] 胡金朝. 重金属污染对不同生境水生植物的毒害机理研究[D]. 南京: 南京师范大学, 2006: 106-112
Hu J C. The toxic mechanism study of heavy metal pollution on aquatic plant under different growth conditions [D]. Nanjing: Nanjing Normal University, 2006: 106-112 (in Chinese)
[3] 周红卫, 施国新, 杜开和, 等. Cd2+污染对水花生生理生化及超微结构的影响[J]. 应用生态学报, 2003, 14(9): 1581-1584
Zhou H W, Shi G X, Du K H, et al. Toxic effects of Cd2+ pollution on the biochemical and physiological characters and ultrastructure of Alternanthera philoxeroides [J]. Chinese Journal of Applied Ecology, 2003, 14(9): 1581-1584 (in Chinese)
[4] 袁祖丽, 马新明, 韩锦峰, 等. 镉污染对烟草叶片超微结构及部分元素含量的影响[J]. 生态学报, 2005, 25(11): 2919-2927
Yuan Z L, Ma X M, Han J F, et al. Effect of Cd Contamination on ultramicroscopic structure and some elements content of tobacco leaves [J]. Acta Ecologica Sinica, 2005, 25(11): 2919-2927 (in Chinese)
[5] 王模善, 赵铁铭. 重金属镉对沉水植物毒性效应的研究[J]. 西南大学学报(自然科学版), 2008, 30(4): 128-134
Wang M S, Zhao T M. Toxicity of cadmium to submerged macrophytes [J]. Journal of Southwest University (Natural Science Edition), 2008, 30(4): 128-134 (in Chinese)
[6] 戴灵鹏, 熊治廷, 马海虎. 镉对满江红(Azolla imbricata)-鱼腥藻(Anabaena azollae)共生体氮代谢的影响[J]. 生态学报, 2009, 29(3): 1629-1635
Dai L P, Xiong Z T, Ma H H. Effects of cadmium on nitrogen metabolism in Azolla imbricata-Anabaena azollae symbiosis [J]. Acta Ecologica Sinica, 2009, 29(3): 1629-1635 (in Chinese)
[7] 戴娟, 赖子尼, 王超, 等. 镉胁迫对浮游藻类群落演替研究[C]// 中国水产学会. 2007年中国水产学会学术年会暨水产微生态调控技术论坛论文摘要汇编. 桂林: 中国水产学会, 2007: 97
[8] 马頔. 镉胁迫对藻类生物多样性影响的微宇宙实验研究[D]. 西安: 西北大学, 2018: 28-31
Ma D. The relationship between algae biodiversity and biomass under different cadmium stress: A microcosm experiment [D]. Xi’an: Northwest University, 2018: 28-31 (in Chinese)
[9] 孙聪, 陈世宝, 宋文恩, 等. 不同品种水稻对土壤中镉的富集特征及敏感性分布(SSD)[J]. 中国农业科学, 2014, 47(12): 2384-2394
Sun C, Chen S B, Song W E, et al. Accumulation characteristics of cadmium by rice cultivars in soils and its species sensitivity distribution [J]. Scientia Agricultura Sinica, 2014, 47(12): 2384-2394 (in Chinese)
[10] 赵雄, 李福燕, 张冬明, 等. 水稻土镉污染与水稻镉含量相关性研究[J]. 农业环境科学学报, 2009, 28(11): 2236-2240
Zhao X, Li F Y, Zhang D M, et al. Relationship between paddy soils cadmium pollution and cadmium content in rice [J]. Journal of Agro-Environment Science, 2009, 28(11): 2236-2240 (in Chinese)
[11] 杨丹慧. 重金属离子对高等植物光合膜结构与功能的影响[J]. 植物学通报, 1991, 26(3): 26-29
Yang D H. The effects of heavy metals on the structure and function of photosynthetic membranes in higher plants [J]. Chinese Bulletin of Botany, 1991, 26(3): 26-29 (in Chinese)
[12] 伍自力, 余孟瑶, 陈露, 等. 小立碗藓对重金属镉胁迫的应答特征[J]. 植物学报, 2015, 50(2): 171-179
Wu Z L, Yu M Y, Chen L, et al. Transcriptome analysis of Physcomitrella patens response to cadmium stress by Bayesian network [J]. Chinese Bulletin of Botany, 2015, 50(2): 171-179 (in Chinese)
[13] 吴坤, 吴中红, 邰付菊, 等. 镉胁迫对烟草叶激素水平、光合特性、荧光特性的影响[J]. 生态学报, 2011, 31(16): 4517-4524
Wu K, Wu Z H, Tai F J, et al. Effects of cadmium on the contents of phytohormones, photosynthetic performance and fluorescent characteristics in tobacco leaves [J]. Acta Ecologica Sinica, 2011, 31(16): 4517-4524 (in Chinese)
[14] 袁祖丽, 吴中红. 镉胁迫对烟草根抗氧化能力和激素含量的影响[J]. 生态学报, 2010, 30(15): 4109-4118
Yuan Z L, Wu Z H. Effect of cadmium on antioxidative capability and phytohormone level in tobacco roots [J]. Acta Ecologica Sinica, 2010, 30(15): 4109-4118 (in Chinese)
[15] 汤春芳, 刘云国, 曾光明, 等. 镉胁迫对萝卜幼苗活性氧产生、脂质过氧化和抗氧化酶活性的影响[J]. 植物生理与分子生物学学报, 2004, 30(4): 469-474
Tang C F, Liu Y G, Zeng G M, et al. Effects of cadmium stress on active oxygen generation, lipid peroxidation and antioxidant enzyme activities in radish seedlings [J]. Acta Photophysiologica Sinica, 2004, 30(4): 469-474 (in Chinese)
[16] 王晓娟, 王文斌, 杨龙, 等. 重金属镉(Cd)在植物体内的转运途径及其调控机制[J]. 生态学报, 2015, 35(23): 7921-7929
Wang X J, Wang W B, Yang L, et al. Transport pathways of cadmium (Cd) and its regulatory mechanisms in plant [J]. Acta Ecologica Sinica, 2015, 35(23): 7921-7929 (in Chinese)
[17] 张玲, 王焕校. 镉胁迫下小麦根系分泌物的变化[J]. 生态学报, 2002, 22(4): 496-502
Zhang L, Wang H X. Changes of root exudates to cadmium stress in wheat (Triticum aestivm L.) [J]. Acta Ecologica Sinica, 2002, 22(4): 496-502 (in Chinese)
[18] 黄新元, 赵方杰. 植物防御素调控水稻镉积累的新机制[J]. 植物学报, 2018, 53(4): 451-455
Huang X Y, Zhao F J. A defensin-like protein regulates cadmium accumulation in rice [J]. Chinese Bulletin of Botany, 2018, 53(4): 451-455 (in Chinese)
[19] 管彬, 周竹青. 细胞自噬在拟南芥应答镉胁迫中的作用[J]. 江苏农业科学, 2019, 47(14): 90-95
Guan B, Zhou Z Q. Role of autophagy in response to cadmium stress in Arabidopsis thaliana [J]. Jiangsu Agricultural Sciences, 2019, 47(14): 90-95 (in Chinese)
[20] 赵步洪, 张洪熙, 奚岭林, 等. 杂交水稻不同器官镉浓度与累积量[J]. 中国水稻科学, 2006, 20(3): 306-312
Zhao B H, Zhang H X, Xi L L, et al. Concentrations and accumulation of cadmium in different organs of hybrid rice [J]. Chinese Journal of Rice Science, 2006, 20(3): 306-312 (in Chinese)
[21] Moral R, Cortés A, Gomez I, et al. Assessing changes in Cd phytoavailability to tomato in amended calcareous soils [J]. Bioresource Technology, 2002, 85(1): 63-68
[22] 徐萍. 镉胁迫对大蒜生理生化、微管骨架及超微结构的影响[D]. 天津: 天津师范大学, 2008: 45-55
Xu P. Effects of cadmium stress on physiology and biochemistry, microtubule skeleton and ultrastructure of garlic [D]. Tianjin: Tianjin Normal University, 2008: 45-55 (in Chinese)
[23] 周菲, 周铁安, 潘炜松. QCM实时监测五价砷胁迫对水稻悬浮细胞黏弹性的影响[J]. 激光生物学报, 2019, 28(5): 452-457, 420
Zhou F, Zhou T A, Pan W S. Real-time monitoring of the effect on the viscoelasticity of rice suspension cells with arsenic (Ⅴ) stress using QCM [J]. Acta Laser Biology Sinica, 2019, 28(5): 452-457, 420 (in Chinese)
[24] Riedl J, Crevenna A H, Kessenbrock K, et al. Lifeact: A versatile marker to visualize F-actin [J]. Nature Methods, 2008, 5(7): 605-607
[25] 张煜, 周铁安, 陈宗星, 等. 宽频耗散型石英晶体微天平实时监测PEG6000胁迫下烟草细胞的黏弹性响应[J]. 农业生物技术学报, 2020, 28(12): 2270-2280
Zhang Y, Zhou T A, Chen Z X, et al. Real-time monitoring of viscoelastic responses of tobacco (Nicotiana tabacum) cells under PEG6000 stress by wide frequency quartz crystal microbalance with dissipation [J]. Journal of Agricultural Biotechnology, 2020, 28(12): 2270-2280 (in Chinese)
[26] Zhou T A, Marx K A, Dewilde A H, et al. Dynamic cell adhesion and viscoelastic signatures distinguish normal from malignant human mammary cells using quartz crystal microbalance [J]. Analytical Biochemistry, 2012, 421(1): 164-171
[27] 马捷, 陈丰源, 周贝贝, 等. 海洋硅藻细胞表面物理化学特性对镉累积的影响[J]. 生态毒理学报, 2019, 14(1): 75-82
Ma J, Chen F Y, Zhou B B, et al. The effects of surface physicochemical properties on cadmium accumulation in marine diatoms [J]. Asian Journal of Ecotoxicology, 2019, 14(1): 75-82 (in Chinese)
[28] González L F, Rojas M C. Role of wall peroxidases in oat growth inhibition by DIMBOA [J]. Phytochemistry, 1999, 50(6): 931-937
[29] Renew S, Heyno E, Schopfer P, et al. Sensitive detection and localization of hydroxyl radical production in cucumber roots and Arabidopsis seedlings by spin trapping electron paramagnetic resonance spectroscopy [J]. The Plant Journal: for Cell and Molecular Biology, 2005, 44(2): 342-347
[30] Clemens S, Antosiewicz D M, Ward J M, et al. The plant cDNA LCT1 mediates the uptake of calcium and cadmium in yeast [J]. Proceedings of the National Academy of Sciences of the United States of America, 1998, 95(20): 12043-12048
[31] Subbaiah C C, Zhang J, Sachs M M. Involvement of intracellular calcium in anaerobic gene expression and survival of maize seedlings [J]. Plant Physiology, 1994, 105(1): 369-376
[32] 王丙莲, 孟庆军, 杨俊慧, 等. 藻细胞膜电信号对重金属的快速反应研究[J]. 生态毒理学报, 2007, 2(2): 172-177
Wang B L, Meng Q J, Yang J H, et al. Study on rapid responses of algae cell membrane electric signal to heavy metals [J]. Asian Journal of Ecotoxicology, 2007, 2(2): 172-177 (in Chinese)
![]() A, Ma
A, Ma ecka A, Kutrowska A, et al. Direct analysis of elemental biodistribution in pea seedlings by LA-ICP-MS, EDX and confocal microscopy: Imaging and quantification [J]. Microchemical Journal, 2016, 128: 305-311
ecka A, Kutrowska A, et al. Direct analysis of elemental biodistribution in pea seedlings by LA-ICP-MS, EDX and confocal microscopy: Imaging and quantification [J]. Microchemical Journal, 2016, 128: 305-311
[34] 金慧英, 李法卿, 谭维国, 等. 镉中毒肝脏过氧化氢(H2O2)定位及抗氧化系统的变化[J]. 中国公共卫生, 2000, 16(1): 15-16
Jin H Y, Li F Q, Tan W G, et al. Study on hydrogen peroxide (H2O2) localization and antioxidative system changes of hepatocytes after cadmium exposure [J]. China Public Health, 2000, 16(1): 15-16 (in Chinese)
[35] Garnier L, Simon-Plas F, Thuleau P, et al. Cadmium affects tobacco cells by a series of three waves of reactive oxygen species that contribute to cytotoxicity [J]. Plant, Cell & Environment, 2006, 29(10): 1956-1969
[36] Dalghi M G, Ferreira-Gomes M, Montalbetti N, et al. Cortical cytoskeleton dynamics regulates plasma membrane calcium ATPase isoform-2 (PMCA2) activity [J]. Biochimica et Biophysica Acta Molecular Cell Research, 2017, 1864(8): 1413-1424
[37] Yemets A, Horiunova I, Blume Y. Cadmium, nickel, copper, and zinc influence on microfilament organization in Arabidopsis root cells [J]. Cell Biology International, 2021, 45(1): 211-226
[38] Fan J L, Wei X Z, Wan L C, et al. Disarrangement of actin filaments and Ca2+ gradient by CdCl2 alters cell wall construction in Arabidopsis thaliana root hairs by inhibiting vesicular trafficking [J]. Journal of Plant Physiology, 2011, 168(11): 1157-1167