塑料因其低成本、耐用性、方便性被广泛应用于当代的日常生活、农业、畜牧业和航空航天的各个领域。据报道,截至2015年,全球大约产生了63亿t塑料垃圾,环境中累积了约49亿t塑料垃圾[1]。研究表明,由于塑料垃圾长期暴露于自然环境中,经过风吹、日晒、微生物作用和水体腐蚀等自然因素老化,最终塑料粒径变小,形成微/纳米塑料。在自然界几乎所有水体中都检测到微/纳米塑料的存在,尤其是越靠近人类活动的地方,微塑料的浓度越大[2-3]。微塑料在自然界的存在多为初级微塑料,经过自然老化形成次生微塑料。次生微塑料包括毫米、微米和纳米级的微塑料[4]。微/纳米塑料由于其特殊的表面形态,可与多种污染物,如与金属、微生物和病毒等,发生相互作用,有研究报道微塑料可以吸附新型冠状病毒[5]。尤其是,微/纳米塑料表面的含氧官能团容易吸附水体中其他溶解性有机污染物,比如抗生素、多氯联苯和多环芳烃。抗生素具有抑菌、杀菌作用,被广泛应用于人类和动物医学中[6]。由于其价格低廉,存在滥用现象,而污水处理厂没有相关配套处理措施,使得大量抗生素随人和动物的排泄物最终排入水体中。作为一种新型污染物,抗生素不仅对非靶生物存在潜在不利影响,还可能会选择自然界中耐抗生素的基因,形成超级细菌,影响人类生存和社会发展[7-10]。研究表明,受污染水体中的微/纳米塑料可能是抗生素的载体[11],与有机污染物结合会增强其毒性[12]。因此,微/纳米塑料和抗生素的相互作用机制及环境行为,引起人们的广泛关注。本文综述了微/纳米塑料与抗生素相互作用研究现状,以期为微塑料/抗生素吸附体的环境行为及对生物体的健康风险研究提供参考。
1 微/纳米塑料与抗生素的相互作用(Interaction between micro/nano plastics and antibiotics)
微/纳米塑料对抗生素的吸附取决于2种污染物的性质[13],如疏水性、亲水性是其主要结合机制。疏水性是微/纳米塑料与疏水有机污染物相互作用的主要因素[14],一般来说,疏水性强的有机污染物更容易被吸附在微塑料表面[15]。如原始聚苯乙烯(PS)颗粒对3种多环芳烃污染物(菲、萘和芘)的吸附作用远大于对3种抗生素(泰乐菌素、磺胺甲嘧啶和红霉素)的吸附作用[16],原因是这3种多环芳烃污染物属于疏水性有机物,抗生素为亲水性有机物。抗生素作为另一类典型的持久性有机污染物,其中包括了许多亲水性污染物[17],氢键、疏水相互作用、π-π相互作用、范德华力和静电相互作用是抗生素与微/纳米塑料之间的主要结合机制[18-19],如图1所示。
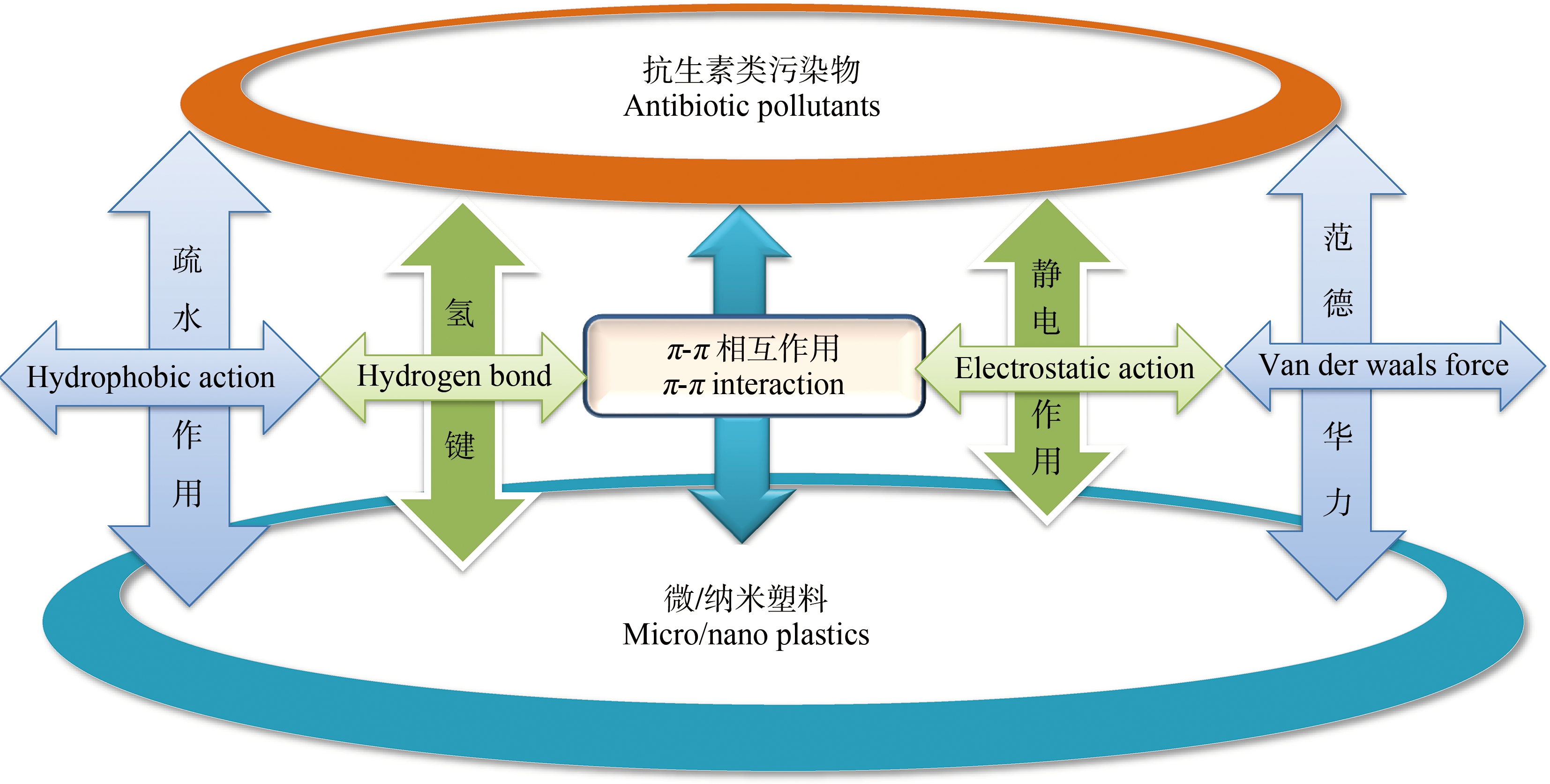
图1 微/纳米塑料和抗生素吸附机理图
Fig. 1 Adsorption mechanism of micro/nano plastics and antibiotics
一般地,微/纳米塑料对抗生素的吸附强度可用抗生物在微/纳米塑料和水之间的平衡分配系数(Kd)来表征[15]。Guo等[20]研究发现聚乙烯(PE)、聚对苯二甲酸乙二醇酯(PET)、聚苯乙烯(PS)、聚氯乙烯(PVC)和聚丙烯(PP)吸附水中抗生素的Kd值为22.2~30.9 L·kg-1,聚酰胺(PA)吸附能力最高,Kd值为284 L·kg-1。
微/纳米塑料老化以后表面形成的含氧官能团,如—OH、—COOH等,使其与周围水分子形成氢键,氢键的形成提高了微/纳米塑料对亲水性抗生素类污染物的吸附效果[16]。而疏水性有机物很难与水分子形成氢键,从而降低其被微/纳米塑料吸附的效果[21]。Sun等[22]研究发现聚乳酸微塑料去除生物膜后,对土霉素的平衡吸附量增加了39.01%,这是因为表面暴露了更多的含氧官能团,形成了更多的氢键增强了吸附效果。Zhang等[23]研究发现纳米PS-COOH对诺氟沙星和左氧氟沙星的吸附容量分别比纳米PS高54.9%和69.6%。此外,Guo等[20, 24]的研究表明6种微塑料对磺胺甲恶唑(SMX)的吸附主要机理可能是静电相互作用和氢键的形成,而6种微塑料对磺胺甲嘧啶SMT的吸附主要机理可能是静电相互作用和范德华力的形成。Xu等[25]的研究表明四环素在PE、PP和PS微塑料上的吸附过程包括疏水相互作用和其他相互作用(如静电相互作用),吸附等温线符合Langmuir模型。四环素在PS微塑料上的吸附容量高于PE和PP微塑料,这主要是由于四环素与PS微塑料之间存在极性相互作用和π-π相互作用所致。Zhang等[23]研究发现双氟喹诺酮类物质诺氟沙星和左氧氟沙星对纳米聚苯乙烯和羧基官能化纳米PS的主要吸附机制包括极性相互作用、静电相互作用和氢键作用。
2 微/纳米塑料性质对微塑料与抗生素相互作用的影响(Effect of micro/nano plastic properties on the interaction between micro plastics and antibiotics)
2.1 微/纳米塑料种类的影响
不同类型的微/纳米塑料具有不同的分子结构和功能基团,这可能导致微/纳米塑料与抗生素之间的相互作用机制不同[26],从而影响微/纳米塑料与污染物之间的吸附效果。Guo等[26]研究了4种微塑料PE、PP、PS和PVC对泰乐菌素的吸附情况,发现PVC的凸起表面更疏松,含有更多的折叠结构,提供了更多的吸附位点,所以吸附效果最好。Guo等[24]研究了6种微塑料对磺胺甲嘧啶的吸附能力,结果表明极性PA对极性磺胺甲嘧啶的吸附能力最强。Li等[18]研究了5种微塑料对5种抗生素的吸附效果,发现PA对抗生素的吸附能力最强,原因是形成了氢键及PA的孔隙比较发达,为吸附抗生素提供了更多有效位点。陈守益等[27]研究发现,PVC吸附泰乐菌素的能力远超PE,原因是PVC有较大的比表面积和较强的孔隙率。如表1所示,总结了目前国内外不同种类抗生素和不同种类微塑料的吸附机理。
表1 抗生素和微/纳米塑料吸附机理的研究总结
Table 1 Summary of research on adsorption mechanism of antibiotics and micro/nano plastics

微/纳米塑料种类Micro/nano plastic types尺寸Size抗生素种类Types of antibiotics主要机理Main mechanism吸附影响因素Influencing factors of adsorption参考文献Reference聚乙烯(PE)Polyethylene (PE)0.15~0.425 mm四环素、金霉素和土霉素Tetracycline, aureomycin and oxytetracycline氢键、静电相互作用和范德华力Hydrogen bond, electrostatic in-teraction and van der Waals forcepH和盐度pH and salinity[29]原始和滩涂聚苯乙烯(PS)Pristine and beach polystyrene (PS)0.45~1.00 mm土霉素Oxytetracycline静电相互作用、氢键和疏水相互作用Electrostatic interaction, hydrogen bond and hydrophobic interaction离子强度(Na+、Ca2+)富里酸(FA)和腐殖酸(HA)Ionic strength (Na+,Ca2+)fulvic acid (FA) and humic acid (HA)[23]PS8.8、50.4 μm环丙沙星Ciprofloxacin静电相互作用和π-π相互作用Electrostatic interaction and π-π interactionpH和温度pH and temperature[30]聚氯乙烯(PVC)Polyvinyl chloride (PVC);PE;PS;1、74 μm;74 μm;125 μm左氧氟沙星Levofloxacin氢键、静电相互作用和离子交换Hydrogen bonding, electrostatic interaction and ion exchange金属离子(Cu2+、 Zn2+、Cr3+、Cd2+和Pb2+)Ionic strength (Cu2+, Zn2+, Cr3+, Cd2+ and Pb2+)[31]聚丙烯(PP)Polypropylene (PP)PE、PS、PVC<74 μm泰乐菌素Tylosin静电相互作用、疏水作用和表面络合作用Electrostatic interaction, hydro-phobic interaction and surface complexationpH和盐度pH and salinity[26]PE、PVC<74 μm泰乐菌素Tylosin表面吸附和颗粒扩散Surface adsorption and particle diffusion无No data[27]聚乳酸(PLA)Polylactic acid (PLA)75~150 μm土霉素Oxytetracycline氢键、静电相互作用和疏相互水作用 Hydrogen bond, electrostatic in-teraction and hydrophobic inter-actionpH、FA以及两者混合的影响pH, FA and the mixed effects of the two[21]聚酰胺(PA)Polyamide (PA)PE、PS、PP、PVC75~180 μm磺胺嘧啶、阿莫西林、四环素、环丙沙星和甲氧苄啶Sulfadiazine, amoxicillin, tetracycline, ciprofloxacin and trimethoprim氢键相互作用、疏水相互作用、范德华力和静电相互作用Hydrogen bond interaction, hy-drophobic interaction, van der Waals force and electrostatic in-teraction离子强度和pH值Ionic strength and pH[17]PE100 μm环丙沙星Ciprofloxacin静电和疏水相互作用Electrostatic and hydrophobic in-teractionpH、盐度和HApH, salinity and HA[42]苯二甲酸乙二醇酯(PET)Ethylene glycol phthalate (PET)、老化PLA、PET、PP和原始PLA、PET、PPAged PLA, PET, PP and pristine PLA, PET, PP100~150 μm四环素Tetracycline氢键和静电相互作用Hydrogen bond and electrostatic interactionpH和盐度pH and salinity[37]PA、PE、PET、PS、PVC、PP100~150 μm磺胺甲恶唑Sulfamethoxazole氢键和静电相互作用Hydrogen bond and electrostatic interaction盐度和pHSalinity and pH[20]
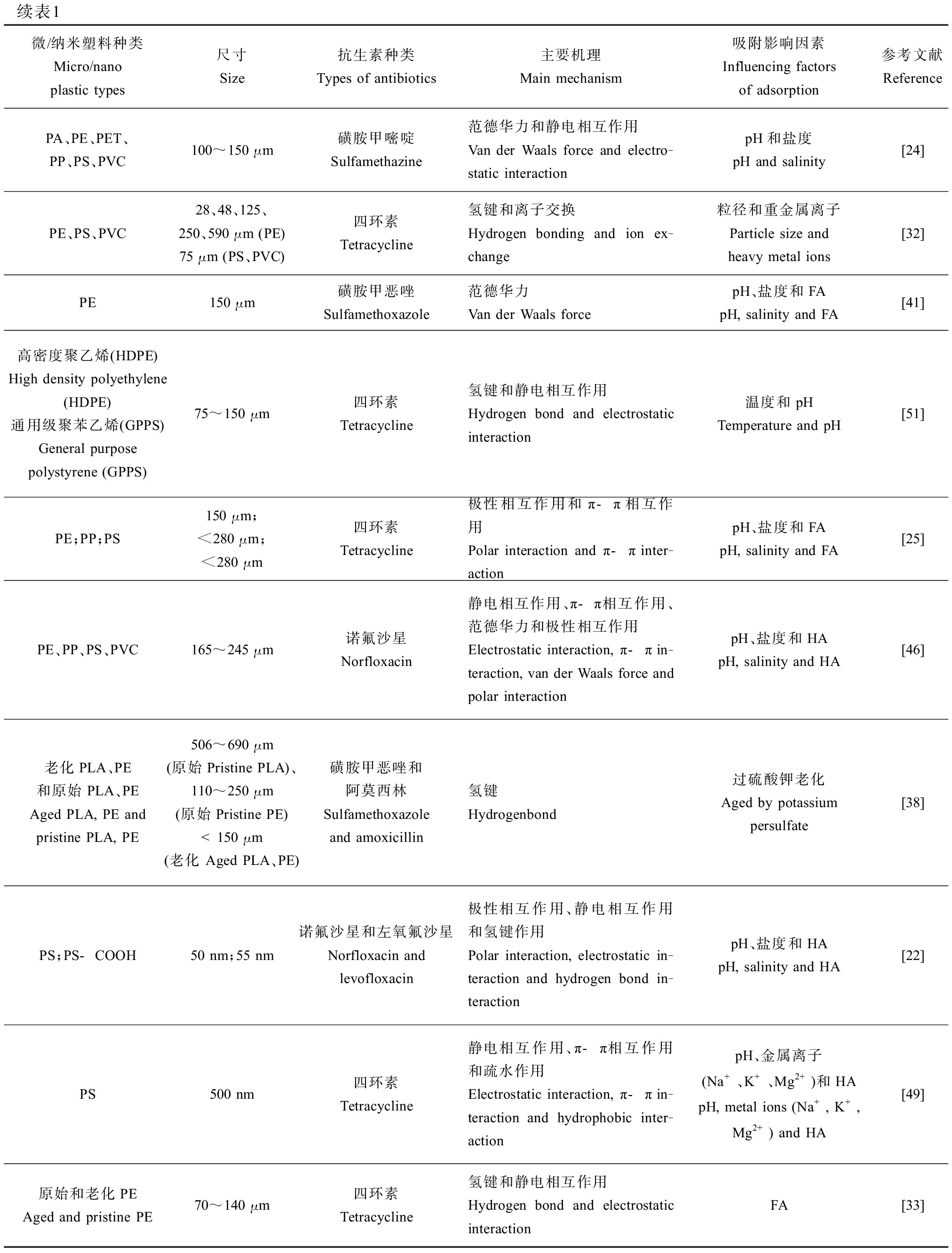
续表1微/纳米塑料种类Micro/nano plastic types尺寸Size抗生素种类Types of antibiotics主要机理Main mechanism吸附影响因素Influencing factors of adsorption参考文献ReferencePA、PE、PET、PP、PS、PVC100~150 μm磺胺甲嘧啶Sulfamethazine范德华力和静电相互作用Van der Waals force and electro-static interactionpH和盐度pH and salinity[24]PE、PS、PVC28、48、125、250、590 μm (PE)75 μm (PS、PVC)四环素Tetracycline氢键和离子交换Hydrogen bonding and ion ex-change粒径和重金属离子Particle size and heavy metal ions[32]PE150 μm磺胺甲恶唑Sulfamethoxazole范德华力Van der Waals forcepH、盐度和FApH, salinity and FA[41]高密度聚乙烯(HDPE)High density polyethylene(HDPE)通用级聚苯乙烯(GPPS)General purpose polystyrene (GPPS)75~150 μm四环素Tetracycline氢键和静电相互作用Hydrogen bond and electrostatic interaction温度和pHTemperature and pH[51]PE;PP;PS150 μm;<280 μm;<280 μm四环素Tetracycline极性相互作用和π-π相互作用Polar interaction and π-π inter-actionpH、盐度和FApH, salinity and FA[25]PE、PP、PS、PVC165~245 μm诺氟沙星Norfloxacin静电相互作用、π-π相互作用、范德华力和极性相互作用Electrostatic interaction, π-π in-teraction, van der Waals force and polar interactionpH、盐度和HApH, salinity and HA[46]老化PLA、PE和原始PLA、PEAged PLA, PE and pristine PLA, PE506~690 μm (原始Pristine PLA)、110~250 μm (原始Pristine PE)<150 μm (老化 Aged PLA、PE)磺胺甲恶唑和阿莫西林Sulfamethoxazole and amoxicillin氢键Hydrogenbond过硫酸钾老化Aged by potassium persulfate[38]PS;PS-COOH50 nm;55 nm诺氟沙星和左氧氟沙星Norfloxacin and levofloxacin极性相互作用、静电相互作用和氢键作用Polar interaction, electrostatic in-teraction and hydrogen bond in-teractionpH、盐度和HApH, salinity and HA[22]PS500 nm四环素Tetracycline静电相互作用、π-π相互作用和疏水作用Electrostatic interaction, π-π in-teraction and hydrophobic inter-actionpH、金属离子(Na+、K+、Mg2+)和HApH, metal ions (Na+, K+, Mg2+) and HA[49]原始和老化PE Aged and pristine PE70~140 μm四环素Tetracycline氢键和静电相互作用Hydrogen bond and electrostatic interactionFA[33]
2.2 微/纳米塑料粒径的影响
微/纳米塑料的粒径、团聚作用和形态同时决定了微/纳米塑料对抗生素的吸附能力。一般来说,微/纳米塑料的比表面积随着粒径的减少而增大,可提供的吸附位点增多,吸附能力就越强[28]。纳米PS的吸附能力远高于微米PE,这归因于纳米PS拥有更大的比表面积[29]。刘鹏等[30]研究了粒径分别为8.8 μm和50.4 μm的PS对环丙沙星的吸附行为,发现粒径小的微塑料明显具有更高的吸附能力。Yu等[31]研究了1 μm和74 μm的PVC对左氧氟沙星的吸附,发现1 μm的PVC吸附能力更强。同样地,Yu等[32]研究了不同微米级的PE对四环素的吸附,发现随着PE的粒径增大,平衡吸附量呈显著下降趋势。而处于中间粒径的125 μm的PE吸附能力最小,表明粒径越小,吸附能力不一定是最强的,可能与其形态有关。当微/纳米塑料的粒径过小时,达到几十纳米,此时微塑料形态很不稳定,容易发生团聚效应,形成较大的团聚颗粒,导致比表面积减少,吸附效果会降低[15]。
2.3 微/纳米塑料老化程度的影响
微/纳米塑料进入环境之后必然会经历老化的过程,所以研究在各种条件下老化的微/纳米塑料与抗生素类有机污染物的环境行为是必要的。据报道,微/纳米塑料进入环境后,在光、氧、高温和环境活性介质的作用下会发生加速老化,这将极大地改变常见微塑料的表面形貌,出现大量褶皱、碎片和沟壑,也会改变其微观结构,出现碳碳双键、羧基、醛基以及羟基等官能团,还会改变微/纳米塑料的结晶度及表面电位,最终导致环境行为的改变[33-36]。微/纳米塑料随着老化程度的增加,结晶度降低。以往研究表明,结晶度低的微/纳米塑料可以吸收更多的疏水有机污染物[32]。目前对微/纳米塑料老化的研究主要是在定性方面,例如在海水、空气、化学药剂、紫外光照、高温下的老化。孔凡星等[37]使用过硫酸盐对聚乳酸(PLA)、聚对苯二甲酸乙二醇酯(PET)和聚丙烯(PP)进行老化处理,结果表明经老化处理之后的PLA和PET比表面积增大,同时羰基和羟基官能团含量显著提高,其对四环素的吸附能力也增强。范秀磊等[38]使用热活化过硫酸钾对PLA和PE进行老化处理,结果表明老化后PLA和PE的粒径变小,表面产生大量的凹坑、裂缝和孔隙,比表面积增大,含氧官能团强度增加,亲水性增强,对磺胺甲恶唑和阿莫西林吸附能力远远强于初始的PLA和PE。Ding等[16]在空气、海水和淡水条件下对PS进行75 ℃老化处理,发现吸附能力大大提高的最大的原因是表面积和表面含氧基团的增加。微/纳米塑料在老化的情况下,一般是提高了对亲水性抗生素污染物的吸附能力,对疏水性有机污染物吸附能力会降低,这可能是老化微/纳米塑料表面的含氧官能团和水环境介质形成了氢键。以上研究有助于进一步了解老化微/纳米塑料吸附有机污染物的环境行为,明确了老化微/纳米塑料的粒径、表面形态和官能团等的变化,但对微/纳米塑料老化过程的定量分析及老化机制的研究尚不全面。尤其是,不同微/纳米塑料在不同的环境和人为实验条件下具有不同的老化机制[39]。因此,想要比较全面阐明老化微/纳米塑料与抗生素类有机污染物的环境行为,需要具体了解微塑料在不同条件下的老化机制。
3 环境因素对微/纳米塑料与抗生素相互作用的影响(Effects of environmental factors on the interaction between micro/nano plastics and antibiotics)
3.1 pH的影响
pH是近期研究微/纳米塑料和抗生素类有机物吸附的主要影响因素之一。在不同pH水平下,微/纳米塑料和抗生素携带不同电性,影响吸附性能。提高pH值,可促进可解离有机污染物的解离,导致带负电荷亲水性物质的形成[40]。Zhang等[23]研究了pH对纳米PS和羧基纳米PS吸附左氧氟沙星和诺氟沙星性能的影响,结果表明,这2种喹诺酮类抗生素在微塑料上的吸附量随pH的增加均呈现先增加后减少的趋势,2种微塑料表面均带负电,且电负性在不断增强。静电相互作用在吸附过程中起关键作用。在吸附量增加阶段,抗生素主要是以阳离子的形态存在,主要为静电吸附。在吸附量曲线急速下降阶段,抗生素主要是以阴离子形态存在,主要为静电斥力。Guo等[26]揭示了pH<7.1时泰乐菌素在PS和PVC上的吸附源于静电吸引。Xu等[41]等研究了pH对磺胺甲恶唑在PE微塑料上吸附的影响,发现pH对两者的吸附没有显著影响,在pH>8时,PE微塑料和磺胺甲恶唑都带电负性,但吸附过程中静电斥力起有限作用,两者的吸附平衡量下降不明显。类似结果报道较少,因此,pH值对微/纳米塑料吸附其他可电离抗生素的影响的研究还需结合疏水性、含氧官能团和静电相互作用等方面进行综合研究。
3.2 有机大分子的影响
自然水体中存在的多种溶解性有机物可能影响微/纳米塑料与抗生素的吸附。通常情况下,溶解性有机物随着浓度的增大与微/纳米塑料的亲和力大于抗生素类有机物,通过竞争吸附来抑制微/纳米塑料和抗生素的相互作用,但也有可能表现为有机大分子对微/纳米塑料吸附抗生素的促进作用或无影响。Atugoda等[42]的研究表明海藻酸钠(HA)存在显著抑制了PE微塑料对环丙沙星的吸附。Zhang等[21]研究发现HA的存在显著促进了微塑料PS与土霉素的吸附。这可能是因为HA在PS和土霉素的吸附过程中起到桥梁作用。此外,Xu等[41]研究得出FA对PE吸附磺胺甲恶唑没有明显影响。以上这些都是推测的原因,想要了解具体的吸附机理,还需要进一步深化研究。也有研究表明,抗生素可能通过疏水作用或络合作用与有机大分子相互作用,有机大分子也可能先吸附在微/纳米塑料上,再与抗生素发生相互作用[43]。
3.3 盐度的影响
盐度对污染物的吸附行为既有促进,又有抑制作用[17]。但是对于抗生素类有机污染物而言,盐度主要通过竞争吸附占据了微塑料的吸附位点,当盐度增强时,更多的的钠离子会被吸附到微塑料表面,占据吸附位点,从而抑制抗生素和微塑料的吸附。同时钠离子带正电,微塑料带负电,钠离子可能通过静电吸附取代微塑料表面的酸性基团,阻止氢键形成,进而降低吸附效果[44]。Liu等[45]的研究表明盐度抑制原始及老化PS和PVC对亲水性有机物环丙沙星的吸附。Zhang等[46]的研究表明,盐度的存在显著阻碍了诺氟沙星的吸附。Guo等[20]研究发现6种微塑料对磺胺甲恶唑的吸附能力随盐度的增加而降低。然而,盐度也可能对微塑料和抗生素相互作用的影响不显著。Xu等[41]研究了盐度对磺胺甲恶唑在PE微塑料上吸附的影响,发现盐度对于两者的吸附没有显著影响。研究仍处于不断探索发展阶段,尚未见盐度促进吸附的报道。
3.4 重金属离子的影响
在自然水体和受污染的水体中存在各种重金属离子,微/纳米塑料作为重金属的一种载体,其与抗生素的相互作用可能会受到重金属的影响。一般情况下,微/纳米塑料和重金属离子带相反电荷,重金属离子可以通过静电吸引吸附在其表面[47],因此重金属的存在可能通过竞争微/纳米塑料表面的吸附位点来抑制微/纳米塑料与抗生素类有机污染物的吸附。Yu等[31]研究5种重金属离子对PVC微塑料吸附左氧氟沙星的影响,发现Cu2+、Zn2+和Cr3+显著促进了PVC对左氧氟沙星的吸附,而Cd2+和Pb2+的加入抑制了吸附。原因是Cd2+和Pb2+位于元素周期表中第五周期,离子半径较大,占据了PVC表面更多的位点。而Cu2+、Zn2+和Cr3+位于元素周期表中第四周期,离子半径相对较小,占据的PVC表面位点相对较少。Yu等[32]也研究了5种重金属离子对PE微塑料与四环素吸附的影响,结果表明Zn2+、Cr3+、Cd2+和Pb2+促进了吸附,可能是这4种重金属离子在四环素和PE塑料表面形成了金属桥接效应[48]。而Cu2+抑制吸附,可能与PE及四环素表面电位有关。Mg2+的存在情况下,抑制了聚苯乙烯纳米球对四环素的吸附,可能是二价镁离子的存在诱导了聚苯乙烯纳米球的聚集[49]。
3.5 温度的影响
温度也是影响微/纳米塑料吸附抗生素的主要因素之一。通常,随着温度的降低,抗生素类有机物溶解度降低,疏水性增加,更易吸附在微/纳米塑料的表面,同时,温度升高,分子的热运动增强,可能不利于抗生素稳定吸附在微塑料表面。因此,温度会显著影响微/纳米塑料和抗生素类有机污染物的吸附[50]。薛向东等[51]研究发现温度升高不利于高密度聚乙烯(HDPE)和通用级聚苯乙烯(GPPS)对四环素的吸附。刘鹏等[30]研究了温度对PS和环丙沙星吸附的影响,结论和薛向东等[51]的一样。但陈守益等[27]的研究表明PE和PVC对泰乐菌素的平衡吸附量随着温度的升高而增大,因此温度升高,平衡吸附量不一定降低,这与微/纳米塑料和抗生素的种类和性质有关。
4 结论与展望(Conclusion and prospect)
本文综述了微/纳米塑料与抗生素类有机污染物相互作用机制研究现状,梳理了微/纳米塑料的性质,如种类、粒径和老化程度等对其吸附抗生素的影响,总结了环境因素,如pH、有机大分子、盐度、重金属离子和温度对微/纳米塑料与抗生素相互作用的影响,为微/纳米塑料和抗生素的吸附行为的后续研究提供了指导。不同种类、不同老化程度的微/纳米塑料对抗生素的吸附效果不同。粒径越小,吸附效果一般越好。原始微/纳米塑料容易吸附疏水性有机物,随着其老化,对抗生素吸附增加。pH一般通过改变微/纳米塑料和抗生素的电负性来显著影响二者吸附效果,有机大分子、盐度和重金属离子都可以通过竞争吸附来影响微/纳米塑料和抗生素的吸附。
本文系统综述的微/纳米塑料的吸附行为可以在一定程度上解释不同污染物在生物体内的联合毒性。其实微/纳米塑料与抗生素有机污染物吸附机理很复杂,需要进一步完善研究内容,了解具体吸附机制和环境行为。基于此,提出如下展望:
(1)目前研究主要集中在对微米级塑料的研究上,对纳米级塑料的研究较少。而微塑料在环境中老化最终可能转化为纳米级的,因此要深入研究纳米老化微塑料对抗生素的吸附行为。微塑料在不同环境条件下老化机制也不相同,要进一步研究不同老化条件下微塑料的吸附。
(2)对于微塑料的去除,首先要确定污废水中微塑料的浓度,但是目前国际上没有统一的检测微塑料分布的原理和方法,因此需要建立有效的、在国际上广泛使用的检测方法。
(3)目前研究的微塑料大多是不可降解的,而可降解的微塑料正在被广泛使用,因此需进一步研究可降解微塑料和抗生素的吸附机理及环境行为。
[1] Geyer R, Jambeck J R, Law K L. Production, use, and fate of all plastics ever made [J]. Science Advances, 2017, 3(7): e1700782
[2] Han M, Niu X R, Tang M, et al. Distribution of microplastics in surface water of the lower Yellow River near estuary [J]. The Science of the Total Environment, 2020, 707: 135601
[3] Shahul Hamid F, Bhatti M S, Anuar N, et al. Worldwide distribution and abundance of microplastic: How dire is the situation? [J]. Waste Management & Research: The Journal of the International Solid Wastes and Public Cleansing Association, 2018, 36(10): 873-897
[4] Ma Y N, Huang A N, Cao S Q, et al. Effects of nanoplastics and microplastics on toxicity, bioaccumulation, and environmental fate of phenanthrene in fresh water [J]. Environmental Pollution, 2016, 219: 166-173
[5] Joo S H, Yejin L, Minbeom K, et al. Microplastics with adsorbed contaminants: Mechanisms and treatment [J]. Environmental Challenges, 2021, 3: 100042
[6] Dinh Q T, Alliot F, Moreau-Guigon E, et al. Measurement of trace levels of antibiotics in river water using on-line enrichment and triple-quadrupole LC-MS/MS [J]. Talanta, 2011, 85(3): 1238-1245
[7] 黄福义, 杨凯, 张子兴, 等. 微塑料对河口沉积物抗生素抗性基因的影响[J]. 环境科学, 2019, 40(5): 2234-2239
Huang F Y, Yang K, Zhang Z X, et al. Effects of microplastics on antibiotic resistance genes in estuarine sediments [J]. Environmental Science, 2019, 40(5): 2234-2239 (in Chinese)
[8] Mirzaei R, Yunesian M, Nasseri S, et al. Occurrence and fate of most prescribed antibiotics in different water environments of Tehran, Iran [J]. Science of the Total Environment, 2018, 619-620: 446-459
[9] Gao L H, Shi Y L, Li W H, et al. Occurrence of antibiotics in eight sewage treatment plants in Beijing, China [J]. Chemosphere, 2012, 86(6): 665-671
[10] 周曙仡聃, 朱永官, 黄福义. 微塑料对海水抗生素抗性基因的影响[J]. 环境科学, 2021, 42(8): 3785-3790
Zhou S, Zhu Y G, Huang F Y. Microplastic-induced alterations to antibiotic resistance genes in seawater [J]. Environmental Science, 2021, 42(8): 3785-3790 (in Chinese)
[11] Caruso G. Microplastics as vectors of contaminants [J]. Marine Pollution Bulletin, 2019, 146: 921-924
[12] Vieira Y, Lima E C, Foletto E L, et al. Microplastics physicochemical properties, specific adsorption modeling and their interaction with pharmaceuticals and other emerging contaminants [J]. The Science of the Total Environment, 2021, 753: 141981
[13] Santos L H M L M, Rodríguez-Mozaz S, Barceló D, et al. Microplastics as vectors of pharmaceuticals in aquatic organisms—An overview of their environmental implications [J]. Case Studies in Chemical and Environmental Engineering, 2021, 3: 100079
[14] Ziccardi L M, Edgington A, Hentz K, et al. Microplastics as vectors for bioaccumulation of hydrophobic organic chemicals in the marine environment: A state-of-the-science review [J]. Environmental Toxicology and Chemistry, 2016, 35(7): 1667-1676
[15] 王一飞, 李淼, 于海瀛, 等. 微塑料对环境中有机污染物吸附解吸的研究进展[J]. 生态毒理学报, 2019, 14(4): 23-30
Wang Y F, Li M, Yu H Y, et al. Research progress on the adsorption and desorption between microplastics and environmental organic pollutants [J]. Asian Journal of Ecotoxicology, 2019, 14(4): 23-30 (in Chinese)
[16] Ding L, Mao R, Ma S, et al. High temperature depended on the ageing mechanism of microplastics under different environmental conditions and its effect on the distribution of organic pollutants [J]. Water Research, 2020, 174: 115634
[17] Yu F, Yang C, Zhu Z, et al. Adsorption behavior of organic pollutants and metals on micro/nanoplastics in the aquatic environment [J]. Science of the Total Environment, 2019, 694: 133643
[18] Li J, Zhang K N, Zhang H. Adsorption of antibiotics on microplastics [J]. Environmental Pollution, 2018, 237: 460-467
[19] Wei X X, Li M, Wang Y F, et al. Developing predictive models for carrying ability of micro-plastics towards organic pollutants [J]. Molecules, 2019, 24(9): 1784
[20] Guo X, Chen C, Wang J. Sorption of sulfamethoxazole onto six types of microplastics [J]. Chemosphere, 2019, 228: 300-308
[21] Zhang H B, Wang J Q, Zhou B Y, et al. Enhanced adsorption of oxytetracycline to weathered microplastic polystyrene: Kinetics, isotherms and influencing factors [J]. Environmental Pollution, 2018, 243(Pt B): 1550-1557
[22] Sun Y, Wang X J, Xia S Q, et al. New insights into oxytetracycline (OTC) adsorption behavior on polylactic acid microplastics undergoing microbial adhesion and degradation [J]. Chemical Engineering Journal, 2021, 416: 129085
[23] Zhang H, Liu F F, Wang S C, et al. Sorption of fluoroquinolones to nanoplastics as affected by surface functionalization and solution chemistry [J]. Environmental Pollution, 2020, 262: 114347
[24] Guo X, Liu Y, Wang J L. Sorption of sulfamethazine onto different types of microplastics: A combined experimental and molecular dynamics simulation study [J]. Marine Pollution Bulletin, 2019, 145: 547-554
[25] Xu B L, Liu F, Brookes P C, et al. Microplastics play a minor role in tetracycline sorption in the presence of dissolved organic matter [J]. Environmental Pollution, 2018, 240: 87-94
[26] Guo X T, Pang J W, Chen S Y, et al. Sorption properties of tylosin on four different microplastics [J]. Chemosphere, 2018, 209: 240-245
[27] 陈守益, 郭学涛, 庞敬文. 微塑料对泰乐菌素的吸附动力学与热力学[J]. 中国环境科学, 2018, 38(5): 1905-1912
Chen S Y, Guo X T, Pang J W. Sorption kinetics and thermodynamics study of tylosin by microplastics [J]. China Environmental Science, 2018, 38(5): 1905-1912 (in Chinese)
[28] Zhang X J, Zheng M G, Yin X C, et al. Sorption of 3,6-dibromocarbazole and 1,3,6,8-tetrabromocarbazole by microplastics [J]. Marine Pollution Bulletin, 2019, 138: 458-463
[29] Chen Y J, Li J N, Wang F H, et al. Adsorption of tetracyclines onto polyethylene microplastics: A combined study of experiment and molecular dynamics simulation [J]. Chemosphere, 2021, 265: 129133
[30] 刘鹏, 王焓钰, 吴小伟, 等. 粒径对聚苯乙烯微塑料吸附环丙沙星的影响[J]. 环境化学, 2020, 39(11): 3153-3160
Liu P, Wang H Y, Wu X W, et al. Effects of particle size on the adsorption of ciprofloxacin on polystyrene microplastics [J]. Environmental Chemistry, 2020, 39(11): 3153-3160 (in Chinese)
[31] Yu F, Li Y, Huang G Q, et al. Adsorption behavior of the antibiotic levofloxacin on microplastics in the presence of different heavy metals in an aqueous solution [J]. Chemosphere, 2020, 260: 127650
[32] Yu F, Yang C, Huang G, et al. Interfacial interaction between diverse microplastics and tetracycline by adsorption in an aqueous solution [J]. Science of the Total Environment, 2020, 721: 137729
[33] Wang Y, Wang X, Li Y, et al. Effects of exposure of polyethylene microplastics to air, water and soil on their adsorption behaviors for copper and tetracycline [J]. Chemical Engineering Journal, 2021, 404: 126412
[34] Liu P, Zhan X, Wu X, et al. Effect of weathering on environmental behavior of microplastics: Properties, sorption and potential risks [J]. Chemosphere, 2020, 242: 125193
[35] Lambert S, Wagner M. Characterisation of nanoplastics during the degradation of polystyrene [J]. Chemosphere, 2016, 145: 265-268
[36] Gewert B, Plassmann M M, MacLeod M. Pathways for degradation of plastic polymers floating in the marine environment [J]. Environmental Science: Processes & Impacts, 2015, 17(9): 1513-1521
[37] 孔凡星, 许霞, 薛银刚, 等. 微塑料老化对四环素吸附行为的影响[J]. 环境科学研究, 2021, 34(9): 2182-2190
Kong F X, Xu X, Xue Y G, et al. Effect of aging on adsorption of tetracycline by microplastics [J]. Research of Environmental Sciences, 2021, 34(9): 2182-2190 (in Chinese)
[38] 范秀磊, 甘容, 谢雅, 等. 老化前后聚乳酸和聚乙烯微塑料对抗生素的吸附解吸行为[J]. 环境科学研究, 2021, 34(7): 1747-1756
Fan X L, Gan R, Xie Y, et al. Adsorption and desorption behavior of antibiotics on polylactic acid and polyethylene microplastics before and after aging [J]. Research of Environmental Sciences, 2021, 34(7): 1747-1756 (in Chinese)
[39] Celina M C. Review of polymer oxidation and its relationship with materials performance and lifetime prediction [J]. Polymer Degradation and Stability, 2013, 98(12): 2419-2429
[40] Fu L N, Li J, Wang G Y, et al. Adsorption behavior of organic pollutants on microplastics [J]. Ecotoxicology and Environmental Safety, 2021, 217: 112207
[41] Xu B L, Liu F, Brookes P C, et al. The sorption kinetics and isotherms of sulfamethoxazole with polyethylene microplastics [J]. Marine Pollution Bulletin, 2018, 131(Pt A): 191-196
[42] Atugoda T, Wijesekara H, Werellagama D R I B, et al. Adsorptive interaction of antibiotic ciprofloxacin on polyethylene microplastics: Implications for vector transport in water [J]. Environmental Technology & Innovation, 2020, 19: 100971
[43] Wu C X, Zhang K, Huang X L, et al. Sorption of pharmaceuticals and personal care products to polyethylene debris [J]. Environmental Science and Pollution Research International, 2016, 23(9): 8819-8826
[44] Aristilde L, Marichal C, Miéhé-Brendlé J, et al. Interactions of oxytetracycline with a smectite clay: A spectroscopic study with molecular simulations [J]. Environmental Science & Technology, 2010, 44(20): 7839-7845
[45] Liu G Z, Zhu Z, Yang Y, et al. Sorption behavior and mechanism of hydrophilic organic chemicals to virgin and aged microplastics in freshwater and seawater [J]. Environmental Pollution, 2019, 246: 26-33
[46] Zhang Y, Ni F, He J S, et al. Mechanistic insight into different adsorption of norfloxacin on microplastics in simulated natural water and real surface water [J]. Environmental Pollution, 2021, 284: 117537
[47] Wang F T, Pan Y F, Cai P X, et al. Single and binary adsorption of heavy metal ions from aqueous solutions using sugarcane cellulose-based adsorbent [J]. Bioresource Technology, 2017, 241: 482-490
[48] Zhao Y P, Tan Y, Guo Y, et al. Interactions of tetracycline with Cd (Ⅱ), Cu (Ⅱ) and Pb (Ⅱ) and their cosorption behavior in soils [J]. Environmental Pollution, 2013, 180: 206-213
[49] Wan T, Lu S H, Cheng W, et al. A spectroscopic and theoretical investigation of interaction mechanisms of tetracycline and polystyrene nanospheres under different conditions [J]. Environmental Pollution, 2019, 249: 398-405
[50] Wang Q J, Zhang Y, Wangjin X X, et al. The adsorption behavior of metals in aqueous solution by microplastics effected by UV radiation [J]. Journal of Environmental Sciences (China), 2020, 87: 272-280
[51] 薛向东, 王星源, 梅雨晨, 等. 微塑料对水中铜离子和四环素的吸附行为[J]. 环境科学, 2020, 41(8): 3675-3683
Xue X D, Wang X Y, Mei Y C, et al. Sorption behaviors of copper ions and tetracycline on microplastics in aqueous solution [J]. Environmental Science, 2020, 41(8): 3675-3683 (in Chinese)