军事训练场地是进行各种人员训练和武器试验的场所,主要包括各种靶场、射击场和武器试验场。据统计,全世界共有超过10万个靶场[1],美国国内就有3 000个小型军事靶场[2]。军事训练活动导致大量弹药或残留物进入环境,成为潜在的污染源,引起了全世界的广泛关注[3]。目前关于军事训练场地污染的研究主要侧重于含能化合物和重金属,主要特征污染物包括:三硝基甲苯(TNT)、环三亚甲基三硝铵(RDX)、环四亚甲基四硝铵(HMX)、铅(Pb)、锑(Sb)和铜(Cu)等。在表1中列出了军事训练场地常见的污染物的来源和用途[4-6],这些污染物在训练场土壤中逐渐积累,影响土壤中微生物的活性,对训练场的生态环境造成严重的威胁,还可能通过生物利用方式在动、植物中积累,并最终通过食物链影响人类健康[7]。因此,了解并掌握这些环境污染物的毒性效应,是评价其生态健康风险和治理修复的科学依据和基础。本文针对军事训练场地的含能化合物和重金属,从其污染现状、生态效应和污染风险等方面进行总结和梳理,为未来军事训练场地风险管控与治理修复提供借鉴和参考。
1 军事训练场地特征污染物(Typical pollutants in military training ranges)
1.1 军事训练场地含能化合物污染
作为军事训练场地特征污染物,含能化合物广泛应用在各类武器弹药中,主要由炸药和推进剂两部分组成[8],其中常见的军用炸药包括TNT、RDX和HMX;而用于推进剂的主要是硝酸甘油(NG)、亚硝亚硝胍(NQ)、硝化纤维(NC)、2,4-二硝基甲苯(DNT)和高氯酸[9]。
用于军事用途的含能化合物主要在使用前的生产、包装和仓储,使用中的武器射击场,特别是其落弹区,以及最终的处置和销毁设施等区域进入环境,污染土壤和地下水[5],由于这些区域的用途不同,它们呈现的污染类型和污染程度也不同。军事训练场地含能化合物主要通过空气和地表水传输造成污染物迁移,进一步扩散进入周围土壤和地下水,最终对周围生态受体造成潜在的威胁[10]。在图1中列出含能化合物在环境中可能的迁移途径,其中弹药存储和废弃物处理造成的污染程度最高。军事训练活动主要影响表层土壤,但是,当地表水存在时,其影响可能更持久,且未爆弹药(UXO)带来的污染可以迁移到更深的深度,而且浓度更高,UXO腐蚀也会增加周围土壤和地下水中含能化合物的浓度[5]。由于含能化合物在环境中具有化学稳定性,很难被普通生物降解,因此会造成土壤和水体的长期污染[11]。据报道,美国有120多万t土壤受到含能化合物的污染,而加拿大共有103个军事训练基地受到TNT的污染,土壤中含能化合物的浓度高达10~1 000 mg·kg-1。在表2中列出了美国和加拿大某些被含能化合物污染的军事训练场地土壤中含能化合物的浓度[5],这些含能化合物已被美国等国家列为优先控制的污染物[12]。因为这些含能化合物的辛醇/水分配系数(Kow)值都比较低[13],具有较高的流动性,不易被固定,因此可以影响大范围的土壤、地表水以及地下水[14]。3种常见的含能化合物吸附性大小为TNT>HMX>RDX,其吸附性大小不仅与化合物本身的结构有关,还受到pH值、离子强度、溶解的有机碳、胶体性质和温度等因素的影响[15]。Sharma等[16]通过土柱实验发现,富含有机碳的土壤会增强TNT、RDX和HMX的吸附,而胶体会减弱TNT的吸附,但对RDX和HMX没有明显的作用。Lingamdinne等[17]发现随着溶液pH值从2.0增加至6.0,TNT和RDX的吸附逐渐减少。Katseanes等[18]发现富里酸对TNT吸附能力取决于溶液pH值、离子强度和温度,随着pH增加,吸附能力增加,当pH=7时,出现转折点,并且吸附能力随着离子强度的增加和温度的降低而增加。在不同的介质中,以上因素相互作用,共同影响含能化合物的吸附性。因此,为了减少含能化合物迁移造成的地下水和地表水污染,需考虑合适的吸附介质和多种物理化学因素使污染物达到最佳的吸附效果,减少其对周围环境的影响。
表1 军事训练场地常见的污染物
Table 1 Common contaminants in
military training ranges

污染成分Contamination components元素符号Element symbols来源或用途Source or use铅LeadPb子弹的主要成分Main components of bullets锑AntimonySb子弹芯的主要成分,硬化剂Main components of bullets core, hardener砷ArsenicAs含铅霰弹的成分 Components of leaded shotguns铜CopperCu弹头和弹壳合金的主要成分Main components of warheads and shells alloy锡TinSn弹头合金的成分(増加硬度)Components of warheads alloy (increase hardness)锌ZincZn弹壳合金的成分Components of shells alloy铁IronFe钢芯弹头的主要成分Main components of steel core warheads镍NickelNi硬度大,一些枪支和弹药的主要成分Hardness, main components of some guns and ammunitions钴CobaltCo弹头的合金材料Alloy material of warheads铬ChromiumCr弹头的合金材料Alloy material of warheads三硝基甲苯TrinitrotolueneTNT炸药的主要成分Main components of explosives环三亚甲基三硝铵Cyclotrimethylene trinitramineRDX炸药的主要成分Main components of explosives环四亚甲基四硝铵Cyclotetramethylene tetranitramineHMX炸药的主要成分Main components of explosives
1.2 军事训练场地重金属污染
多年来,采矿、冶炼等活动产生的重金属严重污染环境,与源自这些工业活动的重金属污染相比,军事训练活动造成的重金属污染在种类、分布、环境行为、存在形态和生物有效性等方面与其他区域都有所不同,但受到的关注较少[19]。虽然军事训练场地中重金属污染面积有限,但依然对周围的生态构成了严重威胁[20],同时,军事训练场地自身功能和周围环境的特殊性使得其中重金属污染的特征与其他区域存在较大差异。如子弹在撞击后会产生碎片,导致军事训练场地中土壤的化学成分和矿物学特征发生改变[21]。Dermatas等[22]发现Pb子弹碎片对Pb在军事训练场地中释放速度和释放量具有重要影响,而军事训练场地中大量植物的存在能够抑制Pb等重金属的流动性[23]。这些特征表明军事训练场地作为重金属污染的一类典型代表区域具有较高的研究价值和迫切的研究需求。
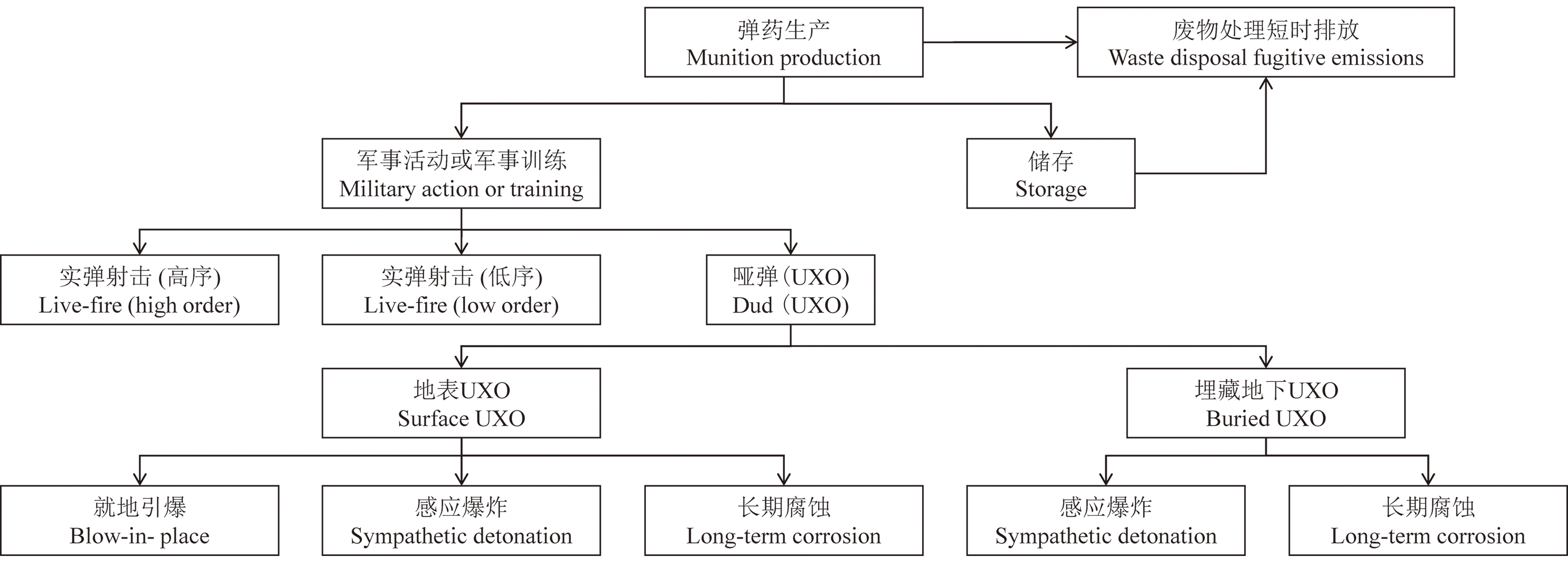
图1 军事训练场地中含能化合物的可能迁移途径
注:UXO表示未爆弹药。
Fig. 1 Possible fates of energetic compounds in military training ranges
Note: UXO is unexploded ordnance.
表2 美国和加拿大部分军事训练场地的含能化合物污染
Table 2 Energetic compound contamination in selected military training ranges in the U.S.A. and Canada
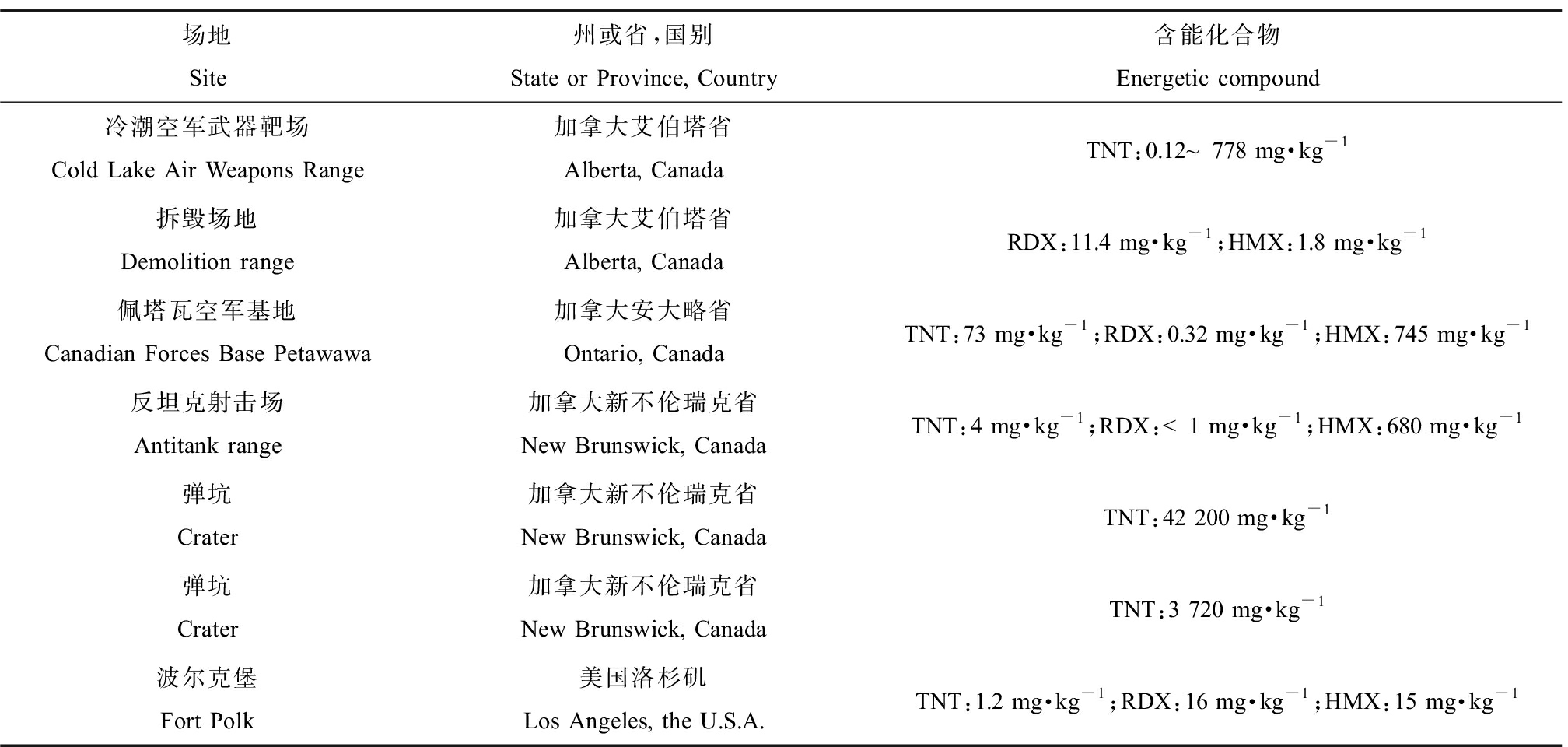
场地Site州或省,国别State or Province, Country含能化合物Energetic compound冷潮空军武器靶场Cold Lake Air Weapons Range加拿大艾伯塔省Alberta, CanadaTNT:0.12~778 mg·kg-1拆毁场地Demolition range加拿大艾伯塔省Alberta, CanadaRDX:11.4 mg·kg-1;HMX:1.8 mg·kg-1佩塔瓦空军基地Canadian Forces Base Petawawa加拿大安大略省Ontario, CanadaTNT:73 mg·kg-1;RDX:0.32 mg·kg-1;HMX:745 mg·kg-1反坦克射击场Antitank range加拿大新不伦瑞克省New Brunswick, CanadaTNT:4 mg·kg-1;RDX:<1 mg·kg-1;HMX:680 mg·kg-1弹坑Crater加拿大新不伦瑞克省New Brunswick, CanadaTNT:42 200 mg·kg-1弹坑Crater加拿大新不伦瑞克省New Brunswick, CanadaTNT:3 720 mg·kg-1波尔克堡Fort Polk美国洛杉矶Los Angeles, the U.S.A.TNT:1.2 mg·kg-1;RDX:16 mg·kg-1;HMX:15 mg·kg-1
军事训练场地的轻武器、迫击炮、火炮和火箭等试弹射击训练活动,会造成重金属在军事训练场地土壤中的沉积[4]。军事训练场地的射击训练等活动残留了大量含Pb弹头,弹头在埋藏后被侵蚀,导致Pb等重金属逐渐向周围的环境中迁移,从而进一步对生态环境系统、人类健康造成威胁。目前军事训练场地已成为全球第二大Pb污染源,仅次于电池制造业[24-25],美国每年从弹药中释放的Pb高达约60 000 t[26]。在表3中列出了各国军事训练场地Pb沉积量和总Pb含量,但是,Pb的总含量本身并不能全面地描述其迁移性、生物可给性、归趋和生态毒性等特征。因此,需要进一步研究土壤中不同Pb形态的形成过程,以获取其在不同环境介质中的分配信息,从而准确评估土壤中Pb大量积累所带来的潜在环境风险。一些技术手段被应用于军事训练场地土壤中不同Pb形态的分离,如Tessier顺序提取法[27],将Pb划分为水溶和可交换态、有机物结合态、碳酸盐结合态、铁锰氧化物结合态和残余态,以便更准确地评估其毒性。
不同Pb形态的形成过程主要是风化和迁移这2种环境行为。含Pb子弹在土壤中的风化引起Pb从子弹向土壤的转移,以及金属Pb向离子态Pb的转化,继而形成次生矿物质。在不同的条件下,Pb的风化产物存在较大差异。一般而言,影响风化过程的环境因素主要包括土壤pH、含水率和有机质含量。如Ma等[29]报道了土壤理化性质对Pb风化的影响,发现当土壤持水率为100%,且土壤中有机质含量充足、pH较低的情况下,Pb的风化速度较快,风化产物主要是Pb3(CO3)2(OH)2和PbO,而在土壤有机质含量低、pH较高的情况下,Pb的风化速度较慢,风化产物以PbO为主。Cao等[30]发现在碱性土壤中Pb的风化产物为Pb3(CO3)2(OH)2,而在酸性土壤中风化产物为Pb3(CO3)2(OH)2、PbCO3和PbO。据报道,在含水量较低,且含有CO2和有机质的沙土中,Pb的风化速率较慢[31-32],而低土壤pH值、有机质和土壤水分能够促进Pb的风化[29]。综上所述,Pb的风化主要受pH、有机质含量和含水量等多种土壤理化性质影响,这些因素相互作用共同决定Pb最终的风化产物,而不同风化产物的形成会进一步影响Pb的迁移。一般而言,除了土壤中残留态的Pb比较稳定外,其他形态都可能发生迁移,因此,土壤中残留态Pb对生态环境的影响较小[27]。
表3 不同国家军事训练场地Pb沉积量和总Pb含量[28]
Table 3 Pb deposition and total Pb content in
military training ranges of different countries[28]
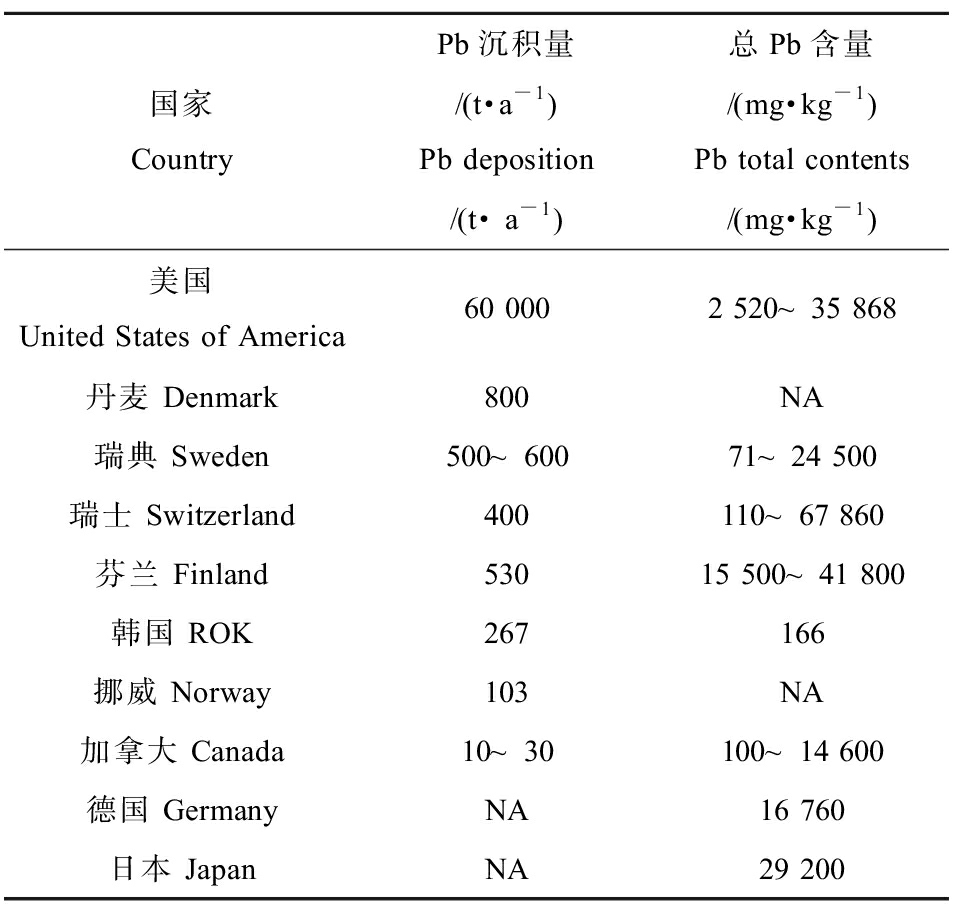
国家CountryPb沉积量/(t·a-1)Pb deposition/(t· a-1)总Pb含量/(mg·kg-1)Pb total contents/(mg·kg-1)美国United States of America60 0002 520~35 868丹麦 Denmark800NA瑞典 Sweden500~60071~24 500瑞士 Switzerland400110~67 860芬兰 Finland53015 500~41 800韩国 ROK267166挪威 Norway103NA加拿大 Canada10~30100~14 600德国 GermanyNA16 760日本 JapanNA29 200
注:NA是未知。
Note: NA is not available.
军事训练场地附近地下水、地表水中的Pb含量很高,表明Pb发生明显的迁![]() 等[34]结合Pb浓度和同位素数据分析了捷克的一个靶场近30年Pb污染,研究表明附近受污染的农田土壤中Pb主要来自靶场,揭示了Pb在土壤中存在明显的迁移行为。Pb的迁移行为受多种因素影响,Cao等[30]认为铁铝氧化物、黏土和有机物由于表面积较大,容易吸附Pb,因此,在这些成分大量存在或高阳离子交换容量的土壤中,Pb的迁移率一般很小。Yin等[35]报道了胶体在不同物理化学条件下对Pb迁移的影响,他们发现离子强度减小、流速增加的条件促进了胶体和Pb在靶场土壤中迁移。
等[34]结合Pb浓度和同位素数据分析了捷克的一个靶场近30年Pb污染,研究表明附近受污染的农田土壤中Pb主要来自靶场,揭示了Pb在土壤中存在明显的迁移行为。Pb的迁移行为受多种因素影响,Cao等[30]认为铁铝氧化物、黏土和有机物由于表面积较大,容易吸附Pb,因此,在这些成分大量存在或高阳离子交换容量的土壤中,Pb的迁移率一般很小。Yin等[35]报道了胶体在不同物理化学条件下对Pb迁移的影响,他们发现离子强度减小、流速增加的条件促进了胶体和Pb在靶场土壤中迁移。
Pb是子弹弹头的主要成分(>90%),此外,弹药中还有一定量的锑(Sb)、砷(As)、铜(Cu)、镍(Ni)和锌(Zn)等[36],虽然军事训练场地的这些重金属没有被广泛地调查,但依然有研究者在给予其关注[37-38]。在表4中列出了军事训练场地不同重金属污染的情况,常用的指标是重金属的总含量和生物有效性,其中土壤中重金属总含量仅能指示它们的污染程度,而生物有效性常被用于风险评估[38]。通过对不同深度土壤中重金属含量的测定发现,这些重金属在土壤中也存在不同程度的迁移行为[39-41]。除了关于Pb的报道外,针对Sb的研究也较为广泛,涉及美国、加拿大、挪威、瑞典、芬兰和瑞士等多个国家的军事训练场地[42]。在瑞士,每年有10~25万t的Sb沉积在军事训练场地土壤中,而美国约有1 900 t,在军事训练场地附近地表水和地下水中也发现Sb浓度升高[43]。多数研究认为Sb比Pb的扩散能力更强,溶液中的Sb(Ⅴ)在较高的pH下更具流动性[44],而溶液中的Sb(Ⅲ)流动性则与pH无关[45],因此了解Sb的流动性对于评估Sb因渗透作用进入当地饮用水的潜力至关重要。
表4 军事训练场地不同重金属的污染
Table 4 Contamination of different heavy metals in military training ranges
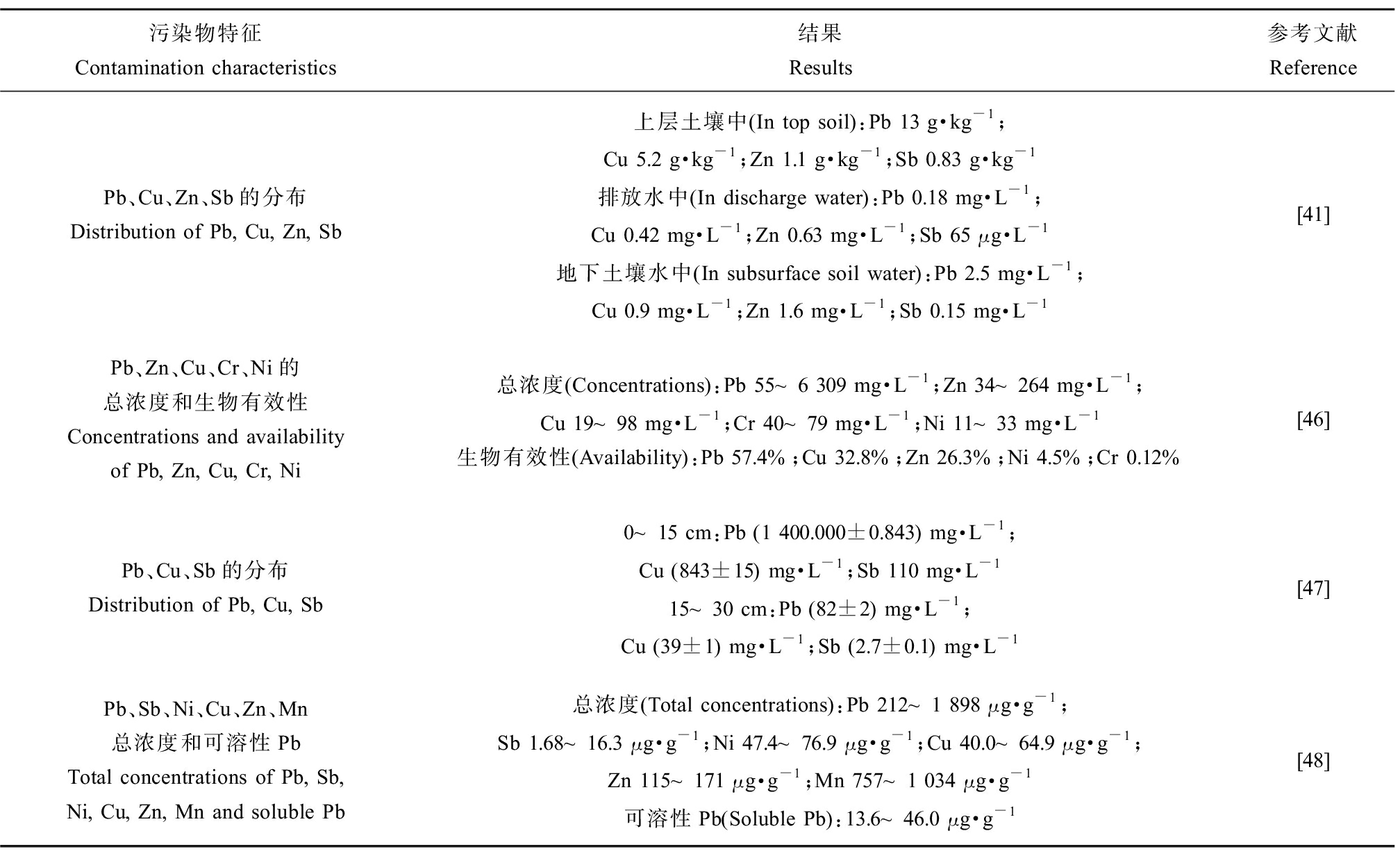
污染物特征Contamination characteristics结果Results参考文献ReferencePb、Cu、Zn、Sb的分布Distribution of Pb, Cu, Zn, Sb上层土壤中(In top soil):Pb 13 g·kg-1;Cu 5.2 g·kg-1;Zn 1.1 g·kg-1;Sb 0.83 g·kg-1排放水中(In discharge water):Pb 0.18 mg·L-1;Cu 0.42 mg·L-1;Zn 0.63 mg·L-1;Sb 65 μg·L-1地下土壤水中(In subsurface soil water):Pb 2.5 mg·L-1;Cu 0.9 mg·L-1;Zn 1.6 mg·L-1;Sb 0.15 mg·L-1[41]Pb、Zn、Cu、Cr、Ni的总浓度和生物有效性Concentrations and availability of Pb, Zn, Cu, Cr, Ni总浓度(Concentrations):Pb 55~6 309 mg·L-1;Zn 34~264 mg·L-1;Cu 19~98 mg·L-1;Cr 40~79 mg·L-1;Ni 11~33 mg·L-1生物有效性(Availability):Pb 57.4%;Cu 32.8%;Zn 26.3%;Ni 4.5%;Cr 0.12%[46]Pb、Cu、Sb的分布Distribution of Pb, Cu, Sb0~15 cm:Pb (1 400.000±0.843) mg·L-1;Cu (843±15) mg·L-1;Sb 110 mg·L-1 15~30 cm:Pb (82±2) mg·L-1;Cu (39±1) mg·L-1;Sb (2.7±0.1) mg·L-1[47]Pb、Sb、Ni、Cu、Zn、Mn总浓度和可溶性PbTotal concentrations of Pb, Sb, Ni, Cu, Zn, Mn and soluble Pb总浓度(Total concentrations):Pb 212~1 898 μg·g-1;Sb 1.68~16.3 μg·g-1;Ni 47.4~76.9 μg·g-1;Cu 40.0~64.9 μg·g-1;Zn 115~171 μg·g-1;Mn 757~1 034 μg·g-1可溶性Pb(Soluble Pb):13.6~46.0 μg·g-1[48]
2 军事训练场地特征污染物的生态效应研究(Study of ecological effects of typical contaminants in military training ranges)
由于重金属和含能化合物自身的化学特征和在环境中的持久性,它们对植物、动物和微生物均会产生毒性效应,因此军事训练场地污染物具有不可忽视的生态和健康风险。目前,研究军事训练场含能化合物和重金属的生态效应的相关工作涵盖植物、无脊椎动物、哺乳动物和微生物等多种生物受体。这些特征污染物对不同生物的效应反映了它们毒性的差异和测试生物不同的敏感性,以及在受污染的军事训练场土壤中污染物的生物利用度。
2.1 军事训练场地污染物对植物的影响
2.1.1 含能化合物对植物的影响
生物和化学氧化以及水解很难破坏含能化合物的结构,因此,它们在环境中是稳定存在的[49]。大多数研究利用农业物种,如小麦、生菜、高粱、大麦、黄瓜、苜蓿、胡萝卜和多年生草本植物等为受体进行分析(表5)。据报道,紫花苜蓿、牧冰草、香根草等植物可以吸收并转化土壤中含能化合物[50-52],从而达到减少土壤中污染的目的。但是,含能化合物对这些植物也具有很强的毒性,能够造成植物的根和茎生长缓慢,植物个体矮小,产量和质量大幅下降。这些毒性效应又反馈影响植物从土壤或水中吸收和转化含能化合物的能力[53],因此植物对含能化合物的吸收和转化作用与含能化合物毒性是相互制约的。
表5 军事训练场地污染物的植物毒性
Table 5 Phytotoxicity of contaminants in military training ranges

污染物Contaminants物种Species效应Effects参考文献ReferencesTNT、HMX生菜、大麦Latuca sativa, Hordeum vugareTNT(55.9 mg·kg-1)抑制植物出苗以及芽和根的生长,HMX(4 500 mg·kg-1)无毒性TNT (55.9 mg·kg-1) decreased the capacity of plant emergence and the growth of shoots and roots; HMX (4 500 mg·kg-1) was not toxic[55]TNT高羊茅、柳枝稷、雀麦草Tall fescue, switchgrass, smooth bromegrassTNT(0~60 mg·L-1)抑制雀麦草和高羊茅种子发芽,TNT(7.5 mg·L-1)抑制柳枝稷和雀麦草的枝条生长TNT (0~60 mg·L-1) decreased germination of smooth bromegrass and tall fescue; TNT (7.5 mg·L-1) reduced shoot growth of switchgrass and smooth bromegrass[56-57]RDX、HMX黑麦草Ryegrass Lolium perenneRDX和HMX的无效应浓度为9 586 mg·kg-1和9 282 mg·kg-1The no observed effect concentration (NOEC) values for growth were 9 586 mg·kg-1 for RDX and 9 282 mg·kg-1 for HMX[58]TNT紫花苜蓿、灌木豌豆Medicago sativa, Phaseolus vulgarisTNT浓度为100 mg·kg-1时,紫花苜蓿无法生长,而灌木豌豆的耐受浓度高达500 mg·kg-1Medicago sativa was not able to grow with TNT (100 mg·kg-1), and Phaseolus vulgaris was able to grow with TNT (500 mg·kg-1) [59]TNT、HMX蜡杨梅Myrica cerifera光合作用和叶片荧光显著下降 Photosynthesis and leaf fluorescence significantly declined[60]Pb、Cu高粱、黄瓜、小麦、玉米Sorghum bicolor, Cucumis sativus, Triticum aestivum, Zea maysPb:芽、根EC50浓度范围为519~>1 280 mg·kg-1、285~445 mg·kg-1EC50 of shoot or root for Pb was 519~>1 280 mg·kg-1 or 285~445 mg·kg-1Cu:芽、根EC50浓度为48~232 mg·kg-1、<40~100 mg·kg-1EC50 of shoot or root for Cu was 48~232 mg·kg-1 or <40~100 mg·kg-1[64]Pb松树Pine trees松树生长受到抑制The growth of the pine trees was reduced[65]
含能化合物对植物产生的毒性受植物种类和土壤类型影响显著[54]。如含有丰富有机质的土壤中含能化合物的生物有效性较低,含能化合物在黏土中的生物有效性比沙土中低,从而产生毒性的可能性较大[14]。Robidoux等[55]研究了TNT和HMX对生菜和小麦出苗率的影响,当TNT的浓度为55.9 mg·kg-1时可降低二者出苗以及芽和根的生长,而HMX浓度达4 500 mg·kg-1仍无毒性。Peterson等[56-57]展示了TNT对多年生草的种子萌发和幼苗发育的影响,在TNT浓度为0~60 mg·L-1时,高羊茅和雀麦草种子发芽率随着TNT浓度增加而下降,当TNT浓度为7.5 mg·L-1时,柳枝稷和雀麦草的枝条生长速度均下降。Rocheleau等[58]证明RDX和HMX对多年生黑麦草生长的无效应浓度为9 586 mg·kg-1和9 582 mg·kg-1。Gong等[54]论证了TNT对水芹和胡萝卜的最低影响浓度为50 mg·kg-1,而燕麦能耐受TNT的浓度可高达1 600 mg·kg-1。Scheidemann等[59]报道了在TNT浓度为100 mg·kg-1时,紫花苜蓿无法生长,而灌木豌豆的耐受浓度高达500 mg·kg-1。含能化合物通过抑制光合作用影响植物生长过程,如Via等[60]报道了TNT和RDX抑制蜡杨梅的光合作用和叶片荧光,从而导致其干质量减轻,水分流失,使植物无法正常生长。含能化合物也会影响植物中抗氧化酶的活性以及植物根部脂类和类脂类物质的相关基因表达,从而进一步影响植物的生长[61]。
2.1.2 重金属对植物的影响
除了对重金属在植物体内积累的直接检测外,已有多种生物学终点如种子发芽、根系生长和幼苗发育等被用来评价污染物造成的负面效应[62],军事训练场地土壤中的重金属植物毒性研究主要以Pb的植物毒性为重点。Ahmad等[63]利用种子发芽实验和幼苗根生长实验进行研究,发现在含有Pb的军事训练场地土壤中培养的种子发芽率仅有15%,半数效应浓度(EC50)为7 150 mg·kg-1。An[64]报道了韩国某军事训练场土壤中Pb和Cu对高粱、黄瓜、小麦和玉米芽(根)生长的影响,结果显示,对于Pb而言,EC50浓度为519 mg·kg-1至>1 280 mg·kg-1(芽)和285~445 mg·kg-1 (根),而Cu的EC50浓度为48~232 mg·kg-1(芽)和<40~100 mg·kg-1(根)。故Cu对植物的毒性强于Pb,并且根生长对Pb和Cu的毒性比芽生长敏感。Selonen和Setälä[65]发现芬兰一个正在使用的军事训练场中松树生长明显受到抑制,这可能是由于根部积累了大量的Pb,使根部组织结构受到损伤造成的。
2.2 军事训练场地污染物对动物的影响
2.2.1 含能化合物对动物的影响
军事训练场地的含能化合物对动物的毒性效应,已经在实验中得到证实。动物毒性实验通过检测生物体的生长、存活、繁殖和身体负担等指标评估含能化合物的毒性(表6)。Mukhi和Pati o[66]研究了RDX对斑马鱼的急性暴露和亚急性暴露的毒性,发现RDX能够导致包括回旋运动和嗜睡等异常行为的发生,9.6 mg·L-1暴露浓度会造成斑马鱼的体质量减轻,死亡率增加,相比于9.6 mg·L-1暴露浓度,1 mg·L-1暴露浓度造成斑马鱼的体质量减轻而对死亡率无影响。Burton[67]基于体质量变化测试终点,证明了RDX对黑头软口鲦的毒性,年龄为15 d左右的黑头软口鲦的96 h急性暴露半致死浓度(LC50)为12.7 mg·L-1,28 d的长期暴露的最低有效浓度和无效浓度为2.4 mg·L-1和1.4 mg·L-1。Johnson等[68]选择蜥蜴、赤背螈和兔子3种不同的动物研究HMX的毒性,结果显示急性暴露于含有5 000 mg·kg-1 HMX的玉米油中蜥蜴会部分死亡,赤背螈在HMX浓度低于1 970 mg·kg-1的土壤中未受到负面影响,但是兔子在口服HMX 24 h后,表现出神经功能亢进,并伴有惊厥。上述数据表明,物种之间的生理差异,尤其是胃肠道的结构和功能差异,可能会影响HMX的吸收,从而导致不同物种暴露于同一化合物的毒性不同。相对于环硝铵类化合物(RDX、HMX)对生物受体的毒性,硝基芳香化合物TNT不仅会影响某些物种的生长和繁殖,还会造成严重的致死效应以及基因毒性[69]。TNT的毒性受体通常为斑马鱼和贻贝,Eum等[70]报道了TNT对斑马鱼胚胎发育的影响,在TNT处理胚胎的发育较快的组织中,细胞凋亡显著增加,通过光片显微镜对心管发育进行细胞分辨率的活体三维成像,发现TNT引起了心室形成不全和心脏循环缺陷。Koske等[71]也报道了TNT及其代谢产物2-氨基-4,6-二硝基甲苯(2-ADNT)和4-氨基-2,6-二硝基甲苯(4-ADNT)会造成斑马鱼胚胎的DNA损伤,从而导致胚胎发育过程中脊髓变形,TNT导致基因毒性的最低浓度为0.1 mg·L-1。Strehse等[72]发现TNT对蓝贻贝中羰基还原酶基因的表达有强烈的浓度依赖性效应。较早的研究也有报道TNT对土壤无脊椎动物的毒性,包括TNT对蚯蚓的致死、生命周期、繁殖力以及DNA损伤等方面的影响[73-75]。此外,TNT也会对大鼠造成脾脏充血、髓外造血、色素沉着和淋巴细胞增生等病状,其口服半致死量(LD50)值分别为607 mg·kg-1(雄鼠)和767 mg·kg-1(雌鼠)[76],TNT也会对犬造成溶血性贫血、白血症、肝损伤和脾肿大等毒性[77]。
o[66]研究了RDX对斑马鱼的急性暴露和亚急性暴露的毒性,发现RDX能够导致包括回旋运动和嗜睡等异常行为的发生,9.6 mg·L-1暴露浓度会造成斑马鱼的体质量减轻,死亡率增加,相比于9.6 mg·L-1暴露浓度,1 mg·L-1暴露浓度造成斑马鱼的体质量减轻而对死亡率无影响。Burton[67]基于体质量变化测试终点,证明了RDX对黑头软口鲦的毒性,年龄为15 d左右的黑头软口鲦的96 h急性暴露半致死浓度(LC50)为12.7 mg·L-1,28 d的长期暴露的最低有效浓度和无效浓度为2.4 mg·L-1和1.4 mg·L-1。Johnson等[68]选择蜥蜴、赤背螈和兔子3种不同的动物研究HMX的毒性,结果显示急性暴露于含有5 000 mg·kg-1 HMX的玉米油中蜥蜴会部分死亡,赤背螈在HMX浓度低于1 970 mg·kg-1的土壤中未受到负面影响,但是兔子在口服HMX 24 h后,表现出神经功能亢进,并伴有惊厥。上述数据表明,物种之间的生理差异,尤其是胃肠道的结构和功能差异,可能会影响HMX的吸收,从而导致不同物种暴露于同一化合物的毒性不同。相对于环硝铵类化合物(RDX、HMX)对生物受体的毒性,硝基芳香化合物TNT不仅会影响某些物种的生长和繁殖,还会造成严重的致死效应以及基因毒性[69]。TNT的毒性受体通常为斑马鱼和贻贝,Eum等[70]报道了TNT对斑马鱼胚胎发育的影响,在TNT处理胚胎的发育较快的组织中,细胞凋亡显著增加,通过光片显微镜对心管发育进行细胞分辨率的活体三维成像,发现TNT引起了心室形成不全和心脏循环缺陷。Koske等[71]也报道了TNT及其代谢产物2-氨基-4,6-二硝基甲苯(2-ADNT)和4-氨基-2,6-二硝基甲苯(4-ADNT)会造成斑马鱼胚胎的DNA损伤,从而导致胚胎发育过程中脊髓变形,TNT导致基因毒性的最低浓度为0.1 mg·L-1。Strehse等[72]发现TNT对蓝贻贝中羰基还原酶基因的表达有强烈的浓度依赖性效应。较早的研究也有报道TNT对土壤无脊椎动物的毒性,包括TNT对蚯蚓的致死、生命周期、繁殖力以及DNA损伤等方面的影响[73-75]。此外,TNT也会对大鼠造成脾脏充血、髓外造血、色素沉着和淋巴细胞增生等病状,其口服半致死量(LD50)值分别为607 mg·kg-1(雄鼠)和767 mg·kg-1(雌鼠)[76],TNT也会对犬造成溶血性贫血、白血症、肝损伤和脾肿大等毒性[77]。
表6 军事训练场污染物的动物毒性
Table 6 Animal toxicity of contaminants in military training ranges
污染物Contaminants物种Species暴露方式Exposure methods效应Effects参考文献ReferencesRDX斑马鱼Zebrafish饮水Drinking water体质量减轻,死亡率增加Lower body weights and high mortality [66]RDX黑头软口鲦Pimephales promelas溶液暴露Solution exposure半致死浓度为12.7 mg·L-1,最低有效应浓度和无效应浓度分别为2.4 mg·L-1和1.4 mg·L-1(体质量)LC50 was 12.7 mg·L-1, lowest-observed-effect concentration and no-observed-effect concentration were 2.4 mg·L-1 and 1.4 mg·L-1 (weight)[67]HMX蜥蜴、赤背螈、兔子Lizards, salamanders,rabbits蜥蜴和兔子:玉米油灌胃赤背螈:食土Lizards and rabbits: Corn oil through gavageSalamanders: Soil exposure部分蜥蜴死亡,兔子神经功能亢进,LD50为93 mg·kg-1,赤背螈无明显的副作用Some lizards died, rabbits showed neurologic effects manifested as hyperkinetic events, LD50 was 93 mg·kg-1, and salamander did not show adverse effects[68]TNT斑马鱼Zebrafish溶液暴露Solution exposure细胞凋亡增加,心室形成不全和心脏循环缺陷Apoptotic cells increased, hypoplastic heart chamber formation and cardiac looping defects[70]TNT贻贝Mytilus spp.溶液暴露Solution exposure羰基还原酶基因表达增加TNT induced the gene expression of carbonyl reductase[72]TNT蚯蚓Eisenia fetida土壤暴露Soil exposure致死效应,生命周期缩短,繁殖力下降,DNA损伤Mortality effect, life-cycle and fecundity were decreased, DNA damage[73-75]Pb、Cu牛、羊Cattle, sheep放牧Grazing体质量减轻Body weight was decreased[78]Pb、Cu、Cd、Ni、Zn蚯蚓Eisenia fetida土壤暴露Soil exposure体质量减轻、子代数减少、抗氧化系统受到影响以及脂质过氧化Body weight and juveniles was decreased, antioxidant system alterations and lipid peroxidation were affected[80]
2.2.2 重金属对动物的影响
军事训练场地中来自废弃弹药的Pb、Sb等重金属经过风化,转化为生物可利用形态,再通过植物的同化进入食物链,最后被动物摄取而在体内积累,当积累到一定量时会出现金属中毒反应。近年来,军事训练场地重金属动物毒性研究的受体主要集中在经常活动在军事训练场地土壤中的反刍动物以及无脊椎动物,主要从它们的生殖毒性、致死水平等个体生物终点和种群、群落的水平进行评估。相对其他重金属,Pb的污染程度最重,因此也最受关注,但整体看来,关于军事训练场地重金属对动物的毒性的信息较为匮乏。
Johnsen和Aaneby[78]评估了在挪威重金属Pb和Cu污染的靶场中放牧的牛和绵羊金属中毒的风险,数据显示,牛和羊摄入的军事训练场地Pb和Cu的量远低于规定值,这主要是土壤摄食率、草中金属积累量和放牧行为共同作用的结果。一般而言,在牛群中,Pb中毒是较常见的,而Cu中毒一般在羊群中更常见。Luo等[79]以蚯蚓为模式生物研究了靶场土壤特性对Pb的生物利用性和毒性影响,实验结果显示,经28 d暴露后,在Pb浓度>2 000 mg·kg-1(干质量),pH值为3.3~3.5时,成虫的死亡率增加,体质量减轻,幼虫的数量减少,后代数显著下降,而在Pb浓度<1 000 mg·kg-1(干质量)时,蚯蚓的繁殖与pH值和其他土壤特性的差异有更大的关系。![]() 等[80]发现重金属污染严重的军事训练场地土壤对蚯蚓的生长和繁殖具有很明显的抑制,蚯蚓通过从污染土壤中积累的大量Cu、Fe等微量元素对酶系统也产生了负面影响。
等[80]发现重金属污染严重的军事训练场地土壤对蚯蚓的生长和繁殖具有很明显的抑制,蚯蚓通过从污染土壤中积累的大量Cu、Fe等微量元素对酶系统也产生了负面影响。
2.3 军事训练场地污染物对微生物的影响
由于与周围土壤及其污染物的密切接触,微生物可能是受军事训练场地污染物影响最为严重的生物[81]。如果污染物的浓度超过了微生物的耐受范围,就会对微生物的生物量、呼吸量和酶活性等产生影响(表7),这些指标也经常被用于评估军事训练场地中污染物的微生物毒性[82]。微生物作为生态系统中的分解者,当其活性受到影响后,又会进一步影响生态系统的功能。因此,研究军事训练场地中高浓度的含能化合物和重金属对微生物的毒性具有非常重要的意义。
表7 军事训练场污染物的微生物毒性
Table 7 Microbial toxicity of contaminants in military training ranges

污染物Contaminants效应Effects参考文献ReferenceTNT、RDX、HMX微生物的生物量、种群数量和脱氢酶活性降低Microbial biomass, populations and dehydrogenase activity were decreased[83]TNT、RDX、HMX微生物的呼吸、群落结构和酶活性受到影响Microbial respiration, community structure and enzyme activity were influenced[12]Pb、Cd、Zn、CuATP值和酶活性及降低ATP values and enzyme activity were lower[84]Pb酶活性降低Enzyme activity were reduced[85]Pb微生物生物量减少Microbial biomass was reduced[19]Pb营养物质的浸出和微生物群落结构的改变Nutrient leaching and change in microbial community[86]
2.3.1 含能化合物对微生物的影响
微生物在军事训练场地中含能化合物的降解和转化过程中扮演着重要的角色,这也是目前针对含能化合物与微生物的主要研究方向。同时也有少量研究显示相关区域高浓度的含能化合物对微生物产生了负面影响,而对于致毒机制的工作目前还十分匮乏。Meyers等[83]报道了土壤中高浓度TNT、RDX和HMX的长期污染降低了微生物的生物量、脱氢酶活性以及细菌和真菌的种群数量。Yang等[12]也发现了TNT、RDX和HMX的暴露明显抑制了土壤微生物的呼吸、尿素酶和脱氢酶的活性,降低了土壤微生物群落结构的多样性。此外,该研究还发现TNT对土壤微生物的毒性明显强于RDX和HMX。
2.3.2 重金属对微生物的影响
高浓度的重金属对微生物具有毒性,但军事训练场地中Pb、Cu和Sb等重金属污染对微生物的影响并没有引起太多关注,少量的研究利用脱氢酶、生物量和群落结构等终点评估了军事训练场地中Pb等重金属对微生物的影响。Lee等[84]评估了韩国某军事训练场地中重金属(Pb、Cd、Zn和Cu)对土壤中微生物的生物量(ATP值)以及脱氢酶、酸性磷酸酶和β-葡糖苷酶活性的抑制作用,结果发现,被重金属污染的土壤中微生物的生长和3种酶的活性均明显受到抑制。Hashimoto等[85]报道了日本的某军事训练场地中重金属Pb对脱氢酶活性的影响,结果显示,脱氢酶的活性与可提取的Pb的量呈负相关。Rantalainen等[19]发现在芬兰一个军事训练场地中受Pb污染严重的区域微生物的生物量较低,表明该区域土壤中高浓度的Pb抑制了微生物的生长。Selonen和Setälä[86]发现在废弃20年的军事训练场地中Pb污染降低了土壤中磷脂脂肪酸含量,改变了微生物群落结构。该项研究结果还表明Pb不仅直接影响微生物群落结构,还可以通过改变土壤pH间接影响土壤微生物,但相关机制还尚不明确。
3 军事训练场地特征污染物的人体健康效应研究(Study of human health effects of typical contaminants in military training ranges)
3.1 含能化合物的人体健康效应研究
含能化合物在生产和使用中会进入土壤、水体和海洋环境,存在环境介质中的这些污染物会通过吸入、摄食和皮肤接触等暴露途径对人类健康造成危害。含能化合物对人类健康的毒害效应数据主要来源于军事训练场工人的流行病学研究。长期接触TNT的军事场地工作人员容易出现再生障碍性和溶血性贫血,威胁生命,其摄入途径与皮肤和呼吸相关,除贫血外,TNT还会导致肝坏死、白内障、皮炎和精子数量减少等健康问题[87]。流行病学研究表明RDX中毒会导致中枢神经系统功能性障碍,如诱发癫痫疾病[88],同时,RDX也会引起恶心、呕吐以及有一定的致癌性[89]。关于HMX对人类健康的影响数据有限,但毒理学的相关实验表明毒性低于TNT和RDX,高浓度的HMX吞咽或接触皮肤后可能对肝脏和中枢神经系统有害[90]。
3.2 重金属的人体健康效应研究
军事训练场地重金属的大量积累会对暴露人群的健康造成危害,如成人体内Pb含量升高会导致男性和女性生殖功能障碍、高血压、消化系统稳定性降低、记忆力减退等现象[91],已发现100 μg·L-1的低浓度Pb就可以造成儿童神经系统损伤、生长缓慢、头痛、听力和视力障碍[92]。Ni主要通过皮肤进入血液中,然后通过血液循环到达它的靶器官:肾脏。Ni的毒性因其赋存形式不同而变化,可溶性化合物能够被肺部吸收,而不溶性化合物则在肺中停留很长时间并产生黏液[93],比如Ni(CO)4会引起肺、脑、肝和肾等病变。Mn是人体必需的微量元素,但军事训练场地中高浓度的Mn会破坏人体的神经,肺和中枢神经系统是Mn产生毒性的靶器官,毒性表现为大脑的慢性疾病和支气管炎等肺部疾病[94-95]。Zn主要通过呼吸、皮肤接触和食道进入人体,摄入过多量的Zn后的直接症状包括腹痛、恶心和呕吐、嗜睡、贫血和头晕等[96]。Sb是人类的一种非必需元素,进入人体会引起呕吐、腹泻并伴有强烈的胃肠道疼痛,而Cu虽然是一种微量必需元素,但摄入过量会引起红细胞恶化等疾病[7]。
4 军事训练场地特征污染物的风险评估(Risk assessment of typical contaminants in military training ranges)
4.1 含能化合物的风险评估
前文所述的军事训练场地污染物的生态和健康风险需要定量的衡量标准加以描述,即风险评估。一定浓度的含能化合物的存在会对生态系统构成风险,常用于军事训练场中含能化合物的风险评估标准有潜在致癌风险和非致癌风险以及生态风险商(EHQ)等。Jung等[97]评估了韩国某一场地含能物的健康风险,结果显示其潜在致癌风险在1.9×10-11~1.4×10-10之间,而潜在的非致癌风险在2.3×10-6~4.9×10-6之间,癌症风险和非癌症风险均可以忽略不计。Choi等[98]用不同的生物受体评估了军事训练场地中TNT、RDX和HMX在附近水库修建前和修建后的潜在风险,在修建水库前,对于陆生无脊椎动物,RDX的EHQ值为6.47,而陆生植物的EHQ值均<0.001,在水库修建后,EHQ值变化不明显。这些EHQ值表明,修建水库不会显著改变EHQ值,且只有RDX构成了潜在的生态风险。Ryu等[99]报道了一个受污染的炮兵场的风险,他们计算TNT的非致癌风险略>1,而RDX的非致癌风险超过50,结果表明该地区TNT和RDX构成的风险超过规定值。
4.2 重金属的风险评估
军事训练场地重金属的风险研究采用各种指数进行评估,生物可利用性和生物性决定了它对不同生物的毒性强弱,常用于土壤和沉积物中重金属风险评估的指标有地质累积指数(Igeo)、生态风险指数(RI)、生物富集因子(BCF)和污染程度(CD)等。Islam等[100]用风险评价指数(RAC)和RI对土壤中残留的重金属进行风险评估,结果显示,亚临界水处理可有效降低重金属污染风险。Urrutia-Goyes等[101]利用BCF和Igeo评估由旧军事训练场地改进而来的城市公园的污染程度,并计算了危险商和致癌风险。研究结果表明,该场地中Pb具有非致癌风险,但致癌风险不明显,而对于Ni和Zn,致癌风险和非致癌风险均不明显。Bai和Zhao[7]利用污染系数(CF)、CD、生态风险系数(Eri)和RI评估了中国5个军事训练场地中的重金属污染风险,通过这些评估手段发现,Pb及其共同污染物Cu、Hg和Sb可能产生潜在的生态风险,但只有Pb具有潜在的健康风险。
5 总结与展望(Conclusion and prospect)
本文对军事训练场地含能化合物和重金属的污染特征、生态效应、人体健康效应和健康风险评估等4个方面进行了综述。从污染程度上来看,含能化合物在土壤中浓度较高,导致地表水和地下水污染严重。军事训练场地重金属污染,尤其是Pb污染最为严重,Pb在环境中容易发生风化和迁移,这些行为又受土壤理化性质,包括pH值、土壤有机质含量和含水量等的影响。从生态效应方面来看,含能化合物会造成植物的根和茎伸长缓慢,植物个体矮小,产量和质量大幅下降等毒性效应,对动物的毒性表现为生殖毒性、生长发育毒性等,而对微生物的影响体现在其活性的抑制方面。军事训练场地中大量Pb也会抑制植物的生长,导致动物的体质量下降和微生物群落结构改变。从健康效应来看,TNT和RDX的研究较多,已被列为潜在的致癌物质,而关于HMX的健康效应报道较少。重金属的摄入会导致人体多个系统功能出现异常,从而诱发一系列的疾病。从风险评价方面来看,目前针对军事训练场地污染物的风险评估都通过模型和指数等手段开展,其中或整合了污染物对特定受体生物的毒性效应作为评估的基础。
综合目前的研究,未来军事训练场地污染物的生态效应的工作应从以下几个方面重点开展:(1)含能化合物的长期污染可能会造成严重的环境风险,除了诱导环境生物自身的毒性外,还可能进一步影响其子代,造成多世代毒性,而含能化合物的跨代毒性研究目前还十分缺乏。因此,未来需要选择合适的生物模型评估含能化合物和新型含能材料的多世代毒性,从而更准确地预测其可能引起的环境风险。(2)目前关于含能化合物致毒机制的研究较少,许多报道仅局限于毒理学现象,未来应从分子水平探究军事训练场地污染物的共同作用对不同生物的毒性机制。对于含能化合物暴露过程中的生物转化过程,亟待引入新的技术和检测手段分析含能化合物在生物体内的赋存状态,推动相关的毒性机制研究,为临床诊断TNT、RDX和HMX等含能化合物的中毒提供理论依据。(3)Sb作为子弹的硬化剂,是军事训练场地中重要的重金属污染物,其毒性与As相当,但大部分研究主要集中于Pb而忽视了Sb。因此,未来需要重点关注Sb等重金属在军事训练场地中的环境行为和毒性,从而更准确地评估军事训练场地中重金属的生态和健康风险,并提出更加合理且经济有效的修复和管理措施。(4)对于污染物的生物有效性研究常采用动物实验和体外实验。动物实验费时费力,而且受到伦理方面的约束,无法满足评估污染物生物有效性的庞大需求。因此,常用体外实验测定生物有效性,包括相对生物有效性浸出方法(RBALP)、欧洲生物可利用性研究组方法(UBM)、基于生理学的提取方法(PBET)、体外消化模型(RIVM)、体外胃肠模型(IVG)和溶解度生物可利用性研究联盟方法(SBRC)等。但是,这些方法对于军事训练场地土壤的适应性还缺乏相关的实践数据,未来需探索适合特定类型土壤的体外方法用以研究军事训练场地中污染物的生物有效应,从而完善军事训练场地的风险管理。
[1] Rodríguez-Seijo A, Lago-Vila M, Andrade M L, et al. Pb pollution in soils from a trap shooting range and the phytoremediation ability of Agrostis capillaris L. [J]. Environmental Science and Pollution Research International, 2016, 23(2): 1312-1323
[2] Cao X D, Ma L Q, Chen M, et al. Lead transformation and distribution in the soils of shooting ranges in Florida, USA [J]. The Science of the Total Environment, 2003, 307(1-3): 179-189
[3] Sanderson P, Qi F J, Seshadri B, et al. Contamination, fate and management of metals in shooting range soils—A review [J]. Current Pollution Reports, 2018, 4(2): 175-187
[4] Barker A J, Clausen J L, Douglas T A, et al. Environmental impact of metals resulting from military training activities: A review [J]. Chemosphere, 2021, 265: 129110
[5] Pichtel J. Distribution and fate of military explosives and propellants in soil: A review [J]. Applied and Environmental Soil Science, 2012, 2012: 617236
[6] 李烨玲. 靶场土壤中铅的环境行为及生物有效性研究[D]. 合肥: 中国科学技术大学, 2018: 7-8
Li Y L. The environmental fate and bioavailability of lead in shooting range soils [D]. Hefei: University of Science and Technology of China, 2018: 7-8 (in Chinese)
[7] Bai J, Zhao X F. Ecological and human health risks of heavy metals in shooting range soils: A meta assessment from China [J]. Toxics, 2020, 8(2): 32
[8] Chatterjee S, Deb U, Datta S, et al. Common explosives (TNT, RDX, HMX) and their fate in the environment: Emphasizing bioremediation [J]. Chemosphere, 2017, 184: 438-451
[9] Certini G, Scalenghe R, Woods W I. The impact of warfare on the soil environment [J]. Earth-Science Reviews, 2013, 127: 1-15
[10] Kalderis D, Juhasz A L, Boopathy R, et al. Soils contaminated with explosives: Environmental fate and evaluation of state-of-the-art remediation processes (IUPAC Technical Report) [J]. Pure and Applied Chemistry, 2011, 83(7): 1407-1484
[11] Katseanes C K, Chappell M A, Hopkins B G, et al. Multivariate soil fertility relationships for predicting the environmental persistence of 2,4,6-trinitrotoluene (TNT) and 1,3,5-trinitro-1,3,5-tricyclohexane (RDX) among taxonomically distinct soils [J]. Journal of Environmental Management, 2017, 203(Pt 1): 383-390
[12] Yang X, Lai J L, Zhang Y, et al. Microbial community structure and metabolome profiling characteristics of soil contaminated by TNT, RDX, and HMX [J]. Environmental Pollution, 2021, 285: 117478
[13] Fayiga A O. Remediation of inorganic and organic contaminants in military ranges [J]. Environmental Chemistry, 2019, 16(2): 81
[14] Via S M, Zinnert J C. Impacts of explosive compounds on vegetation: A need for community scale investigations [J]. Environmental Pollution, 2016, 208: 495-505
[15] Alavi G, Chung M, Lichwa J, et al. The fate and transport of RDX, HMX, TNT and DNT in the volcanic soils of Hawaii: A laboratory and modeling study [J]. Journal of Hazardous Materials, 2011, 185(2-3): 1600-1604
[16] Sharma P, Mayes M A, Tang G. Role of soil organic carbon and colloids in sorption and transport of TNT, RDX and HMX in training range soils [J]. Chemosphere, 2013, 92(8): 993-1000
[17] Lingamdinne L P, Roh H, Choi Y L, et al. Influencing factors on sorption of TNT and RDX using rice husk biochar [J]. Journal of Industrial and Engineering Chemistry, 2015, 32: 178-186
[18] Katseanes C K, Chappell M A, Hopkins B G, et al. Multivariate functions for predicting the sorption of 2,4,6-trinitrotoluene (TNT) and 1,3,5-trinitro-1,3,5-tricyclohexane (RDX) among taxonomically distinct soils [J]. Journal of Environmental Management, 2016, 182: 101-110
[19] Rantalainen M L, Torkkeli M, Strömmer R, et al. Lead contamination of an old shooting range affecting the local ecosystem—A case study with a holistic approach [J]. Science of the Total Environment, 2006, 369(1-3): 99-108
[20] Lewis L A, Poppenga R J, Davidson W R, et al. Lead toxicosis and trace element levels in wild birds and mammals at a firearms training facility [J]. Archives of Environmental Contamination and Toxicology, 2001, 41(2): 208-214
[21] Fayiga A O, Saha U K. Soil pollution at outdoor shooting ranges: Health effects, bioavailability and best management practices [J]. Environmental Pollution, 2016, 216: 135-145
[22] Dermatas D, Menounou N, Dadachov M, et al. Lead leachability in firing range soils [J]. Environmental Engineering Science, 2006, 23(1): 88-101
[23] Fayiga A, Saha U. Impact of soil amendments and vegetation on Pb mobility in contaminated shooting range soils[J]. International Research Journal of Environmental Sciences, 2016, 5: 42-50
[24] Li Y L, Zhu Y B, Zhao S P, et al. The weathering and transformation process of lead in China’s shooting ranges [J]. Environmental Science Processes & Impacts, 2015, 17(9): 1620-1633
[25] Islam M N, Nguyen X P, Jung H Y, et al. Chemical speciation and quantitative evaluation of heavy metal pollution hazards in two army shooting range backstop soils [J]. Bulletin of Environmental Contamination and Toxicology, 2016, 96(2): 179-185
[26] Cao X D, Dermatas D, Xu X F, et al. Immobilization of lead in shooting range soils by means of cement, quicklime, and phosphate amendments [J]. Environmental Science and Pollution Research International, 2008, 15(2): 120-127
[27] Kelebemang R, Dinake P, Sehube N, et al. Speciation and mobility of lead in shooting range soils [J]. Chemical Speciation & Bioavailability, 2017, 29(1): 143-152
[28] Ahmad M, Lee S S, Moon D H, et al. A Review of Environmental Contamination and Remediation Strategies for Heavy Metals at Shooting Range Soils [M]//Environmental Protection Strategies for Sustainable Development. Dordrecht: Springer Netherlands, 2011: 437-451
[29] Ma L Q, Hardison D W Jr, Harris W G, et al. Effects of soil property and soil amendment on weathering of abraded metallic Pb in shooting ranges [J]. Water, Air, and Soil Pollution, 2007, 178(1): 297-307
[30] Cao X D, Ma L Q, Chen M, et al. Weathering of lead bullets and their environmental effects at outdoor shooting ranges [J]. Journal of Environmental Quality, 2003, 32(2): 526-534
[31] Liu R, Gress J, Gao J, et al. Impacts of two best management practices on Pb weathering and leachability in shooting range soils [J]. Environmental Monitoring and Assessment, 2013, 185(8): 6477-6484
[32] Yin X Q. Effectiveness of best management practices in reducing Pb-bullet weathering in a shooting range in Florida [J]. Journal of Hazardous Materials, 2010, 179(1-3): 895-900
[33] Rooney C, McLaren R. Distribution of soil lead contamination at clay target shooting ranges[J]. Australasian Journal of Ecotoxicology, 2000, 6(2): 95-102
![]() V, Komárek M, Hájek T. Lead contamination of an agricultural soil in the vicinity of a shooting range [J]. Environmental Monitoring and Assessment, 2010, 162(1): 37-46
V, Komárek M, Hájek T. Lead contamination of an agricultural soil in the vicinity of a shooting range [J]. Environmental Monitoring and Assessment, 2010, 162(1): 37-46
[35] Yin X Q, Gao B, Ma L Q, et al. Colloid-facilitated Pb transport in two shooting-range soils in Florida [J]. Journal of Hazardous Materials, 2010, 177(1-3): 620-625
[36] Dinake P, Maphane O, Sebogisi K, et al. Pollution status of shooting range soils from Cd, Cu, Mn, Ni and Zn found in ammunition [J]. Cogent Environmental Science, 2018, 4(1): 1528701
[37] Laporte-Saumure M, Martel R, Mercier G. Characterization and metal availability of copper, lead, antimony and zinc contamination at four Canadian small arms firing ranges [J]. Environmental Technology, 2011, 32(7): 767-781
[38] Martin W A, Lee L S, Schwab P. Antimony migration trends from a small arms firing range compared to lead, copper, and zinc [J]. Science of the Total Environment, 2013, 463-464: 222-228
[39] Tandy S, Meier N, Schulin R. Use of soil amendments to immobilize antimony and lead in moderately contaminated shooting range soils [J]. Journal of Hazardous Materials, 2017, 324(Pt B): 617-625
[40] Okkenhaug G, Grasshorn Gebhardt K A, Amstaetter K, et al. Antimony (Sb) and lead (Pb) in contaminated shooting range soils: Sb and Pb mobility and immobilization by iron based sorbents, a field study [J]. Journal of Hazardous Materials, 2016, 307: 336-343
[41] Mariussen E, Johnsen I V, Strømseng A E. Distribution and mobility of lead (Pb), copper (Cu), zinc (Zn), and antimony (Sb) from ammunition residues on shooting ranges for small arms located on mires [J]. Environmental Science and Pollution Research, 2017, 24(11): 10182-10196
[42] Sanderson P, Naidu R, Bolan N. Effectiveness of chemical amendments for stabilisation of lead and antimony in risk-based land management of soils of shooting ranges [J]. Environmental Science and Pollution Research International, 2015, 22(12): 8942-8956
[43] Tandy S, Hockmann K, Keller M, et al. Antimony mobility during prolonged waterlogging and reoxidation of shooting range soil: A field experiment [J]. The Science of the Total Environment, 2018, 624: 838-844
[44] Hu X Y, Guo X, He M, et al. pH-dependent release characteristics of antimony and arsenic from typical antimony-bearing ores [J]. Journal of Environmental Sciences, 2016, 44: 171-179
[45] Johnson C A, Moench H, Wersin P, et al. Solubility of antimony and other elements in samples taken from shooting ranges [J]. Journal of Environmental Quality, 2005, 34(1): 248-254
[46] Rodríguez-Seijo A, Alfaya M C, Andrade M L, et al. Copper, chromium, nickel, lead and zinc levels and pollution degree in firing range soils [J]. Land Degradation & Development, 2016, 27(7): 1721-1730
[47] Okkenhaug G, Smebye A B, Pabst T, et al. Shooting range contamination: Mobility and transport of lead (Pb), copper (Cu) and antimony (Sb) in contaminated peatland [J]. Journal of Soils and Sediments, 2018, 18(11): 3310-3323
[48] Migliorini M. The effects of heavy metal contamination on the soil arthropod community of a shooting range [J]. Environmental Pollution, 2004, 129(2): 331-340
[49] Panz K, Miksch K. Phytoremediation of explosives (TNT, RDX, HMX) by wild-type and transgenic plants [J]. Journal of Environmental Management, 2012, 113: 85-92
[50] Groom C A, Halasz A, Paquet L, et al. Accumulation of HMX (octahydro-1,3,5,7-tetranitro-1,3,5,7-tetrazocine) in indigenous and agricultural plants grown in HMX-contaminated anti-tank firing-range soil [J]. Environmental Science & Technology, 2002, 36(1): 112-118
[51] Zhang L, Rylott E L, Bruce N C, et al. Genetic modification of western wheatgrass (Pascopyrum smithii) for the phytoremediation of RDX and TNT [J]. Planta, 2019, 249(4): 1007-1015
[52] Das P, Sarkar D, Datta R. Proteomic profiling of vetiver grass (Chrysopogon zizanioides) under 2,4,6-trinitrotoluene (TNT) stress [J]. GeoHealth, 2017, 1(2): 66-74
[53] Rocheleau S, Kuperman R G, Simini M, et al. Toxicity of 2,4-dinitrotoluene to terrestrial plants in natural soils [J]. The Science of the Total Environment, 2010, 408(16): 3193-3199
[54] Gong P, Wilke B M, Fleischmann S. Soil-based phytotoxicity of 2,4,6-trinitrotoluene (TNT) to terrestrial higher plants [J]. Archives of Environmental Contamination and Toxicology, 1999, 36(2): 152-157
[55] Robidoux P Y, Bardai G, Paquet L, et al. Phytotoxicity of 2,4,6-trinitrotoluene (TNT) and octahydro-1,3,5,7-tetranitro-1,3,5,7-tetrazocine (HMX) in spiked artificial and natural forest soils [J]. Archives of Environmental Contamination and Toxicology, 2003, 44(2): 198-209
[56] Peterson M M, Horst G L, Shea P J, et al. Germination and seedling development of switchgrass and smooth bromegrass exposed to 2,4,6-trinitrotoluene [J]. Environmental Pollution, 1998, 99(1): 53-59
[57] Peterson M M, Horst G L, Shea P J, et al. TNT and 4-amino-2,6-dinitrotoluene influence on germination and early seedling development of tall fescue [J]. Environmental Pollution, 1996, 93(1): 57-62
[58] Rocheleau S, Lachance B, Kuperman R G, et al. Toxicity and uptake of cyclic nitramine explosives in ryegrass Lolium perenne [J]. Environmental Pollution, 2008, 156(1): 199-206
[59] Scheidemann P, Klunk A, Sens C, et al. Species dependent uptake and tolerance of nitroaromatic compounds by higher plants [J]. Journal of Plant Physiology, 1998, 152(2-3): 242-247
[60] Via S M, Zinnert J C, Butler A D, et al. Comparative physiological responses of Morella cerifera to RDX, TNT, and composition B contaminated soils [J]. Environmental and Experimental Botany, 2014, 99: 67-74
[61] Yang X. Analysis of the biodegradation and phytotoxicity mechanism of TNT, RDX, HMX in alfalfa (Medicago sativa) [J]. Chemosphere, 2021, 281: 130842
[62] Branzini A, Zubillaga M S. Assessing phytotoxicity of heavy metals in remediated soil [J]. International Journal of Phytoremediation, 2010, 12(4): 335-342
[63] Ahmad M, Lee S S, Yang J E, et al. Effects of soil dilution and amendments (mussel shell, cow bone, and biochar) on Pb availability and phytotoxicity in military shooting range soil [J]. Ecotoxicology and Environmental Safety, 2012, 79: 225-231
[64] An Y J. Assessment of comparative toxicities of lead and copper using plant assay [J]. Chemosphere, 2006, 62(8): 1359-1365
[65] Selonen S, Setälä H. Soil processes and tree growth at shooting ranges in a boreal forest reflect contamination history and lead-induced changes in soil food webs [J]. Science of the Total Environment, 2015, 518-519: 320-327
[66] Mukhi S, Pati o R. Effects of hexahydro-1,3,5-trinitro-1,3,5-triazine (RDX) in zebrafish: General and reproductive toxicity [J]. Chemosphere, 2008, 72(5): 726-732
o R. Effects of hexahydro-1,3,5-trinitro-1,3,5-triazine (RDX) in zebrafish: General and reproductive toxicity [J]. Chemosphere, 2008, 72(5): 726-732
[67] Burton D T. The acute and chronic toxicity of hexahydro-1,3,5-trinitro-1,3,5-triazine (RDX) to the fathead minnow (Pimephales) [J]. Chemosphere, 1994, 29(3): 567-579
[68] Johnson M S, McFarland C A, Bazar M A, et al. Toxicity of octahydro-1,3,5,7-tetranitro-1,3,5,7-tetrazocine (HMX) in three vertebrate species [J]. Archives of Environmental Contamination and Toxicology, 2010, 58(3): 836-843
[69] Lotufo G R. Toxicity and Bioaccumulation of Munitions Constituents in Aquatic and terrestrial Organisms [M]//Challenges and Advances in Computational Chemistry and Physics. Cham: Springer International Publishing, 2017: 445-479
[70] Eum J, Kwak J, Kim H J, et al. 3D visualization of developmental toxicity of 2,4,6-trinitrotoluene in zebrafish embryogenesis using light-sheet microscopy [J]. International Journal of Molecular Sciences, 2016, 17(11): 1925
[71] Koske D, Goldenstein N I, Kammann U. Nitroaromatic compounds damage the DNA of zebrafish embryos (Danio rerio) [J]. Aquatic Toxicology, 2019, 217: 105345
[72] Strehse J S, Brenner M, Kisiela M, et al. The explosive trinitrotoluene (TNT) induces gene expression of carbonyl reductase in the blue mussel (Mytilus spp.): A new promising biomarker for sea dumped war relicts? [J]. Archives of Toxicology, 2020, 94(12): 4043-4054
[73] Lachance B, Renoux A Y, Sarrazin M, et al. Toxicity and bioaccumulation of reduced TNT metabolites in the earthworm Eisenia andrei exposed to amended forest soil [J]. Chemosphere, 2004, 55(10): 1339-1348
[74] Robidoux P Y, Hawari J, Bardai G, et al. TNT, RDX, and HMX decrease earthworm (Eisenia andrei) life-cycle responses in a spiked natural forest soil [J]. Archives of Environmental Contamination and Toxicology, 2002, 43(4): 379-388
[75] Fuchs J, Piola L, González E P, et al. Coelomocyte biomarkers in the earthworm Eisenia fetida exposed to 2,4,6-trinitrotoluene (TNT) [J]. Environmental Monitoring and Assessment, 2011, 175(1-4): 127-137
[76] Reddy G, Chandra S A M, Lish J W, et al. Toxicity of 2,4,6-trinitrotoiuene (TNT) in hispid cotton rats (Sigmodon hispidus): Hematological, biochemical, and pathological effects [J]. International Journal of Toxicology, 2000, 19(3): 169-177
[77] Levine B S, Rust J H, Barkley J J, et al. Six month oral toxicity study of trinitrotoluene in beagle dogs [J]. Toxicology, 1990, 63(2): 233-244
[78] Johnsen I V, Aaneby J. Soil intake in ruminants grazing on heavy-metal contaminated shooting ranges [J]. The Science of the Total Environment, 2019, 687: 41-49
[79] Luo W, Verweij R A, van Gestel C A M. Determining the bioavailability and toxicity of lead contamination to earthworms requires using a combination of physicochemical and biological methods [J]. Environmental Pollution, 2014, 185: 1-9
![]() J, Praspaliauskas M, Pedišius N, et al. Biological assessment of contaminated shooting range soil using earthworm biomarkers [J]. Ecotoxicology, 2021, 30(10): 2024-2035
J, Praspaliauskas M, Pedišius N, et al. Biological assessment of contaminated shooting range soil using earthworm biomarkers [J]. Ecotoxicology, 2021, 30(10): 2024-2035
[81] Sanderson P, Naidu R, Bolan N. Ecotoxicity of chemically stabilised metal(loid)s in shooting range soils [J]. Ecotoxicology and Environmental Safety, 2014, 100: 201-208
[82] Kumpiene J, Guerri G, Landi L, et al. Microbial biomass, respiration and enzyme activities after in situ aided phytostabilization of a Pb- and Cu-contaminated soil [J]. Ecotoxicology and Environmental Safety, 2009, 72(1): 115-119
[83] Meyers S K, Deng S P, Basta N T, et al. Long-term explosive contamination in soil: Effects on soil microbial community and bioremediation [J]. Soil and Sediment Contamination: An International Journal, 2007, 16(1): 61-77
[84] Lee I S, Kim O K, Chang Y Y, et al. Heavy metal concentrations and enzyme activities in soil from a contaminated Korean shooting range [J]. Journal of Bioscience and Bioengineering, 2002, 94(5): 406-411
[85] Hashimoto Y, Matsufuru H, Takaoka M, et al. Impacts of chemical amendment and plant growth on lead speciation and enzyme activities in a shooting range soil: An X-ray absorption fine structure investigation [J]. Journal of Environmental Quality, 2009, 38(4): 1420-1428
[86] Selonen S, Setälä H. Nutrient leaching, soil pH and changes in microbial community increase with time in lead-contaminated boreal forest soil at a shooting range area [J]. Environmental Science and Pollution Research, 2017, 24(6): 5415-5425
[87] Bolt H M, Degen G H, Dorn S B, et al. Genotoxicity and potential carcinogenicity of 2,4,6-TNT trinitrotoluene: Structural and toxicological considerations [J]. Reviews on Environmental Health, 2006, 21(4): 217-228
[88] Woody R C, Kearns G L, Brewster M A, et al. The neurotoxicity of cyclotrimethylenetrinitramine (RDX) in a child: A clinical and pharmacokinetic evaluation [J]. Journal of Toxicology Clinical Toxicology, 1986, 24(4): 305-319
[89] Major M A. Biological Degradation of Explosives. Agronomy Monographs. [M]. Madison, WI, USA: American Society of Agronomy, Crop Science Society of America, Soil Science Society of America, 2015: 111-132
[90] Bernstein A, Ronen Z. Biodegradation of the Explosives TNT, RDX and HMX [M]//Environmental Science and Engineering. Berlin, Heidelberg: Springer Berlin Heidelberg, 2011: 135-176
[91] Camobreco V J, Richards B K, Steenhuis T S, et al. Movement of heavy metals through undisturbed and homogenized soil columns [J]. Soil Science, 1996, 161(11): 740-750
[92] Bruell R, Nikolaidis N P, Long R P. Evaluation of remedial alternatives of lead from shooting range soil [J]. Environmental Engineering Science, 1999, 16(5): 403-414
[93] Lima D R, Bezerra M L, Neves E B, et al. Impact of ammunition and military explosives on human health and the environment [J]. Reviews on Environmental Health, 2011, 26(2): 101-110
[94] Aschner M, Vrana K E, Zheng W. Manganese uptake and distribution in the central nervous system (CNS) [J]. Neurotoxicology, 1999, 20(2-3): 173-180
[95] Guilarte T R. Manganese and Parkinson’s disease: A critical review and new findings [J]. Environmental Health Perspectives, 2010, 118(8): 1071-1080
[96] Plum L M, Rink L, Haase H. The essential toxin: Impact of zinc on human health [J]. International Journal of Environmental Research and Public Health, 2010, 7(4): 1342-1365
[97] Jung J W, Lee G, Im S, et al. Human health risk assessment of a civilian-accessible active firing range [J]. Human and Ecological Risk Assessment: An International Journal, 2013, 19(3): 807-818
[98] Choi Y, Jeong S, Ryu H, et al. Ecological risk characterization in a military heavy metals- and explosives-contaminated site [J]. Human and Ecological Risk Assessment: An International Journal, 2011, 17(4): 856-872
[99] Ryu H, Han J K, Jung J W, et al. Human health risk assessment of explosives and heavy metals at a military gunnery range [J]. Environmental Geochemistry and Health, 2007, 29(4): 259-269
[100] Islam M N, Jung H Y, Park J H. Subcritical water treatment of explosive and heavy metals co-contaminated soil: Removal of the explosive, and immobilization and risk assessment of heavy metals [J]. Journal of Environmental Management, 2015, 163: 262-269
[101] Urrutia-Goyes R, Argyraki A, Ornelas-Soto N. Assessing lead, nickel, and zinc pollution in topsoil from a historic shooting range rehabilitated into a public urban park [J]. International Journal of Environmental Research and Public Health, 2017, 14(7): 698