长链非编码RNA(long non-coding RNA, LncRNA)是指转录本长度>200个核苷酸(nucleotide, nt)且一般无编码蛋白质能力的一类RNA分子[1]。与信使RNA(message RNA, mRNA)形成类似,LncRNA是由RNase Ⅱ聚合酶转录生成,而后经过剪切加工形成。与mRNA不同的是,大部分LncRNAs的基因序列保守性低,仅在LncRNA的启动子区域附近或剪切位点具有一定的保守性。虽然LncRNA保守性较差而且不能编码蛋白质,但它能够通过与DNA、RNA、蛋白质相互作用,在表观遗传水平、转录以及转录后水平调控基因的表达进而发挥生物学功能[2-4]。有研究指出,LncRNA参与生物体的生长发育、细胞分化、细胞增殖凋亡、免疫及代谢等多种生命活动[5-9],并且与一些疾病过程[10-11]也密切相关。近年来,随着对LncRNA的深入研究,发现其在环境污染物引起的毒理学效应中同样发挥着重要作用[12],生物体暴露于各种环境污染物可引起LncRNA的异常表达[13],同时环境污染物可以通过调节特定LncRNA来调控相关基因的表达,从而产生生理效应[14]。本文综述了LncRNA在不同类型环境污染物作用下的应答研究,为后续更加深入地探索LncRNA的毒理学效应提供参考。
1 LncRNA的分类(The classification of LncRNAs)
根据LncRNA的不同特点可以将LncRNA进行不同的分类。按照LncRNA的长度,可以将LncRNA分为小型LncRNA(200~950 nt)、中型LncRNA(950~4 800 nt)、大型LncRNA(4 800 nt以上)。在人类(Homo sapiens)中,大多数LncRNAs是小型LncRNA(58%),而在小鼠(Mus musculus)中大多数LncRNAs是中型LncRNA(78%)[15]。按照LncRNA在基因组中与蛋白质编码基因的相对位置(图1),可以将LncRNA分为:(1)正义LncRNA,即LncRNA是在蛋白质编码基因的正义链转录形成;(2)反义LncRNA,即LncRNA是在蛋白质编码基因的反义链转录形成;(3)基因间LncRNA,是指LncRNA是在基因之间的区域转录形成;(4)双向LncRNA,是指位于基因启动子区域附近但转录方向相反的LncRNA;(5)内含子LncRNA,由基因的内含子区域转录而成的LncRNA。目前的研究主要集中在基因间LncRNA和反义LncRNA上。此外,按照LncRNA的作用机制,可以将LncRNA分为4类:信号分子(Signal)、诱饵分子(Decoy)、引导分子(Guide)和支架分子(Scaffold)[16]。信号分子是指生物在受到刺激后,一些特异性LncRNA被转录出来,并可以作为信号传导分子参与特殊信号的传导。Zhang等[17]用Toll样受体刺激人类巨噬细胞后,鉴别出了229对顺式LncRNA-蛋白质编码基因对。诱饵分子是指LncRNA能够与蛋白质/DNA/RNA结合,从而阻断了该分子的作用和信号通路,如LncRNA MxA能够与干扰素基因IFN-β启动子结合从而抑制IFN-β的转录[18]。引导分子是指LncRNA与蛋白质(通常是转录因子)结合后可将蛋白复合物定位到特定的DNA序列上,从而调控下游分子的转录。比如,LncRNA DANCR可以通过引导亮氨酸的五肽重复序列到白细胞介素11(IL11)、细胞周期蛋白D1(CCND1)、尿激酶型纤维蛋白溶酶原激活因子(PLAU)的mRNA上,从而促进它们的表达[19]。支架分子是指LncRNA可作为一个“中心平台”,能够与多种蛋白质结合形成核糖核蛋白复合物,当多条信号通路被激活后,LncRNA可以实现不同信号通路交汇与整合。比如,LncRNA GClnc1可以作为一个支架结合组蛋白甲基转移酶复合物的关键组成部分(WDR5)和组蛋白乙酰转移酶(KAT2A)从而对超氧化物歧化酶2(SOD2)等靶标进行修饰[20]。
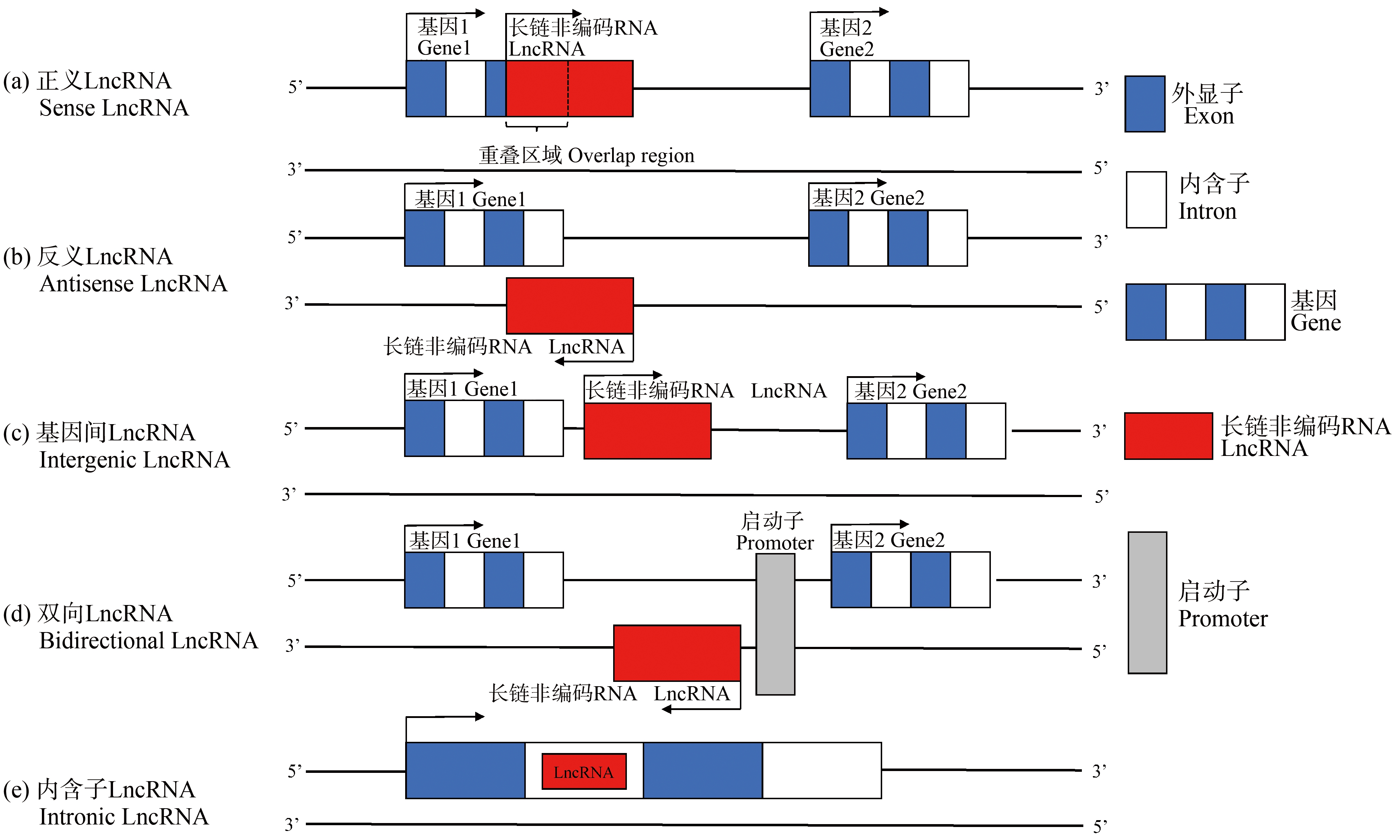
图1 5类LncRNA
注:LncRNA表示长链非编码RNA;箭头代表基因转录方向。
Fig.1 Five types of LncRNA
Note: LncRNA stands for long non-coding RNA; the arrow represents the direction of gene transcription.
2 LncRNA的生物学功能(The biological functions of LncRNAs)
LncRNA之前一直被认为不具备功能调控作用。随着研究LncRNA的方法逐渐增多,从最初的基因印记到后续的微阵列、转录组测序和RNA结合蛋白免疫沉淀等[21],使得对LncRNA功能的研究愈加深入。LncRNA不仅可以调控相同染色体上的邻近基因,还能与其他染色体上的多个结合位点相互作用[22]。总的来说,LncRNA能够在转录、转录后及表观遗传水平发挥生物学作用。在转录水平上,LncRNA可通过与转录因子、DNA或RNA聚合酶发生作用从而调控基因的转录过程[23]。比如由酿酒酵母半乳糖基因gal转录成的LncRNA在gal启动子上形成LncRNA-DNA复合物,诱导gal的表达[24];LncRNA HITT通过引导甲基转移酶Ezh2与下游缺氧诱导因子基因HIF-1α启动子形成RNA-DNA三聚体,从而抑制下游启动子的转录[25]。LncRNA在转录后水平的调控主要是指LncRNA可调控转录后mRNA各方面的功能包括对mRNA的加工和剪接、转运、翻译和降解等[26]。比如来自成纤维细胞生长因子受体2基因(FGFR2)的反义LncRNA可以促进FGFR2选择性剪接从而影响其表达[27]。LncRNA在表观遗传上的调控的表现形式主要是DNA甲基化、组蛋白修饰,染色质重塑修饰等[28]。如LncRNA XIST通过募集DNA甲基转移酶加速金属蛋白酶-3基因(TIMP-3)启动子的甲基化,从而提高软骨细胞中的胶原蛋白降解[29];LncRNA HOTAIR可以结合至少2个组蛋白修饰复合体,使组蛋白H3K4去甲基化,进而调控目标基因的表达[30]。
越来越多的证据表明,LncRNA在转录后水平上能够通过竞争性内源RNA机制(competing endogenous RNAs, CeRNA)实现对基因的调控。CeRNA机制最早由Salmena等[31]提出,认为mRNA、LncRNA可以通过一些应答因子即MicroRNA(miRNA)实现它们之间的“交流”。miRNA是指长度只有19~25个核苷酸的非编码RNA分子,它们可以与靶基因的3’非翻译区结合从而抑制靶基因的翻译或降解靶基因。因而CeRNA机制(图2)就是指对于同一个miRNA,LncRNA能够和mRNA形成竞争关系,通过竞争性结合miRNA从而达到保护mRNA表达的作用。目前CeRNA机制在哺乳动物比如人、小鼠中已经得到了广泛的研究。如在人体精原细胞中LncRNA CASC7能够与泛素蛋白连接酶基因CBL竞争性结合miRNA-122-5p,从而影响CBL的表达量以此调控精原干细胞的增殖过程[32];在小鼠中LncRNA NEAT1通过miRNA-148a-3p靶向磷酸酶基因Pten在M2巨噬细胞极化过程中起重要作用[33]。
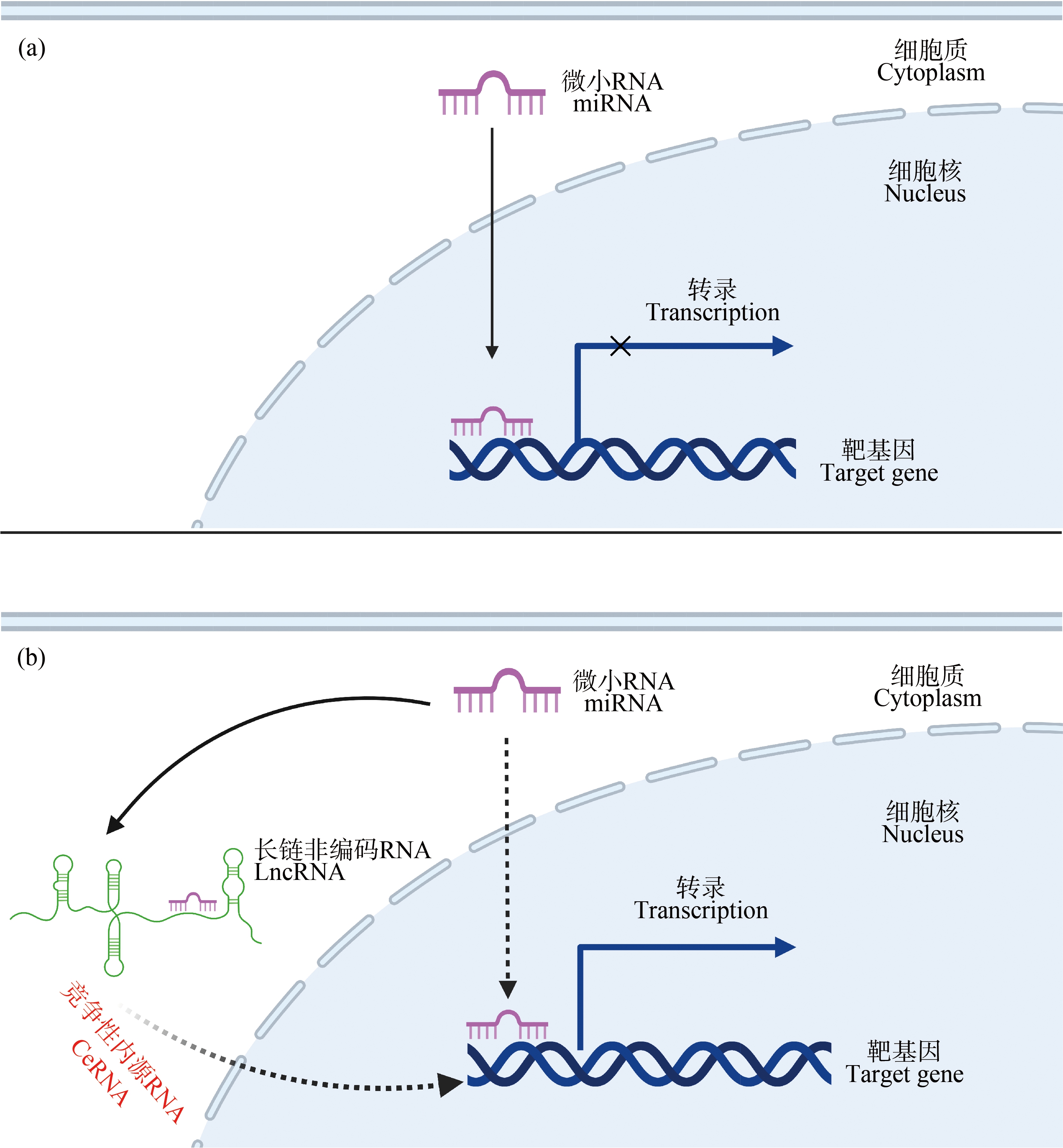
图2 竞争性内源RNA机制
注:(a)miRNA影响靶基因的表达;(b)LncRNA充当miRNA分子海绵使靶基因正常表达;miRNA为微小RNA;CeRNA为竞争性内源RNA。
Fig.2 Mechanisms of competing endogenous RNA
Note:(a)miRNA represses the expression of target gene;(b)LncRNA acts as a molecular sponge regulating miRNA to enable normal expression of target gene; miRNA stands for microRNA; CeRNA stands for competing endogenous RNAs.
3 环境污染物作用下LncRNA的应答研究(Response of LncRNAs to environmental pollutants)
大量LncRNAs的发现,有力地证明了LncRNA结构与功能的多样性与复杂性。目前LncRNA的研究主要集中在遗传学上,在毒理学方面的研究还比较少,同时也缺乏相关毒理学的LncRNA数据库。尽管如此,根据LncRNA在环境污染物毒理学方面近10年发表的文献数量,发现LncRNA在毒理学方面的研究也越来越广泛。环境污染物如多环芳烃、多氯联苯、多溴联苯醚、苯、双酚类化合物、全氟和多氟烷醚类化合物、药品及个人护理品、农药、重金属、纳米材料以及PM2.5等,都会引起机体内LncRNA产生应答。
3.1 多环芳烃胁迫下LncRNA的应答
多环芳烃是一类广受关注的持久性环境污染物,在环境中无处不在,具有“三致”效应。Gao等[34]采集了150名焦炉工人与60名非多环芳烃暴露工人的外周血淋巴细胞进行了相关LncRNAs(HOTAIR、MALAT1、TUG1和GAS5)表达量分析,这些LncRNAs均有被报道与DNA损伤及癌症相关。实验发现焦炉工人外周血淋巴细胞中的LncRNA HOTAIR、LncRNA MALAT1表达增强且DNA损伤程度与其表达量呈显著正相关,由此表明这2个LncRNAs可能参与了多环芳烃引起的DNA损伤反应。Yu等[35]进一步利用LncRNA芯片技术检测了焦炉工人和正常工人的差异表达的LncRNAs,发现与对照组相比,焦炉工人有1 234个LncRNAs下调,805个LncRNAs上调。其中一个LncRNA NR_024564与尿液中的2-羟基菲、1-羟基芘以及总多环芳烃代谢物水平呈负相关,表明其可能参与了多环芳烃的毒性效应。Gao等[36]研究了苯并a芘暴露下人支气管上皮细胞系(BEAS-2B)中LncRNAs的诱导情况,发现LncRNA-DQ786227在细胞内高表达且显著性促进了该细胞在体外形成集落和在裸鼠体内形成肿瘤的能力,表明其可能是一个潜在的癌症标志物。
3.2 多氯联苯和多溴二苯醚胁迫下LncRNA的应答
多氯联苯是一类工业化合物,曾被广泛应用于电容器和变压器的绝缘油、液压油、导热油以及液体绝缘电缆。多氯联苯可以通过人类活动释放到环境中,由于理化性质稳定,不易降解,导致其能在环境中持续存在。同时,共面的多氯联苯是一种强烈的致癌物质,能够对人类健康造成威胁。Chen等[37]探究了LncRNA参与2,3,3’,4,4’,5-六氯联苯(PCB156)引起的肝损伤效应,发现暴露于3.4 μmol·L-1PCB156 72 h后,人体肝细胞系(L-02)有222个差异表达的mRNAs和628个差异表达的LncRNAs;进一步通过验证发现3个差异显著表达的LncRNAs(LncRNA NON-HSAT174696、LncRNA NONHSAT179219和LncRNA NONHSAT161887)能够作为外胚层发育异常蛋白受体基因EDAR、细胞色素基因CYP1B1和乙醛脱氢酶基因ALDH3A1的调节因子从而在PCB156诱导的肝毒性效应发挥重要作用。与多氯联苯类似,多溴联苯醚的暴露同样对肝中的LncRNA表达产生了影响。Zhang等[38]将人体肝细胞系(HepaRG)暴露于25 μmol·L-1的四溴二苯醚(BDE-47)和五溴二苯醚(BDE-99)24 h后发现,总共有1 104个LncRNAs受到BDE-47的特异性调节,560个LncRNAs受到BDE-99的特异性调节。进一步发现多溴联苯醚可以通过孕烷X受体(PXR)/组成型雄甾烷受体(CAR)配体的方式来影响LncRNA表达和LncRNA-蛋白质编码基因间的相互作用。Garcia等[39]发现,在暴露于2,3,7,8-四氯二苯并二噁英(TCDD)的斑马鱼(Danio rerio)胚胎中,LncRNA slincR表达量增加,其能抑制转录因子sox9b的表达,从而减轻TCDD的毒性效应。
3.3 苯、双酚类化合物胁迫下LncRNA的应答
苯是一种重要的工业原料和有机溶剂,长期接触苯可能会造成血液系统损害甚至导致白血病。为探究苯暴露过程中诱导血液毒性的潜在LncRNAs,Tian等[40]采用微阵列技术分析了慢性苯暴露组、白血病组以及正常组差异表达的LncRNAs,发现了173个上调和258个下调的LncRNAs,其中LncRNA CUST_40243可能与慢性苯中毒有关。与之类似的,Bai等[41]通过微阵列技术鉴定出2个LncRNAs(NR_045623和NR_028291)可能是与苯血液毒性相关的关键LncRNAs。Guo等[42]进一步探究了LncRNA在苯诱导血液毒性效应的潜在机制,通过体内和体外实验发现,LncRNA-OBFC2A能够通过调节细胞周期参与苯毒性,其中该LncRNA主要是通过靶向信号传导蛋白SMAD3进而调节细胞周期蛋白D1的表达,抑制G1/S细胞周期进程,从而引发细胞毒性。
双酚A(bisphenol-A, BPA)是一种典型的内分泌干扰物,能够与雌激素受体、雄激素受体和甲状腺激素受体相互作用,从而对机体的生殖系统、神经系统、代谢功能、免疫功能以及后代的生长发育造成危害。Bhan等[43]发现在人乳腺癌细胞系(MCF7)中,BPA能够通过驱使LncRNA HOTAIR启动子活化,从而导致LncRNA的异常表达。Pang等[44]将大鼠(Rattus norvegicus)神经细胞系(PC12)暴露于40 μmol·L-1的BPA 48 h后发现,有151个LncRNAs和794个mRNAs出现了差异表达,其中LncRNA GAS5可能是通过影响一些差异表达基因来间接调节Jun、RAS和其他通路从而参与BPA诱导的神经毒性。LncRNA不仅参与BPA诱导的神经毒性,在BPA诱导的免疫毒性效应中也有一定的调控作用。Liu等[45]探究了BPA鱼类免疫毒性中的特异性LncRNAs,将鲤鱼(Cyprinus carpio)原代巨噬细胞暴露于1 mg·L-1的BPA 6 h后,有2 095和1 138个差异表达的mRNAs和LncRNAs,这些差异表达mRNAs主要都富集到了一些免疫相关的通路上(比如NFκB、Jak-STAT和Hippo通路);进一步筛选构建了LncRNA-mRNA调控网络,发现一个差异表达的LncRNA能调控多个差异表达基因,同时一个差异表达的mRNA也可能受到多个上游LncRNA的调节。表明,LncRNA可能在BPA引起的有害免疫反应中发挥着潜在作用。
3.4 全氟和多氟烷醚类化合物的胁迫下LncRNA的应答
全氟和多氟烷醚类化合物是分子中全部或部分C—H被C—F取代的一类人工合成有机物,被广泛应用于各种工业生产中。这类化合物在环境中极难被降解,具有生物蓄积性及多种潜在毒性[46]。Li等[47]发现暴露于全氟辛烷磺酸可导致小鼠胎盘组织中LncRNA H19启动子低甲基化;同时miR-19a和miR-19b表达量下降,Smad3表达量上升。验证发现,H19能通过竞争性海绵吸附miR-19a和miR-19b来调节Smad3的表达,从而在全氟辛烷磺酸诱导的细胞毒性中起重要作用。杨雪等[48]以乳腺癌细胞系(MCF-7)为离体模型,以斑马鱼胚胎为活体模型,探究全氟辛基碘烷的毒性效应以及对LncRNA malat-1的调节作用。结果表明,全氟辛基碘烷暴露导致MCF-7细胞的迁移能力提高,并且使斑马鱼胚胎发育迟缓、胚胎孵化率下降;同时malat-1被诱导高表达。表明malat-1参与了全氟辛基碘烷诱导癌细胞迁移和自发运动过度活跃等毒性效应的调节作用。
3.5 药品及个人护理品胁迫下LncRNA的应答
药物及个人护理品是一类与人类密切相关的新污染物,其主要包括人类用药、兽药、化学消费品及其生产和加工过程中使用的添加剂和惰性成分等,比如各种处方药和非处方药(抗生素、抗抑郁药等)、香料、化妆品、染发剂、洗发水和香皂等[49]。Wang等[50]将斑马鱼胚胎暴露于不同浓度(0、6.25和12.5 mg·L-1)的β-二酮类抗生素中30 d,鉴定和筛选出了10个特异性LncRNAs,进一步通过原位杂交实验发现其中3个LncRNAs在肝、脾组织中异常表达,推测这些LncRNAs可能是β-二酮类抗生素的靶分子。Cai等[51]用500 μg·g-1的米非司酮胁迫尼罗罗非鱼(Oreochromis niloticus),在鱼的性腺组织中共筛选出了962个差异表达的LncRNAs,其中3个LncRNAs在早期性分化过程中表现出二态性,表明LncRNA可能参与米非司酮的内分泌生殖干扰效应。张丹燕[52]将斑马鱼胚胎暴露于7种不同浓度的邻苯二甲酸二酯中发现,一些神经发育相关基因(mbp、neuroD、asclla、alpha、tubulin和neurog)表达量发生改变;随着处理浓度的升高,LncRNA cyrano的表达显著上调,miR-7的表达显著下调,预测cyrano可能通过调节miR-7从而参与斑马鱼胚胎的神经发育过程。Li等[53]用5 nmol·L-1和10 nmol·L-1乙酰氨基酚处理人体HepG2肝细胞16 h,发现了一个肝毒性特异性LncRNA-LINC00844,其与细胞色素酶CYP3A41及CYP2E1、磺基转移酶SULT2A1、孕烷X受体PXR和肝细胞核因子HNFα的mRNA表达水平呈正相关;进一步发现该LncRNA可以通过CeRNA机制,通过结合hsa-miR-486-5p,保护SULT2A1免受miRNA介导的基因沉默,从而在乙酰氨基酚诱导的肝毒性效应中发挥调控作用。
3.6 农药胁迫下LncRNA的应答
农药是一类有利于农业生产的化学制剂,如今已经有650余种商业化农药,按照其化学性质可以分为有机氯类农药、有机磷类农药、氨基甲酸酯类农药和拟除虫菊酯类农药等[54]。当生物摄入一些农药残留物的食物和水,可能会引发毒性效应。Sai等[55]发现暴露于100 μg·L-1阿特拉津180 d,引起爪蟾(Xenopus laevis)性腺86个LncRNAs发生变化。乔嘉凯等[56]将斑马鱼暴露于亚致死浓度的三唑磷96 h,发现LncRNA Sox2OT和LncRNA H19出现了差异表达;与此同时,可能与LncRNA H19相互作用的miRNA dre-let-7c表达下调了78%,而miRNA的靶基因核仁RNA结合蛋白基因ddx18的表达则上调了2.11倍;据此推测,在三唑磷的作用下,LncRNA H19可能作为靶基因ddx18的竞争性内源RNA而与dre-let-7c发生相互作用,从而调控靶基因ddx18的表达,进而参与三唑磷引发的毒性效应。Li等[57]对毒死蜱暴露的小鼠胚胎肾脏进行了转录组测序,发现了3个显著下调的LncRNAs(Gm28760、Gm28139和Gm26717),预测这些LncRNAs很有可能是通过调控胰蛋白酶基因Prss1、Prss2和Prss3来阻碍肾脏的发育。Wang等[58]探讨了百草枯影响小鼠神经退化过程中相关的LncRNAs,利用基因芯片技术筛选鉴定出了6个潜在的LncRNAs调节因子。其中,LncRNA NR_027648和LncRNA NR_030777可能分别通过影响锌指蛋白基因Zc3h14、细胞色素酶基因Cybb或锌指蛋白基因Zfp326和Ca2+依赖性磷脂结合蛋白基因Cpne5的表达,进而在百草枯诱导的神经毒性机制中发挥作用。Zhang等[59]采用腹腔注射5 mg·kg-1和10 mg·kg-1的百草枯方式构建了小鼠模型,发现百草枯很有可能是通过诱导LncRNA AK039862的低表达,从而阻断了小胶质细胞的增殖和迁移。作为一类广谱型拟除虫菊酯类杀虫剂,氯氰菊酯在农业生产中应用广泛。Liu等[60]将大鼠睾丸间质细胞暴露于50 μmol·L-1的氯氰菊酯8 h后发现,LncRNA XIST表达受到抑制,而miR-142-5p的表达量上升;进一步证实LncRNA XIST能与miR-142-5p竞争性结合酪氨酸激酶基因Jak1,从而影响JAK/STAT通路,抑制睾酮生成。
3.7 重金属胁迫下LncRNA的应答
3.7.1 汞、铅胁迫下LncRNA的应答
为探索斑马鱼胚胎中新的特异性汞神经毒性生物标志物,Cao等[61]筛选了几个研究较成熟的LncRNAs(birc6-as2、mettl3、malat1、stedlb1a和oip5-as)作为参照对象。其将斑马鱼胚胎暴露于氯化汞、甲基汞、氯化铅、氯化镉和铬酸溶液中,发现只有LncRNA malat1在氯化汞、甲基汞暴露中出现了差异表达;同时,汞暴露组斑马鱼胚胎显示出了明显的神经行为障碍,表明其可能是汞特异性诱导的LncRNA并参与了汞的神经毒性效应。
低剂量和长期暴露于铅会导致生殖系统的损伤。Ma等[62]分析了暴露于200 mg·L-1醋酸铅90 d的雄性小鼠性腺中转录组情况,发现有288个上调的LncRNAs和326个下调的LncRNAs;通过LncRNA-mRNA共表达网络分析发现,LncRNA Gm16677可能通过调节钙离子通道蛋白基因Cacna2d1,抑制小鼠性腺的发育。
3.7.2 镉胁迫下LncRNA的应答
长期暴露于镉也会导致生殖毒性。Gao等[63]发现氯化镉暴露会导致小鼠性腺精子生产和运动减少,并且伴随有139个LncRNAs表达量上调以及174个LncRNAs表达量下调;差异表达LncRNAs的靶基因,其功能与精子发生的过程密切相关,表明这些LncRNAs很有可能参与了镉的生殖毒性效应。Zhou等[64]利用小鼠(体内模型)和16HBE细胞(体外模型)证实了一个LncRNA-enst0000446135在氯化镉暴露过程中呈现浓度依赖效应,敲除该LncRNA会引起一些DNA修复基因(MSH2S、DDB1、DDB2、OGG1、ERCC1、MSH2、RAD50、XRCC1和BARD1)表达量升高和DNA损伤相关基因(ATM、ATR和ATRIP)的表达量下降;双荧光素酶实验证实MSH2是该LncRNA作用的直接转录靶点,由此表明该LncRNA参与了DNA的损伤与修复过程且可以作为镉毒性效应的一个新的标志物。Lin等[65]将人支气管上皮细胞(BEAS-2B)暴露于2.5 μmol·L-1的氯化镉9个月,发现LncRNA DUXAP10表达量上调,预测其可能是通过影响Hedgehog信号转导通路参与致癌过程。
3.7.3 砷胁迫下LncRNA的应答
砷是一种具有复杂毒性的重金属,长期摄入过量的砷会诱发癌症[66]。Luo等[67]发现在2 μmol·L-1亚砷酸盐诱导的人肝上皮细胞(L-02)致癌过程中,LncRNA MALAT1可以和缺氧诱导因子2(HIF-2)形成反馈环,加剧砷诱导的恶性转化过程。Li等[68]用不同浓度亚砷酸盐刺激人支气管上皮细胞(HBE),发现LncRNA linc-ROR表达呈现剂量性效应;同时细胞内活性氧和DNA损伤增加,表明其可能是一个亚砷酸盐诱导的特异性LncRNA。LncRNA不仅参与砷的毒性效应,也能够作为细胞抗氧化系统的一部分协调信号通路,以应对砷暴露的胁迫。Dong等[69]发现用10 μmol·L-1砷处理人肝癌细胞(HepG2),LncRNA UCA1可以促进甲基转移酶EZH2的泛素化从而上调活化T细胞核因子2(NFATC2),拮抗As诱导的细胞周期阻滞和细胞毒性。Jiang等[70]发现LncRNA DICER1-AS1可以抑制砷诱导的细胞增殖过程。以上研究结果说明LncRNA参与的毒性效应具有双重性,既可以参与到毒性效应中,也可以作为信号分子抑制毒性效应。
3.8 纳米材料胁迫下LncRNA的应答
纳米材料具有独特的物理化学性质和良好的生物相容性,因此被广泛应用在电子、农业、纺织、包装、食品和生物医学等各个领域,而这不可避免地将一些纳米材料带入环境中,并可能通过接触、吸入等方式使生物体暴露在这些污染物中,从而对机体的健康产生危害。有研究指出,纳米材料能够诱导细胞内活性氧的产生,造成DNA损伤、溶酶体损伤、线粒体功能障碍以及最终通过凋亡或坏死导致细胞死亡[71]。于峰等[72]以10 mg·L-1纳米氧化钕处理16HBE细胞48 h,发现925个LncRNAs表达发生改变,预测其中异常表达的LncRNA LOC105373796可能参与了细胞毒性效应。高晓洁[73]以大鼠为实验对象,探究了LncRNA在纳米镍诱导大鼠细胞凋亡中的作用机制,发现纳米镍诱导细胞发生凋亡的过程中LncRNA LOC102551356表达水平上调,其能通过靶向调控P53信号通路中的胰岛素样生长因子结合蛋白基因Igfbp-3,诱发线粒体凋亡通路,从而影响凋亡的发生。占海兵[74]探讨了LncRNA在纳米镍致肺纤维化中的作用及其分子机制,发现100 mg·L-1纳米镍处理的A549细胞中LncRNA MEG3表达量发生下调,该过程促进了TGF-β1蛋白的高表达,从而激活PI3K/AKT信号通路,导致了肺纤维化。施立芳[75]以秀丽线虫(Caenorhabditis elegans)为受试生物模型,筛选出了氧化石墨烯(100 μg·L-1)暴露后的4个显著差异表达的LncRNAs(linc-37、linc-5、linc-103和XLOC010849),利用RNAi技术干扰linc-37和linc-5的表达后,机体对氧化石墨烯毒性效应表现出抗性,表明linc-37和linc-5可能以负调控的方式调控氧化石墨烯的毒性效应。
3.9 PM2.5胁迫下LncRNA的应答
大气污染中直径≤2.5μm的细颗粒物(particulate matter 2.5, PM2.5)具有粒径小,表面积大,吸附能力强,易于吸附重金属、有机物等物质的特点,是困扰人们健康的主要问题之一。Huang等[76]探讨了LncRNA在PM2.5毒性效应的潜在作用,发现在PM2.5暴露条件下人支气管上皮细胞系中的LncRNA N405968和LncRNA MALAT1表达显著上调,且分别与炎症因子基因IL6、IL8表达水平以及上皮-间质转化过程成正相关,预测这2个LncRNAs可能通过调节炎症和上皮-间质转化过程参与PM2.5的毒理学过程。Guo等[77]发现一个新的LncRNA-LOC107985872,在PM2.5刺激的肺癌细胞系中表达量上调,预测该LncRNA可能通过激活上游蛋白如金属蛋白酶ADAM17、早老素蛋白PSEN1和跨膜蛋白DLL1,从而激活Notch信号通路诱导肺癌的发生。
4 总结与展望(Conclusion and prospective)
综上,大多数环境污染物的暴露都会引起生物体内LncRNA的表达发生变化,其中显著性差异表达的LncRNA可以作为环境毒性效应的潜在标志物。在暴露过程中,多数LncRNA主要作为基因表达调控因子发挥调控作用,其能通过CeRNA机制等作用影响mRNA的表达,从而发挥毒性效应。另外LncRNA不仅能够参与环境化学物质暴露引起的毒性效应,其本身也能够作为“抵抗分子”减轻相关的毒性效应,表明LncRNA有一定的抗逆性机制调控,在以后研究中需要更加深入探究LncRNA的抗逆性机制。LncRNA在毒理学领域中发挥的作用正在被揭示,然而目前人们对LncRNA的认知也还不完全清晰,还有许多问题亟需解答和完善。目前存在的问题主要有:(1)关于LncRNA在环境污染物中的研究大多只是初步筛选出差异表达LncRNAs,而针对这些筛选出的LncRNAs,则需要深入探究其作用机制;(2)虽然有一些LncRNAs能够作为潜在生物标志物,但是目前并没有建立将LncRNA识别为特异性和早期生物标志物的方法,需要建立一种快速、高效和灵敏度高的高通量方法,将LncRNA识别作为早期特异性生物标志物较好的方法,以准确预测毒性作用和人类疾病;(3)在LncRNA毒性效应机制探究中,大多数的研究可能只关注到其与下游分子信号通路或靶基因的关系,对于污染物致使LncRNA产生差异表达的原因探究还较少,需要进一步探究;(4)随着高通量测序技术的不断发展,越来越多物种的LncRNAs被陆续发现,但对数量如此庞大的LncRNAs进行准确分类以及具体功能的研究尚未得到完美解决。尽管目前已有一些人类、小鼠LncRNA的数据库,但较少涉及其他物种(比如秀线丽虫、鸟类和鱼类等),目前也没有毒理学方面的数据库,未来亟待建立全面地包含各个物种以及毒理学导向的LncRNA特征的功能数据库,从而为环境污染物的风险评估以及决策提供数据支持。
总而言之,目前关于LncRNA毒理学方面的研究仍在起步阶段,需要不断挖掘与毒理学相关的LncRNAs,深入阐述其具体的分子作用机制。
[1] Noh J H, Kim K M, McClusky W G, et al.Cytoplasmic functions of long noncoding RNAs[J].Wiley Interdisciplinary Reviews RNA, 2018, 9(3): e1471
[2] Vance K W, Ponting C P.Transcriptional regulatory functions of nuclear long noncoding RNAs[J].Trends in Genetics, 2014, 30(8): 348-355
[3] Dykes I M, Emanueli C.Transcriptional and post-transcriptional gene regulation by long non-coding RNA[J].Genomics, Proteomics &Bioinformatics, 2017, 15(3): 177-186
[4] Cayir A.Environmental exposures and RNA N6-methyladenosine modified long non-coding RNAs[J].Critical Reviews in Toxicology, 2020, 50(8): 641-649
[5] Kang X D, Zhao Y, Van Arsdell G, et al.Ppp1r1b-lncRNA inhibits PRC2 at myogenic regulatory genes to promote cardiac and skeletal muscle development in mouse and human[J].RNA, 2020, 26(4): 481-491
[6] Weng R, Lu C Q, Liu X Q, et al.Long noncoding RNA-1604 orchestrates neural differentiation through the miR-200c/ZEB axis[J].Stem Cells, 2018, 36(3): 325-336
[7] Yin D X, Li Y Z, Fu C G, et al.Pro-angiogenic role of LncRNA HULC in microvascular endothelial cells via sequestrating miR-124[J].Cellular Physiology and Biochemistry: International Journal of Experimental Cellular Physiology, Biochemistry, and Pharmacology, 2018, 50(6): 2188-2202
[8] Fan K, Shen Y B, Xu X Y, et al.LncRNA-WAS and lncRNA-C8807 interact with miR-142a-3p to regulate the inflammatory response in grass carp[J].Fish &Shellfish Immunology, 2021, 111: 201-207
[9] Ma Z Y, Guo C L.Advances on the effects of lncRNA on bone metabolism related signaling pathways in osteoporosis[J].Chinese Journal of Osteoporosis, 2018, 24(4): 547-551
[10] Wang S F, Rao C, Huang X Y, et al.Regulating age-related hearing loss with bisphenol A via the long non-coding RNA X inactive specific transcript and microRNA-34a-5p pathways[J].Nanoscience and Nanotechnology Letters, 2020, 12(8): 987-995
[11] Chen J, Ao L F, Yang J.Long non-coding RNAs in diseases related to inflammation and immunity[J].Annals of Translational Medicine, 2019, 7(18): 494
[12] Dempsey J L, Cui J Y.Long non-coding RNAs: A novel paradigm for toxicology[J].Toxicological Sciences, 2016, 155(1): 3-21
[13] Miguel V, Lamas S, Espinosa-Diez C.Role of non-coding-RNAs in response to environmental stressors and consequences on human health[J].Redox Biology, 2020, 37: 101580
[14] Yang J J, Liu L P, Tao H, et al.MeCP2silencing of LncRNA H19 controls hepatic stellate cell proliferation by targeting IGF1R[J].Toxicology, 2016, 359-360: 39-46
[15] Ma L N, Bajic V B, Zhang Z.On the classification of long non-coding RNAs[J].RNA Biology, 2013, 10(6): 925-933
[16] Wang K C, Chang H Y.Molecular mechanisms of long noncoding RNAs[J].Molecular Cell, 2011, 43(6): 904-914
[17] Zhang Q, Chao T C, Patil V S, et al.The long noncoding RNA ROCKIregulates inflammatory gene expression[J].The EMBO Journal, 2019, 38(8): e100041
[18] Li X D, Guo G J, Lu M, et al.Long noncoding RNA lnc-MxA inhibits beta interferon transcription by forming RNA-DNA triplexes at its promoter[J].Journal of Virology, 2019, 93(21): e00786-e00719
[19] Chen Z Y, Chen X, Xie R H, et al.DANCR promotes metastasis and proliferation in bladder cancer cells by enhancing IL-11-STAT3 signaling and CCND1 expression[J].Molecular Therapy: The Journal of the American Society of Gene Therapy, 2019, 27(2): 326-341
[20] Sun T T, He J, Liang Q, et al.LncRNA GClnc1 promotes gastric carcinogenesis and may act as a modular scaffold of WDR5 and KAT2A complexes to specify the histone modification pattern[J].Cancer Discovery, 2016, 6(7): 784-801
[21] Rinn J L, Chang H Y.Genome regulation by long noncoding RNAs[J].Annual Review of Biochemistry, 2012, 81: 145-166
[22] Batista P J, Chang H Y.Long noncoding RNAs: Cellular address codes in development and disease[J].Cell, 2013, 152(6): 1298-1307
[23] 乔嘉凯, 张丹燕, 周胜利, 等.斑马鱼长链非编码RNA的研究进展[J].生命科学, 2018, 30(8): 822-830
Qiao J K, Zhang D Y, Zhou S L, et al.Research progress in long non-coding RNAs of zebrafish[J].Chinese Bulletin of Life Sciences, 2018, 30(8): 822-830(in Chinese)
[24] Cloutier S C, Wang S W, Ma W K, et al.Regulated formation of lncRNA-DNA hybrids enables faster transcriptional induction and environmental adaptation[J].Molecular Cell, 2016, 62(1): 148
[25] Wang X W, Wang Y D, Li L, et al.A lncRNA coordinates with Ezh2 to inhibit HIF-1αtranscription and suppress cancer cell adaption to hypoxia[J].Oncogene, 2020, 39(9): 1860-1874
[26] He R Z, Luo D X, Mo Y Y.Emerging roles of lncRNAs in the post-transcriptional regulation in cancer[J].Genes &Diseases, 2019, 6(1): 6-15
[27] Gonzalez I, Munita R, Agirre E, et al.A lncRNA regulates alternative splicing via establishment of a splicing-specific chromatin signature[J].Nature Structural &Molecular Biology, 2015, 22(5): 370-376
[28] 陈宇宁, 熊兴东.长链非编码RNA与表观遗传调控[J].生物化学与生物物理进展, 2014, 41(8): 723-730
Chen Y N, Xiong X D.Long noncoding RNA and epigenetic regulation[J].Progress in Biochemistry and Biophysics, 2014, 41(8): 723-730(in Chinese)
[29] Chen H W, Yang S D, Shao R Y.Long non-coding XIST raises methylation of TIMP-3 promoter to regulate collagen degradation in osteoarthritic chondrocytes after tibial plateau fracture[J].Arthritis Research &Therapy, 2019, 21(1): 271
[30] Tsai M C, Manor O, Wan Y, et al.Long noncoding RNA as modular scaffold of histone modification complexes[J].Science, 2010, 329(5992): 689-693
[31] Salmena L, Poliseno L, Tay Y, et al.A ceRNA hypothesis: The Rosetta stone of a hidden RNA language?[J].Cell, 2011, 146(3): 353-358
[32] Zhou F, Chen W, Cui Y H, et al.miRNA-122-5p stimulates the proliferation and DNA synthesis and inhibits the early apoptosis of human spermatogonial stem cells by targeting CBL and competing with lncRNA CASC7[J].Aging, 2020, 12(24): 25528-25546
[33] Zhang P F, Lu B, Zhang Q, et al.LncRNA NEAT1 sponges MiRNA-148a-3p to suppress choroidal neovascularization and M2 macrophage polarization[J].Molecular Immunology, 2020, 127: 212-222
[34] Gao C, He Z N, Li J, et al.Specific long non-coding RNAs response to occupational PAHs exposure in coke oven workers[J].Toxicology Reports, 2016, 3: 160-166
[35] Yu J, Fang Q, Liu M, et al.Polycyclic aromatic hydrocarbons associated long non-coding RNAs and heart rate variability in coke oven workers[J].Environmental Science and Pollution Research International, 2021, 28(34): 47035-47045
[36] Gao L Y, Mai A, Li X, et al.LncRNA-DQ786227-mediated cell malignant transformation induced by benzo(a)pyrene[J].Toxicology Letters, 2013, 223(2): 205-210
[37] Chen N N, Shan Q L, Qi Y, et al.Transcriptome analysis in normal human liver cells exposed to 2,3,3’,4,4’,5-hexachlorobiphenyl(PCB 156)[J].Chemosphere, 2020, 239: 124747
[38] Zhang A, Li C Y, Kelly E J, et al.Transcriptomic profiling of PBDE-exposed HepaRG cells unveils critical lncRNA-PCG pairs involved in intermediary metabolism[J].PLoS One, 2020, 15(2): e0224644
[39] Garcia G R, Goodale B C, Wiley M W, et al.In vivocharacterization of an AHR-dependent long noncoding RNA required for proper Sox9bexpression[J].Molecular Pharmacology, 2017, 91(6): 609-619
[40] Tian W, Wang T S, Fang Y, et al.Aberrant lncRNA profiles are associated with chronic benzene poisoning and acute myelocytic leukemia[J].Journal of Occupational and Environmental Medicine, 2020, 62(7): e308-e317
[41] Bai W L, Yang J, Yang G X, et al.Long non-coding RNA NR_045623 and NR_028291 involved in benzene hematotoxicity in occupationally benzene-exposed workers[J].Experimental and Molecular Pathology, 2014, 96(3): 354-360
[42] Guo X L, Zhang W, Ren J, et al.LncRNA-OBFC2A targeted to Smad3 regulated Cyclin D1 influences cell cycle arrest induced by 1,4-benzoquinone[J].Toxicology Letters, 2020, 332: 74-81
[43] Bhan A, Hussain I, Ansari K I, et al.Bisphenol-A and diethylstilbestrol exposure induces the expression of breast cancer associated long noncoding RNA HOTAIR in vitroand in vivo[J].The Journal of Steroid Biochemistry and Molecular Biology, 2014, 141: 160-170
[44] Pang W, Lian F Z, Leng X, et al.Microarray expression profiling and co-expression network analysis of circulating LncRNAs and mRNAs associated with neurotoxicity induced by BPA[J].Environmental Science and Pollution Research International, 2018, 25(15): 15006-15018
[45] Liu S, Pan C Y, Tang Y, et al.Identification of novel long non-coding RNAs involved in bisphenol A induced immunotoxicity in fish primary macrophages[J].Fish &Shellfish Immunology, 2020, 100: 152-160
[46] 朱永乐, 汤家喜, 李梦雪, 等.全氟化合物污染现状及与有机污染物联合毒性研究进展[J].生态毒理学报, 2021, 16(2): 86-99
Zhu Y L, Tang J X, Li M X, et al.Contamination status of perfluorinated compounds and its combined effects with organic pollutants[J].Asian Journal of Ecotoxicology, 2021, 16(2): 86-99(in Chinese)
[47] Li J, Quan X J, Chen G, et al.PFOS-induced placental cell growth inhibition is partially mediated by lncRNA H19 through interacting with miR-19a and miR-19b[J].Chemosphere, 2020, 261: 127640
[48] 杨雪, 宋飞, 彭蕾, 等.全氟辛基碘烷的毒性效应及对长链非编码RNA MALAT-1的调节作用[J].生态毒理学报, 2020, 15(4): 149-157
Yang X, Song F, Peng L, et al.The toxic effects of 1-iodoperfluorooctane and its regulation of long-chain non-coding RNA MALAT-1[J].Asian Journal of Ecotoxicology, 2020, 15(4): 149-157(in Chinese)
[49] 褚莹倩, 陈溪, 张晓林, 等.中国地表水环境中药物与个人护理品生态风险评价的研究进展[J].生态毒理学报, 2021, 16(4): 80-92
Chu Y Q, Chen X, Zhang X L, et al.Ecological risk assessment of pharmaceutical and personal care products in the surface water of China: A review[J].Asian Journal of Ecotoxicology, 2021, 16(4): 80-92(in Chinese)
[50] Wang X D, Lin J B, Li F H, et al.Screening and functional identification of lncRNAs under β-diketone antibiotic exposure to zebrafish(Danio rerio)using high-throughput sequencing[J].Aquatic Toxicology, 2017, 182: 214-225
[51] Cai J, Li L, Song L Y, et al.Effects of long term antiprogestine mifepristone(RU486)exposure on sexually dimorphic lncRNA expression and gonadal masculinization in Nile tilapia(Oreochromis niloticus)[J].Aquatic Toxicology, 2019, 215: 105289
[52] 张丹燕.lncRNA cyrano在低浓度DEHP处理的斑马鱼胚胎中的调控作用研究[D].杭州: 浙江理工大学, 2019: 64-65
Zhang D Y.Regulatory role of lncRNAcyrano in zebrafish embryos exposed to low concentration DEHP[D].Hangzhou: Zhejiang Sci-Tech University, 2019: 64-65(in Chinese)
[53] Li D Y, Wu L H, Knox B, et al.Long noncoding RNA LINC00844-mediated molecular network regulates expression of drug metabolizing enzymes and nuclear receptors in human liver cells[J].Archives of Toxicology, 2020, 94(5): 1637-1653
[54] Rani L, Thapa K, Kanojia N, et al.An extensive review on the consequences of chemical pesticides on human health and environment[J].Journal of Cleaner Production, 2021, 283: 124657
[55] Sai L L, Qu B P, Zhang J, et al.Analysis of long non-coding RNA involved in atrazine-induced testicular degeneration of Xenopus laevis[J].Environmental Toxicology, 2019, 34(4): 505-512
[56] 乔嘉凯, 杜羽亭, 贾龙略, 等.三唑磷对斑马鱼H19和Sox2OT基因表达调控的影响[J].农药学学报, 2019, 21(3): 291-299
Qiao J K, Du Y T, Jia L L, et al.Effect of triazophos on the expression of H19 and Sox2OT genes in Danio rerio[J].Chinese Journal of Pesticide Science, 2019, 21(3): 291-299(in Chinese)
[57] Li B J, Xiang W Y, Qin J, et al.Co-expression network of long non-coding RNA and mRNA reveals molecular phenotype changes in kidney development of prenatal chlorpyrifos exposure in a mouse model[J].Annals of Translational Medicine, 2021, 9(8): 653
[58] Wang L J, Yang H Y, Wang Q Q, et al.Paraquat and MPTP induce alteration in the expression profile of long noncoding RNAs in the substantia nigra of mice: Role of the transcription factor Nrf2[J].Toxicology Letters, 2018, 291: 11-28
[59] Zhang Y Y, Shao W Y, Wu J W, et al.Inflammatory lncRNA AK039862 regulates paraquat-inhibited proliferation and migration of microglial and neuronal cells through the Pafah1b1/Foxa1 pathway in co-culture environments[J].Ecotoxicology and Environmental Safety, 2021, 208: 111424
[60] Liu C J, Qu J Y, Wu M Z, et al.Cypermethrin triggers YY1-mediated testosterone biosynthesis suppression[J].Ecotoxicology and Environmental Safety, 2021, 225: 112792
[61] Cao M X, Song F, Yang X, et al.Identification of potential long noncoding RNA biomarker of mercury compounds in zebrafish embryos[J].Chemical Research in Toxicology, 2019, 32(5): 878-886
[62] Ma H T, Yu J, Xie J, et al.Genome-wide identification and functional analysis of long non-coding RNAs and mRNAs in male mice testes at the onset of puberty after low dose lead exposure[J].Toxicology and Applied Pharmacology, 2021, 422: 115556
[63] Gao F X, Zhang P, Zhang H Y, et al.Dysregulation of long noncoding RNAs in mouse testes and spermatozoa after exposure to cadmium[J].Biochemical and Biophysical Research Communications, 2017, 484(1): 8-14
[64] Zhou Z H, Huang Z J, Chen B X, et al.LncRNA-ENST00000446135 is a novel biomarker of cadmium toxicity in 16HBE cells, rats, and Cd-exposed workers and regulates DNA damage and repair[J].Toxicology Research, 2020, 9(6): 823-834
[65] Lin H P, Wang Z S, Yang C F.LncRNA DUXAP10 upregulation and the hedgehog pathway activation are critically involved in chronic cadmium exposure-induced cancer stem cell-like property[J].Toxicological Sciences, 2021, 184(1): 33-45
[66] 张晓莉, 谷仕艳, 屈腾佼, 等.长链非编码RNA参与砷毒性的研究进展[J].中国工业医学杂志, 2020, 33(5): 421-424
Zhang X L, Gu S Y, Qu T J, et al.Research progress of long non-coding RNA involved in arsenic toxicity[J].Chinese Journal of Industrial Medicine, 2020, 33(5): 421-424(in Chinese)
[67] Luo F, Sun B F, Li H Q, et al.A MALAT1/HIF-2αfeedback loop contributes to arsenite carcinogenesis[J].Oncotarget, 2016, 7(5): 5769-5787
[68] Li X Y, Zuo C, Sun D L, et al.Arsenite increases linc-ROR in human bronchial epithelial cells that can be inhibited by antioxidant factors[J].Biological Trace Element Research, 2020, 198(1): 131-141
[69] Dong Z, Gao M, Li C Y, et al.LncRNA UCA1 antagonizes arsenic-induced cell cycle arrest through destabilizing EZH2 and facilitating NFATc2expression[J].Advanced Science, 2020, 7(11): 1903630
[70] Jiang C L, Sun M J, Li S T, et al.Long non-coding RNA DICER1-AS1-low expression in arsenic-treated A549 cells inhibits cell proliferation by regulating the cell cycle pathway[J].Environmental Toxicology and Pharmacology, 2021, 84: 103617
[71] 冯辰昀, 李旭东, 郑妤婕, 等.纳米材料的毒理学研究进展[J].中国科学: 化学, 2022, 52(1): 15-22
Feng C Y, Li X D, Zheng Y J, et al.Recent progress in nanotoxicology of nanomaterials[J].Scientia Sinica Chimica, 2022, 52(1): 15-22(in Chinese)
[72] 于峰, 薛海南, 刘凌, 等.纳米氧化钕致16HBE细胞炎症反应中lncRNA差异性表达[J].环境与健康杂志, 2019, 36(3): 198-201
Yu F, Xue H N, Liu L, et al.Differential expression of lncRNA in inflammatory response of 16HBE cells induced by nano-neodymium oxide[J].Journal of Environment and Health, 2019, 36(3): 198-201(in Chinese)
[73] 高晓洁.LncRNA在纳米镍诱导大鼠生精-支持细胞凋亡中的调控机制研究[D].南京: 东南大学, 2018: 57-58
Gao X J.Study on the regulation mechanism of LncRNA in nickle-nanoparticles-induced apoptosis of rat sertoli-germ cell co-culture[D].Nanjing: Southeast University, 2018: 57-58(in Chinese)
[74] 占海兵.LncRNA MEG3介导的PI3K/AKT通路和EMT在纳米氧化镍致大鼠肺纤维化中的作用[D].兰州: 兰州大学, 2021: 44-45
Zhan H B.Roles of LncRNA MEG3-mediated PI3K/AKT pathway and EMT in NiO NPs-induced pulmonary fibrosis in rats[D].Lanzhou: Lanzhou University, 2021: 44-45(in Chinese)
[75] 施立芳.linc-37和linc-5调控氧化石墨烯致秀丽线虫毒效应的分子机制研究[D].南京: 东南大学, 2019: 46-47
Shi L F.Molecular mechanism of linc-37 and linc-5 in regulating the graphene oxide toxicity in Caenorhabditis elegans[D].Nanjing: Southeast University, 2019: 46-47(in Chinese)
[76] Huang Q S, Chi Y L, Deng J J, et al.Fine particulate matter 2.5 exerted its toxicological effect by regulating a new layer, long non-coding RNA[J].Scientific Reports, 2017, 7(1): 9392
[77] Guo H Q, Feng Y, Yu H Y, et al.A novel lncRNA, loc107985872, promotes lung adenocarcinoma progression via the Notch1 signaling pathway with exposure to traffic-originated PM2.5organic extract[J].Environmental Pollution, 2020, 266(Pt 1): 115307