随着集约化养殖业的兴起与不断发展,抗生素被广泛用于预防、治疗动物疾病和促进动物生长[1]。我国2019年抗生素使用量为16.1万t,据估计养殖业的抗生素用量高达7.4万t,约占总使用量的46.0%[2-3]。抗生素进入动物体内后不能被完全吸收代谢,大量未被代谢的抗生素随动物粪便排出体外,促进了抗生素在环境中的迁移扩散[4]。Wang等[5]对我国不同地区猪粪中抗生素污染做了大量研究,结果发现猪粪中四环素含量最高可达172.90 mg·kg-1。抗生素的使用会对畜禽肠道微生物群落产生选择压力,提高粪便中细菌耐药性与抗性基因(antibiotic resistance genes, ARGs)蓄积。与其他环境介质相比,畜禽粪便是ARGs的主要来源和储存库。Li等[6]考察了10种典型环境介质中的ARGs分布特征,结果显示畜禽粪便中ARGs含量高于其他环境介质(如土壤、河水、饮用水和沉积物等)1~3个数量级。据统计,我国每年畜禽粪便排放量可达20亿t,其中畜禽粪便中抗生素残留以及ARGs的产生、迁移和转化会对生态环境和人体健康构成潜在威胁[7]。因此,寻求科学有效的畜禽粪便无害化处理和资源化利用技术对我国畜禽养殖业可持续发展具有重要意义。好氧堆肥作为目前国内外畜禽粪便资源化处理运用最广泛的处理方式之一,可以有效降低畜禽粪便中抗生素的浓度和ARGs的丰度,抗生素和ARGs的去除率分别能达到47.3%~98.8%和25.4%~76.0%[8-10]。但该技术仍存在抗生素与ARGs去除不完全,去除效果不稳定等缺点[11]。例如,常规堆肥中最高温度在70 ℃以下,部分ARGs和病原菌、极端嗜热菌等,在此温度下不能被有效去除,且会随着堆肥后期温度的下降而不断增加[12]。因此提高好氧堆肥产品的安全性,寻求有效的堆肥产品再加工技术,是当前一项重要的研究任务。
热解技术是粪便无害化的一种常用技术,是将生物质在缺氧的条件下进行热处理[13],可生成可燃气、焦油和生物炭等[14]。热解过程可以改变原料的某些特性,降低抗生素以及ARGs的环境风险[15-16]。已有研究表明,高于600 ℃的热解能够有效去除泰乐菌素、四环素、磺胺嘧啶、磺胺甲噁唑、金霉素、强力霉素和磺胺二嗪等多种典型抗生素[15, 17]。迄今为止,热解去除有机肥中抗生素的温度主要在300~700 ℃之间,达到炭化温度以上。有机肥炭化后不能保持原来的肥力甚至失去肥力,严重影响有机肥的品质。污泥中3种典型抗生素环丙沙星、土霉素和磺胺二甲嘧啶的初始分解温度均在300 ℃以下[18],故低温热解(300 ℃以下)不仅能在一定程度上去除抗生素、杀死病原微生物、破坏ARGs结构,且其对有机肥肥力破坏也相对较小。目前,关于低温热解对有机肥中抗生素及ARGs的去除研究鲜见报道。此外,硅藻土和沸石常被作为改良剂用于提高堆肥品质,其表面丰富的微孔结构可以为抗生素吸附、微生物附着提供位点,促进微生物和抗生素的接触进而加速抗生素降解[19-20]。硅藻土和沸石还可以通过抑制可移动元件和降低ARGs潜在宿主丰度等途径有效抑制堆肥中ARGs传播[21-22]。热解能进一步改善硅藻土和沸石的结构性能,提高对污染物的去除能力[23-24],但在低温热解条件下这2种改良剂对有机肥中抗生素和ARGs的去除效果尚不明确。因此,本研究采用80~250 ℃的热解温度,并添加硅藻土和沸石对堆肥产品进行改良,探究低温热解对有机肥中抗生素和ARGs的影响,并结合有机肥热解能耗进行综合分析,以期为提高堆肥产品的环境安全性和实用性提供科学依据。
1 材料与方法(Materials and methods)
1.1 供试材料和试剂
选取的有机肥采自广东省清远市某堆肥公司。该公司主要对畜禽养殖废物进行资源化综合利用。有机肥主要以农作物秸秆、畜禽粪便、污泥、沼液渣、食品业加工后的废料以及餐厨垃圾等为原料,其处理工艺流程主要包括有机废弃物的前处理(调节水分及碳氮比)、添加复合酶进行一次发酵、接种复合微生物进行二次发酵、后处理以及回流堆肥等。采集处理后的有机肥后进行冷冻干燥,研磨并过100目筛网备用,放于-20 ℃冷冻保存。沸石粉末(粒径为22.5 μm)和硅藻土粉末(粒径≤10 μm)均购自上海阿拉丁试剂有限公司。
45种抗生素混标溶液,包括:磺胺类17种、氟喹诺酮类12种、大环内酯类6种、四环素类5种和其他类5种,具体信息如表1所示[25]。其中,泰乐菌素、红霉素和罗红霉素均购自Sigma-Aldrich(美国),脱水红霉素为本实验室自制,其他抗生素标准品均购自Dr.Ehrenstorfer GmbH(德国)。8种抗生素内标:甲氯环素购自Sigma-Aldrich(美国);磺胺二甲嘧啶-13C6购自Cambridge Isotope Laboratories(美国);甲氧苄啶-D3、林可霉素-D3、红霉素-13C-D3、磺胺甲噁唑-D4、噻苯咪唑-D4和环丙沙星-D8均购自Toronto Research Chemicals(加拿大)。
表1 目标抗生素的基本信息[26]
Table 1 Information of target antibiotics[26]
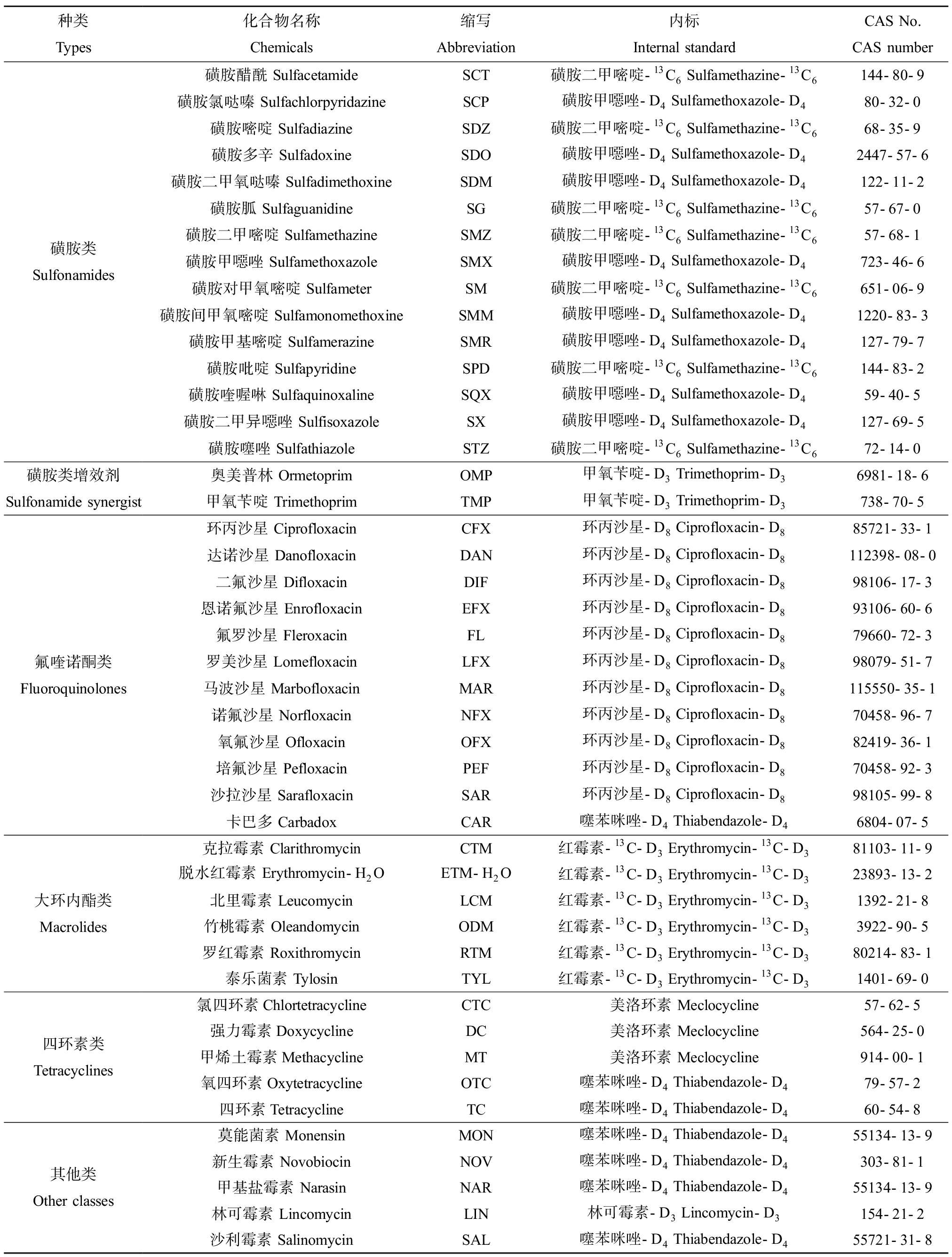
种类Types化合物名称Chemicals缩写Abbreviation内标Internal standardCAS No.CAS number磺胺类Sulfonamides磺胺醋酰 SulfacetamideSCT磺胺二甲嘧啶-13C6 Sulfamethazine-13C6144-80-9磺胺氯哒嗪 SulfachlorpyridazineSCP磺胺甲噁唑-D4 Sulfamethoxazole-D480-32-0磺胺嘧啶 SulfadiazineSDZ磺胺二甲嘧啶-13C6 Sulfamethazine-13C668-35-9磺胺多辛 SulfadoxineSDO磺胺甲噁唑-D4 Sulfamethoxazole-D42447-57-6磺胺二甲氧哒嗪 SulfadimethoxineSDM磺胺甲噁唑-D4 Sulfamethoxazole-D4122-11-2磺胺胍 SulfaguanidineSG磺胺二甲嘧啶-13C6 Sulfamethazine-13C657-67-0磺胺二甲嘧啶 SulfamethazineSMZ磺胺二甲嘧啶-13C6 Sulfamethazine-13C657-68-1磺胺甲噁唑 SulfamethoxazoleSMX磺胺甲噁唑-D4 Sulfamethoxazole-D4723-46-6磺胺对甲氧嘧啶 SulfameterSM磺胺二甲嘧啶-13C6 Sulfamethazine-13C6651-06-9磺胺间甲氧嘧啶 SulfamonomethoxineSMM磺胺甲噁唑-D4 Sulfamethoxazole-D41220-83-3磺胺甲基嘧啶 SulfamerazineSMR磺胺甲噁唑-D4 Sulfamethoxazole-D4127-79-7磺胺吡啶 SulfapyridineSPD磺胺二甲嘧啶-13C6 Sulfamethazine-13C6144-83-2磺胺喹喔啉 SulfaquinoxalineSQX磺胺甲噁唑-D4 Sulfamethoxazole-D459-40-5磺胺二甲异噁唑 SulfisoxazoleSX磺胺甲噁唑-D4 Sulfamethoxazole-D4127-69-5磺胺噻唑 SulfathiazoleSTZ磺胺二甲嘧啶-13C6 Sulfamethazine-13C672-14-0磺胺类增效剂Sulfonamide synergist奥美普林 OrmetoprimOMP甲氧苄啶-D3 Trimethoprim-D36981-18-6甲氧苄啶 TrimethoprimTMP甲氧苄啶-D3 Trimethoprim-D3738-70-5氟喹诺酮类Fluoroquinolones环丙沙星 CiprofloxacinCFX环丙沙星-D8 Ciprofloxacin-D885721-33-1达诺沙星 DanofloxacinDAN环丙沙星-D8 Ciprofloxacin-D8112398-08-0二氟沙星 DifloxacinDIF环丙沙星-D8 Ciprofloxacin-D898106-17-3恩诺氟沙星 EnrofloxacinEFX环丙沙星-D8 Ciprofloxacin-D893106-60-6氟罗沙星 FleroxacinFL环丙沙星-D8 Ciprofloxacin-D879660-72-3罗美沙星 LomefloxacinLFX环丙沙星-D8 Ciprofloxacin-D898079-51-7马波沙星 MarbofloxacinMAR环丙沙星-D8 Ciprofloxacin-D8115550-35-1诺氟沙星 NorfloxacinNFX环丙沙星-D8 Ciprofloxacin-D870458-96-7氧氟沙星 OfloxacinOFX环丙沙星-D8 Ciprofloxacin-D882419-36-1培氟沙星 PefloxacinPEF环丙沙星-D8 Ciprofloxacin-D870458-92-3沙拉沙星 SarafloxacinSAR环丙沙星-D8 Ciprofloxacin-D898105-99-8卡巴多 CarbadoxCAR噻苯咪唑-D4 Thiabendazole-D46804-07-5大环内酯类Macrolides克拉霉素 ClarithromycinCTM红霉素-13C-D3 Erythromycin-13C-D381103-11-9脱水红霉素 Erythromycin-H2OETM-H2O红霉素-13C-D3 Erythromycin-13C-D323893-13-2北里霉素 LeucomycinLCM红霉素-13C-D3 Erythromycin-13C-D31392-21-8竹桃霉素 OleandomycinODM红霉素-13C-D3 Erythromycin-13C-D33922-90-5罗红霉素 RoxithromycinRTM红霉素-13C-D3 Erythromycin-13C-D380214-83-1泰乐菌素 TylosinTYL红霉素-13C-D3 Erythromycin-13C-D31401-69-0四环素类Tetracyclines氯四环素ChlortetracyclineCTC美洛环素 Meclocycline57-62-5强力霉素DoxycyclineDC美洛环素 Meclocycline564-25-0甲烯土霉素MethacyclineMT美洛环素 Meclocycline914-00-1氧四环素OxytetracyclineOTC噻苯咪唑-D4 Thiabendazole-D479-57-2四环素TetracyclineTC噻苯咪唑-D4 Thiabendazole-D460-54-8其他类Other classes莫能菌素 MonensinMON噻苯咪唑-D4 Thiabendazole-D455134-13-9新生霉素 NovobiocinNOV噻苯咪唑-D4 Thiabendazole-D4303-81-1甲基盐霉素 NarasinNAR噻苯咪唑-D4 Thiabendazole-D455134-13-9林可霉素 LincomycinLIN林可霉素-D3 Lincomycin-D3154-21-2沙利霉素 SalinomycinSAL噻苯咪唑-D4 Thiabendazole-D455721-31-8
DNA提取试剂盒(DNeasy PowerSoil Pro Kit,美国)购自誉维生物科技有限公司,SYBR Green(TaKaRa,日本)染料购自上海百赛生物技术有限公司,基因引物购自华大基因。
色谱纯乙腈和甲醇均购自德国Merck公司,分析纯乙腈和甲醇购自天津富宇精细化工有限公司,分析纯甲酸购于美国Tedia公司,分析纯乙酸铵购于美国Sigma-Aldrich公司。分析纯的乙二胺四乙酸四钠(EDTA-4Na)、柠檬酸和柠檬酸钠均购自上海阿拉丁试剂有限公司。超纯水自制,氮气(纯度≥99%)购自广州科气达公司。
1.2 低温热解实验
向30 g有机肥中分别添加质量比1%的沸石或硅藻土,混合均匀,同时设置无任何添加剂的有机肥对照组。参考葛丽炜等[27]的方法,将不同处理组的有机肥样品在坩埚中压实,包裹锡箔纸以隔绝氧气,放入马弗炉中加热。低温热解实验设计是基于单一控制变量的原则,兼顾去除有机肥中污染物和保持肥力的要求,结合堆肥过程的最高温度与热解过程的最低温度,低温热解温度设为80 ℃、150 ℃和250 ℃,设定温度下持续加热0.5 h,待马弗炉冷却后取出样品。将热解后样品混合均匀,其中一部分放入-20 ℃冰箱待抗生素分析,剩余部分放入-40 ℃冰箱待ARGs分析。各处理组均设置4个平行(表2)。
表2 低温热解实验设置
Table 2 Experiment design of low-temperature pyrolysis
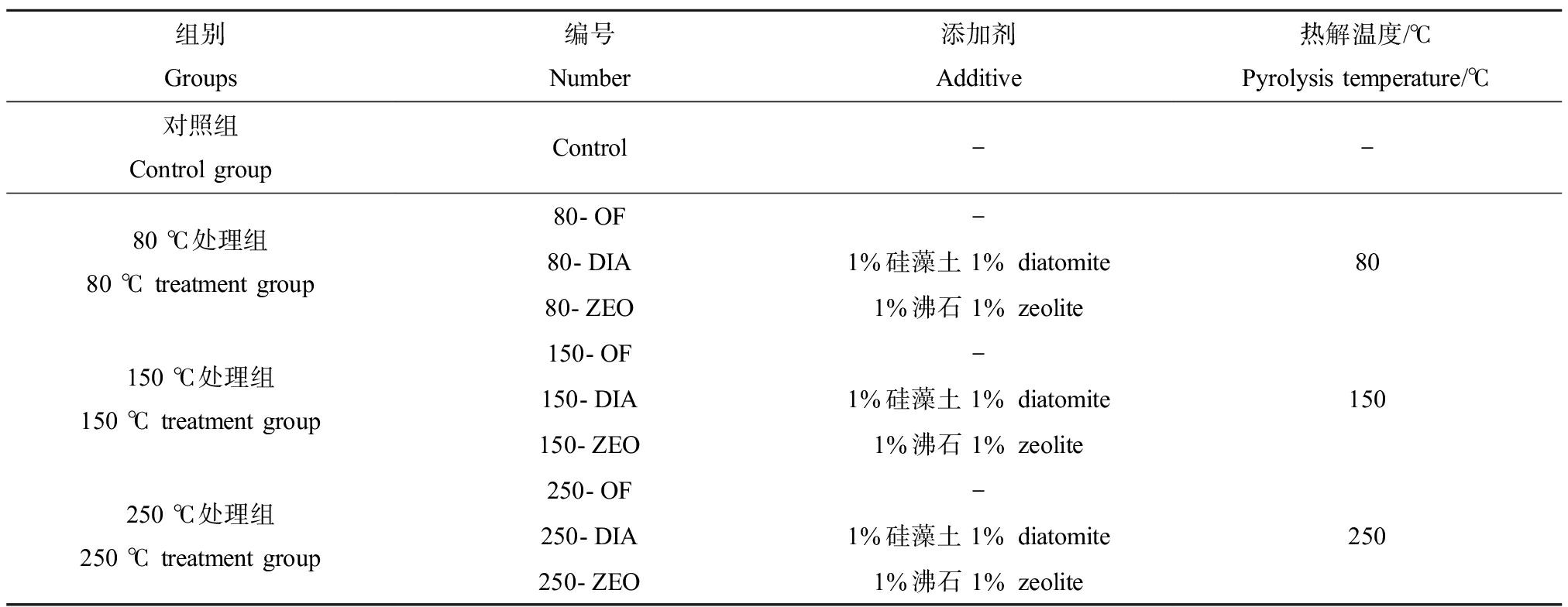
组别Groups编号Number添加剂Additive热解温度/℃Pyrolysis temperature/℃对照组Control groupControl--80 ℃处理组80 ℃ treatment group80-OF-80-DIA1%硅藻土 1% diatomite80-ZEO1%沸石 1% zeolite80 150 ℃处理组150 ℃ treatment group150-OF-150-DIA1%硅藻土 1% diatomite150-ZEO1%沸石 1% zeolite150250 ℃处理组250 ℃ treatment group250-OF-250-DIA1%硅藻土 1% diatomite250-ZEO1%沸石 1% zeolite250
1.3 样品前处理
1.3.1 抗生素提取
参考Zhou等[25]的抗生素提取方法,称取0.5 g有机肥于30 mL洁净玻璃离心管中,加入1 mg·L-1内标100 μL,置于4 ℃冰箱黑暗条件下过夜。分别向离心管中加入10 mL乙腈和10 mL柠檬酸盐缓冲液(34.74 g柠檬酸和10.2 g的柠檬酸钠溶于0.5 L的超纯水中),涡旋混匀,超声处理15 min,然后在3000r·min-1转速下离心10 min,将上清液转移至洁净的200 mL圆底烧瓶,重复此步骤2次。将收集有上清液的圆底烧瓶置于旋转蒸发仪,在55 ℃下旋转蒸发至烧瓶中有机溶剂挥发完全;然后向圆底烧瓶中加入超纯水至溶液体积约200 mL,加入0.2 g EDTA-4Na用以螯合金属离子,均匀摇动瓶身使EDTA-4Na完全溶解。然后采用SAX-HLB串联柱(HLB柱,500 mg,6 mL,上海安谱实验科技股份有限公司;SAX柱,500 mg,6 mL,美国Varian公司)进行富集和净化,以5 mL·min-1的速度加载于已活化的串联柱上,加载完成后移去SAX柱,再用10 mL的超纯水洗去吸附在HLB柱上的杂质和EDTA-4Na。将HLB小柱抽干,约1 h为宜。用10 mL甲醇洗脱目标抗生素,氮吹干后,用1 mL的色谱级甲醇溶解后过0.22 μm有机相滤膜,存于棕色小瓶并保存在-20 ℃冰箱。抗生素提取同时设置空白与质控样品,提取过程同上。上机前,取100 μL样品,吹干后用混合溶液(V(含0.2%甲酸的甲醇)∶V(2 mmol·L-1乙酸铵)=30∶70)重新定容。
1.3.2 DNA提取
称取0.15 g有机肥样品,按照DNA提取试剂盒的说明操作,提取并纯化有机肥总DNA。样品总DNA用超微量紫外分光光度计(NanoDrop Onec,Termo Scientific,美国)检测,DNA的浓度和纯度满足要求后,储存于-40 ℃冰箱用于后续基因定量。
1.4 仪器分析
1.4.1 高分辨液相色谱-串联质谱分析抗生素
利用Agilent 1200 series高分辨液相色谱-串联质谱仪(HPLC-MS/MS)对有机肥中抗生素进行分析[24]。色谱条件:色谱柱为Agilent Eclipse Plus-C18(100 mm×2.1 mm, 1.8 μm),在色谱柱的上游端安置在线过滤器,目的是去除样品及流动相中的细小颗粒;柱温设置为40 ℃,进样量设置为5 μL;流动相为缓冲盐溶液(含0.2%甲酸和2 mmol·L-1乙酸铵)(A相)和乙腈(B相),流动相的流速设为0.3 mL·min-1;梯度洗脱参数设置:0 min 90% A,5 min 85% A,7 min 80% A,11 min 60% A,15 min 40% A,16 min 5% A,25 min 5% A。质谱条件:质谱参数由软件Optimizer(安捷伦公司)进行优化。所有抗生素均用正离子模式(ESI+)采集数据,多重反应模式(MRM)检测。
1.4.2 质量保证和质量控制
实验中所使用的玻璃器皿均洗净。清洗流程如下:使用碱液浸泡24 h后,用自来水清洗干净,然后用去离子水润洗3次,放置于70 ℃烘箱烘干,最后在马弗炉中以450 ℃煅烧4 h。为防止抗生素光解,实验过程均在相对黑暗环境下进行,避免强光照。
样品处理的同时还需设置空白和质量控制样品。实验空白样品只添加内标,与有机肥样品按照相同的步骤提取分析,用来矫正试剂及人为因素造成的误差。质量控制样品中添加干净基质(本实验基质为采取的山地土)和标准品(2 mg·L-1的混标),与有机肥样品按照相同的步骤提取分析,用来分析目标化合物提取过程的重现性和稳定性。本实验目标化合物质控回收率范围均在60%~120%;精密度(RSD)的范围为0.15%~12.14%,<20%;线性拟合的R2的范围为0.990~0.999,均在0.990以上,说明样品处理与上机符合数据分析要求。
1.4.3 荧光定量PCR分析
对DNA样品中的基因进行绝对定量。采用笔者课题组建立的ARGs荧光定量方法[28]。使用SYBR Green染料,在实时荧光定量PCR仪(ABI QuantStudioTM7 Flex System)上定量分析目标基因。本文选择的目标基因包括细菌总量的16S rRNA基因;移动元件(intI1、intI2、Tn916);19种常见的抗生素ARGs,分别为磺胺类ARGs(sul1、sul2)、喹诺酮类ARGs(qnrD、qnrS)、大环内酯类ARGs(ermA、ereA)、四环素类ARGs(tetC、tetD、tetG、tetH、tetO、tetW、tetB/P)、氯霉素类ARGs(cmlA、cfr、floR、fexA)、氨基糖苷类ARGs(aadA)、β-内酰胺酶类ARGs(blaTEM)、大肠杆菌指示基因(uida)。本实验定量PCR的反应体系为20 μL,其组成成分如下[9]:10 μL SYBR®Premix Ex TaqTMⅡ(Tli RNaseH Plus)(2×)、0.4 μL ROX Reference Dye Ⅱ(50×)、0.4 μL上游引物(10 μmol·L-1)、0.4 μL下游引物(10 μmol·L-1)、2 μL DNA和6.8 μL无菌超纯水。每个基因都同时设置了阳性对照(含有相应目的基因的DNA溶液)和阴性对照(无菌超纯水)。等待仪器程序运行完成后,检查扩增曲线的反应效率,熔解曲线理论上应与标准曲线一致。然后根据荧光强度反映出的CT值,利用标准曲线计算出样品里面目标基因的含量(copies·μL-1DNA),将基因丰度单位换算成copies·g-1。本文用于荧光定量PCR的引物、扩增片段大小和退火温度等信息参考前人的方法[29-32]。
1.5 数据分析
用Microsoft Excel 2016对数据进行方差以及去除率等常规计算;采用Origin 2018进行数据统计与可视化;采用SPSS Statistics 19.0单因素方差分析(one way ANOVA)进行LSD检验,以P<0.05作为有显著性差异,比较不同处理组之间的显著差异。
2 结果与讨论(Results and discussion)
2.1 抗生素含量变化
在45种目标抗生素中,有机肥样品中共检测到8种抗生素,主要包括磺胺类抗生素1种:磺胺间甲氧嘧啶(sulfamonomethoxine, SMM);大环内酯类的抗生素1种:脱水红霉素(erythromycin-H2O, ETM-H2O);喹诺酮类抗生素4种,包括恩诺氟沙星(enrofloxacin, EFX)、氧氟沙星(ofloxacin, OFX)、环丙沙星(ciprofloxacin, CFX)和培氟沙星(pefloxacin, PEF);林可霉素类抗生素1种:林可霉素(lincomycin, LIN);其他类抗生素1种:莫能菌素(monensin, MON)(图1)。有机肥中抗生素组成以脱水红霉素、磺胺间甲氧嘧啶和恩诺氟沙星为主,分别占抗生素总含量的32.75%、9.05%和38.24%,总占比达80.04%;经过有机肥进行的热解处理,抗生素残留量显著降低,去除率在11.63%~47.32%之间。
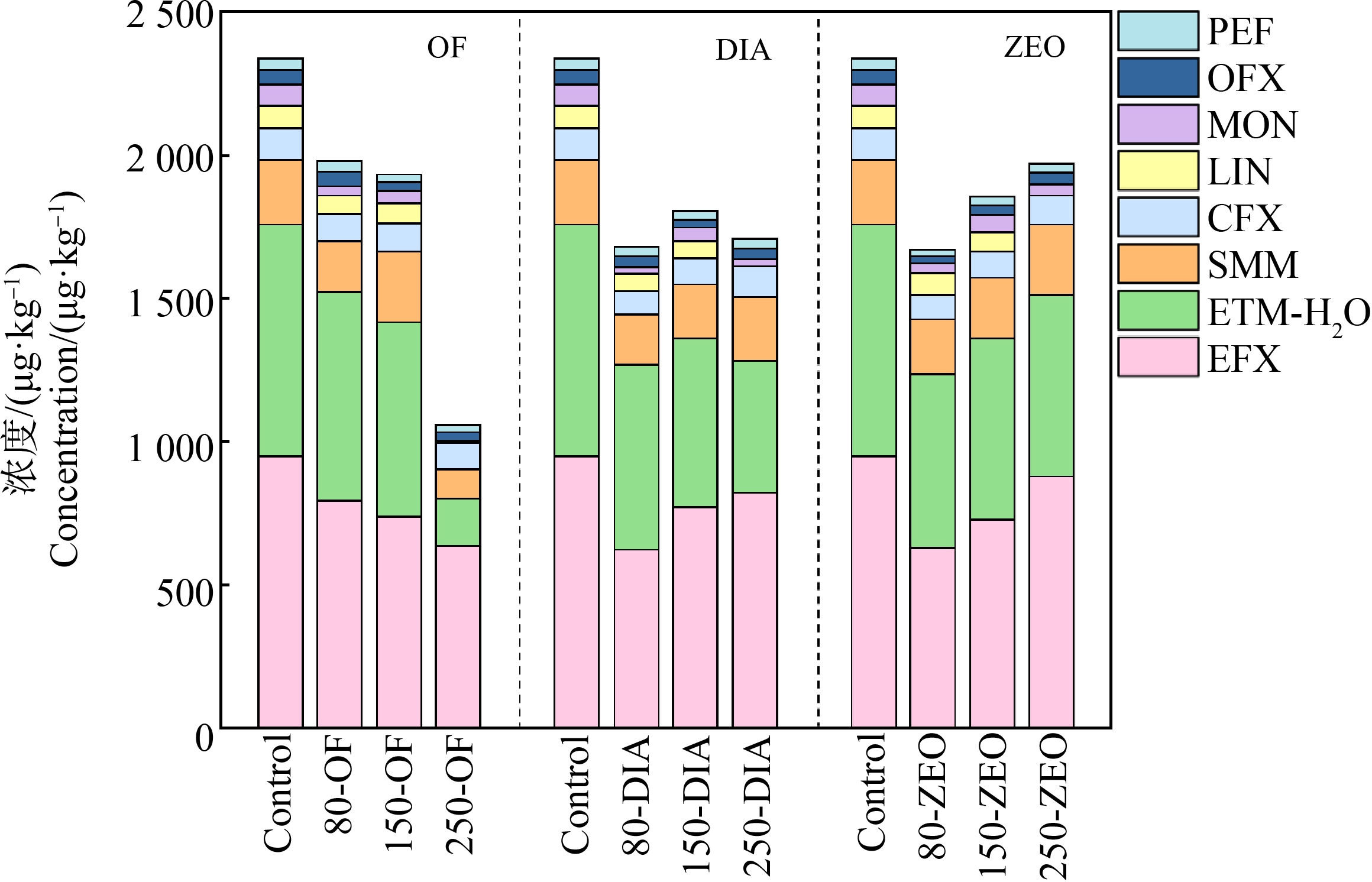
图1 低温热解后抗生素浓度
Fig. 1 Antibiotics content in organic fertilizer under low-temperature pyrolysis treatment
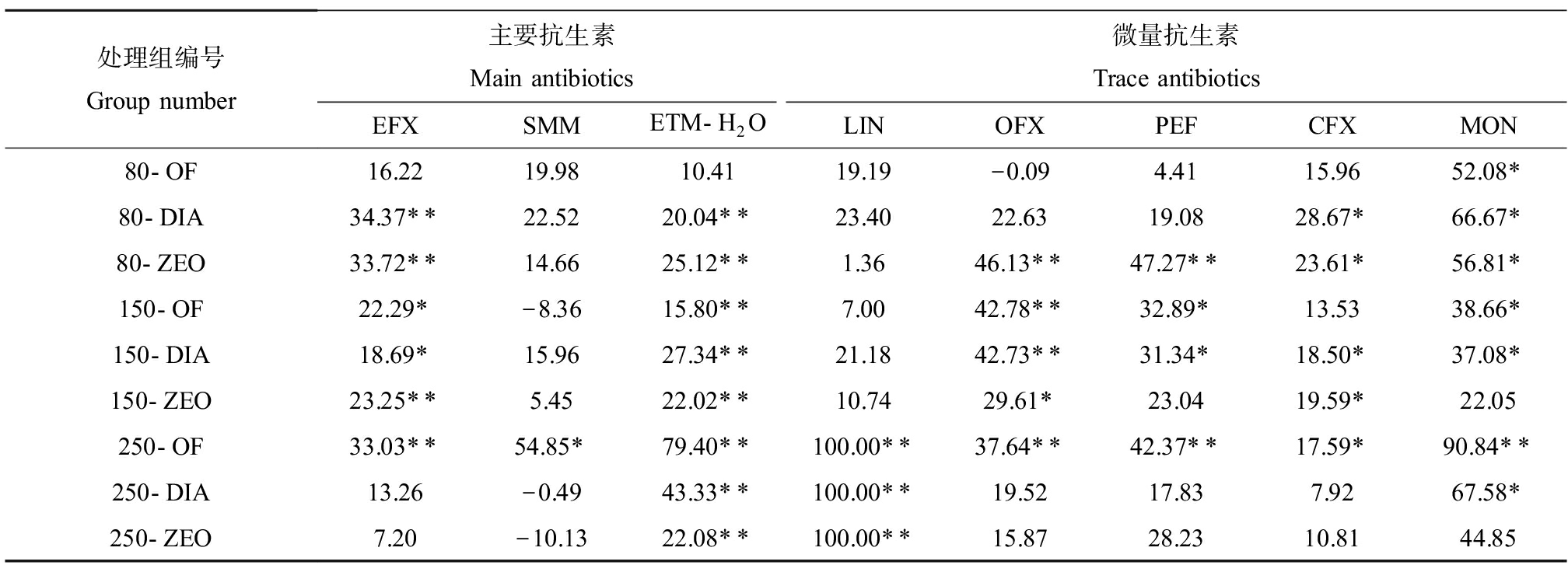
对有机肥中主要抗生素脱水红霉素、磺胺间甲氧嘧啶和恩诺氟沙星的去除率进行分析发现(表3),不同处理组中脱水红霉素,除80-OF组外,所有处理组均对脱水红霉素有显著的去除效果(P<0.01),去除率在15.80%~79.40%之间;对于不同处理组中恩诺氟沙星,大部分处理组对恩诺氟沙星去除效果显著,其中80-DIA、80-ZEO、150-ZEO和250-OF处理组对恩诺氟沙星有显著的去除效果(P<0.01),去除率在7.20%~34.37%之间。对于不同处理组中磺胺间甲氧嘧啶,仅有250-OF处理组对磺胺间甲氧嘧啶有显著的去除效果(P<0.05),去除率54.85%,其他热解处理均对磺胺间甲氧嘧啶含量没有显著影响。另外对有机肥中微量抗生素的去除率进行分析(表3),发现不同的热解温度,80 ℃热解条件下莫能菌素的去除率最好,平均去除率为58.52%,其次较好的是环丙沙星,平均去除率为22.75%;150 ℃热解条件下氧氟沙星的去除率最好,平均去除率为38.37%,其次较好的是莫能菌素,平均去除率为32.60%;250 ℃热解条件下林可霉素的去除率最好,平均去除率为100%,其次是较好的是莫能菌素,平均去除率为67.76%。对不同的添加剂,无添加剂组、添加沸石组以及添加硅藻土组均是莫能菌素的去除率最好,对应平均去除率分别是60.53%、41.24%和57.11%;其次均是林可霉素,对应平均去除率分别是42.39%、37.37%和48.19%。
表3 抗生素去除率
Table 3 Removal rates of antibiotics (%)
处理组编号Group number主要抗生素Main antibiotics微量抗生素Trace antibioticsEFXSMMETM-H2OLINOFXPEFCFXMON80-OF16.2219.9810.4119.19-0.094.4115.9652.08*80-DIA34.37**22.5220.04**23.4022.6319.0828.67*66.67*80-ZEO33.72**14.6625.12**1.3646.13**47.27**23.61*56.81*150-OF22.29*-8.3615.80**7.0042.78**32.89*13.5338.66*150-DIA18.69*15.9627.34**21.1842.73**31.34*18.50*37.08*150-ZEO23.25**5.4522.02**10.7429.61*23.0419.59*22.05250-OF33.03**54.85*79.40**100.00**37.64**42.37**17.59*90.84**250-DIA13.26-0.4943.33**100.00**19.5217.837.9267.58*250-ZEO7.20-10.1322.08**100.00**15.8728.2310.8144.85
注:负数表示与对照组有机肥相比,抗生素含量增加;*表示与对照组有机肥相比,抗生素含量在P<0.05水平上有显著差异;**表示与对照组有机肥相比,抗生素含量在P<0.01水平上有显著差异。
Note: Negative data indicate an increase in antibiotic content compared to organic fertilizer in the control group; *indicates that there was a significant difference in antibiotic content at the P<0.05 level compared with the organic fertilizer in the control group; **indicates that there was a significant difference in antibiotic content at the P<0.01 level compared with the control group organic fertilizer.
总体上,温度越高对有机肥中抗生素的去除效果越好,250 ℃对抗生素的去除率最高,这主要是因为热解温度越高,对抗生素的分解越彻底[18]。田仁强等[15]通过热解技术发现鸡粪与农林废弃物中的4种典型抗生素在400 ℃以上高温下的去除率能达到90%以上,且在600 ℃的去除率能达到100%;Li等[33]通过共热解工艺发现猪粪中的四环素及磺胺类等6种抗生素在600 ℃的高温下能够被完全去除。喹诺酮类物质主要含有苯环、喹啉环、哌嗪环、吡哌酸、环外羟基、乙基、环丙基、甲氧基和氮双环等结构[34]。因此我们推测堆肥中的喹诺酮类抗生素在80~150 ℃主要通过吸热脱去结晶水和C—N键断裂来降低抗生素含量;热解温度进一步升高,达到250 ℃时,与许多喹诺酮类抗生素熔点接近[34],主要通过C—N键与羧基断裂、侧链哌嗪环破裂进一步发生离解,进而有效降低抗生素含量[18, 34]。磺胺类抗生素热解失重主要发生在250 ℃以上[18, 35],这在一定程度上解释了为什么仅在250 ℃对磺胺间甲氧嘧啶有显著去除效果。堆肥中磺胺间甲氧嘧啶可能首先发生S—N断裂,接着磺胺结构与取代基中的甲氧基、—NH2基团等进一步发生分解、取代与加成反应,实现小分子脱落与碳环缩聚的过程。大环内酯类抗生素物质主要含有内酯环、吡喃、环外羟基以及氨基等结构[36],热解失重发生在120 ℃以上[37]。因此推测堆肥中的大环内酯类抗生素在80~120 ℃主要通过吸热脱去结晶水和C—N键断裂来降低抗生素含量;当热解温度接近或超过大环内酯类抗生素熔点,主要通过C—O键断裂、吡喃环以及内酯环开环进一步分解,进而降低了抗生素的含量。总体而言,热解温度与抗生素熔点对堆肥中抗生素分解发挥重要作用,脱水红霉素、林可霉素和莫能菌素这3种抗生素的熔点均在100~150 ℃之间,更易分解,因此与其他抗生素相比,脱水红霉素、林可霉素和莫能菌素的去除效果最好。此外,堆肥中存在栖热菌属(Thermus)、扁平丝菌属(Planifilum)等嗜热菌,80 ℃加热条件会促进这些嗜热菌的生长增殖,有效分解堆肥中抗生素[38]。同一热解温度下,与单一有机肥组相比,添加硅藻土和沸石粉末在80 ℃和150 ℃条件下对抗生素的去除有促进作用,可能原因是,沸石和硅藻土丰富的微孔结构能为部分嗜热菌提供更多的繁殖场所,从而有效转化抗生素。但在250 ℃时,沸石和硅藻土对抗生素的去除有抑制作用,特别是抑制了脱水红霉素的去除。可能是因为在此温度下几乎全部微生物被杀死失活,微生物分解抗生素作用消失;同时硅藻土、沸石的表面性质发生改变,孔穴和通道中的水分和杂质大量挥发,孔容增大,吸附能力增强[20-21]。因此通过表面作用或增加的微孔结构固定有机肥中抗生素,进而改变抗生素形态或熔点,削弱热解对抗生素的去除效果。
2.2 16S rRNA基因、ARGs及可移动元件丰度变化
根据荧光定量PCR结果,在有机肥中共检测出目标基因22种,包括表征细菌总量的基因(16S rRNA)、移动元件(intI1、intI2、Tn916)、磺胺类ARGs(sul1、sul2)、喹诺酮类ARGs(qnrD)、大环内酯类ARGs(ereA)、四环素类ARGs(tetC、tetD、tetG、tetH、tetO、tetW、tetB/P)、氯霉素类ARGs(cmlA、cfr、floR、fexA)、氨基糖苷类ARGs(aadA)、β-内酰胺酶类ARGs(blaTEM)、大肠杆菌指示基因(uida)。
ARGs和大肠杆菌指示基因丰度变化如图2所示,有机肥中sul1占比最高,范围为2.20×106~9.31×109copies·g-1,优势ARGs主要是sul1、sul2、cmlA、fexA和aadA。对单一有机肥进行热解处理,随加热温度的升高,对ARGs的去除效果不断增强。在250 ℃处理下,有机肥中ARGs去除率最高达到99%,平均去除率均高达90%;uida的去除效果最为显著,在各个温度处理下的平均去除率均达99%以上,说明80~250 ℃低温热解能有效降低堆肥中大肠杆菌丰度,而且随着热解温度的升高,uida的去除效果越显著。

图2 不同处理组有机肥中抗性基因(ARGs)和大肠杆菌指示基因的绝对丰度变化
Fig. 2 Absolute abundance of antibiotic resistance genes(ARGs)and uidain organic fertilizer under different treatments
对16S rRNA的丰度变化进行分析(图3(a)),与原始有机肥相比,随热解温度升高,16S rRNA显著降低,说明细菌总量随热解温度升高不断降低,特别是250 ℃处理下,16S rRNA丰度仅为原始有机肥的0.97%~2.14%。ARGs与16S rRNA丰度比值代表ARGs的相对丰度,可以反映不同热解温度下单个细菌中ARGs的变化规律。由图3(b)可知,与原始有机肥相比,随热解温度升高,有机肥中ARGs的相对丰度不断降低。其中,150~250 ℃处理下ARGs的相对丰度显著下降,对细菌抗性的消减效果最为显著。通过不同处理组中可移动元件的丰度变化可以看出(图3(c)),随热解温度升高,可移动元件(intI1、intI2和Tn916)的含量均显著降低。在250 ℃处理下,可移动元件几乎都被去除,平均去除率均高达90%。由此可以看出低温热解对ARGs水平转移有强烈抑制作用。添加沸石和硅藻土后,在80 ℃和150 ℃条件下,与同一温度的单一有机肥相比,去除ARGs的效果有所下降:80 ℃时,硅藻土和沸石添加组中ARGs的绝对丰度有所提高;150 ℃时,添加硅藻土处理组中ARGs的相对丰度显著高于单一有机肥组。

图3 不同处理组有机肥中16S rRNA绝对丰度(a)、ARGs相对丰度(b)以及可移动元件绝对丰度(c)
注:*表示与对照组有机肥相比,16S rRNA绝对丰度、ARGs相对丰度在P<0.05水平上有显著差异;**表示与对照组有机肥相比,16S rRNA绝对丰度、ARGs相对丰度在P<0.01水平上有显著差异;***表示与对照组有机肥相比,16S rRNA绝对丰度、ARGs相对丰度在P<0.001水平上有显著差异。
Fig.3 Absolute abundance of 16S rRNA(a), relative abundance of ARGs(b)and absolute abundance of mobile gene elements(c)in organic fertilizer under different treatments
Note: *indicates that there was a significant difference in absolute abundance of 16S rRNA , relative abundance of ARGs at the P<0.05 level compared with the organic fertilizer of the control group; **indicates that there was a significant difference in absolute abundance of 16S rRNA , relative abundance of ARGs at the P<0.01 level compared with the organic fertilizer of the control group; ***indicates that there was a significant difference in absolute abundance of 16S rRNA , relative abundance of ARGs at the P<0.001 level compared with the organic fertilizer of the control group.
以上表明,热解温度对ARGs的去除有显著影响,温度越高去除效果越好。李哲[16]通过热碱解技术处理污泥发现四环素ARGs的去除率能达到95%以上;余震和周顺桂[12]利用超高温堆肥技术(80~100 ℃)对抗生素ARGs进行消减,相比普通堆肥去除率显著提升89%;Kimbell等[39]通过热解技术处理城市固体污染物发现,四环素和磺胺类ARGs以及细菌16S和可移动元件intI1在300~700 ℃显著减少,去除率高达99%以上。高温会破坏有机肥中细菌细胞壁,造成细胞结构破环,释放细胞内DNA物质,并破坏DNA的双螺旋结构[15, 40]。因此高温能够显著降低包括细菌(芽孢杆菌属(Bacillus)、拟杆菌属(Bacteroides)、梭状芽胞杆菌属(Clostridium)、肠球菌属(Enterococcus))和古菌(甲烷短杆菌属(Methanobrevibacter))在内的各种ARGs潜在宿主以及抗性质粒丰度[38]。同时可移动元件的减少在一定程度上反映了ARGs的水平转移受到限制,也是低温热解过程中ARGs丰度降低的潜在原因。添加硅藻土和沸石后,其丰富的微孔结构为更多微生物提供了适宜的繁殖场所。加热过程中,有机肥中的嗜热菌更有可能存活下来。嗜热菌栖热菌属以及扁平丝菌属中通常携带包括磺胺类ARGs在内的大量ARGs[41-42]。因此推测在80 ℃和150 ℃条件下,硅藻土和沸石可能促进了某些携带有ARGs的嗜热菌的繁殖,因此与相同温度下单一有机肥相比增加了有机肥中ARGs丰度。
2.3 低温热解能耗分析
使用马弗炉对有机肥进行低温热解,需要考虑热解过程中的能耗成本。温度越高,对有机肥中抗生素和ARGs的去除效果越好,但马弗炉用电量增加,经济成本也增加。因此,通过计算低温热解有机肥的能耗,可以从经济角度对有机肥产品的实用性进行评估。参考武晓春[43]的电阻炉功率计算方法,采用经验和估算方式计算马弗炉功率。计算升温时段和保温时段的功率,保温功率采用升温功率的50%计算[44]。查阅相关文献[43, 45],最终选用式(1)来确定马弗炉的升温功率。
P=C×τ-0.5×F0.9×t1.55
(1)
式中:P为升温功率(kW);C为散热系数,散热量大的马弗炉取30~35,散热量小的马弗炉取20~25,本文C取22[43];τ为马弗炉升温到工作温度的时间(h)(实验为程序升温,τ=0.5 h);F为炉膛内壁的有效面积,包括炉底、侧墙和炉顶所有面积之和(m2)(内壁尺寸为500 mm×300 mm×200 mm);t为马弗炉的工作温度(k℃)。热解过程中马弗炉耗能是升温阶段和保温阶段的耗电量之和,耗电量公式如式(2):
W=P升t升+P保t保
(2)
式中:P升为升温功率(kW);t升为升温时间(h);P保为保温功率(kW);t保为保温时间(h)。
结合式(1)和式(2)最终算出80 ℃热解处理组的马弗炉耗电量为0.30 kW·h,150 ℃热解处理组的耗电量为0.80 kW·h,250 ℃热解处理组的耗电量为1.77kW·h。因此250 ℃热解过程的耗能分别是80 ℃和150 ℃的2.7倍和5.9倍。从经济成本角度出发,80 ℃和150 ℃热解有机肥产品更具有竞争优势。
2.4 抗生素、ARGs风险与能耗综合分析
低温热解能有效降低有机肥中抗生素和ARGs丰度,提高有机肥产品的环境安全性,但有机肥产品的大面积推广需要考虑其经济成本。因此,从降低抗生素、ARGs风险以及节约成本的角度出发,对低温热解有机肥进行综合评价,评价指标分别是抗生素残留、ARGs残留以及能耗(energy)。对所有处理组有机肥按照热解温度进行分类(图4),比较80 ℃、150 ℃和250 ℃热解条件下的性能差异。各指标的坐标刻度按其大小分别赋予其级别强度(Ⅰ、Ⅱ、Ⅲ、Ⅳ和Ⅴ),根据指标封闭区域所围成的面积可以衡量样品的综合性能[46]。评价级别Ⅰ、Ⅱ、Ⅲ、Ⅳ和Ⅴ代表指标性能从高到低。设定抗生素、ARGs的残留量越低、能耗越少,对应指标级别越高,封闭区域面积越小,表示其综合性能越好。如图4所示,在250 ℃时各个指标所围成的封闭区域面积最小,综合性能最好,是消减抗生素和ARGs的最佳条件,特别是对ARGs的去除效果尤为显著,不足之处是能耗成本最高。150 ℃低温热解的综合性能次之,耗电成本大幅下降,对ARGs的去除效果较好,对抗生素的去除效果较差。80 ℃低温热解有机肥对ARGs的去除效果较差,但对抗生素的去除效果较好,同时能耗成本最低。因此,250 ℃低温热解是提高有机肥环境安全性的最有效手段,对抗生素和ARGs的平均去除率分别为32.47%和99.42%,但成本最高,适用于深度去除有机肥中的抗生素和ARGs残留;80 ℃和150 ℃热解有机肥所需要的经济成本分别为250 ℃的16.9%和45.2%,对抗生素的平均去除率分别为23.98%和20.25%,对ARGs的平均去除率分别为51.73%和87.88%,适用于处理ARGs残留较高的大批量有机肥。
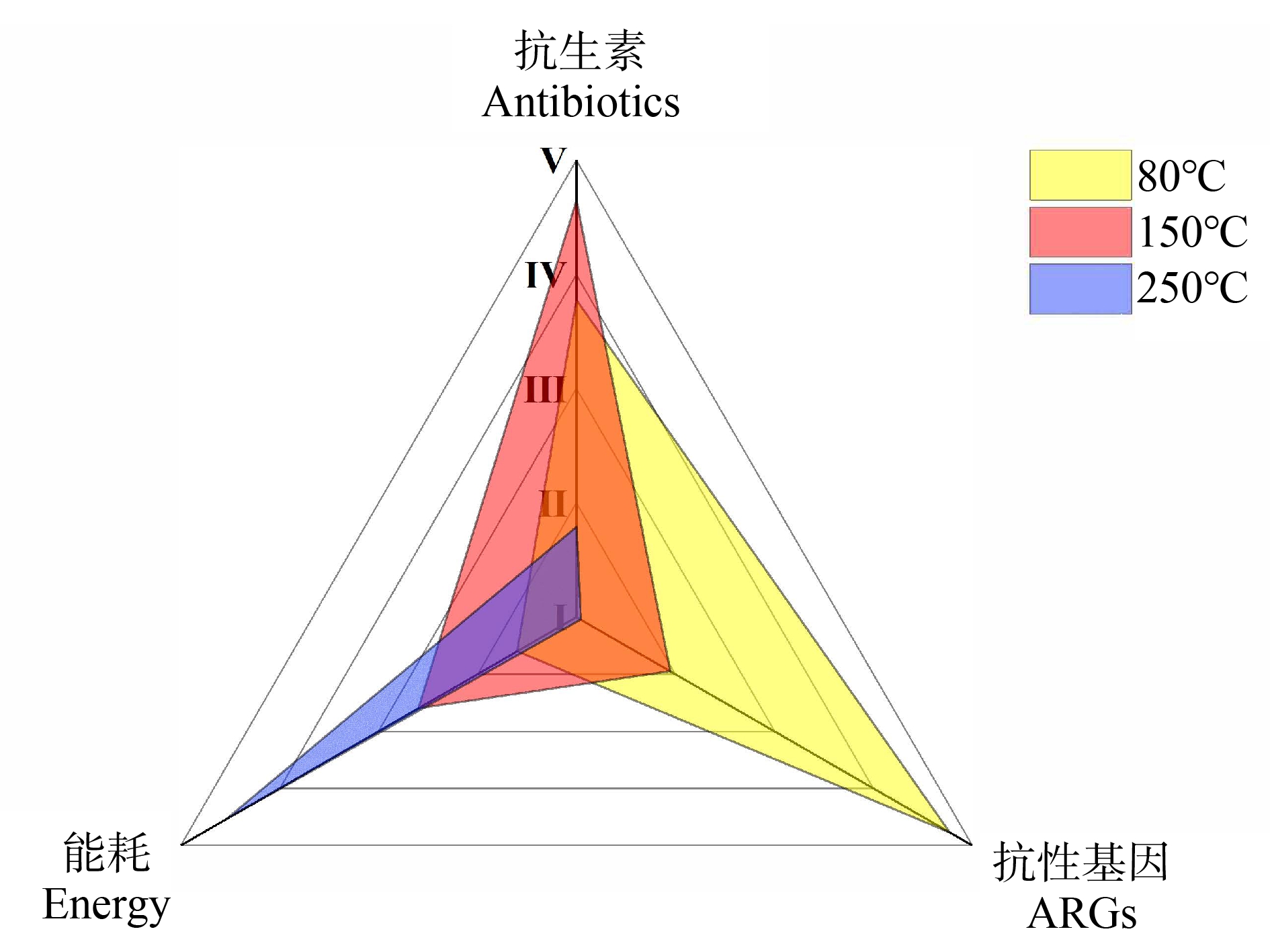
图4 不同温度下有机肥的综合性能比较
Fig. 4 Comparison of the comprehensive properties of organic fertilizers at different temperatures
本研究结果表明,对有机肥进行低温热解可以有效降低抗生素含量和ARGs丰度。热解温度和抗生素熔点对有机肥中抗生素的去除影响显著,热解温度越高、抗生素熔点越低,去除效果越好。脱水红霉素、林可霉素和莫能菌素的熔点较低,在100~150 ℃之间,去除率最高。硅藻土与沸石在80~150 ℃时对抗生素的去除有促进作用,但在250 ℃对抗生素去除有抑制作用,可能与80~150 ℃热解过程中硅藻土和沸石促进微生物降解、250 ℃加热引起材料结构改变进而固定抗生素有关。随热解温度升高,ARGs的去除效果不断增强,去除率最高可达99%;可移动元件平均去除率高达90%,在250 ℃下,几乎被完全去除。可移动元件减少,也在一定程度上抑制了ARGs的水平转移,降低了有机肥中ARGs的传播。在80~250 ℃的热解范围内,大肠杆菌指示基因uida的去除率均达99%以上,说明低温热解能有效降低堆肥中大肠杆菌丰度,提高有机肥安全性。硅藻土与沸石在80~150 ℃时对ARGs的去除有抑制作用,可能因为在此温度下硅藻土和沸石为携带有ARGs的嗜热菌提供了适宜的繁殖场所。结合不同热解温度下的能耗分析,250 ℃低温热解是提高有机肥环境安全性的最有效手段,但成本较高,更适用于对抗生素和ARGs含量较高的有机肥进行深度处理。80 ℃和150 ℃热解有机肥产品成本较低,且对ARGs和大肠杆菌的去除效果显著,有望在农业生产中大面积推广。本研究揭示了不同热解温度下抗生素和ARGs的消减规律,为低温热解有机肥中抗生素和ARGs技术提供了理论指导。
[1] 郭坤.有机肥中抗生素及其抗性基因的检测和恩诺沙星对生菜内生细菌的喹诺酮抗性基因的影响[D].南京: 南京师范大学, 2013: 1-2
Guo K.Detection of antibiotics and their resistance genes in organic fertilizer and the effect of enrofloxacin on quinolone resistance genes of endophytic bacteria in lettuce[D].Nanjing: Nanjing Normal University, 2013: 1-2(in Chinese)
[2] 李轶, 胡童, 王琳琼, 等.环丙沙星和铜复合污染下河流底质微生物群落与抗生素抗性基因的交互关系[J].河海大学学报(自然科学版), 2022, 50(6): 75-84
Li Y, Hu T, Wang L Q, et al.The interactions between microbial communities and antibiotic resistance genes to ciprofloxacin and copper co-contamination in river sediments[J].Journal of Hohai University(Natural Sciences), 2022, 50(6): 75-84(in Chinese)
[3] Li J J, Xin Z H, Zhang Y Z, et al.Long-term manure application increased the levels of antibiotics and antibiotic resistance genes in a greenhouse soil[J].Applied Soil Ecology, 2017, 121: 193-200
[4] Xie W Y, Shen Q, Zhao F.Antibiotics and antibiotic resistance from animal manures to soil: A review[J].European Journal of Soil Science, 2018, 69(1): 181-195
[5] Wang Y, Chen G X, Liang J, et al.Comparison of oxytetracycline degradation behavior in pig manure with different antibiotic addition methods[J].Environmental Science and Pollution Research International, 2015, 22(23): 18469-18476
[6] Li B, Yang Y, Ma L P, et al.Metagenomic and network analysis reveal wide distribution and co-occurrence of environmental antibiotic resistance genes[J].The ISME Journal, 2015, 9(11): 2490-2502
[7] Wang Y Z, Zhang Y L, Li J X, et al.Biogas energy generated from livestock manure in China: Current situation and future trends[J].Journal of Environmental Management, 2021, 297: 113324
[8] Gaballah M S, Guo J B, Sun H, et al.A review targeting veterinary antibiotics removal from livestock manure management systems and future outlook[J].Bioresource Technology, 2021, 333: 125069
[9] Zhang M, He L Y, Liu Y S, et al.Variation of antibiotic resistome during commercial livestock manure composting[J].Environment International, 2020, 136: 105458
[10] Liu B T, Yu K F, Ahmed I, et al.Key factors driving the fate of antibiotic resistance genes and controlling strategies during aerobic composting of animal manure: A review[J].The Science of the Total Environment, 2021, 791: 148372
[11] Cheng X Q, Zhang C, Wang Z X, et al.Tailoring nanofiltration membrane performance for highly-efficient antibiotics removal by mussel-inspired modification[J].Journal of Membrane Science, 2016, 499: 326-334
[12] 余震, 周顺桂.超高温好氧发酵技术: 堆肥快速腐熟与污染控制机制[J].南京农业大学学报, 2020, 43(5): 781-789
Yu Z, Zhou S G.Hyperthermophilic composting of organic solid wastes: Accelerated humification and pollution control mechanisms[J].Journal of Nanjing Agricultural University, 2020, 43(5): 781-789(in Chinese)
[13] 孟俊.猪粪堆制、热解过程中重金属形态变化及其产物的应用[D].杭州: 浙江大学, 2014: 11-12
Meng J.Change of heavy metal fractions during the composting and pyrolysis processes of swine manure and the applications of its composts and biochars[D].Hangzhou: Zhejiang University, 2014: 11-12(in Chinese)
[14] 王艳.城市生活垃圾中低温热解特性研究[D].天津: 天津大学, 2005: 15-16
Wang Y.Characteristic studies on middle and low-temperature pyrolysis of municipal household garbage[D].Tianjin: Tianjin University, 2005: 15-16(in Chinese)
[15] 田仁强, 谢胜禹, 李春星, 等.鸡粪与农林废弃物共热解对生物炭中残留重金属和抗生素的影响[J].农业环境科学学报, 2019, 38(11): 2619-2631
Tian R Q, Xie S Y, Li C X, et al.Effect of co-pyrolysis of chicken manure and agricultural or forestry wastes on residual heavy metals and antibiotics in biochar[J].Journal of Agro-Environment Science, 2019, 38(11): 2619-2631(in Chinese)
[16] 李哲.热碱解-水解处理剩余污泥的效果及四环素类抗性基因的变化研究[D].广州: 华南理工大学, 2018: 62-63
Li Z.Study on the effect of disposing residual sludge and the change of tetracyclines resistance genes by thermal-alkaline combined with hydrolysis process[D].Guangzhou: South China University of Technology, 2018: 62-63(in Chinese)
[17] Tian R Q, Li C X, Xie S Y, et al.Preparation of biochar via pyrolysis at laboratory and pilot scales to remove antibiotics and immobilize heavy metals in livestock feces[J].Journal of Soils and Sediments, 2019, 19(7): 2891-2902
[18] 李杰, 潘兰佳, 余广炜, 等.污泥中抗生素热解特性及动力学分析[J].环境工程学报, 2017, 11(9): 5213-5219
Li J, Pan L J, Yu G W, et al.Pyrolysis characteristics and kinetics analysis of several antibiotics in sludge[J].Chinese Journal of Environmental Engineering, 2017, 11(9): 5213-5219(in Chinese)
[19] 陈原, 张庚庚, 施宇震, 等.高硅沸石吸附水中有机微污染物的研究进展[J].广州化工, 2022, 50(7): 11-14
Chen Y, Zhang G G, Shi Y Z, et al.Research progress on adsorption of organic micro pollutants in water by high silica zeolite[J].Guangzhou Chemical Industry, 2022, 50(7): 11-14(in Chinese)
[20] 郭志伟, 赵宝龙, 郑志宏, 等.碳化改性硅藻土对四环素的吸附[J].环境工程, 2022, 40(5): 44-52
Guo Z W, Zhao B L, Zheng Z H, et al.Preparation of modified diatomite via carbonization and its adsorption performance on tetracycline[J].Environmental Engineering, 2022, 40(5): 44-52(in Chinese)
[21] Zhou G X, Qiu X W, Wu X Y, et al.Horizontal gene transfer is a key determinant of antibiotic resistance genes profiles during chicken manure composting with the addition of biochar and zeolite[J].Journal of Hazardous Materials, 2021, 408: 124883
[22] Wei Y, Gu J, Wang X J, et al.Elucidating the beneficial effects of diatomite for reducing abundances of antibiotic resistance genes during swine manure composting[J].Science of the Total Environment, 2022, 821: 153199
[23] 董颖博, 张圆, 林海, 等.焙烧温度对天然沸石物化性能的影响[J].中国有色金属学报, 2017, 27(7): 1520-1526
Dong Y B, Zhang Y, Lin H, et al.Effects of calcination temperature on physicochemical properties of natural zeolite[J].The Chinese Journal of Nonferrous Metals, 2017, 27(7): 1520-1526(in Chinese)
[24] 郭绍英.焙烧改性硅藻土处理垃圾渗滤液[J].环境科学与管理, 2012, 37(11): 101-103
Guo S Y.Treatment of landfill leachate by roasting-modified diatomite[J].Environmental Science and Management, 2012, 37(11): 101-103(in Chinese)
[25] Zhou L J, Ying G G, Liu S, et al.Simultaneous determination of human and veterinary antibiotics in various environmental matrices by rapid resolution liquid chromatography-electrospray ionization tandem mass spectrometry[J].Journal of Chromatography A, 2012, 1244: 123-138
[26] 刘叶新, 周志洪, 区晖, 等.珠江广州河段沉积物中典型抗生素的污染特征[J].华南师范大学学报(自然科学版), 2018, 50(4): 48-54
Liu Y X, Zhou Z H, Ou H, et al.Occurrence of typical antibiotics in sediments of Guangzhou section of the Pearl River[J].Journal of South China Normal University(Natural Science Edition), 2018, 50(4): 48-54(in Chinese)
[27] 葛丽炜, 夏颖, 刘书悦, 等.热解温度和时间对马弗炉制备生物炭的影响[J].沈阳农业大学学报, 2018, 49(1): 95-100
Ge L W, Xia Y, Liu S Y, et al.Effect of pyrolysis temperature and time on biochar production in a muffle furnace[J].Journal of Shenyang Agricultural University, 2018, 49(1): 95-100(in Chinese)
[28] He L Y, Liu Y S, Su H C, et al.Dissemination of antibiotic resistance genes in representative broiler feedlots environments: Identification of indicator ARGs and correlations with environmental variables[J].Environmental Science &Technology, 2014, 48(22): 13120-13129
[29] 何轮凯, 张敏, 刘有胜, 等.长期施用粪肥的土壤中抗生素耐药基因的消减规律[J].华南师范大学学报(自然科学版), 2018, 50(1): 1-10, 130
He L K, Zhang M, Liu Y S, et al.Dynamics of antibiotic resistance genes in soil chronically fertilized by swine manure[J].Journal of South China Normal University(Natural Science Edition), 2018, 50(1): 1-10, 130(in Chinese)
[30] Madsen L, Aarestrup F M, Elmerdahl Olsen J.Characterisation of streptomycin resistance determinants in Danish isolates of Salmonella typhimurium[J].Veterinary Microbiology, 2000, 75(1): 73-82
[31] Ram J L, Ritchie R P, Fang J W, et al.Sequence-based source tracking of Escherichia colibased on genetic diversity of beta-glucuronidase[J].Journal of Environmental Quality, 2004, 33(3): 1024-1032
[32] Sidrach-Cardona R, Hijosa-Valsero M, Marti E, et al.Prevalence of antibiotic-resistant fecal bacteria in a river impacted by both an antibiotic production plant and urban treated discharges[J].Science of the Total Environment, 2014, 488-489: 220-227
[33] Li C X, Xie S Y, Wang Y, et al.Simultaneous heavy metal immobilization and antibiotics removal during synergetic treatment of sewage sludge and pig manure[J].Environmental Science and Pollution Research, 2020, 27(24): 30323-30332
[34] 韩森, 朱小梅.喹诺酮类药物诺氟沙星的热稳定性研究[J].中国新药杂志, 2007, 16(14): 1104-1107
Han S, Zhu X M.Thermal analysis of norfloxacin[J].Chinese Journal of New Drugs, 2007, 16(14): 1104-1107(in Chinese)
[35] 胡慧敏.生物质材料固定化微生物及其降解土壤中磺胺类抗生素的研究[D].广州: 华南农业大学, 2017: 51-53
Hu H M.The research of biomass material immobilized microorganism and its degradation of sulfonamides in soil[D].Guangzhou: South China Agricultural University, 2017: 51-53(in Chinese)
[36] Böer T M, Procópio J V, Nascimento T G, et al.Correlation of thermal analysis and pyrolysis coupled to GC-MS in the characterization of tacrolimus[J].Journal of Pharmaceutical and Biomedical Analysis, 2013, 73: 18-23
[37] 李玮.大环内酯类抗生素热稳定性及分解动力学研究[J].药物分析杂志, 2010, 30(8): 1544-1547
Li W.Studies on the thermal kinetics of thermal decomposition and stability of macrolide drugs[J].Chinese Journal of Pharmaceutical Analysis, 2010, 30(8): 1544-1547(in Chinese)
[38] Yu Y S, Chen L J, Fang Y, et al.High temperatures can effectively degrade residual tetracyclines in chicken manure through composting[J].Journal of Hazardous Materials, 2019, 380: 120862
[39] Kimbell L K, Kappell A D, McNamara P J.Effect of pyrolysis on the removal of antibiotic resistance genes and class Ⅰ integrons from municipal wastewater biosolids[J].Environmental Science: Water Research &Technology, 2018, 4(11): 1807-1818
[40] Ma Y J, Wilson C A, Novak J T, et al.Effect of various sludge digestion conditions on sulfonamide, macrolide, and tetracycline resistance genes and class Ⅰ integrons[J].Environmental Science &Technology, 2011, 45(18): 7855-7861
[41] Liao H P, Lu X M, Rensing C, et al.Hyperthermophilic composting accelerates the removal of antibiotic resistance genes and mobile genetic elements in sewage sludge[J].Environmental Science &Technology, 2018, 52(1): 266-276
[42] Xu F, Liu Y L, Du W C, et al.Response of soil bacterial communities, antibiotic residuals, and crop yields to organic fertilizer substitution in North China under wheat-maize rotation[J].Science of the Total Environment, 2021, 785: 147248
[43] 武晓春.卧式电阻炉的设计与应用[J].现代制造技术与装备, 2020(4): 94-95
Wu X C.Design and application of horizontal resistance furnace[J].Modern Manufacturing Technology and Equipment, 2020(4): 94-95(in Chinese)
[44] 孙晓兵, 穆玉芹, 吕金根, 等.箱式电阻炉热处理生产中的降本增效案例及创新思维[J].金属加工(热加工), 2019(3): 1-3, 11
Sun X B, Mu Y Q, Lv J G, et al.Reduction and efficiency cases and innovative thinking in heat treatment production of box-type resistance furnace[J].MW Metal Forming, 2019(3): 1-3, 11(in Chinese)
[45] 江尧忠.工业电炉[M].北京: 清华大学出版社, 1993: 520-530
[46] 高采文.基于因子分析的改进雷达图及其在综合评价中的应用[J].山西师范大学学报(自然科学版), 2013, 27(4): 19-22
Gao C W.Improved radar chart based on factor analysis and its application in comprehensive evaluating[J].Journal of Shanxi Normal University(Natural Science Edition), 2013, 27(4): 19-22(in Chinese)