1 背景介绍(Background introduction)
化学工业在大部分国家的国民经济体系中都占有重要地位,是许多国家的基础和支柱型产业,其发展速度和产业规模对社会经济的各个组成部分都有着直接或间接的影响,因此一直备受国民关注[1]。近年来,在政府的规范管控下我国化工行业的发展逐渐迈入规范化、系统化、高质量化的新阶段,并且对于行业的安全环保有了更高的标准与要求。新冠疫情暴发后,全球对诸如酒精、表面活性剂和部分聚烯烃制品等抗疫必需品存在巨大的需求,在化工产品生产和使用的过程中产生了大量成分复杂的污染物,其中新型有机污染物(emerging organic pollutants, EOPs)的潜在威胁逐渐被大家了解。目前这类污染物的归趋、毒性效应与作用机理等尚未明确。国际上仍未就新型有机污染物的分类达成共识,但通常可以分为内分泌干扰物(EDCs)、药品与个人护理用品(PPCPs)、全氟化合物(PFCs)、溴代阻燃剂(BRPs)、饮用水消毒副产物、纳米材料和微塑料等[2-3]。随着水体中EOPs种类的急速增加,迫切需要了解其潜在的生态环境危害。因此,对各类污染物的生态毒理学研究逐步提上日程,研究人员正不断寻找不同环境中最合适的生物模型进行毒性测试实验。鱼类作为最多样化的水生脊椎动物受到了研究人员的广泛重视,其对于污染物毒性评价和了解毒物作用机制的生态毒理学研究同样不可或缺[4-5]。尽管最近其他硬骨鱼的测序项目也为生态毒理学提供了不少有价值的信息,但被认为是“鱼类小鼠”的斑马鱼(Danio rerio)和日本青鳉鱼(Oryzias latipes)作为传统的模式生物仍然优势明显——可获取的全基因组和突变基因信息,并已广泛应用于基因组学和蛋白质组学研究[5-6]。
目前,水生生态毒理学的研究趋势依然以淡水环境下各类环境胁迫(如环境参数、外源污染物等)对淡水鱼的毒性研究为主。随着工业化和城市化进展,海洋污染问题日益严重[7],加强海洋污染的生态毒理学研究具有重大的现实意义。由于淡水和海水环境中的盐度、密度、浮力、pH、离子强度和溶解氧等环境参数上存在的较大差异,污染物的尺寸、填充率、固液分配系数及其生物累积系数等方面的生态毒理学特征受到了显著影响,导致对生活在淡水和海水2种不同环境中的生物进行类似的研究往往会产生截然不同的结果[8-10]。因此,日本青鳉和斑马鱼作为淡水鱼种只适用于江河湖等淡水环境的影响研究,其研究结论不能直接外推至海洋环境下的毒理学研究,探寻可行的海洋环境鱼类研究模型对于海洋污染的生态风险评估至关重要。而海水青鳉鱼作为新兴的海洋鱼类模型生物正逐渐得到研究者们的青睐。
海水青鳉(Oryzias melastigma)隶属辐鳍亚纲(Actinopterygii)、颌针鱼目(Beloniformes)、怪颌鳉科(Adrianichthyidae)、青鳉属(Oryzias),原产于印度沿岸[11],已被公认为海洋环境下生态毒理学和环境研究的模式鱼类[12]。虽然海水青鳉和淡水青鳉鱼极为类似,包括具有相似的基因序列和蛋白质组,但Yang等[13]发现海水青鳉中的FXYD蛋白(FXYD蛋白为Na+-K+-ATP酶的新型调节剂)相较于淡水青鳉显现出不同的表达模式,这使得海水青鳉比淡水青鳉表现出了更好的耐盐性。并且,Kang等[14]发现淡水青鳉鱼的肌肉含水量随外部盐度的升高而降低,但是在海水青鳉中保持不变,这证明海水青鳉对于高盐度能表现出更好的渗透压调节能力。另外,Lai等[15]通过RNA测序发现,海水青鳉中很大一部分转录序列在现有的淡水青鳉的转录组序列中并不存在。这些发现进一步印证了淡水环境的生态毒理学结论不能直接外推到海洋环境研究的观点。
1.1 海水青鳉作为海洋生态毒理学研究模型的优势与现状
目前国际公认的、用于海洋生态毒理学研究的鱼类模型仍未确立。海水青鳉由于具有评估急性和慢性毒性、组织和系统毒性的巨大潜力而受到了毒理学领域研究的广泛应用,其作为一种极具潜力的海洋生物模型已被国际生命科学学会(ILSI)与健康和环境科学研究所(HESI)认定为海洋生态毒理学研究的重要工具[12]。
得益于海水青鳉体型小(2.5~3.5 cm),世代时间短(3~4个月)[16],具有很强的环境耐受性(可适应盐度范围为0~35‰,温度为17~31 ℃)[17],成鱼阶段两性差异显著[18],其胚胎和幼鱼对多种环境污染物敏感[19],在实验室易规模化养殖等诸多优势,其作为海洋毒理学生物研究模型已经进行了大范围的研究与应用。由图1可知,以海水青鳉为主体的生态毒理学研究文章整体呈现上升趋势,并且研究热度在近2年有着显著的提升。
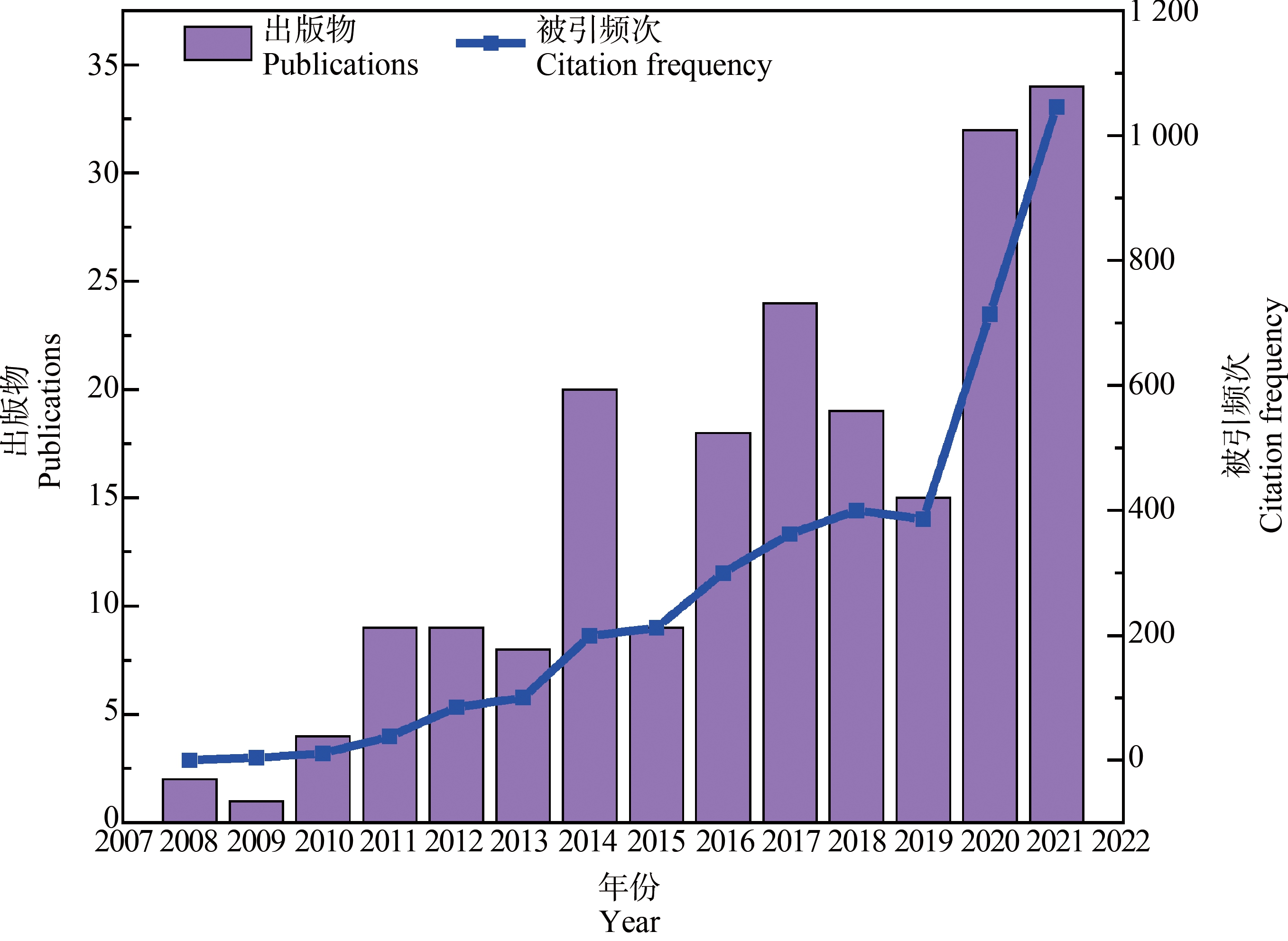
图1 海水青鳉近15年出版物和被引频次趋势图
Fig. 1 Trend map of publications and citation frequency of Oryzias melastigma in recent 15 years
1.2 从基因组学到蛋白质组学
基因组学和蛋白质组学相互联系又相互补充,其迅猛发展取决于相关技术方法、仪器设备的日新月异。基因组学主要用于对目标生物体的关键调控基因进行表征和量化,并研究它们之间的相互关系及各自对生物体的影响[20]。基因组学包括对基因组的测序和分析,通过使用高通量DNA测序和生物信息学来组装和分析整个基因组的功能和结构[21]。随着高通量测序技术的出现和发展,生物基因组信息得以逐渐完善,并且极大地促进了有关生命体对环境压力、化学刺激的适应和毒性效应在基因层面的影响等方面的研究进展。
基因组学能帮助我们更加清晰地了解毒性效应的分子作用机制,但是从DNA/RNA分析中获得的信息仍然较为局限与片面。在翻译成蛋白质之前,基因转录物可以通过不同的方式进行剪接,最终会形成各类各样的蛋白质。来自单个基因的信息可以编码成多达50种不同的蛋白质,而在翻译后大多数蛋白质会由于蛋白质翻译后修饰(protein translational modifications, PTMs)而发生化学变化(主要是通过添加碳水化合物和磷酸基团进行修饰,主要反应包括糖基化、乙酰化、脱酰胺化、棕榈酰化和硫酸化等),这种修饰在调节大部分蛋白质的功能中起着至关重要的作用,也使得蛋白质的种类和功能更加复杂。因此,DNA序列分析并不能准确预测蛋白质的活性形式,且RNA的定量并不总是能准确反映相应的蛋白质水平,DNA/RNA分析也无法预测基因产物的数量,包括基因翻译时PTMs的类型和数量,或诸如衰老、应激反应、药物反应和病理转化等涉及多个基因的事件[22]。正是由于基因组学通常不能提供蛋白质的丰度、结构和活性的准确概况,蛋白质组学也得到了快速地发展与应用。而随着人类基因组计划的完成,科学家们的研究重点正逐步转移到对人类有机体的蛋白质补充方面,这更加促进了蛋白质组学的发展。
蛋白质组学是一个新兴的组学领域,旨在分析细胞和生物体中产生、调节和进一步修饰后(例如磷酸化、泛素化、蛋白质-蛋白质相互作用、翻译后修饰)的整套蛋白质,其中涉及识别体内蛋白质并确定它们在生理功能中的作用。“蛋白质组”是指单一基因组表达对应的所有蛋白质。虽然基因组在通常环境下基本都会保持不变,但任何特定细胞中的蛋白质都会由于基因响应环境的改变而发生巨大变化。
由于蛋白质能够直接参与和正常活动或疾病相关的生理过程,因此可以通过研究病患对应细胞或组织中的蛋白质变化来更全面地了解疾病。在研究环境外源污染物的毒性效应领域的研究中同样类似,基于蛋白质组学的毒理学研究可以使我们更加全面、更加直观、更加清晰地了解污染物的致毒机理。
在实际的研究与应用上,基因组学和蛋白质组学是互补的领域,基因组学提供了基因层面的信息,而蛋白质组学可以扩展基因组学通常无法提供的功能性分析,这更有助于深入地了解生态毒物的致毒机理。基因组学与蛋白质组学已成功应用于海洋生态环境研究领域。在对海洋生物进行的生态毒理学研究中,蛋白质组学已成为表征在环境压力源中细胞效应和了解环境因素对海洋生物毒性机制的有力工具。
2 基因组学和蛋白质组学技术的研究进展(Research progress of genomics and proteomics technology)
2.1 基因组学
基因组学是强大的分子毒理学研究工具,可以提供生物的全基因组信息来分析污染物对生物在基因层面上的影响。基因组学的技术经历了近50年的发展,现已形成较为完善、统一的研究体系,其中实时荧光定量PCR(real-time quantitative PCR, RT-qPCR)和第二代测序(next generation sequencing, NGS)是目前进行毒性研究时运用最为广泛的定量和定性的生物信息学2种技术,对于海水青鳉基因序列的获取和比对有着深远的影响。
RT-qPCR可以根据反应体系中加入的荧光基团所积累的荧光信号强度变化,对PCR反应中的每一个循环扩增产物进行实时监控。相比于常规聚合酶链式反应(PCR),可以实现对扩增反应的实时监测、对初始DNA的定量以及较高的灵敏度,能满足大部分的基因检测需求。而NGS是基于PCR和基因芯片发展而来的DNA测序技术,更适合高通量检测需求,能够一次性测定大量序列,大幅降低测序时间和成本,并保持较高的准确性。目前RT-qPCR由于其普及度高、检测时间短和成本低的优势仍然是海水青鳉毒性研究最主流的基因检测技术,而NGS可以进行全基因组测序从而能够检测新产生的个体差异突变位点,非常适合用于探索筛选新的生物标志物和分析环境胁迫的分子作用机制,但是其仍存在诸多瓶颈尚未攻克,比如读长普遍较低、最终检测结果存在一定的错误信息,需要在后续研究中进行人为的分析与剔除等,因此二者优势互补、相辅相成。而随着基因测序技术的更新迭代,越来越多的新型技术开始在基因组学领域得到应用,如数字PCR、第三代单分子测序技术和第四代纳米孔测序技术等,各类技术应用领域不尽相同,各有优缺点,未来或许能够成为海水青鳉在基因组学上的新型主流技术[23-26]。
2.2 蛋白质组学
蛋白质组学是一个新兴的组学领域,旨在分析在细胞或生物体中产生、调节或进一步修饰的整套蛋白质[5]。在NGS技术的支持下,大量的蛋白质组学数据被收集、整合为全新的生物信息学数据库。生物信息学数据库的建立旨在对大量的蛋白质组学数据进行更好地存储与处理。目前已开发了用于3D结构预测、蛋白质结构域、基序分析、蛋白质-蛋白质相互作用快速分析和MS数据分析的各种生物信息学工具。
蛋白质组分析研究通常使用单一或多种蛋白质组学技术,对细胞结构和功能信息进行完整分析与描述,对细胞在各种类型的应激反应下的作用机制进行细致探究。典型的蛋白质组学实验流程包括以下4个主要方面:蛋白质的提取分离、蛋白质定性研究、蛋白质定量研究和生物信息学(图2)。目前常用的蛋白质组学技术如下。

图2 蛋白质组学实验流程
Fig. 2 Proteomics experimental process
2.2.1 蛋白质提取分离技术
2.2.1.1 凝胶电泳(Gel electrophoresis)
2.2.1.1.1 二维凝胶电泳(Two-dimensional gel electrophoresis, 2D-PAGE)
二维凝胶电泳是一种基于质量和电荷分离蛋白质的有效且可靠的方法。2D-PAGE能够连续解析约5 000种不同的蛋白质,具体取决于凝胶的大小。蛋白质在第一维等电聚焦凝胶电泳中以蛋白质电荷差异为基础进行分离,而在第二维SDS-PAGE中则根据它们的质量差异进行分离[27-28]。
2.2.1.1.2 二维荧光差异凝胶电泳(Two-dimensional differential gel electrophoresis, 2D-DIGE)
二维荧光差异凝胶电泳,即2D-DIGE,是在传统双向电泳的基础上发展而来的新型蛋白质组学定量技术。2D-DIGE分离混合蛋白质的原理与二维凝胶电泳一致,即利用蛋白质的等电点和分子量的差异来分离蛋白质混合物。同时通过应用荧光染料的灵敏度及内标等技术,使其在定量蛋白质组学的研究中效果明显优于传统双向电泳[29]。
2.2.1.2 高效液相色谱法(High performance liquid chromatography, HPLC)
高效液相色谱法进行蛋白质分离时,首先会将样品中的蛋白质分解成肽的混合物,随后将肽分离后再进行分析[30-31]。由于其可以将非常不均匀的蛋白质混合物转换为更为均匀的肽混合物,从而使分析更容易进行,因此HPLC在一次运行中能够获得数百或数千个肽的质谱数据,而一维凝胶电泳(1D-SDS-PAGE)和二维凝胶电泳(2D-SDS-PAGE)在肽的分离中并不实用。
2.2.2 蛋白质定性技术
质谱法(mass spectrometry, MS)即用电场和磁场将运动的离子(带电荷的原子、分子或分子碎片,有分子离子、同位素离子、碎片离子、重排离子、多电荷离子、亚稳离子、负离子和离子-分子相互作用产生的离子)按它们的质荷比分离后进行检测的方法。基本原理是使待测样品中的组分在离子源中离子化,经过电场加速形成离子束,进入质量分析器,获得质谱图。与Uniprot数据库比较得到对应的蛋白定量[27]。
2.2.3 蛋白质定量技术
2.2.3.1 凝胶电泳(Gel electrophoresis)
凝胶电泳分离后的蛋白质点经显色后通过分离胶的图像分析才可以进行定量分析。获得蛋白质凝胶电泳图像后,要对凝胶图像进行备份保存,以数字化图像的形式将其存储下来,而且要尽量完整地保留其定性和定量信息,以利于进一步分析。通过对批量凝胶图谱的分析,可以获得每一块凝胶中分离得到的总蛋白质点数、蛋白质点的缺失与出现以及多块胶之间蛋白质点的表达丰度的定量变化[28, 32]。
2.2.3.2 细胞培养稳定同位素标记(Stable isotopic labeling with amino acids in cell culture, SILAC)
细胞培养稳定同位素标记是一种基于质谱技术发展而来的定量蛋白质组学方法,它是在细胞培养过程中利用稳定同位素标记的氨基酸结合质谱技术,对蛋白表达进行定量分析的一种新技术。2组细胞同时培养,A组是在包含正常氨基酸(light)的培养基中;B组的培养基则含有“重型(heavy)”的氨基酸,即稳定同位素标记的氨基酸。细胞传代若干代后,稳定同位素标记的氨基酸完全掺入到蛋白中,取代了原有的氨基酸。这样,2个蛋白之间就存在分子量的改变,而其他化学性质无异。最初SILAC使用的标记氨基酸是氚代甲硫氨酸和氘代甘氨酸,目前常用的标记氨基酸有亮氨酸、精氨酸、赖氨酸、甲硫氨酸和酪氨酸等。它不仅可以对蛋白质进行定性分析,还可通过对质谱图上一对轻重稳定同位素峰的比例来反映对应蛋白在不同状态下的表达水平,实现对蛋白质的精确定量[27, 33]。
SILAC已被开发为一种方便的技术,用于研究基因表达、细胞信号传导和翻译后修饰的调节。此外,SILAC是细胞培养中分泌途径和分泌蛋白质的重要技术。
2.2.3.3 同位素标记相对和绝对定量技术(Isobaric tag for relative and absolute quantification, iTRAQ)
同位素标记相对和绝对定量技术是基于串联质谱的蛋白质定量的多重蛋白质标记技术。该技术利用多种同位素试剂标记蛋白多肽N末端或赖氨酸侧链基团,经高精度质谱仪串联分析,可同时比较多达8种样品之间的蛋白表达量,是近年来蛋白质组学定量常用的高通量筛选技术[27]。
2.3 生物信息学分析(Bioinformatics analysis)
生物信息学通过计算机系统收集和分析不同实验的大量数据,进行包括DNA序列分析、基因表达和功能性调控分析在内的不同生物基因组和蛋白质组的比较研究。而随着更多新颖高效算法的开发和具有强大数据分析潜力的高通量技术的发展使得生物信息学在蛋白质组学中的重要程度与日俱增。更高特异性和准确性的数据分析有助于蛋白质的定量定性分析,也更有利于进行蛋白质组的整体比较研究。但如何收集和管理如此庞大的数据依旧是目前生物信息分析学存在的主要问题。此外,仍然很难找到蛋白质组学数据与其他组学技术(包括基因组学和代谢组学)之间的关联,需要未来在数据库技术以及统计算法的改进来弥补不足。目前,组学研究主要使用数据库如下。
2.3.1 基因本体论(Gene ontology, GO)数据库
基因本体,即Gene ontology,是对所有基因的功能进行描述的本体数据库。该数据库将收录的基因本体按照术语描述的内容不同,将所有基因本体分为三大类,分别是描述分子功能(molecular function)的本体,描述细胞组分(cellular component)的本体以及描述生物过程(biological process)的本体。
2.3.2 京都基因和基因组(Kyoto encyclopedia of genes and genomes, KEGG)数据库
KEGG是通过分子水平信息,尤其是大型分子数据集生成的基因组测序和其他高通量实验技术了解高级功能和生物系统(如细胞、生物和生态系统)的实用程序数据库资源,由日本京都大学生物信息学中心的Kanehisa实验室于1995年建立。是国际最常用的生物信息数据库之一,以“理解生物系统的高级功能和实用程序资源库”著称。
2.3.3 基因/蛋白相互作用检索搜查工具(Search tool for the retrieval of interacting genes/proteins, STRING)
STRING数据库(https://string-db.org/)主要研究蛋白之间的相互作用网络,有助于挖掘核心的调控基因。String数据库是目前数据量最丰富、应用最广泛的研究蛋白质相互作用的数据库之一。目前,STRING数据库已更新到Version 11.5版本,收录了超过14 000个物种、6千多万种蛋白、200多亿个相互作用的信息。这些蛋白质相互作用既包括直接的物理作用,也包括间接的功能相关性。通过STRING数据库,我们可以很方便地检索已知蛋白间的互作关系,有助于更好地理解生物体中复杂的调控网络。
3 基因组学和蛋白质组学在海水青鳉生态毒理学研究中的应用(Application of genomics and proteomics in ecotoxicology of Oryzias melastigma)
3.1 基因组学在海水青鳉生态毒理学研究上的应用进展
在过去的10年中,PCR和NGS技术极大地促进了我们对于生物在分子机制层面上的理解[5]。将高通量DNA/RNA测序与生物信息学相结合,极大地提高了科学家对于生命体在分子水平层面反应评估的准确性。有关生命体对环境压力、化学刺激的适应性研究和对污染物的基因毒性效应的调查得以开展,为水生生态毒理学研究范式的优化奠定了坚实的基础。海洋生态系统经常受到不同来源的多种环境胁迫的影响,这些环境胁迫往往会使其影响下的生命体的基因产生突变。而由于海水青鳉在生理和基因表型上均对环境压力源表现出了敏感性[19],通过PCR或NGS技术可以快速准确地知悉突变的基因,因此通过基因组学有望将该物种开发为用于风险评估的海洋生态毒理学模式生物模型。
许多科学小组一直在不断对海水青鳉的转录组和基因组进行测序研究,旨在获取大量关于海水青鳉的基因信息,以推进对海洋环境的相关研究进展,例如Kim等[34]使用Illumina RNA-seq技术对孵化后24 h的海水青鳉幼鱼进行了转录组整体测序,为基于基因信息的环境基因组学和生态毒理基因组学研究提供了海水青鳉幼鱼的转录组信息;Lai等[15]使用Illumina高通量RNA测序技术为海水青鳉的不同组织(包括大脑、肝脏、卵巢和睾丸)提供了转录组资源;Hwang等[35]通过NGS测序技术获得了海水青鳉完整的线粒体基因组,确定一批器官特异性分子标志物。这些标志物可以用来指示特定器官的发育状态,其异常表达可以用来指示污染物对特定器官的毒性效应。海水青鳉基因组现在已经基本完成测序,但远未拼接完成[36]。最近,Kim等[37]首次提出了海水青鳉的第一个全基因组草案,共预测了23 528个基因,并鉴定了与3种硬骨鱼类(日本青鳉、红树林鳉鱼和斑马鱼)共有的12 670个基因家族。基因组分析显示,海水青鳉基因组的特点是重复序列含量高、杂合度高。国内学者构建了海水青鳉专用基因芯片,其中包含与细胞分裂、解毒反应、缺氧反应、氧化应激、细胞凋亡、生长、性别决定、性腺分化和生殖激素分泌相关的180个基因。该芯片涵盖了毒理学研究中最常见的标记基因,可有效用于差异表达的基因筛选[38]。至此,海水青鳉的基因组数据已经基本得到完备,并进行了首次的全基因组组装。而随着海水青鳉的基因组数据库逐渐得到完善,许多研究开始通过生物信息学来分析测定不同组织中的功能基因,从而探究组织对环境条件的特异性反应(表1)。
表1 不同环境胁迫对海水青鳉不同器官、组织中部分功能基因的表达影响
Table 1 Effects of different environmental stresses on the expression of some functional genes in different organs and tissues of Oryzias melastigma

功能Functions表达基因Genes expression分析的器官、组织Organs and tissues analyzed暴露环境及其影响Exposure environment and its effects参考文献References缺氧反应Hypoxia-responsive端粒酶逆转录酶(Telomerase reverse transcriptase, Tert)卵巢、肝脏、睾丸、肾脏、鳃、脑、脾、肠、眼、肌肉和皮肤Ovary, liver, testis, kidney, gill, brain, spleen, intestine, eye, muscle, and skin缺氧(上调)Hypoxia (up-regulated)[39-40]缺氧诱导因子-1 α(Hypoxia-inducible factor-1 α, HIF-1 α)肝脏、睾丸Liver, testis缺氧(上调)Hypoxia (up-regulated)[39]促红细胞生成素(Erythropoietin, EPO)肝脏、睾丸和胚胎Liver, testis, and embryos缺氧(上调),全氟辛烷磺酸(全氟辛烷磺酸(PFOS)(保持不变)Hypoxia (up-regulated), perfluorooctane sulfonic acid (PFOS) (unchanged)[39, 41]瘦素受体(Leptin receptor, LERP)肝、鳃、心、肾、鳃、脑、脾、肠、眼、肌肉、卵巢和睾丸Liver, gill, heart, kidney, gill, brain, spleen, intestine, eye, muscle, ovary, and testis缺氧(上调)Hypoxia(up-regulated)[42]血红素氧合酶-1(Hemoxygenase-1, HO-1)肝脏、鳃和心脏Liver, gill, and heart原油中的水溶性组分(WAFs)(下调),缺氧(上调)Water-soluble fractions in crude oil (WAFs) (down-regulated), hypoxia (up-regulated)[42-43]免疫毒性Immune toxicity谷胱甘肽过氧化物酶(Glutathione peroxidase, GPX)过氧化氢酶(Catalase, CAT)解偶联蛋白2(Uncoupling protein 2, UCP2)环氧合酶-2(Cyclooxygenase-2, COX-2)过氧化物酶体增殖物激活受体(Peroxisome proliferator-activated receptors, PPARs): Pparα、Pparβ、Ppar γ胚胎Embryos胚胎,整条鱼Embryos, whole fish全氟辛烷磺酸(PFOS)(下调)Perfluorooctane sulfonic acid (PFOS) (down-regulated)[44]全氟辛烷磺酸(PFOS)(下调)Perfluorooctane sulfonic acid (PFOS) (down-regulated)[44]全氟辛烷磺酸(PFOS)(下调)Perfluorooctane sulfonic acid (PFOS) (down-regulated)[44-45]全氟辛烷磺酸(PFOS)(下调)Perfluorooctane sulfonic acid (PFOS) (down-regulated)[44]全氟辛烷磺酸(PFOS)(上调),原油中的水溶性组分(WAFs)(下调)Perfluorooctane sulfonic acid (PFOS) (up-regulated), water-soluble fractions in crude oil (WAFs) (down-regulated)[43-44, 46]补体基因Complement-related genes甘露糖结合凝集素-2(Lectin, mannose-binding 2, MBL-2)青色荧光蛋白(Cyan fluorescent protein, CFP)补体成分(Complement component): C1r/s、C3、C9、C3-2、C4、C1q、C5、C8、C1抑制物(C1 inhibitor)凝血酶原(Prothrombin, F2)补体因子(Complement factor): HF、BF肝Liver2,2’,4,4’-四溴联苯醚(BDE-47)(雄性下调,雌性上调)2,2’,4,4’-tetrabromodiphenyl ether (BDE-47) (male down-regulated, female up-regulated)[47]2,2’,4,4’-四溴联苯醚(BDE-47)(雄性下调,雌性上调)2,2’,4,4’-tetrabromodiphenyl ether (BDE-47) (male down-regulated, female up-regulated)[47]2,2’,4,4’-四溴联苯醚(BDE-47)(雄性下调,雌性无明显变化),副溶血性弧菌(上调)2,2’,4,4’-tetrabromodiphenyl ether (BDE-47)(male down-regulated, female unchanged), Vibrio parahaemolyticus (up-regulated)[47-48]副溶血性弧菌(上调)Vibrio parahaemolyticus (up-regulated)[48]副溶血性弧菌(上调)Vibrio parahaemolyticus (up-regulated)[48]

续表1功能Functions表达基因Genes expression分析的器官、组织Organs and tissues analyzed暴露环境及其影响Exposure environment and its effects参考文献References补体基因Complement-related genes铁调素(Hepcidin, Hep): Hep1、Hep2甘露糖结合凝集素相关丝氨酸蛋白酶(Mannose-binding lectin-associated serine protease, MASP)肝、脾、鳃、肠、卵巢、睾丸、脑和胚胎Liver, spleen, gill, intestine, ovary, testis, brain, and embryos肝Liver副溶血性弧菌(上调)Vibrio parahaemolyticus (up-regulated)[48]副溶血性弧菌(上调)Vibrio parahaemolyticus (up-regulated)[48]炎症基因Inflammation-related genes肿瘤坏死因子-α(Tumor necrosis factor-α, TNF-α)白细胞介素(Il)(Interleukin (Il)): IL-1β, IL-8CC趋化因子配体11(CC chemokine eotaxin-1, CCL11)超氧化物歧化酶(Superoxide dismutase, SOD)胚胎Embryos全氟辛烷磺酸(PFOS)(下调),双酚A(BPA)(上调)Perfluorooctane sulfonic acid (PFOS) (down-regulated), bisphenol A (BPA) (up-regulated)[44, 49]全氟辛烷磺酸(PFOS)(下调),双酚A(BPA)(上调)Perfluorooctane sulfonic acid (PFOS) (down-regulated), bisphenol A (BPA) (up-regulated)[44, 49]双酚A(BPA)(上调)Bisphenol A (BPA) (up-regulated)[49]全氟辛烷磺酸(PFOS)(下调),双酚A(BPA)(上调)Perfluorooctane sulfonic acid (PFOS) (down-regulated), bisphenol A (BPA) (up-regulated)[44, 49]渗透压调节机制Osmoregulatory mechanismNa+/K+-ATP酶(Na+/K+-ATPase, NKA)鳃、胚胎Gill, embryos双酚A(BPA)(下调),海水(SW)(35‰),微咸水(BW)(15‰),淡水(FW)(0)(随盐度上升而上调)Bisphenol A (BPA) (down-regulated), seawater (SW) (35‰), brackish water (BW) (15‰), freshwater (FW) (0) (up-regulated with increasing salinity)[14, 49-50]Na+、K+、2Cl-协同转运蛋白(Na+、K+、2Cl- cotransporter, NKCC):NKCC1a、NKCC1b、NKCC2鳃、肝、睾丸、肠、卵巢、脑、肌肉、肾、心脏、鳍和眼Gill, liver, testis, intestine, ovary, brain, muscle, kidney, heart, fin, and eye海水(SW)(35‰),微咸水(BW)(15‰),淡水(FW)(0) (随盐度上升而上调)Seawater (SW) (35‰), brackish water (BW) (15‰), freshwater (FW) (0) (up-regulated with increasing salinity)[50]含有FXYD结构域的离子传输调节剂(FXYD domain-containing ion transport regulator, FXYD):FXYD5、FXYD6、FXYD7、FXYD8、FXYD9、FXYD11、FXYD12鳃、肠、肾、脑、眼、肝和尾鳍Gill, intestine, kidney, brain, eye, liver, and caudal fin海水(SW)(35‰),微咸水(BW)(15‰),淡水(FW)(0) (随盐度上升而上调)Seawater (SW) (35‰), brackish water (BW) (15‰), freshwater (FW) (0) (up-regulated with increasing salinity)[13]心脏发育相关基因Cardiac development-related genesNK型同源盒基因转录因子2.5(NK2 transcription factor related 5, NKX2.5)环氧合酶(Cyclooxygenase, COX): COX1、COX2胚胎Embryos全氟辛烷磺酸(PFOS)(下调),双酚A(BPA)(下调)、菲(Phe)(下调)Perfluorooctane sulfonic acid (PFOS) (down-regulated), bisphenol A (BPA) (down-regulated), phenanthrene (Phe) (down-regulated)[41, 49, 51]全氟辛烷磺酸(PFOS)(下调),双酚A(BPA) (COX1下调,COX2上调)、微塑料(MPs)(上调)、菲(Phe)(下调)Perfluorooctane sulfonate (PFOS) (down-regulated), bisphenol A (BPA) (COX1 down-regulated, COX2 up-regulated), microplastics (MPs) (up-regulated), phenanthrene (Phe) (down-regulated)[41, 49, 51]

续表1功能Functions表达基因Genes expression分析的器官、组织Organs and tissues analyzed暴露环境及其影响Exposure environment and its effects参考文献References心脏发育相关基因Cardiac development-related genesATP合酶(ATP synthase)骨形态发生蛋白(Bone morphogenetic protein, BMP4)成纤维细胞生长因子8(Fibroblast growth factor 8, FGF8)GATA结合蛋白4(GATA-binding protein 4, GATA4)瘦素受体(Leptin receptor, LERP)SET和MYND结构域蛋白1(SET and MYND domain containing 1, SMYD1)促红细胞生成素(Erythropoietin, EPO)胚胎Embryos全氟辛烷磺酸(PFOS)(下调)、微塑料(MPs)(下调)Perfluorooctane sulfonic acid (PFOS) (down-regulated), microplastics (MPs) (down-regulated)[41, 45]全氟辛烷磺酸(PFOS)(下调),双酚A(BPA)(下调)、菲(Phe)(下调)Perfluorooctane sulfonic acid (PFOS) (down-regulated), bisphenol A (BPA) (down-regulated), phenanthrene (Phe) (down-regulated)[41, 49, 51]全氟辛烷磺酸(PFOS)(下调),双酚A(BPA)(下调)、菲(Phe)(下调)Perfluorooctane sulfonic acid (PFOS) (down-regulated), bisphenol A (BPA) (down-regulated), phenanthrene (Phe) (down-regulated)[41, 49, 51]全氟辛烷磺酸(PFOS)(下调),双酚A(BPA)(下调),菲(Phe)(下调)Perfluorooctane sulfonic acid (PFOS) (down-regulated), bisphenol A (BPA) (down-regulated), phenanthrene (Phe) (down-regulated)[41, 49, 51]双酚A(BPA)(上调)Bisphenol A (BPA) (up-regulated)[49]全氟辛烷磺酸(PFOS)(下调)、微塑料(MPs)(下调)、菲(Phe)(下调)Perfluorooctane sulfonic acid (PFOS) (down-regulated), bisphenol A (BPA) (down-regulated), phenanthrene (Phe) (down-regulated)[41, 51]菲(Phe)(下调)Phenanthrene (Phe) (down-regulated)[51]代谢Metabolisms细胞色素P450(Cytochrome P450, CYP450)醛脱氢酶(Aldehyde dehydrogenase, ALDH)谷胱甘肽S-转移酶(Glutathione S-transferase, GST): GSTa、GSTk、GSTo、GSTt、GSTzUDP-葡萄糖醛酸转移酶(UDP-glucuronyltransferases, UGTs): UGT1b、UGT2a、UGT2a2、UGT2a3、UGT2b33、UGT2b3-like、UGT5a1、UGT5g1羟基类固醇脱氢酶(Hydroxysteroid dehydrogenase, HSD): 3β-HSD、11β-HSD、17β-HSD芳基烃受体(Aryl hydrocarbon receptor, AhR): AhR1、AhR2肝脏、鳃、胚胎、肠和卵巢Liver, gill, embryos, intestine, and ovary整条鱼Whole fish胚胎,整条鱼Embryos, whole fish全氟辛烷磺酸(PFOS)(下调),原油中的水溶性组分(WAFs)(上调)Perfluorooctane sulfonic acid (PFOS) (down-regulated), water-soluble components in crude oil (WAFs) (up-regulated)[43, 46, 52]原油中的水溶性组分(WAFs)(无明显变化)Water-soluble components in crude oil (WAFs) (unchanged)[43]原油中的水溶性组分(WAFs)(上调)Water-soluble components in crude oil (WAFs) (up-regulated)[43]原油中的水溶性组分(WAFs)(上调)Water-soluble components in crude oil (WAFs) (up-regulated)[43]原油中的水溶性组分(WAFs)(下调)Water-soluble components in crude oil (WAFs) (down-regulated)[43]全氟辛烷磺酸(PFOS)(保持极低水平),原油中的水溶性组分(WAFs)(上调)Perfluorooctane sulfonic acid (PFOS) (very low), water-soluble components in crude oil (WAFs) (up-regulated)[43, 46]

续表1功能Functions表达基因Genes expression分析的器官、组织Organs and tissues analyzed暴露环境及其影响Exposure environment and its effects参考文献References代谢Metabolisms5α-还原酶(5α-reductase, SRD5α)类固醇激素合成急性调节蛋白(Steroidogenic acute regulatory protein, StAR)ATP结合盒(ATP-binding cassette, ABC): ABCb1、ABCc2、ABCc3、ABCc4、ABCg2热休克蛋白(Heat shock protein, HSP): HSP10、HSP22、HSP27、HSP30、HSP60、HSP70、HSP75、HSP90a、HSP90β、HSPβ7、HSPβ11芳香烃受体核转位因子(Aryl hydrocarbon receptor nuclear translocator, ARNT)卵黄蛋白原(Vitellogenin, VTG)雌激素受体(Estrogen receptor, ER)卵黄蛋白原(Vitellogenin, VTG)细胞色素P450(Cytochrome P450, CYP450): CYP1A1谷胱甘肽S-转移酶(Glutathione S-transferase, GST)血浆脂质过氧化物(Lipid peroxide, LPO)整条鱼Whole fish胚胎Embryos肝脏、鳃、肠Liver, gill, intestine胚胎、仔鱼Embryos, larvae原油中的水溶性组分(WAFs)(下调)Water-soluble components in crude oil (WAFs) (down-regulated)[43]原油中的水溶性组分(WAFs)(下调)Water-soluble components in crude oil (WAFs) (down-regulated)[43]原油中的水溶性组分(WAFs)(上调)Water-soluble components in crude oil (WAFs) (up-regulated)[43]原油中的水溶性组分(WAFs)(下调)Water-soluble components in crude oil (WAFs) (down-regulated)[43]全氟辛烷磺酸(PFOS)(上调)Perfluorooctane sulfonic acid (PFOS) (up-regulated)[46]全氟辛烷磺酸(PFOS)(上调)Perfluorooctane sulfonic acid (PFOS) (up-regulated)[46]全氟辛烷磺酸(PFOS)(上调)Perfluorooctane sulfonic acid (PFOS) (up-regulated)[46]苯并三唑(上调)Benzotriazole (up-regulated)[53]苯并三唑(下调)Benzotriazole (down-regulated)[53]菲和烷基菲(上调)Phenanthrene and alkylphenanthrene (up-regulated)[54-55]菲和烷基菲(上调)Phenanthrene and alkylphenanthrene (up-regulated)[54-55]调节类固醇生成Regulating steroid production类固醇激素合成急性调节蛋白(Steroidogenic acute regulatory protein, StAR)细胞色素P450(Cytochrome P450, CYP450): CYP19a、CYP11a羟基类固醇脱氢酶(Hydroxysteroid dehydrogenase, HSD):3βHSD、20βHSD类固醇激素合成急性调节蛋白(Steroidogenic acute regulatory protein, StAR)细胞色素P450(Cytochrome P450, CYP450): CYP11a2、CYP17a1羟基类固醇脱氢酶(Hydroxysteroid dehydrogenase, HSD): 11βHSD、17βHSD卵巢Ovary银纳米粒子(nAg)(无明显变化)Silver nanoparticles (nAg) (unchanged)[56]银纳米粒子(nAg)(下调)Silver nanoparticles (nAg) (down-regulated)[56]银纳米粒子(nAg)(下调)Silver nanoparticles (nAg) (down-regulated)[56]微塑料(MPs)(下调)Microplastics (down-regulated)[57]微塑料(MPs)(下调)Microplastics (down-regulated)[57]微塑料(MPs)(下调)Microplastics (down-regulated)[57]
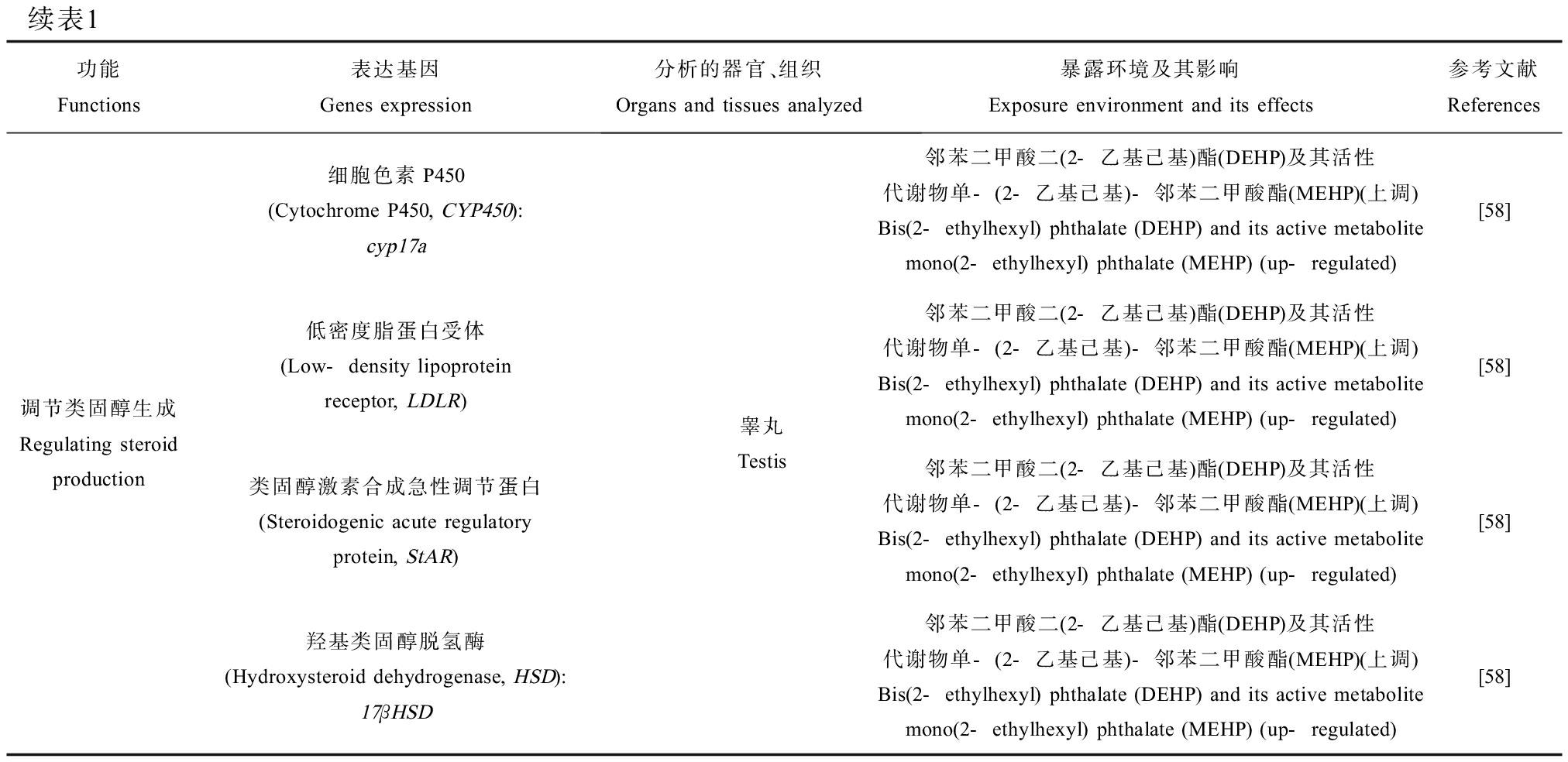
续表1功能Functions表达基因Genes expression分析的器官、组织Organs and tissues analyzed暴露环境及其影响Exposure environment and its effects参考文献References调节类固醇生成Regulating steroid production细胞色素P450(Cytochrome P450, CYP450): cyp17a低密度脂蛋白受体(Low-density lipoprotein receptor, LDLR)类固醇激素合成急性调节蛋白(Steroidogenic acute regulatory protein, StAR)羟基类固醇脱氢酶(Hydroxysteroid dehydrogenase, HSD): 17βHSD睾丸Testis邻苯二甲酸二(2-乙基己基)酯(DEHP)及其活性代谢物单-(2-乙基己基)-邻苯二甲酸酯(MEHP)(上调)Bis(2-ethylhexyl) phthalate (DEHP) and its active metabolite mono(2-ethylhexyl) phthalate (MEHP) (up-regulated)[58]邻苯二甲酸二(2-乙基己基)酯(DEHP)及其活性代谢物单-(2-乙基己基)-邻苯二甲酸酯(MEHP)(上调)Bis(2-ethylhexyl) phthalate (DEHP) and its active metabolite mono(2-ethylhexyl) phthalate (MEHP) (up-regulated)[58]邻苯二甲酸二(2-乙基己基)酯(DEHP)及其活性代谢物单-(2-乙基己基)-邻苯二甲酸酯(MEHP)(上调)Bis(2-ethylhexyl) phthalate (DEHP) and its active metabolite mono(2-ethylhexyl) phthalate (MEHP) (up-regulated)[58]邻苯二甲酸二(2-乙基己基)酯(DEHP)及其活性代谢物单-(2-乙基己基)-邻苯二甲酸酯(MEHP)(上调)Bis(2-ethylhexyl) phthalate (DEHP) and its active metabolite mono(2-ethylhexyl) phthalate (MEHP) (up-regulated)[58]
不同环境胁迫对海水青鳉产生影响的表达基因按功能可以被归纳为缺氧反应、免疫毒性、补体、炎症、渗透压调节机制、心脏发育、代谢和调节类固醇生成8类主要功能,用来指示海水青鳉特定器官的发育状态,它们的异常表达可以用来指示不同污染物对器官发育的毒性,阐明污染物对海水青鳉的致毒机理。功能基因的归纳总结也可以为后续更多新型污染物的基因毒理学研究提供借鉴与参考,更快更准确地筛选出异常表达的基因,减少对致毒机理探究的疏漏和盲目性。
3.2 蛋白质组学在海水青鳉生态毒理学研究上的应用进展
目前海水青鳉的蛋白质组学研究主要使用凝胶电泳(GE)+质谱(MS)分析作为分离和识别技术。二维凝胶电泳(2D-PAGE)作为目前最成熟、有效的蛋白质分离技术深受毒理学研究工作者的青睐,在海水青鳉的蛋白质组学研究中同样应用较多。例如,Wang等[59]研究了急性暴露于1 000 μg·L-1氯化汞(HgCl2)浓度下8 h后的海水青鳉肝脏和大脑中的蛋白质变化,通过2D-PAGE技术得到了暴露组和未暴露组的蛋白谱并进行比较分析,结果发现在大脑中的20个点和肝脏中的27个点定量检测到蛋白质的改变。对改变的蛋白质点进行基质辅助激光解吸/电离串联飞行时间质谱(MALDI-TOF-TOF MS)分析,最终识别鉴定出46种蛋白质在急性HgCl2环境下发生的变化,识别鉴定出的蛋白质涉及氧化应激、细胞骨架组装、信号转导、蛋白质修饰、代谢和其他相关功能(例如免疫反应、离子调节和转运);Tian等[60]分析了海水青鳉暴露于脂溶性聚醚毒素(PbTx-1)时的潜在毒性机制,通过2D-PAGE技术,发现鳃和大脑中的14种和24种蛋白质丰度均发生了显著变化。同样通过MALDI-TOF-TOF MS识别鉴定了13种鳃蛋白和20种脑蛋白,并进行了的功能划分;Zhu等[61]分析海水青鳉在氨胁迫(1.2 mmol·L-1和2.6 mmol·L-1 NH4Cl,96 h)下蛋白质谱和代谢产物的变化。通过2D-PAGE技术研究确定了23种改变的蛋白质。结果表明,氨胁迫不仅能够诱导氧化应激、免疫应激、细胞损伤和凋亡,还影响了海水青鳉的运动能力和中枢神经系统。
虽然二维凝胶电泳在海水青鳉蛋白质组学中有着较为广泛成熟的应用,并为蛋白质组学研究提供了极大的帮助,但是其仍然存在一定的缺陷与局限性。二维荧光差异凝胶电泳(2D-DIGE)在灵敏度和准确度方面的巨大提升使其成为科研工作者的另一大科研利器。Wang等[62],通过2D-DIGE技术进一步研究了长期暴露于不同氯化汞(HgCl2)浓度(1 μg·L-1或10 μg·L-1,慢性暴露60 d)下海水青鳉肝组织细胞的超微结构和Hg的富集情况。对暴露组和对照组的蛋白质谱进行比较,发现45个蛋白质点的丰度在对Hg处理反应中发生了显著变化。对改变的蛋白质点进行MALDI-TOF-TOF MS分析,最终鉴定出33种蛋白质。这些蛋白质主要参与细胞骨架组装、氧化应激和能量产生。其中,几种与线粒体功能相关的蛋白质(如呼吸代谢)在处理的肝细胞中显著改变。Wang等[63]使用2D-DIGE技术和MALDI-TOF-TOF MS分析对长期暴露于HgCl2的海水青鳉大脑中Hg的积累和超微结构进行了研究。结果表明,Hg在暴露组的大脑中显著积累,并造成了明显的损伤。暴露组和对照组之间2D-DIGE蛋白质谱的比较显示,16个蛋白质点的丰度发生了显著变化,进一步用MALDI-TOF-TOF MS分析,鉴定出的蛋白质表明无机汞可能通过诱导氧化应激、细胞骨架装配功能障碍和代谢紊乱而引起神经毒性。
2D-DIGE技术是目前海水青鳉蛋白质组学最为常用的定量分析技术,但它本质上依旧是二维凝胶电泳的一种改进,凝胶制造耗时、成本高,会忽略低丰度蛋白质的问题依然存在[4]。非凝胶蛋白定量分析技术也因此应运而生。关于同位素标记相对和绝对定量技术(iTRAQ)等新型技术虽然在海水青鳉毒理学中运用较少,但相较于2D-PAGE技术而言能够发现更多数量和更多种类的蛋白质,两者在功能上有一定的互补性[64](表2)。
表2 4种定量分析技术的功能比较[27, 65]
Table 2 Function comparison of four quantitative analysis techniques[27, 65]
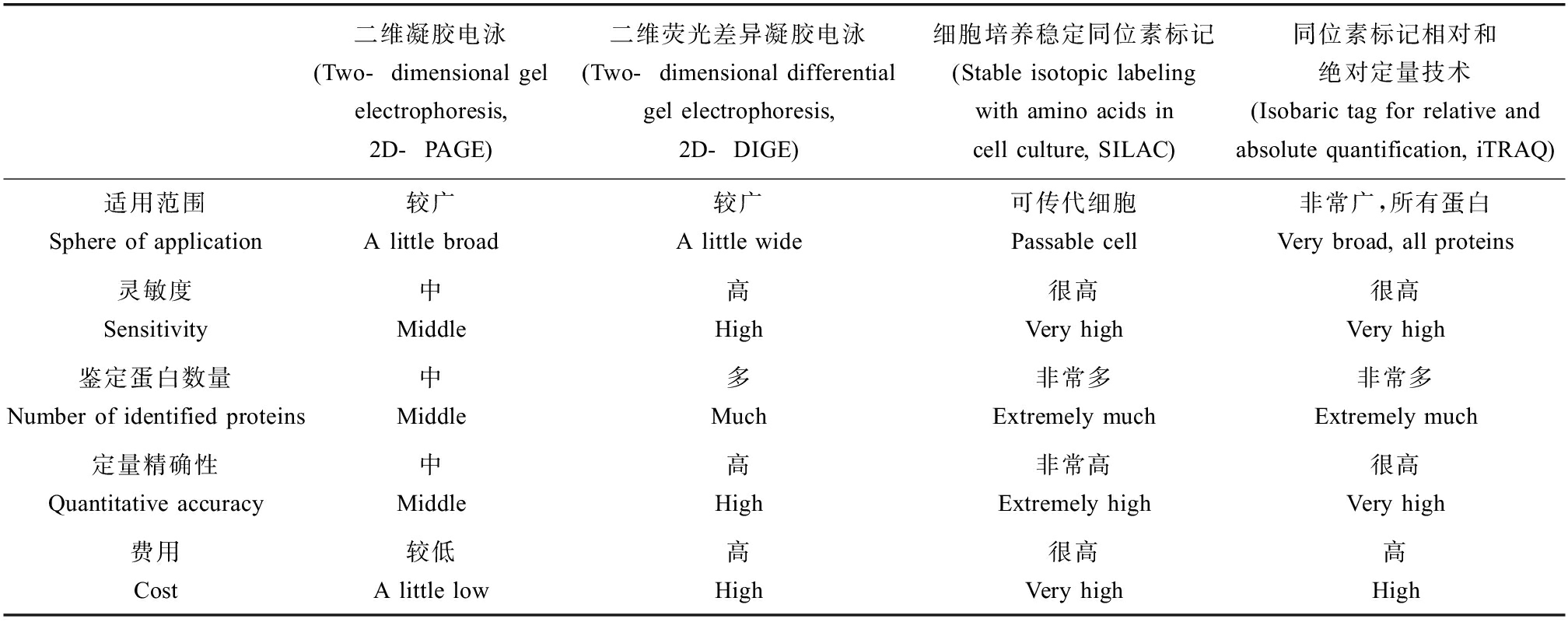
二维凝胶电泳(Two-dimensional gel electrophoresis, 2D-PAGE)二维荧光差异凝胶电泳(Two-dimensional differential gel electrophoresis, 2D-DIGE)细胞培养稳定同位素标记(Stable isotopic labeling with amino acids in cell culture, SILAC)同位素标记相对和绝对定量技术(Isobaric tag for relative and absolute quantification, iTRAQ)适用范围Sphere of application较广A little broad较广A little wide可传代细胞Passable cell非常广,所有蛋白Very broad, all proteins灵敏度Sensitivity中Middle高High很高Very high很高Very high鉴定蛋白数量Number of identified proteins中Middle多Much非常多Extremely much非常多Extremely much定量精确性Quantitative accuracy中Middle高High非常高Extremely high很高Very high费用Cost较低A little low高High很高Very high高High
iTRAQ技术能够精准分析鉴定出受影响的相关蛋白质。Chen等[66]结合iTRAQ技术和液相色谱串联质谱(LC-MS/MS)研究特征有机污染物(2.55 μg·L-1的4,5-二氯-N-辛基-4-异噻唑啉-3-酮(DCOIT)和浓度为2.31 μg·L-1的丁烯内酯)暴露下的海水青鳉脑组织中的蛋白质表达谱。发现DCOIT和丁烯内酯分别使雄性个体大脑中26种和18种蛋白质以及雌性个体大脑中27种和23种蛋白质表达与正常个体产生显著差异。暴露于DCOIT环境中主要导致有丝分裂原活化蛋白激酶(MAPK)信号通路的破坏,而丁烯内酯则会影响与细胞骨架解体相关的蛋白质。Fong等[67]研究了暴露于2种剂量(0.65 μg·g-1·d-1和1.30 μg·g-1·d-1,21 d)的2,2’,4,4’-四溴二苯醚(BDE-47)的海水青鳉雄性和雌性性腺的蛋白质表达谱。提取的蛋白质用iTRAQ标记并通过MALDI TOF/TOF MS进行分析。结果表明,在睾丸中发现了42种产生差异的蛋白质,证明了BDE-47会导致组蛋白变体和小白蛋白调节能力的减弱,这可能会破坏精子的生成并导致鱼类不育;而在卵巢中发现38种产生了差异的蛋白质,证明了BDE-47会导致卵黄原蛋白和载脂蛋白A-I的表达量升高,表明其可能会成为一种雌激素化合物从而导致海水青鳉的生殖障碍。
近年来,海水青鳉的蛋白质被不断发掘与完善,许多研究者对不同环境胁迫下海水青鳉在不同组织中蛋白质的表达做了大量的分析实验,以寻找合适的生物标志物来检测和评价日益增加的新型化学污染物的暴露及其效应(表3)。
表3 不同环境胁迫对海水青鳉不同器官、组织中部分蛋白质的表达影响
Table 3 Effects of different environmental stresses on the expression of some proteins in different organs and tissues of Oryzias Melastigma

相关功能Related functions蛋白质Proteins分析的器官、组织(暴露条件)及其影响Analysis of organs, tissues (exposure conditions) and their effects参考文献References细胞结构Cell structure组蛋白结合蛋白(Histone-binding protein, RBBP4)鳃(短裸甲藻毒素, PbTx-1)(下调)Gill (brevetoxin, PbTx-1) (down-regulated)[60]凝溶胶蛋白(Gelsolin)鳃、脑(短裸甲藻毒素, PbTx-1) (下调)Gill, brain (brevetoxin, PbTx-1) (down-regulated)[60]Krt4蛋白(Krt4 protein)鳃(短裸甲藻毒素, PbTx-1)(下调)Gill (brevetoxin, PbTx-1) (down-regulated)[60]氧化应激反应Oxidative stress response血红蛋白β链(Hemoglobin beta chain)鳃(短裸甲藻毒素, PbTx-1)(上调)Gill (brevetoxin, PbTx-1) (up-regulated)[60]组蛋白H3(Histone H3)鳃(短裸甲藻毒素, PbTx-1)(下调)Gill (brevetoxin, PbTx-1) (down-regulated)[60]胶质纤维酸性蛋白(Glial fibrillary acidic protein)脑(短裸甲藻毒素, PbTx-1)(上调)Brain (brevetoxin, PbTx-1) (up-regulated)[60]角蛋白15(Keratin 15, KRT15)脑(短裸甲藻毒素, PbTx-1)、肝脏(氯化汞, HgCl2)(下调)Brain (brevetoxin, PbTx-1), liver (mercuric chloride, HgCl2) (down-regulated)[59-60]肌球蛋白轻链2(Myosin light chain 2)脑(短裸甲藻毒素, PbTx-1)(上调)Brain (brevetoxin, PbTx-1) (up-regulated)[60]原肌球蛋白alpha-3链(Tropomyosin alpha-3 chain)脑(短裸甲藻毒素, PbTx-1)(上调)Brain (brevetoxin, PbTx-1) (up-regulated)[60]α-微管蛋白1(α-Tubulin 1)肝脏(氯化汞, HgCl2)(上调)Liver (mercuric chloride, HgCl2) (up-regulated)[59]角蛋白8(Keratin 8)肝脏(氯化汞, HgCl2)(上调)Liver (mercuric chloride, HgCl2) (up-regulated)[59]α-肌动蛋白(α-Actin)肝脏(氯化汞, HgCl2)(上调)Liver (mercuric chloride, HgCl2) (up-regulated)[59]角蛋白 18(Keratin 18)肝脏、脑(氯化汞, HgCl2)(上调)Liver, brain (mercuric chloride, HgCl2) (up-regulated)[59]β-肌动蛋白(β-Actin)肝脏、脑(氯化汞, HgCl2)(上调)Liver, brain (mercuric chloride, HgCl2) (up-regulated)[59]Krt5蛋白(Krt5 protein)脑(氯化汞, HgCl2)(上调)Brain (mercuric chloride, HgCl2) (up-regulated)[59]角蛋白K10(Keratin K10, KRT10)肝脏(氯化汞, HgCl2)(上调)Liver (mercuric chloride, HgCl2) (up-regulated)[62]过氧化还原酶4(Peroxiredoxin 4)肝脏(氯化汞, HgCl2)(上调)Liver (mercuric chloride, HgCl2) (up-regulated)[62]过氧化还原酶6(Peroxiredoxin 6)肝脏(氯化汞, HgCl2)(出现)Liver (mercuric chloride, HgCl2) (occurred)[62]谷胱甘肽 S-转移酶(Glutathione S-transferase, GST)肝脏(氯化汞, HgCl2)(下调)Liver (mercuric chloride, HgCl2) (down-regulated)[62]SOD(Cu/Zn)肝脏(氯化汞, HgCl2)(下调)Liver (mercuric chloride, HgCl2) (down-regulated)[62]

续表3相关功能Related functions蛋白质Proteins分析的器官、组织(暴露条件)及其影响Analysis of organs, tissues (exposure conditions) and their effects参考文献References氧化应激反应Oxidative stress response醛脱氢酶1家族,成员A2(Aldehyde dehydrogenase 1 family, member A2)脑(氯化汞, HgCl2)(下调)Brain (mercuric chloride, HgCl2) (down-regulated)[62]线粒体醛脱氢酶(Aldehyde dehydrogenase, mitochondrial)脑(氯化汞, HgCl2)(下调)Brain (mercuric chloride, HgCl2) (down-regulated)[62]过氧化还原酶2(Peroxiredoxin-2, PRDX2)肝脏(氯化汞, HgCl2)(上调)Liver (mercuric chloride, HgCl2) (up-regulated)[62]自然杀伤细胞增强因子(Natural killer enhancing factor)肝脏(氯化汞, HgCl2)(上调)Liver (mercuric chloride, HgCl2) (up-regulated)[59]过氧化还原酶1(Peroxiredoxin-1, PRDX1)肝脏(氯化汞, HgCl2)(上调)Liver (mercuric chloride, HgCl2) (up-regulated)[62]DJ-1蛋白(DJ-1 protein, DJ-1)肝脏(氯化汞, HgCl2)(上调)Liver (mercuric chloride, HgCl2) (up-regulated)[62]组织蛋白酶D(Cathepsin D, CTSD)肝脏(氯化汞, HgCl2)(上调)Liver (mercuric chloride, HgCl2) (up-regulated)[62]增殖细胞核抗原(Proliferating cell nuclear antigen, PCNA)每个发育时期的睾丸、肌肉、肾脏、肝脏、脸颊、大脑、肠道和卵巢胚胎(缺氧)(上调)Testis, muscle, kidney, liver, cheek, brain, intestine, and ovary embryo during each development period (hypoxia) (up-regulated)[40, 68]端粒酶逆转录酶(Telomerase reverse transcriptase, TERT)睾丸、脑、肌肉、鳃、肠、肾(正常)和肝(缺氧)(下调)Testis, brain, muscle, gill, intestine, kidney (normal) and liver (hypoxia) (down-regulated)[40]超氧化物歧化酶(Superoxide dismutase, SOD)整条鱼(纳米氧化锌, nZnO)(上调)Whole fish (nanometer zinc oxide, nZnO) (up-regulated)[69]金属硫蛋白(Metallothionein, MT)整条鱼(纳米氧化锌, nZnO)(上调)Whole fish (nanometer zinc oxide, nZnO) (up-regulated)[69]热休克蛋白70(Heat shock protein 70, HSP70)整条鱼(纳米氧化锌, nZnO)(上调)Whole fish (nanometer zinc oxide, nZnO) (up-regulated)[69]超氧化物歧化酶(Superoxide dismutase, SOD)肠道(微塑料)(上调)Intestine (microplastics) (up-regulated)[57]谷胱甘肽 S-转移酶(Glutathione S-transferase, GST)睾丸、肝脏(微塑料)(下调),肠道、腮(微塑料)(上调)Testis, liver (microplastics) (down-regulated), intestine, gill (microplastics) (up-regulated)[57]过氧化氢酶(Catalase, CAT)肝脏(微塑料)(下调)Liver (microplastics) (down-regulated)[57]总谷胱甘肽(Total glutathione, TGSH)睾丸、肝脏(微塑料)(下调)Testis, liver (microplastics) (down-regulated)[57]谷胱甘肽过氧化物酶(Glutathione peroxidase, GSH-Px)睾丸、肝脏(微塑料)(下调)Testis, liver (microplastics) (down-regulated)[57]

续表3相关功能Related functions蛋白质Proteins分析的器官、组织(暴露条件)及其影响Analysis of organs, tissues (exposure conditions) and their effects参考文献References代谢Metabolism载脂蛋白A-IV4(ApoA-IV4)鳃(短裸甲藻毒素, PbTx-1)(下调)Gill (brevetoxin, PbTx-1) (down-regulated)[60]醛糖还原酶(Aldose reductase)鳃(短裸甲藻毒素, PbTx-1)(上调),脑(短裸甲藻毒素, PbTx-1)(下调)Gill (brevetoxin, PbTx-1) (up-regulated), brain (brevetoxin, PbTx-1) (down-regulated)[60]丙酮酸羧化酶(Pyruvate carboxylase, PYC)脑(短裸甲藻毒素, PbTx-1)(下调)Brain (brevetoxin, PbTx-1) (down-regulated)[60]磷酸丙糖异构酶(Triose-phosphateisomerase, TPI)脑(短裸甲藻毒素, PbTx-1)(上调)Brain (brevetoxin, PbTx-1) (up-regulated)[60]烯醇化酶(Enolase)脑(短裸甲藻毒素, PbTx-1)(下调)Brain (brevetoxin, PbTx-1) (down-regulated)[60]谷氨酰胺合成酶(Glutamine synthetase, GS)脑(短裸甲藻毒素, PbTx-1;氯化汞, HgCl2)(下调)Brain (brevetoxin, PbTx-1; mercuric chloride, HgCl2) (down-regulated)[59-60]异戊酰辅酶A脱氢酶(Isovaleryl coenzyme A dehydrogenase)脑(短裸甲藻毒素, PbTx-1)(下调)Brain (brevetoxin, PbTx-1) (down-regulated)[60]甘油醛3-磷酸脱氢酶(Glyceraldehyde 3-phosphate dehydrogenase)脑(短裸甲藻毒素, PbTx-1)(上调)Brain (brevetoxin, PbTx-1) (up-regulated)[60]尿黑酸1,2-二氧化酶(Homogentisate 1,2-dioxygenase)肝脏(氯化汞, HgCl2)(无改变)Liver (mercuric chloride, HgCl2) (unchanged)[59]丙氨酰-tRNA合成酶,细胞质(Alanyl-tRNA synthetase, cytoplasmic)肝脏(氯化汞, HgCl2)(下调)Liver (mercuric chloride, HgCl2) (down-regulated)[59]二氢硫辛酰胺转乙酰基酶(Dihydrolipoamide S-acetyltransferase)肝脏(氯化汞, HgCl2)(下调)Liver (mercuric chloride, HgCl2) (down-regulated)[59]腺苷高半胱氨酸酶(Adenosylhomocysteinase)肝脏(氯化汞, HgCl2)(下调)Liver (mercuric chloride, HgCl2) (down-regulated)[59]丙酮酸脱氢酶E1-α,体细胞形态,线粒体(Pyruvate dehydrogenase E1 component subunit alpha, somatic form, mitochondrial)肝脏(氯化汞, HgCl2)(下调)Liver (mercuric chloride, HgCl2) (down-regulated)[59]脑型脂肪酸结合蛋白(Brain-type fatty acid binding protein)肝脏(氯化汞, HgCl2)(上调)Liver (mercuric chloride, HgCl2) (up-regulated)[59]蛋氨酸腺苷转移酶样(Methionine adenosyltransferase-like)肝脏(氯化汞, HgCl2)(下调)Liver (mercuric chloride, HgCl2) (down-regulated)[59]S-甲酰基谷胱甘肽水解酶(S-formylglutathione hydrolase)肝脏(氯化汞, HgCl2)(下调)Liver (mercuric chloride, HgCl2) (down-regulated)[59]载脂蛋白A1(Apolipoprotein A1)脑(氯化汞, HgCl2)(下调)Brain (mercuric chloride, HgCl2) (down-regulated)[59]丙酮酸激酶(Pyruvate kinase)脑(氯化汞, HgCl2)(无改变)Brain (mercuric chloride, HgCl2) (unchanged)[59]二氢嘧啶酶相关蛋白5(Dihydropyrimidinase-related protein 5)脑(氯化汞, HgCl2)(无改变)Brain (mercuric chloride, HgCl2) (unchanged)[59]二氢嘧啶酶样2(Dihydropyrimidinase-like 2)脑(氯化汞, HgCl2)(无改变)Brain (mercuric chloride, HgCl2) (unchanged)[59]烯醇化酶1(Enolase 1)脑(氯化汞, HgCl2)(上调)Brain (mercuric chloride, HgCl2) (up-regulated)[59]

续表3相关功能Related functions蛋白质Proteins分析的器官、组织(暴露条件)及其影响Analysis of organs, tissues (exposure conditions) and their effects参考文献References代谢Metabolism肌酸激酶(Creatine kinase)脑(氯化汞, HgCl2)(上调)Brain (mercuric chloride, HgCl2) (up-regulated)[59]总谷胱甘肽(Total glutathione, TGSH)整条鱼(原油中的水溶性组分, WAFs)(上调)Whole fish (water-soluble components in crude oil, WAFs) (up-regulated)[43]谷胱甘肽S-转移酶(Glutathione S-transferase, GST)整条鱼(原油中的水溶性组分, WAFs)(上调)Whole fish (water-soluble components in crude oil, WAFs) (up-regulated)[43]磺基转移酶(Sulfotransferase, SULT)整条鱼(原油中的水溶性组分, WAFs)(上调)Whole fish (water-soluble components in crude oil, WAFs) (up-regulated)[43]超氧化物歧化酶(Superoxide dismutase, SOD)整条鱼(原油中的水溶性组分, WAFs)(上调)Whole fish (water-soluble components in crude oil, WAFs) (up-regulated)[43]谷胱甘肽还原酶(Glutathione reductase, GR)整条鱼(原油中的水溶性组分, WAFs)(上调)Whole fish (water-soluble components in crude oil, WAFs) (up-regulated)[43]谷胱甘肽过氧化物酶(Glutathione peroxidase, GPx)整条鱼(原油中的水溶性组分, WAFs)(上调)Whole fish(Water-soluble components in crude oil, WAFs) (up-regulated)[43]过氧化氢酶(Catalase, CAT)整条鱼(原油中的水溶性组分, WAFs)(上调)Whole fish (water-soluble components in crude oil, WAFs) (up-regulated)[43]线粒体ATP合成酶亚基d(ATP synthase subunit d, mitochondrial, ATP5H)肝脏(氯化汞, HgCl2)(下调)Liver (mercuric chloride, HgCl2) (down-regulated)[62]电子传递黄素蛋白脱氢酶(Electron-transferring-flavoprotein dehydrogenase, ETFDH)肝脏(氯化汞, HgCl2)(下调)Liver (mercuric chloride, HgCl2) (down-regulated)[62]线粒体电子转移黄素蛋白亚基α(Electron transferring flavoprotein subunit alpha, mitochondrial, ETFA)肝脏(氯化汞, HgCl2)(下调)Liver (mercuric chloride, HgCl2) (down-regulated)[62]丙酮酸脱氢酶(硫辛酰胺)β(Pyruvate dehydrogenase (lipoamide) beta, PDHB)肝脏(氯化汞, HgCl2)(上调)Liver (mercuric chloride, HgCl2) (up-regulated)[62]磷酸化酶(Phosphorylase, PYGB)肝脏(氯化汞, HgCl2)(下调)Liver (mercuric chloride, HgCl2) (down-regulated)[62]甲酰亚胺基转移酶-环脱氨酶(Formimidoyltransferase-cyclodeaminase, FTCD)肝脏(氯化汞, HgCl2)(下调)Liver (mercuric chloride, HgCl2) (down-regulated)[62]信号转导Signal transduction肌球蛋白调节轻链2(Myosin regulatory light chain 2)鳃(短裸甲藻毒素, PbTx-1)(上调)Gill (brevetoxin, PbTx-1) (up-regulated)[60]含有FXYD结构域的离子转运调节剂(FXYD domain-containing ion transport regulator)鳃(盐度, SAL)(上调)Gill (Salinity, SAL) (up-regulated)[13]NKA α-亚基(NKA α-subunit)鳃(盐度, SAL)(上调)Gill (Salinity, SAL) (up-regulated)[14, 50]颗粒钙蛋白(Grancalcin)鳃(短裸甲藻毒素, PbTx-1)(下调)Gill (brevetoxin, PbTx-1) (down-regulated)[60]

续表3相关功能Related functions蛋白质Proteins分析的器官、组织(暴露条件)及其影响Analysis of organs, tissues (exposure conditions) and their effects参考文献References蛋白质修饰Protein modification肌球蛋白轻链2(Myosin light chain 2)鳃(短裸甲藻毒素, PbTx-1)(上调)Gill (brevetoxin, PbTx-1) (up-regulated)[60]钙网蛋白(Calreticulin, like 2)鳃(短裸甲藻毒素, PbTx-1)(下调)Gill (brevetoxin, PbTx-1) (down-regulated)[60]转化蛋白RhoA(Transforming protein RhoA)脑(短裸甲藻毒素, PbTx-1)(无改变),脑(氯化汞, HgCl2)(下调)Brain (brevetoxin, PbTx-1) (unchanged), brain (mercuric chloride, HgCl2) (down-regulated)[59-60]钙调蛋白(Calmodulin)脑(短裸甲藻毒素, PbTx-1)(上调)Brain (brevetoxin, PbTx-1) (up-regulated)[60]膜联蛋白4(Annexin 4)肝脏(氯化汞, HgCl2)(下调)Liver (mercuric chloride, HgCl2) (down-regulated)[59]膜联蛋白A13(Annexin A13)脑(氯化汞, HgCl2)(下调)Brain (mercuric chloride, HgCl2) (down-regulated)[59]蛋白酶体亚基α型1(Proteasome alpha 1 subunit)肝脏(氯化汞, HgCl2)(上调)Liver (mercuric chloride, HgCl2) (up-regulated)[59]热休克蛋白90(Heat shock protein 90, HSP-90)脑(氯化汞, HgCl2)(下调)Brain (mercuric chloride, HgCl2) (down-regulated)[59]其他功能相关Other function related含TCP1伴侣蛋白亚基8(Chaperonin containing TCP1, subunit 8)脑(氯化汞, HgCl2)(下调)Brain (mercuric chloride, HgCl2) (down-regulated)[59]β-突触核蛋白(Beta-synuclein)脑(短裸甲藻毒素, PbTx-1)(无改变)Brain (brevetoxin, PbTx-1) (unchanged)[60]补体成分C3-1(Complement component C3-1)肝脏(氯化汞, HgCl2)(下调)Liver (mercuric chloride, HgCl2) (down-regulated)[59]碳酸酐酶1(Carbonic anhydrase 1)脑(氯化汞, HgCl2)(下调)Brain (mercuric chloride, HgCl2) (down-regulated)[59]其他功能相关Other function related转铁蛋白(Transferrin)脑(氯化汞, HgCl2)(上调)Brain (mercuric chloride, HgCl2) (up-regulated)[59]组蛋白H4(Histone H4)肝脏(氯化汞, HgCl2)(上调)Liver (mercuric chloride, HgCl2) (up-regulated)[62]
不同环境胁迫对海水青鳉产生影响的蛋白质按其相关功能可以主要分为氧化应激反应、代谢、信号转导和蛋白质修饰等,它们的异常表达可以用来指示污染物对器官发育的毒性。但是,由于个别数据集并不能很好地代表海水青鳉特定器官的发育状态,阐明污染物对海水青鳉的致毒机理,因此蛋白质数据的整合是一个重要目标。数据的整合也可以为后续更多新型污染物的蛋白质毒理学研究提供借鉴与参考,使其研究对污染物暴露下可能产生影响的蛋白质有一个比较清晰明确的方向,减少致毒机理探究的疏漏和盲目性。
在过去的几年里,蛋白质组学在海水青鳉生态毒理领域的研究取得了巨大的进展。更快速、更灵敏的高通量技术的发展为研究提供更大的蛋白质组覆盖率。海水青鳉蛋白质数据库的丰富和完善为通过生物信息学分析进行蛋白质组学研究奠定了坚实的基础。但目前海水青鳉的蛋白质组整体数据仍然不足,研究比较零散。对此,应进一步做好数据的整理收集与归一化处理工作。为确定不同环境胁迫下最合适的生物标志物,进一步推动生态毒理学等相关学科的研究进展,进行生态环境风险评估等实际应用提供支持与帮助。
3.3 海水青鳉基因和蛋白质组学在各类毒性研究中的应用以及发展趋势
随着数据可重复性能力的提高和高通量技术的发展,基因组学和蛋白质组学已经成功应用于生态毒理学和环境监测,越来越多的生物标志物开始被发现并投入应用。海洋青鳉研究中的基因和蛋白质组学方法可以提供可靠的分子生物标志物,作为环境损害的敏感信号对海洋环境风险评估提供准确的科学依据。因此,海水青鳉已被视作为评估对有机化学品、无机化学品、有害生物、自然生物毒素和环境压力等多类环境胁迫的重要研究模型。目前研究较为常见的污染物包括全氟辛烷磺酸(PFOS)、微塑料(MPs)、原油中的水溶性组分(WAFs)、苯并三唑和多环芳烃等有机化学品,银纳米粒子、HgCl2等无机化学品,副溶血性弧菌等有害生物,PbTx-1等自然生物毒素以及缺氧等环境压力。
不同的表达基因和蛋白可以作为生物标志物反应不同种类的环境胁迫的影响水平。例如,对比海水青鳉的ChgH和ChgL对雌激素污染物的敏感程度,发现ChgH的最低可见效应浓度(Lowest Observed Effect Concentration, LOEC)远低于ChgL[70],使得ChgH可以作为一种高度敏感的生物标志物来检测海洋环境中雌激素污染物的污染水平;海水青鳉的肝脏和大脑中无机汞金属的积累会诱导氧化应激、细胞骨架重组和/或破坏、代谢功能障碍、蛋白质修饰、信号转导和其他相关功能的表达基因和蛋白[59,62-63],使得该类基因和蛋白可以作为生物标志物来检测海洋环境中无机汞金属污染物的污染水平;副溶血性弧菌会诱导海水青鳉肝细胞细胞核和细胞质中铁调素基因的表达[71],使得铁调素基因可以作为生物标志物来检测海洋环境中有害生物副溶血性弧菌的污染水平;瘦素受体基因的表达在缺氧条件下表现出组织特异性[39],使得瘦素受体基因可以作为海洋缺氧环境的敏感标记基因。
由于脊椎动物的高度进化保守性,我们或许能够开发出更具体更敏感的不同环境胁迫的生物标志物,这些生物标志物将有助于推动生态毒理学研究和人类健康风险评估体系的进一步深入与完善。
在过去10年中,单一的基因和蛋白质组学平台已广泛应用于包括海洋青鳉在内的多种海洋模式生物,但是单一的组学技术往往具有局限性,无法完全解释环境胁迫潜在的致毒机理,从单一层面上的研究逐步走向多元化,从局部到整体将是一种必然的趋势,因此,多组学方法开始逐渐得到应用。多组学方法通过整合不同的组学方法(包括代谢组学、基因组学和蛋白质组学等),将调控因子、mRNA、基因、蛋白和代谢等不同层面之间信息进行整合,构建生物体的调控网络,深层次理解各个分子之间的调控及因果关系,从而可以更深入地认识环境胁迫对海水青鳉毒性的潜在分子机制,揭示环境胁迫对海洋青鳉的时空变化和永久性表型变化,这将是未来海洋生态毒理学的重要发展趋势。
4 总结和展望(Conclusion and prospect)
海水青鳉基于其尺寸小、繁殖力强、世代时间短、胚胎透明、性别差异性以及易于进行实验室规模化养殖等特点已经成为海洋生态毒理学潜在的理想模式生物。随着海洋污染问题受到民众重视程度的不断提高,海水青鳉在生态毒理学研究中的应用必将愈发深入。基于数据可再现性的提高、高通量量化技术的发展,研究生态毒理学的潜在分子机制已成为海水青鳉毒理学研究的大势所趋。此外,随着组学技术的兴起,基因组学和蛋白质组学也将成为进行海水青鳉生态毒理学研究的重要方法。近年来,对于海水青鳉基因组和蛋白质组的信息已经有相当多的科学研究和数据发布,但尚未有文献将这些组学方法和信息尽可能的整合在一起。本综述为该方面的研究提供了部分参考与借鉴,旨在让大家能够更快地了解目前海水青鳉基因组学和蛋白质组学的研究方法与进展。未来,基因组学与蛋白质组学的结合与发展将不断地完善污染物的分子毒理机制的研究。尤其是在污染物的评价与监测方面,利用海水青鳉对污染物进行毒性评价或将会逐渐成为一种新兴的标准测试方法,进而形成一种成熟的海水青鳉毒性评价平台。我们同样期待未来海水青鳉的研究学者能够建立起一个开放的、完整的基因和蛋白质信息数据库,使海水青鳉的全基因组信息和蛋白质信息能够成为研究界共享的信息领域,从而推动海水青鳉鱼成为更受认可的海洋生态毒理学研究模式生物,并吸引更多研究者参与到对海水青鳉的更广泛的研究中去。
[1] 郭强之, 党文义, 张昌运, 等. 石油化工企业开展毒理学研究的意义探讨[J]. 安全、健康和环境, 2018, 18(11): 50-52
Guo Q Z, Dang W Y, Zhang C Y, et al. Discussion on the significance of toxicology research in petrochemical enterprises [J]. Safety Health &Environment, 2018, 18(11): 50-52 (in Chinese)
[2] 李文刚, 孙耀胜, 么强, 等. 新型有机污染物污染现状及其深度处理工艺研究进展[J]. 环境工程, 2021, 39(8): 77-87
Li W G, Sun Y S, Yao Q, et al. Review on pollution status and advanced treatment technologies of emerging organic pollutants [J]. Environmental Engineering, 2021, 39(8): 77-87 (in Chinese)
[3] 罗莹. 典型新型污染物水生态风险评估研究[D]. 保定: 河北大学, 2018: 1-3
[4] Sanchez B C, Ralston-Hooper K, Sepúlveda M S. Review of recent proteomic applications in aquatic toxicology [J]. Environmental Toxicology and Chemistry, 2011, 30(2): 274-282
[5] Kim B M, Kim J, Choi I Y, et al. Omics of the marine medaka (Oryzias melastigma) and its relevance to marine environmental research [J]. Marine Environmental Research, 2016, 113: 141-152
[6] 史志诚. 中国现代毒理学的形成与发展[C]// 中国毒理学会毒理学史专业委员会. 毒理学史研究文集(第八集). 2009: 9-26
[7] 谷河泉, 陈庆强. 中国近海持久性毒害污染物研究进展[J]. 生态学报, 2008, 28(12): 6243-6251
Gu H Q, Chen Q Q. Persistent toxic substances in offshore zone of China: A review [J]. Acta Ecologica Sinica, 2008, 28(12): 6243-6251 (in Chinese)
[8] French R A, Jacobson A R, Kim B, et al. Influence of ionic strength, pH, and cation valence on aggregation kinetics of titanium dioxide nanoparticles [J]. Environmental Science &Technology, 2009, 43(5): 1354-1359
[9] You C, Jia C X, Pan G. Effect of salinity and sediment characteristics on the sorption and desorption of perfluorooctane sulfonate at sediment-water interface [J]. Environmental Pollution, 2010, 158(5): 1343-1347
[10] Jeon J, Kannan K, Lim H K, et al. Bioaccumulation of perfluorochemicals in Pacific oyster under different salinity gradients [J]. Environmental Science &Technology, 2010, 44(7): 2695-2701
[11] 陈漪, 王晓杰, 冉皓宇, 等. 海水模式种青鳉鱼(Oryzias melastigma)的胚胎发育观察[J]. 海洋与湖沼, 2016, 47(1): 71-82
Chen Y, Wang X J, Ran H Y, et al. Developmental stages of a marine model fish—Medaka Oryzias melastigma [J]. Oceanologia et Limnologia Sinica, 2016, 47(1): 71-82 (in Chinese)
[12] 伍辛泷, 黄乾生, 方超, 等. 新兴海洋生态毒理学模式生物——海洋青鳉鱼(Oryzias melastigma)[J]. 生态毒理学报, 2012, 7(4): 345-353
Wu X L, Huang Q S, Fang C, et al. Oryzias melastigma: A new promising model organism for marine ecotoxicology [J]. Asian Journal of Ecotoxicology, 2012, 7(4): 345-353 (in Chinese)
[13] Yang W K, Kang C K, Chang C H, et al. Expression profiles of branchial FXYD proteins in the brackish medaka Oryzias dancena: A potential saltwater fish model for studies of osmoregulation [J]. PLoS One, 2013, 8(1): e55470
[14] Kang C K, Tsai S C, Lee T H, et al. Differential expression of branchial Na+/K(+)-ATPase of two medaka species, Oryzias latipes and Oryzias dancena, with different salinity tolerances acclimated to fresh water, brackish water and seawater [J]. Comparative Biochemistry and Physiology Part A, Molecular &Integrative Physiology, 2008, 151(4): 566-575
[15] Lai K P, Li J W, Wang S Y, et al. Tissue-specific transcriptome assemblies of the marine medaka Oryzias melastigma and comparative analysis with the freshwater medaka Oryzias latipes [J]. BMC Genomics, 2015, 16(1): 135
[16] 杨志艳, 薛雅芳, 徐永健. 4种重金属离子对海水青鳉胚胎发育及仔鱼的急性毒性研究[J]. 宁波大学学报(理工版), 2021, 34(5): 9-15
Yang Z Y, Xue Y F, Xu Y J. Effects of four heavy metal ions on embryonic development and larval growth of Oryzias melastigma [J]. Journal of Ningbo University (Natural Science &Engineering Edition), 2021, 34(5): 9-15 (in Chinese)
[17] Ni X M, Wan L, Liang P P, et al. The acute toxic effects of hexavalent chromium on the liver of marine medaka (Oryzias melastigma) [J]. Comparative Biochemistry and Physiology Toxicology &Pharmacology, 2020, 231: 108734
[18] Au D W T. 15th International Symposium on Toxicity Assessment [J]. Environmental Science and Pollution Research, 2012, 19(7): 2463-2464
[19] Chen X P, Li L, Cheng J P, et al. Molecular staging of marine medaka: A model organism for marine ecotoxicity study [J]. Marine Pollution Bulletin, 2011, 63(5-12): 309-317
[20] Gordon S. Genomics and World Health: Report of the Advisory Committee on Health Research [R]. Geneva: World Health Organization, 2002: 248
[21] Klug W, Cummings M R. Concepts of Genetics [M]. New York: Macmillan, 2019: 575-578
[22] Cho W C S. Proteomics technologies and challenges [J]. Genomics, Proteomics &Bioinformatics, 2007, 5(2): 77-85
[23] 解增言, 林俊华, 谭军, 等. DNA测序技术的发展历史与最新进展[J]. 生物技术通报, 2010(8): 64-70
Xie Z Y, Lin J H, Tan J, et al. The history and advances of DNA sequencing technology [J]. Biotechnology Bulletin, 2010(8): 64-70 (in Chinese)
[24] 田李, 张颖, 赵云峰. 新一代测序技术的发展和应用[J]. 生物技术通报, 2015, 31(11): 1-8
Tian L, Zhang Y, Zhao Y F. The next generation sequencing technology and its applications [J]. Biotechnology Bulletin, 2015, 31(11): 1-8 (in Chinese)
[25] Heather J M, Chain B. The sequence of sequencers: The history of sequencing DNA [J]. Genomics, 2016, 107(1): 1-8
[26] Shendure J, Balasubramanian S, Church G M, et al. DNA sequencing at 40: Past, present and future [J]. Nature, 2017, 550(7676): 345-353
[27] Aslam B, Basit M, Nisar M A, et al. Proteomics: Technologies and their applications [J]. Journal of Chromatographic Science, 2017, 55(2): 182-196
[28] 龙晓辉, 莫志宏, 张耀洲. 基于二维凝胶电泳的蛋白质定量分析技术[J]. 化学进展, 2006, 18(4): 474-481
Long X H, Mo Z H, Zhang Y Z. Quantitative analytical techniques of proteins based on two-dimensional gel electrophoresis [J]. Progress in Chemistry, 2006, 18(4): 474-481 (in Chinese)
[29] Meleady P. Two-dimensional gel electrophoresis and 2D-DIGE [J]. Methods in Molecular Biology, 2018, 1664: 3-14
[30] 张淑红, 冯硕, 李正平, 等. 高效液相色谱(HPLC)分离和检测蛋白质[J]. 河北农业大学学报, 2003, 26(S1): 148-151
Zhang S H, Feng S, Li Z P, et al. The separation and detection of protein by high performance liquid chromatography [J]. Journal of Agricultural University of Hebei, 2003, 26(S1): 148-151 (in Chinese)
[31] 吴霓, 江天久, 江涛. 高效液相色谱分析鱼毒性藻类海洋卡盾藻溶血毒素[J]. 分析化学, 2012, 40(8): 1181-1186
Wu N, Jiang T J, Jiang T. Analyses of hemolytic toxin from ichthyotoxic phytoplankton Chattonella marina (Hong Kong strain) by high performance liquid chromatography [J]. Chinese Journal of Analytical Chemistry, 2012, 40(8): 1181-1186 (in Chinese)
[32] 贺锋. 基于二维凝胶电泳图像的蛋白质点检测方法研究[D]. 南昌: 南昌航空大学, 2011: 2-4
[33] Ong S E, Blagoev B, Kratchmarova I, et al. Stable isotope labeling by amino acids in cell culture, SILAC, as a simple and accurate approach to expression proteomics [J]. Molecular &Cellular Proteomics, 2002, 1(5): 376-386
[34] Kim B M, Choi B S, Kim H S, et al. Transcriptome profiling of larvae of the marine medaka Oryzias melastigma by Illumina RNA-seq [J]. Marine Genomics, 2015, 24(Pt 3): 255-258
[35] Hwang D S, Kim B M, Au D W T, et al. Complete mitochondrial genome of the marine medaka Oryzias melastigma (Beloniformes, Adrianichthyidae) [J]. Mitochondrial DNA, 2012, 23(4): 308-309
[36] 崔倩. 苯并芘暴露诱导海水青鳉免疫应答的信号通路及其免疫调控机制研究[D]. 厦门: 厦门大学, 2019: 1-3
[37] Kim H S, Lee B Y, Han J, et al. The genome of the marine medaka Oryzias melastigma [J]. Molecular Ecology Resources, 2018, 18(3): 656-665
[38] 陈瑶, 方志俊, 郑金树, 等. 海洋青鳉鱼专用型基因芯片的设计及其在生态毒理学上的应用研究[J]. 台湾海峡, 2010, 29(3): 359-366
Chen Y, Fang Z J, Zheng J S, et al. Design of marine medaka (Oryzias melastigma) functional specific cDNA microarray and its ecotoxicological application [J]. Journal of Oceanography in Taiwan Strait, 2010, 29(3): 359-366 (in Chinese)
[39] Yu R M, Chen E X, Kong R Y, et al. Hypoxia induces telomerase reverse transcriptase (TERT) gene expression in non-tumor fish tissues in vivo: The marine medaka (Oryzias melastigma) model [J]. BMC Molecular Biology, 2006, 7: 27
[40] Kong R Y, Giesy J P, Wu R S, et al. Development of a marine fish model for studying in vivo molecular responses in ecotoxicology [J]. Aquatic Toxicology, 2008, 86(2): 131-141
[41] Huang Q S, Fang C, Wu X L, et al. Perfluorooctane sulfonate impairs the cardiac development of a marine medaka (Oryzias melastigma) [J]. Aquatic Toxicology, 2011, 105(1-2): 71-77
[42] Wong M M, Yu R M, Ng P K, et al. Characterization of a hypoxia-responsive leptin receptor (omLepR(L)) cDNA from the marine medaka (Oryzias melastigma) [J]. Marine Pollution Bulletin, 2007, 54(6): 797-803
[43] Rhee J S, Kim B M, Choi B S, et al. Whole spectrum of cytochrome P450 genes and molecular responses to water-accommodated fractions exposure in the marine medaka [J]. Environmental Science &Technology, 2013, 47(9): 4804-4812
[44] Fang C, Huang Q S, Ye T, et al. Embryonic exposure to PFOS induces immunosuppression in the fish larvae of marine medaka [J]. Ecotoxicology and Environmental Safety, 2013, 92: 104-111
[45] Huang Q S, Dong S J, Fang C, et al. Deep sequencing-based transcriptome profiling analysis of Oryzias melastigma exposed to PFOS [J]. Aquatic Toxicology, 2012, 120-121: 54-58
[46] Fang C, Wu X L, Huang Q S, et al. PFOS elicits transcriptional responses of the ER, AHR and PPAR pathways in Oryzias melastigma in a stage-specific manner [J]. Aquatic Toxicology, 2012, 106-107: 9-19
[47] Ye R R, Lei E N Y, Lam M H W, et al. Gender-specific modulation of immune system complement gene expression in marine medaka Oryzias melastigma following dietary exposure of BDE-47 [J]. Environmental Science and Pollution Research, 2012, 19(7): 2477-2487
[48] Bo J, Giesy J P, Ye R, et al. Identification of differentially expressed genes and quantitative expression of complement genes in the liver of marine medaka Oryzias melastigma challenged with Vibrio parahaemolyticus [J]. Comparative Biochemistry and Physiology Part D, Genomics &Proteomics, 2012, 7(2): 191-200
[49] Huang Q S, Fang C, Chen Y J, et al. Embryonic exposure to low concentration of bisphenol A affects the development of Oryzias melastigma larvae [J]. Environmental Science and Pollution Research International, 2011, 19(7): 2506-2514
[50] Kang C K, Tsai H J, Liu C C, et al. Salinity-dependent expression of a Na+, K+, 2Cl- cotransporter in gills of the brackish medaka Oryzias dancena: A molecular correlate for hyposmoregulatory endurance [J]. Comparative Biochemistry and Physiology Part A: Molecular &Integrative Physiology, 2010, 157(1): 7-18
[51] Li Y J, Wang J, Yang G X, et al. Low level of polystyrene microplastics decreases early developmental toxicity of phenanthrene on marine medaka (Oryzias melastigma) [J]. Journal of Hazardous Materials, 2020, 385: 121586
[52] Kim R O, Kim B M, Hwang D S, et al. Evaluation of biomarker potential of cytochrome P450 1A (CYP1A) gene in the marine medaka, Oryzias melastigma exposed to water-accommodated fractions (WAFs) of Iranian crude oil [J]. Comparative Biochemistry and Physiology Toxicology &Pharmacology, 2013, 157(2): 172-182
[53] He T T, Liang B, Liu W H, et al. Estrogenic potential of benzotriazole on marine medaka (Oryzias melastigma) [J]. Ecotoxicology and Environmental Safety, 2012, 80: 327-332
[54] Mu J L, Wang J Y, Jin F, et al. Comparative embryotoxicity of phenanthrene and alkyl-phenanthrene to marine medaka (Oryzias melastigma) [J]. Marine Pollution Bulletin, 2014, 85(2): 505-515
[55] 马继铭. 菲与烷基菲对海水青鳉早期发育阶段的毒性效应比较研究[D]. 大连: 大连海事大学, 2012: 47
[56] Degger N, Tse A C K, Wu R S S. Silver nanoparticles disrupt regulation of steroidogenesis in fish ovarian cells [J]. Aquatic Toxicology, 2015, 169: 143-151
[57] Wang J, Li Y J, Lu L, et al. Polystyrene microplastics cause tissue damages, sex-specific reproductive disruption and transgenerational effects in marine medaka (Oryzias melastigma) [J]. Environmental Pollution, 2019, 254(Pt B): 113024
[58] Ye T, Kang M, Huang Q S, et al. Exposure to DEHP and MEHP from hatching to adulthood causes reproductive dysfunction and endocrine disruption in marine medaka (Oryzias melastigma) [J]. Aquatic Toxicology, 2014, 146: 115-126
[59] Wang M H, Wang Y Y, Wang J, et al. Proteome profiles in medaka (Oryzias melastigma) liver and brain experimentally exposed to acute inorganic mercury [J]. Aquatic Toxicology, 2011, 103(3-4): 129-139
[60] Tian L, Wang M H, Li X M, et al. Proteomic modification in gills and brains of medaka fish (Oryzias melastigma) after exposure to a sodium channel activator neurotoxin, brevetoxin-1 [J]. Aquatic Toxicology, 2011, 104(3-4): 211-217
[61] Zhu L M, Gao N, Wang R F, et al. Proteomic and metabolomic analysis of marine medaka (Oryzias melastigma) after acute ammonia exposure [J]. Ecotoxicology, 2018, 27(3): 267-277
[62] Wang M H, Wang Y Y, Zhang L, et al. Quantitative proteomic analysis reveals the mode-of-action for chronic mercury hepatotoxicity to marine medaka (Oryzias melastigma) [J]. Aquatic Toxicology, 2013, 130-131: 123-131
[63] Wang Y Y, Wang D Z, Lin L, et al. Quantitative proteomic analysis reveals proteins involved in the neurotoxicity of marine medaka Oryzias melastigma chronically exposed to inorganic mercury [J]. Chemosphere, 2015, 119: 1126-1133
[64] 潘三强, 宿宝贵, 吕来清. 二维电泳和iTRAQ的实验比较[J]. 神经解剖学杂志, 2008, 24(5): 538-542
Pan S Q, Su B G, Lyu L Q. A comparative study between the two dimensional gel electrophoresis and iTRAQ method [J]. Chinese Journal of Neuroanatomy, 2008, 24(5): 538-542 (in Chinese)
[65] Deracinois B, Flahaut C, Duban-Deweer S, et al. Comparative and quantitative global proteomics approaches: An overview [J]. Proteomes, 2013, 1(3): 180-218
[66] Chen L G, Sun J, Zhang H M, et al. Hepatic proteomic responses in marine medaka (Oryzias melastigma) chronically exposed to antifouling compound butenolide [5-octylfuran-2(5H)-one] or 4,5-dichloro-2-N-octyl-4-isothiazolin-3-one (DCOIT) [J]. Environmental Science &Technology, 2015, 49(3): 1851-1859
[67] Fong C C, Shi Y F, Yu W K, et al. iTRAQ-based proteomic profiling of the marine medaka (Oryzias melastigma) gonad exposed to BDE-47 [J]. Marine Pollution Bulletin, 2014, 85(2): 471-478
[68] 谷河泉, 陈庆强. 中国近海持久性毒害污染物研究进展[J]. 生态学报, 2008, 28(12): 6243-6251
Gu H Q, Chen Q Q. Persistent toxic substances in offshore zone of China: A review [J]. Acta Ecologica Sinica, 2008, 28(12): 6243-6251 (in Chinese)
[69] Wong S W Y, Leung P T Y, ![]() A B, et al. Toxicities of nano zinc oxide to five marine organisms: Influences of aggregate size and ion solubility [J]. Analytical and Bioanalytical Chemistry, 2010, 396(2): 609-618
A B, et al. Toxicities of nano zinc oxide to five marine organisms: Influences of aggregate size and ion solubility [J]. Analytical and Bioanalytical Chemistry, 2010, 396(2): 609-618
[70] Chen X P, Li V W, Yu R M, et al. Choriogenin mRNA as a sensitive molecular biomarker for estrogenic chemicals in developing brackish medaka (Oryzias melastigma) [J]. Ecotoxicology and Environmental Safety, 2008, 71(1): 200-208
[71] Bo J, Cai L, Xu J H, et al. The marine medaka Oryzias melastigma—A potential marine fish model for innate immune study [J]. Marine Pollution Bulletin, 2011, 63(5-12): 267-276