环境中存在着大量可干扰动物和人体内分泌系统的污染物。这些污染物主要通过作用于核受体超家族中的多种转录因子,产生包括生殖系统损伤、代谢紊乱、神经发育异常等生态和健康危害[1]。作为核受体超家族中的重要成员,孕烷X受体(pregnane X receptor, PXR)在内外源物代谢及机体代谢稳态中发挥着关键作用,且主要表达在肝脏、小肠、胃、肾脏等消化、代谢器官中。PXR蛋白由434个氨基酸组成,主要功能区包括DNA结合区(氨基酸残基41~107)和配体结合区(氨基酸残基141~434)。PXR为Ⅱ型核受体,可在细胞核内与维甲酸X受体(RXR)形成异二聚体[2],其与配体结合后调控下游基因(例如细胞色素酶P450和谷胱甘肽转移酶[3]等关键代谢基因)的转录激活和表达。研究表明,PXR配体结合域可分别容纳多种结构各异的疏水性化合物,典型污染物包括药物类化合物、杀虫剂、类固醇激素和全氟化合物等都能产生PXR激活效应,因此PXR也被认为是一种可监测环境复合污染的生物传感器[4]。最新的研究指出,有机磷酸酯(organophosphate esters, OPEs)阻燃剂磷酸三甲苯(tricresyl phosphate, TCP)、塑化剂邻苯二甲酸二环己酯可分别介由PXR通路导致人肝脏、小鼠小肠等代谢器官的功能异常,进一步揭示了具有PXR活性的环境污染物与非酒精性脂肪肝[5-6]、动脉粥样硬化[7]等多种代谢性疾病发生的潜在关联。因此,开发可检测PXR受体活性的实验方法对于环境污染监测及化学品健康风险评估具有重要意义。
在现有化学物质毒性评估方法体系中,报告基因实验可反映环境内分泌干扰物(EDCs)与核受体作用介导的内源性基因表达变化情况,被美国环境保护局、美国国家卫生研究所等推荐为内分泌干扰效应的标准筛选方法之一[4]。目前,国内外学者已建立若干PXR受体报告基因检测方法,并对环境污染物PXR激活效应开展了研究。例如,Kojima等[8]通过构建基于COS-7细胞的PXR体外细胞报告基因系统,对200种农药的PXR结合活性进行筛查,并发现有机磷农药代谢物比起母体化合物具有更强的受体激活效应。Delfosse等[9-10]基于可稳定表达GAL4-PXR-LBD的HeLa细胞系,发现了顺式氯丹、反式九氯等有机氯农药可与内源性17β-雌二醇协同激活hPXR并诱导下游基因的表达。Creusot等[4]构建了HG5LN-hPXR的体外报告基因系统,发现环境水体样品和沉积物的提取物普遍具有较强的PXR激活效应,并且目前已知的PXR激动剂仅能解释不到1%的生物学活性。上述已有方法建立在基于萤火虫荧光素酶或β-半乳糖苷酶表达的单报告基因实验体系上,需要共转染分别带有受体(或带有受体配体结合域的融合蛋白)和受体反应元件的2种质粒,检测结果也受到细胞转染效率低、受试物毒性等因素的影响[4, 11]。而通过共转染含内参基因的表达质粒,可对不同样品孔的细胞数量及转染效率进行校正,并有效降低检测结果的系统误差。但是现有的PXR受体双报告基因实验需同时转染3种质粒,对细胞转染的实验操作及质粒的稳定表达带来风险[12-14]。另外,现有方法仅关注PXR受体激活活性的检测,而缺乏可同时适用不同结合活性特征(激活、拮抗及协同作用等)的检测手段。因此,有必要进一步开发高灵敏的、稳定的和适用范围广的PXR双荧光素酶报告基因检测方法。
基于此,本文利用重组基因技术,构建了一种新型的人孕烷X受体(human pregnane X receptor, hPXR)双荧光素酶报告基因检测方法,并测试了9种典型的OPEs阻燃剂的hPXR受体结合活性。本研究将为环境污染物的hPXR受体干扰效应筛查及化学品的健康风险评估提供研究手段和科学依据。
1 材料与方法(Materials and methods)
1.1 细胞与质粒
人胚肾细胞HEK 293T源自中国科学院上海生命科学研究院资源中心。E. coli DH5α感受态细胞购于上海生工生物工程技术服务有限公司(以下简称上海生工)。双荧光素酶报告基因载体质粒,包括海肾荧光素酶报告基因pFN26A (BIND) hRluc-neo Flexi和萤火虫荧光素酶报告基因pGL4.35[luc2P/9×GAL4UAS/Hygro] (以下简称GAL4-UAS-Luc),均购于美国Promega公司。
1.2 试剂与仪器
青霉素-链霉素溶液、氨苄西林、DMEM高糖培养基、胎牛血清(fetal bovine serum, FBS)、PBS缓冲液均购于上海泰坦科技股份有限公司(以下简称上海泰坦),胰蛋白酶-EDTA溶液购于美国Sigma-Aldrich公司,PEI 40K转染试剂购于上海懋康生物科技有限公司,无内毒素质粒提取试剂盒购于北京天根生化科技有限公司,二甲基亚砜(DMSO)、双荧光素酶报告基因检测试剂盒购于上海碧云天生物技术有限公司。人PXR受体激动剂利福平(>98%)和SR-12813(98%)分别购于上海泰坦和上海陶术生物科技有限公司,PXR受体拮抗剂酮康唑(>98%)购于上海源叶生物科技有限公司。本研究用于PXR受体结合活性测试的其他标准品包括:顺式氯丹(>98%,Dr. Ehrenstorfer)、17β-雌二醇(99.5%,TargetMol)、9种OPEs包括磷酸三丁酯(TBP)、磷酸三(2-氯乙基)酯(TCEP)、磷酸三(1-氯-2-丙基)酯(TCIPP)、磷酸三(1,3-二氯-2-丙基)酯(TDCIPP)、磷酸三(2-乙基己基)酯(TEHP)、磷酸三(2-丁氧基乙基)酯(TBOEP)、磷酸三苯酯(TPHP)、磷酸三甲苯酯(TCP)纯度均>99%,均购于Dr. Ehrenstorfer;2-乙基己基二苯基磷酸酯(EHDPP),纯度>98%,购于上海源叶。所有待测物均配制成100 mmol·L-1的DMSO储备溶液,储存于-20 ℃,待暴露时稀释使用。本研究用到的主要仪器包括超微量分光光度计和多功能酶标仪,分别购自美国Thermo Scientific公司(型号:NanoDrop 2000C)和美国BioTek公司(型号:Synergy H4)。
1.3 报告基因质粒构建
人孕烷X受体配体结合结构域(hPXR-LBD,Genbank编号NM_003889.4,对应氨基酸序列范围108-434)基因由上海生工合成。构建报告基因质粒时,首先在hPXR-LBD的5’和3’端分别加入限制性内切酶Sgfl和Pmel的识别位点,然后在经Sgfl/Pmel酶消化处理的pFN26A (BIND) hRluc-neo Flexi模板质粒上插入目的基因,最终构建可表达由GAL4蛋白DNA结合结构域(GAL4-DBD)和hPXR-LBD组成的融合蛋白pBIND-hPXR重组质粒。该质粒的启动子下游含有可同时表达海肾荧光素酶(hRluc)的基因片段。将pBIND-hPXR和GAL4-UAS-Luc分别转化至E. coli DH5α感受态细胞进行质粒扩增,使用去内毒素质粒DNA抽提试剂盒提取质粒,通过超微量分光光度计测定质粒的纯度和浓度。利用限制性内切酶(Sgfl/Pmel)对扩增的重组质粒pBIND-hPXR进行消化处理,后经琼脂糖凝胶电泳验证片段长度。同时,对pBIND-hPXR进行DNA序列分析(上海生工),验证质粒构建是否成功。
1.4 双荧光素酶报告基因实验
使用高糖DMEM培养基和10% FBS,将稳定传代>3次的293T细胞以2×104 个·孔-1的密度接种于96孔板中。培养24 h后,待细胞达到60%~80%的汇合度时,使用PEI 40K将pBIND-hPXR和GAL4-UAS-Luc质粒转染至293T细胞内。转染完毕后,继续孵育24 h,将培养液更换为含有DMSO或不同浓度受试物质(9种OPEs等)的新鲜培养基(DMSO最终浓度皆为0.1%),继续孵育24 h。每个化学物质的不同浓度梯度均设置3个生物学平行组。暴露完毕后,根据双荧光素酶报告基因检测试剂盒的操作说明,对每孔样品的萤火虫荧光素酶(Luc)和海肾荧光素酶(hRluc)信号进行测定,计算每孔样品Luc与hRluc信号的比值。对于单次96孔板实验,将样品孔的Luc/hRluc信号值相对于阴性对照(DMSO)孔的信号值进行矫正,结果用于表征化学品诱导激活hPXR受体活性的强弱。采用Prism软件(美国Graphpad公司,版本号8.0.2)对每种受试物质的hPXR受体激活/拮抗活性的剂量-效应曲线进行拟合,选取Hill方程作为拟合模型[15]。此外,各个化学品的logKow值均源自EPA的EPI软件的计算结果。
由于不同批次实验中,2种荧光素酶(Luc和hRluc)信号的绝对值受到细胞量、转染效率、温度和暴露时长等多种实验条件的影响,因此本研究的所有96孔板实验均设置了10 μmol·L-1的利福平阳性对照孔(n=3),并将其信号值设为100%。为了比较不同批次实验中不同化学物质的hPXR受体激活效应能力,计算每个物质不同浓度下相对于阳性物质的活性值(以百分比表示)。通过剂量-效应曲线计算各个物质达到阳性对照激活效应值的20%的对应浓度(20% relative effective concentration, REC20),依据不同物质REC20值的大小比较其对hPXR激活能力。
此外,对双荧光素酶报告基因实验的重复性进行验证。对比了10 μmol·L-1的利福平在同一96孔板内不同样品孔间、不同批次实验间和不同传代次数的293T细胞进行的实验间(5代及20代)的hPXR受体激活效应。采用方差分析检验不同物质、不同暴露浓度与阴性对照(DMSO组)的hPXR受体激活效应差异的显著性,本研究的统计学显著性水平设定为P<0.05。
2 结果与讨论(Results and discussion)
2.1 报告基因质粒的验证
本研究构建的pBIND-hPXR报告基因质粒图谱如图1(a)所示,pBIND-hPXR的理论DNA碱基数为7 692 bp。由hPXR-LBD连接GAL4-DBD构成的融合蛋白序列位于T7启动子的下游。该蛋白与GAL4-UAS-Luc质粒的UAS区结合,进而诱导Luc荧光素酶的转录和表达。pBIND-hPXR质粒转录过程可同时表达hRLuc,因此hRLuc荧光素酶可作为内参对报告基因实验的Luc信号值进行矫正,以克服细胞量、细胞状态等其他因子对融合蛋白调控Luc转录表达的影响[11]。
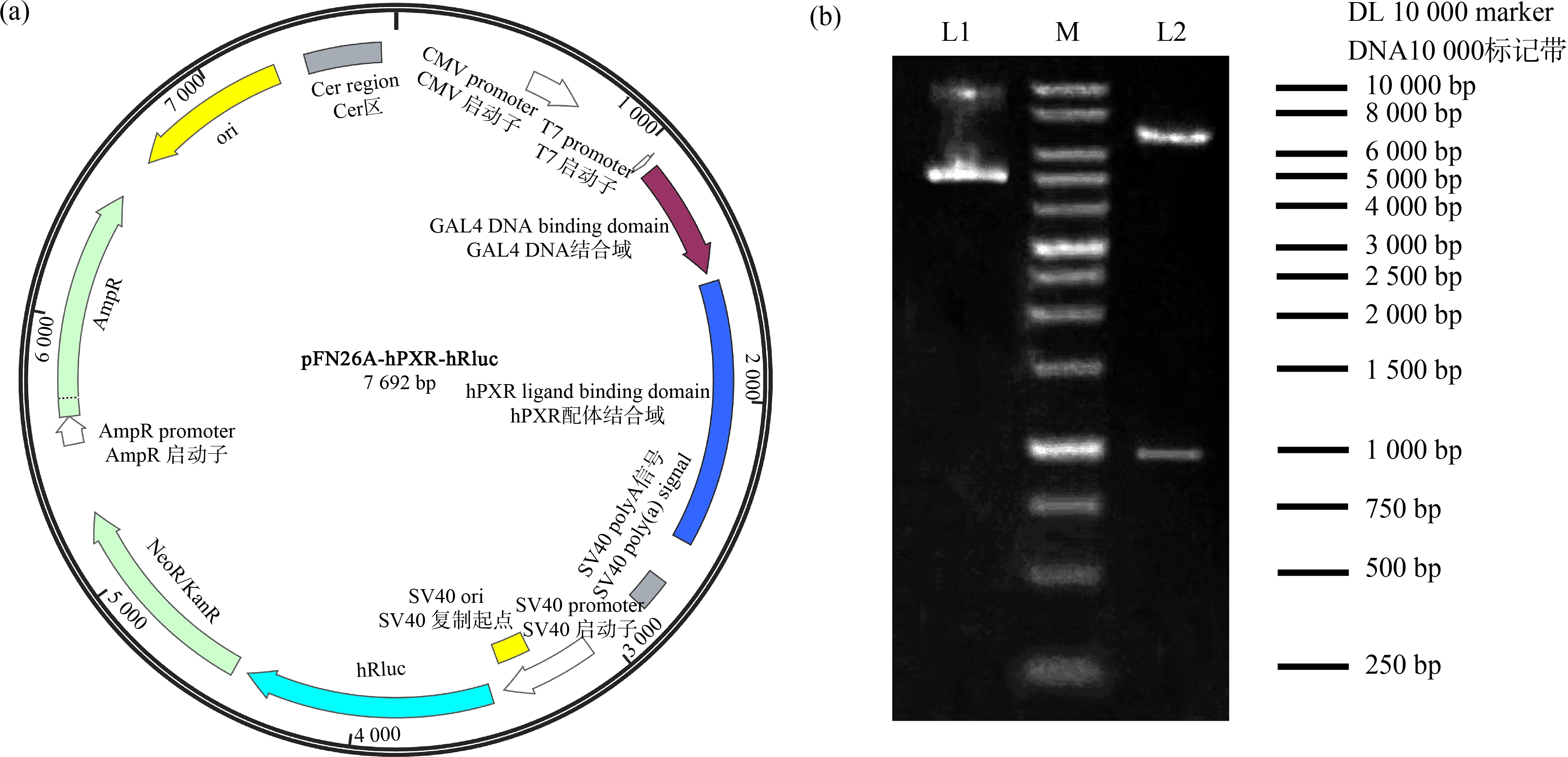
图1 构建的pBIND-hPXR质粒图谱及其结构验证
注:(a) pBIND-hPXR质粒结构图;(b) 重组质粒及其经Sgfl/Pmel消化所得产物的电泳结果图;M和DL为10 000 bp的DNA标记带,L1为重组质粒pBIND-hPXR的电泳结果,L2为重组质粒消化产物的电泳结果。
Fig. 1 Map of the constructed plasmid pBIND-hPXR and its structural validation
Note: (a) The plasmid structure of pBIND-hPXR; (b) Electrophoresis results of the recombinant plasmid and its product digested by Sgfl/Pmel; M and DL represents 10 000 bp DNA marker, L1 represents the electrophoretic result of the recombinant plasmid pBIND-hPXR, and L2 represents the electrophoretic result of the digested recombinant plasmid.
使用限制性内切酶Sgfl/Pmel消化重组质粒,然后进行琼脂糖凝胶电泳试验。如图1(b)所示,泳道L1和L2分别对应为重组质粒及其经Sgfl/Pmel消化所得产物的条带。其中,L1包含了一条代表重组质粒DNA超螺旋结构的强信号条带。L2中上方强条带及下方弱条带分别代表未接入目的基因的载体质粒及hPXR-LBD的DNA线性化片段,其条带位置与理论计算得到的DNA碱基(对)数(分别为6 701和991)一致。进一步对重组质粒pBIND-hPXR进行测序鉴定,结果显示与理论构建的序列匹配度为100%。
2.2 双荧光素酶报告基因方法的建立
2.2.1 方法的测试条件确立
报告基因实验的最终检测信号受质粒转染条件的影响,本实验严格按照转染试剂PEI 40K的说明步骤进行。为了获取最佳转染质粒用量,在转染试剂厂商推荐的最佳质粒总用量(1.0 mg·L-1)范围内,对比研究了增加pBIND-hPXR或GAL4-UAS-Luc的转染量后,293T细胞产生的hPXR激活效应信号强度。由图2(a)可知,在所测试的质粒浓度组成条件中,当pBIND-hPXR和GAL4-UAS-Luc的浓度比为1∶4时,293T细胞呈现出最高的hPXR诱导活性,因此报告基因实验中2种质粒的浓度分别设定为0.2 mg·L-1和0.8 mg·L-1。
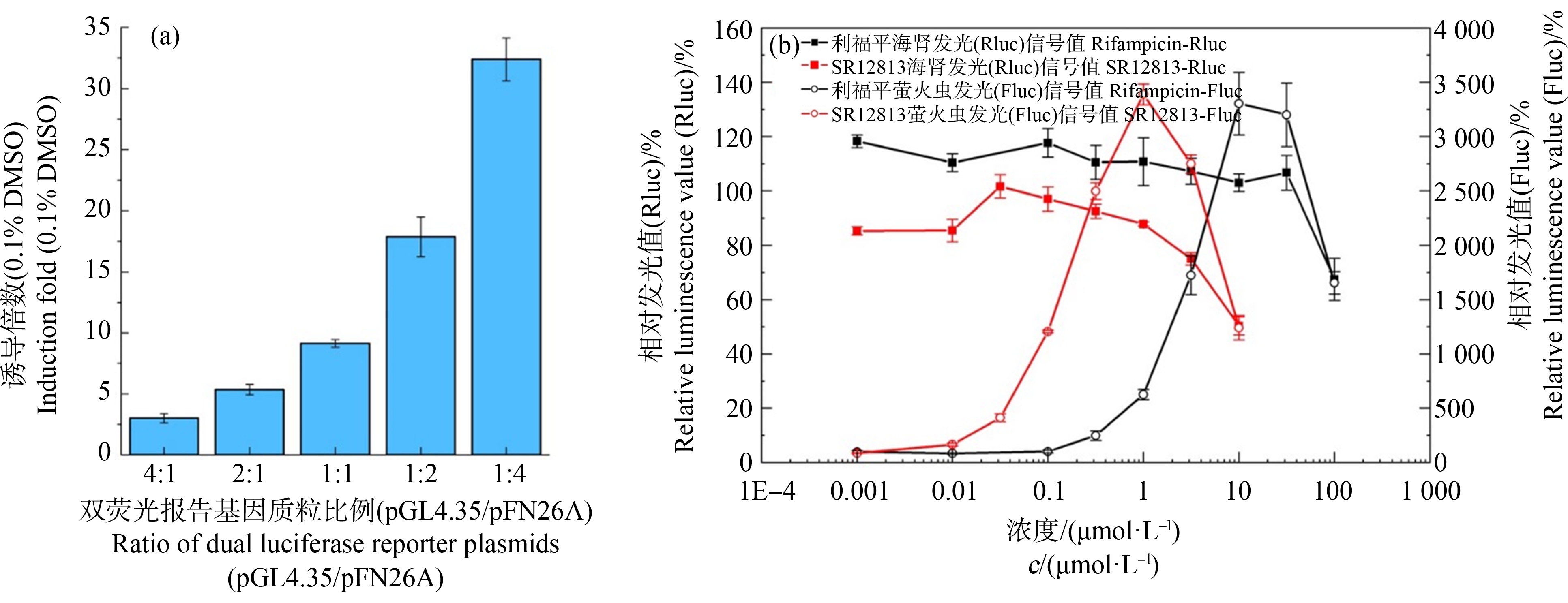
图2 报告基因实验条件的优化
注:(a) 不同质粒浓度条件下的hPXR受体活性诱导倍数;(b) 不同浓度的利福平和SR12813诱导的海肾和萤火虫相对信号值;DMSO表示二甲基亚砜。
Fig. 2 Optimization of the reporter gene assay conditions
Note: (a) Fold induction of hPXR agonistic activity at different plasmid concentrations; (b) Relative signal values of renilla and firefly luciferase induced by different concentrations of rifampicin and SR12813; DMSO stands for dimethyl sulfoxide.
细胞的存活率直接影响基于其体外培养的生物活性检测的最终结果。双荧光素酶方法中的hRluc荧光信号值除了用于矫正细胞量、转染效率、暴露条件等因素对Luc信号的干扰外,还可用于指示受试物质浓度是否对细胞产生毒性作用[16]。本研究分别测试2种已知强hPXR激动剂SR12813和利福平在不同浓度范围内(0.001~10 μmol·L-1和0.001~100 μmol·L-1) Luc和hRluc信号强度的变化趋势,结果如图2(b)所示。当SR12813浓度达到3.16 μmol·L-1,利福平浓度达到100 μmol·L-1时,293T细胞的hRluc信号分别较阴性对照(DMSO)组降低49.7%和32.6%。在类似的报告基因实验方法体系中,hRluc信号值相对阴性对照信号值降低20%以上说明存在细胞毒性[11, 16],因此SR12813(10 μmol·L-1)及利福平(100 μmol·L-1)具有明显的细胞毒性作用。这也与文献报道的SR12813和利福平对LS174T细胞[17](5.5 μmol·L-1)及HepG2细胞(50 μmol·L-1)[18]产生毒性的浓度水平接近。因此,本方法可有效排除因受试物质的毒性作用造成细胞存活率降低,进而干扰荧光信号产生的影响。
2.2.2 方法有效性验证
选取已知的强hPXR受体激动剂利福平和SR12813,分别在其非细胞毒性浓度范围内(利福平:0.001~31.6 μmol·L-1,SR12813:0.001~3.16 μmol·L-1)验证本方法的有效性。由图3(a)可知,利福平与SR12813均呈现典型的S型剂量-效应关系,其EC50值分别为3.27 μmol·L-1和0.18 μmol·L-1。此前,Svecova等[19]构建了基于GAL4-PXR-LBD和VP16-SRC-1-receptor-interacting质粒转染CV-1细胞的hPXR激活实验,测得利福平的EC50值为5.6 μmol·L-1;Xue等[20]建立了基于CV-1细胞转染全长hPXR和CYP3A4-LUC质粒的报告基因方法,测得利福平的EC50值为1.2 μmol·L-1;Creusot等[21]的研究结果显示,人宫颈癌细胞系HG5LN转染全长hPXR和CYP3A4-LUC质粒后,SR12813的EC50值为0.16 μmol·L-1;而Toporova等[22]研究指出,HG5LN细胞转染含GAL4-PXR-LBD融合蛋白的质粒后,SR12813的EC50值为0.15 μmol·L-1。综上,本实验建立的hPXR结合活性检测方法的灵敏度与此前报道的报告基因方法基本一致。
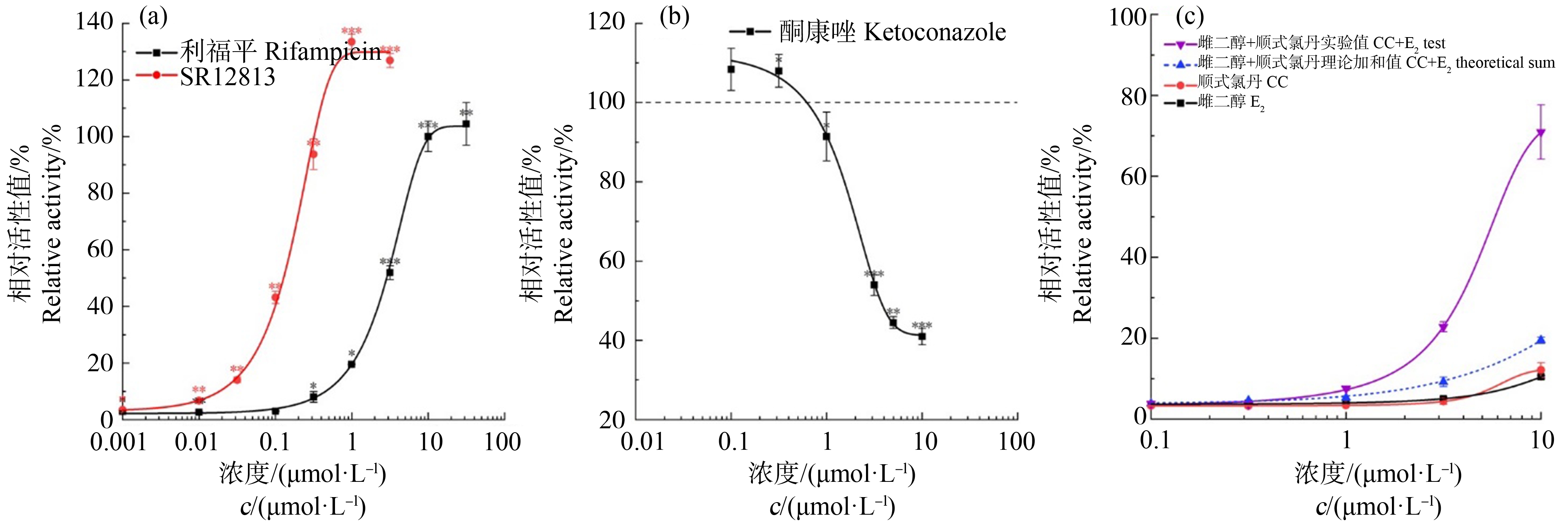
图3 报告基因实验方法的有效性验证
注:(a) 利福平和SR12813的hPXR激活剂量-效应曲线(10 μmol·L-1利福平的响应设为100%的相对活性值);(b) 酮康唑的hPXR拮抗剂量-效应曲线(1 μmol·L-1利福平的响应设为100%的相对活性值);(c) 雌二醇与顺式氯丹共暴露的hPXR剂量-效应曲线,蓝色虚线代表使用Bliss独立模型得到的2种物质激活效应的理论加和曲线(10 μmol·L-1利福平的响应设为100%的相对活性值);*表示P<0.05,**表示P<0.01,***表示P<0.001。
Fig. 3 Validation of the reporter gene assay
Note: (a) hPXR agonistic activity dose-response curves for rifampicin and SR12813 (in relative to the activity of 10 μmol·L-1 rifampicin); (b) hPXR antagonistic activity dose-response curve for ketoconazole (in relative to the activity of 1 μmol·L-1 rifampicin); (c) hPXR dose-response curves for co-exposure of estradiol and cis-chlordane (in relative to the activity of 10 μmol·L-1 rifampicin), the blue dashed line represented the theoretical additive activation curves calculated using the Bliss independent model; *represents P<0.05, **represents P<0.01, ***represents P<0.001.
选取已知的hPXR拮抗剂酮康唑来验证方法用于检测hPXR拮抗作用的适用性。将1 μmol·L-1利福平和不同浓度的酮康唑(0.1~10 μmol·L-1)共暴露于转染后的293T细胞。经过24 h,细胞的荧光素酶信号值与酮康唑浓度呈现标准的拮抗剂量-效应关系(图3(b)),IC50值为3.69 μmol·L-1。此前,Das等[23]采用基于HepG2细胞转染全长hPXR和CYP3A4-LUC质粒的报告基因检测方法,测得酮康唑对利福平(10 μmol·L-1)的拮抗作用IC50值为18.73 μmol·L-1,略高于本方法的研究结果。这可能与2项研究中添加的激动剂初始浓度不同有关[24]。另外,本方法和Das等[23]所使用的细胞种类、培养液组分、转染的质粒和浓度等实验条件也可能对方法的灵敏度差异造成影响。此外,与Das等[23]的单荧光报告基因方法相比,本方法构建的内含海肾荧光素酶基因的hPXR表达质粒,可对不同样品孔的细胞数量及转染效率进行校正,减少细胞转染效率低、受试物毒性等因素对检测结果的影响,降低检测结果的系统误差。
Xue等[20]的研究表明,由于hPXR-LBD具有较大的且结构特殊的配体结合结构域,因此可能同时容纳多种小分子配体,这一点与其他典型的内分泌干扰核受体如雌激素受体(ER)、肝X受体(LXR)等的LBD区显著不同。Delfosse等[10]的研究进一步指出,一些有机氯农药例如顺式氯丹(cis-chlordane, CC)、硫丹(endosulfan, END)和七氯环氧化物(heptachlor endoepoxide, HEP)等可与内源性17β-雌二醇(17β-estradiol, E2)分子协同激活hPXR受体并调控CYP3A4基因的表达。本研究也测试了0.1~10 μmol·L-1浓度范围内的CC和E2共暴露产生的hPXR受体活性作用。由图3(c)可知,293T细胞同时暴露于CC和E2时受到显著的hPXR协同激活作用,例如当CC和E2的浓度达到10 μmol·L-1时,2种物质诱导的相对激活活性值为Bliss独立加和模型计算所得理论值的6.2倍。因此,本方法也适用于检测多种不同小分子配体对hPXR的协同激活作用。此外,相较于Delfosse等[10]所用的5倍重复序列(5×GAL4)的酵母GAL4/UAS系统,本方法使用的9×GAL4系统灵敏度更高,由图3(a)可知,本研究中SR12813在10 nmol·L-1表现出显著的hPXR激活效应,而Delfosse等[10]所用方法下的最低效应浓度为30 nmol·L-1,略高于本研究。
2.2.3 方法重复性分析
以1 μmol·L-1和10 μmol·L-1的利福平分别测试本方法的重复性。其中,同一块96孔板中的3个复孔的信号值变异系数分别为9.57%和8.95%。此外,比较了3次不同实验相同浓度利福平的hPXR激活信号,1 μmol·L-1和10 μmol·L-1利福平信号值的板间变异系数分别为13.97%和10.31%。因此,本方法的实验系统误差较小,测试结果稳定。此外,对比了不同传代次数的293T细胞(5代及20代)经利福平暴露后的信号响应灵敏度,结果显示利用5代及20代的细胞测试所得的利福平REC20分别为(1.19±0.12) μmol·L-1和(1.31±0.22) μmol·L-1,二者无显著差异(P>0.05),说明基于不同批次293T细胞的测试结果具有较好的可重现性。另外,与Kojima等[13]同时转染3种质粒(包括内参质粒)的双荧光报告基因方法相比,本方法基于酵母GAL4/UAS系统构建含有海肾荧光素酶内参基因的双质粒系统,在操作便捷性及质粒转染的稳定性上更具优势。
2.3 有机磷酸酯阻燃剂的hPXR受体活性检测
本研究测试了9种典型的OPEs阻燃剂,包括3种烷基(TBP、TEHP和TBOEP)、3种卤代(TCEP、TCIPP和TDCIPP)、3种芳基OPEs (TPHP、EHDPP和TCP)的hPXR受体结合活性。为了排除受试物的细胞毒性对其活性测试结果的影响,根据hRluc信号值相对阴性对照(DMSO)信号值的衰减程度确定不同受试物的有效测试(衰减<20%)浓度范围[16]。由图4可知,在测试浓度范围内,除TCEP外的其他8种OPEs均产生不同程度的hPXR受体激动效应。其中,3种芳基OPEs均在较低测试浓度(≤1 μmol·L-1)产生显著的hPXR激活活性,且最大激活效应值达到或接近10 μmol·L-1利福平产生的效应值。进一步对比9种OPEs的hPXR激活能力,根据剂量-效应曲线分别计算不同物质的REC20值。如表1所示,按REC20由低到高排序依次为TCP、EHDPP、TDCIPP、TEHP、TPhP、TBOEP、TCIPP、TBP,其中,TCP(REC20为(0.92±0.11) μmol·L-1)表现出比利福平(REC20为(1.19±0.12) μmol·L-1)更强的受体激活活性(P<0.05)。
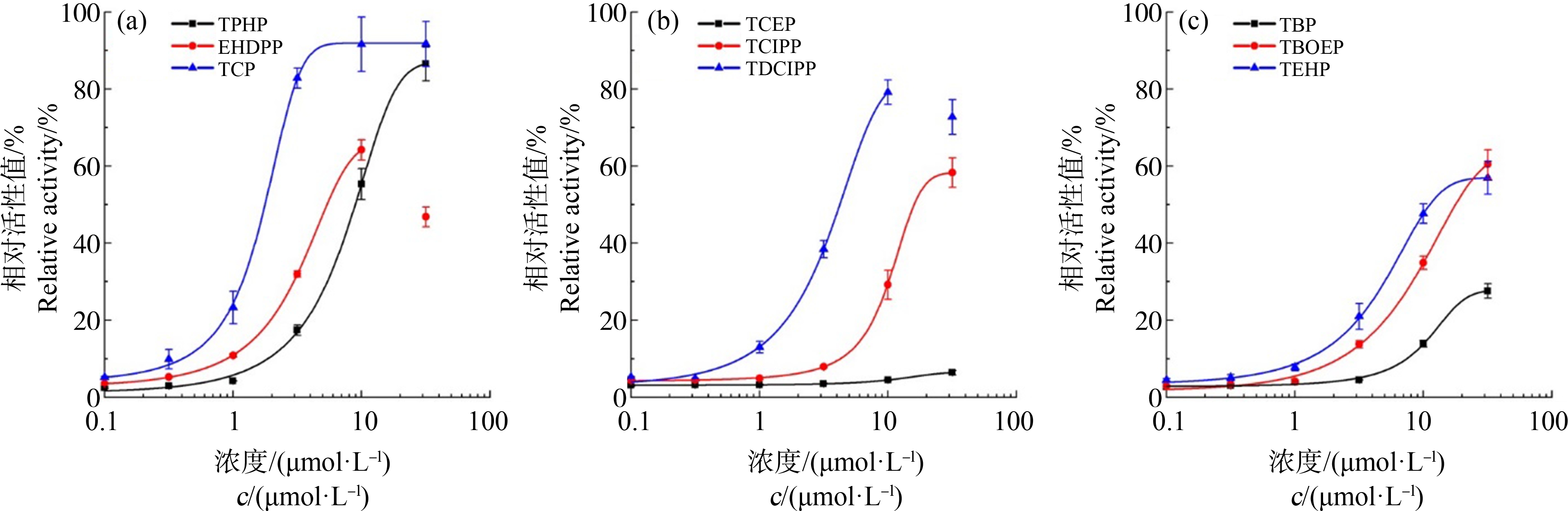
图4 9种典型有机磷阻燃剂(OPEs)的hPXR激活效应
注:(a) 3种芳基OPEs的hPXR活性剂量-效应曲线;(b) 3种卤代OPEs的hPXR活性剂量-效应曲线;(c) 3种烷基OPEs的hPXR活性剂量-效应曲线;其中EHDPP和TDCIPP在31.6 μmol·L-1相对活性值较其10 μmol·L-1的活性值均显著下降(P<0.05),因此剂量效应曲线拟合时不包含该浓度点数据。
Fig. 4 Dose-response curves for hPXR agonistic activities of nine typical organic phosphate esters (OPEs)
Note: (a) Three aryl OPEs, (b) Three halogenated OPEs and (c) three alkyl OPEs; the relative activity values of EHDPP and TDCIPP at 31.6 μmol·L-1 were significantly lower (P<0.05) than their corresponding activity values at 10 μmol·L-1, so the data at this concentration point were excluded from the dose-effect curve fitting.
表1 有机磷酸酯等物质的正辛醇-水分配系数及其诱导hPXR产生20%最大效应的浓度值(REC20)
Table 1 Octanol-water partition coefficients and 20% relative effective concentration (REC20) values of the organophosphates
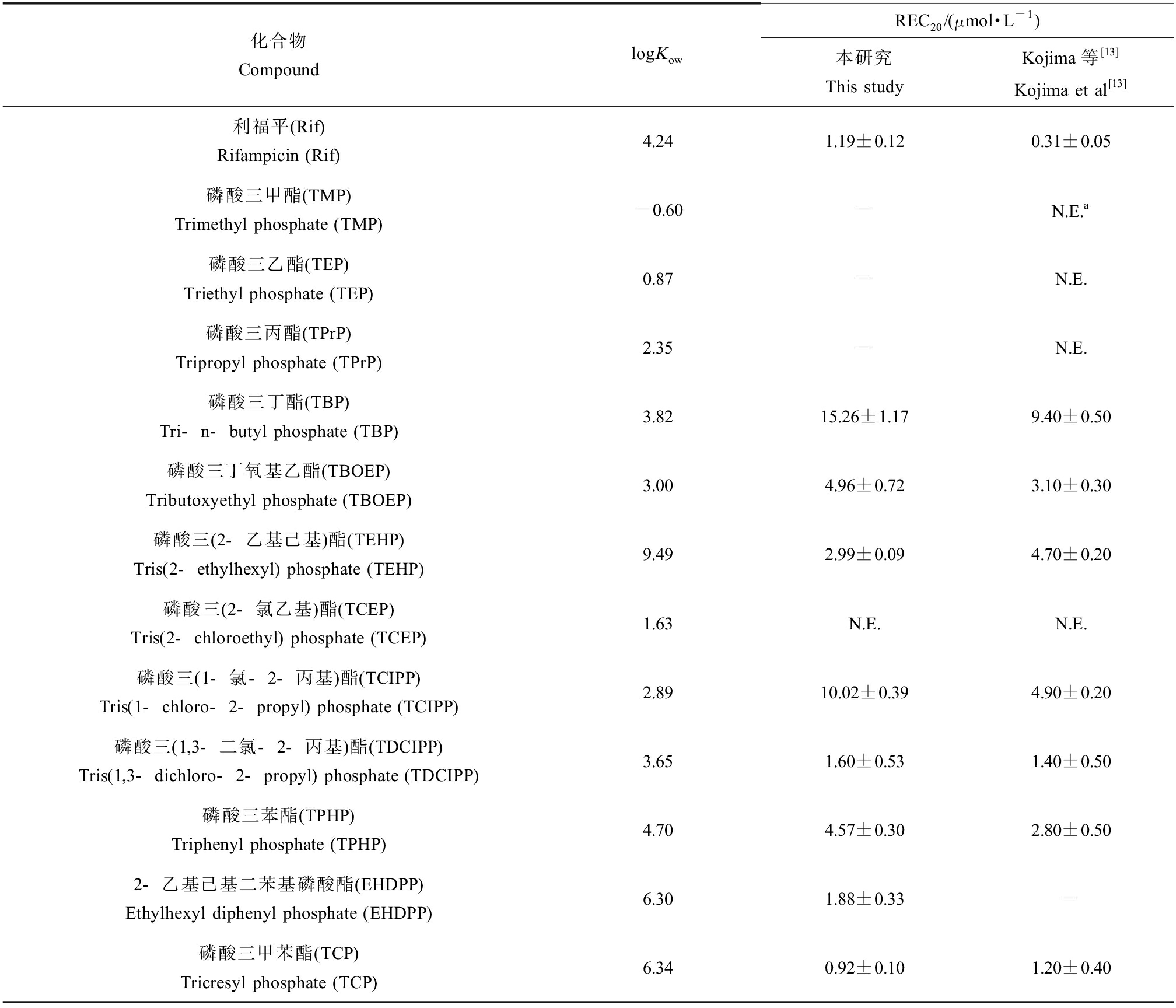
化合物CompoundlogKowREC20/(μmol·L-1)本研究This studyKojima等[13]Kojima et al[13]利福平(Rif)Rifampicin (Rif)4.241.19±0.120.31±0.05磷酸三甲酯(TMP)Trimethyl phosphate (TMP)-0.60-N.E.a磷酸三乙酯(TEP)Triethyl phosphate (TEP)0.87-N.E.磷酸三丙酯(TPrP)Tripropyl phosphate (TPrP)2.35-N.E.磷酸三丁酯(TBP)Tri-n-butyl phosphate (TBP)3.8215.26±1.179.40±0.50磷酸三丁氧基乙酯(TBOEP)Tributoxyethyl phosphate (TBOEP)3.004.96±0.723.10±0.30磷酸三(2-乙基己基)酯(TEHP)Tris(2-ethylhexyl) phosphate (TEHP)9.492.99±0.094.70±0.20磷酸三(2-氯乙基)酯(TCEP)Tris(2-chloroethyl) phosphate (TCEP)1.63N.E.N.E.磷酸三(1-氯-2-丙基)酯(TCIPP)Tris(1-chloro-2-propyl) phosphate (TCIPP)2.8910.02±0.394.90±0.20磷酸三(1,3-二氯-2-丙基)酯(TDCIPP)Tris(1,3-dichloro-2-propyl) phosphate (TDCIPP)3.651.60±0.531.40±0.50磷酸三苯酯(TPHP)Triphenyl phosphate (TPHP)4.704.57±0.302.80±0.502-乙基己基二苯基磷酸酯(EHDPP)Ethylhexyl diphenyl phosphate (EHDPP)6.301.88±0.33-磷酸三甲苯酯(TCP)Tricresyl phosphate (TCP)6.340.92±0.101.20±0.40
注:a无影响(N.E.),REC20>31.6 μmol·L-1。
Note: a No effect (N.E.), REC20>31.6 μmol·L-1.
此前,Kojima等[13]采用报告基因方法对11种常见OPEs(包含本研究测试的8种物质TCP、TDCIPP、TEHP、TPhP、TBOEP、TCIPP、TBP和TECP)的hPXR激活效应进行了检测,发现TECP不能产生hPXR激活效应,而其他7种OPEs均表现出不同程度的hPXR受体激活活性,与本方法研究结果一致。此外,本研究和Kojima等[13]测得的7种物质的REC20值呈显著线性正相关关系(r=0.92,P<0.05),该结果也验证了本方法的可靠性。进一步对比发现,Kojima等[13]报道的TCIPP、TBP的REC20值低于本研究方法的对应数值,而TEHP的REC20值要高于本研究结果。由于Kojima等[13]和本方法分别采用猿猴肾细胞系COS-7和人胚肾细胞系HEK 293T进行转染,因此不同OPEs穿透2种细胞膜进入胞内与靶标蛋白结合的能力可能存在差异。另外,2种方法分别基于全长hPXR/CYP3A4基因上游的hPXR应答元件和酵母GAL4/UAS系统,2种转录调控系统分别要求不同的共激活子,这也可能造成2种实验体系中不同物质的REC20值存在差异。
除了受转染细胞及转录调控系统的影响,物质结构及理化性质也是决定其能否诱导hPXR产生活性的关键因素。Li等[25]评估了全氟烷基羧酸类物质(perfluoroalkyl carboxylic acids, PFCAs)对过氧化物酶体增殖剂激活受体γ(PPARγ)的激活作用,发现PFCAs的疏水性直接影响胞内的污染物质浓度进而影响报告基因实验的荧光信号值。与核受体家族其他成员相比,PXR具有更大的疏水配体结合域以及多种类型的配体结合位点,因此能结合多种结构各异的疏水性物质[26-27]。本研究进一步将8种可激活hPXR的OPEs的REC20和其辛醇水分配系数(logKow)进行回归分析,结果如图5所示,二者呈现显著的线性负相关关系(r=-0.47,P<0.05)。此外,结合本研究和Kojima等[13]的研究结果分析可知,一些logKow值较低的OPEs类物质,例如TMP(-0.65)、TEP(0.8)、TPrP(2.35)和TCEP(1.63)都不能产生hPXR激活活性。上述结果表明疏水性是决定OPEs类物质诱导激活PXR受体的关键因素之一。除了疏水性外,物质的极性官能团或者特殊结构也影响其与受体蛋白的相互作用[25]。例如,Zhang等[28]研究了不同链长的PFCAs与PPARγ的亲和力,发现当总碳数从4增加到11,物质与PPARγ的亲和力逐渐增加,但随着碳原子数继续增加,PFCAs与PPARγ蛋白的亲和力逐渐降低。虽然hPXR配体被认为缺乏结构特异性,但是本研究中的芳基化合物比卤代和烷基取代的OPEs具有更强的hPXR激活作用,这可能与hPXR-LBD特有的强疏水性芳香牢笼与外源性配体芳环结构的π-π电子云堆叠相关[10]。
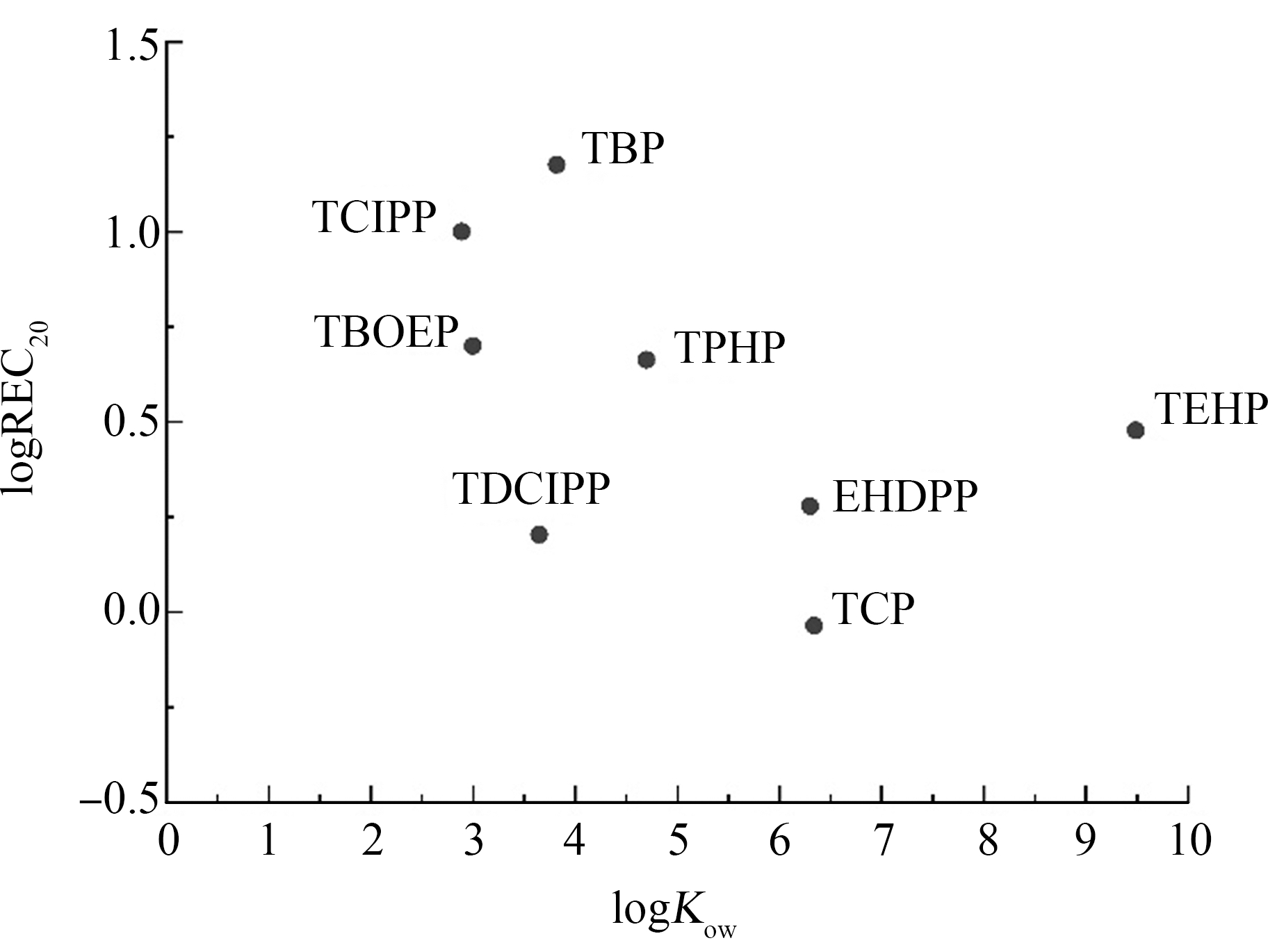
图5 OPEs的正辛醇-水分配系数与logREC20的相关性
Fig. 5 Correlation of octanol-water partition coefficients of OPEs with logREC20
本研究首次发现一种典型的芳基类OPEs,即EHDPP具有较强的hPXR激活效应,其REC20值和利福平相近。作为一种广泛使用的芳基阻燃剂类物质,EHDPP在灰尘、食品、空气和饮用水等多种环境介质中大量检出[29-31]。此前的研究指出,EHDPP能与ER、AR、LXRα/β、PPARγ和IGF1R[32]等多种核受体或转录因子作用,诱导包括青鳉鱼雌雄同体[33]、胎盘发育受损[34]、巨噬细胞泡沫化[35]和肝脏脂肪变性[6]等多种毒理健康效应。本研究则表明,EHDPP在较低浓度水平(316 nmol·L-1)即可产生显著的hPXR激活效应,而该浓度仅略高于我国华东某地人群血液中所检出的EHDPP最高浓度(80 nmol·L-1)[36]。此外,以EHDPP为代表的芳基类OPEs普遍具有较强的hPXR激活效应,因此可能会对异生物质(如药物)的体内代谢[37]以及胆固醇的肠道吸收和转运过程[38]等产生影响。因此,有必要进一步研究EHDPP及其他芳基类OPEs通过PXR受体通路产生的毒理效应和健康风险。
最后,PXR作为一种典型的Ⅱ型核受体,需与维甲酸X受体(RXR)在细胞核内形成异二聚体进而调控PXR通路基因的表达。由于PXR-RXR复合物是一种许可型异二聚体,因此除与PXR配体相互作用外,其也能被RXR配体激活。例如,典型的RXR配体三丁基锡(TBT)可单独激活PXR-RXR复合物,而TBT在PXR配体共存时可与其产生明显的协同激活效应[10]。本研究所建立的方法仅关注受试物质与hPXR单体的结合活性,因此在评价化学品的hPXR通路干扰效应时,仍需结合其他实验手段综合评判受试物质与PXR-RXR二聚体的相互作用及影响。
综上,本研究通过构建内含海肾荧光素酶基因的受体重组表达质粒(pBIND-hPXR),与荧光素酶报告基因质粒(GAL4-UAS-Luc)共转染至HEK 293T细胞,最终成功建立了一种可筛查化学品hPXR激动/拮抗作用的双荧光素酶报告基因检测方法。经过对质粒转染条件的优化和检测浓度范围的验证,该方法具有灵敏度高、适用范围广和重复性好等特点。应用该方法检测9种OPEs的hPXR激活效应,其中芳基类OPEs表现出比氯代和烷基类OPEs更强的hPXR激活活性,并且TCP和EHDPP的最低效应浓度及最大激活效应值和已知hPXR强激动剂利福平相当。本文建立的双荧光素酶报告基因方法为研究化学品对hPXR信号通路的扰动作用提供了重要工具,也可为开发新污染物对其他核受体的激动/拮抗作用提供参考。
[1] Gronemeyer H, Gustafsson J Å, Laudet V. Principles for modulation of the nuclear receptor superfamily [J]. Nature Reviews Drug Discovery, 2004, 3(11): 950-964
[2] Tata J R. Signalling through nuclear receptors [J]. Nature Reviews Molecular Cell Biology, 2002, 3(9): 702-710
[3] Kliewer S A. The nuclear pregnane X receptor regulates xenobiotic detoxification [J]. The Journal of Nutrition, 2003, 133(7): 2444S-2447S
[4] Creusot N, Kinani S, Balaguer P, et al. Evaluation of an hPXR reporter gene assay for the detection of aquatic emerging pollutants: Screening of chemicals and application to water samples [J]. Analytical and Bioanalytical Chemistry, 2010, 396(2): 569-583
[5] Xiang D D, Wang Q W. PXR-mediated organophorous flame retardant tricresyl phosphate effects on lipid homeostasis [J]. Chemosphere, 2021, 284: 131250
[6] Negi C K, Bajard L, Kohoutek J, et al. An adverse outcome pathway based in vitro characterization of novel flame retardants-induced hepatic steatosis [J]. Environmental Pollution, 2021, 289: 117855
[7] Liu J W, Hernandez R, Li X C, et al. Pregnane X receptor mediates atherosclerosis induced by dicyclohexyl phthalate in LDL receptor-deficient mice [J]. Cells, 2022, 11(7): 1125
[8] Kojima H, Sata F, Takeuchi S, et al. Comparative study of human and mouse pregnane X receptor agonistic activity in 200 pesticides using in vitro reporter gene assays [J]. Toxicology, 2011, 280(3): 77-87
[9] Delfosse V, Dendele B, Huet T, et al. Synergistic activation of human pregnane X receptor by binary cocktails of pharmaceutical and environmental compounds [J]. Nature Communications, 2015, 6: 8089
[10] Delfosse V, Huet T, Harrus D, et al. Mechanistic insights into the synergistic activation of the RXR-PXR heterodimer by endocrine disruptor mixtures [J]. Proceedings of the National Academy of Sciences of the United States of America, 2021, 118(1): e2020551118
[11] Paguio A, Stecha P, Wood K V, et al. Improved dual-luciferase reporter assays for nuclear receptors [J]. Current Chemical Genomics, 2010, 4: 43-49
[12] Sui Y P, Ai N, Park S H, et al. Bisphenol A and its analogues activate human pregnane X receptor [J]. Environmental Health Perspectives, 2012, 120(3): 399-405
[13] Kojima H, Takeuchi S, Itoh T, et al. In vitro endocrine disruption potential of organophosphate flame retardants via human nuclear receptors [J]. Toxicology, 2013, 314(1): 76-83
[14] 冯帆, 张帆, 司文, 等. 孕烷X受体应答元件萤光素酶报告基因的构建及活性检测[J]. 解放军医学院学报, 2015, 36(2): 166-170
Feng F, Zhang F, Si W, et al. Construction of pregnane X receptor response elements (ER6 and DR3) luciferase reporter and its transcription activity [J]. Academic Journal of Chinese PLA Medical School, 2015, 36(2): 166-170 (in Chinese)
[15] Finlay D B, Duffull S B, Glass M. 100 years of modelling ligand-receptor binding and response: A focus on GPCRs [J]. British Journal of Pharmacology, 2020, 177(7): 1472-1484
[16] Nilles J, Weiss J, Haefeli W E, et al. How to avoid misinterpretation of dual reporter gene assay data affected by cell damage [J]. Archives of Toxicology, 2022, 96(9): 2501-2510
[17] Creusot N, Gassiot M, Alaterre E, et al. The anti-cancer drug dabrafenib is a potent activator of the human pregnane X receptor [J]. Cells, 2020, 9(7): 1641
[18] Nasser V M, Mahmoud R J. Differential toxicity of rifampcin on HepG2 and Hep2 cells using MTT test and electron microscope [J]. Pharmacologyonline, 2007, 3: 405-413
[19] Svecova L, Vrzal R, Burysek L, et al. Azole antimycotics differentially affect rifampicin-induced pregnane X receptor-mediated CYP3A4 gene expression [J]. Drug Metabolism and Disposition: The Biological Fate of Chemicals, 2008, 36(2): 339-348
[20] Xue Y, Moore L B, Orans J, et al. Crystal structure of the pregnane X receptor-estradiol complex provides insights into endobiotic recognition [J]. Molecular Endocrinology, 2007, 21(5): 1028-1038
[21] Creusot N, Garoche C, Grimaldi M, et al. A comparative study of human and zebrafish pregnane X receptor activities of pesticides and steroids using in vitro reporter gene assays [J]. Frontiers in Endocrinology, 2021, 12: 665521
[22] Toporova L, Grimaldi M, Boulahtouf A, et al. Assessing the selectivity of FXR, LXRs, CAR, and RORγ pharmaceutical ligands with reporter cell lines [J]. Frontiers in Pharmacology, 2020, 11: 1122
[23] Das B C, Madhukumar A V, Anguiano J, et al. Synthesis of novel ketoconazole derivatives as inhibitors of the human pregnane X receptor (PXR; NR1I2; also termed SXR, PAR) [J]. Bioorganic &Medicinal Chemistry Letters, 2008, 18(14): 3974-3977
[24] Neale P A, Leusch F D L. Considerations when assessing antagonism in vitro: Why standardizing the agonist concentration matters [J]. Chemosphere, 2015, 135: 20-23
[25] Li C H, Shi Y L, Li M J, et al. Receptor-bound perfluoroalkyl carboxylic acids dictate their activity on human and mouse peroxisome proliferator-activated receptor γ [J]. Environmental Science &Technology, 2020, 54(15): 9529-9536
[26] Watkins R E, Wisely G B, Moore L B, et al. The human nuclear xenobiotic receptor PXR: Structural determinants of directed promiscuity [J]. Science, 2001, 292(5525): 2329-2333
[27] Kliewer S A, Goodwin B, Willson T M. The nuclear pregnane X receptor: A key regulator of xenobiotic metabolism [J]. Endocrine Reviews, 2002, 23(5): 687-702
[28] Zhang L Y, Ren X M, Wan B, et al. Structure-dependent binding and activation of perfluorinated compounds on human peroxisome proliferator-activated receptor γ [J]. Toxicology and Applied Pharmacology, 2014, 279(3): 275-283
[29] Wong F, Suzuki G, Michinaka C, et al. Dioxin-like activities, halogenated flame retardants, organophosphate esters and chlorinated paraffins in dust from Australia, the United Kingdom, Canada, Sweden and China [J]. Chemosphere, 2017, 168: 1248-1256
[30] Tang B, Christia C, Malarvannan G, et al. Legacy and emerging organophosphorus flame retardants and plasticizers in indoor microenvironments from Guangzhou, South China [J]. Environment International, 2020, 143: 105972
[31] Poma G, Glynn A, Malarvannan G, et al. Dietary intake of phosphorus flame retardants (PFRs) using Swedish food market basket estimations [J]. Food and Chemical Toxicology: An International Journal Published for the British Industrial Biological Research Association, 2017, 100: 1-7
[32] Xu C K, Ma H J, Gao F M, et al. Screening of organophosphate flame retardants with placentation-disrupting effects in human trophoblast organoid model and characterization of adverse pregnancy outcomes in mice [J]. Environmental Health Perspectives, 2022, 130(5): 57002
[33] Li Y, Kang Q Y, Chen R C, et al. 2-ethylhexyl diphenyl phosphate and its hydroxylated metabolites are anti-androgenic and cause adverse reproductive outcomes in male Japanese medaka (Oryzias latipes) [J]. Environmental Science &Technology, 2020, 54(14): 8919-8925
[34] Hu W X, Gao F M, Zhang H, et al. Activation of peroxisome proliferator-activated receptor gamma and disruption of progesterone synthesis of 2-ethylhexyl diphenyl phosphate in human placental choriocarcinoma cells: Comparison with triphenyl phosphate [J]. Environmental Science &Technology, 2017, 51(7): 4061-4068
[35] Hu W X, Jia Y T, Kang Q Y, et al. Screening of house dust from Chinese homes for chemicals with liver X receptors binding activities and characterization of atherosclerotic activity using an in vitro macrophage cell line and ApoE-/- mice [J]. Environmental Health Perspectives, 2019, 127(11): 117003
[36] Ya M L, Yu N Y, Zhang Y Y, et al. Biomonitoring of organophosphate triesters and diesters in human blood in Jiangsu Province, Eastern China: Occurrences, associations, and suspect screening of novel metabolites [J]. Environment International, 2019, 131: 105056
[37] Gao J, Xie W. Targeting xenobiotic receptors PXR and CAR for metabolic diseases [J]. Trends in Pharmacological Sciences, 2012, 33(10): 552-558
[38] Sui Y P, Helsley R N, Park S H, et al. Intestinal pregnane X receptor links xenobiotic exposure and hypercholesterolemia [J]. Molecular Endocrinology, 2015, 29(5): 765-776