近年来,我国快速扩张的经济发展导致能量消耗增高、空气污染物排放超标等环境问题,石油和煤炭燃烧的固定源排放是大气颗粒物PM2.5的主要排放来源[1]。研究已证实,空气直径<2.5 μm的大气颗粒物PM2.5严重危害人体健康[2],其直径小但是相对表面积大,可以携带很多种有毒物质,如多环芳烃(polycyclic aromatic hydrocarbons, PAHs)、重金属等。此外,PM2.5可以通过上呼吸道到达肺泡支气管[2],进而损伤肺泡和呼吸道上皮细胞,并且可以通过血管上皮细胞扩散入血液系统,从而影响机体组织和器官的正常生理功能[3]。目前,PM2.5导致机体损伤的作用机制还不是很清楚,相关毒理学机制的研究还处于探索阶段。尽管诸多机制被认为是PM2.5介导细胞损伤的原因,但是关于PM2.5介导组织损伤的早期分子事件的相关研究较少。
代谢组学方法广泛用于评估和识别暴露-疾病连续体中早期分子事件,为评估生物体的健康风险提供了更准确的信息[4]。代谢组可定义为一套完整的低分子量化合物(<2 000 Da),它们在生物系统的代谢途径和细胞过程中发挥重要作用[5]。传统意义上,代谢组学的研究目的是识别疾病诊断和预测中的生物标志物。然而,代谢组学的价值已经从一个简单的生物标志物识别工具重新定义为一个发现生物代谢过程中活跃驱动因素和因子的技术方法[6]。由于机体微小变化会导致代谢物水平的巨大变化,因此,代谢组可以敏锐地捕捉到机体器官和组织的代谢物差异,最真实地反映系统生物的生理和病理状态[7]。同时,采用外周液体,如血浆或尿液,进行代谢组学分析,使其成为研究各种暴露物毒性影响的一种有效方法[8]。
代谢组学的工作流程一般分为:样本收集、样本准备、样本分析、数据处理、标志物发掘以及通路揭示。关于样本检测方面,气相色谱-质谱(gas chromatography-mass spectrometer, GC-MS)、液相色谱-质谱(liquid chromatography-mass spectrometer, LC-MS)和核磁共振(nuclear magnetic resonance, NMR)是样本检测的主要技术方法[8]。其中,NMR拥有较好的可重复性以及样品处理的便利性。NMR工作原理是基于一些受到外部磁场影响的原子核吸收能量和再发射能量的过程,并且对分子无破坏性[6],同时提供了在大范围或时间尺度内的分子和内部动力学的详细信息[9]。相比之下,LC-MS与GC-MS拥有较高的分辨率,但样本需要量更多,可重复性低[6]。
目前,大气颗粒物PM2.5诱导机体损伤进展中,基于代谢组学的暴露研究对象多为实验动物,暴露研究的器官或组织多集中在肺与血液[10-18],而其他器官(如肝脏、大脑等)的代谢组学研究相对较少。此外,对于易于收集的人体样品(如血液、尿液),也会考虑自然暴露于PM2.5的人群,因而拥有更强的研究代表性。同时,也有研究者创新性地选取肝肠循环芯片[12]开展体外暴露的代谢组学研究,以便于排除机体混杂因素,更加精确地揭示局部器官代谢物的变化。综合代谢组学的研究分析发现,PM2.5暴露引起机体代谢组改变的主要途径包括TCA循环、氨基酸代谢、脂代谢、核苷酸代谢、多环芳烃代谢[10-25]。
本文综述了大气颗粒物PM2.5诱导机体损伤进展中的代谢组学研究,进一步从研究对象、PM2.5暴露方式和剂量、研究组织或器官、代谢组学分析仪器、代谢物和代谢通路等方面进行阐述,为PM2.5暴露毒理学研究提供了一定的理论支撑。
1 研究介绍(Study introduction)
1.1 以肺为研究材料
关于PM2.5暴露后肺组织的代谢组学的研究中,Ran等[10]采用雌性BALB/c小鼠作为实验对象,每天8 h吸入PM2.5(69.1±3.7) μg·m-3,暴露8周后收集小鼠支气管肺泡灌洗液,采用NMR方法进行代谢物学检测和分析。结果表明,PM2.5实验组小鼠的胆碱、氧化三甲胺、肌酸、甜菜碱、柠檬酸、丙酮酸和谷氨酰胺水平显著低于实验对照组。Li和Lin[11]选取C57BL/6J小鼠作为实验对象,每天连续6 h吸入PM2.5(100 μg·m-3),每周暴露5 d,持续暴露1个月。处死小鼠后,裂解肺组织,离心后取上清液,使用超高效液相色谱-飞行时间质谱仪(UPLC-Q-TOF-MS)进行代谢物的检测。分析结果表明,暴露组代谢产物中变化最大的前5种代谢物为溶血磷脂酰胆碱、鞘氨醇、硫糖脂、葡萄糖基神经酰胺、硫糖脂。Li等[12]以雄性C57BL/6N小鼠为实验对象,按照PM2.5浓度不同,分为对照组(PBS缓冲液)、低(180 μg·m-3 PM2.5)、中(540 μg·m-3 PM2.5)、高(1 620 μg·m-3 PM2.5)暴露组,于实验开始后的第1、4、7天进行气管滴注PM2.5或PBS溶液。实验结束后取肺组织裂解液,采用超高效液相色谱-质谱仪(UPLC-MS)进行代谢物差异分析。结果显示,在PM2.5暴露组中,TCA循环、乙醛酸和二羧酸代谢、丙酮酸代谢、核苷酸代谢、支链氨基酸代谢发生显著变化。Wang等[13]采用雄性SD大鼠作为研究对象,气管内灌注500 μg·m-3 PM2.5(每天平均0.05 mg),每周一次进行3个月。将肺裂解液加入UPLC-MS中进行检测,结果显示,上调簇包括甘油三酯(triglyceride, TGs)、溶血磷脂磷脂酰甘油(lysophosphatidylglycerol, LysoPG)、氨基酸和核苷酸衍生物,下调簇包括鞘磷脂(sphingomyelin, SM)、磷脂酰胆碱(phosphatidylcholine, PC)、磷脂酰甘油(phosphatidylglycerol, PG)和胆固醇。进一步分析差异性代谢途径表明,甘油磷脂代谢、嘌呤代谢和鞘脂代谢是改变最明显的代谢物途径。史纯珍等[14]以雄性ICR小鼠为研究对象,设置对照组(生理盐水)、低剂量组(7.5 g·L-1 PM2.5)、中剂量组(20 g·L-1 PM2.5)、高剂量组(37.5 g·L-1 PM2.5),采用鼻腔滴入方式,每天以每只60 μL剂量滴注一次,连续滴注3 d。取肺裂解液后,采样GC-MS方法进行代谢物检测,结果表明PM2.5暴露后丙氨酸、缬氨酸、亮氨酸、鸟氨酸的相对浓度减少,支链氨基酸代谢紊乱;延胡索酸浓度下降,柠檬酸先增加后减少,TCA循环受到影响。体外研究中,Huang等[4]将50 μg·mL-1 PM2.5孵育A549细胞24 h后,取细胞裂解液。采样NMR方法检测细胞代谢物水平差异发现,丙氨酸、缬氨酸、乳酸、ω-6脂肪酸和柠檬酸水平上调,伽马氨基丁酸、醋酸、亮氨酸、异亮氨酸、葡萄糖、赖氨酸和二甲基甘氨酸水平下调,提示氨基酸、能量和核苷酸代谢途径受到干扰。
1.2 以血液为研究材料
PM2.5暴露后,不少研究者采以血液为研究对象,开展了大量的代谢组学研究。Chu等[15]于中国南京医科大学江宁校区招募大学生志愿者,2015年11月至2016年9月每季度进行2次血液抽样,结束后随机选取一部分实验对象于2016年12月17日至2017年1月7日加入空气净化器开展对照实验研究。期间暴露组实验对象自然暴露于大气环境中,PM2.5最高浓度为191 μg·m-3,均值为53 μg·m-3。进一步采用UHPLC-Q-TOF-MS方法开展血液代谢物检测,与室内空气净化器组进行比较,结果表明,血浆中LysoPC、胆碱、1,3-二苯基蛋白-2-烯-1-酮、LysoPC(P-20:0)和LysoPC(P-18:1(9z))水平显著升高。Gao等[16]于美国马萨诸塞州昆西市招募焊接工人,进行焊接培训,焊接区的日平均PM2.5为421 μg·m-3,非焊接区PM2.5日平均水平为120 μg·m-3,每天进行6 h的焊接培训,于早中晚取血液样品。后采用LC-MS进行代谢物检测,显示PM2.5的暴露影响1-磷酸鞘氨醇(sphingosine 1-phosphate, S1P)、1-磷酸二氢神经鞘氨醇(sphinganine 1-phosphate, SA1P)、鞘氨醇的昼夜节律。
Ran等[10]选取4~5周龄的雌性BALB/c小鼠,PM2.5暴露剂量为(69.1±3.7) μg·m-3,每周7 d,每天吸入8 h。连续暴露8周后,取小鼠后眼窝血,采用NMR进行代谢物的检测。结果显示PM2.5的暴露与丙酮酸代谢、氨基酸代谢、脂质代谢和胆碱代谢途径的代谢物水平增加有关。除谷氨酰胺降低外,PM2.5暴露组小鼠血清中,TCA循环、不饱和脂肪酸、氨基酸、胆碱和甲酸水平均显著升高。Li和Lin[11]选取C57BL/6J小鼠为研究对象,每天连续6 h吸入100 μg·m-3 PM2.5,每周5 d,持续暴露1个月。取小鼠血清,使用UPLC-Q-TOF-MS进行代谢物的检测,结果显示血清中变化最大的前5个代谢物为苯并(a)芘、烟酰胺、菲、苊和柠檬酸。Zhao等[17]选取7~8周龄的雌性野生型BALB/c小鼠为研究对象。通过旋转和超声处理将不溶性PM2.5样品稀释至10 mg·mL-1。对于短期暴露组,小鼠采用水溶性PM2.5提取物或生理盐水进行一次鼻滴灌注处理;对于长期暴露组,小鼠每3 d鼻腔滴注一次水溶性PM2.5提取物或生理盐水,共6次。后取小鼠血清,使用超UPLC-Q-TOF-MS进行代谢物的检测。结果显示,PM2.5暴露小鼠血清中,超过30种代谢物浓度显著性改变,其中3种代谢物浓度升高,包括溶血磷脂酰乙醇胺(Lyso phosphatidyl ethanolamine, LysoPE)、1-亚油基甘油胆碱和柠檬酸;另外27种代谢物血清含量降低。Zhang等[18]选取6~7周龄雄性C57BL/6J小鼠为研究对象,共256只分为16个小组。设置低、中、高组,PM2.5暴露剂量分别为10、50、150 μg。于暴露后第3天(PED3, post-exposure-day 3)、第7天(PED7)、第14天(PED14)、第21天(PED21)采集血清样本。LC-MS检测代谢物变化,结果显示,与各对照组相比,低剂量小鼠PED3、PED7、PED14、PED21的脂质显著变化总数分别为6.3%、15.2%、28.1%和11.6%(P<0.05),中位组和高剂量组的变化趋势相似,从PED3到PED14增加到PED14,在PED14上达到峰值,在PED21上下降。代谢物网络分析结果显示,PC水平下降与TGs积累间接相关,这2个亚类是PM2.5效应的主要预测因子,推测PC的不平衡周转可能是膜损伤修复后储存脂质功能失调有关。
1.3 以心脏为研究材料
Li和Lin[11]选取C57BL/6J小鼠作为实验对象,每天连续6 h吸入PM2.5(100 μg·m-3),每周5 d暴露,持续暴露1个月。处死小鼠后,裂解心脏组织,离心后取上清液,使用UPLC-Q-TOF-MS进行代谢物的检测。分析结果表明,心脏变化最大的前5种代谢物为马尿酸盐、精氨酸、鸟氨酸、鼠李糖基葡萄糖苷、N-(1-脱氧-1-果糖)-丙氨酸,主要提示存在氨基酸代谢的紊乱。
1.4 以肝脏为研究材料
Li和Lin[11]的研究表明,肝脏中变化最大的前5种代谢物为N(6)-(1,2-二羧乙基)AMP、氨酰色氨酸、2-磷酸腺苷、TG(18:0/18:0/18:0)、4-MeSO2-多氯联苯。体外研究中,Duan等[19]采用LO2细胞(人类正常肝细胞)、HUVECs细胞(人脐静脉内皮细胞)和Caco-2细胞(人克隆结肠癌细胞),构建体外人类肝肠循环芯片L-GOC(liver-gut-on-chip),将200 μg·mL-1 PM2.5以0.25 μL·min-1流速灌注24 h。取LO2细胞裂解液于LC-MS中进行代谢物检测。结果表明,96种代谢物表达上调,268种代谢物表达下调;LO2细胞中4.11%(364/8839)的代谢物水平失调。其中,PM2.5影响最显著的代谢途径是胆固醇代谢、胆汁酸代谢(胆汁酸合成和分泌)、牛磺酸和次牛磺酸代谢。
1.5 以肾脏或尿液为研究材料
Li和Lin[11]研究发现,肾脏组织中代谢组变化最大的前5种代谢物为次黄嘌呤、马尿酸盐、2,3-辛二酮、苯乙醛酸、尿囊素。周俊等[20]选取南京市城区及郊区共25名健康男性门卫,跟踪取样尿液。取样期间城区采样点PM2.5平均质量浓度为(129.28±22.73) μg·m-3,郊区采样点PM2.5平均质量浓度为(59.51±12.91) μg·m-3。尿液经处理后加入气相色谱-质谱联用仪,进行代谢物的检测。比较城区、郊区研究对象尿液中10种多环芳烃羟基代谢物(OH-PAHs)含量,结果显示,城区研究对象尿液中2-OH-Flu、3-OH-Bap含量显著高于郊区组,其他代谢产物水平无明显差异。谢天宁等[21]以14名美国洛杉矶加州大学到中国北京大学的暑期交换生为随访对象,以洛杉矶为低浓度组,北京为高浓度组。采取GC-MS对尿液进行代谢物水平检测发现,氨基酸代谢物、脂代谢通路发生明显变化。
1.6 以生殖腺为研究材料
王晓飞等[22]以2月龄雄性成年SD大鼠为研究对象,每周进行25 mg·kg-1 PM2.5气管滴注,连续3个月。取睾丸匀浆,采用LC-MS检测代谢物,最终筛选的差异代谢物包括6种核苷酸代谢物、3种类固醇激素代谢物、2种前列腺素、3种LysoPG、20种PC、7种PE、5种SM、2种甘油单酯、1种甘油二酯、5种甘油三酯和2种氨基酸代谢物,差异性代谢通路富集于核苷酸代谢、类固醇激素及多种脂类代谢异常,色氨酸和亮氨酸的合成和代谢通路。何慧慧等[23]以6~8周龄SD大鼠为研究对象,每天采用573.61 μg·m-3 PM2.5暴露4 h,连续12周。取睾丸匀浆,使用GC-MS检测代谢物水平。PM2.5组与对照组比较,共筛选出神经酰胺、磷脂酰胆碱、磷脂酰乙醇胺等25个重要差异代谢产物,与苯丙氨酸、酪氨酸和色氨酸生物合成和苯丙氨酸代谢等5条代谢通路相关。Shi等[24]以GC-2spd细胞作为体外研究对象。GC-2spd细胞是一种小鼠精母细胞,研究者用0、25、50、100 mg·mL-1 PM2.5处理GC-2spd细胞48 h后采用UHPLC检测GC-2spd细胞非靶向代谢组差异,分析显示,PM2.5暴露会干扰TCA循环,减少氨基酸和核苷酸的合成。
1.7 以胚胎为研究材料
Dong等[25]采用小鼠胚胎作为研究对象,实验以C57BL/6雌性受精小鼠作为研究对象,以每只0.3 mg·kg-1 PM2.5的剂量每2 d气管内滴注一次,持续到胚胎发育后第18天。选用成像质谱(imaging mass spectrometry, iMS)对小鼠胚胎进行全系统代谢物成像分析。结合基于组学的系统生物学和基于网络的算法,分析了母体暴露PM2.5后,胚胎发育过程中各个器官代谢差异,一定程度上揭示了PM2.5诱导不同器官代谢通路相互作用和易感程度,也揭示了不同器官特异性的代谢通路变化情况。各种研究概况见表1。
表1 PM2.5相关的代谢组学研究概况
Table 1 Overviews of the studies of metabolomics about PM2.5
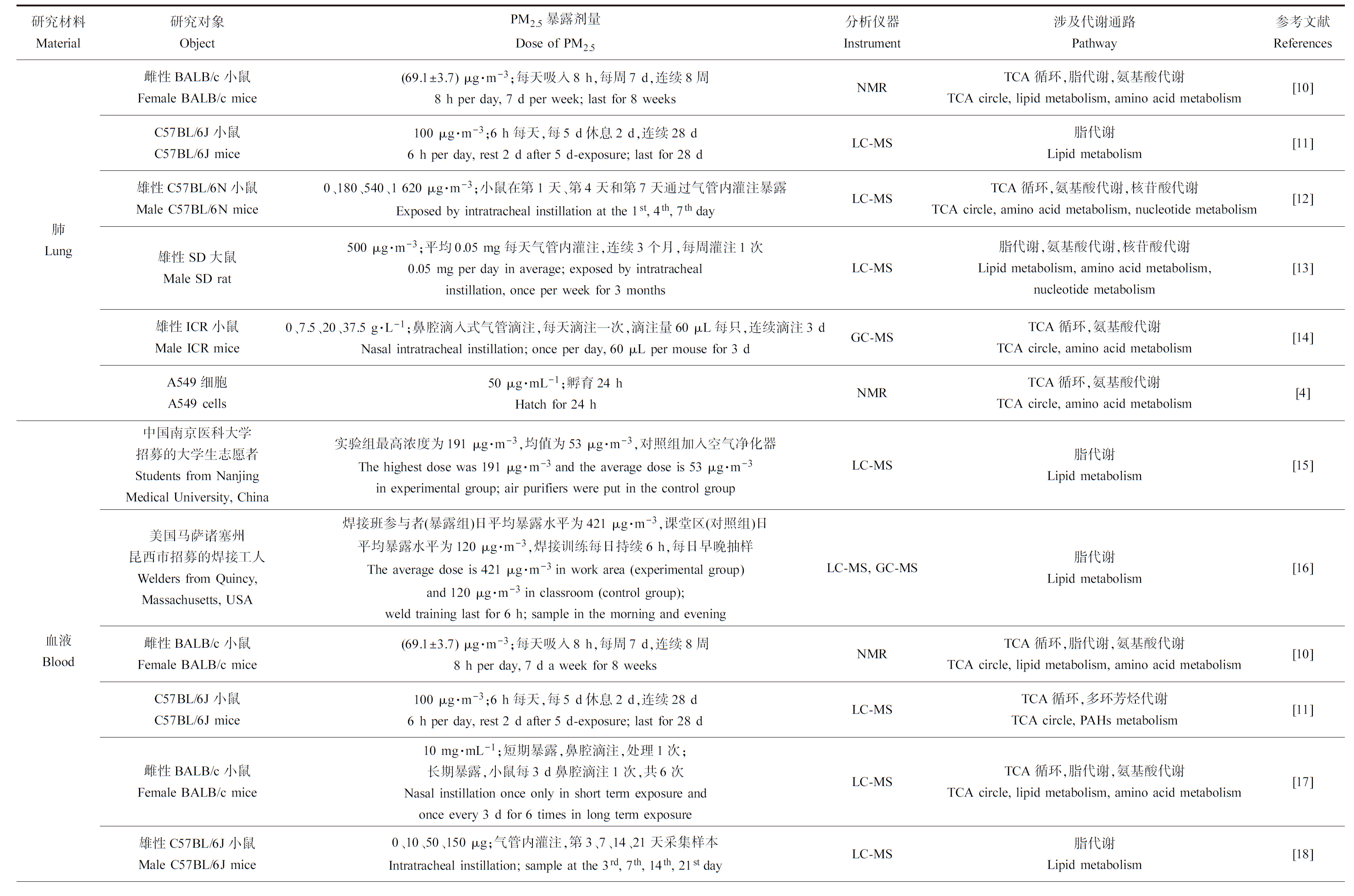
研究材料Material研究对象ObjectPM2.5暴露剂量Dose of PM2.5分析仪器Instrument涉及代谢通路Pathway参考文献References肺Lung雌性BALB/c小鼠Female BALB/c mice(69.1±3.7) μg·m-3;每天吸入8 h,每周7 d,连续8周8 h per day, 7 d per week; last for 8 weeksNMRTCA循环,脂代谢,氨基酸代谢TCA circle, lipid metabolism, amino acid metabolism[10]C57BL/6J小鼠C57BL/6J mice100 μg·m-3;6 h每天,每5 d休息2 d,连续28 d6 h per day, rest 2 d after 5 d-exposure; last for 28 dLC-MS脂代谢Lipid metabolism[11]雄性C57BL/6N小鼠Male C57BL/6N mice0、180、540、1 620 μg·m-3;小鼠在第1天、第4天和第7天通过气管内灌注暴露Exposed by intratracheal instillation at the 1st, 4th, 7th dayLC-MSTCA循环,氨基酸代谢,核苷酸代谢TCA circle, amino acid metabolism, nucleotide metabolism[12]雄性SD大鼠Male SD rat500 μg·m-3;平均0.05 mg每天气管内灌注,连续3个月,每周灌注1次0.05 mg per day in average; exposed by intratracheal instillation, once per week for 3 monthsLC-MS脂代谢,氨基酸代谢,核苷酸代谢Lipid metabolism, amino acid metabolism, nucleotide metabolism[13]雄性ICR小鼠Male ICR mice0、7.5、20、37.5 g·L-1;鼻腔滴入式气管滴注,每天滴注一次,滴注量60 μL每只,连续滴注3 dNasal intratracheal instillation; once per day, 60 μL per mouse for 3 dGC-MSTCA循环,氨基酸代谢TCA circle, amino acid metabolism[14]A549细胞A549 cells50 μg·mL-1;孵育24 hHatch for 24 hNMRTCA循环,氨基酸代谢TCA circle, amino acid metabolism[4]血液Blood 中国南京医科大学招募的大学生志愿者Students from Nanjing Medical University, China实验组最高浓度为191 μg·m-3,均值为53 μg·m-3,对照组加入空气净化器The highest dose was 191 μg·m-3 and the average dose is 53 μg·m-3in experimental group; air purifiers were put in the control groupLC-MS脂代谢Lipid metabolism[15]美国马萨诸塞州昆西市招募的焊接工人Welders from Quincy, Massachusetts, USA焊接班参与者(暴露组)日平均暴露水平为421 μg·m-3,课堂区(对照组)日平均暴露水平为120 μg·m-3,焊接训练每日持续6 h,每日早晚抽样The average dose is 421 μg·m-3 in work area (experimental group) and 120 μg·m-3 in classroom (control group); weld training last for 6 h; sample in the morning and evening LC-MS, GC-MS脂代谢Lipid metabolism[16]雌性BALB/c小鼠Female BALB/c mice(69.1±3.7) μg·m-3;每天吸入8 h,每周7 d,连续8周8 h per day, 7 d a week for 8 weeksNMRTCA循环,脂代谢,氨基酸代谢TCA circle, lipid metabolism, amino acid metabolism[10]C57BL/6J小鼠C57BL/6J mice100 μg·m-3;6 h每天,每5 d休息2 d,连续28 d6 h per day, rest 2 d after 5 d-exposure; last for 28 dLC-MSTCA循环,多环芳烃代谢TCA circle, PAHs metabolism[11]雌性BALB/c小鼠Female BALB/c mice10 mg·mL-1;短期暴露,鼻腔滴注,处理1次;长期暴露,小鼠每3 d鼻腔滴注1次,共6次Nasal instillation once only in short term exposure and once every 3 d for 6 times in long term exposureLC-MSTCA循环,脂代谢,氨基酸代谢TCA circle, lipid metabolism, amino acid metabolism[17]雄性C57BL/6J小鼠Male C57BL/6J mice0、10、50、150 μg;气管内灌注,第3、7、14、21天采集样本Intratracheal instillation; sample at the 3rd, 7th, 14th, 21st dayLC-MS脂代谢Lipid metabolism[18]心脏HeartC57BL/6J小鼠C57BL/6J mice100 μg·m-3;6 h每天,每5 d休息2 d,连续28 d6 h per day, rest 2 d after 5 d-exposure; last for 28 dLC-MS氨基酸代谢Amino acid metabolism[11]肝脏LiverC57BL/6J小鼠C57BL/6J mice100 μg·m-3;6 h每天,每5 d休息2 d,连续28 d6 h per day, rest 2 d after 5 d-exposure; last for 28 dLC-MS脂代谢,氨基酸代谢Lipid metabolism, amino acid metabolism[11]人类肝肠循环芯片(LO2细胞,HUVECs细胞,Caco-2细胞)Liver-gut-on-chip (LO2 cells, HUVECs cells, Caco-2 cells)200 mg·mL-1;通过整个肝肠循环系统,流速为0.25 μL·min-1,持续24 hFlow through the whole liver-gut-on-chip at the speed of 0.25 μL·min-1 for 24 hLC-MS脂代谢,氨基酸代谢Lipid metabolism, amino acid metabolism[19]
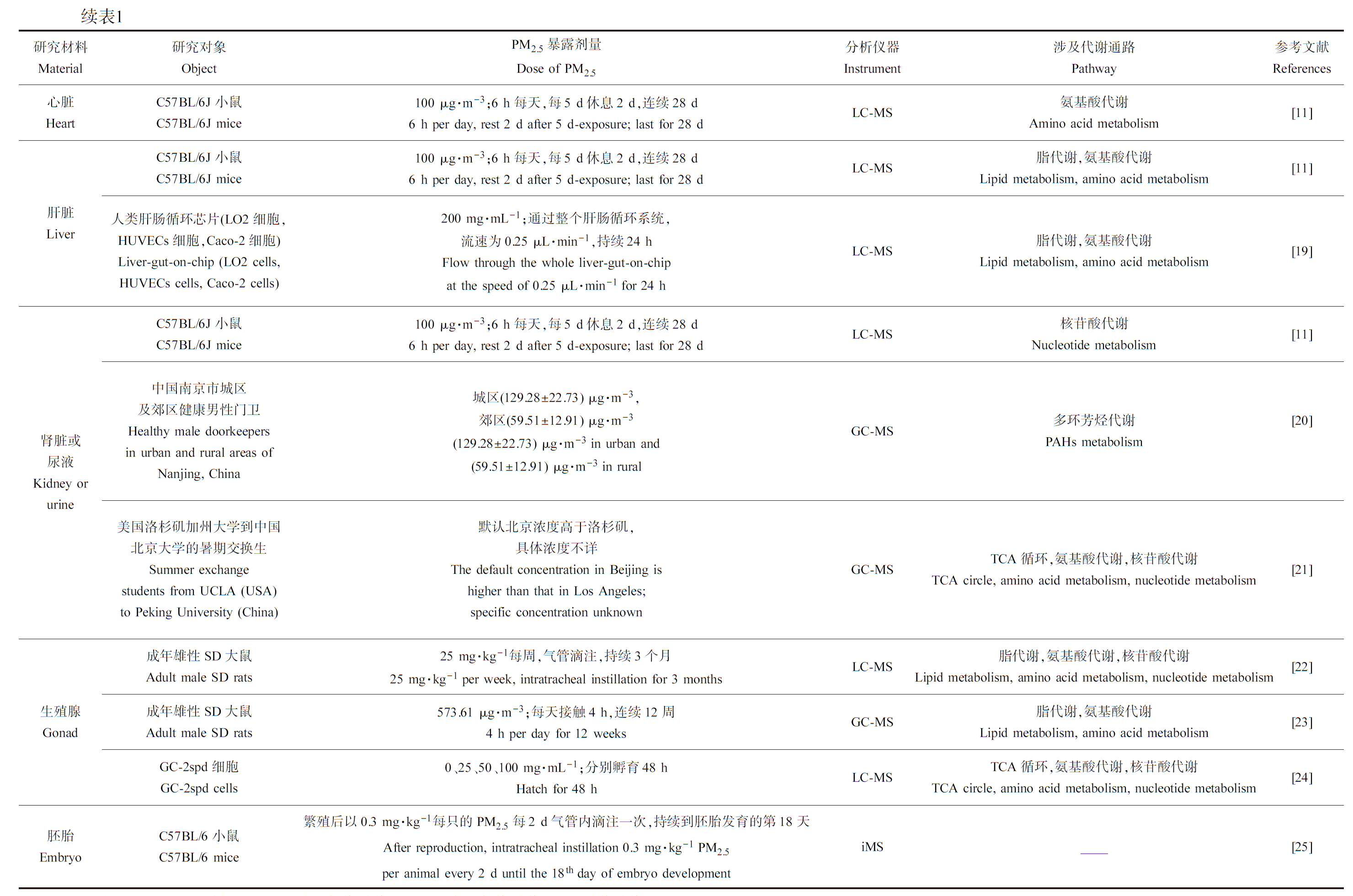
续表1研究材料Material研究对象ObjectPM2.5暴露剂量Dose of PM2.5分析仪器Instrument涉及代谢通路Pathway参考文献References肾脏或尿液Kidney or urineC57BL/6J小鼠C57BL/6J mice100 μg·m-3;6 h每天,每5 d休息2 d,连续28 d6 h per day, rest 2 d after 5 d-exposure; last for 28 dLC-MS核苷酸代谢Nucleotide metabolism[11]中国南京市城区及郊区健康男性门卫Healthy male doorkeepers in urban and rural areas of Nanjing, China城区(129.28±22.73) μg·m-3,郊区(59.51±12.91) μg·m-3(129.28±22.73) μg·m-3 in urban and (59.51±12.91) μg·m-3 in ruralGC-MS多环芳烃代谢PAHs metabolism[20]美国洛杉矶加州大学到中国北京大学的暑期交换生Summer exchange students from UCLA (USA) to Peking University (China)默认北京浓度高于洛杉矶,具体浓度不详The default concentration in Beijing is higher than that in Los Angeles; specific concentration unknownGC-MSTCA循环,氨基酸代谢,核苷酸代谢TCA circle, amino acid metabolism, nucleotide metabolism[21]生殖腺Gonad成年雄性SD大鼠Adult male SD rats25 mg·kg-1每周,气管滴注,持续3个月25 mg·kg-1 per week, intratracheal instillation for 3 monthsLC-MS脂代谢,氨基酸代谢,核苷酸代谢Lipid metabolism, amino acid metabolism, nucleotide metabolism[22]成年雄性SD大鼠Adult male SD rats573.61 μg·m-3;每天接触4 h,连续12周4 h per day for 12 weeksGC-MS脂代谢,氨基酸代谢Lipid metabolism, amino acid metabolism[23]GC-2spd细胞GC-2spd cells0、25、50、100 mg·mL-1;分别孵育48 hHatch for 48 hLC-MSTCA循环,氨基酸代谢,核苷酸代谢TCA circle, amino acid metabolism, nucleotide metabolism[24]胚胎EmbryoC57BL/6小鼠C57BL/6 mice繁殖后以0.3 mg·kg-1每只的PM2.5每2 d气管内滴注一次,持续到胚胎发育的第18天After reproduction, intratracheal instillation 0.3 mg·kg-1 PM2.5per animal every 2 d until the 18th day of embryo developmentiMS____[25]
注:TCA是三羧酸;NMR是核磁共振;LC-MS是液相色谱-质谱;GC-MS是气相色谱-质谱;iMS是成像质谱。
Note: TCA is tricarboxylic acid; NMR is nuclear magnetic resonance; LC-MS is liquid chromatography-mass spectrometer; GC-MS is gas chromatography-mass spectrometer; iMS is imaging mass spectrometry.
2 通路变化(Changes of pathway)
大部分PM2.5暴露的实验对象中,差异最明显的代谢通路为脂代谢、氨基酸代谢、能量代谢和核苷酸代谢。代谢通路的差异性可能与研究组织或器官有关,如血浆代谢通路的变化以脂代谢为主,而实质器官组织均存在能量代谢、氨基酸代谢、脂代谢的异常;一些器官中还存在特异性的代谢通路,如尿液和肾脏存在尿囊素代谢和多环芳烃代谢的变化,肝肠循环存在胆汁酸代谢的变化,睾丸存在睾酮代谢的改变(图1)。
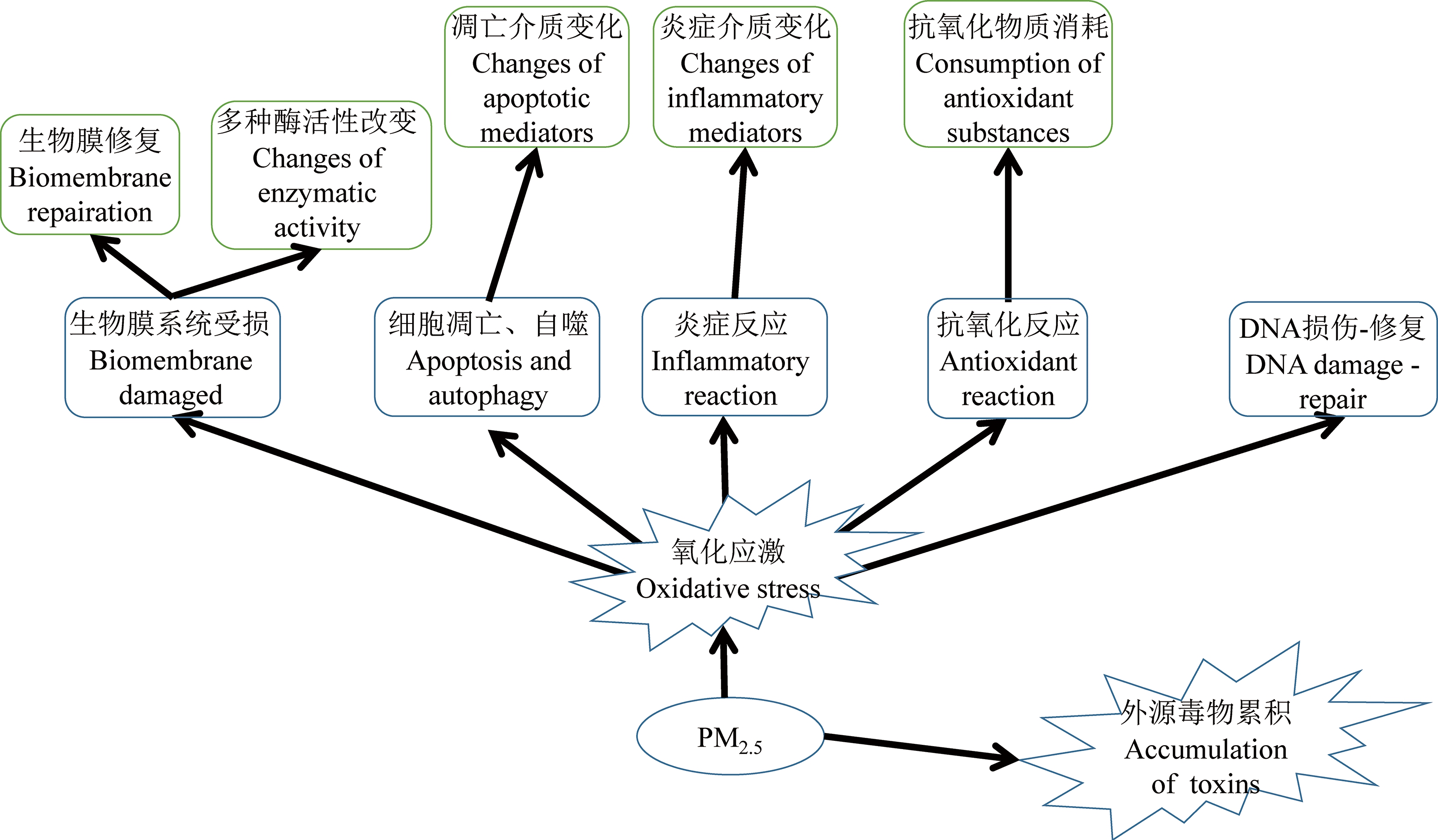
图1 PM2.5可能诱导的早期事件
Fig. 1 The probable early events induced by PM2.5
2.1 PM2.5暴露与能量代谢通路
TCA循环是细胞能量的主要来源,PM2.5暴露能够抑制TCA循环,降低柠檬酸、丙酮酸水平[4,10-12,14,17,21,24],提示PM2.5暴露降低线粒体有氧呼吸水平,诱导乳酸水平升高,提示激活无氧呼吸糖酵解通路(图2)。普遍观点认为,PM2.5通过氧化应激导致线粒体损伤,进而引起TCA循环紊乱。张胜男和桑楠[26]采用透射电镜观察肝脏组织中线粒体超微结构的改变,并结合糖酵解相关基因表达情况和ROS水平检测,指出PM2.5暴露对小鼠肝脏组织中的线粒体造成损伤,导致ATP下降、丙酮酸和乳酸积累。此外,丙酮酸脱氢酶、柠檬酸合成酶和延胡索酸酶的表达水平显著降低,ROS、果糖-2,6-二磷酸酶和乳酸脱氢酶的表达水平显著升高,表明PM2.5通过ROS抑制TCA循环,另一方面通过增强糖酵解途径,促使肝脏细胞弥补能量供应。班红芳等[27]通过检测暴露于PM2.5的人神经母细胞瘤中丙二醛(MDA)含量,结果表明,PM2.5暴露组内MDA含量高于对照组。MDA是膜脂质过氧化产物,是生物膜系统发生氧化损伤的重要指标之一[28],提示PM2.5暴露导致线粒体氧化损伤,以及相关代谢通路变化。
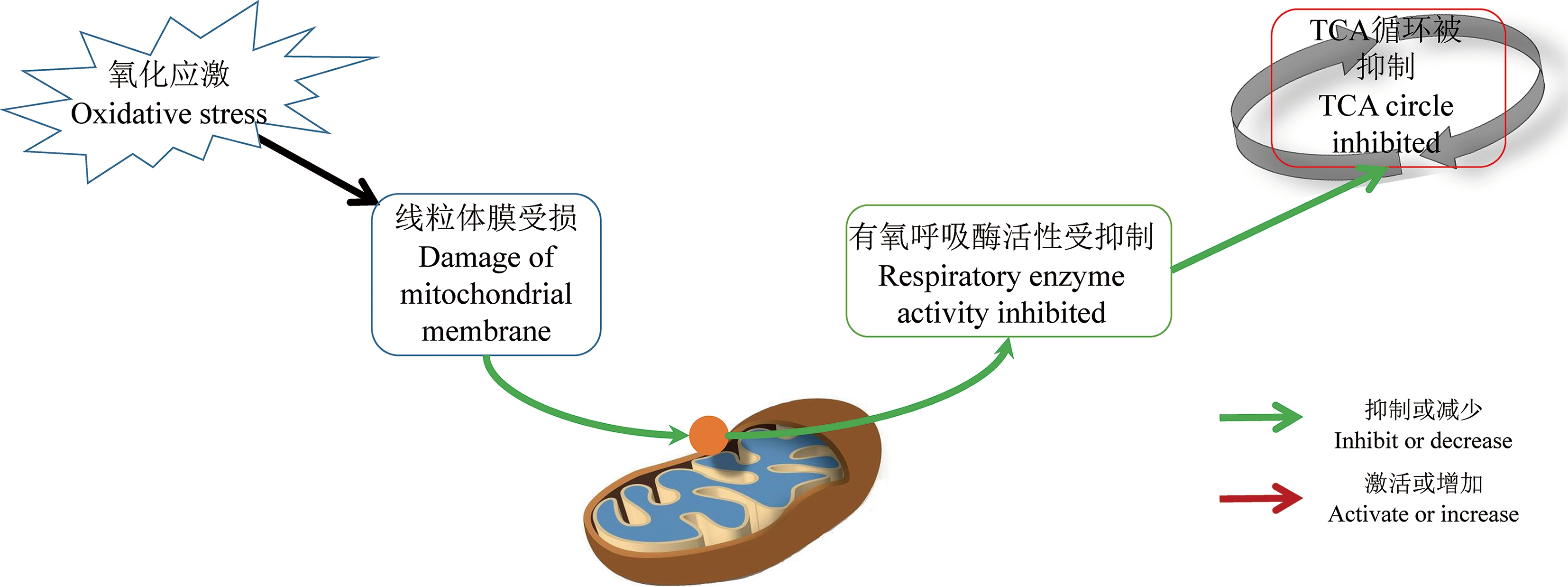
图2 PM2.5暴露后的早期事件与能量代谢间的可能关系
注:TCA是三羧酸。
Fig. 2 The probable relations between TCA circle and early events induced by PM2.5
Note: TCA is tricarboxylic acid.
2.2 PM2.5暴露与脂代谢通路
部分脂代谢通路,如脂肪酸、甘油磷脂和神经鞘脂代谢等,也参与调节TCA循环以及其他能量代谢过程。另外,脂类作为信号分子和生物膜的重要结构,其代谢水平紊乱也反映了细胞凋亡、坏死等细胞状态。PM2.5暴露使二十碳五烯酸(eicosapentaenoic acid, EPA)、PC、二十二碳五烯酸n6(docosapentaenoic acid n6, DPAn6)、LysoPC、LysoPE、SM、PG和二十二碳五烯酸n3(docosapentaenoic acid n3, DPAn3)水平下降,TGs、甘油三脂、LysoPG等水平上升[10,11,13,15-19,22-23]。推测PM2.5一方面通过氧化应激参与基因表达调控,影响脂质转录调控元件的表达水平,另一方面激活炎症反应消耗抗炎因子,扰乱细胞脂代谢水平(图3)。
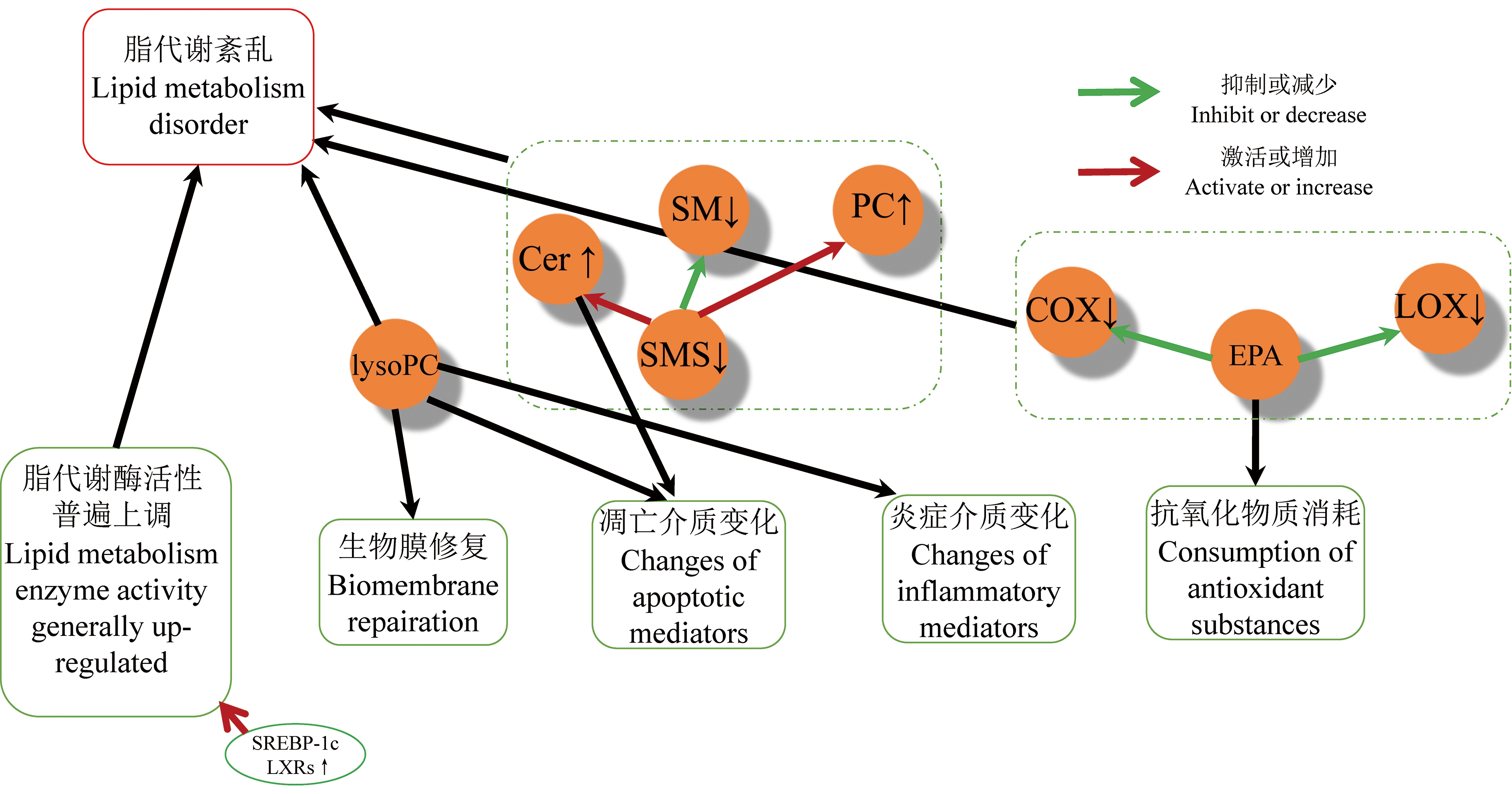
图3 PM2.5暴露后的早期事件与脂代谢之间的可能关系
注:SREBP-1c是固醇调控元件结合蛋白-1c;LXRs是肝细胞X受体;lysoPC是溶血磷脂酰胆碱;PC是磷脂酰胆碱;SMS是神经鞘磷脂合成酶;SM是神经鞘磷脂;Cer是神经酰胺;COX是环氧化酶;LOX是脂肪氧化酶;EPA是二十碳五烯酸。
Fig. 3 The probable relations between lipid metabolism and early events induced by PM2.5
Note: SREBP-1c is sterol regulatory element binding protein-1c; LXRs is liver X receptors; lysoPC is lysophosphatidylcholine; PC is phosphatidylcholine; SMS is sphingomyelin synthase; SM is sphingomyelin; Cer is ceramide; COX is cyclooxygenase; LOX is lipoxygenase; EPA is eicosapentaenoic acid.
一项针对人肝肿瘤细胞株HepG2的染毒实验,定量检测了固醇调控元件结合蛋白-1c(sterol regulatory element binding protein-1c, SREBP-1c)和肝细胞X受体α(liver X receptor α, LXRα)的表达情况。结果表明,PM2.5染毒组中,LXRα和SREBP-1c表达均高于对照组[29]。其中,SREBP-1c是LXRs转录调节因子的下游靶基因,是合成脂肪酸的关键调节因子,能够直接上调脂肪酸合成通路上多个酶的表达[30],与PM2.5导致脂质代谢组水平升高相一致。目前PM2.5作用于LXRs转录调节因子的机制尚未明确,可能仍然与氧化应激有关。
LysoPC的合成与分解代谢主要发生在肝脏,并表现为血浆中LysoPC水平的波动[31]。磷脂酶A2水解磷脂,释放花生四烯酸和LysoPG。LysoPG在炎性反应、细胞膜磷脂重塑、内质网应激、细胞凋亡、细胞坏死、细胞自噬等过程中发挥着重要的作用。近年有学者发现LysoPG在氧化应激调控过程中,扮演着重要角色[32],其具体调控机制仍未明确。血液代谢组学研究结果显示PM2.5暴露后LysoPC下调,因此可能与氧化应激有关。
神经鞘磷脂合成酶(sphingomyelin synthase, SMS)作为神经鞘磷脂合成途径中的关键酶,可以催化PC和神经酰胺(ceramide, Cer)生成SM和甘油二酯,其活性改变将影响SM和PC的浓度。有研究表明[33],当SMS基因沉默时,其底物Cer水平升高,而Cer是促进细胞凋亡的信号分子[34],因此SM的下降与细胞凋亡关联在一起,这正与代谢组学的结果相一致。
EPA通过与氨基酸竞争环氧化酶(cyclooxygenase, COX)和脂肪氧化酶(lipoxygenase, LOX),通过抑制COX-2和5-LOX活性,进而减少氨基酸源的类花生酸,从而抑制炎症反应[35]。因此,EPA的降低可能与炎症反应有关。
2.3 PM2.5暴露与氨基酸代谢通路
氨基酸作为功能物质参与调节TCA循环,同时也参与炎症反应和抗氧化应激。代谢组学研究显示,缬氨酸、亮氨酸和异亮氨酸代谢、丙氨酸、天冬氨酸和谷氨酸代谢、牛磺酸和亚牛磺酸代谢、组氨酸代谢、苯丙氨酸和酪氨酸代谢紊乱[10-14,17,19,21-24](图4)。
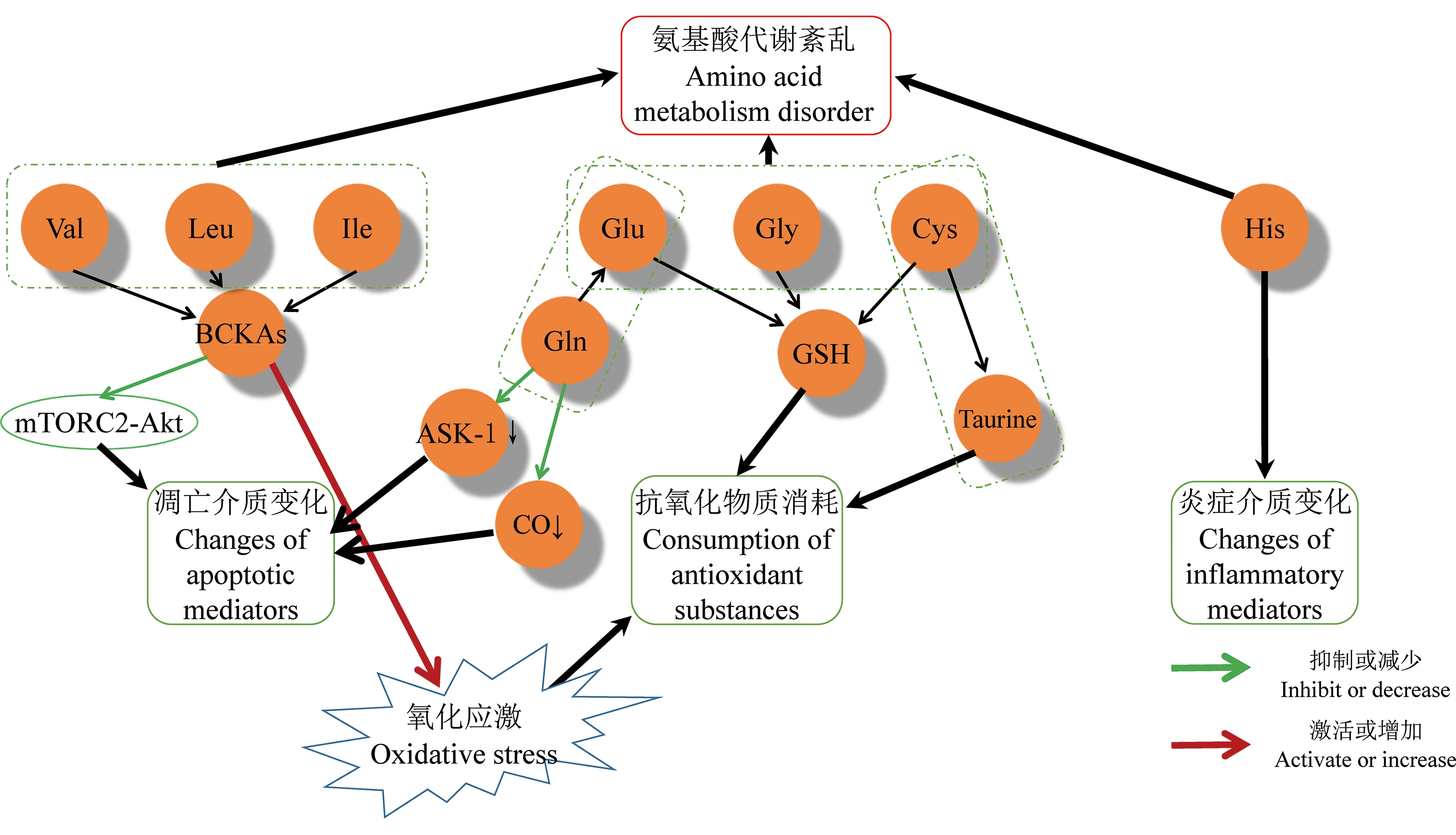
图4 PM2.5暴露后的早期事件与氨基酸代谢之间的可能关系
注:BCKAs是支链α-酮酸;ASK-1是人凋亡信号调节激酶;GSH是谷胱甘肽;Val是缬氨酸;Leu是亮氨酸;Ile是异亮氨酸;Gln是谷氨酰胺;Glu是谷氨酸;Gly是甘氨酸;Cys是半胱氨酸;His是组氨酸。
Fig. 4 The probable relations between amino acid metabolism and early events induced by PM2.5
Note: BCKAs is branched chain α-keto acids; ASK-1 is human apoptosis signal regulated kinase; GSH is glutathione; Val is valine; Leu is leucine; Ile is isoleucine; Gln is glutamine; Glu is glutamine acid; Gly is glycine; Cys is cysteine; His is histidine.
缬氨酸、亮氨酸和异亮氨酸为支链氨基酸,经过支链氨基酸转氨酶(branched chain amino acid aminotransferase, BCAT)催化生成支链α-酮酸(branched chain α-keto acids, BCKAs),后者或经过α-酮酸脱氢酶生成酰基辅酶,参与TCA循环。而BCKAs拥有多种生物学功能,可通过氧化磷酸化的解偶联作用,抑制α-酮戊二酸脱氢酶的活性抑制线粒体功能。BCKAs上调可显著抑制抗氧化酶的活性,加剧氧化应激损伤,还可通过抑制mTORC2-Akt信号通路促进细胞凋亡[36]。因此,支链氨基酸代谢紊乱与PM2.5引起的氧化损伤、细胞凋亡、线粒体功能抑制相关。
丙氨酸、天冬氨酸和谷氨酸通过转氨酶的转氨基作用联系在一起,形成一系列代谢通路。谷氨酸的前体L-谷氨酰胺是血浆中含量最丰富的游离氨基酸,谷氨酰胺可迅速分解产生氨和谷氨酸,也可以在谷氨酰胺酶的作用下产生抑制性神经递质γ-氨基丁酸,或经转氨基作用参与嘌呤、嘧啶的合成。谷氨酰胺可参与凋亡相关酶的调节过程,或作为一氧化碳合成的有效抑制剂抑制细胞凋亡,还可以作为重要抗氧化剂谷胱甘肽的前体物质减轻氧化压力。在肿瘤细胞中,L-谷氨酰胺参与肿瘤坏死因子TNF-α诱导的细胞毒性作用,促进肿瘤细胞的死亡,因此,在不同类型细胞和组织内,谷氨酰胺的作用机制存在差异[37]。在代谢组学相关研究中,丙氨酸、天冬氨酸和谷氨酸的代谢紊乱与氧化应激和细胞凋亡之间存在很大的关联性。
牛磺酸生物合成的主要途径是通过半胱氨酸脱羧酶(cysteine decarboxylase, CSD)从蛋氨酸和半胱氨酸中合成,最后通过将亚牛磺酸氧化为牛磺酸。CSD最初被克隆并鉴定为牛磺酸生物合成的限速酶,后来被证明广泛存在于肾脏和大脑胶质细胞中。牛磺酸通过抑制谷氨酸诱发的细胞毒性,从而具有细胞保护特性,同时可以通过稳定电子传递链和抑制活性氧,起到抗氧化作用[38]。牛磺酸的消耗可能与PM2.5引起的氧化损伤有关。
组氨酸一般由食物摄入,可以通过组氨酸脱羧酶(histidine decarboxylase, HDC)将组氨酸脱羧生成组胺。HDC定位于各种组织中的肥大细胞和胃黏膜肠嗜铬样细胞,但最近也被发现存在于中枢神经系统和免疫细胞中。组胺被认为是典型的炎症介质,可引起皮肤Lewis反应,同时在过敏反应中IgE与肥大细胞膜受体的结合会引起组胺释放。另外,组胺在大脑特定区域中作为神经递质存在,控制各种功能,如睡眠-觉醒周期、食欲、记忆和应激反应。此外,组氨酸是人类肌肉和大脑部分区域中肌肽的前体物。肌肽主要由组氨酸和β-丙氨酸合成,并且发挥着抗氧化作用[39]。因此,组氨酸代谢的紊乱与炎症反应和抗氧化应激息息相关。
苯丙氨酸羟化酶催化苯丙氨酸分解代谢的限速步骤,将苯丙氨酸羟化为酪氨酸,其中酪氨酸进一步降解为延胡索酸和乙酰乙酸,其中延胡索酸进入柠檬酸循环[40]。苯丙氨酸羟化酶主要由苯丙氨酸含量自适应调节,与氧化应激间的关系尚不明确。而酪氨酸与TCA循环紧密联系,因此苯丙氨酸和酪氨酸代谢通路的变化可能与能量代谢通路的改变有较大的关系。
2.4 PM2.5暴露与核苷酸代谢通路
代谢组学研究中可见核苷酸衍生物增多,这可能与PM2.5带来的氧化压力引发DNA损伤-修复过程有关。5-磷酸核糖-1-焦磷酸(phosphoribosyl pyrophosphate, PRPP)来自于磷酸戊糖途径(pentose phosphate pathway, PPP)中的5-磷酸核糖,作为核苷酸生物合成过程中核糖的激活物。在嘧啶合成过程中,二氧化碳(以碳酸根存在)、谷氨酸、天冬氨酸在一系列酶的作用下参与嘧啶成环,与PRPP结合形成嘧啶核苷酸。在嘌呤合成中,二氧化碳、谷氨酰胺、天冬氨酸、甘氨酸参与嘌呤成环,与PRPP结合形成嘌呤核苷酸。核苷酸合成调节主要受基层通路的影响,以及4种三磷酸脱氧核糖核酸(deoxyNTPs)含量的影响[41]。由此可见核苷酸与丙氨酸、天冬氨酸和谷氨酸代谢途径关联很大,进而与PM2.5引起的炎症和氧化应激联系在一起(图5)。
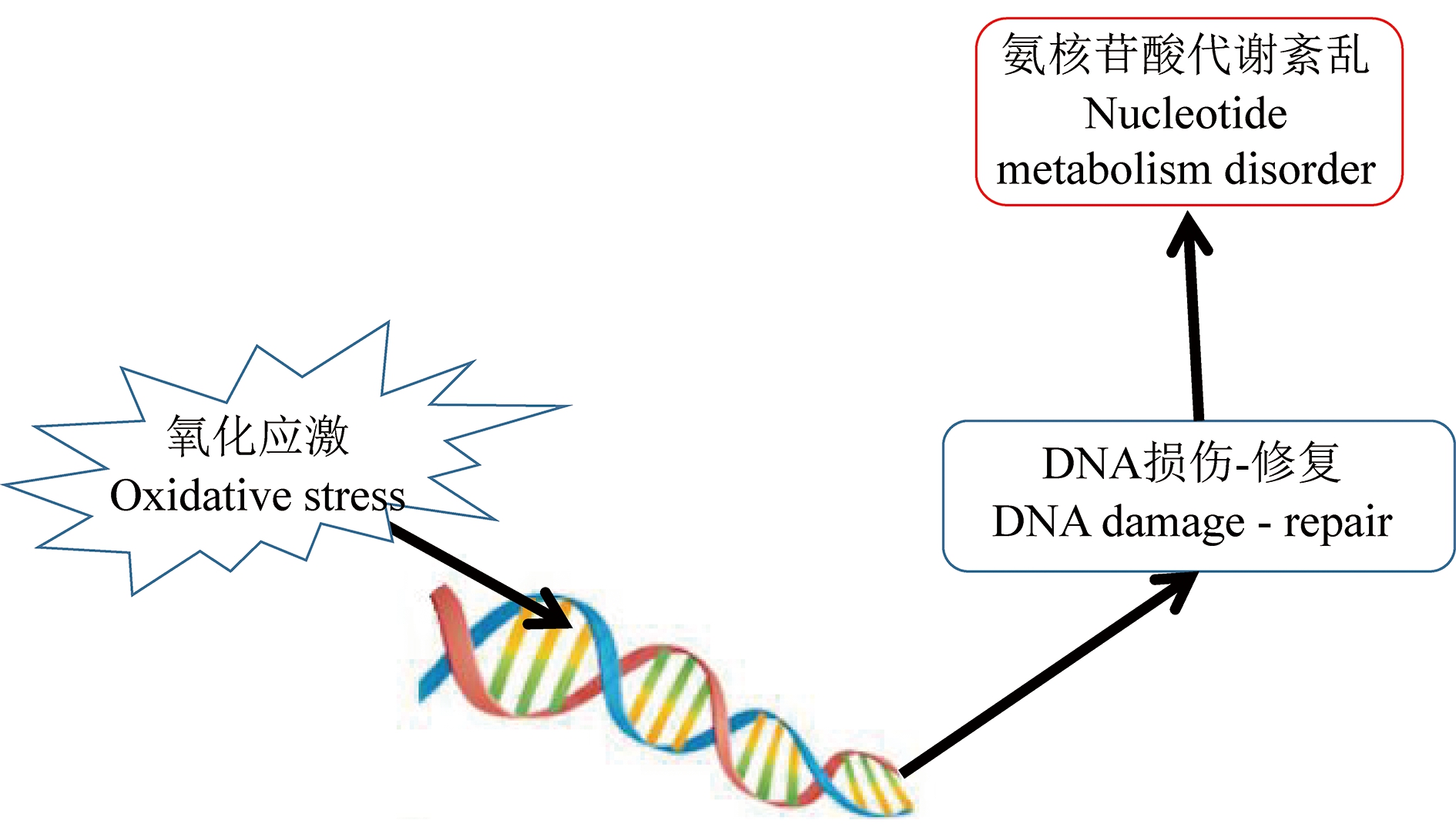
图5 PM2.5暴露后的早期事件与核苷酸代谢之间的可能关系
Fig. 5 The probable relations between nucleotide metabolism and early events induced by PM2.5
2.5 PM2.5暴露与多环芳烃代谢
尿液中的多环芳烃羟基衍生物在PM2.5暴露后普遍增多,这与PM2.5组成成分密切相关。PM2.5中附着有大量有机物,包括大量种类的多环芳烃类有机物。多环芳烃在体内可以代谢为包括羟基多环芳烃在内的多种代谢物,而羟基多环芳烃会随尿液排出体外[42],因此,PM2.5体内暴露很直接地体现在尿液多环芳烃羟基衍生物的含量(图6)。
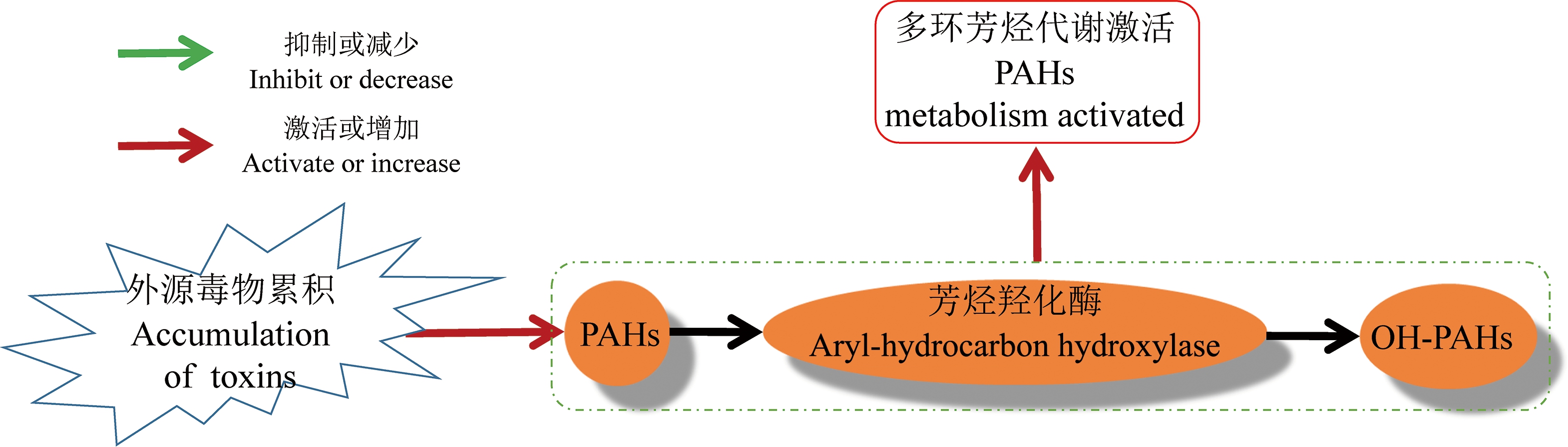
图6 PM2.5暴露后的早期事件与多环芳烃代谢之间的可能关系
注:PAHs是多环芳烃。
Fig. 6 The probable relations between polycyclic aromatic hydrocarbons metabolism and early events induced by PM2.5
Note: PAHs is polycyclic aromatic hydrocarbons.
2.6 PM2.5暴露导致多种代谢紊乱的的可能机制
综上,PM2.5进入体内的早期事件可能主要有氧化应激和外源毒物的累积(图1)。氧化应激进一步导致生物膜系统受损、细胞凋亡、自噬、炎症反应、抗氧化反应、DNA损伤修复,并与TCA循环、氨基酸代谢、脂代谢、核苷酸代谢相联系(图2~5);三大代谢间通过糖异生等多种途径相互联系,核苷酸代谢原料也来自糖代谢和氨基酸代谢,因此,主要通路之间存在紧密联系。另外,外源毒物的累积主要体现在有机物多环芳烃代谢上(图6)。
3 总结(Conclusion)
(1)研究结果上,目前与PM2.5暴露相关的代谢组学研究处于起步阶段,许多研究的样本量比较小,对代谢物检测并不够敏感,因而不具备较好的代表性。未来对于PM2.5毒理机制的探索中可开展更多代谢组学的相关研究,并且可在研究中增大样本容量以提高结果的代表性。(2)研究材料上,目前研究的靶器官聚焦于肺部和血液,对肝脏、肾脏、心脏、生殖腺、尿液的代谢组学研究屈指可数,对大脑、外周神经、胃肠、淋巴系统、内分泌系统、运动系统等的研究尚待开拓,鉴于PM2.5良好的穿透性,后续研究很有必要弥补这些空缺。(3)研究方法上,多数研究采用LC-MS联用,少数几个研究采取了GC-MS和NMR。未来的研究可以考虑2~3种检测方法并行,互相弥补缺陷,以提高结果的准确度和可信度,具体方法可参考Wei等[8]的研究。另外,Dong等[25]采用的iMS技术描绘了个体多个器官间代谢的相互作用,此方法也十分值得进一步挖掘。(4)暴露方式上,PM2.5作为多种不同化合物的混合物,不同时间、不同地点的PM2.5组分不尽相同,因而不同研究间的PM2.5并不具备良好的一致性,其研究结果也因此不能简单地互相比较。未来的研究有必要对PM2.5的构成组分进行详细分析,并揭示每种毒性成分的作用机制以及毒性成分间的交互协同作用,也有必要设置PM2.5的浓度梯度以更立体地观察代谢物变化与PM2.5暴露的剂量-效应关系。
[1] Zhou X H, Cao Z Y, Ma Y J, et al. Concentrations, correlations and chemical species of PM2.5/PM10 based on published data in China: Potential implications for the revised particulate standard [J]. Chemosphere, 2016, 144: 518-526
[2] Xing Y F, Xu Y H, Shi M H, et al. The impact of PM2.5 on the human respiratory system [J]. Journal of Thoracic Disease, 2016, 8(1): E69-E74
[3] Xie W, You J, Zhi C X, et al. The toxicity of ambient fine particulate matter (PM2.5) to vascular endothelial cells [J]. Journal of Applied Toxicology, 2021, 41(5): 713-723
[4] Huang D C, Zou Y J, Abbas A, et al. Nuclear magnetic resonance-based metabolomic investigation reveals metabolic perturbations in PM2.5-treated A549 cells [J]. Environmental Science and Pollution Research International, 2018, 25(31): 31656-31665
[5] Segers K, Declerck S, Mangelings D, et al. Analytical techniques for metabolomic studies: A review [J]. Bioanalysis, 2019, 11(24): 2297-2318
[6] Rinschen M M, Ivanisevic J, Giera M, et al. Identification of bioactive metabolites using activity metabolomics [J]. Nature Reviews Molecular Cell Biology, 2019, 20(6): 353-367
[7] Hou L D, Guan S, Jin Y R, et al. Cell metabolomics to study the cytotoxicity of carbon black nanoparticles on A549 cells using UHPLC-Q/TOF-MS and multivariate data analysis [J]. Science of the Total Environment, 2020, 698: 134122
[8] Wei Y Y, Wang Z X, Chang C Y, et al. Global metabolomic profiling reveals an association of metal fume exposure and plasma unsaturated fatty acids [J]. PLoS One, 2013, 8(10): e77413
[9] Lane A N, Fan T W M. NMR-based stable isotope resolved metabolomics in systems biochemistry [J]. Archives of Biochemistry and Biophysics, 2017, 628: 123-131
[10] Ran Z H, An Y P, Zhou J, et al. Subchronic exposure to concentrated ambient PM2.5 perturbs gut and lung microbiota as well as metabolic profiles in mice [J]. Environmental Pollution, 2021, 272: 115987
[11] Li K L, Lin Y C. PM2.5 induced cardiac hypertrophy via CREB/GSK3b/SOS1 pathway and metabolomics alterations [J]. Oncotarget, 2018, 9(56): 30748-30760
[12] Li J L, Hu Y R, Liu L J, et al. PM2.5 exposure perturbs lung microbiome and its metabolic profile in mice [J]. Science of the Total Environment, 2020, 721: 137432
[13] Wang X F, Jiang S F, Liu Y, et al. Comprehensive pulmonary metabolome responses to intratracheal instillation of airborne fine particulate matter in rats [J]. Science of the Total Environment, 2017, 592: 41-50
[14] 史纯珍, 毛旭, 韩茜, 等. 气相色谱-质谱联用技术分析大气细颗粒物对小鼠肺组织代谢轮廓的影响[J]. 分析化学, 2017, 45(8): 1116-1122
Shi C Z, Mao X, Han X, et al. Gas chromatography-mass spectrometry analysis of metabolic profiling of lung tissues of mice after instillation of fine particulate matter [J]. Chinese Journal of Analytical Chemistry, 2017, 45(8): 1116-1122 (in Chinese)
[15] Chu H Y, Huang F Q, Yuan Q, et al. Metabolomics identifying biomarkers of PM2.5 exposure for vulnerable population: Based on a prospective cohort study [J]. Environmental Science and Pollution Research International, 2021, 28(12): 14586-14596
[16] Gao S Z, Zhuo Z, Hutchinson J, et al. Metabolomic profiling identifies plasma sphingosine 1-phosphate levels associated with welding exposures [J]. Occupational and Environmental Medicine, 2021, 78(4): 255-261
[17] Zhao C, Niu M Y, Song S Y, et al. Serum metabolomics analysis of mice that received repeated airway exposure to a water-soluble PM2.5 extract [J]. Ecotoxicology and Environmental Safety, 2019, 168: 102-109
[18] Zhang X, Zhang J, Wu Y, et al. Dynamic recovery after acute single fine particulate matter exposure in male mice: Effect on lipid deregulation and cardiovascular alterations [J]. Journal of Hazardous Materials, 2021, 414: 125504
[19] Duan X X, Zheng L L, Zhang X L, et al. A membrane-free liver-gut-on-chip platform for the assessment on dysregulated mechanisms of cholesterol and bile acid metabolism induced by PM2.5 [J]. ACS Sensors, 2020, 5(11): 3483-3492
[20] 周俊, 袁琪, 张正东, 等. 大气PM2.5暴露对健康人群尿液中多环芳烃羟基代谢产物水平的影响[J]. 环境与健康杂志, 2018, 35(6): 515-518
Zhou J, Yuan Q, Zhang Z D, et al. Influence of PM2.5 exposure on urinary hydroxyl metabolites levels of polycyclic aromatic hydrocarbons in healthy population [J]. Journal of Environment and Health, 2018, 35(6): 515-518 (in Chinese)
[21] 谢天宁, 林岩, 邱兴华. 基于洛杉矶-北京迁徙人群的大气污染暴露相关急性健康效应标志物的代谢组学研究[J]. 北京大学学报(自然科学版), 2019, 55(3): 501-508
Xie T N, Lin Y, Qiu X H. A preliminary metabolomics study on air pollution associated acute biomarkers of health effect based on a migration panel between Los Angeles and Beijing [J]. Acta Scientiarum Naturalium Universitatis Pekinensis, 2019, 55(3): 501-508 (in Chinese)
[22] 王晓飞, 蒋守芳, 张维冰, 等. 利用代谢组学研究大气细颗粒物的生殖毒性效应[J]. 分析化学, 2017, 45(5): 633-640
Wang X F, Jiang S F, Zhang W B, et al. Study on reproductive toxicity of fine particulate matter by metabolomics [J]. Chinese Journal of Analytical Chemistry, 2017, 45(5): 633-640 (in Chinese)
[23] 何慧慧, 刘卫红, 贾瑞, 等. 当归芍药散对PM2.5致雄性生殖损伤大鼠睾丸组织代谢组学的影响[J]. 郑州大学学报(医学版), 2022, 57(1): 38-44
He H H, Liu W H, Jia R, et al. Effects of Danggui Shaoyao San on metabolomics in testis of rats with reproductive damage induced by PM2.5 [J]. Journal of Zhengzhou University (Medical Sciences), 2022, 57(1): 38-44 (in Chinese)
[24] Shi F Q, Zhang Z H, Wang J K, et al. Analysis by metabolomics and transcriptomics for the energy metabolism disorder and the aryl hydrocarbon receptor activation in male reproduction of mice and GC-2spd cells exposed to PM2.5 [J]. Frontiers in Endocrinology, 2021, 12: 807374
[25] Dong J Y, Peng Q W, Deng L L, et al. iMS2Net: Amultiscale networking methodology to decipher metabolic synergy of organism [J]. iScience, 2022, 25(9): 104896
[26] 张胜男, 桑楠. PM2.5暴露对小鼠肝脏能量代谢的影响[J]. 环境科学学报, 2017, 37(8): 3207-3212
Zhang S N, Sang N. Exposure to PM2.5 promotes the conversion of energy metabolism in livers of mice [J]. Acta Scientiae Circumstantiae, 2017, 37(8): 3207-3212 (in Chinese)
[27] 班红芳, 成丽霞, 吕懿, 等. 大气细颗粒物对SH-SY5Y细胞能量代谢的影响[J]. 环境与职业医学, 2018, 35(7): 607-612
Ban H F, Cheng L X, Lv Y, et al. Effect of airborne fine particulate matters on energy metabolism of SH-SY5Y cells [J]. Journal of Environmental &Occupational Medicine, 2018, 35(7): 607-612 (in Chinese)
[28] 贾秀英, 董爱华, 马小梅. 铅胁迫对蟾蜍抗氧化酶活性及丙二醛含量的影响[J]. 中国环境科学, 2004, 24(2): 155-158
Jia X Y, Dong A H, Ma X M. Affection of lead stress on antioxidant enzyme activities and malonyldialdehyde contents of Bufo bufo gargarizans [J]. China Environmental Science, 2004, 24(2): 155-158 (in Chinese)
[29] 谢菁菁, 邝俊侠, 王婴, 等. PM2.5对HepG2细胞脂质堆积影响及机制研究[J]. 环境与健康杂志, 2015, 32(6): 509-512, 565
Xie J J, Kuang J X, Wang Y, et al. Effect and mechanism of PM2.5 in inducing lipid accumulation in hepatocytes [J]. Journal of Environment and Health, 2015, 32(6): 509-512, 565 (in Chinese)
[30] 王璐, 谢元翼, 李雪, 等. 调节胆固醇代谢的新药物靶点LXR [J]. 中国现代药物应用, 2009, 3(15): 189-191
Wang L, Xie Y Y, Li X, et al. New drug targets LXR for cholesterol control [J]. Chinese Journal of Modern Drug Application, 2009, 3(15): 189-191 (in Chinese)
[31] 宋丹军, 潘家琪, 李鹏旭, 等. 溶血磷脂酰胆碱在肝脏疾病中的研究进展[J]. 中国药理学通报, 2014, 30(12): 1642-1646
Song D J, Pan J Q, Li P X, et al. Research progress of lysophosphatidylcholines for liver diseases [J]. Chinese Pharmacological Bulletin, 2014, 30(12): 1642-1646 (in Chinese)
[32] 范晓礼, 王胜杰, 杨韵颖, 等. 钙非依赖性磷脂酶A2在氧化应激中作用的研究进展[J]. 中华实验外科杂志, 2020, 37(2): 383-387
Fan X L, Wang S J, Yang Y Y, et al. Research progress on the role of calcium-independent phospholipase A2 in oxidative stress [J]. Chinese Journal of Experimental Surgery, 2020, 37(2): 383-387 (in Chinese)
[33] 石渊渊, 李志强, 谷敬丽, 等. 神经鞘磷脂合成酶基因沉默对细胞凋亡的影响[J]. 高等学校化学学报, 2009, 30(9): 1759-1762
Shi Y Y, Li Z Q, Gu J L, et al. Influence of sphingomyelin synthase knockdown on cell apoptosis [J]. Chemical Journal of Chinese Universities, 2009, 30(9): 1759-1762 (in Chinese)
[34] Stancevic B, Kolesnick R. Ceramide-rich platforms in transmembrane signaling [J]. FEBS Letters, 2010, 584(9): 1728-1740
[35] Djuricic I, Calder P C. Beneficial outcomes of Omega-6 and Omega-3 polyunsaturated fatty acids on human health: An update for 2021 [J]. Nutrients, 2021, 13(7): 2421
[36] 张玉寒, 陈雪飞, 张靓. 骨骼肌支链氨基酸代谢小分子与运动[J]. 生理科学进展, 2021, 52(2): 139-145
Zhang Y H, Chen X F, Zhang J. Branched chain amino acids related metabolites of skeletal muscle and exercise [J]. Progress in Physiological Sciences, 2021, 52(2): 139-145 (in Chinese)
[37] 王学斌, 刘凤莲, 李东风, 等. 体内游离谷氨酰胺的抗氧化作用[J]. 生物物理学报, 2004, 20(6): 429-433
Wang X B, Liu F L, Li D F, et al. Free glutamine in organism and its anti-oxygenation [J]. Acta Biophysica Sinica, 2004, 20(6): 429-433 (in Chinese)
[38] Ripps H, Shen W. Review: Taurine: A “very essential” amino acid [J]. Molecular Vision, 2012, 18: 2673-2686
[39] Brosnan M E, Brosnan J T. Histidine metabolism and function [J]. The Journal of Nutrition, 2020, 150(Suppl 1): 2570S-2575S
[40] Flydal M I, Martinez A. Phenylalanine hydroxylase: Function, structure, and regulation [J]. IUBMB Life, 2013, 65(4): 341-349
[41] Lane A N, Fan T W M. Regulation of mammalian nucleotide metabolism and biosynthesis [J]. Nucleic Acids Research, 2015, 43(4): 2466-2485
[42] Angerer J, Mannschreck C, Gündel J. Biological monitoring and biochemical effect monitoring of exposure to polycyclic aromatic hydrocarbons [J]. International Archives of Occupational and Environmental Health, 1997, 70(6): 365-377