由病原菌大丽轮枝菌(Verticillium dahliae Kleb)致使的棉花黄萎病造成了棉花的严重减产甚至绝收,危害了全国棉花生产业的发展,是棉花病虫害中危害最严重的土传病害,被称为“棉花的癌症”[1]。并且由于我国棉花的种植地域和种植方法的单一,随着耕作时间的延长,使得大丽轮枝菌导致的棉花黄萎病的危害性也在不断加重[2-4]。目前在棉花的生产中用于防治棉花黄萎病的方法主要有作物轮作法、培养抗性品种法、化学农药法、生物防治以及综合防治法。而随着绿色经济的发展,利用生防菌和生防菌的抑菌代谢产物来进行生物防治的绿色防控技术已逐步成为农业生产中的研究热点[5]。针对植物土传病害的生物防治主要就是通过筛选出自然界中存在的有益微生物,利用生防菌的菌体本身或其代谢产物的直接作用防治各种植物病原菌[6],或者是通过改变土壤中微生物的群落结构以此来防治植物病害[7]。目前在防治棉花黄萎病上应用较多的生防菌就是芽孢杆菌和假单胞菌等生防菌[8-9]。例如李芮[9]的相关专利中,发现假单胞菌841P-3对棉花黄萎病有着极其显著且绿色安全的防治效果;胡彦婷[10]通过基因组测序,发现枯草芽孢杆菌BSD-2能够分泌如脂肽、Tas A及溶素等多种抑菌代谢产物,以此来高效抑制棉花黄萎病病原菌的生长。
随着各类生防菌剂的逐渐成熟,许多生防菌剂都在逐渐应用到农田和温室大棚中。但是并非所有天然来源的生防菌剂都是安全无害的,仍有部分的生防菌剂是存在一定毒性的,因此需要进行生防菌剂的安全性评价。同时虽然目前发现的大部分生防菌剂都来源于田间土壤或者植物本身,但是在施用生防菌剂进行防治的过程中以人为的形式将大量外源的生防菌剂施入到田间土壤,很有可能会不同程度影响到土壤原有的微生物群落结构和生态功能,并对土壤稳定的微生态系统产生一定影响[11]。而土壤微生物中细菌作为含量最多、作用强度和影响最大的微生物,在土壤中起着十分重要的作用[12]。在土壤环境发生变化的同时,细菌群落结构的多样性及丰富度就会受到影响,而土壤中细菌群落结构的多样性及丰富度与植物真菌病害的发生关系密切[12]。尹丹韩等[13]研究发现施入生防菌哈茨木霉T4的发酵液后会对黄瓜根际周围的土壤细菌群落产生显著影响,并持续一段时间。李全胜等[14]研究发现施用水分散粒剂H14可以提高棉花棉田土壤细菌群落的物种丰富度和多样性,增加有益菌属的相对丰度,有利于棉花的健康生长。因此在应用生防菌剂前必须对生防菌剂对土壤中细菌微生态的潜在影响展开相应研究。
目前,筛选并分离能够拮抗棉花黄萎病病原菌的菌株和抑菌物质的研究较多,但对患病的棉花棉田土壤施用生防菌次生代谢产物后,通过观察土壤中细菌群落结构变化,来揭示抑菌物质安全性的研究还较为少见。枯草芽孢杆菌J-15是由本实验室筛选获得的1株可以高效拮抗棉花黄萎病病原菌的生防细菌[15],后期通过对其发酵液的分离纯化,制备出了其次生代谢产物。利用其代谢产物能高效拮抗棉花黄萎病病原菌大丽轮枝菌,吴梦君等[16]的实验证实该菌株在实验室盆栽条件下对棉花黄萎病有着良好的生防作用,可以作为棉花黄萎病生物防治的抑菌物质。而枯草芽孢杆菌J-15虽然具有良好的生物防治潜能,但是其次生代谢产物却又可能具有一定的细胞毒活性,并对土壤微生物产生危害。因此本研究以不施菌剂的清水组作为对照组,以施用枯草芽孢杆菌J-15次生代谢产物(secondary metabolites of Bacillus subtilis J-15, SMs)粗提液作为处理组,采用Illumina HiSeq测序平台,分析SMs粗提液对土壤中细菌群落的影响,以期作为评价该次生代谢产物对土壤微生物安全性的一条依据,为利用SMs进行棉花黄萎病的生物防治提供理论指导和依据。
1 材料与方法(Materials and methods)
1.1 菌株及主要试剂
枯草芽孢杆菌J-15[15]由本实验室从患病棉花棉田土壤筛选得出并保存,其次生代谢产物提取自本实验室自主筛选得出的枯草芽孢杆菌J-15。
土壤微生物DNA提取试剂盒为康维世纪的Soil DNA Kit试剂盒。
1.2 J-15次生代谢产物粗提液的制备
采用平板划线法分离纯化出枯草芽孢杆菌J-15的单菌落,挑取其单菌落接种于20 mL牛肉膏蛋白胨液体培养基中,培养至对数生长期,制备其种子液。将种子液以1%接种量转接于牛肉膏蛋白胨液体培养基中,培养18 h,得到其发酵液。以4 ℃、12 000 r·min-1条件,离心30 min后,弃去菌体沉淀,取上清。将J-15上清液用浓盐酸将其pH值调节至1.5,置于4 ℃冰箱过夜。再以4 ℃、12 000 r·min-1的条件,离心30 min后,弃上清,取沉淀,并将沉淀溶解在一定量的无菌水中,调节pH值至7,所得溶液用4倍体积的冰浴丙酮抽提3 h,离心除去沉淀,取上清,旋转蒸发。所得溶液氯仿萃取3 h后取上层水相,旋转蒸发残余氯仿,最后通过0.22μm无菌滤膜过滤获得SMs粗提液,并冷冻干燥。以无菌水为溶剂,配制0.33 mg·mL-1 SMs溶液备用[17]。
1.3 土壤样品的采集
从新疆玛纳斯实验棉田采样。采样方法选用随机取样法,随机挑选5个点采样,采集0~20 cm厚度的土层,采样时需避开棉花根际,采样后将样品充分混合,存于密封袋中带至实验室。使用2 mm的土壤筛除杂质。
1.4 土壤样品的处理
试验分别设置两个大组。处理组(SMs):添加100 mL 0.33 mg·mL-1 SMs粗提液至土壤,达到其最大含水量;对照组(CK):添加等量的灭菌后的去离子水。土样均为100 g,置于室温黑暗培养,以此模拟SMs溶液在大田中的试验情况。实验培养的过程中采取称重法定期测量土壤中的含水量,保持2个组中的土壤含水量相同,分别在10、30和60 d时,采用三点垂直取样法取样,并将取样土壤充分混合备用。处理组分别命名为SMs-0、SMs-10、SMs-30和SMs-60,每组均设3次重复;对照组分别命名为CK-0、CK-10、CK-30和CK-60,每组均设3次重复。
1.5 土壤微生物DNA的提取
利用康维世纪的Soil DNA Kit试剂盒,参照其说明书提取土壤DNA。土壤样品的DNA提取完成后,以电压100 V、时间40 min的条件,采用1%琼脂糖凝胶电泳进行检测。
1.6 16S rDNA基因的PCR扩增
以提取的土壤DNA为PCR模板,扩增细菌的16S rDNA区域,引物(338F:5’-ACTCCTACGGGAGGCAGCA-3’,806R:5’-GGACTACHVGGGTWTCTAAT-3’)[18]。PCR的扩增程序:98 ℃预变性2 min;98 ℃变性30 s,50 ℃复性30 s,72 ℃延伸5 min,共计30个循环[19]。在检测过8组土壤样品的PCR产物后,送至北京百迈克公司进行高通量测序。
1.7 数据处理与分析
利用Illumina HiSeq的高通量测序平台,通过PCR扩增产物构建出测序文库并质检,对质检合格的测序文库进行高通量测序。将高通量测序得到的原始数据转化为原始的测序序列。对测序获得的原始测序序列进行预处理,首先使用Trimmomatic v0.33软件,对原始测序序列中的Raw Reads进行过滤;然后使用cutadapt 1.9.1软件去除引物序列,得到高质量Reads;然后使用FLASH v1.2.7软件,拼接土壤样品中高质量的Reads,得到优化序列,最后使用UCHIME v4.2软件,去除优化序列中的嵌合体。
利用北京百迈克公司提供的百迈克云平台对最终有效的测序数据进行OTU聚类、物种注释、丰度分析,以此来揭示对照组和实验组中物种的组成,再进一步通过Alpha多样性分析(Alpha diversity)、Beta多样性分析(Beta diversity)和群落结构分析[20]等,分析对照组和处理组样品之间的差异。利用SPSS软件和Sigma Plot 12.0软件进行数据分析和图片制作。
2 结果(Results)
2.1 土壤细菌测序信息
根据高通量测序土壤样品共测得1 680 362对Reads,其中经过质检筛选、拼接过滤以及去除引物序列后共产生1 436 797条优化序列,优化序列去除嵌合体后的最终有效序列数为1 412 445条,其中单个样品获得的优化序列数至少为667 44,平均产生68 419条优化序列。如表1所示,所有的土壤样品有效率均在83%以上。有效序列的平均长度分布在418~420 bq之间,且在419 bq分布最多。测序质量值Q20皆>96%,Q30皆>94%,表明测序质量较高,测序数据准确。
表1 样本序列数统计
Table 1 Sample sequence statistics
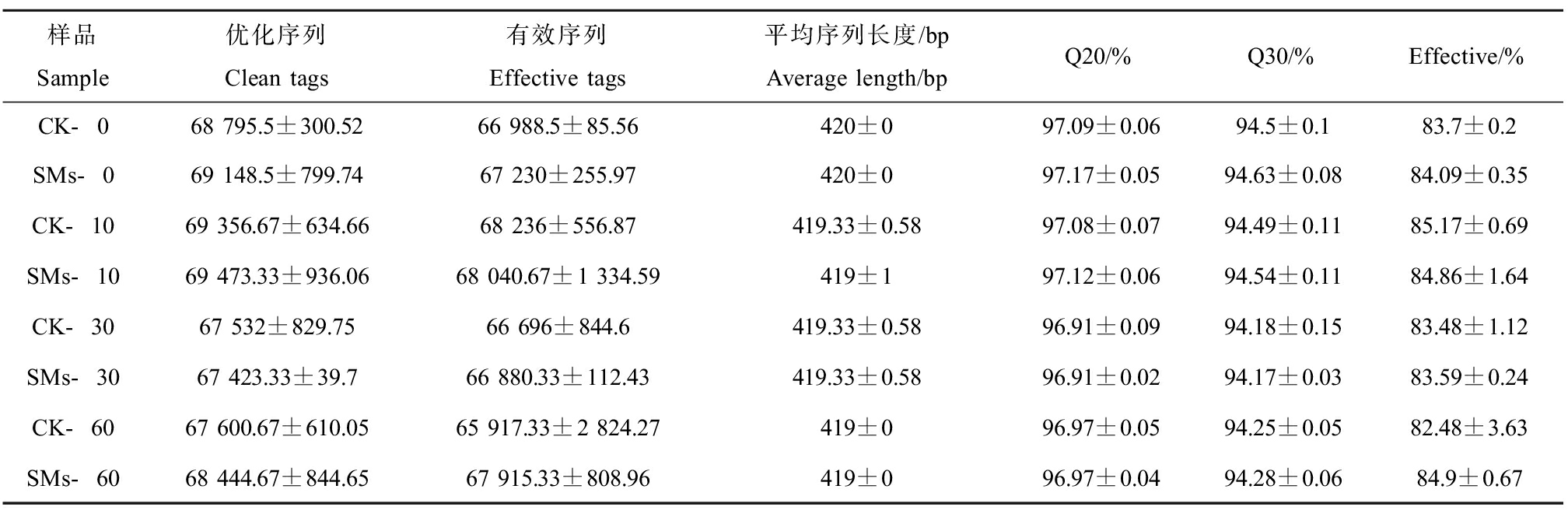
样品Sample优化序列Clean tags有效序列Effective tags平均序列长度/bpAverage length/bpQ20/%Q30/%Effective/%CK-068 795.5±300.5266 988.5±85.56420±097.09±0.0694.5±0.183.7±0.2SMs-069 148.5±799.7467 230±255.97420±097.17±0.0594.63±0.0884.09±0.35CK-1069 356.67±634.6668 236±556.87419.33±0.5897.08±0.0794.49±0.1185.17±0.69SMs-1069 473.33±936.0668 040.67±1 334.59419±197.12±0.0694.54±0.1184.86±1.64CK-3067 532±829.7566 696±844.6419.33±0.5896.91±0.0994.18±0.1583.48±1.12SMs-3067 423.33±39.766 880.33±112.43419.33±0.5896.91±0.0294.17±0.0383.59±0.24CK-6067 600.67±610.0565 917.33±2 824.27419±096.97±0.0594.25±0.0582.48±3.63SMs-6068 444.67±844.6567 915.33±808.96419±096.97±0.0494.28±0.0684.9±0.67
2.2 OTU聚类分析结果
8组土壤样品覆盖率均>99.8%(表2),说明本次测序可以较为全面地反映出土壤细菌群落多样性和丰富度。在序列相似度为97%的水平上划分出分类单元(OTUs),共获得1 670个OTUs。全部OTUs共划分为27个门,85个纲,129个目,232个科,422个属,330个种。韦恩图(Venn) (图1)直观地表示了对照组(CK)和处理组(SMs)之间土壤细菌群落的OTUs数目以及2组之间的相似性和特异性。CK和SMs的土壤样本分别检测到1 657和1 641个OTUs,其中共有的OTUs数目为1 628个,共有的OTUs在CK中占98.25%,在SMs中占99.21%,说明CK和SMs中优势菌门相似。但是CK特有OTUs个数(29个)多于SMs(13个),说明加入SMs会使细菌群落差异减小。
表2 SMs处理土壤样品不同时间的细菌丰富度和多样性指数
Table 2 Bacterial richness and diversity index of soil samples treated with SMs at different time
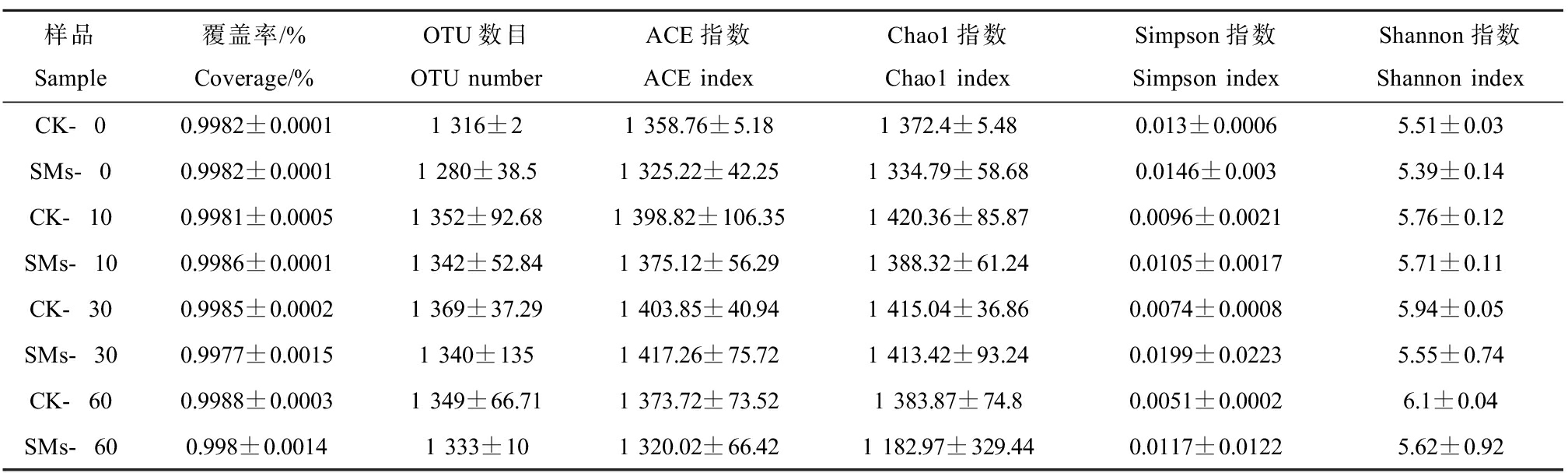
样品Sample覆盖率/%Coverage/%OTU数目OTU number ACE指数ACE indexChao1指数Chao1 indexSimpson指数Simpson index Shannon指数Shannon indexCK-00.9982±0.00011 316±21 358.76±5.181 372.4±5.480.013±0.00065.51±0.03SMs-00.9982±0.00011 280±38.51 325.22±42.251 334.79±58.680.0146±0.0035.39±0.14CK-100.9981±0.00051 352±92.681 398.82±106.351 420.36±85.870.0096±0.00215.76±0.12SMs-100.9986±0.00011 342±52.841 375.12±56.291 388.32±61.240.0105±0.00175.71±0.11CK-300.9985±0.00021 369±37.291 403.85±40.941 415.04±36.860.0074±0.00085.94±0.05SMs-300.9977±0.00151 340±1351 417.26±75.721 413.42±93.240.0199±0.02235.55±0.74CK-600.9988±0.00031 349±66.711 373.72±73.521 383.87±74.80.0051±0.00026.1±0.04SMs-600.998±0.00141 333±101 320.02±66.421 182.97±329.440.0117±0.01225.62±0.92
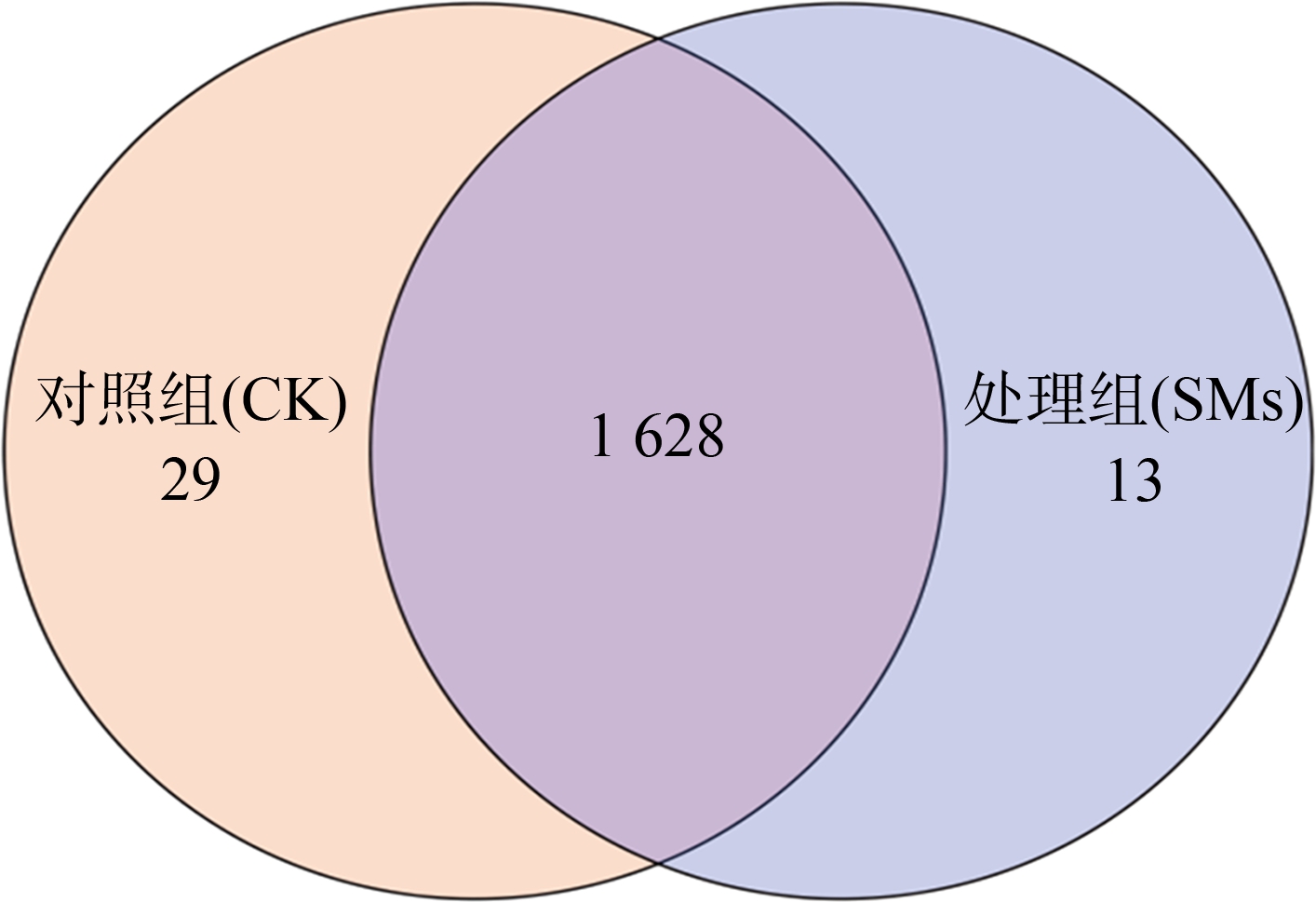
图1 土壤细菌群落的韦恩图
注:CK表示对照组(添加等量的灭菌去离子水);SMs表示处理组(添加100 mL 0.33 mg·mL-1枯草芽孢杆菌J-15次生代谢产物粗提液至土壤,达到其最大含水量)。
Fig. 1 Venn diagrams of soil bacterial community
Note: CK refers to the control group (add the same amount of sterilized deionized water); SMs represents the treatment group (add 100 mL 0.33 mg·mL-1 crude extract of secondary metabolites of Bacillus subtilis J-15 to the soil to reach its maximum water content).
2.3 细菌Alpha多样性分析
通过比较Chao1、Ace、Shannon、Simpson等多种Alpha多样性指数,反映了对照组和处理组共8组土壤样品的物种丰富度及物种多样性。Chao1指数反映的是样品中所含OTUs数目,其指数越大说明样品中所含物种越多。Ace指数反映的是样本中物种组成的丰富度和均匀度,其指数越大表示该环境的物种越丰富,各物种分配越均匀[21]。而Shannon指数则是用来估算样品中微生物的多样性指数之一,Shannon值越大,说明群落多样性越高。
Simpson指数反映的则是优势种在群落中的地位和作用,若一个群落中优势种占的多,其他非优势物种所占的比例则会减少,所以Simpson指数值较大,则说明群落多样性较低,该指数与其他多样性指数均呈负相关,即Shannon指数越大时,Simpson指数就会越小[22]。如表2所示,8组土壤样品中Chao1指数和Ace指数都较大,说明8组样品中的细菌群落皆有较高的丰富度。且8组土壤样品的Shannon指数都较大,Simpson指数都较小,说明8组样品中细菌群落皆有着较高的多样性。但比较对照组和处理组的Alpha多样性指数,发现SMs处理土壤不同时间后Shannon、Simpson、Chao1和Ace指数均与对照组无显著差异,说明SMs对土壤中细菌群落的丰富度和多样性无显著影响,即SMs的施用没有显著改变土壤细菌的丰富度和多样性。
2.4 细菌Beta多样性分析
Beta多样性分析比较的是不同生态系统之间多样性,也就是样品间的差异,是通过利用各样本之间优化序列间的序列距离来计算样本间距离,以此反映样本间是否具有显著的群落差异[23]。根据PCA主成分分析结果(图2)可看出,主成分1(PC1)和主成分2(PC2)分别占比47.81%和22.88%,0 d与其他时间阶段相比,两者在坐标轴上的距离较远,说明0 d与其他时间段的细菌群落结构差异较大;除此之外SMs处理土壤不同时间后的处理组与其对照组在坐标轴上距离都比较接近,说明SMs处理土壤不同时间后的处理组与其对照组的细菌群落结构相似性都较高,即施用SMs没有显著改变土壤细菌的群落结构。
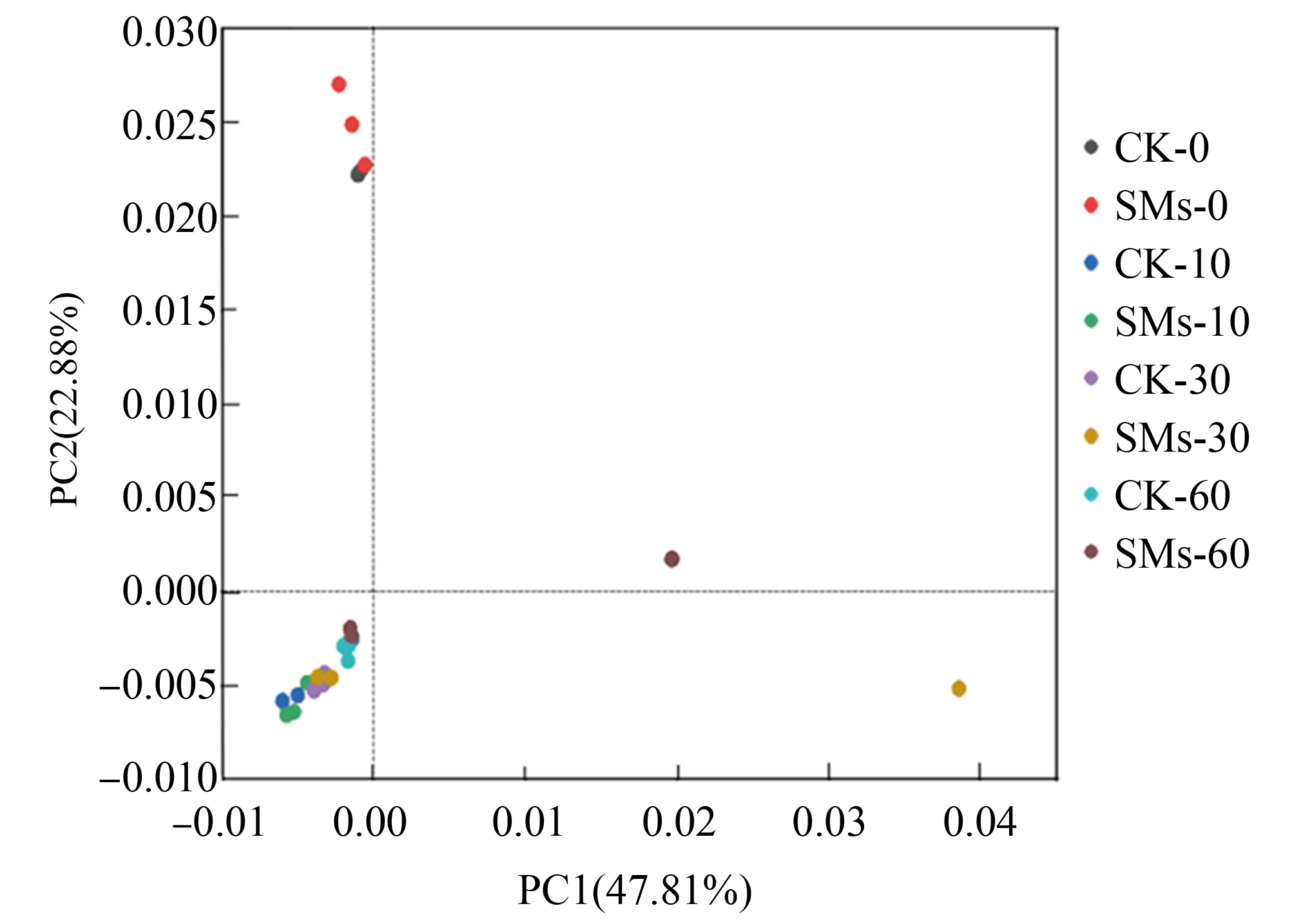
图2 SMs处理土壤不同时间细菌的主坐标分析结果
Fig. 2 Principal coordinate analysis of bacteria in soil treated with SMs at different time
同时利用置换多元方差分析,根据样本间的Binary Jaccard距离,分析了对照组与SMs处理组的组间组内差异解释度,并使用置换检验进行显著性统计。根据置换多元方差分析的分析结果(图3)可知,对照组与SMs处理组之间没有显著性差异,说明加入SMs并不会显著改变土壤细菌的群落结构。除此之外,处理组的组内差异小于对照组的组内差异,说明了加入SMs可以使细菌群落差异减小,与OTUs聚类分析的结果相同。

图3 SMs处理土壤样品的置换多元方差分析结果
Fig. 3 Replacement multiple variance analysis results of soil samples treated by SMs
2.5 SMs处理土壤不同时间对细菌群落结构的影响
2.5.1 门水平的群落结构分析
应用统计学方法对土壤样品中的细菌进行门水平上的群落结构分析,如图4所示,8组土壤样品中排名前十的土壤细菌群落的主要门皆是变形菌门(Proteobacteria)、酸杆菌门(Acidobacteria)、拟杆菌门(Bacteroidetes)、绿弯菌门(Chloroflexi)、放线菌门(Actinobacteria)、硬壁菌门(Firmicutes)、芽单胞菌门(Gemmatimonadetes)、疣微菌门(Verrucomicrobia)。其中在8组土壤样品中变形菌门的相对丰度均占有绝对优势,平均相对丰度为46.60%。除此之外,酸杆菌门和拟杆菌门在8组土壤样品中的平均相对丰度也皆>10%,平均相对丰度分别为13.83%和12.76%。SMs处理土壤10、30和60d后,变形菌门和硬壁菌门的相对丰度相较于对照组皆有上升趋势,拟杆菌门、绿弯菌门和放线菌门相较于对照组则有下降趋势,但差异均不显著。其余主要门的相对丰度有所变化却影响不大。说明SMs处理土壤后对土壤中的细菌群落结构有一定影响但不显著。

图4 SMs处理土壤不同时间细菌物种分布图(门)
Fig. 4 Distribution of bacterial species in soil treated with SMs at different times (phylum)
2.5.2 属水平的群落结构分析
应用统计学方法对土壤样品中的细菌属水平上的群落结构分析,如图5所示,8组土壤样品中排名前十的土壤细菌群落的主要属皆为鞘氨醇单胞菌属(Sphingomonas)、溶杆菌属(Lysobacter)、芽单胞菌科(uncultured bacterium_f_Gemmatimonadaceae)、蒂莫内马赛菌属(Masilia)、噬几丁质菌科(uncultured bacterium f_Chitinophagaceae)、uncultured_bacterium_c_Subgroup_6、砂单胞菌属(Arenimonas)、假单胞菌属(Pseudomonas)、RB41、芽孢杆菌属(Bacillus)。其中鞘氨醇单胞菌属的相对丰度在8组土壤细菌样品中均占有绝对优势,平均相对丰度为10.94%。除此之外SMs处理土壤10 d和30 d后,黏球菌属、蒂莫内马赛菌属和噬几丁质菌科的相对丰度相较于对照组略有下降,而假单胞菌属和芽孢杆菌属的相对丰度相较于对照组则有所上升,但差异均不显著。其余主要属的相对丰度有所变化,但变化幅度不大。再次说明了SMs处理土壤后对土壤中的细菌群落结构有一定影响但不显著。与门水平上的细菌群落分析结果趋于一致。
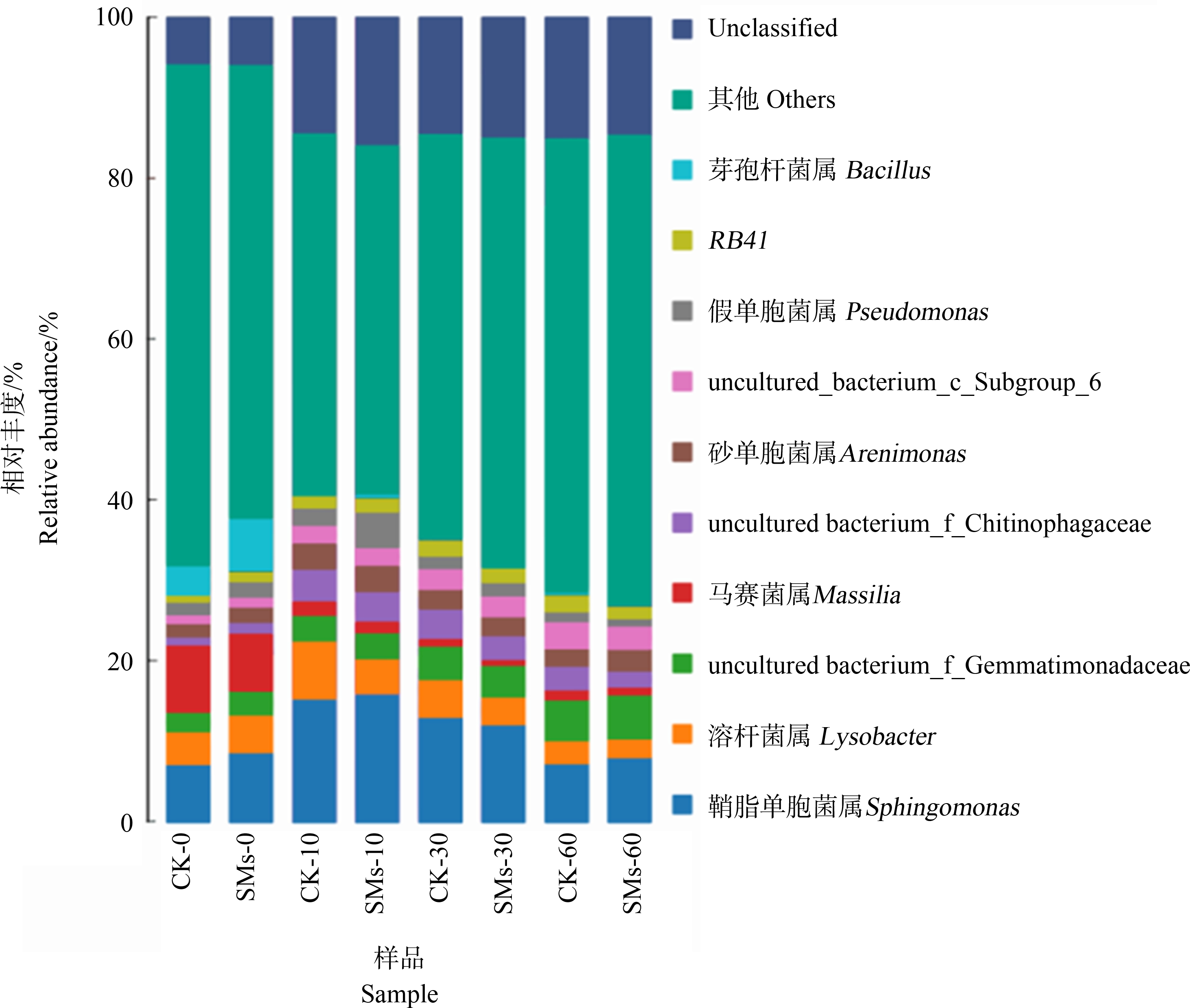
图5 SMs处理土壤不同时间细菌物种分布图(属)
Fig. 5 Distribution of bacterial species in soil treated with SMs at different times (genus)
由图5可知,鉴定出的结果中排名前十且相对丰度(>1%)的属中有未鉴定出的属,也占有一定的比例,它们分别为芽单胞菌科中的一属、噬几丁质菌科中的一属以及细菌中的一属,这表明土壤样品中可能存在一部分细菌的新类群。
2.6 SMs处理土壤不同时间细菌聚类分析
选取丰度排名前二十的属按照上述8组样品的分组情况进行各样品间细菌物种丰度相似性的聚类分析,生成聚类热图,直观反映了SMs处理土壤不同时间后细菌在属水平上群落组成的相似性和差异性。横坐标代表8组土壤样品,纵坐标表示相对丰度排名前二十的属,聚类分析结果见图6,通过纵向比较可以看出0 d与其他时间阶段相比,0 d时取样的样品优势属较多,物种之间的相对丰度差异较大,其他时间阶段取样的样品优势属较少,物种之间的相对丰度差异较小。通过横向比较可以看出各个时间段样品的优势属各不相同;相同时间段的处理组与对照组,样品优势属的差异性也不大,即SMs处理土壤对细菌群落的多样性和复杂度影响不大。
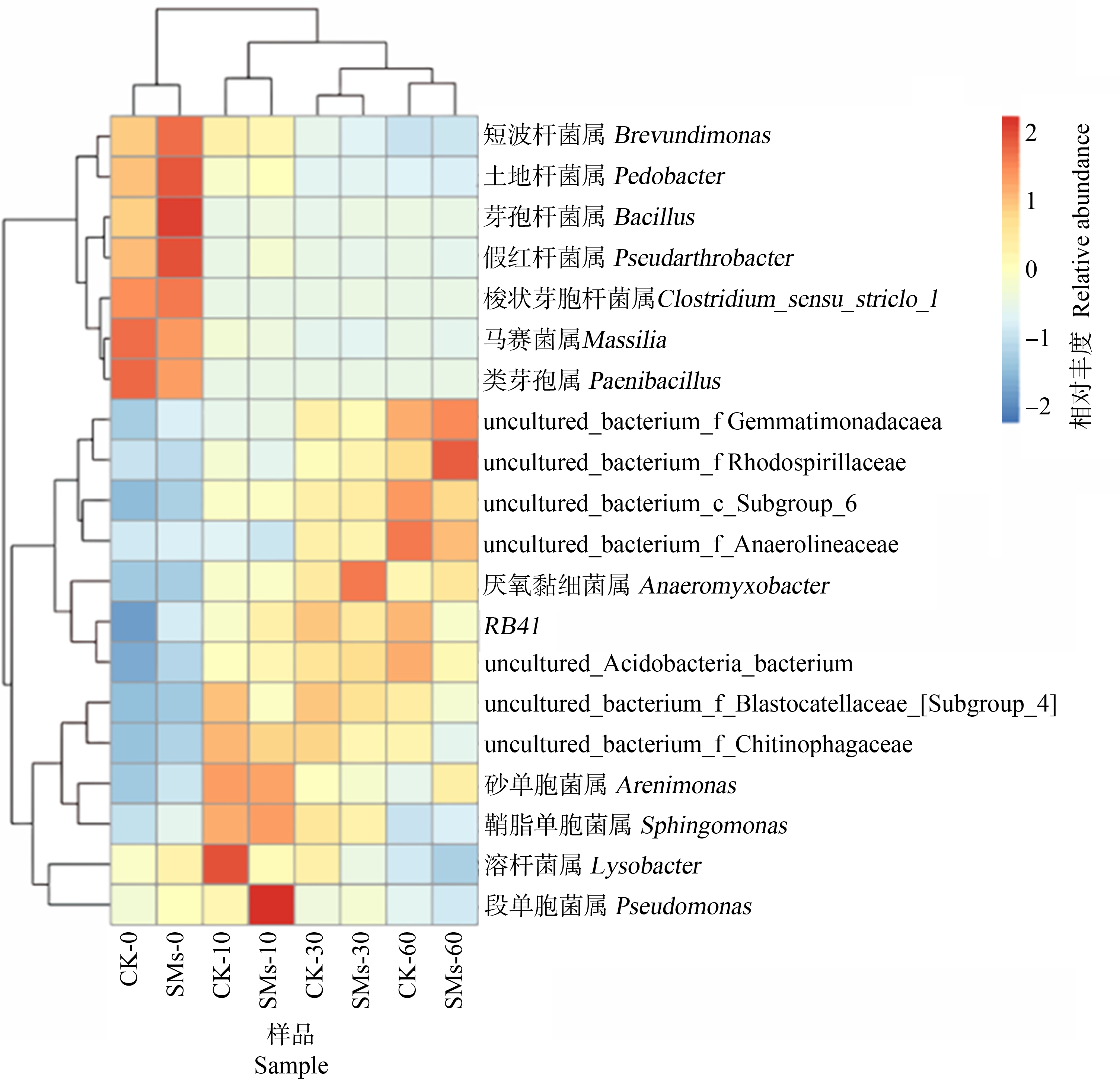
图6 SMs处理土壤不同时间细菌属水平聚类分析热图
Fig. 6 Heatmap of cluster analysis of bacterial genus in soil treated with SMs at different times
3 讨论(Discussion)
在施用生防微生物及其代谢产物防治各种植物病害前,通过研究生防微生物及其代谢产物对土著微生物群落的影响,进行初步安全性评价已成为国际共识[24]。土壤是微生物可以健康生长的繁殖场所,因为土壤中含有可以让微生物生长繁殖所需要的一切物质条件,因此有着“微生物的天然培养基”之称[25]。而土壤中的微生物主要有细菌、真菌、放线菌、藻类和原生动物。它们皆与土壤肥力密切相关,在自然界的物质循环中起着重要作用[26]。土壤越肥沃,微生物种类和数量越多,而土壤中的细菌占土壤微生物总量最多,在土壤微生物中占据着主要地位,其细菌群落的多样性和丰富度则反映了土壤的活性[27-28]。利用两者可有效分析SMs对土壤细菌群落影响,以此评估SMs的安全性。
通过对SMs处理过的土壤样品中的细菌16S rDNA (V3+V4)区域测序分析,根据OTUs聚类分析结果、Alpha多样性和Beta多样性分析结果,可知SMs对土壤中细菌群落的丰富度和多样性均无显著影响。本研究结果与刘雪娇等[29]发现施用贝莱斯芽胞杆菌3A3-15时,对土壤细菌整体的丰富度和多样性没有显著差异的研究结果基本一致。
比较不同时间段下SMs处理土壤细菌主要门相对丰度可知,8组土壤细菌样品中相对丰度较高的前3个门是变形菌门(Proteobacteria)、酸杆菌门(Acidobacteria)、拟杆菌门(Bacteroidetes),且变形菌门的相对丰度在8组土壤样品中均占有绝对优势。在SMs处理土壤10、30和60 d后,变形菌门和硬壁菌门的相对丰度略有提高,而拟杆菌门、绿弯菌门和放线菌门的相对丰度略有下降,但差异均不显著,其余主要门的相对丰度变化则不大。变形菌门属于土壤中的益生菌,可以参与土壤中的物质循环,甚至可以降解土壤中的化学污染[30]。在SMs处理土壤后,其相对丰度的略微上升。这说明SMs处理土壤后对土壤中的细菌群落结构有一定影响但不显著。
由土壤样品中的细菌属分类水平上的群落结构分析可知,鞘氨醇单胞菌属的相对丰度在所有土壤细菌样品中皆占有绝对优势。而研究发现,具有高代谢能力的鞘氨醇单胞菌属,可以通过降解芳香化合物,来保护环境[31]。除此之外绝大多数的假单胞菌属和芽孢杆菌均属于植物根际促生菌,对植物根际吸收土壤元素起着重要作用[32-33]。本研究在8组土壤样品中均检测到了假单胞菌属和芽孢杆菌属,且相对丰度均>1%。同时SMs处理土壤10 d和30 d后,假单胞菌属和芽孢杆菌属相对丰度均有所上升,但差异均不显著。其余主要属的相对丰度有所变化,但变化幅度不大。说明SMs并没有显著影响到农业生产的土壤细菌群落结构,为后期开发利用枯草芽孢杆菌J-15进行农业上生物防治提供了依据。
本研究通过高通量测序技术检测了SMs对土壤细菌群落的影响,结果说明SMs对土壤中细菌群落的丰富度及多样性均无显著影响,且SMs的加入没有显著改变棉花棉田土壤中的细菌群落结构。而谢尔瓦尼木·阿不都艾尼等[34]则分析了SMs处理对棉花致病的病原菌及其他几类植物病原真菌的影响。结果表明,SMs处理后链格孢属(Alternaria)、头束霉(Cephalotrichum)、枝孢属(Cladosporium)、镰孢霉属(Fusarium)、鳞斑霉属(Malassezia)、棉花致病的病原菌轮枝孢属(Verticillium)等植物病原真菌的丰度均下降[34]。因此说明SMs在可以使棉花致病的病原菌及其他几类病原真菌的相对丰度下降的同时,对土壤细菌群落却并无显著影响。说明了SMs在棉花黄萎病的生物防治中可作为生物农药的潜力,可以在农业生产中进一步研究开发利用。本研究结果为利用SMs防治棉花黄萎病提供了一定的理论基础。
[1] Wang J Y, Cai Y, Gou J Y, et al. VdNEP, an elicitor from Verticillium dahliae, induces cotton plant wilting [J]. Applied and Environmental Microbiology, 2004, 70(8): 4989-4995
[2] 张亚楠, 王兴祥, 李孝刚, 等. 连作对棉花抗枯萎病生理生化特性的影响[J]. 生态学报, 2016, 36(14): 4456-4464
Zhang Y N, Wang X X, Li X G, et al. Effects of continuous cropping on physiological and biochemical resistance of cotton to Fusarium wilt [J]. Acta Ecologica Sinica, 2016, 36(14): 4456-4464 (in Chinese)
[3] Zhang T, Jin Y, Zhao J H, et al. Host-induced gene silencing of the target gene in fungal cells confers effective resistance to the cotton wilt disease pathogen Verticillium dahliae [J]. Molecular Plant, 2016, 9(6): 939-942
[4] 刘海洋, 王兰, 努尔孜亚, 等. 棉田深翻对棉花黄萎病发病及其微菌核分布影响的初步研究[J]. 新疆农业科学, 2010, 47(5): 932-935
Liu H Y, Wang L, Nuerziya, et al. Effect of deap plough on occurrence of cotton Verticillium wilt and microsclerotia distribution [J]. Xinjiang Agricultural Sciences, 2010, 47(5): 932-935 (in Chinese)
[5] Abbasi M K, Sharif S, Kazmi M, et al. Isolation of plant growth promoting rhizobacteria from wheat rhizosphere and their effect on improving growth, yield and nutrient uptake of plants [J]. Plant Biosystems - An International Journal Dealing with All Aspects of Plant Biology, 2011, 145(1): 159-168
[6] 丛韫喆. 生防菌混合发酵液对植物土传病害防治、土壤性质微生物区系和采后果实品质的影响[D]. 济南: 山东大学, 2020: 20-23
Cong Y Z. Effects of mixed fermentation broth of biocontrol bacteria on prevention and control of plant soil-borne diseases, soil microbial flora and postharvest fruit quality [D]. Jinan: Shandong University, 2020:20-23 (in Chinese)
[7] 高芬, 闫欢, 王梦亮, 等. 土壤微生物菌群变化对土传病害的影响及生物调控[J]. 中国农学通报, 2020, 36(13): 160-164
Gao F, Yan H, Wang M L, et al. Soil microbial community changes: Effects on soil-borne diseases and biological regulation [J]. Chinese Agricultural Science Bulletin, 2020, 36(13): 160-164 (in Chinese)
[8] 柳春燕, 郭敏, 林学政, 等. 拟康氏木霉和枯草芽孢杆菌对黄瓜枯萎病的协同防治作用[J]. 中国生物防治, 2005, 21(3): 206-208
Liu C Y, Guo M, Lin X Z, et al. The synergistic efficacy of Trichoderma pseudokoningii and Bacillus subtilis against cucumber wilt [J]. Chinese Journal of Biological Control, 2005, 21(3): 206-208 (in Chinese)
[9] 李芮. 解淀粉芽孢杆菌41B-1、铜绿假单胞菌841P-3对棉花根围土壤微生物群落结构的影响[D]. 南京: 南京农业大学, 2013: 48-49
Li R. Effects of Bacillus amyloliquefaciens 41B-1 and Pseudomonas aeruginosa 841P-3 on soil microbial community structure around cotton roots [D]. Nanjing: Nanjing Agricultural University, 2013: 48-49 (in Chinese)
[10] 胡彦婷. 枯草芽孢杆菌BSD-2全基因组数据挖掘及抗菌物质的分离[D]. 天津: 河北工业大学, 2017: 56-61
Hu Y T. Data mining of whole genome of Bacillus subtilis BSD-2 and isolation of antibacterial substances [D]. Tianjin: Hebei University of Technology, 2017: 56-61 (in Chinese)
[11] 韩永琴, 陈新建, 罗路云, 等. 生防菌剂多黏类芽胞杆菌对辣椒根际土壤细菌群落的影响[J]. 植物保护, 2020, 46(2): 135-142
Han Y Q, Chen X J, Luo L Y, et al. Effects of the biocontrol agent Bacillus polymyxa on the bacterial community in the rhizosphere of pepper [J]. Plant Protection, 2020, 46(2): 135-142 (in Chinese)
[12] 黄阔, 叶长文, 李栋, 等. 烟草根结线虫病防治药剂对根际土壤细菌群落结构的影响[J]. 烟草科技, 2021, 54(11): 9-17
Huang K, Ye C W, Li D, et al. Effects of control agents against tobacco root-knot nematode disease on bacterial community structure in rhizosphere soil of tobacco plants [J]. Tobacco Science &Technology, 2021, 54(11): 9-17 (in Chinese)
[13] 尹丹韩, 高观朋, 夏飞, 等. 生防菌哈茨木霉T4对黄瓜根围土壤细菌群落的影响[J]. 中国农业科学, 2012, 45(2): 246-254
Yin D H, Gao G P, Xia F, et al. Effects of the introduction of biocontrol agent Trichoderma harzianum T4 on the bacterial community in cucumber rhizosphere [J]. Scientia Agricultura Sinica, 2012, 45(2): 246-254 (in Chinese)
[14] 李全胜, 孙国清, 梁飞, 等. 水分散粒剂H14对棉花黄萎病发生及土壤细菌群落的影响[J]. 西北农业学报, 2020, 29(3): 451-460
Li Q S, Sun G Q, Liang F, et al. Effect of water dispersible granule H14 on occurrence of cotton Verticillium wilt and soil bacterial community [J]. Acta Agriculturae Boreali-Occidentalis Sinica, 2020, 29(3): 451-460 (in Chinese)
[15] 赵君洁, 曾卫军, 李艳红, 等. 大丽轮枝菌拮抗芽孢菌株的分离、鉴定及两株菌抑菌特性研究[J]. 北京师范大学学报(自然科学版), 2017, 53(3): 294-300
Zhao J J, Zeng W J, Li Y H, et al. Isolation and identification of antagonistic Bacillus spp. against Verticillium dahliae: The antibacterial properties of two strains [J]. Journal of Beijing Normal University (Natural Science), 2017, 53(3): 294-300 (in Chinese)
[16] 吴梦君, 杨启林, 李艳红, 等. BS-Z15代谢产物防治棉花黄萎病的作用及对棉花生长的影响[J]. 分子植物育种, 2019, 17(24): 8237-8244
Wu M J, Yang Q L, Li Y H, et al. Effect of BS-Z15 metabolites on cotton Verticillium wilt prevention and cotton growth [J]. Molecular Plant Breeding, 2019, 17(24): 8237-8244 (in Chinese)
[17] 赵君洁. 棉花黄萎病拮抗芽孢菌的筛选及其活性物质研究[D]. 乌鲁木齐: 新疆师范大学, 2017: 18-26
Zhao J J. Screening of antagonistic Bacillus against Verticillium dahliae in cotton and study on its active substances [D]. Urumqi: Xinjiang Normal University, 2017:18-26 (in Chinese)
[18] 刘小龙, 马建江, 管吉钊, 等. 连作对棉田土壤枯、黄萎病菌数量及细菌群落的影响[J]. 棉花学报, 2015, 27(1): 62-70
Liu X L, Ma J J, Guan J Z, et al. Effects of continuous cropping on numbers of Fusarium oxysporum, Verticillium dahliae and soil bacterial community in cotton field [J]. Cotton Science, 2015, 27(1): 62-70 (in Chinese)
[19] 孔令春, 魏松红, 宋鹏, 等. 抗稻瘟病的生防细菌筛选与鉴定[J]. 沈阳农业大学学报, 2018, 49(6): 655-660
Kong L C, Wei S H, Song P, et al. Screening and identification of biocontrol bacteria against Pyricularia oryzae [J]. Journal of Shenyang Agricultural University, 2018, 49(6): 655-660 (in Chinese)
[20] 赵思崎. 复合菌剂对水稻根际土壤微生物组的影响[D]. 天津: 天津科技大学, 2020: 11-13
[21] 孙倩, 吴宏亮, 陈阜, 等. 基于高通量测序的几种不同作物根际土壤细菌群落结构和多样性分析[J]. 农业生物技术学报, 2020, 28(8): 1490-1498
Sun Q, Wu H L, Chen F, et al. Analysis of bacterial community structure and diversity in rhizosphere soil of several different crops based on high-throughput sequencing [J]. Journal of Agricultural Biotechnology, 2020, 28(8): 1490-1498 (in Chinese)
[22] 陆娜, 宋吉玲, 周小华, 等. 工厂化双孢蘑菇催蕾期覆土层细菌群落变化研究[J]. 西南农业学报, 2021, 34(7): 1480-1485
Lu N, Song J L, Zhou X H, et al. Changes of bacterial community in covering soil layer of industrial Agaricus bisporus during bud induction [J]. Southwest China Journal of Agricultural Sciences, 2021, 34(7): 1480-1485 (in Chinese)
[23] 武华周, 娄德钊, 涂娜娜, 等. 抗、感青枯病桑树根际细菌群落结构与多样性[J]. 福建农业学报, 2020, 35(9): 1004-1011
Wu H Z, Lou D Z, Tu N N, et al. Rhizosphere bacterial community and diversity at fields of wilt resistant or susceptible mulberry trees [J]. Fujian Journal of Agricultural Sciences, 2020, 35(9): 1004-1011 (in Chinese)
[24] 夏京津. 解淀粉芽孢杆菌HE活性成分分析及安全性评价[D]. 武汉: 华中农业大学, 2019: 32-35
[25] 李春霞, 吴兴彪, 靳亚忠. 根系代谢物介导的植物-微生物互作的研究进展[J]. 微生物学报, 2022, 62(9): 3318-3328
Li C X, Wu X B, Jin Y Z. Advances on plant-microbe interaction mediated by root metabolites [J]. Acta Microbiologica Sinica, 2022, 62(9): 3318-3328 (in Chinese)
[26] 黄龙, 包维楷, 李芳兰, 等. 土壤结构和植被对土壤微生物群落的影响[J]. 应用与环境生物学报, 2021, 27(6): 1725-1731
Huang L, Bao W K, Li F L, et al. Effects of soil structure and vegetation on microbial communities [J]. Chinese Journal of Applied and Environmental Biology, 2021, 27(6): 1725-1731 (in Chinese)
[27] 赵勇, 李武, 周志华, 等. 秸秆还田后土壤微生物群落结构变化的初步研究[J]. 农业环境科学学报, 2005, 24(6): 1114-1118
Zhao Y, Li W, Zhou Z H, et al. Changes of microbial community structure in straw amended soil [J]. Journal of Agro-Environmental Science, 2005, 24(6): 1114-1118 (in Chinese)
[28] 刘海洋, 王伟, 张仁福, 等. 棉花与几种作物根际土壤酶活性及细菌多样性分析[J]. 新疆农业科学, 2020, 57(8): 1514-1526
Liu H Y, Wang W, Zhang R F, et al. Analysis of soil enzyme activity and bacterial diversity in rhizosphere of cotton and several economic crops [J]. Xinjiang Agricultural Sciences, 2020, 57(8): 1514-1526 (in Chinese)
[29] 刘雪娇, 姚艳辉, 李红亚, 等. 贝莱斯芽胞杆菌3A3-15菌株对盆栽大豆土壤细菌群落结构的影响[J]. 农业生物技术学报, 2020, 28(5): 903-910
Liu X J, Yao Y H, Li H Y, et al. Effect of Bacillus velezensis 3A3-15 on bacterial community structure of potted soybean (Giycine max) soil [J]. Journal of Agricultural Biotechnology, 2020, 28(5): 903-910 (in Chinese)
[30] Cai X X, Li J B, Guan F Y, et al. Unveiling metabolic characteristics of an uncultured gammaproteobacterium responsible for in situ PAH biodegradation in petroleum polluted soil [J]. Environmental Microbiology, 2021, 23(11): 7093-7104
[31] 台喜生, 冯佳丽, 李梅, 等. 鞘氨醇单胞菌在生物降解方面的研究进展[J]. 湖南农业科学, 2011(7): 21-25
Tai X S, Feng J L, Li M, et al. Progress in application of Sphingomonas sp. in biodegradation [J]. Hunan Agricultural Sciences, 2011(7): 21-25 (in Chinese)
[32] 白建飞, 韩升才, 高聚林, 等. 内生菌莫拉维假单胞菌GF-55促进玉米生长和提高抗倒伏功能分析[J]. 微生物学通报, 2022, 49(7): 2625-2637
Bai J F, Han S C, Gao J L, et al. Endophytic bacterial strain GF-55 improves the growth and lodging resistance of maize [J]. Microbiology China, 2022, 49(7): 2625-2637 (in Chinese)
[33] 张文韬, 杨皓, 毛国豪, 等. 一株高地芽孢杆菌的鉴定与促生能力研究[J]. 江苏农业科学, 2022, 50(5): 225-229
[34] 谢尔瓦尼木·阿不都艾尼, 海孜尼姑力·努尔, 赵歉歉, 等. 枯草芽孢杆菌J-15抗大丽轮枝菌次生代谢产物对棉田土壤真菌多样性的影响[J]. 微生物学通报, 2021, 48(6): 1997-2007
Sherwanimu A I, Heizi N E, Zhao Q Q, et al. Effects of Bacillus subtilis J-15 secondary metabolites against Verticillium dahliae on diversity of soil fungi [J]. Microbiology China, 2021, 48(6): 1997-2007 (in Chinese)