三氯卡班作为杀菌剂普遍添加于抑菌皂、牙膏、沐浴露、洗发水等个人护理品中[1],添加量在0.1%~2%范围[2],在中国的年使用量估计超过400 t[3]。使用以后,三氯卡班随生活污水进入城市污水处理系统或直接排入受纳水环境。然而,现行的污水处理工艺对三氯卡班的去除效果有限,其水相去除率不足30%[4],大部分三氯卡班随污水处理厂污泥及出水持续排入受纳环境[5]。调查表明,三氯卡班在我国辽河、海河、黄河、长江、珠江地表水和沉积物中的浓度分别可达数百ng·L-1和数千μg·kg-1[3,6-7]。水环境中的三氯卡班能被各级水生生物吸收,并造成不同程度的毒性效应[4]。其中,三氯卡班对大型蚤(Ceriodaphnia dubia)、糠虾(Mysidopsis bahia)和淡水泥螺(Potamopyrgus antipodarum)的繁殖抑制效应浓度分别低至1.9、0.06和0.05 μg·L-1[8-10]。环境相关暴露浓度下(1.6~5 μg·L-1),三氯卡班能诱导黑头软口鲦(Pimephales promelas)雄激素受体蛋白分泌下降,表现出雌激素效应[11],并对成年斑马鱼(Danio rerio)卵巢造成组织病理性损伤[12],还能干扰斑马鱼胚胎发育过程中的甲状腺激素合成[13]。前期这些毒理研究结果表明,三氯卡班的持续排放对水生生态系统构成威胁。
野外调查发现,三氯卡班在我国珠江流域和长江流域野生鱼体肌肉和肝脏中均普遍存在[7],在印度淡水鱼体内的浓度可达数百ng·g-1(以单位湿质量计)[14]。然而,关于三氯卡班在生物体内的富集及转化机制鲜有报道。本文系统研究了环境相关暴露浓度下(2 μg·L-1),三氯卡班在我国常见水生生物尼罗罗非鱼(Oreochromis aureas)体内的吸收/净化动力学过程以及组织富集和分配规律,并初步鉴定了其代谢转化产物。旨在为三氯卡班的生态风险评价及环境监管提供科学依据。
1 材料与方法(Materials and methods)
1.1 仪器和试剂
高效液相色谱-三重四级杆串联质谱联用仪(UPLC-MS/MS,美国Agilent,1200/6460系列);高效液相色谱-高分辨飞行时间质谱仪(UPLC-QTOF/MS,美国Agilent,1290/6540B系列);氮气吹扫浓缩仪(中国安谱,EFAA-DC24-RT);固相萃取真空装置(德国CNW,SBEQ-CG1416);离心机(中国湘仪,L550、H1650R)。三氯卡班和同位素内标三氯卡班-D4标准品分别从德国Dr. Ehrensorfer和加拿大CDN Isotopes公司购买,其纯度均>95%。色谱纯试剂乙腈、甲醇和二甲基亚砜从德国Merck公司购买。色谱纯乙酸铵、乙酸、甲酸和肝素钠从德国CNW公司购买。QuEChERS提取试剂盒、分散固相萃取试剂盒和Captiva蛋白质/磷脂吸附管从美国Agilent公司购买,实验用水为超纯水。
1.2 实验设计
选取尼罗罗非鱼(Oreochromis aureas)幼鱼(3个月龄)作为受试生物。从渔业基地购买受试生物后,曝气尽快运回实验室,采用预脱氯自来水驯养至少4周,期间按个体质量1%的比例投放基础营养饲料进行喂养,驯养结束后,挑选状态活跃、体型接近的个体用于室内暴露试验。采用可以同时匀速进水和出水的循环流动系统进行试验,试验容器为200 L不锈钢鱼缸,鱼缸数量为4个,其中3个用于暴露实验,1个用于备用生物个体暂养,试验用水为预脱氯自来水,每缸投放生物个体数量不超过25条,暴露试验期间,按个体质量1%的比例投放不含三氯卡班的基础营养饲料进行喂养。每天记录个体死亡率、摄食和活动状态,暴露试验期间,受试个体共死亡3条,其余个体状态良好,死亡率和不良个体比例低于10%。
动力学试验设计。由于每缸投放生物个体数量不超过25条,为了满足多次取样受试个体数量要求,用2个同规格的鱼缸在相同的条件下同时进行暴露。开始吸收动力学试验前,取3条未染药的罗非鱼作为初始时刻0 d的样品,采用微量注射泵(New Era,NE-300)向鱼缸中匀速加入溶于二甲基亚砜的三氯卡班暴露母液,同时鱼缸保持匀速出水,使鱼缸中三氯卡班的名义浓度为2 μg·L-1,吸收动力学试验周期为14 d;然后,将鱼缸中的受试个体全部转移到水体中未添加三氯卡班的洁净鱼缸中,开始14 d净化动力学试验。总共为期28 d的吸收和净化动力学试验过程中持续曝气供氧,温度保持(26±1) ℃,光暗周期控制在14 h∶10 h。暴露水体溶解氧浓度维持在7.8~8.2 mg·L-1范围,不低于饱和氧含量的60%。于吸收动力学试验的第0.5天、第1天、第3天、第5天、第12天和第14天分别取样3条,2个鱼缸交替取样;同样,于净化动力学试验的第0.5天、第1天、第3天、第5天、第12天和第14天(即动力学试验的第14.5天、第15天、第17天、第19天、第26天和第28天)分别取样3条。分别于吸收动力学试验和净化动力学试验结束后从暂养缸中取样3条,作为空白对照样品。每次取样后,样品立即用冰麻醉,称量质量,量体长,尽快解剖,取各组织称量质量后置于-80 ℃保存,所选个体体长10.2~14.7 cm,体质量19.2~28.5 g,最小个体体质量大于最大个体体质量的2/3。
组织分配及代谢试验设计。根据动力学试验结果,用2个同规格的鱼缸分别设置为实验组和对照组,用于组织分配及组织代谢试验研究:实验组采用微量注射泵向鱼缸中匀速加入溶于二甲基亚砜的三氯卡班暴露母液,同时鱼缸保持匀速出水,使鱼缸中三氯卡班的名义浓度为2 μg·L-1;对照组采用微量注射泵向鱼缸中匀速加入不含三氯卡班的二甲基亚砜溶液,同时鱼缸保持匀速出水,暴露试验周期为14 d,试验结束以后,分别从实验组和对照组取样6条,立即用冰麻醉,称量质量,量体长,尽快解剖,取各组织称量质量后置于-80 ℃保存,所选个体体长12.6~15.8 cm,体质量26.3~30.5 g,最小个体体质量大于最大个体体质量的2/3。
1.3 样品提取与分析
1.3.1 提取
根据前期已经建立的提取方法,采用QuEChERS方法对固相组织(皮、肉、肝、肾、胃、肠、脑、鳃)进行提取和净化[15];采用溶剂沉淀吸附及分散固相萃取对液相组织(胆汁、血浆)进行提取和净化[16]。取适量固相组织(2 g肉或0.5 g鳃或全组织)分别置于50 mL尖底离心管,加入2颗陶瓷匀浆子,加入内标20 ng,加入5 mL水,涡旋1 min将组织打碎,然后加入10 mL乙腈(含0.1%乙酸),再加入盐析试剂(1.5 g乙酸钠+6 g无水硫酸镁),用手震荡1 min促进液液分层,离心,取7 mL上清液加入分散固相萃取试剂(900 mg无水硫酸镁+150 mg PSA+150 mg C18),用手震荡15 s,离心,取5 mL上清液用氮气轻轻吹至近干,用200 μL甲醇定容,置于-20 ℃保存。取50 μL胆汁或50 μL血浆分别置于1 mL离心管,加入内标20 ng,加入500 μL乙腈(含1%乙酸)涡旋30 s混合沉淀,随后尽快将混合液加载至Captiva蛋白质/磷脂吸附管,通过固相萃取真空装置加压过滤混合液,收集滤液并稀释至6 mL,加入分散固相萃取试剂(900 mg无水硫酸镁+150 mg PSA+150 mg C18),用手震荡15 s,离心,取3 mL上清液用氮气轻轻吹至近干,用200 μL甲醇定容,置于-20 ℃保存。暴露水体中的三氯卡班通过液液萃取进行提取:取1 mL暴露水溶液,采用3 mL正己烷依次萃取3次,合并萃取上清液,氮气轻轻吹至近干,用1 mL甲醇定容,置于-20 ℃保存。
1.3.2 分析
三氯卡班采用UPLC-MS/MS进行定量分析,通过C18液相色谱柱(50 mm×2.1 mm,1.8 μm)进行分离,流动相为含0.01%甲酸的水溶液(A)和甲醇(B),进样体积为5 μL,流动相流速为0.32 mL·min-1,柱温35 ℃,梯度程序进样:0 min 90% A,1.5 min 45% A,2.5 min 30% A,3.5 min 20% A,3.8 min 12% A,4.8 min 7% A,4.9 min 3% A,并保持5 min。三氯卡班在UPLC-MS/MS电喷雾离子源负模式下,经多反应监测模式(MRM)进行检测,离子源和质谱参数为:气体温度280 ℃,气体流速11 mL·min-1,喷嘴电压345 kPa,鞘气温度350 ℃,鞘气流速11 mL·min-1,毛细管电压3 500 V,三氯卡班的定性定量离子对(m/z)为313>160和313>126;三氯卡班-D4的定性定量离子对(m/z)为317>160和317>130。
三氯卡班代谢产物在UPLC-QTOF/MS电喷雾离子源负模式下,经MS和target MS模式扫描分析,离子源和质谱参数为:气体温度325 ℃,气体流速11 mL·min-1,鞘气温度350 ℃,鞘气流速11 mL·min-1,雾化器压力276 kPa,毛细管电压3 000 V,毛细管出口电压120 V,锥孔电压65 V,八级杆电压750 V,参比离子为m/z 112.9855和m/z 966.0007。
1.4 质量保证与质量控制
暴露水体及组织提取液中的三氯卡班采用同位素类似物三氯卡班-D4作为内标,通过内标稀释法进行定性和定量分析。配制的标准曲线溶液中三氯卡班的浓度分别为0.1、0.5、1、5、10、20、50、100、200、500、1 000 μg·L-1,内标三氯卡班-D4浓度均为50 μg·L-1。样品分析过程中同时设置程序空白、溶剂空白和空白加标,用于检查背景空白和携带污染,通过时间偏差≤5%,离子比例偏差≤20%作为目标物定性依据。采用前期已建立的提取分析方法,三氯卡班在鱼体胆汁和血浆中的最低检出限(MQLs)范围为0.38~1.06 ng·mL-1,在鱼体其他组织中的最低检出限(MQLs)范围为0.22~1.17 ng·g-1。空白加标中三氯卡班的回收率均在70%~120%范围。
暴露试验期间,三氯卡班在暴露组水体中的浓度范围为1.61~2.25 μg·L-1,平均浓度为1.98 μg·L-1,水体中实测浓度相比名义浓度2 μg·L-1的相对标准偏差在±20%范围,说明循环流动暴露系统可以使暴露水体中三氯卡班的浓度保持稳定。吸收动力学试验中,2个同规格鱼缸中三氯卡班的平均浓度分别为1.95 μg·L-1和1.98 μg·L-1,2个缸中三氯卡班浓度变化<15%,说明2个吸收动力学试验缸中暴露条件具有同质性。净化动力学试验所用鱼缸和暂养所用鱼缸的水体中三氯卡班浓度均未检出,所有空白对照组生物样品中均未检出三氯卡班。
每批次鱼体组织样品和水样提取时设置空白加标回收样进行质量控制,结果显示取固相生物组织中三氯卡班的平均回收率范围为68%~82%;液相生物组织中三氯卡班的平均回收率范围为79%~86%;水体中三氯卡班的平均回收率为75%。
1.5 数据分析
1.5.1 动力学参数
以采样时间点为横坐标,以三氯卡班在鱼体组织的含量为纵坐标作图,获得三氯卡班在鱼体组织浓度随试验时间的变化曲线,采用伪一级动力学模型拟合曲线[17],获得三氯卡班在鱼体组织的吸收动力学曲线方程和净化动力学曲线方程,根据拟合结果,进一步计算获得三氯卡班在鱼体组织的吸收动力学常数ku(mL·g-1·h-1)、净化动力学常数ke(h-1)和半衰期t1/2(h)[18-19],计算过程如方程(1)~(3)所示:
ct=c0×e-ke×t
(1)
(2)
(3)
式中:c0为净化动力学试验开始时,三氯卡班在鱼体组织的浓度(ng·g-1);ct为t时刻三氯卡班在鱼体组织的浓度(ng·g-1);t为暴露时间(h);cw为暴露水体中三氯卡班的浓度(ng·mL-1)。
1.5.2 生物浓缩系数
根据OECD推荐的方法[20],三氯卡班在鱼体组织中的稳态生物浓缩系数BCFss(L·kg-1)可以通过方程式(4)进行计算,三氯卡班在鱼体组织中的动力学生物浓缩系数BCFK(mL·g-1)可以通过方程(5)进行计算:
(4)
(5)
式中:cf为达到吸收/净化动力学平衡时,三氯卡班在鱼体组织中的稳态浓度(ng·g-1);cw为三氯卡班在暴露水体中的实测稳态浓度(ng·mL-1),取暴露期间水体中三氯卡班的平均浓度1.98 μg·L-1进行计算。
2 结果与讨论(Results and discussion)
2.1 三氯卡班的吸收及净化动力学特征
三氯卡班在罗非鱼组织(肝、鳃、肾、胃、肉)中的吸收动力学曲线如图1所示。吸收期的第120小时(即动力学试验第5天),三氯卡班在鱼体组织中的浓度达到最大值,并在吸收期的第5天至第14天保持稳定,处于吸收动力学和净化动力学平衡状态。吸收期第120小时,三氯卡班在罗非鱼肝、鳃、肾、胃和肉中的稳定浓度分别为152、167、82.4、945和29.2 ng·g-1。由表1可知,三氯卡班在鱼体肝、鳃、肾、胃和肉中的吸收动力学过程均符合伪一级动力学方程,方程拟合相关系数(r2)分别为0.60、0.67、0.71、0.62和0.73;三氯卡班在罗非鱼肝、鳃、肾、胃和肉中的吸收动力学常数(ku)分别为1.93、2.10、1.30、13.4和0.429 mL·g-1·h-1,比较而言,三氯卡班在胃中的ku值远高于其他4个组织,说明胃吸收是罗非鱼摄入三氯卡班的主要方式。
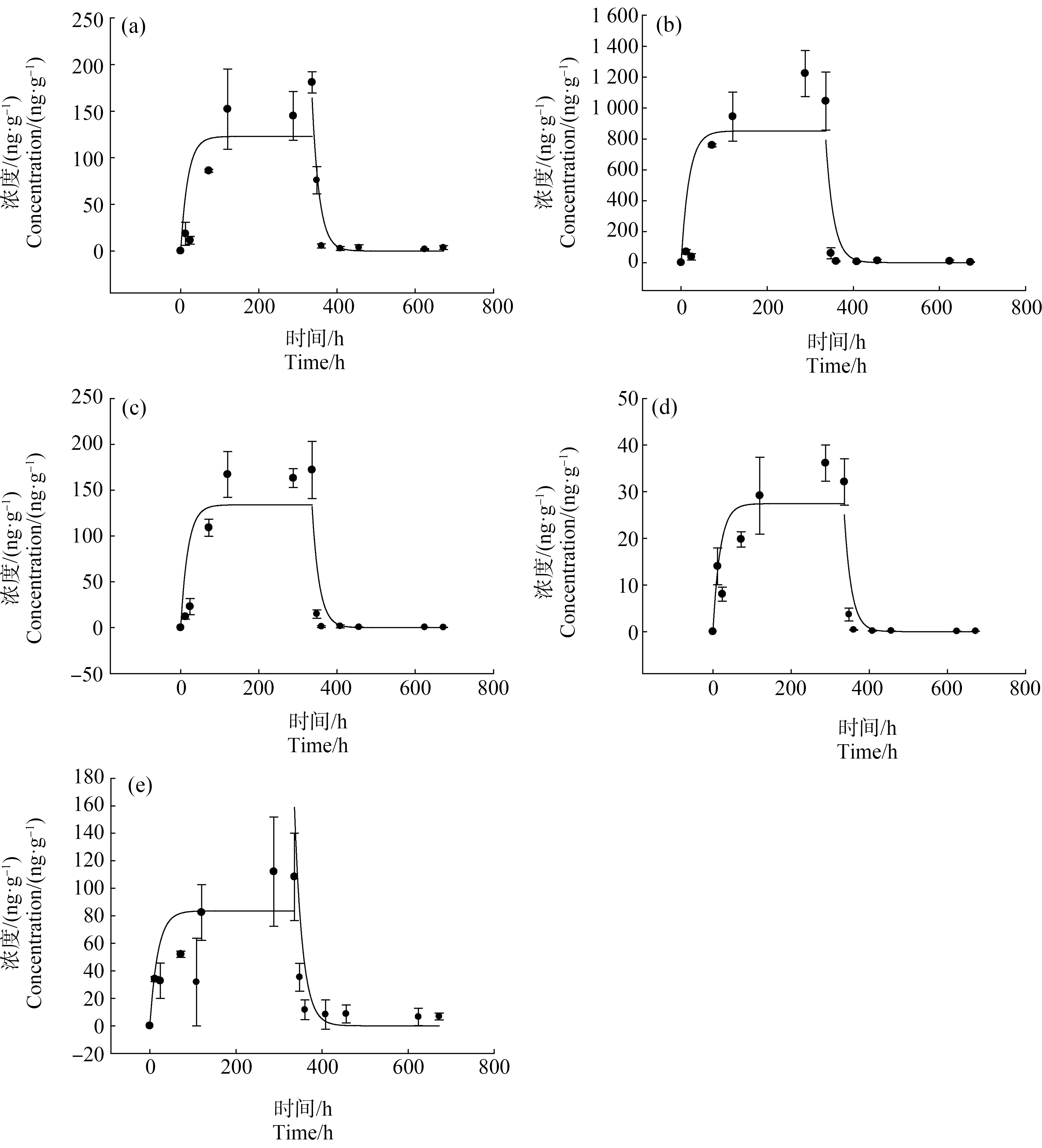
图1 三氯卡班在鱼体肝(a)、胃(b)、鳃(c)、肌肉(d)和肾(e)组织中的吸收及净化动力学曲线
Fig. 1 The kinetics curves of uptake (0~336 h) and metabolism (336~672 h) of triclocarban in the tissues of liver (a), stomach (b), gill (c), muscle (d), and kidney (e) of tilapia
表1 三氯卡班的吸收和净化动力学拟合结果
Table 1 The toxicokinetic equations and indices of triclocarban in liver, stomach, gill, muscle, and kidney samples of tilapia
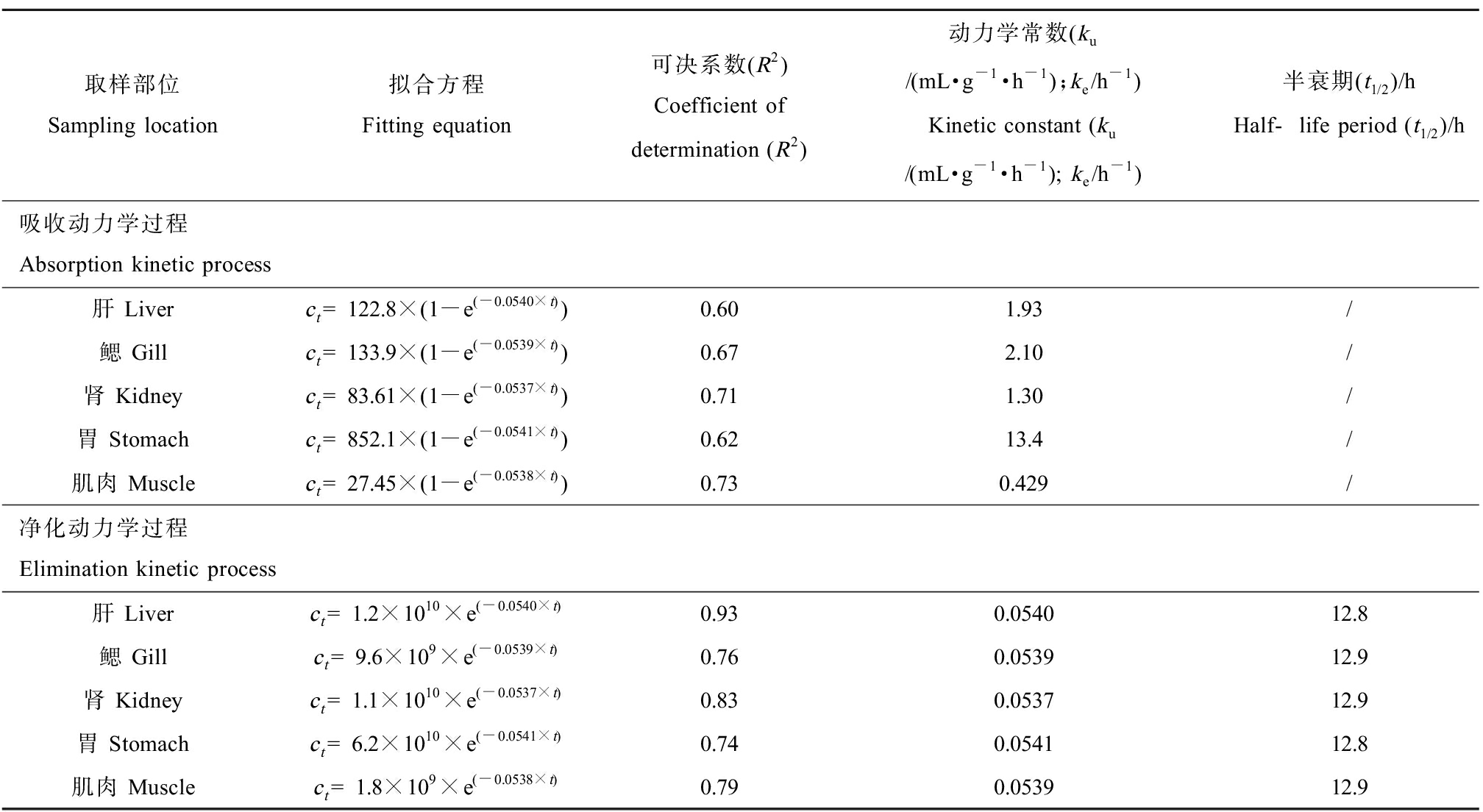
取样部位Sampling location拟合方程Fitting equation可决系数(R2)Coefficient of determination (R2)动力学常数(ku/(mL·g-1·h-1);ke/h-1)Kinetic constant (ku/(mL·g-1·h-1); ke/h-1)半衰期(t1/2)/hHalf-life period (t1/2)/h吸收动力学过程Absorption kinetic process肝 Liverct=122.8×(1-e(-0.0540×t))0.601.93/鳃 Gillct=133.9×(1-e(-0.0539×t))0.672.10/肾 Kidneyct=83.61×(1-e(-0.0537×t))0.711.30/胃 Stomachct=852.1×(1-e(-0.0541×t))0.6213.4/肌肉 Musclect=27.45×(1-e(-0.0538×t))0.730.429/净化动力学过程Elimination kinetic process肝 Liverct=1.2×1010×e(-0.0540×t)0.930.054012.8鳃 Gillct=9.6×109×e(-0.0539×t)0.760.053912.9肾 Kidneyct=1.1×1010×e(-0.0537×t)0.830.053712.9胃 Stomachct=6.2×1010×e(-0.0541×t)0.740.054112.8肌肉 Musclect=1.8×109×e(-0.0538×t)0.790.053912.9
注:ku表示吸收动力学常数,ke表示净化动力学常数。
Note: ku stands for absorption kinetic constant, and ke stands for elimination kinetic constant.
三氯卡班在罗非鱼组织(肝、鳃、肾、胃、肉)中的净化动力学曲线如图1所示。净化期的第24小时(即动力学试验第15天),三氯卡班在鱼体组织中的浓度达到最低值,并在净化期的第1天至第14天(即动力学试验第28天)保持稳定。净化期第24小时,三氯卡班在罗非鱼肝、鳃、肾、胃和肉中的稳定浓度分别为5.4、1.2、11.6、8.7和0.4 ng·g-1,说明三氯卡班在消化器官肝、肾和胃中依旧有较高残留,这可能是因为三氯卡班的脂溶性较高(log Kow=4.9)[15],不容易被脂肪含量较高的消化器官彻底净化。由表1可知,三氯卡班在鱼体肝、鳃、肾、胃和肉中的净化动力学过程均符合伪一级动力学方程,方程拟合可决系数(R2)分别为0.93、0.76、0.83、0.74和0.79;三氯卡班在罗非鱼肝、鳃、肾、胃和肉中的ke分别为0.0540、0.0539、0.0537、0.0541和0.0539·h-1,根据ke值进一步计算获得三氯卡班在罗非鱼肝、鳃、肾、胃和肉中的半衰期t1/2分别为12.8、12.9、12.9、12.8和12.9 h,整体而言,三氯卡班在鱼体组织中的净化速度比较接近。
2.2 三氯卡班的组织分配规律
根据上述吸收动力学试验结果,第120小时至第336小时阶段,三氯卡班在鱼体组织中已达到吸收/净化动力学平衡,于吸收动力学试验结束的时刻(336 h),另取3条暴露后的罗非鱼,解剖取各组织,分析达到平衡时三氯卡班在鱼体内的组织分配规律。结果如图2所示,三氯卡班在罗非鱼血浆、胆汁、肉、皮、脑、肾、鳃、肝、胃、肠中的浓度分别为1.3 ng·mL-1、21.8 ng·mL-1、23.3 ng·g-1、38.6 ng·g-1、51.7 ng·g-1、202 ng·g-1、223 ng·g-1、258 ng·g-1、1 039 ng·g-1、1 290 ng·g-1;根据暴露水体中三氯卡班的平均浓度1.98 μg·L-1,进一步计算获得三氯卡班在罗非鱼血浆、胆汁、肉、皮、脑、肾、鳃、肝、胃、肠中的稳态生物浓缩系数对数值log(BCFss)分别为-0.18、1.04、1.07、1.29、1.42、2.01、2.05、2.11、2.72、2.81。非参数Kruskal-Wallis检验结果显示,肉、皮和脑的log(BCFss)值不存在显著性差异(P>0.05),肾、鳃和肝的log(BCFss)值不存在显著性差异(P>0.05),肠和胃的log(BCFss)值也不存在显著性差异(P>0.05)。比较可知,三氯卡班在罗非鱼各组织中的稳态浓缩水平顺序为:肠、胃>肝、鳃、肾>脑、皮、肉>胆汁、血浆。根据动力学参数,计算获得三氯卡班在罗非鱼肝、鳃、肾、胃、肉中的动力学生物浓缩系数对数值log(BCFK)分别为1.55、1.59、1.38、2.39、0.91,各组织中的动力学生物浓缩系数BCFK均略低于其稳态生物浓缩系数BCFss。这可能是由于暴露试验期间,受试罗非鱼的生长造成其体内三氯卡班的浓度被稀释,导致拟合计算获得的各组织ke高于实际值,从而使计算的动力学生物浓缩系数对数值log(BCFK)偏低[20],也可能是由于暴露水体中三氯卡班的浓度存在波动,而计算BCFss值时取三氯卡班浓度的平均值,导致计算的BCFss值存在误差。结果显示,三氯卡班在胃、肠和肝中的富集水平较高,在血浆、胆汁中富集很少,说明达到稳态平衡时,三氯卡班主要富集在胃肠道等消化器官中,在液态组织部位血液和胆汁中存在很少,这与我们前期在野生鱼体内的调查结果相似[7,21]。值得注意的是,三氯卡班能突破血脑屏障富集在罗非鱼的脑组织部位,需要加强三氯卡班对罗非鱼的生态毒性及行为影响研究。
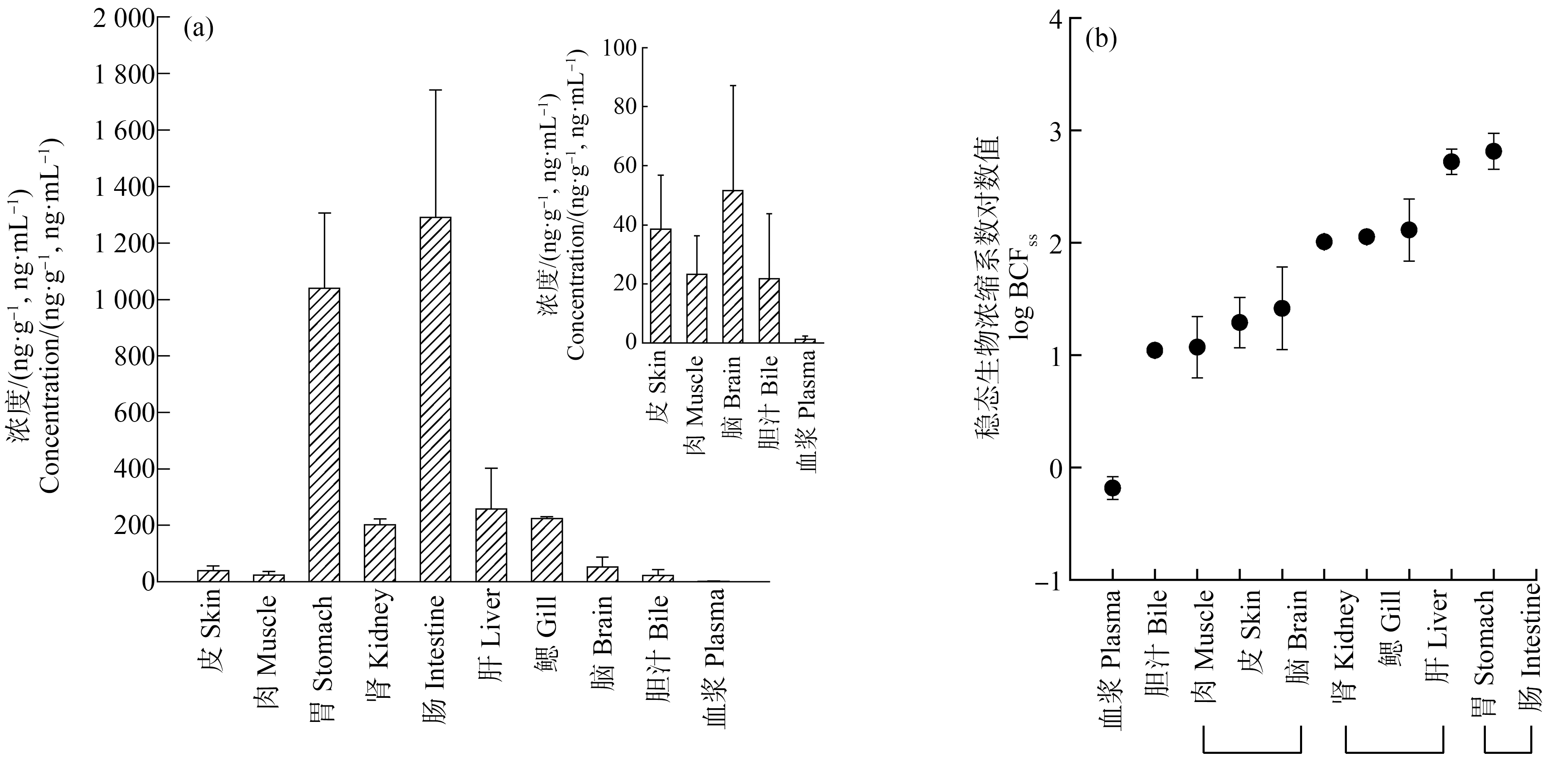
图2 三氯卡班在鱼体内各组织的含量(a)及稳态生物浓缩系数对数(b)
注:胆汁和血浆浓度单位为ng·mL-1,其余组织浓度单位为ng·g-1。
Fig. 2 The bioaccumulation characteristics of triclocarban in tissues of tilapia, as tissue concentrations (a), and the logarithm values of the steady state bioconcentration (b) in tissues
Note: The unit of concentrations for bile and plasma is ng·mL-1, and the unit of concentrations for other tissues is ng·g-1.
我们前期野外调查的结果显示,三氯卡班在长江流域野生鱼体肌肉和肝脏中的生物富集系数log(BAF)平均值分别为2.41和2.53,高于本研究室内暴露试验中三氯卡班的生物富集水平。这可能是由于三氯卡班不断排入环境水体,导致其在地表水、藻类[22]、虾等水生生物[23]中均普遍存在,野生鱼类不仅可以通过鳃从水中吸收三氯卡班,还可以通过捕食低等水生动植物摄取三氯卡班。然而,鱼类对污染物的净化速率有限,使得三氯卡班在鱼体内不断积累,最终导致野外调查获得的生物富集系数log(BAF)高于室内单一水体暴露时的生物浓缩系数log(BCFss)。上述结果说明,生物在野外的生存条件更复杂,野生生物对污染物的实际负荷可能比实验室暴露模拟的情况更严重[24]。
2.3 三氯卡班的组织代谢产物
采用高分辨质谱QTOF对达到吸收和净化动力学平衡时鱼体各组织提取液进行扫描,通过保留时间和分子离子的精确质量数进行定性分析,在鱼体肝、鳃、肉、皮、肠中均识别出三氯卡班的羟基化代谢产物(C13H9Cl3N2O2)以及羟基化+硫酸化代谢产物(C13H9Cl3N2SO5),其特征离子m/z分别为328.9657和408.9225(图3),此外,在胆汁中也可发现三氯卡班的羟基化+硫酸化代谢产物。由QTOF的半定量结果可知,鱼体内三氯卡班的羟基化+硫酸化代谢产物含量相比羟基化代谢产物含量更高,主要存在于肠组织,其次为肝和鳃组织,在皮和肌肉组织中含量相对较低,这与三氯卡班在鱼体内的富集趋势一致。前期研究结果通过高浓度暴露,识别出了三氯卡班在生物肝细胞和肠道中的代谢途径,与本研究结果一致:Wang等[25]研究也发现,给小鼠连续投喂含三氯卡班(80 mg·L-1)的食物28 d后,在小鼠肠道组织内可以检测到三氯卡班的羟基化代谢产物和羟基化+硫酸化代谢产物;而Zhang等[26]通过体外实验证实,将人体肝细胞置于含三氯卡班(10 μmol·L-1)的培养基中暴露48 h后,可以检测到三氯卡班的羟基化+硫酸化代谢产物。这说明三氯卡班进入生物体后,主要经历Ⅰ相代谢途径的羟基化和Ⅱ相代谢途径的硫酸化转化过程,生成水溶性更强的代谢产物。

图3 代谢产物及其同位素标记物提取离子色谱图
注:m/z表示质荷比。
Fig. 3 The extracted ion chromatogram (EIC) of the metabolites and their isotopically labeled ions which having 6 heavy atoms substituted
Note: m/z stands for charge to mass ratio.
本研究将罗非鱼置于环境相关浓度(2 μg·L-1)进行暴露,研究了三氯卡班在鱼体组织内的吸收、富集分配及代谢过程,找到了吸收速率较快的胃组织,识别出富集水平较高的胃、肠组织,鉴定出羟基化三氯卡班及羟基化+硫酸化三氯卡班2种主要的代谢产物。然而,由于暴露浓度较低,没有捕捉到三氯卡班在各组织中的代谢产物随时间的变化规律,后续研究中可以通过提高暴露浓度,增加采样频次,深入研究三氯卡班在生物体各组织中的代谢产物随时间的变化趋势,作为现有研究的有效补充。
[1] Cui Z H, He F L, Li X X, et al. Response pathways of superoxide dismutase and catalase under the regulation of triclocarban-triggered oxidative stress in Eisenia foetida: Comprehensive mechanism analysis based on cytotoxicity and binding model [J]. The Science of the Total Environment, 2022, 1: 158821
[2] Zhao J L, Ying G G, Liu Y S, et al. Occurrence and risks of triclosan and triclocarban in the Pearl River system, South China: From source to the receiving environment [J]. Journal of Hazardous Materials, 2010, 179(1-3): 215-222
[3] Zhao J L, Zhang Q Q, Chen F, et al. Evaluation of triclosan and triclocarban at river basin scale using monitoring and modeling tools: Implications for controlling of urban domestic sewage discharge [J]. Water Research, 2013, 47(1): 395-405
[4] Yun H, Liang B, Kong D Y, et al. Fate, risk and removal of triclocarban: A critical review [J]. Journal of Hazardous Materials, 2020, 387: 121944
[5] Wang X K, Jiang X J, Wang Y N, et al. Occurrence, distribution, and multi-phase partitioning of triclocarban and triclosan in an urban river receiving wastewater treatment plants effluent in China [J]. Environmental Science and Pollution Research International, 2014, 21(11): 7065-7074
[6] Liu W R, Zhao J L, Liu Y S, et al. Biocides in the Yangtze River of China: Spatiotemporal distribution, mass load and risk assessment [J]. Environmental Pollution, 2015, 200: 53-63
[7] Yao L, Zhao J L, Liu Y S, et al. Personal care products in wild fish in two main Chinese rivers: Bioaccumulation potential and human health risks [J]. The Science of the Total Environment, 2018, 621: 1093-1102
[8] Tamura I, Kagota K, Yasuda Y, et al. Ecotoxicity and screening level ecotoxicological risk assessment of five antimicrobial agents: Triclosan, triclocarban, resorcinol, phenoxyethanol and p-thymol [J]. Journal of Applied Toxicology, 2013, 33(11): 1222-1229
[9] Brausch J M, Rand G M. A review of personal care products in the aquatic environment: Environmental concentrations and toxicity [J]. Chemosphere, 2011, 82(11): 1518-1532
[10] Giudice B D, Young T M. The antimicrobial triclocarban stimulates embryo production in the freshwater mudsnail Potamopyrgus antipodarum [J]. Environmental Toxicology and Chemistry, 2010, 29(4): 966-970
[11] Zenobio J E, Sanchez B C, Archuleta L C, et al. Effects of triclocarban, N,N-diethyl-meta-toluamide, and a mixture of pharmaceuticals and personal care products on fathead minnows (Pimephales promelas) [J]. Environmental Toxicology and Chemistry, 2014, 33(4): 910-919
[12] Wang P P, Du Z K, Gao S X, et al. Impairment of reproduction of adult zebrafish (Danio rerio) by binary mixtures of environmentally relevant concentrations of triclocarban and inorganic mercury [J]. Ecotoxicology and Environmental Safety, 2016, 134: 124-132
[13] Dong X, Xu H, Wu X Y, et al. Multiple bioanalytical method to reveal developmental biological responses in zebrafish embryos exposed to triclocarban [J]. Chemosphere, 2018, 193: 251-258
[14] Vimalkumar K, Arun E, Krishna-Kumar S, et al. Occurrence of triclocarban and benzotriazole ultraviolet stabilizers in water, sediment, and fish from Indian rivers [J]. The Science of the Total Environment, 2018, 625: 1351-1360
[15] Yao L, Zhao J L, Liu Y S, et al. Simultaneous determination of 24 personal care products in fish muscle and liver tissues using QuEChERS extraction coupled with ultra pressure liquid chromatography-tandem mass spectrometry and gas chromatography-mass spectrometer analyses [J]. Analytical and Bioanalytical Chemistry, 2016, 408(28): 8177-8193
[16] Yao L, Lv Y Z, Zhang L J, et al. Determination of 24 personal care products in fish bile using hybrid solvent precipitation and dispersive solid phase extraction cleanup with ultrahigh performance liquid chromatography-tandem mass spectrometry and gas chromatography-mass spectrometry [J]. Journal of Chromatography A, 2018, 1551: 29-40
[17] Landrum P F, Lydy M J, Lee HⅡ. Toxicokinetics in aquatic systems: Model comparisons and use in hazard assessment [J]. Environmental Toxicology and Chemistry, 1992, 11(12): 1709-1725
[18] Zhao J L, Furlong E T, Schoenfuss H L, et al. Uptake and disposition of select pharmaceuticals by bluegill exposed at constant concentrations in a flow-through aquatic exposure system [J]. Environmental Science &Technology, 2017, 51(8): 4434-4444
[19] Kobayashi J, Kinoshita K, Mizukawa K, et al. Dietary uptake kinetics of polychlorinated biphenyls from sediment-contaminated sandworms in a marine benthic fish (Pseudopleuronectes yokohamae) [J]. Chemosphere, 2011, 82(5): 745-750
[20] Organization for Economic Co-operation and Development (OECD). Guidance document of aspects of OECD TG 305 on fish bioaccumulation [R]. Paris: OECD, 2017
[21] Yao L, Lv Y Z, Zhang L J, et al. Bioaccumulation and risks of 24 personal care products in plasma of wild fish from the Yangtze River, China [J]. The Science of the Total Environment, 2019, 665: 810-819
[22] Coogan M A, Edziyie R E, La Point T W, et al. Algal bioaccumulation of triclocarban, triclosan, and methyl-triclosan in a North Texas wastewater treatment plant receiving stream [J]. Chemosphere, 2007, 67(10): 1911-1918
[23] Peng X Z, Zheng K, Liu J, et al. Body size-dependent bioaccumulation, tissue distribution, and trophic and maternal transfer of phenolic endocrine-disrupting contaminants in a freshwater ecosystem [J]. Environmental Toxicology and Chemistry, 2018, 37(7): 1811-1823
[24] 姚理, 马艳芳, 周漪波, 等. 氯咪巴唑在鱼体的富集和代谢动力学[J]. 中国环境科学, 2019, 39(8): 3501-3507
Yao L, Ma Y F, Zhou Y B, et al. The bioaccumulation and metabolic kinetics of climbazole in fish [J]. China Environmental Science, 2019, 39(8): 3501-3507 (in Chinese)
[25] Wang G Q, Zhang H N, Zhang J N, et al. Metabolic fate of environmental chemical triclocarban in colon tissues: Roles of gut microbiota involved [J]. The Science of the Total Environment, 2021, 787: 147677
[26] Zhang H N, Lu Y, Liang Y S, et al. Triclocarban-induced responses of endogenous and xenobiotic metabolism in human hepatic cells: Toxicity assessment based on nontargeted metabolomics approach [J]. Journal of Hazardous Materials, 2020, 392: 122475