胶质母细胞瘤(glioblastoma, GBM)是恶性程度最高的脑肿瘤[1],占成人恶性原发脑肿瘤的70%,是最常见的恶性脑肿瘤[2]。GBM起源于脑或脊髓中的神经元或星形胶质细胞,患者癌症进程进展迅速,中位总生存期仅为16~21个月[3],其标准治疗手段一般包括手术切除和放化疗,然而由于GBM的弥漫性,无法通过手术切除全部的病灶,导致以现有手段无法治愈,GBM的复发率和死亡率居高不下。环氧合酶2(cyclooxygenase 2, COX2)能催化花生四烯酸(arachidonic acid, AA)转化为前列腺素(prostaglandin, PG),其编码基因为PTGS2。COX2在正常生理条件下几乎不表达,但在组织器官受损后被显著上调,参与炎症反应并通过诱导上皮间充质转化增强细胞存活以促进组织再生[4]。持续高表达的COX2常见于各种恶性肿瘤和癌前状态,如GBM[5]、乳腺癌[6]和宫颈癌症[7]等,并参与诸多肿瘤生理活动,如血管生成、免疫抑制、迁移侵袭以及化疗抵抗等[8-10]。
芳香烃受体(aryl hydrocarbon receptor, AhR)通路是介导二噁英化合物毒性作用的经典路径[11],在生殖、心血管和免疫等发育和功能作用中扮演着至关重要的角色[12]。二噁英以配体的形式与AhR结合后,能够显著上调以CYP1A1和CYP1B1为代表的P450酶家族,并影响诸多基因的转录表达进而导致机体各种生理功能紊乱。AhR参与COX2表达调控已在多种肿瘤中被证实,但AhR与COX2之间的关系仍存在争议。在GBM中,COX2能通过催化生成前列腺素E2(PGE2)促进肿瘤中AhR内源性激动剂表达上调,进而促进肿瘤免疫逃逸[13]。而在食管鳞状细胞癌中,AhR激动剂3,3’-二吲哚甲烷(3,3’-diindolylmethane, DIM)能够降低COX2/PGE2表达,最终逆转癌细胞上皮间充质转化,减缓癌症进程[14];在乳腺癌中,AhR激活降低了细胞凋亡标志蛋白(B-cell lymphoma 2, BCL2)、COX2和干细胞标志蛋白SRY盒转录因子4(SRY-box transcription factor 4, SOX4)的表达水平,并选择性地增加了肿瘤抑制基因P53的表达,促进癌细胞凋亡,在体内外实验中均能抑制乳腺癌细胞增殖[15]。
大量研究流行病学数据和体内外实验证明二噁英参与多种肿瘤的发生发展[16-19]。越战退伍军人总癌症发病率相较一般人群显著增加,在500多名女性越战退伍军人中生殖相关肿瘤发病率最高,所有退伍军人中枢神经系统癌变风险极高[20]。二噁英能够扰乱生物体内分泌系统的正常工作,进而引起神经系统发育异常、机体代谢紊乱,促进癌症的发生发展[21]。二噁英类污染物具有神经毒性。研究表明,父母职业接触农药或住宅接触农药与儿童脑肿瘤发生之间存在关联[22];2,3,7,8-二苯并-p-二噁英(2,3,7,8-tetrachlorodibenzo-p-dioxin, TCDD)暴露会导致机体神经系统发育异常,且TCDD可以通过AhR破坏神经内分泌系统的功能结构,影响脊椎动物神经系统中神经元以及胶质细胞的增殖、分化和存活[23]。二噁英经典毒性作用靶点AhR在GBM中过表达,并随胶质瘤恶性程度升高表达增加[24]。在GBM中,内源性的犬尿氨酸(kynurenine, Kyn)能通过激活AhR进而促进肿瘤增殖、维持肿瘤干细胞的干性以及促进免疫抑制微环境形成,色氨酸-2,3-双加氧酶(tryptophan-2,3-dioxygenase, TDO)和AhR调节基因的表达与GBM的恶性进展和低生存率有关[25]。二噁英能以AhR依赖的方式诱导COX2在多种组织中表达,如成纤维细胞[26]、子宫内膜细胞[27]、造血干细胞[28]以及人肺癌细胞[29],但关于二噁英化合物与GBM发生发展之间的关系有待进一步探究。
本研究旨在探究二噁英能否通过引起胶质母细胞瘤U87细胞中COX2的改变进而促进肿瘤发展。通过体外细胞实验,以毒性最强的二噁英2,3,7,8-TCDD为代表性污染物,明确二噁英污染物能否通过经典的AhR通路在U87细胞中引起下游COX2基因表达量的变化;通过转录组测序进一步分析COX2在TCDD暴露后U87细胞中经历的生理活动转变。本研究有助于扩展对二噁英在GBM发展过程影响机制上的认识,明晰AhR在这一过程中的作用和挖掘未知的下游功能基因,并为今后二噁英促癌作用的相关研究提供一些参考,也为以AhR为靶点开发的新型抗肿瘤药物提供数据支持。
1 材料与方法(Materials and methods)
1.1 材料
人胶质母细胞瘤细胞系U87购自中国医学科学院细胞资源中心。DMEM培养基、0.25%胰酶、青霉素/链霉素、胎牛血清均购自Gibco公司;二甲亚砜(dimethyl sulfoxide, DMSO;纯度99.9%)购自Sigma公司,2,3,7,8-二苯并-p-二噁英(2,3,7,8-tetrachlorodibenzo-p-dioxin, TCDD;纯度99.9%)购自Wellington公司。荧光定量PCR仪(4485694, Life, USA),PCR仪(T100TM, BIO-RAD, USA)。
1.2 细胞培养和传代
使用DMEM空白培养基混合10%胎牛血清、100 U·mL-1青霉素和100 μg·mL-1的链霉素配制为全培养基培养U87细胞。2种细胞均培养在5% CO2、饱和湿度的37 ℃恒温培养箱中。当细胞生长至80%~90%时,使用0.25%的胰酶消化,按1∶3传代。
1.3 AhR干扰RNA转染
干扰RNA转染实验按照RNAiMAX Transfection Reagent(Invitrogen)说明书进行。首先接种5×105 个细胞于6孔板中,培养24 h后,待细胞覆盖6孔板底面80%时进行转染。配制转染试剂时,先使用无血清Opti-MEM培养基分别稀释试剂Lipofectamine RNAiMAX和AhR siRNA,之后两液体按1∶1的比例涡旋混合至均匀。混合后的溶剂室温放置5 min后,6孔板的每孔加入250 μL干扰试剂,使得孔中干扰RNA含量为50 pmol,培养箱中孵育24 h后进行后续实验。正式实验前需对干扰RNA的干扰效率进行检测,通过检测目标基因的表达水平计算干扰效率。本实验中的siRNA序列如表1所示。
表1 AhR siRNA序列
Table 1 The sequence of AhR siRNA

基因Gene干扰RNA序列siRNA sequence阴性对照(NC)Negative control (NC)5’-UUCUCCGAACGUGUCACCUTT-3’5’-ACGUGACACGUUCGGAGAATT-3’AhR5’-AGGGAAAGAUGGAUCAAUATT-3’5’-UAUUGAUCCAUCUUUCCCUTT-3’
1.4 总RNA提取与cDNA合成
RNA提取采用纯化柱法,GeneJETRNA(Thermo)纯化试剂盒被用于提取细胞内总RNA。RevertiAid First Strand cDNA Synthesis(Thermo)试剂盒被用于进行逆转录实验。使用NanoDrop 2000/2000c分光光度计检测提取的RNA质量和浓度。之后使用无菌水将所有样品配制成总RNA量为2 000 ng的RNA溶液,用于后续cDNA合成。首先混匀11 μL稀释后的RNA溶液、0.5 μL Oligo(dT)18和0.5 μL Random Primer,配制总体积为12 μL的Mix1,待其在PCR仪65 ℃加热5 min后取出,再向每样品中加入4 μL Reaction Buffer(5×)、2 μL dNTP Mix、1 μL RI和1 μL RT,涡旋混匀后再次放入PCR仪中,按如下程序进行反转录:25 ℃孵育5 min,42 ℃加热1 h,70 ℃加热5 min,4 ℃冷却。-30 ℃冰箱储存cDNA样品。
1.5 实时荧光定量PCR检测目标基因表达量
反转RNA合成cDNA后,荧光定量PCR实验用于检测AhR、CYP1A1、CYP1B1和PTGS2的表达量。qPCR仪中热循环条件为:95 ℃加热2 min,95 ℃解旋15 s,60 ℃下20 s退火,72 ℃延伸20 s,变性循环共40次。最终表达量通过2-ΔΔCT值法进行计算分析。实验中,GAPDH表达恒定,被选定为内参基因,每个样品设置3个平行复孔。以上基因的引物序列均基于GenBank网站中的Primer-BLAST功能设计而得,正式实验前所有引物均已进行过引物验证,效率在0.9~1.1之间。所有引物由生工生物科技公司(北京)合成,具体序列见表2。
表2 引物序列
Table 2 Primer sequence

基因Gene引物序列Primer sequencesGAPDH(F) 5’-ATGACCCCTTCATTGACC-3’(R) 5’-GAAGATGGTGATGGGATTTC-3’AhR(F) 5’-CTGAAGTCAACCTCACCAGAAAAAT-3’(R) 5’-AAAAACAGTGACTTGTACAGCATAATGA-3’COX2(PTGS2)(F) 5’-GCTAGACAGCGTAAACTGCG-3’(R) 5’-CATCATCAGACCAGGCACCA-3’CYP1B1(F) 5’-GGCCGGTACGTTCTCCAAATC-3’(R) 5’-AACGTCATGAGTGCCGTGTGT-3’CYP1A1(F) 5’-GGGTTGACCCATAGCTTCTG-3’(R) 5’-TCCTGGAGACCTTCCGACAC-3’
1.6 转录组测序分析
TCDD处理U87细胞48 h后,根据说明书使用GeneJETRNA(Thermo)纯化试剂盒提取总mRNA,在验证完整性和纯度后,将总mRNA随机断裂成约200 bp的片段,并将RNA转录成双链DNA。通过Illumina NovaSeq 6000探测产生的DNA产物序列。为了确定2个不同样本之间的差异表达基因(different expressed genes, DEGs),根据每百万次读取的转录本方法计算每个转录本的表达水平,FC>1.5、P<0.05的基因被定义为DEGs。使用DAVID平台(https://david.ncifcrf.gov/home.jsp)对筛选出的DEGs进行KEGG和GO富集分析,分析结果中P<0.05的通路被认为具有显著性。使用Origin 2021(Northampton, MA, USA)进行绘图。使用STRING 11.5在线平台(https://cn.string-db.org/)进行蛋白相互作用分析。
1.7 数据统计与分析
实验结果的数据统计与分析通过GraphPad prism(v.7,La Jolla,CA, USA)软件进行,数值结果以平均值±标准误(n=3)显示,每次独立实验设置3次平行。最后采用单因素或双因素方差分析(ANOVA)和Bonferroni检验进行统计检验。P<0.05被认为具有统计学意义,*表示P<0.05,**为P<0.01,***为P<0.001。
2 结果(Results)
2.1 TCDD诱导U87细胞中COX2表达上调
首先,探究了TCDD在U87细胞中对COX2基因表达的影响及时间剂量效应关系。在U87中,10-8 mol·L-1 TCDD处理24 h后COX2基因表达量发生了明显变化,其表达水平升高约6倍,在处理48 h后,COX2的表达量增加至40多倍(图1(a)),说明TCDD诱导COX2基因表达上调的作用具有时间依赖性;10-13~10-8 mol·L-1 TCDD处理U87细胞48 h后,COX2基因表达量随着TCDD浓度升高而升高,具有明显的剂量依赖效应,在10-10 mol·L-1 TCDD处理后,U87中COX2的表达量上调2倍左右,具有统计学意义(图1(b))。
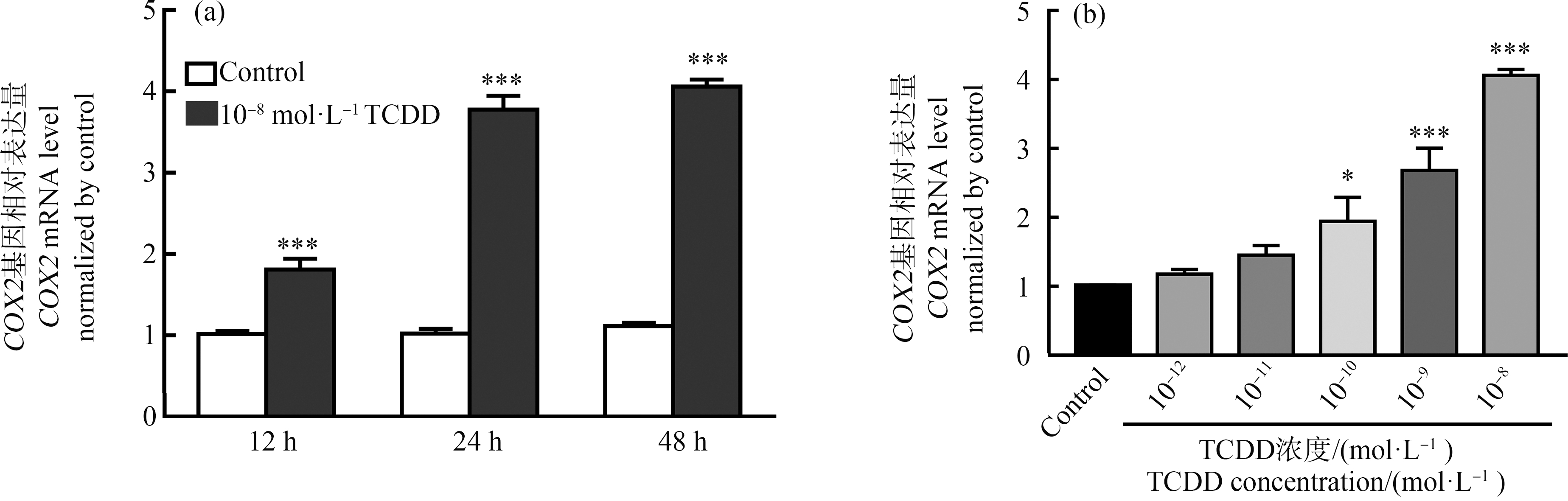
图1 TCDD诱导U87细胞中COX2表达的时间和剂量效应
注:(a) 10-8 mol·L-1 TCDD处理U87细胞12、24、48 h后COX2 (PTGS2)表达量变化的时间效应;(b) 10-13~10-8 mol·L-1 TCDD处理U87细胞48 h后COX2 (PTGS2)表达量变化的剂量效应;与对照组相比,*P<0.05,***P<0.001。
Fig. 1 The dose effect and time effect of TCDD inducing COX2 expression in U87 cells
Note: (a) Time effect of COX2 (PTGS2) expression in U87 cells treated with 10-8 mol·L-1 TCDD for 12, 24 and 48 h; (b) Dose effect of COX2 (PTGS2) expression after 10-13~10-8 mol·L-1 TCDD treatment of U87 cells for 48 h; compared with the control, *indicatess P<0.05, and ***indicates P<0.001.
2.2 AhR信号通路介导了TCDD对COX2基因表达的上调作用
分析了10-8 mol·L-1 TCDD处理U87细胞后,12、24、48 h处U87细胞中AhR基因和AhR通路下游CYP1A1、CYP1B1基因的表达情况。在U87中,AhR的表达量在TCDD处理后不同时间点处略有降低但未发生显著性变化(图2(a)),而CYP1A1与CYP1B1的表达量在3个时间点下均急剧升高,在TCDD处理24 h后,CYP1B1增至10倍左右,CYP1A1表达变化幅度更大,激增约50倍,且2个基因的表达量均随TCDD处理时间延长持续升高(图2(b)和2(c))。在系列浓度TCDD处理下,U87细胞中CYP1A1与CYP1B1的表达均显著上调,且CYP1A1上调倍数同样高于CYP1B1。当10-10 mol·L-1 TCDD处理U87细胞后,CYP1A1上调3倍左右,相对CYP1B1对TCDD刺激的响应更显著(图2(d))。
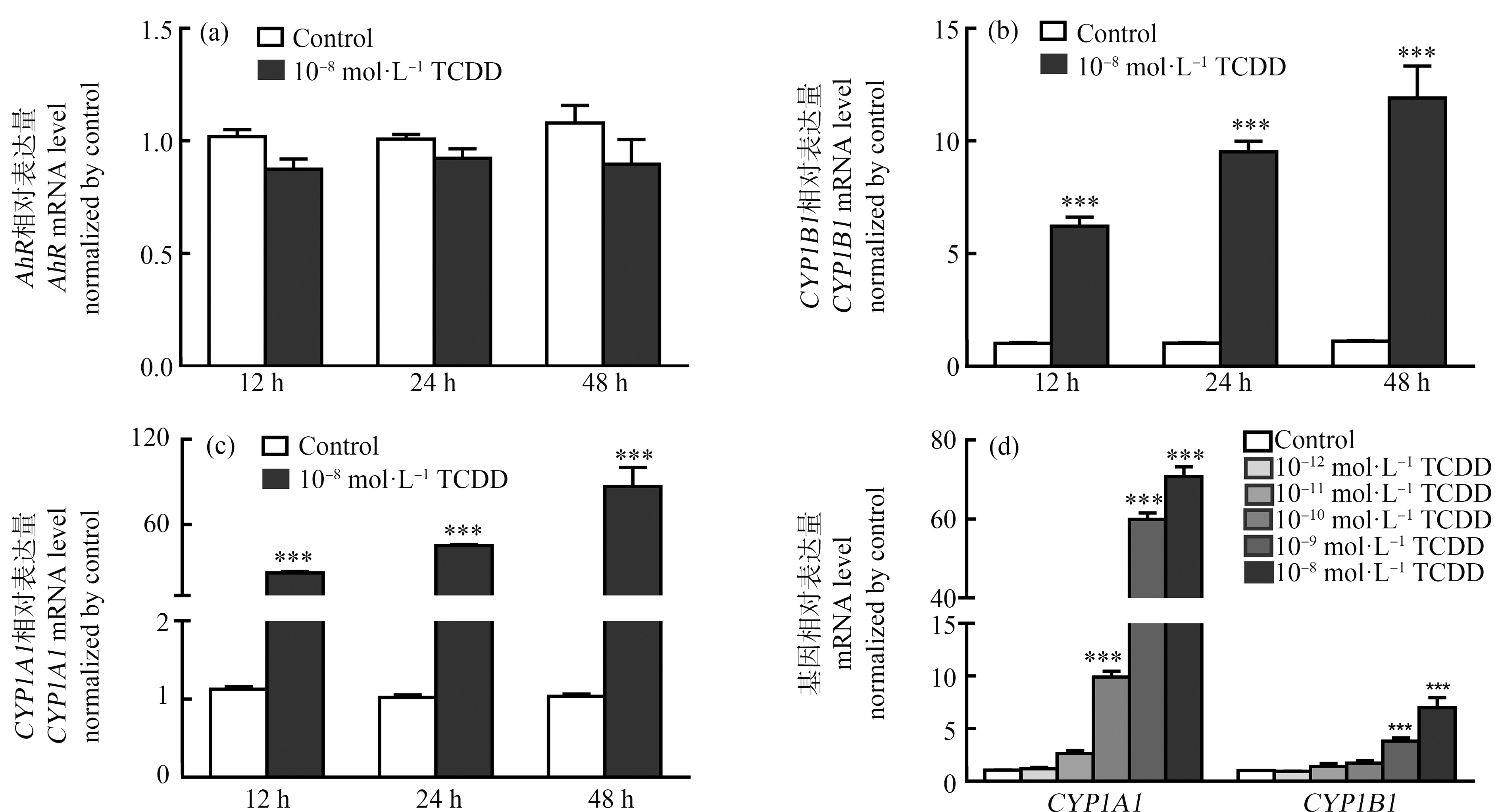
图2 TCDD处理对U87细胞中AhR信号通路的激活情况
注:(a)、(b)、(c) 10-8 mol·L-1 TCDD处理U87细胞12、24、48 h后AhR (a)、CYP1B1 (b)和CYP1A1 (c)的变化情况;(d) 在U87细胞中,10-12~10-8 mol·L-1 TCDD处理48 h后AhR下游标志基因CYP1A1和CYP1B1的表达变化情况;与对照组相比,***P<0.001。
Fig. 2 The activation of AhR pathway in U87 cells
Note: (a), (b), (c) The expression change of AhR (a), CYP1B1 (b) and CYP1A1 (c) in U87 cells after 10-8 mol·L-1 TCDD treatment for 12, 24, 48 h; (d) The expression of CYP1A1 and CYP1B1 in U87 cells after 10-12~10-8 mol·L-1 TCDD treatment for 48 h; compared with the control, ***indicates P<0.001.
为进一步探究AhR通路在TCDD对COX2基因表达调控中的作用,使用AhR siRNA处理U87细胞,观察AhR基因表达沉默后,TCDD对AhR、CYP1A1、CYP1B1和COX2(PTGS2)基因的表达影响。并检测了10-10 mol·L-1和10-9 mol·L-1 TCDD处理后AhR和CYP1A1的表达量。结果显示,使用AhR siRNA沉默AhR基因表达后,AhR基因表达下调约50%(图3(a))。同时,与NC组相比,AhR通路被显著抑制,TCDD对CYP1A1的表达上调作用在AhR沉默后被大幅抑制,尤其是在10-9 mol·L-1 TCDD暴露条件下由60倍降低至20倍(图3(b))。AhR沉默后,COX2的表达与对照组没有明显变化,但是,TCDD对COX2的表达上调作用受到显著抑制(图3(c))。在NC组内TCDD处理显著上调了COX2的表达,但在AhR siRNA处理组中,虽然TCDD处理后,COX2表达仅略有增加,并没有显著差异。同时,与NC组相比,AhR siRNA处理组中10-10 mol·L-1和10-9 mol·L-1 TCDD使得COX2基因的表达分别降低2倍和4倍,均被显著下调。
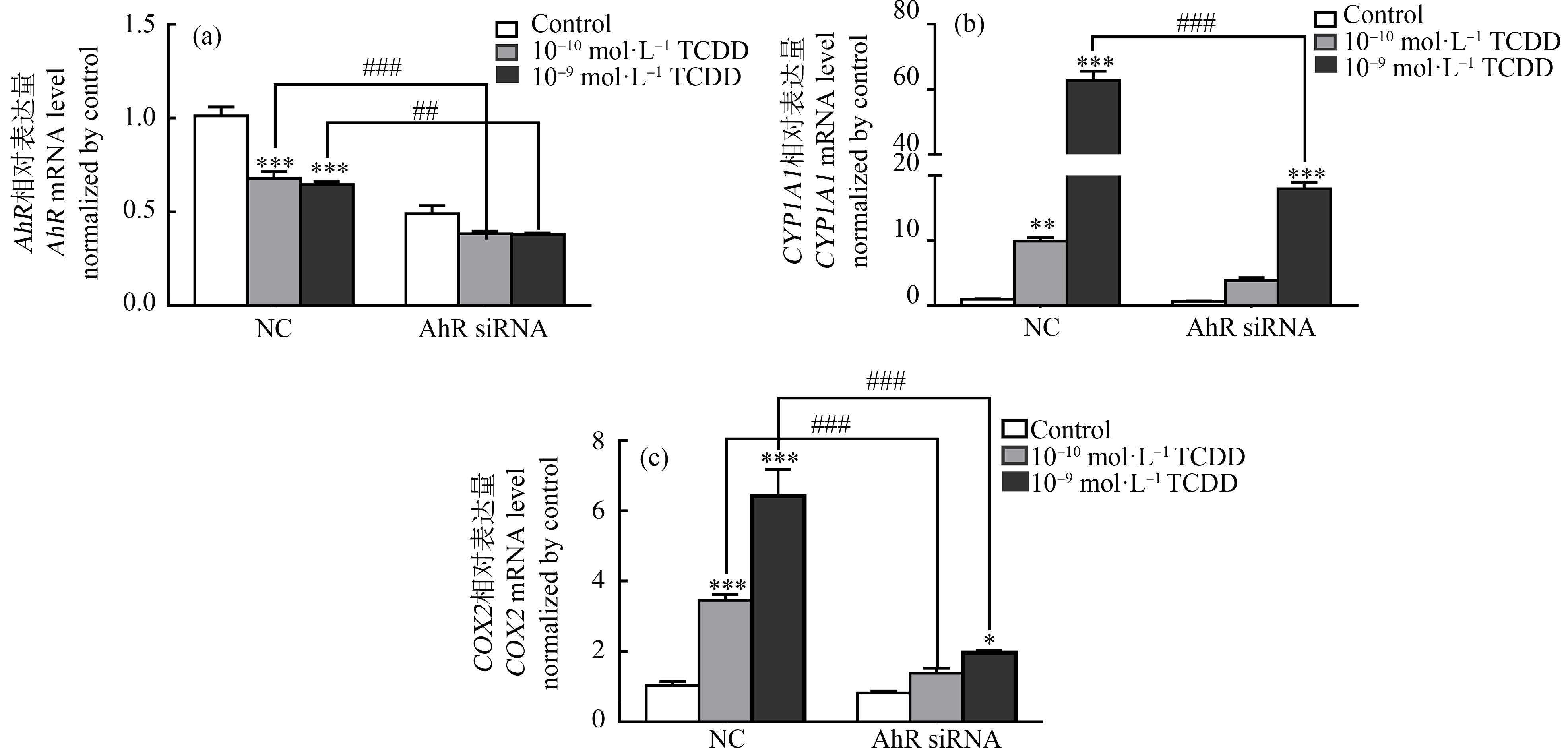
图3 AhR siRNA处理U87细胞后AhR、CYP1A1和COX2 (PTGS2)的变化情况
注:(a)、(b) AhR siRNA干扰后U87细胞以及10-10 mol·L-1和10-9 mol·L-1 TCDD处理后,AhR (a)和CYP1A1 (b)的表达情况;(c) 10-9 mol·L-1和10-10 mol·L-1 TCDD处理U87细胞后COX2 (PTGS2)表达量的变化;*表示与对照组相比具有显著性(*P<0.05、**P<0.01、***P<0.001),#表示与NC组相比变化显著(## P<0.01、### P<0.001、#### P<0.0001)。
Fig. 3 Changes of AhR, CYP1A1, COX2 (PTGS2) after treatment of U87 cells with AhR siRNA
Note: (a), (b) The expression of AhR (a) and CYP1A1 (b) in U87 cells after 10-10 mol·L-1 and 10-9 mol·L-1 TCDD treatment; (c) Changes in the expression of COX2 (PTGS2) in U87 cells treated with 10-9 mol·L-1 and 10-10 mol·L-1 TCDD; *indicates significant changes compared to the control group (*P<0.05,**P<0.01, ***P<0.001), while # indicates significant changes compared to the NC group (## P<0.01, ### P<0.001, #### P<0.0001) 。
2.3 TCDD暴露后U87细胞的基因表达谱发生变化
2.3.1 TCDD暴露改变U87细胞中的细胞黏附和膜转运活动
为进一步探究COX2表达升高的生物学意义,选择了TCDD处理U87细胞后COX2基因表达升高具有显著性的最小浓度10-10 mol·L-1 TCDD作为暴露浓度,在暴露U87细胞48 h后进行了转录组分析。共筛选出824个DEGs(fold change>1.5, P<0.05),其中包括上调基因187个,下调基因637个,转录组中所有基因的火山图如图4(a)所示。之后对筛选出的DEGs进行了KEGG和GO分析,结果如图4所示。KEGG通路富集分析显示,TCDD处理后,细胞通讯、细胞黏附和免疫相关通路更为活跃,尤其是细胞间相互作用相关通路,此外NF-κB通路也被激活(图4(b));GO生物功能分析注释表现出与KEGG相似的结果,最显著的几条富集通路显示细胞黏附、胞外刺激检测以及膜转运等功能活跃(图4(c))。
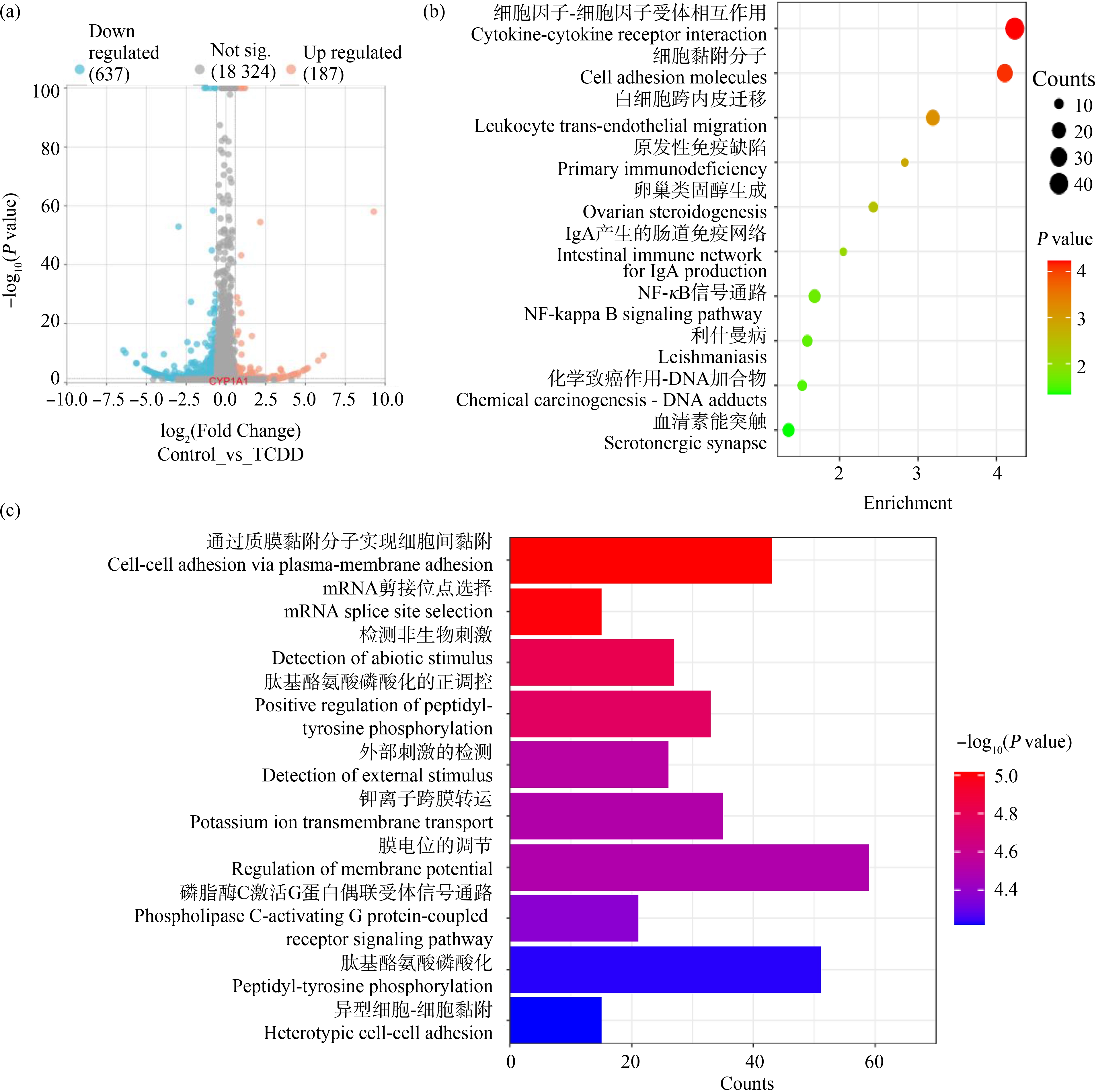
图4 转录组差异表达基因的火山图、KEGG和GO分析
注:(a) 转录组中差异表达基因火山图;10-10 mol·L-1 TCDD处理后U87细胞中总体差异表达基因的KEGG富集通路(b)和GO分析(c)。
Fig. 4 KEGG and GO enrichment analysis of differentially expressed genes
Note: (a) Volcano map of differentially expressed genes in transcriptome; KEGG (b) and GO (c) enrichment analysis of total differentially expressed genes in U87 cells after treating with 10-10 mol·L-1 TCDD.
2.3.2 COX2主要参与脂质形成和炎症响应
转录组分析结果与上文的细胞学实验结果一致,COX2的表达量在TCDD处理后相比对照组上调2.3倍。GO富集分析中COX2相关的且具有显著性的通路共有19条(图5)。其中,多肽酶活负向调节通路的显著性最高,炎症反应调节相关通路涉及最多的基因,总体而言COX2主要参与脂质形成和炎症响应相关通路。
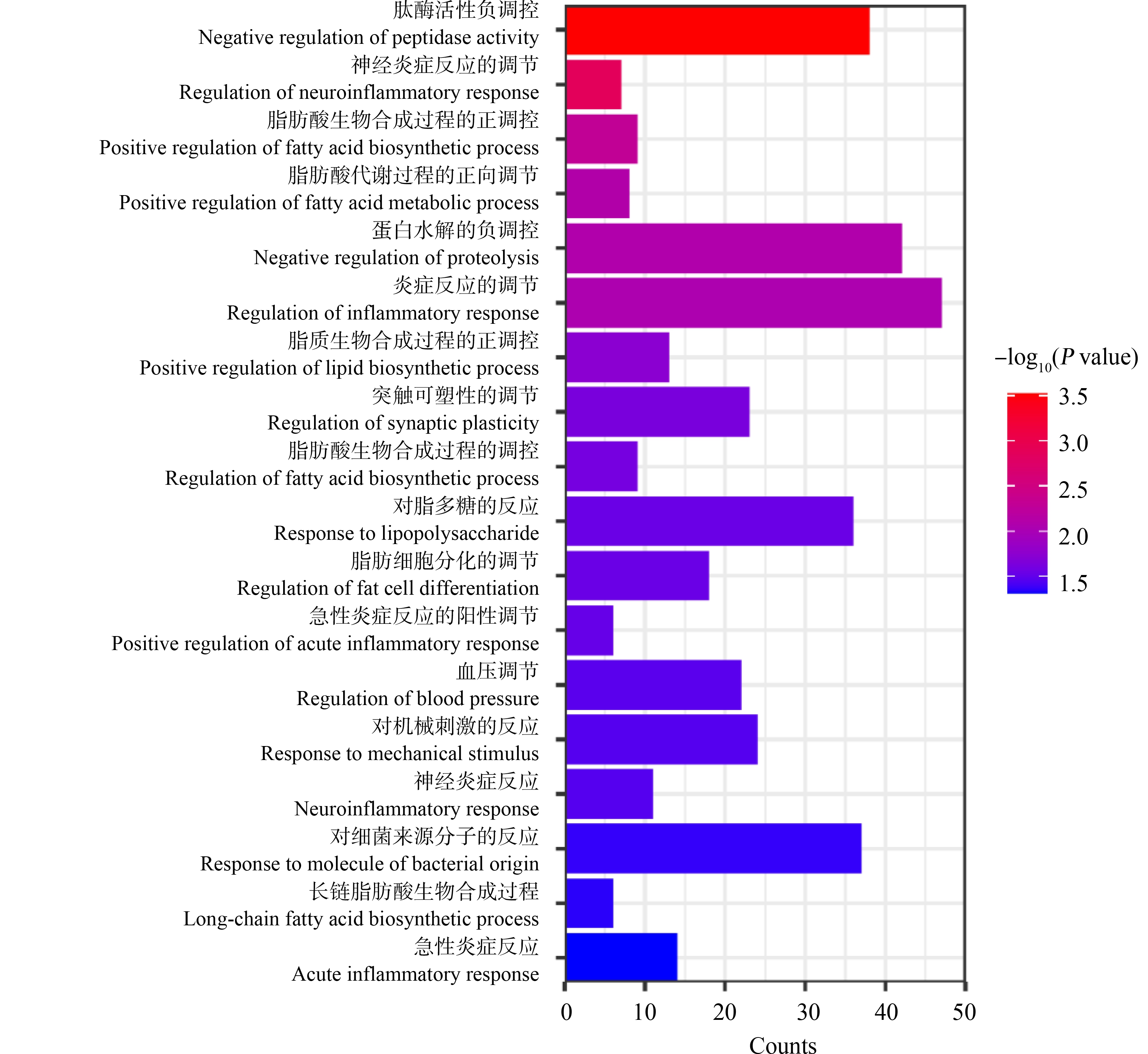
图5 GO分析中COX2参与通路
Fig. 5 Significant pathways involved in GO enrichment analysis
2.3.3 COX2的潜在调控分子机制
为进一步了解COX2影响U87细胞生理活动的作用机制,利用DEGs进行蛋白相互作用分析,并通过聚类筛选出40个与COX2相关的DEGs,其相互作用关系如图6所示,线条颜色深浅代表了两分子间联系的密切程度。其中IL1B处于网络中心,且IL1B、CYP2E1、PTGER3、KNG1和CXCL12与COX2相关,尤其是IL1B和CYP2E1。IL1B由免疫细胞、成纤维细胞或肿瘤细胞等多种细胞产生分泌,在正常情况下通过结合IL1R促进炎症发生参与先天免疫活动,在肿瘤微环境中其表达增加可促进癌细胞增殖、新血管生成或肿瘤浸润免疫细胞[30],TCDD处理后表达量增长约2.2倍;CYP2E1属于P450酶超家族,在肝脏中高表达,主要负责体内酒精、药物和环境毒素的代谢[31],TCDD处理后增长约2.9倍。

图6 蛋白相互作用网络
注:COX2参与的蛋白相互作用网络图。
Fig. 6 Network of protein-protein interaction
Note: Network diagram of protein interaction involving COX2.
因此,COX2可能通过与IL1B和CYP2E1的相互作用影响U87细胞的脂质代谢过程并维持肿瘤内部炎症反应进而影响其免疫活动。
3 讨论(Discussion)
为探究二噁英污染物在GBM中能否诱导COX2表达,本研究以TCDD为代表性二噁英化合物、U87细胞为细胞模型进行体外实验。实验数据显示,TCDD诱导COX2基因表达上调的作用具有显著的时间依赖性和剂量依赖效应;AhR在U87细胞中被TCDD显著激活,AhR下游基因CYP1A1相较CYP1B1响应更强。AhR siRNA干扰AhR表达后AhR通路被大幅抑制,尤其是在高浓度TCDD刺激时抑制作用更明显,同时COX2基因的表达量在TCDD处理后相较NC组同样被显著下调。之后为进一步探究COX2表达上调的生理学意义,对10-10 mol·L-1 TCDD处理48 h后的U87细胞进行了转录组分析,DEGs的KEGG和GO富集分析结果显示,TCDD处理后,U87细胞中细胞黏附、胞外刺激检测以及膜转运等功能活跃,此外COX2的上游NF-κB通路也被激活。进一步分析COX2参与的GO富集分析中显著的通路,发现COX2主要参与脂质形成和炎症响应等活动。最后,蛋白相互作用分析发现IL1B、CYP2E1、PTGER3、KNG1和CXCL12与COX2相关,尤其是IL1B和CYP2E1,说明COX2可能通过IL1B和CYP2E1影响U87细胞的炎症响应和脂质代谢过程(图7)。
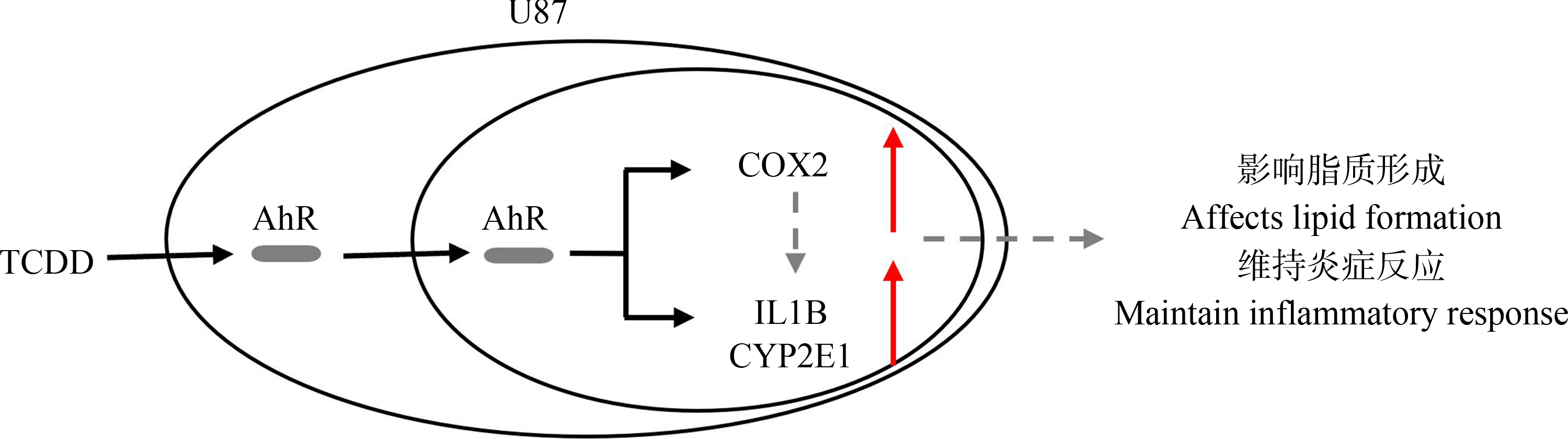
图7 本研究模式图
Fig. 7 The framework of this study
前人研究显示10-10 mol·L-1 TCDD处理U87细胞后,AhR表达水平相比对照组显著降低[19],这与本文图3(a)中NC组TCDD处理后AhR表达水平相对对照组显著降低的现象相符。AhR结合配体后会与AhR核转位子相结合并转位入核启动下游基因转录,之后AhR-配体复合物被转运到细胞质通过泛素/蛋白酶体系统被迅速降解,导致胞内AhR存在水平下降[32]。虽然TCDD刺激后AhR的存在水平有所降低,但胞内AhR处于动态平衡,刺激后AhR表达总量增高,导致胞内AhR通路活性很高。
许多研究发现AhR在GBM的发展中起到重要作用,但不同配体激活AhR导致的下游效应不尽相同。犬尿氨酸能以自分泌的方式激活GBM细胞内的AhR,促进细胞增殖、上调整合素表达,进而增强肿瘤侵袭性;AhR能促进胶质瘤细胞分泌炎症因子IL6并上调IDO表达;AhR还能驱动CD39表达,通过CD39与CD73的相互作用生成免疫抑制性腺苷,以招募巨噬细胞,影响肿瘤生长[33]。GBM中AhR的激活还被发现与细胞迁移能力相关:Liu等[19]发现AhR过表达能增加U87细胞的迁移能力,相反,敲低AhR会抑制肿瘤细胞迁移,但在AhR激动剂6-甲酰基[3,2-b]咔唑(6-formyl[3,2-b]carbazole, FICZ)和TCDD激活下,U87细胞通过AhR上调肿瘤抑制因子IL24的表达,细胞迁移能力被抑制,并在乳腺癌和肺癌细胞中发现了同样的AhR-IL24轴的抑制机制。这些研究的结果与我们的结果相似:在U87细胞中AhR通路能被配体TCDD显著激活,并可能促进肿瘤的发展。
COX2能将AA催化成PG,是机体脂质生成与转化的重要一环,在慢性和急性炎症中表达上调[34]。诸多证据表明,在GBM中COX2表达升高参与肿瘤免疫微环境形成,促进细胞增殖和增强肿瘤细胞耐药性。COX2抑制剂帕瑞考昔联合免疫疗法治疗患脑瘤大鼠能显著提高大鼠的长期治愈率[35];COX2的催化产物PGE2和IL10能分别作用在EP2/4受体和IL10受体上,激活调节NOS2和Arg1的回路,影响巨噬细胞状态,COX2抑制剂处理能使巨噬细胞重新转变为表达NSO2的抗肿瘤表型[36]。8 μmol·L-1和30 μmol·L-1的COX2抑制剂塞来昔布能引起U87细胞发生DNA损伤、抑制DNA合成,虽然U87细胞在塞来昔布处理后未发生凋亡,但其细胞周期停滞在G1期[37]。COX2/PGE2/EP4轴能激活MAPK信号通路并诱导Id1转录,促进肿瘤细胞的抗辐射能力和维持肿瘤干细胞干性[5]。以上研究表明过表达的COX2促进GBM的发展。
IL1B被证实在多种肿瘤中显著上调并且与病人预后较差有关,如黑色素瘤、结肠癌和乳腺癌,是公认的炎症因子[30]。骨髓来源抑制细胞(myeloid-derived suppressor cells, MDSCs)增加是肿瘤免疫抑制微环境的标志之一,研究发现IL1B过表达导致胃癌和纤维肉瘤中MDSC浸润增加,进而抑制肿瘤免疫[38]。CYP2E1是体内代谢脂溶性小分子外源药物和环境污染物的重要代谢酶,是机体对80多种外源性物质致癌产物代谢的第一步[39]。结合上文转录组分析结果,COX2可能是通过IL1B和CYP2E1影响U87细胞黏附和分泌活动,进而影响肿瘤细胞的迁移和免疫活动。
综上所述,本研究以TCDD为代表性二噁英化合物,以U87细胞为模型探究了二噁英在GBM中对COX2表达的诱导作用,最后通过转录组测序进一步探究TCDD暴露后U87细胞的生理变化以及COX2的潜在作用机制。实验结果显示,TCDD以AhR依赖的方式诱导U87细胞中COX2基因表达上调并具有显著的时间和剂量依赖效应。转录组分析结果表明,TCDD暴露对U87细胞中细胞黏附、胞外刺激检测以及膜转运等相关通路影响最显著,且COX2的公认上游NF-κB通路也被显著激活,COX2可能通过影响脂质形成和维持炎症反应参与U87的改变。互作分析发现IL1B、CYP2E1、PTGER3、KNG1和CXCL12与COX2相关,尤其是IL1B和CYP2E1,说明COX2可能通过IL1B和CYP2E1影响U87细胞的炎症响应和脂质代谢过程,进而影响细胞黏附以及各种细胞因子的分泌。本研究探讨了二噁英促进GBM发展的可能途径、AhR对COX2表达的调控作用以及COX2影响肿瘤活动的可能途径,有助于人们更好地了解二噁英在GBM发展过程中的机制,也为今后对二噁英促癌作用和AhR与GBM发展关系的研究提供了一些见解。
[1] Rodríguez-Camacho A, Flores-Vázquez J G, Moscardini-Martelli J, et al. Glioblastoma treatment: State-of-the-art and future perspectives [J]. International Journal of Molecular Sciences, 2022, 23(13): 7207
[2] Zhai L J, Lauing K L, Chang A L, et al. The role of IDO in brain tumor immunotherapy [J]. Journal of Neuro-Oncology, 2015, 123(3): 395-403
[3] Ladomersky E, Scholtens D M, Kocherginsky M, et al. The coincidence between increasing age, immunosuppression, and the incidence of patients with glioblastoma [J]. Frontiers in Pharmacology, 2019, 10: 200
[4] Rios A, Vargas-Robles H, Gámez-Méndez A M, et al. Cyclooxygenase-2 and kidney failure [J]. Prostaglandins &Other Lipid Mediators, 2012, 98(3-4): 86-90
[5] Cook P J, Thomas R, Kingsley P J, et al. Cox-2-derived PGE2 induces Id1-dependent radiation resistance and self-renewal in experimental glioblastoma [J]. Neuro-Oncology, 2016, 18(10): 1379-1389
[6] Lyons T R, O’Brien J, Borges V F, et al. Postpartum mammary gland involution drives progression of ductal carcinoma in situ through collagen and COX-2 [J]. Nature Medicine, 2011, 17(9): 1109-1115
[7] Manchana T, Triratanachat S, Sirisabya N, et al. Prevalence and prognostic significance of COX-2 expression in stage IB cervical cancer [J]. Gynecologic Oncology, 2006, 100(3): 556-560
[8] Gasparini G, Longo R, Sarmiento R, et al. Inhibitors of cyclo-oxygenase 2: A new class of anticancer agents? [J]. The Lancet Oncology, 2003, 4(10): 605-615
[9] Alique M, Calleros L, Luengo A, et al. Changes in extracellular matrix composition regulate cyclooxygenase-2 expression in human mesangial cells [J]. American Journal of Physiology Cell Physiology, 2011, 300(4): C907-C918
[10] Privorotskiy A, Bhavsar S P, Lang F F, et al. Impact of anesthesia and analgesia techniques on glioblastoma progression. A narrative review [J]. Neuro-Oncology Advances, 2020, 2(1): vdaa123
[11] Fernandez-Salguero P M, Hilbert D M, Rudikoff S, et al. Aryl-hydrocarbon receptor-deficient mice are resistant to 2,3,7,8-tetrachlorodibenzo-p-dioxin-induced toxicity [J]. Toxicology and Applied Pharmacology, 1996, 140(1): 173-179
[12] Shivanna B, Chu C, Moorthy B. The aryl hydrocarbon receptor (AHR): A novel therapeutic target for pulmonary diseases? [J]. International Journal of Molecular Sciences, 2022, 23(3): 1516
[13] Ochs K, Ott M, Rauschenbach K J, et al. Tryptophan-2,3-dioxygenase is regulated by prostaglandin E2 in malignant glioma via a positive signaling loop involving prostaglandin E receptor-4 [J]. Journal of Neurochemistry, 2016, 136(6): 1142-1154
[14] Zhu P Y, Yu H Y, Zhou K, et al. 3,3’-diindolylmethane modulates aryl hydrocarbon receptor of esophageal squamous cell carcinoma to reverse epithelial-mesenchymal transition through repressing RhoA/ROCK1-mediated COX2/PGE2 pathway [J]. Journal of Experimental &Clinical Cancer Research, 2020, 39(1): 113
[15] Hanieh H, Ibrahim H M, Mohammed M, et al. Activation of aryl hydrocarbon receptor signaling by gallic acid suppresses progression of human breast cancer in vitro and in vivo [J]. Phytomedicine: International Journal of Phytotherapy and Phytopharmacology, 2022, 96: 153817
[16] Enan E, El-Sabeawy F, Scott M, et al. Alterations in the growth factor signal transduction pathways and modulators of the cell cycle in endocervical cells from macaques exposed to TCDD [J]. Toxicology and Applied Pharmacology, 1998, 151(2): 283-293
[17] Warner M, Mocarelli P, Samuels S, et al. Dioxin exposure and cancer risk in the Seveso Women’s Health Study [J]. Environmental Health Perspectives, 2011, 119(12): 1700-1705
[18] Bui L C, Tomkiewicz C, Pierre S, et al. Regulation of aquaporin 3 expression by the AhR pathway is critical to cell migration [J]. Toxicological Sciences: An Official Journal of the Society of Toxicology, 2016, 149(1): 158-166
[19] Liu Y Y, Chen Y S, Sha R, et al. A new insight into the role of aryl hydrocarbon receptor (AhR) in the migration of glioblastoma by AhR-IL24 axis regulation [J]. Environment International, 2021, 154: 106658
[20] Lee W, Park S, Kang S K, et al. Cancer risk in Vietnam war veterans from the Korean Vietnam war veterans’ health study cohort [J]. Frontiers in Oncology, 2023, 13: 1048820
[21] Schug T T, Janesick A, Blumberg B, et al. Endocrine disrupting chemicals and disease susceptibility [J]. The Journal of Steroid Biochemistry and Molecular Biology, 2011, 127(3-5): 204-215
[22] Mesnil M, Defamie N, Naus C, et al. Brain disorders and chemical pollutants: A gap junction link? [J]. Biomolecules, 2020, 11(1): 51
[23] Juricek L, Coumoul X. The aryl hydrocarbon receptor and the nervous system [J]. International Journal of Molecular Sciences, 2018, 19(9): 2504
[24] Gabriely G, Wheeler M A, Takenaka M C, et al. Role of AHR and HIF-1α in glioblastoma metabolism [J]. Trends in Endocrinology and Metabolism, 2017, 28(6): 428-436
[25] Opitz C A, Litzenburger U M, Sahm F, et al. An endogenous tumour-promoting ligand of the human aryl hydrocarbon receptor [J]. Nature, 2011, 478(7368): 197-203
[26] Wölfle D, Marotzki S, Dartsch D, et al. Induction of cyclooxygenase expression and enhancement of malignant cell transformation by 2,3,7,8-tetrachlorodibenzo-p-dioxin [J]. Carcinogenesis, 2000, 21(1): 15-21
[27] Li Y, Wang K, Zou Q Y, et al. A possible role of aryl hydrocarbon receptor in spontaneous preterm birth [J]. Medical Hypotheses, 2015, 84(5): 494-497
[28] Casado F L, Singh K P, Gasiewicz T A. Aryl hydrocarbon receptor activation in hematopoietic stem/progenitor cells alters cell function and pathway-specific gene modulation reflecting changes in cellular trafficking and migration [J]. Molecular Pharmacology, 2011, 80(4): 673-682
[29] Ho I C, Lee T C. Arsenite pretreatment attenuates benzo[a]pyrene cytotoxicity in a human lung adenocarcinoma cell line by decreasing cyclooxygenase-2 levels [J]. Journal of Toxicology and Environmental Health Part A, 2002, 65(3-4): 245-263
[30] Rebe C, Ghiringhelli F. Interleukin-1beta and cancer [J]. Cancers (Basel), 2020, 12(7): 1-31
[31] Anzenbacher P, Anzenbacherová E. Cytochromes P450 and metabolism of xenobiotics [J]. Cellular and Molecular Life Sciences, 2001, 58(5): 737-747
[32] Pollenz R S. The mechanism of AH receptor protein down-regulation (degradation) and its impact on AH receptor-mediated gene regulation [J]. Chemico-Biological Interactions, 2002, 141(1-2): 41-61
[33] Lim T X, Ahamed M, Reutens D C. The aryl hydrocarbon receptor: A diagnostic and therapeutic target in glioma [J]. Drug Discovery Today, 2022, 27(2): 422-435
[34] Ye Y, Wang X P, Jeschke U, et al. COX-2-PGE2-EPs in gynecological cancers [J]. Archives of Gynecology and Obstetrics, 2020, 301(6): 1365-1375
[35] Eberstål S, Badn W, Fritzell S, et al. Inhibition of cyclooxygenase-2 enhances immunotherapy against experimental brain tumors [J]. Cancer Immunology, Immunotherapy, 2012, 61(8): 1191-1199
[36] Basudhar D, Bharadwaj G, Somasundaram V, et al. Understanding the tumour micro-environment communication network from an NOS2/COX2 perspective [J]. British Journal of Pharmacology, 2019, 176(2): 155-176
[37] Kang K B, Zhu C J, Yong S K, et al. Enhanced sensitivity of celecoxib in human glioblastoma cells: Induction of DNA damage leading to p53-dependent G1 cell cycle arrest and autophagy [J]. Molecular Cancer, 2009, 8: 66
[38] Tu S P, Bhagat G, Cui G L, et al. Overexpression of interleukin-1beta induces gastric inflammation and cancer and mobilizes myeloid-derived suppressor cells in mice [J]. Cancer Cell, 2008, 14(5): 408-419
[39] Trafalis D T, Panteli E S, Grivas A, et al. CYP2E1 and risk of chemically mediated cancers [J]. Expert Opinion on Drug Metabolism &Toxicology, 2010, 6(3): 307-319