有机磷酸酯(organophosphate esters, OPEs)是目前广泛应用的一种有机磷阻燃剂(organophosphorus flame retardants, OPFRs),常被添加至建筑、家具材料、电子设备以及塑料制品中,具有良好的阻燃和增塑效果[1]。近年来,随着多溴联苯醚(PBDEs)被逐步禁用,OPEs逐渐成为主要的替代品。随着时间推移,以物理方式添加到产品中的OPEs很容易通过挥发和溶解等作用释放到各种环境介质中。
作为一种烷基OPEs,磷酸三丁酯(TnBP)具有脂溶性高,易与有机质结合,阻燃效果好等优点[2]。在工业上作为液压油、润滑油、传动液和机油的重要组成成分,也可用作增塑剂、水消泡剂和萃取剂等[3-4]。TnBP在海洋环境中分布广泛,并在部分海域成为主要的污染单体。刘静等[5]发现TnBP是珠江三角洲广州段沉积物中的优势OPEs,浓度可达到78 ng·g-1。此外,在东海以及黄海的沿海海域也检测到浓度较高的TnBP(129 ng·L-1)[6]。目前,在哺乳类、甲壳类、软体动物、多毛类和藻类等各种海洋生物检测到TnBP[7]。例如,TnBP可富集在冠海豹(Cystophora cristata)的肌肉和脂肪等组织中,在软体动物、甲壳类动物和海鱼等可食用海产动物体内的浓度可达198、2 360和39 μg·kg-1(干质量)[8]。同时,海洋中广泛存在的TnBP也可以通过食物链传递,最终甚至会影响到人体的健康和生态安全[9]。
目前,关于TnBP在内的OPFRs生态风险备受关注。以水生生物为研究对象的毒理学已在陆续开展。研究表明,TnBP(3.125 mg·L-1, 14 d)能够引起青鳉鱼胚胎孵化率显著降低,且畸形率升高;还能引起斑马鱼和青鳉幼鱼游泳速度减慢,推测TnBP具有神经毒性效应[10]。暴露于TnBP(1.6 mg·L-1)能够对海洋轮虫产生生殖毒性效应,并干扰了其脂质代谢[11]。作为初级生产者,浮游植物是污染物进入水生食物链的起点,对污染物胁迫十分敏感。研究表明,TnBP可以破坏浮游植物细胞形态,损伤细胞膜结构和线粒体等细胞器,抑制微藻细胞的生长[12]。同时,TnBP引起了藻细胞线粒体膜电位下降,诱导细胞凋亡发生。活性氧(ROS)的水平与生长抑制和凋亡程度密切有关,同时ROS抑制剂减弱了TnBP的毒性作用。因此TnBP诱导ROS过量产生被认为藻细胞凋亡和生长抑制的原因[13]。然而对于这些活性氧如何产生,并不清楚。
对于植物细胞而言,叶绿体和线粒体的电子传递链,过氧化物酶和氧化酶以及叶绿素分子等光敏剂促使了细胞中ROS的产生[14-15]。作为一种海洋硅藻,三角褐指藻广泛分布于世界海洋中,且具有易培养、遗传背景清晰等特点,被被认为是生态毒理学研究的水生模式生物,也是化学污染物毒性生物测定的标准海洋物种[16-17]。以三角褐指藻作为受试藻种探究OPFRs的生态毒性具有较高的研究价值。在前期研究中,我们发现了线粒体是TnBP诱导ROS产生的主要来源[13],然而并不清楚其他途径是否协同参与了ROS的产生。为了进一步从分子水平上阐明氧化损伤机理,本研究通过转录组学技术研究了不同TnBP处理下三角褐指藻的基因表达情况,筛选出差异表达基因和代谢通路,并利用生理生化手段对相关结果进行验证。研究结果将为包含TnBP在内的烷基OPEs的毒性作用模式(mode of action, MOA)提供依据,对于海洋生态系统中OPFRs的风险评估具有实际意义。
1 材料与方法(Materials and methods)
1.1 实验藻种
本实验选用的三角褐指藻(Phaeodactylum tricornutum)来自中国海洋大学海洋生态学实验室的藻类培养中心。藻种接种于含有f/2培养基的锥形瓶中进行培养。所有的锥形瓶放置于恒温光照培养箱(温度(20±1) ℃,光照强度50~75 μmol·m-2·s-1,光暗比12 h∶12 h)。每天定时摇动锥形瓶2次,以防止微藻细胞下沉。处于指数生长时期的三角褐指藻用于接下来的毒性实验。
1.2 TnBP的浓度设置
TnBP粉末(分析标准品,CAS号:126-73-8),呈白色粉末状,购自Sigma Aldrich公司(St. Louis, MO, USA)。以DMSO作为助溶剂,将TnBP粉末配制成5 000 mg·L-1的母液备用,于室温下避光保存。实验前,用灭菌冷却后的过滤海水依次将母液稀释成所相应浓度的工作液,再加入各实验组中。
1.3 实验设计
参照Shi等[18]环境浓度的设定,本实验TnBP的3个浓度分别为:1.5、3.0和4.5 μmol·L-1,其中1.5 μmol·L-1代表的是各类水体中的烷基OPEs最高浓度[19]。三角褐指藻的初始密度设定为2×104 cells·mL-1,并在300 mL的锥形瓶中开展实验。于TnBP胁迫的24 h、48 h,取一定体积的藻液开展相关参数的测定。
1.3.1 藻细胞活性氧含量的测定
于每个时间点取20 mL藻液,用装有1.2 μm孔径滤膜的抽滤装置(压力小,不损伤藻细胞)收集藻细胞。将浓度为10 μmol·L-1的活性氧探针DCFH-DA添加到细胞中,并充分混匀。将混合后的细胞在37 ℃培养箱中避光孵育20 min,离心(6 000 r·min-1, 5 min, 20 ℃),用PBS(0.1 mol·L-1, pH=7.2, 4 ℃)重悬细胞,并用流式细胞仪(Cytomics FC 500 MPL, Beckman Coulter Inc, USA)检测DCF荧光。
1.3.2 转录组学研究
在本部分实验中,观察2个浓度TnBP(1.5 μmol·L-1和4.5 μmol·L-1)对三角褐指藻基因表达的影响。主要过程为:暴露24 h后,收集全部的藻细胞(1 L)。采用Trizol法提取总RNA,并利用琼脂糖凝胶电泳、Nanodrop 2 000分光光度计以及Agilent 2100 RNA 6 000 Nano kit检测RNA的纯度和完整性。随后使用DNA酶消化DNA后获得mRNA。以此为模式,合成单链cDNA和双链cDNA并纯化。对纯化的双链cDNA进行修复、测序接头,选择合适大小片段进行PCR扩增。在质检合格后,使用Illumina HiSepTM 2500测序仪进行测序。
为了得到高质量reads,对raw reads开展质量过滤。使用Trimmomatic软件过滤原始数据,并采用Trinity(version: 2.4)软件paired-end的拼接方法将clean reads拼接得到Transcript序列。采用FPKM方法对基因表达水平进行归一化处理,对Padjust<0.05和log2|fold change|>1的基因作为显著的差异表达基因(DEGs)进行比较。将所有的DEGs进行KEGG通路分析。每个实验组均具有3个生物学重复。三角褐指藻的参考基因组来自http://protists.ensembl.org/Phaeodactylum_tricornutum/Info/Index。
1.3.3 实时荧光定量PCR(qRT-PCR)验证
随机抽取3个基因,以核糖体蛋白(RPS)作为管家基因,利用qRT-PCR和2-△△Ct方法获得3个基因的相对表达量,以此来验证转录组数据的可靠性。主要步骤为,主要的差异基因与引物序列如表1所示。
表1 qRT-PCR验证中所用基因的引物序列
Table 1 The primers used in qRT-PCR validation

基因名称Gene name基因IDGene ID引物序列Primer sequence磷酸丙糖异构酶Triosephosphate isomerasePhatr3_J50738F: ATTGGAGCCGAGGGTGTTTGR: GCCAGGTCTTGTTCGTATTCβ-碳酸酐酶β-carbonic anhydrasePhatr3_J51305F: AGGATGCCGCTTATTTTGACACR: ACGGACACCACCACATTCA岩藻黄素-叶绿素a/c蛋白复合体Fucoxanthin chlorophyll a/c proteinPhatr3_EG02221F: CGCAACTTTGGGAACACTGGR: CAAAATCACCAGGCTTTCGTC核糖体蛋白RPSPhatr3_J10847F: CGAAGTCAACCAGGAAACCAAR: GTGCAAGAGACCGGACATACC
1.3.4 光合电子传递链速率
将三角褐指藻暴露于不同浓度TnBP(1.5、3.0和4.5 μmol·L-1),于24 h、48 h每个时间点取5 mL藻液。每个样品测量前进行15 min暗适应处理,然后利用叶绿素荧光仪(Water-PAM,德国Walz公司)测定光合电子传递效率(ETR)。每个处理设置3个平行。
1.3.5 谷胱甘肽(GSH)含量及其相关抗氧化酶活性测定
暴露于不同浓度TnBP(1.5、3.0和4.5 μmol·L-1)后,在不同时间点(24 h、48 h),收集40 mL藻液,抽滤获得藻细胞。倒入液氮进行研磨。研磨充分后,加入1 mL 5%三氯乙酸与粉末充分混合。5 min后,离心(6 000 r·min-1, 5 min, 4 ℃)获得上清液,参照Griffith方法[20],测定GSH和氧化型谷胱甘肽(GSSG)含量。另取40 mL藻液,收集藻细胞,然后悬浮在PBS缓冲液(0.1 mol·L-1, pH=7.2, 4 ℃)中。随后利用超声波(功率300 W,破碎2 s,间歇2 s,工作时间4 min)在低温条件下将藻细胞破碎,离心取上清液用于谷胱甘肽还原酶(GR)、抗坏血酸过氧化物酶(APx)测定。GR的测定方法参照Grace和Logan的方法[21],单位为U·mg-1。APx活性的测定参照Miyake和Asada的方法[22],单位为μmol·min-1·mg-1。细胞样品的蛋白浓度用BCA蛋白浓度测定试剂盒(上海碧云天生物技术有限公司)测定。
1.4 数据处理与分析
各组数据采取平均值±标准差表示。数据采用SPSS 24.0单因素方差分析(One-way ANOVA)和LSD多重比较进行统计分析。当P<0.05、P<0.01时,组间差异显著。采用GraphPad Prism 9软件进行绘图。
2 结果(Results)
2.1 TnBP对浮游植物细胞内ROS水平的影响
不同浓度TnBP胁迫下,三角褐指藻细胞内DCF荧光值变化如图1所示。结果发现,在24 h,与对照组相比,3.0 μmol·L-1和4.5 μmol·L-1 TnBP显著诱导三角褐指藻细胞内呈现更强的DCF荧光(P<0.01),表明ROS含量显著上升。其中4.5 μmol·L-1 TnBP组中,该荧光值约为对照组的4.02倍。但在1.5 μmol·L-1 TnBP组的DCF荧光值和对照组之间并未有明显差异。在48 h,3个浓度TnBP组中,DCF荧光值显著升高,表明三角褐指藻胞内ROS含量上升。
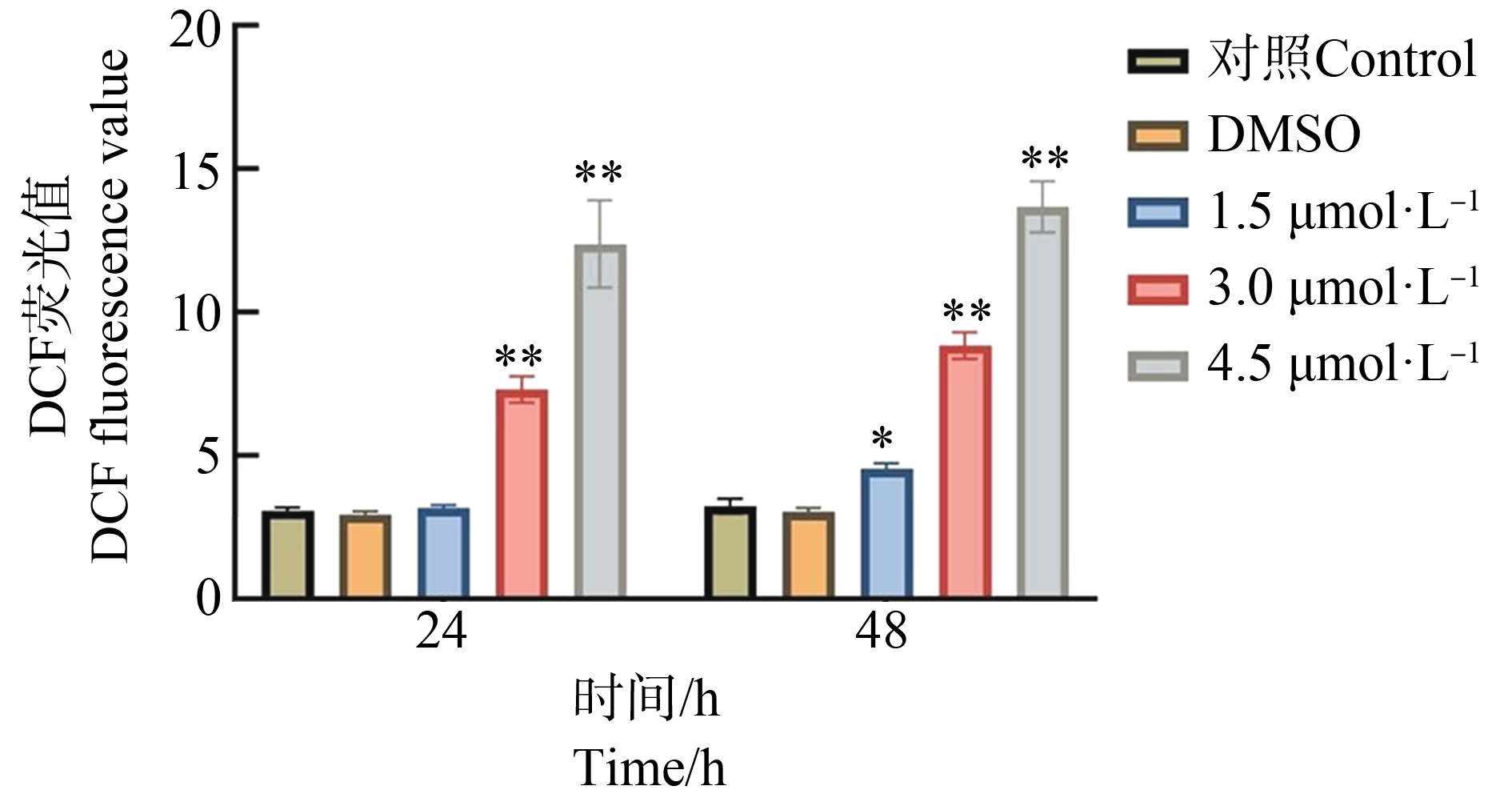
图1 磷酸三丁酯(TnBP)对三角褐指藻细胞内活性氧(ROS)水平的影响
注:与对照组相比,*P<0.05、**P<0.01。
Fig. 1 Effect of tributyl phosphate (TnBP) on the reactive oxygen species (ROS) level of P. tricornutum
Note: Compared with the control, *P<0.05, **P<0.01.
2.2 TnBP对三角褐指藻基因表达的影响
2.2.1 转录组
与对照组相比,在1.5 μmol·L-1和4.5 μmol·L-1TnBP组中,分别鉴定出1 885、3 936个差异表达基因(图2)。其中显著上调基因分别为699、1 887,显著下调的基因分别为1 186、2 049个。具有明显的剂量依赖性效应。且下调基因远多于上调基因。在各组差异基因韦恩图中,2个处理组中共有1 556个基因的表达起共同的调节作用。
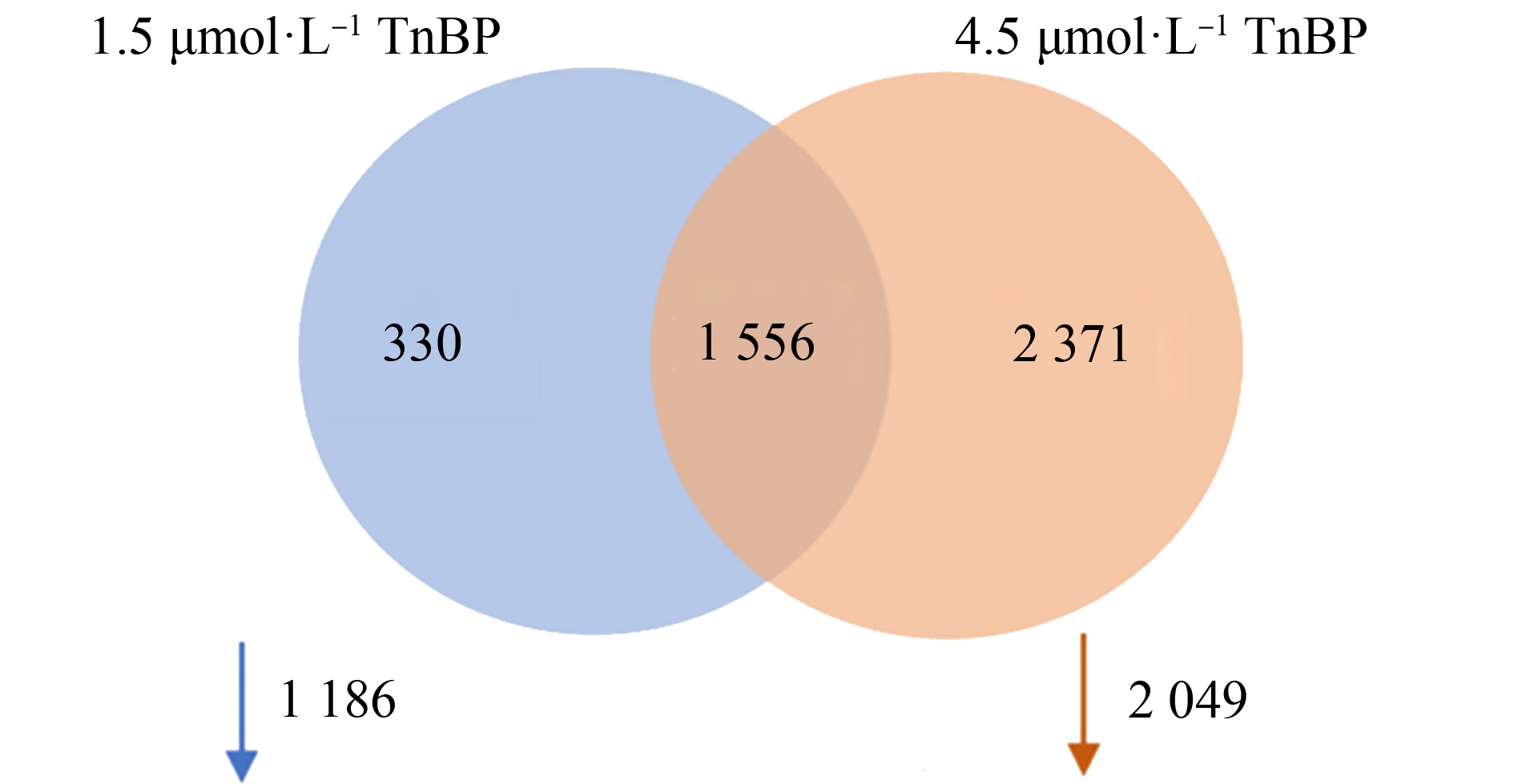
图2 TnBP暴露下三角褐指藻差异表达基因韦恩图
Fig. 2 Venn diagram of DEGs in P. tricornutum exposed to 1.5 μmol·L-1 and 4.5 μmol·L-1 TnBP
为了进一步研究差异基因所行使的主要生物学功能,将差异表达基因进行KEGG通路分析,如图3所示。KEGG代谢通路结果表明,在1.5 μmol·L-1 TnBP组和4.5 μmol·L-1 TnBP组中,RNA传递(RNA transport; ko03013)、嘧啶代谢(pyrimidine metabolism; ko00240)、真核生物的核糖体生物合成(ribosome biogenesis in eukaryotes; ko03008)等途径都是最为显著富集的通路。此外,在KEGG富集TOP20通路中,谷胱甘肽代谢(glutathione metabolism; ko00480)和光合生物固碳作用(carbon fixation in photosynthetic organisms; ko00720)也是显著富集的通路,表明三角褐指藻这些代谢通路受到了明显的影响。
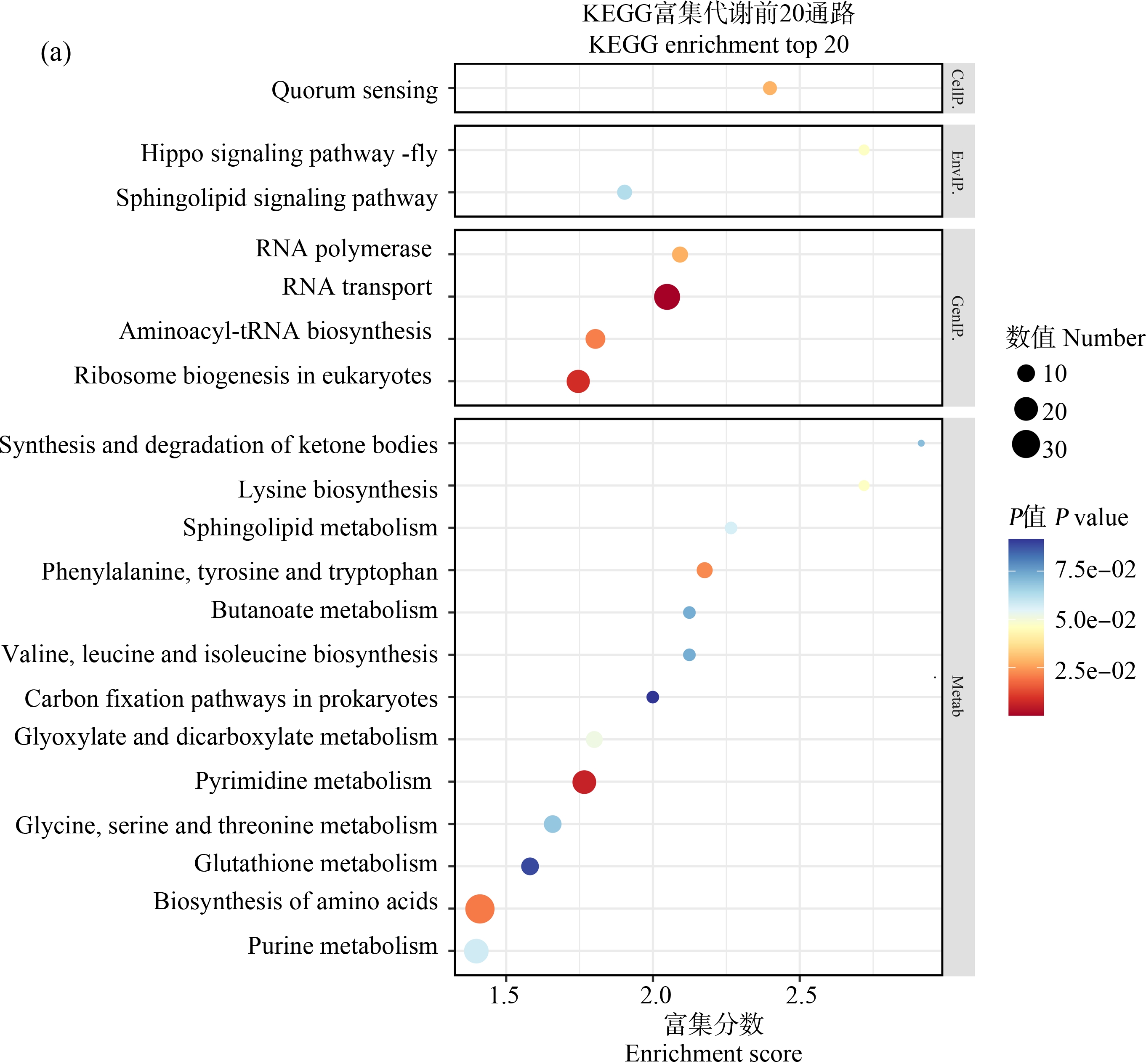

图3 KEGG富集代谢通路分析
注:(a) 1.5 μmol·L-1 TnBP组,(b) 4.5 μmol·L-1TnBP组。
Fig. 3 KEGG enriched metabolic pathway analysis
Note: (a) 1.5 μmol·L-1 TnBP exposure group, (b) 4.5 μmol·L-1 TnBP exposure group.
2.2.2 qPCR验证
为了验证转录组分析结果,随机挑选了3个基因进行了qRT-PCR分析,结果如图4所示。在1.5 μmol·L-1 TnBP组(图4(a)),Phatr3_J50738(TPI)、Phatr3_J51305(CA)、Phatr3_EG02221(LHCF17)基因表达在转录组和qRT-PCR中均呈现下调趋势。在4.5 μmol·L-1 TnBP组(图4(b)),Phatr3_J51305(CA)、Phatr3_EG02221(LHCF17)基因表达在转录组和qRT-PCR中均呈现下调趋势,而Phatr3_J50738(TPI)呈现上调趋势。因此,2种基因表达分析模式里,基因的表达呈现良好的一致性。

图4 转录组分析和qRT-PCR分析中基因表达倍数的比较
注:(a) 1.5 μmol·L-1 TnBP组,(b) 4.5 μmol·L-1 TnBP组。
Fig. 4 Comparison of fold change in gene expression between RNA-Seq analysis and qRT-PCR results
Note: (a) 1.5 μmol·L-1 TnBP exposure group, (b) 4.5 μmol·L-1 TnBP exposure group.
2.2.3 与ROS产生和清除有关基因的差异表达
接下来进一步探讨了与ROS产生和清除相关基因的表达情况。根据对照组以及2个TnBP处理组中样品的基因表达量FPKM值做热图(图5)。可以看出,TnBP在24 h之内显著抑制了岩藻黄素-叶绿素a/c蛋白复合体(Phatr3_J32294等)、细胞色素b6f复合体(Phatr3_J46657)、光合电子传递链(Phatr3_J23717等)等光合作用基因的表达。与GSH合成和代谢相关的基因如谷胱甘肽合成酶(GSH2, Phatr3_J25876)、谷胱甘肽还原酶(Phatr3_J29167)、谷胱甘肽过氧化物酶(Phatr3_J50476)等显著下调。此外,TnBP下调了与过氧化物酶体功能有关的基因如PEX1(Phatr3_J14397)、PEX3(Phatr3_J50623)、PEX5(Phatr3_J32173)等表达。结果表明,TnBP干扰了藻细胞内的ROS产生与清除机制。
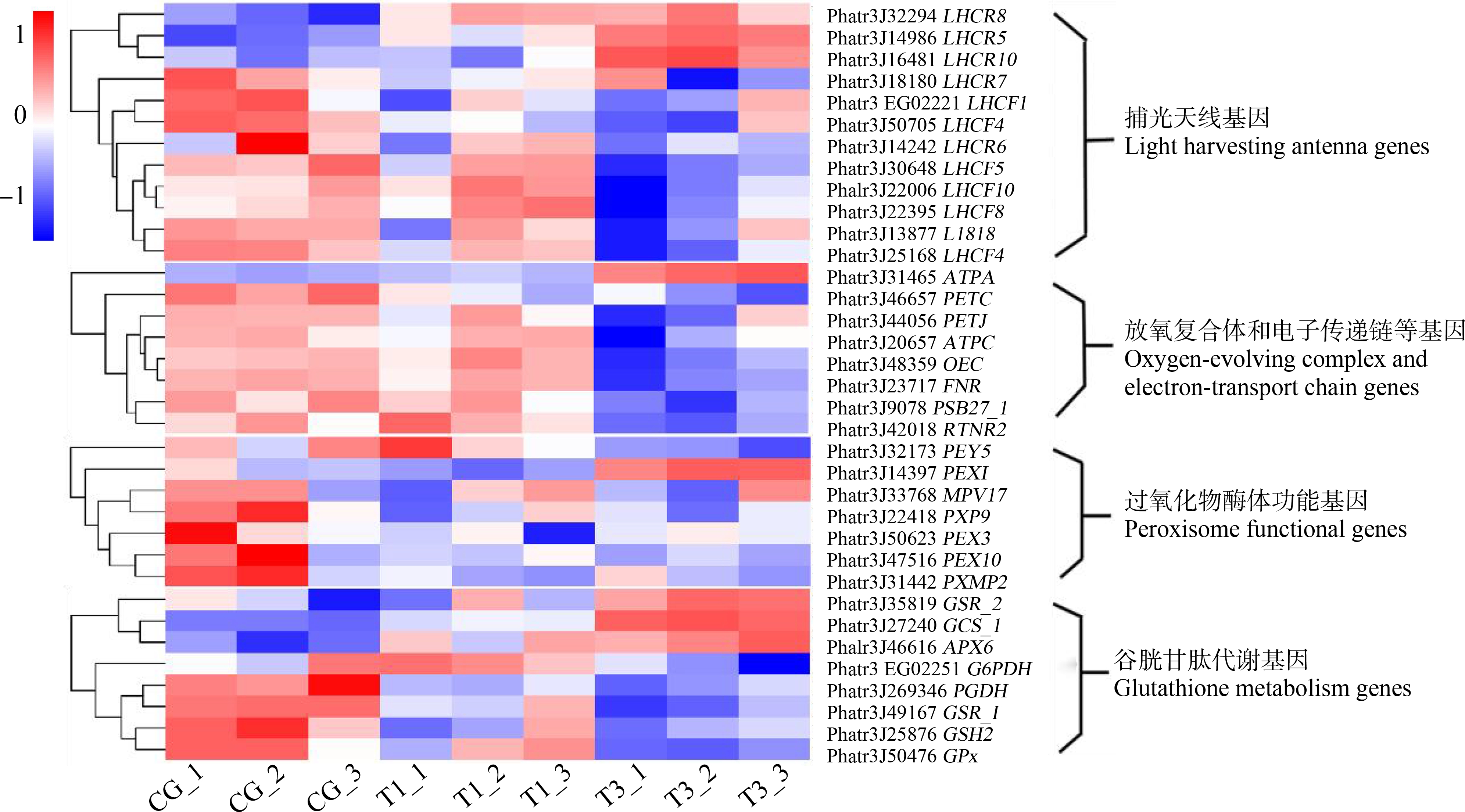
图5 不同浓度TnBP暴露下,三角褐指藻细胞内与ROS产生和清除有关的基因的表达模式
注:CG表示对照组;T1表示1.5 μmol·L-1 TnBP组;T3表示4.5 μmol·L-1 TnBP组。
Fig. 5 The expression patterns of genes involved in ROS production and removal in P. tricornutum exposed to 1.5 μmol·L-1 and 4.5 μmol·L-1 TnBP
Note: CG means blank group; T1 means 1.5 μmol·L-1 TnBP exposure group; T3 means 4.5 μmol·L-1 TnBP exposure group.
2.3 TnBP对三角褐指藻光合电子传递速率的影响
TnBP对三角褐指藻光合电子传递速率的影响如图6所示。TnBP对光合电子传递速率的影响呈现剂量-效应关系,即随着TnBP浓度升高,三角褐指藻的电子传递速率不断下降。在24 h,与空白对照组相比,当TnBP浓度为1.5 μmol·L-1时,光合电子传递速率降至86.1%(P<0.01),而4.5 μmol·L-1 TnBP使得该参数降至51.1%(P<0.01)。随着胁迫时间延长,在48 h,TnBP所引起的剂量依赖性抑制效应持续存在,表明三角褐指藻光合电子传递速率受到显著抑制。
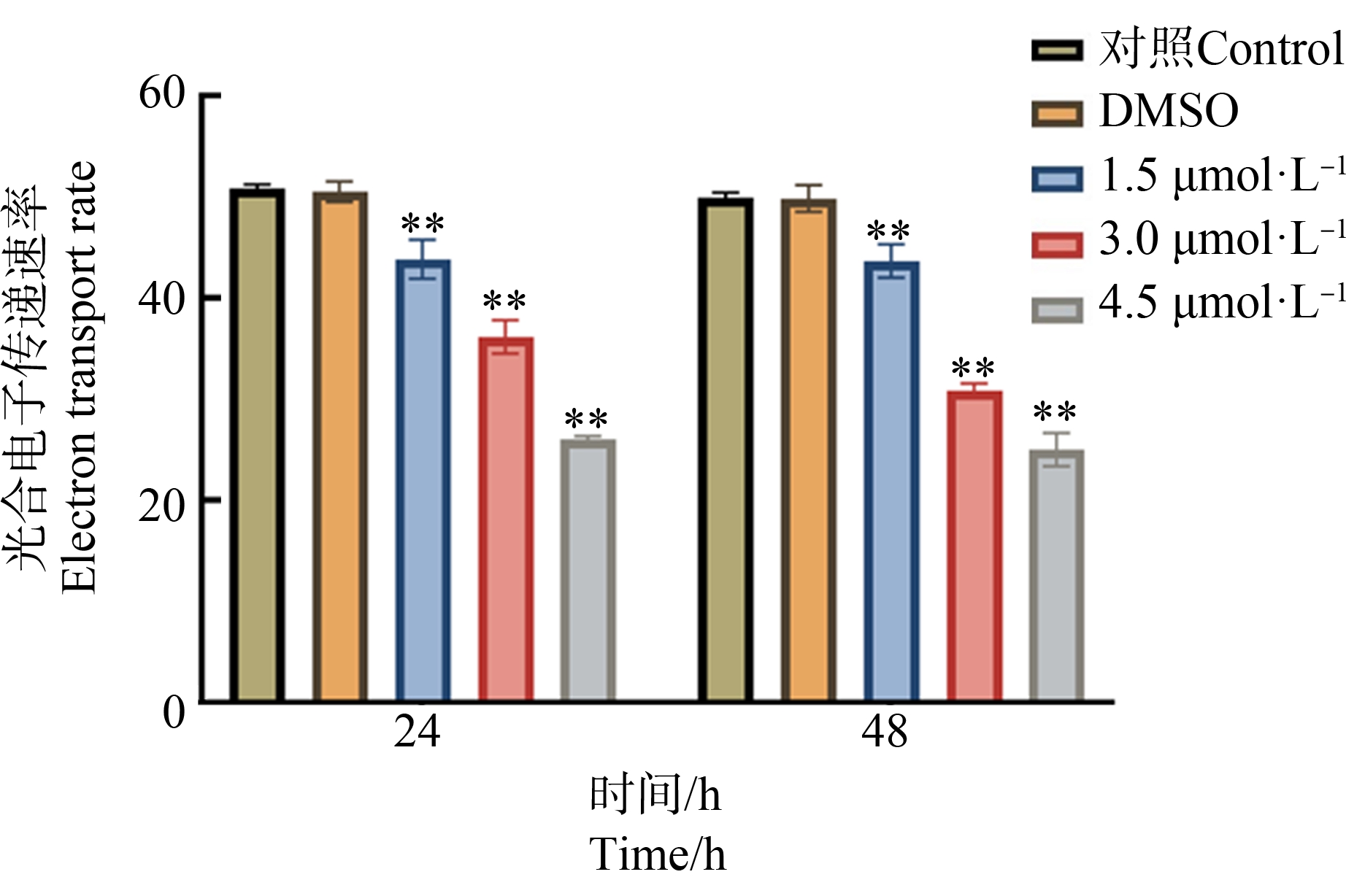
图6 TnBP对三角褐指藻光合电子传递速率的影响
注:与对照组相比,**P<0.01。
Fig. 6 Effect of TnBP on the photosynthetic electron transport rate of P. tricornutum
Note: Compared with the control, **P<0.01.
2.4 TnBP对三角褐指藻GSH含量及其代谢相关酶活性的影响
不同浓度TnBP胁迫下,三角褐指藻APX活性变化如图7(a)所示。TnBP对APX活性具有明显的诱导作用。在24 h,当TnBP为1.5 μmol·L-1时,APX活性约为空白对照组的1.39倍(P<0.01),随TnBP浓度升高,该酶活性进一步上升。在48 h,TnBP暴露组中藻的APX活性显著高于空白对照组(P<0.01)。而TnBP却显著抑制了GR活性,且具有明显的剂量效应关系。由图7(b)可知,在24 h和48 h,4.5 μmol·L-1 TnBP组中藻细胞的GR活性降至空白对照组的54.4%、54.2%(P<0.01)。由图7(c)可知,在24 h,与空白对照组相比,3.0 μmol·L-1和4.5 μmol·L-1TnBP显著降低了三角褐指藻的GSH/GSSG比值,但在1.5 μmol·L-1组中,该比值并未发生明显变化。在48 h,3个浓度TnBP胁迫处理下,藻细胞中的GSH/GSSG比值明显低于空白对照组(P<0.01)。

图7 TnBP对三角褐指藻APX(a)、GR活性(b)和GSH/GSSG(c)的影响
注:与对照组相比,*P<0.05、**P<0.01。
Fig. 7 Effect of TnBP on the activity of APX (a) and GR (b) and the ratio of GSH to GSSG (c) of P. tricornutum
Note: Compared with the control, *P<0.05, **P<0.01.
3 讨论(Discussion)
以浮游植物、浮游动物、贝类和鱼类为对象的研究表明,诱导细胞氧化应激是TBP主要的毒性作用机制[11, 23-25]。表现为ROS的产生造成氧化损伤以及抗氧化酶活性的变化。相似的,在本研究中发现TnBP能够使得三角褐指藻细胞ROS水平上升。但二者之间的剂量-效应关系并不明显。体现在24 h,1.5 μmol·L-1TnBP暴露组与空白对照组之间并无显著差异。可能的原因在低浓度污染物诱导下,藻细胞内ROS产生与清除暂达平衡,但随着暴露时间延长和暴露浓度增加,该平衡被破坏,进而引起了藻细胞内ROS的过量富集。
光合作用是一系列复杂化学反应的总和,也是微藻暴露于环境压力下最先受到影响的生理过程之一[26]。在本研究中,从基因表达来看,TnBP对光合作用的影响较大。对于硅藻而言,其特有的捕光天线蛋白“岩藻黄素-叶绿素a/c蛋白复合体”(fucoxanthin chlorophyll a/c protein, FCP)能够捕获蓝绿光使得硅藻适应水下弱光环境。目前已在三角褐指藻中鉴定出近40个FCP基因[27]。在本研究中,1.5 μmol·L-1和4.5 μmol·L-1 TnBP组中分别有3个和9个FCP基因表达下调,这表明TnBP抑制了藻细胞的光能捕获能力。这种抑制作用在三角褐指藻遭受高光和高CO2等胁迫中[27-28]。此外,4.5 μmol·L-1 TnBP还显著下调了编码放氧复合体重要组分PsbP(Phatr3_J48359)以及PSⅡ组装中的重要因子Psb27(Phatr3_J9078)等基因的表达。这些基因的下调将引起藻细胞的光合效率下降。细胞色素b6f复合体(cytochrome b6f complex, Cyt b6f)是硅藻光合电子传递链中的重要组成部分。主要介导电子从光系统Ⅱ到光系统Ⅰ,催化电子从质体醌(PQH2)传到质体蓝素(PC)[29]。此外,Cyt b6f也充当氧化还原传感中心,对调节光收集和循环电子传递至关重要,从而可防止代谢和环境胁迫[30]。在本研究中,无论是1.5 μmol·L-1还是4.5 μmol·L-1 TnBP组中,编码Cyt b6f核心亚基Rieske Fe-S蛋白(PETC, Phatr3_J46657)显著下调。这表明TnBP暴露使得三角褐指藻电子传递受阻。利用叶绿素荧光分析发现,三角褐指藻的电子传递速率显著下降。值得注意的是,在4.5 μmol·L-1 TnBP处理组中,2个基因编码的铁氧还蛋白-NADP+还原酶(Phatr3_J23717和Phatr3_J42018)显著下调。该酶主要负责光合线性电子传递最后一步反应,催化电子将还原态的铁氧还蛋白传递给NADP+,产生NADPH。在TnBP胁迫下,铁氧还蛋白-NADP+还原酶的下调可能使得PSⅠ的还原侧O2接收电子被还原成超氧阴离子,并被叶绿体内源SOD转化成过氧化氢(H2O2)。在藻细胞暴露于磷酸三(1,3-二氯丙基)酯(TDCPP)[31]和磷酸三苯酯(TPhP)[32]的实验中也得到了相同的结果。因此,我们推测三角褐指藻光合作用对OPEs胁迫敏感,且当电子传递速率受阻后,将会产生大量ROS。
在正常生长条件下,H2O2等ROS的产生与清除过程保持着平衡状态。在保证ROS生理功能前提下,又不至于对植物细胞产生氧化损伤。植物细胞中能够分解H2O2的酶——过氧化氢酶位于过氧化物酶体中,但以GSH为核心的氧化还原系统,广泛存在于线粒体、叶绿体和细胞基质中,在ROS清除中发挥重要作用[33]。首先,GSH可以直接参与抗坏血酸-谷胱甘肽(AsA-GSH)循环,其次是调控谷胱甘肽过氧化物酶(glutathione peroxidase, GPX)活性来清除ROS[34]。在本研究中发现,编码APX(Phatr3_J46616)基因上调,且酶活性升高。APX催化AsA与H2O2之间的反应,使得H2O2之转化为H2O。这可能成为1.5 μmol·L-1TnBP组ROS未发生明显累积的原因。在APX催化清除H2O2的同时,AsA被氧化形成单脱氢抗坏血酸和脱氢抗坏血酸。脱氢抗坏血酸还原酶(DHAR)氧化GSH形成GSSG,同时将DHA还原为AsA,最后谷胱甘肽还原酶(GR)在NAD(P)H参与下将GSSG还原回GSH,从而形成1个氧化还原循环[35]。然而,暴露TnBP后,三角褐指藻细胞内的谷胱甘肽还原酶(GR, Phatr3_J49167)的基因和酶活性显著下调,且GSH/GSSG比值下降,这意味着TnBP无法使得细胞内GSH库保持在还原状态,扰乱了藻细胞的AsA-GSH循环。同时,本研究发现,编码谷胱甘肽合成酶(GSH2, Phatr3_J25876)显著下调,表明GSH的从头合成受到了抑制。此外,在4.5 μmol·L-1 TnBP胁迫下,三角褐指藻编码GPX(Phatr3_J50476)基因表达下调,将进一步抑制了藻细胞对ROS的清除能力。
在真核生物细胞中,过氧化物酶体是广泛存在的一种由单层磷脂膜包裹的细胞器,在维持植物细胞的氧化还原动态平衡中发挥重要作用[36]。过氧化物酶体可以通过光呼吸、β-氧化、黄嘌呤氧化酶催化以及芬顿反应等途径产生多种ROS,同时也包含这众多的抗氧化酶防御系统,来调控ROS的稳态。过氧化氢酶(CAT)是过氧化物酶体中所特有的一种抗氧化酶,是清除H2O2主要的抗氧化组分。然而在本研究中发现,编码CAT酶的基因(Phatr3_J22418)下降。同时,过氧化物酶体内部重要的酶与其他蛋白质分子在核糖体合成后,依赖于一系列由PEX基因编码的蛋白的协同作用进行跨膜转运后进入基质。例如,胞浆内的受体PEX5可以识别货物蛋白上位于羧基端的信号肽,进而将其招募至位于过氧化物酶体表面[37]。细胞器表面将通过某种未知机制协助受体PEX5和货物蛋白穿过膜并一同被释放进基质中,从而使得货物蛋白在过氧化物酶体中发挥作用[38]。此外,受体PEX5需要返回细胞质中开始下一轮转运。这一过程则由膜内PEX2-PEX10-PEX12组成的逆向转运复合物和位于过氧化物酶体表面的PEX1-PEX6 ATP酶复合物所先后介导完成的[39]。暴露在TnBP后,尽管PEX1(Phatr3_J14397)基因表达上调,但三角褐指藻细胞内编码PEX3(Phatr3_J50623)、PEX5(Phatr3_J32173)、PEX10(Phatr3_J47516)等基因表达下调,意味着过氧化物酶体功能的破坏,最终使得藻细胞内ROS水平上升。
综上所述,不同浓度TnBP胁迫能够抑制三角褐指藻的捕光和放氧能力,引起ROS含量上升,这与光合电子传递链受阻有关,为OPEs诱导植物细胞ROS产生的靶点提供有力参考。虽然APX酶活性升高,但TnBP降低了GR活性,造成GSH/GSSG比值下降,引起GR、GPX等抗氧化酶、过氧化物酶体功能基因下调,抑制了藻细胞对ROS的清除能力,最终引起了ROS的过量积累。光合电子传递速率可以作为敏感的生物标志物来反映TnBP等有机磷酸酯对浮游植物的生态毒性。
[1] Wang W, Deng S B, Li D Y, et al. Adsorptive removal of organophosphate flame retardants from water by non-ionic resins [J]. Chemical Engineering Journal, 2018, 354: 105-112
[2] 张金凤, 逯南南, 侯书国, 等. 磷酸三丁酯的生物毒性效应研究进展[J]. 生态毒理学报, 2022, 17(3): 366-384
Zhang J F, Lu N N, Hou S G, et al. Research progress on biological toxicity effects of tributyl phosphate [J]. Asian Journal of Ecotoxicology, 2022, 17(3): 366-384 (in Chinese)
[3] 赵海娟, 张文洁, 郑美玲, 等. GC-MS法测定烟用包装材料中非邻苯酯类增塑剂[J]. 包装工程, 2019, 40(9): 59-65
Zhao H J, Zhang W J, Zheng M L, et al. Determination of non-phenyl ester plasticizers in packaging materials for cigarettes by GC-MS [J]. Packaging Engineering, 2019, 40(9): 59-65 (in Chinese)
[4] van der Veen I, de Boer J. Phosphorus flame retardants: Properties, production, environmental occurrence, toxicity and analysis [J]. Chemosphere, 2012, 88(10): 1119-1153
[5] 刘静, 何丽雄, 曾祥英, 等. 珠江主干和东江河流表层沉积物中有机磷酸酯阻燃剂/增塑剂分布[J]. 生态毒理学报, 2016, 11(2): 436-443
Liu J, He L X, Zeng X Y, et al. Occurrence and distribution of organophosphorus flame retardants/plasticizer in surface sediments from the Pearl River and Dongjiang River [J]. Asian Journal of Ecotoxicology, 2016, 11(2): 436-443 (in Chinese)
[6] Zhong M Y, Tang J H, Guo X Y, et al. Occurrence and spatial distribution of organophosphorus flame retardants and plasticizers in the Bohai, Yellow and East China Seas [J]. Science of the Total Environment, 2020, 741: 140434
[7] Vetter W, Janussen D. Halogenated natural products in five species of Antarctic sponges: Compounds with POP-like properties? [J]. Environmental Science &Technology, 2005, 39(11): 3889-3895
[8] Wang X, Zhu Q Q, Yan X T, et al. A review of organophosphate flame retardants and plasticizers in the environment: Analysis, occurrence and risk assessment [J]. The Science of the Total Environment, 2020, 731: 139071
[9] Ji B J, Liu Y, Wu Y, et al. Organophosphate esters and synthetic musks in the sediments of the Yangtze River Estuary and adjacent East China Sea: Occurrence, distribution, and potential ecological risks [J]. Marine Pollution Bulletin, 2022, 179: 113661
[10] 彭涛. 有机磷酸酯阻燃剂对模式鱼的行为毒性[D]. 杭州: 浙江工业大学, 2015: 14-33
Peng T. Behavioral toxicolgy of organophosphorus flame retardants on the model fish [D]. Hangzhou: Zhejiang University of Technology, 2015: 14-33 (in Chinese)
[11] Zhang X, Tang X X, Yang Y Y, et al. Responses of the reproduction, population growth and metabolome of the marine rotifer Brachionus plicatilis to tributyl phosphate (TnBP) [J]. Environmental Pollution, 2021, 273: 116462
[12] Song H, Fan X J, Liu G F, et al. Inhibitory effects of tributyl phosphate on algal growth, photosynthesis, and fatty acid synthesis in the marine diatom Phaeodactylum tricornutum [J]. Environmental Science and Pollution Research, 2016, 23(23): 24009-24018
[13] Liu Q, Tang X X, Wang Y, et al. ROS changes are responsible for tributyl phosphate (TBP)-induced toxicity in the alga Phaeodactylum tricornutum [J]. Aquatic Toxicology, 2019, 208: 168-178
[14] Dat J, Vandenabeele S, Vranová E, et al. Dual action of the active oxygen species during plant stress responses [J]. Cellular and Molecular Life Sciences, 2000, 57(5): 779-795
[15] Edreva A. Generation and scavenging of reactive oxygen species in chloroplasts: A submolecular approach [J]. Agriculture, Ecosystems &Environment, 2005, 106(2-3): 119-133
[16] De Martino A, Meichenin A, Shi J A, et al. Genetic and phenotypic characterization of Phaeodactylum tricornutum (Bacillariophyceae) accessions [J]. Journal of Phycology, 2007, 43(5): 992-1009
[17] International Organization for Standardization (ISO). Water quality - Marine algal growth inhibition test with Skeletonema sp. and Phaeodactylum tricornutum: ISO 10253-2016 [S]. Geneva: ISO, 2016
[18] Shi Q P, Guo W, Shen Q C, et al. In vitro biolayer interferometry analysis of acetylcholinesterase as a potential target of aryl-organophosphorus flame-retardants [J]. Journal of Hazardous Materials, 2021, 409: 124999
[19] Li A M, Zheng G C, Chen N, et al. Occurrence characteristics and ecological risk assessment of organophosphorus compounds in a wastewater treatment plant and upstream enterprises [J]. Water, 2022, 14(23): 3942
[20] Griffith O W. Determination of glutathione and glutathione disulfide using glutathione reductase and 2-vinylpyridine [J]. Analytical Biochemistry, 1980, 106(1): 207-212
[21] Grace S C, Logan B A. Acclimation of foliar antioxidant systems to growth irradiance in three broad-leaved evergreen species [J]. Plant Physiology, 1996, 112(4): 1631-1640
[22] Miyake C, Asada K. Thylakoid-bound ascorbate peroxidase in spinach chloroplasts and photoreduction of its primary oxidation product monodehydroascorbate radicals in thylakoids [J]. Plant and Cell Physiology, 1992, 33(5): 541-553
[23] Yan S H, Wu H M, Qin J H, et al. Halogen-free organophosphorus flame retardants caused oxidative stress and multixenobiotic resistance in Asian freshwater clams (Corbicula fluminea) [J]. Environmental Pollution, 2017, 225: 559-568
[24] 陈寒嫣. 常用有机磷酸酯阻燃剂对斑马鱼肝脏毒性研究[D]. 南京: 南京大学, 2017: 26-40
Chen H Y. Hepatotoxicity of commonly used organophosphate flame retardants in zebrafish (Danio rerio) [D]. Nanjing: Nanjing University, 2017: 26-40 (in Chinese)
[25] Chu Y H, Zhang C F, Ho S H. Computational simulation associated with biological effects of alkyl organophosphate flame retardants with different carbon chain lengths on Chlorella pyrenoidosa [J]. Chemosphere, 2021, 263: 127997
[26] Bubalo M C, ![]() I R, et al. A brief overview of the potential environmental hazards of ionic liquids [J]. Ecotoxicology and Environmental Safety, 2014, 99: 1-12
I R, et al. A brief overview of the potential environmental hazards of ionic liquids [J]. Ecotoxicology and Environmental Safety, 2014, 99: 1-12
[27] Nymark M, Valle K C, Brembu T, et al. An integrated analysis of molecular acclimation to high light in the marine diatom Phaeodactylum tricornutum [J]. PLoS One, 2009, 4(11): e7743
[28] Huang R P, Ding J C, Gao K S, et al. A potential role for epigenetic processes in the acclimation response to elevated pCO2 in the model diatom Phaeodactylum tricornutum [J]. Frontiers in Microbiology, 2019, 9: 3342
[29] Tikhonov A N. The cytochrome b6f complex at the crossroad of photosynthetic electron transport pathways [J]. Plant Physiology and Biochemistry, 2014, 81: 163-183
[30] Li B X, Mao D Z, Liu Y L, et al. Characterization of the cytochrome b(6)f complex from marine green alga, Bryopsis corticulans [J]. Photosynthesis Research, 2005, 83(3): 297-305
[31] Liu Q, Tang X X, Jian X Y, et al. Toxic effect and mechanism of tris (1,3-dichloro-2-propyl)phosphate (TDCPP) on the marine alga Phaeodactylum tricornutum [J]. Chemosphere, 2020, 252: 126467
[32] Liu Q, Tang X X, Zhang X, et al. Mechanistic understanding of the toxicity of triphenyl phosphate (TPhP) to the marine diatom Phaeodactylum tricornutum: Targeting chloroplast and mitochondrial dysfunction [J]. Environmental Pollution, 2022, 295: 118670
[33] Locato V, Cimini S, De Gara L. Glutathione as a Key Player in Plant Abiotic Stress Responses and Tolerance [M]//Hossain M, Mostofa M, Diaz-Vivancos P, et al. Glutathione in Plant Growth, Development, and Stress Tolerance. Cham: Springer, 2017: 127-145
[34] Hasanuzzaman M, Bhuyan M H M B, Zulfiqar F, et al. Reactive oxygen species and antioxidant defense in plants under abiotic stress: Revisiting the crucial role of a universal defense regulator [J]. Antioxidants, 2020, 9(8): 681
[35] Gill S S, Anjum N A, Hasanuzzaman M, et al. Glutathione and glutathione reductase: A boon in disguise for plant abiotic stress defense operations [J]. Plant Physiology and Biochemistry, 2013, 70: 204-212
[36] Islinger M, Grille S, Fahimi H D, et al. The peroxisome: An update on mysteries [J]. Histochemistry and Cell Biology, 2012, 137(5): 547-574
[37] Kalel V C, Erdmann R. Unraveling of the Structure and Function of Peroxisomal Protein Import Machineries [M]//del Río L, Schrader M. Proteomics of Peroxisomes. Singapore: Springer, 2018: 299-321
[38] Skowyra M L, Rapoport T A. PEX5 translocation into and out of peroxisomes drives matrix protein import [J]. Molecular Cell, 2022, 82(17): 3209-3225.e7
[39] Feng P Q, Wu X D, Erramilli S K, et al. A peroxisomal ubiquitin ligase complex forms a retrotranslocation channel [J]. Nature, 2022, 607(7918): 374-380