有机磷农药(organophosphorus pesticides, OPs)是世界范围内广泛使用的杀虫剂,也是在河流、地下水、土壤、空气和植物中最常检出的合成化学品之一。OPs具有较强的神经毒性,对乙酰胆碱酯酶(acetylcholine E, AchE, EC 3.1.1.7)酶活性的抑制是OPs毒性作用机制之一。这种抑制作用直接导致神经递质乙酰胆碱在突触间隙积聚,进而干扰胆碱能信号传导[1-3]。正是由于OPs对人类具有急性和慢性毒性,使其在公共卫生领域一直备受关注。然而,由于暴露途径和/或与AChE的相互作用模式的多样性,暴露于不同的OPs可能会导致不同的毒理学路径和结局[4-5]。大多数的OPs会经生物转化为毒性更强的O—P形式,而苯线磷和甲胺磷与众所周知的神经毒剂塔崩(Tabun)类似,已经具有O—P形式,因此苯线磷和甲胺磷是与Tabun类似的AChE抑制剂[6-8]。
苯线磷和甲胺磷是2种OPs杀虫剂,近年来常用于防治水果、蔬菜和农作物上的各种害虫[9-11]。Akoto等[12]在一项针对加纳蔬菜产品的研究中发现,所有蔬菜产品中甲胺磷的含量都超过了最大残留限量。同时,在中国的蔬菜剩菜中也发现了甲胺磷[13]。研究发现,在蔬菜中发现的残留的杀螨磷和甲胺磷会增加人体暴露的风险。在以色列,已经发现儿童比成年人摄入更多的苯线磷和甲胺磷,并且暴露水平被认为分别超过可接受的每日摄入量25%和50%[14]。由于脐带血样本中也有甲胺磷被检出,因此胎儿同样面临着接触甲胺磷的风险[15]。基于经口或经皮暴露大鼠的LD50值,世界卫生组织(WHO)在“世界卫生组织推荐的农药危险分类”中将苯线磷和甲胺磷列为“高度危险(Ⅰ b类)”。人群队列研究和动物实验结果显示,这2种OPs对人体和实验动物中均有毒性。在厄瓜多尔,苯线磷暴露的工人的染色体畸变的频率增加[1],而长期接触甲胺磷影响小鼠大脑发育[2]。然而,这些毒性作用机制尚不完全清楚。
红细胞AChE的酶活性是评估OPs中毒的经典生物标志物之一[16]。此外,红细胞也是OPs发挥毒性的靶细胞。一些血液疾病的发生,如白血病,与OPs暴露有关[7,17]。TF-1是一种人类红白血病细胞系,已被用于研究AChEH在成红血细胞分化过程中表达的调节机制。因此,在本研究中,使用TF-1细胞来研究苯线磷和甲胺磷对人AChE的影响。包括在TF-1细胞裂解液中进行体外研究,明确OPs对AChE活性的影响,以及这2种OPs与人AChE的直接相互作用情况。同时,进行TF-1细胞OPs给药处理,以明确OPs对人AChE的细胞酶活性和AChE mRNA表达的影响。本文不但揭示了苯线磷和甲胺磷对人AChE的影响情况,同时还比较了这2种OPs对TF-1细胞的细胞毒性差异。本研究将为OPs的健康风险评估提供理论依据。
1 材料与方法(Materials and methods)
1.1 实验材料
人红细胞白血病淋巴细胞(TF-1)购自中国医学科学院细胞资源中心。1640培养基、0.25%胰酶、青霉素/链霉素、GlutaMAX、GeneJET RNA纯化试剂盒和RevertAid First Strand cDNA反转录试剂盒均购自Thermo Fisher Scientific公司,胎牛血清、Ellman Assay检测试剂与二甲亚砜(dimethyl sulfoxide, DMSO;纯度99.9%)购自Sigma-Aldrich公司。粒细胞-巨噬细胞集落刺激因子(GM-CSF)、CCK-8检测试剂盒购自上海生工公司,膜联蛋白V-FITC细胞凋亡检测试剂盒购自上海碧云天公司。苯线磷(CAS:22224-92-6,纯度:99.4%)和甲胺磷(CAS:10265-92-6,纯度:99.5%)分别购自TM标准品公司和CATO公司。GoTaq® qPCR Master Mix荧光定量试剂盒购自Promega公司。荧光定量PCR仪 (QuantStudioTM 6 Flex, Life, USA),流式细胞仪(Novocyte 1040,Agilent,美国),分光光度计(CARY 300,Agilent,美国),酶标仪(Infinite F200 Pro,Tecan,瑞士),核酸微量定量仪(NanoDrop 2000,Thermo Scientific,美国)。
1.2 细胞培养及处理
使用1640基础培养基混合10%胎牛血清、100 U·mL-1青霉素/100 μg·mL-1链霉素、4 mmol·L-1 GlutaMAX和8 ng·mL-1 GM-CSF配制完全培养基培养TF-1细胞。培养箱条件设置为:5% CO2、饱和湿度、37 ℃。将TF-1细胞悬液以每孔8×105个细胞的密度接种到6孔板中,24 h后进行样品暴露,苯线磷暴露于细胞的终浓度为10-7、10-6、10-5、10-4和10-3 mol·L-1,甲胺磷的最终浓度为10-7、10-6、10-5和10-4 mol·L-1,所有样品溶剂包括对照组DMSO的体积浓度均为0.05%。
1.3 细胞活力和增殖实验
将TF-1细胞与苯线磷或甲胺磷一起孵育,并以适当的密度接种到96孔板中。24 h后,用CCK-8溶液(10 μL·孔-1)处理TF-1细胞,然后在37 ℃下孵育1 h,随后使用酶标仪(TECAN Infinite F200 Pro)在450 nm处测量光密度(OD)值。计算过程如下:
细胞活力=(实验组OD值-空白组OD值)/(对照组OD值-空白组OD值)
(1)
实验组:含TF-1细胞、CCK-8溶液、苯线磷或甲胺磷。对照组:含TF-1细胞、CCK-8溶液、二甲基亚砜。空白组:含培养基,CCK-8溶液。
1.4 流式细胞术
根据膜联蛋白V-FITC细胞凋亡检测试剂盒操作说明,将TF-1细胞用苯线磷或甲胺磷处理,然后以8×105个细胞的密度接种到6孔板中。24 h后收集TF-1细胞,将膜联蛋白V-FITC结合溶液(195 μL·管-1)加入每个处理组中,然后加入5 μL膜联蛋白V-FITC和10 μL碘化丙啶(PI),在室温下避光孵育20 min后,使用流式细胞仪(Novocyte 1040)读取数据。
1.5 AChE酶活定量分析
采用改良的Ellman Assay[18]对AChE酶活性进行定量分析,具体操作如下:使用低盐裂解缓冲液(LSLB;10 mmol·L-1 HEPES、150 mmol·L-1 NaCl、1 mmol·L-1 EDTA、1 mmol·L-1 EGTA、0.5%Triton X-100和4 mmol·L-1苯甲脒)在4 ℃下提取TF-1细胞裂解物30 min,然后在室温下将细胞上清液与不同浓度的苯线磷或甲胺磷孵育。1 h后,将细胞样品用于Ellman测定。此外,将TF-1细胞在含有苯线磷或甲胺磷的培养基中培养24 h,然后收集经LSLB裂解的细胞上清液用于实验。将细胞上清液加入96孔板中,并与80 mmol·L-1磷酸氢二钠、0.1 mmol·L-1四异丙基焦磷酰胺(ISO-OMPA)和0.5 mmol·L-1 5,5-二硫代双(2-硝基苯甲酸)(DTNB)一起孵育30 min后,将0.625 mmol·L-1乙酰硫代胆碱碘化物(ATCH)加入每个孔中。在酶标仪中每5 min读取一次405 nm处的吸光值,持续100 min。使用Bradford方法测量蛋白质浓度。酶活力单位为单位时间每微克蛋白质的催化速度。
为了评估抑制常数,将人重组AChE与苯线磷(10×10-6~150×10-6 mol·L-1)或甲胺磷(5×10-6~40×10-6 mol·L-1)在室温下孵育。通过在指定时间(最长60 min)加入ATCH停止进行性抑制,并测量残余酶活性。二阶抑制速率常数(ki)采用已发表的方法进行计算[19-20]。在甲胺磷的情况下,ki是kobs对浓度曲线的斜率,而在苯胺磷饱和曲线情况下,ki是通过双曲线拟合计算的最大抑制速率常数和解离常数的比值。所有活性测量均在含0.01% BSA的0.1 mol·L-1磷酸钠缓冲液中进行,25 ℃时pH值为7.4,使用带有温度控制器的CARY 300分光光度计测定在412 nm的OD值。
1.6 荧光实时定量PCR
采用GeneJET RNA纯化试剂盒从TF-1细胞中提取总RNA并使用NanoDrop2000核酸微量定量仪对RNA浓度定量,使用2 μg总RNA进行cDNA合成,具体步骤按照RevertAid First Strand cDNA反转录试剂盒说明书所述。反转录完成后,将得到的cDNA稀释10倍用于实时荧光定量PCR实验,qPCR仪中热循环条件为:95 ℃加热2 min,95 ℃解旋15 s,60 ℃下20 s退火,72 ℃延伸20 s,变性循环共40次。最终表达量通过2-ΔΔCT值法进行计算分析。实验中,GAPDH为内参基因,每个样品设置3个平行复孔。以上基因的引物序列均基于GenBank网站中的Primer-BLAST功能设计而得,正式实验前所有引物均已进行过引物验证,效率在0.9~1.1之间。所有引物由生工生物科技公司(北京)合成。引物序列信息如下:人AChEH(NM_000665.5)引物序列是5’-AGT ACG TTA GTC TGG ACC TGC G-3’和5’-GGT GGC GCT GAG CAA TTT GG-3’,人GAPDH(NM_001256799.3)引物序列是5’-ATG ACC CCT TCA TTG ACC-3’和5’-GAA GAT GGT GAT GGG ATT TC-3’。
1.7 数据统计
单因素方差分析和动力学评估采用GraphPad Prism程序(7.0版,美国加利福尼亚州圣地亚哥),并使用Bonferroni校正进行统计分析。数据以(平均值±标准误)表示,每个实验3个独立生物学重复,P<0.05被认为具有统计学差异。
2 结果(Results)
2.1 苯线磷和甲胺磷对TF-1细胞活力的影响
在苯线磷(10-7~10-3 mol·L-1)或甲胺磷(10-7~10-4 mol·L-1)处理24 h后进行CCK-8检测。与溶剂对照相比,在10-4 mol·L-1和10-3 mol·L-1的苯线磷处理后,细胞活力分别降低了约65%和15%(图1(a))。然而,所有甲胺磷处理组中细胞活力没有显著改变(图1(b))。

图1 苯线磷(a)和甲胺磷(b)对TF-1细胞活力的影响
注:不同浓度的苯线磷(a)或甲胺磷(b)或0.05% DMSO(V∶V,二甲基亚砜为溶剂对照)处理TF-1细胞,24 h处理后,收集细胞进行CCK-8测定;具体实验步骤见“材料与方法”的相关内容;数据为对照组的百分比,用平均值±标准误(n=3);所有样品进行3次独立重复实验;统计分析方法为单因素方差分析和Bonferroni多重比较( *表示与对照组之间存在统计学差异,显著性水平为 ***P<0.001)。
Fig. 1 Effects of fenamiphos (a) and methamidophos (b) on the cell viability of TF-1 cells
Note: TF-1 cells were incubated with fenamiphos (a) or methamidophos (b) at different concentrations as indicated, or 0.05% DMSO (V∶V, solvent control); after the 24-h treatments, cells were collected for CCK-8 assay; see the relevant contents of “Materials and Methods” for specific experimental steps; the data are % of control group and expressed as mean±SEM (n=3); all samples were measured in three independent experiments; statistical analysis methods were one-way ANOVA and Bonferroni multiple comparison ( *indicates a significant difference between the treatment and control; the level of significance was set at ***P<0.001).
使用流式细胞术进一步分析了10-4 mol·L-1和10-3 mol·L-1苯线磷对细胞的影响。用10-4 mol·L-1苯线磷处理细胞24 h后,凋亡细胞的百分比没有变化,而坏死细胞的百分比略有下降(图2)。然而,凋亡和坏死细胞的百分比在用10-3 mol·L-1苯线磷处理后显著增加(图2)。

图2 苯线磷对TF-1细胞凋亡和坏死的影响
注:苯线磷(10-3 mol·L-1和10-4 mol·L-1)或0.05% DMSO(V∶V,二甲基亚砜为溶剂对照)处理细胞24 h,通过流式细胞散点图(a)分析凋亡(b)和坏死(c)细胞;具体实验步骤见“材料与方法”的相关内容;数值为处理组凋亡细胞(b)与坏死细胞(c)与对照组相比的百分比,表示为平均值±标准误(n=3),所有样品进行3次独立重复实验;统计分析方法为单因素方差分析和Bonferroni多重比较( *表示与对照组之间存在统计学差异,显著性水平为***P<0.001)。
Fig. 2 Effects of fenamiphos on apoptosis and necrosis of TF-1 cells
Note: TF-1 cells were incubated with fenamiphos (10-3 mol·L-1 and 10-4 mol·L-1) or 0.05% DMSO (solvent control) for 24 h, apoptotic (b) and necrotic (c) cells were determined by flow cytometry (a); see the relevant contents of “Materials and Methods” for specific experimental steps; values are percentage of apoptotic (a) and necrotic (b) cells and expressed as mean±SEM (n=3); statistical analysis methods were one-way ANOVA and Bonferroni multiple comparison (*indicates a significant difference between the treatment and control; the level of significance was set a ***P<0.001).
2.2 苯线磷和甲胺磷对TF-1细胞裂解液中AChE活性的影响
为明确苯线磷和甲胺磷是否与TF-1中AChE在体外直接作用,将2种OPs分别混合到TF-1细胞裂解液中,然后对AChE活性进行定量。结果显示,孵育1 h和5 h后,所有浓度(10-7~10-4 mol·L-1)苯线磷处理组中AChE活性均下降,并具有剂量依赖性的抑制作用(图3(a))。其中10-4 mol·L-1苯线磷处理后,AChE活性与对照组相比,在1 h和5 h分别下降大约45%和70%。体外孵育1 h,苯线磷对细胞裂解液中AChE活性的直接抑制作用的平均IC50值为1.181×10-6 mol·L-1(表1)。同时,10-6~10-5 mol·L-1的甲胺磷处理对AChE活性也有抑制作用,其中10-5 mol·L-1的甲胺磷组的最大抑制率为85%(图3(b))。体外孵育1 h,甲胺磷对细胞裂解液中AChE活性的直接抑制作用的平均IC50值为2.837×10-6 mol·L-1(表1)。
表1 苯线磷和甲胺磷对细胞裂解液中和TF-1细胞中AChE活性抑制的IC50值以及人AChE的抑制常数
Table 1 The IC50 values of AChE in lysate and TF-1 cells and inhibition constants for human AChE

IC50/(mol·L-1)1裂解液AChE (Lysate AChE) 1 hIC50/(mol·L-1)1细胞AChE (Cell AChE) 24 hki/(mol·L-1·min-1)2hAChE 1 h苯线磷 Fenamiphos1.181×10-6±6.9×10-71.333×10-6±1.75×10-83 980±260甲胺磷 Methamidophos2.837×10-6±2.425×10-72.249×10-6±3.95×10-82 760±360
注:1 IC50表示AChE酶活性一半时的抑制浓度,其值表示为平均值±标准误;2 ki表示人AChE酶活性抑制常数,抑制作用越强ki越小。
Note: 1 IC50 represents the inhibitory concentration for half of AChE enzymatic activity, and values are expressed as mean±SEM; 2 ki represents the inhibitory constant of human AChE enzyme activity, and the stronger the inhibitory effect, the smaller the ki.
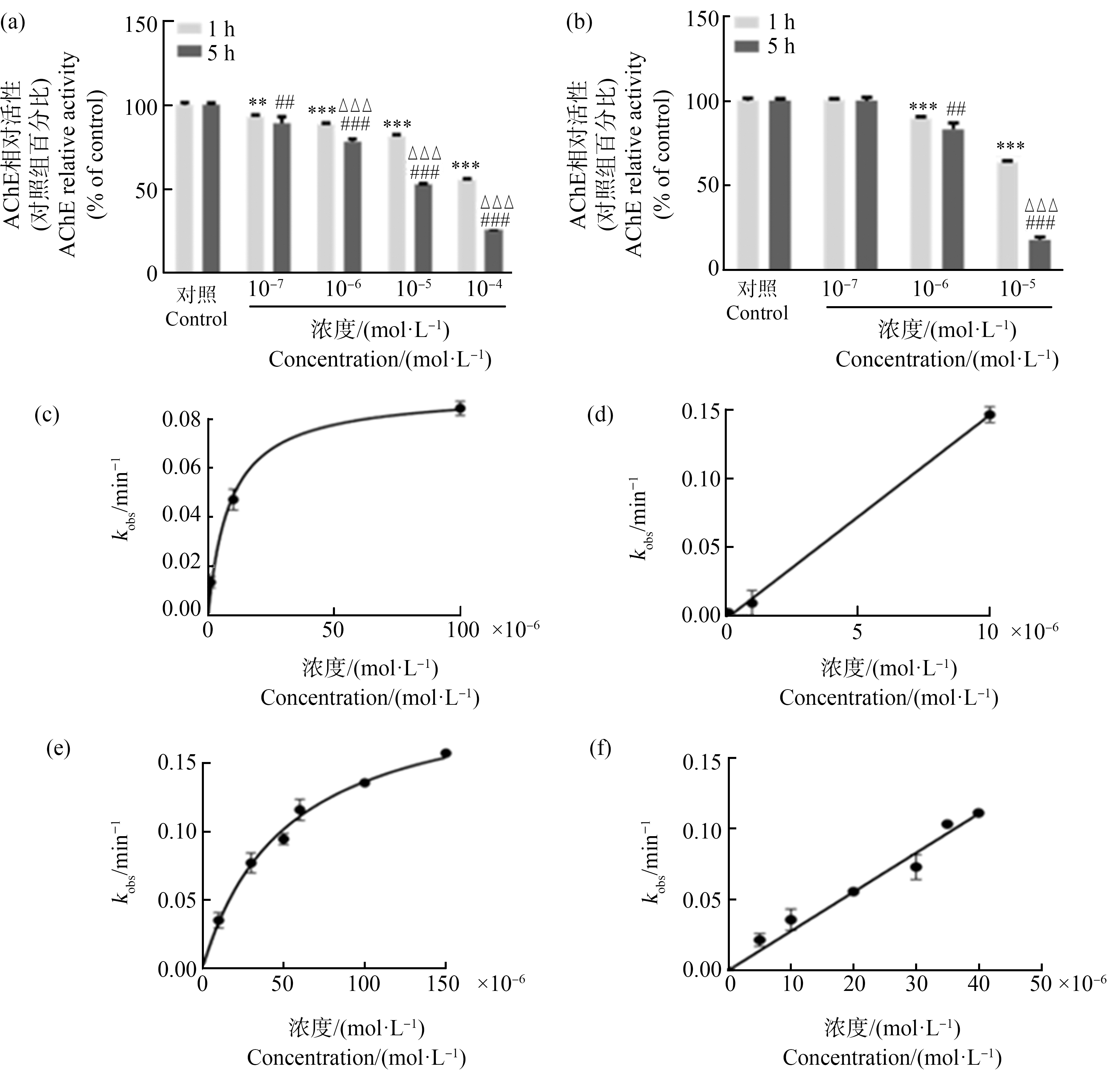
图3 苯线磷(a)和甲胺磷(b)对TF-1细胞裂解液中AChE活性的影响及苯线磷(c)、(e)和甲胺磷(d)、(f)对AChE活性的渐进式抑制
注:(a)和(b)为降低裂解液对有机磷农药(OPs)的影响,在细胞密度增加5倍后,用磷酸钠缓冲液稀释细胞裂解液5倍,然后用不同浓度的苯线磷和甲胺磷或0.05% DMSO(V∶V,二甲基亚砜为溶剂对照)处理1 h或5 h,测定AChE活性,AChE酶活性使用Ellman法进行测定,数值为各处理组与对照组的百分比,表示为平均值±标准误(n=3),所有样品进行3次独立重复实验;统计分析方法为单因素方差分析和Bonferroni多重比较(*与处理时间为1 h的对照组相比存在统计学差异,显著性水平为**P<0.01,***P<0.001;#与处理5 h的对照组相比存在统计学差异,显著性水平为## P <0.01,### P<0.001;Δ与处理时间为1 h的处理组相比存在统计学差异,显著性水平为ΔΔΔ P<0.001)。
Fig. 3 Effects of fenamiphos (a) and methamidophos (b) on AChE enzymatic activity in TF-1 cells lysate and progressive inhibition of human AChE with fenamiphos (c), (e) and metamidophos (d), (f)
Note: (a) and (b) In order to reduce the effect of lysates on pesticides, cell lysates were diluted 5 times with sodium phosphate buffer after increasing cell density 5 times, and then incubated with different types and concentrations of organophosphorus pesticides (OPs) or 0.05% DMSO (solvent control) for 1 h or 5 h, AChE enzymatic activity was measured using the Ellman assay; values are expressed as mean±SEM (n=3); **P<0.01, ***P<0.001 compared with the DMSO groups with treatment time of 1 h; ## P<0.01, ### P<0.001 compared with DMSO groups treated for 5 h; ΔΔΔ P<0.001 compared with the treatment groups with treatment time of 1 h (one-way ANOVA with Bonferroni test).
2.3 苯线磷和甲胺磷对TF-1细胞中AChE酶活性的影响
用对细胞活力没有影响剂量的苯线磷和甲胺磷处理TF-1细胞,以明确苯线磷和甲胺磷对TF-1细胞中AChE酶活性的影响。结果,在用2种OPs进行处理后,AChE的酶活性下降,都具有剂量依赖性效应。在10-6 mol·L-1和10-5 mol·L-1苯线磷处理后,与对照相比,细胞中的AChE酶活性显著降低,其中10-5 mol·L-1苯线磷处理细胞5 h和24 h后,相对于对照组,AChE活性下降大约60%和80%;但在用10-7 mol·L-1苯线磷处理后没有明显变化(图4(a))。此外,在10-7~10-5 mol·L-1的甲胺磷处理后,AChE活性同样受到抑制,其中10-5 mol·L-1甲胺磷处理细胞5 h和24 h后,相对于对照组,AChE活性下降大约50%和65%(图4(b))。处理TF-1细胞24 h,苯线磷和甲胺磷对AChE活性抑制作用的IC50值分别为1.333×10-6 mol·L-1和2.249×10-6 mol·L-1(表1)。
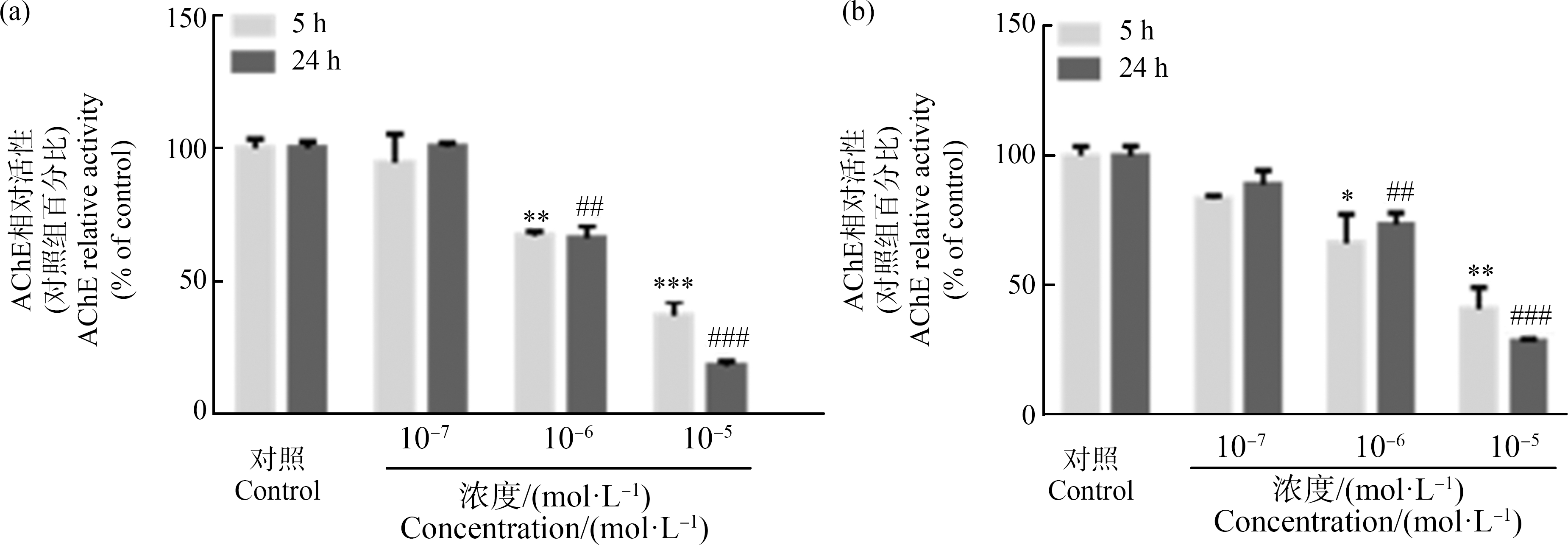
图4 苯线磷(a)和甲胺磷(b)对TF-1细胞中AChE活性的影响
注:将TF-1细胞接种到6孔板中,用不同浓度的苯线磷(a)和甲胺磷(b)或0.05% DMSO(V∶V,二甲基亚砜为溶剂对照)处理细胞;在处理一定时间后,收集细胞用于Ellman测定;数值为各处理组与对照组的百分比,表示为平均值±标准误(n=3),所有样品进行3次独立重复实验;统计分析方法为单因素方差分析和Bonferroni多重比较;*与5 h对照组相比存在统计学差异,显著性水平为*P<0.05,**P<0.01,***P<0.001;#与24 h对照组相比存在统计学差异,显著性水平为## P<0.01,### P<0.001。
Fig. 4 Effect of fenamiphos (a) and methamidophos (b) on AChE enzymatic activity of TF-1 cells
Note: TF-1 cells were seeded into 6-well plates and incubated with different types and concentrations of organophosphorus pesticides or 0.05% DMSO (solvent control); after treatment for certain time, cells were collected for the Ellman assay; values are expressed as mean±SEM (n=3); *P<0.05,**P<0.01, ***P<0.001 compared with the control groups with treatment time of 5 h; ## P<0.01, ### P<0.001 compared with control groups treated for 24 h (one-way ANOVA with Bonferroni test).
2.4 苯线磷和甲胺磷处理对TF-1细胞AChE基因表达的影响
在基因水平上进一步研究了这2种OPs对AChE mRNA表达的影响。AChE具有不同的剪接异构体,其中AChEH是TF-1细胞中AChE的主要剪接异构体。处理24 h后,10-6 mol·L-1和10-5 mol·L-1的苯线磷上调了AChEH的表达(约为对照的1.25倍和1.3倍),但10-7 mol·L-1的苯线磷处理AChEH没有发生明显变化(图5(a))。然而,AChEH的表达在10-7~10-5 mol·L-1甲胺磷处理后上调(约为对照的1.5倍),而在更高浓度的甲胺磷(10-4 mol·L-1)处理AChEH没有发生明显变化(图5(b))。
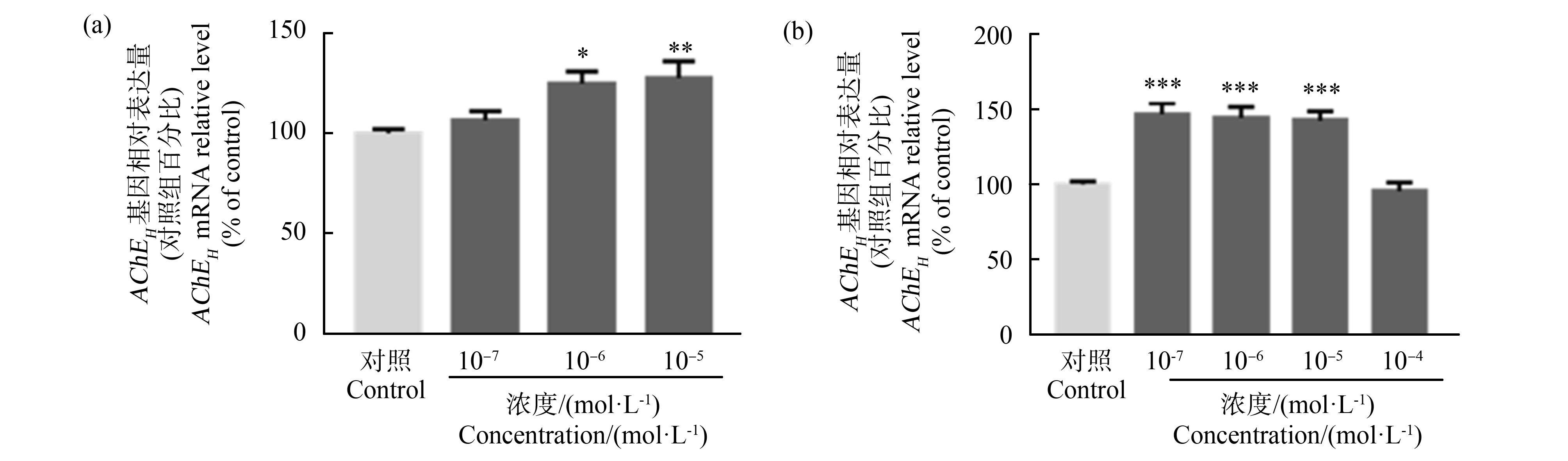
图5 苯线磷(a)和甲胺磷(b)对TF-1细胞AChEH mRNA表达的影响
注:将TF-1细胞接种到6孔板中,用不同浓度的苯线磷(a)和甲胺磷(b)或0.05% DMSO(V∶V,二甲基亚砜为溶剂对照)处理细胞;处理24 h后,收集细胞进行qRT-PCR;数值为各处理组与对照组的百分比,表示为平均值±SEM(n=3),所有样品进行3次独立重复实验;统计分析方法为单因素方差分析和Bonferroni多重比较( *与对照组相比存在显著差异,*P<0.05,**P<0.01,***P<0.001)。
Fig. 5 Effect of fenamiphos (a) and methamidophos (b) on AChEH mRNA expression of TF-1 cells
Note: (a) and (b) TF-1 cells were seeded into 6-well plates and incubated with different types and concentrations of organophosphorus pesticides or 0.05% DMSO (solvent control); after treatment for 24 h, cells were collected for qRT-PCR; values are expressed as mean±SEM (n=3); *P<0.05, **P<0.01, ***P<0.001 compared with the control groups (one-way ANOVA with Bonferroni test).
3 讨论(Discussion)
在本研究中,发现高浓度苯线磷(10-3 mol·L-1)处理后,TF-1细胞活力降低,同时诱导细胞凋亡和坏死;而所有被试浓度的甲胺磷对细胞活力均没有明显影响。此外,对于TF-1细胞裂解液中的AChE,苯线磷和甲胺磷短期处理(1 h和5 h)均可产生直接抑制作用,其中苯线磷的抑制作用略强于甲胺磷(IC50值分别为1.181×10-6 mol·L-1和2.837×10-6 mol·L-1)。对培养细胞的药物处理实验结果显示,苯线磷和甲胺磷(10-6 mol·L-1和10-5 mol·L-1)处理24 h后,均显著降低了TF-1细胞的AChE酶活性,苯线磷的抑制率略高于甲胺磷。而与对酶活性的抑制作用相反,苯线磷和甲胺磷对TF-1中AChEH转录本表达有轻微的上调作用,以甲胺磷更为明显,提示存在反馈调节机制。总结上述结果,发现苯线磷对TF-1细胞中AChE的抑制作用总体略强于甲胺磷,而甲胺磷对AChE基因表达的反馈上调作用更明显。
研究发现,大多数OPs具有较强的细胞毒性[21]。10-3 mol·L-1苯线磷处理SH-SY5Y人神经母细胞瘤细胞24 h,与对照组相比,细胞活力下降了25%[4]。我们的研究结果在一定程度上验证了这一观点,发现在高浓度苯线磷(10-4~10-3 mol·L-1)处理下,TF-1细胞的活力显著降低了30%~90%。然而,在我们的实验条件下,甲胺磷对TF-1细胞没有细胞毒性。但是,有结果显示,甲胺磷对人外周单核细胞的细胞毒性浓度为40 mg·L-1(~2.8×10-4 mol·L-1)[22]。同样,MCF10A细胞暴露于500 mg·L-1(3.5×10-3 mol·L-1)甲胺磷96 h,细胞活力仅下降12%[23]。在我们的研究中,甲胺磷的最高浓度为10-4 mol·L-1,低于上述研究中的暴露剂量,这可能是我们实验中甲胺磷未产生细胞毒性的原因。此外,苯线磷诱导细胞凋亡和坏死,进而影响细胞活力与其他报道一致。在TF-1细胞中,用高剂量的苯线磷处理可显著抑制细胞活力。这种细胞死亡机制已被证明,OPs暴露导致线粒体释放的细胞色素C并激活caspase-9,引起细胞凋亡[24-25]。此外,一些研究表明,甲胺磷会影响许多与细胞死亡相关的基因和蛋白质的表达,而苯线磷影响的基因和蛋白与甲胺磷不同[26-27]。研究结果表明,在相同浓度下,甲胺磷对细胞活力的影响远小于苯线磷,这可能是由于2种OPs的作用机制不同。
除了直接作用于AChE蛋白外,OPs还会干扰AChE的生物合成[28]。在磷酸缓冲液中用苯线磷处理大鼠嗜铬细胞瘤PC12细胞30 min,对AChE活性抑制作用的IC50为8.3×10-2 mol·L-1[29]。相似地,在我们的实验中,TF-1细胞的裂解液与苯线磷孵育1 h,在最高浓度的苯线磷10-3 mol·L-1处理后,TF-1裂解液中AChE酶活性略有下降。此外,Emerick等[4]发现,苯线磷对SH-SY5Y人神经母细胞瘤细胞的AChE活性的抑制具有剂量效应依赖性,IC50值为4.4×10-6 mol·L-1。这些结果与我们的细胞内结果相当。其他研究发现,苯线磷对人AChE的抑制不易被肟重新激活[30]。因此,可以推测苯线磷主要抑制AChE的生物合成。同时,我们发现甲胺磷对裂解液中和细胞中的AChE有很强的抑制作用。Worek等[30]证明了甲胺磷抑制的AChE很容易被肟重新激活。此外,甲胺磷对裂解液中AChE活性抑制的IC50值大于其对TF-1细胞中AChE活性抑制的IC50。因此,我们认为甲胺磷直接作用于AChE蛋白来影响AChE活性,但不能排除其对AChE生物合成的影响。一些研究也报道了OPs类物质对不同组织器官的影响,例如在怀孕和哺乳期间接触甲胺磷会导致后代小鼠肺组织出现不正常的免疫反应[31]。甲胺磷暴露后大鼠的器官组织发生组织病理学变化[32]。因此,除了研究OPs对AChE活性的抑制作用外,其他毒理学机制也值得进一步研究。
[1] Paz-y-Mi o C, Bustamante G, Sánchez M E, et al. Cytogenetic monitoring in a population occupationally exposed to pesticides in Ecuador [J]. Environmental Health Perspectives, 2002, 110(11): 1077-1080
o C, Bustamante G, Sánchez M E, et al. Cytogenetic monitoring in a population occupationally exposed to pesticides in Ecuador [J]. Environmental Health Perspectives, 2002, 110(11): 1077-1080
[2] Lima C S, Dutra-Tavares A C, Nunes F, et al. Methamidophos exposure during the early postnatal period of mice: Immediate and late-emergent effects on the cholinergic and serotonergic systems and behavior [J]. Toxicological Sciences: An Official Journal of the Society of Toxicology, 2013, 134(1): 125-139
[3] Ukpebor J, Llabjani V, Martin F L, et al. Sublethal genotoxicity and cell alterations by organophosphorus pesticides in MCF-7 cells: Implications for environmentally relevant concentrations [J]. Environmental Toxicology and Chemistry, 2011, 30(3): 632-639
[4] Emerick G L, Fernandes L S, de Paula E S, et al. In vitro study of the neuropathic potential of the organophosphorus compounds fenamiphos and profenofos: Comparison with mipafox and paraoxon [J]. Toxicology in Vitro: An International Journal Published in Association with BIBRA, 2015, 29(5): 1079-1087
[5] Worek F, Thiermann H, Szinicz L, et al. Kinetic analysis of interactions between human acetylcholinesterase, structurally different organophosphorus compounds and oximes [J]. Biochemical Pharmacology, 2004, 68(11): 2237-2248
[6] Xie H Q, Xu H M, Fu H L, et al. AhR-mediated effects of dioxin on neuronal acetylcholinesterase expression in vitro [J]. Environmental Health Perspectives, 2013, 121(5): 613-618
[7] ![]() Z, Sit R K, Kovarik Z, et al. Refinement of structural leads for centrally acting oxime reactivators of phosphylated cholinesterases [J]. The Journal of Biological Chemistry, 2012, 287(15): 11798-11809
Z, Sit R K, Kovarik Z, et al. Refinement of structural leads for centrally acting oxime reactivators of phosphylated cholinesterases [J]. The Journal of Biological Chemistry, 2012, 287(15): 11798-11809
[8] Kovarik Z, Bosak A, Sinko G, et al. Exploring the active sites of cholinesterases by inhibition with bambuterol and haloxon [J]. Croatica Chemical Acta, 2003, 76(1): 63-67
[9] Méndez N, Anguas-Cabrera D N, García-de la Parra L M. Effects of methamidophos on sediment processing and body mass of Capitella sp. Y from Estero del Yugo, Mazatlán, Mexico [J]. Journal of Experimental Marine Biology and Ecology, 2008, 361(2): 92-97
[10] do Nascimento C P, Maretto G X, Marques G L M, et al. Methamidophos, an organophosphorus insecticide, induces pro-aggressive behaviour in mice [J]. Neurotoxicity Research, 2017, 32(3): 398-408
[11] Koleli N, Kantar C, Cuvalci U, et al. Movement and adsorption of methamidophos in clay loam and sandy loam soils [J]. International Journal of Environmental Analytical Chemistry, 2006, 86(15): 1127-1134
[12] Akoto O, Gavor S, Appah M K, et al. Estimation of human health risk associated with the consumption of pesticide-contaminated vegetables from Kumasi, Ghana [J]. Environmental Monitoring and Assessment, 2015, 187(5): 244
[13] Wu M L, Deng J F, Tsai W J, et al. Food poisoning due to methamidophos-contaminated vegetables [J]. Journal of Toxicology Clinical Toxicology, 2001, 39(4): 333-336
[14] Freeman S, Kaufman-Shriqui V, Berman T, et al. Children’s diets, pesticide uptake, and implications for risk assessment: An Israeli case study [J]. Food and Chemical Toxicology, 2016, 87: 88-96
[15] Silver M K, Shao J, Zhu B Q, et al. Prenatal naled and chlorpyrifos exposure is associated with deficits in infant motor function in a cohort of Chinese infants [J]. Environment International, 2017, 106: 248-256
[16] Mason H J. The recovery of plasma cholinesterase and erythrocyte acetylcholinesterase activity in workers after over-exposure to dichlorvos [J]. Occupational Medicine, 2000, 50(5): 343-347
[17] Zhang Y, Zhu S, Gao Y, et al. A case-control study on correlation of pesticide exposure with childhood acute leukemia [J]. Chinese Journal of Preventive Medicine, 2011, 45(1): 41-46
[18] Ellman G L, Courtney K D, Andres V Jr, et al. A new and rapid colorimetric determination of acetylcholinesterase activity [J]. Biochemical Pharmacology, 1961, 7: 88-95
[19] Zrinka K, Anita B, Goran  , et al. Exploring the active sites of cholinesterases by inhibition with bambuterol and haloxon [J]. Croatica Chemica Acta, 2003, 76(1): 63-67
, et al. Exploring the active sites of cholinesterases by inhibition with bambuterol and haloxon [J]. Croatica Chemica Acta, 2003, 76(1): 63-67
[20] Kovarik Z, ![]() Z, Berman H A, et al. Acetylcholinesterase active centre and gorge conformations analysed by combinatorial mutations and enantiomeric phosphonates [J]. The Biochemical Journal, 2003, 373(Pt 1): 33-40
Z, Berman H A, et al. Acetylcholinesterase active centre and gorge conformations analysed by combinatorial mutations and enantiomeric phosphonates [J]. The Biochemical Journal, 2003, 373(Pt 1): 33-40
[21] Al-Sarar A S, Bayoumi A E, Hussein H I, et al. Cytotoxic effects of acephate, ethoprophos, and monocrotophos in CHO-K1 cells [J]. CyTA - Journal of Food, 2015, 13(3): 427-433
[22] Ramirez-Vargas M A, Huerta-Beristain G, Guzman-Guzman I P, et al. Methamidophos induces cytotoxicity and oxidative stress in human peripheral blood mononuclear cells [J]. Environmental Toxicology, 2017, 32(1): 147-155
[23] Olea-Flores M, Parra-Rojas I, Calderón-Aranda E S, et al. Cytotoxicity of methamidophos in MCF10A Cells: Oxidative stress and DNA damage [J]. Toxicology Letters, 2016, 259: S179-S180
[24] Karami-Mohajeri S, Abdollahi M. Mitochondrial dysfunction and organophosphorus compounds [J]. Toxicology and Applied Pharmacology, 2013, 270(1): 39-44
[25] Saleh A M, Vijayasarathy C, Fernandez-Cabezudo M, et al. Influence of paraoxon (POX) and parathion (PAT) on apoptosis: A possible mechanism for toxicity in low-dose exposure [J]. Journal of Applied Toxicology, 2003, 23(1): 23-29
[26] Lewis J A, Szilagyi M, Gehman E, et al. Distinct patterns of gene and protein expression elicited by organophosphorus pesticides in Caenorhabditis elegans [J]. BMC Genomics, 2009, 10: 202
[27] Li T W, Zhao H T, Hung G C, et al. Differentially expressed genes and pathways induced by organophosphates in human neuroblastoma cells [J]. Experimental Biology and Medicine, 2012, 237(12): 1413-1423
[28] Pope C N. Organophosphorus pesticides: Do they all have the same mechanism of toxicity? [J]. Journal of Toxicology and Environmental Health, Part B, 1999, 2(2): 161-181
[29] Wang C, Zhang N, Li L, et al. Enantioselective interaction with acetylcholinesterase of an organophosphate insecticide fenamiphos [J]. Chirality, 2010, 22(6): 612-617
[30] Worek F, Aurbek N, Koller M, et al. Kinetic analysis of reactivation and aging of human acetylcholinesterase inhibited by different phosphoramidates [J]. Biochemical Pharmacology, 2007, 73(11): 1807-1817
[31] Watanabe W, Yoshida H, Hirose A, et al. Perinatal exposure to insecticide methamidophos suppressed production of proinflammatory cytokines responding to virus infection in lung tissues in mice [J]. BioMed Research International, 2013, 2013: 151807
[32] Araoud M, Neffeti F, Douki W, et al. Toxic effects of methamidophos on paraoxonase 1 activity and on rat kidney and liver and ameliorating effects of alpha-tocopherol [J]. Environmental Toxicology, 2016, 31(7): 842-854