长链全氟和多氟化合物(PFASs),如全氟辛烷羧酸(PFOA)和全氟辛烷磺酸(PFOS)具有环境持久性及高生物累积性[1-2],在生态环境中如空气[3]、水样[4]与沉积物[5]、土壤[6]、野生动物[7]甚至极地冰原地区[8]均可检出,长链PFASs的生态环境安全问题已经引起人们的高度关注。2001年国际社会共同签署了《关于持久性有机污染物(POPs)的斯德哥尔摩公约》,开启了保护环境和人类健康免受长链全氟污染物危害的全球行动。2019年3月我国禁止PFOS及全氟辛烷磺酰氟(PFOSF)等除可接受用途外的生产和使用。
短链PFASs如全氟丁烷磺酸(PFBS)和全氟丁酸(PFBA)与长链类似物具有相似的化学结构和性质,近年来作为替代品大量生产使用,大量研究显示短链PFASs在环境及生物体内不断检出[9-11]。新加坡垃圾填埋场渗滤液中PFBS的积累水平高达1.9 μg·L-1[12]。我国大凌河PFBS和PFBA最高浓度达到2.90 μg·L-1和1.35 μg·L-1[13]。武汉汤逊湖地表水PFBS浓度高达8.0 μg·L-1,并在鲫鱼血液中发现与PFOS污染水平相当的大量蓄积[14]。我国上海市地表水及天津市地下水的PFASs以PFOA和PFBS为主[15-16]。研究发现,水体中PFBS和PFBA在水平方向上可沿水流向远距离输送,在垂直方向上可向深层渗透[17]。短链PFASs的持久性与长链类似物相似,且短链替代品具有较高的水溶性、低吸附性更容易在环境中迁移[18]。2002—2014年的一项长期监测研究发现,在鲸类样本中PFBS的生物积累逐渐增加,有望成为PFOS的主要替代物[7]。
研究表明,短链PFASs对环境生物产生巨大的威胁。雄性青鳉暴露在PFBS中视觉系统受的影响相对于雌性青鳉似乎更严重,这可能与雄性和雌性激素水平和解毒能力的内在差异有关[19-20]。对非洲爪蟾蝌蚪毒理学研究表明,暴露于PFBS中的雌激素受体和雄激素受体呈现出的内分泌干扰效应存在巨大差异[21]。青鳉(Oryzias melastigma)暴露于PFBS中,三代青鳉(F0、F1和F2)的甲状腺内分泌系统(例如激素水平、运输和信号传导)显著并持续紊乱[22]。
鉴于短链PFASs的生物积累和毒性,是否可以将其用作长链全氟化合物的安全替代品还有待继续评估。2019年12月9日,PFBS及其盐类被欧洲化学品管理局(ECHA)认定为高关注度物质(SVHC),并于2020年添加到《关于化学品注册、评估、许可和限制》(REACH)候选物质清单中,长链全氟替代品在环境中的广泛分布及造成的潜在生态风险逐渐成为研究热点。
斑马鱼易于区分雌雄,在生理、发育和代谢功能等方面与人类高度相似,被广泛应用于毒理学实验[23-24]。斑马鱼的卵黄蛋白原(vitellogenin, VTG)、甲状腺素(T4)和3,5,3’-三碘甲状腺原氨酸(T3),是常见的生物标志物,被广泛用于评价化学物质内分泌干扰效应,目前已经得到了大量应用[25-26]。但有关短链全氟替代品PFBA及PFBS的暴露对斑马鱼血浆和组织匀浆中VTG、T3和T4含量影响的研究尚未见报道。本研究分别以雌性和雄性斑马鱼(Brachydanio rerio)为受试动物,研究短链全氟替代品PFBA及PFBS暴露对斑马鱼血浆、全鱼匀浆液和头尾匀浆液中VTG、T3和T4含量的影响,以探究PFBA及PFBS对鱼类的内分泌干扰作用及其机制,为短链全氟替代化学品的环境风险管控提供基础。
1 材料与方法(Materials and methods)
1.1 仪器与试剂
仪器:酶标仪(Spectramax i3X,美国美谷分子仪器(上海)有限公司);电子分析天平(ME 204E,美国梅特勒-托利多);混合型研磨仪(MM400,德国莱驰);冷冻离心机(D-37520,美国Thermo Fisher Scientific)。
试剂:全氟丁酸(PFBA,分析纯,纯度98%,CAS 375-22-4)、全氟丁烷磺酸(PFBS,分析纯,纯度97%,CAS 375-73-5)、抑肽酶、肝素钠,以上均购自国药集团化学试剂有限公司。斑马鱼卵黄蛋白原(VTG)试剂盒、斑马鱼甲状腺T3/T4检测试剂盒均购自南京建成生物工程研究所。
1.2 试验生物
斑马鱼鱼龄3个月左右,体长2.5~3.0 cm,体质量(0.28±0.02) g,雌雄兼有,本实验室自养。实验前7 d将雌雄斑马鱼分开预养,水温(25±2) ℃,光照周期14 h∶10 h,每日早晚喂食丰年虾,驯养期间斑马鱼死亡率不超过5%,7 d后用于毒性试验。
1.3 毒性试验
驯养结束后,前1 d停止喂食,进行染毒试验。分别设置3个PFBS染毒组、5个PFBA染毒组,设置空白对照组,对斑马鱼进行21 d的毒性实验。依据Godfrey等[27]研究得出PFBA对斑马鱼胚胎LC50为1.4 g·L-1,PFBA最高浓度选择140 mg·L-1,最低为0.014 mg·L-1,设置5组PFBA的毒性试验(0.014、0.14、1.4、14、140 mg·L-1)和1个空白组,每个浓度设置3个平行。PFBS浓度设置依据Hu等[28]的研究,设置为0、10、100 μg·L-1。毒性试验在5 L的烧杯中加入5 L暴露溶液,投放雌性与雄性斑马鱼各5条,烧杯表面放置表面皿,防止实验溶液挥发。每日喂食2次,温度控制在(25±2) ℃,光照12~14 h,每4 d更换全部染毒液。雌性斑马鱼在试验周期内未出现死亡才可进行VTG及甲状腺激素T3、T4检测。
血浆的制备参照Babaei等[29]的方法。21 d染毒结束后,对斑马鱼进行冷冻麻醉。将每条鱼的伤口朝下放入自制的已穿孔的0.5 mL微量离心管中,然后将含有截肢鱼的离心管放入含有10 μL肝素钠的1.5 mL微量离心管中,然后放入离心机中,并在10 ℃下以40 g离心5 min。保持鱼处于麻醉状态,在现有伤口后紧贴另一处切口,从而去除伤口上形成的凝块。重复离心,收集血液进一步离心(13 700 g,15 min,4 ℃)以分离细胞和血浆,收集少量血浆并储存在-80 ℃直至进一步的分析。
组织匀浆液参照程艳等[30]的方法。将取血后的斑马鱼沿鱼鳍切分为头部、尾部制备头尾匀浆。称量头尾质量及冷冻后致死的全鱼质量,用手术剪刀将其剪碎后放入离心管,加入适量的预冷稀释液(m∶V= 200 mg∶1 mL),放入混合型球磨仪(30 Hz,1.5 min),直至组织充分混匀。混匀后4 ℃、5 000 g条件下离心30 min,将吸液管伸入表面的脂肪层下,抽取液体,-80 ℃下封存备用。
雌雄斑马鱼血浆采用VTG血浆检测试剂盒,全鱼匀浆及头尾匀浆采用VTG组织检测试剂盒,对斑马鱼全鱼匀浆进行甲状腺T3、T4检测分析。
1.4 数据统计
采用SPSS 27.0统计软件对实验数据进行显著性分析,各组实验数据以平均值±标准偏差表示。采用单因素方差分析(one-way ANOVA)中最小极差法(LSD)多重比较法,分析空白对照组与不同暴露浓度组之间差异的显著性。当P<0.05、P<0.01,数据组间差异具有统计学意义。
2 结果(Results)
2.1 PFBA与PFBS暴露对斑马鱼VTG含量的影响
2.1.1 PFBA暴露
PFBA对不同性别斑马鱼的21 d染毒试验结束时,空白对照组与暴露组均未出现死亡。PFBA所有暴露组对斑马鱼血浆及全鱼、头尾匀浆的VTG含量如图1所示。可以看出,所有浓度组与空白对照组(KB)相比,均导致雄性斑马鱼(图1(a))和雌性斑马鱼(图1(b))的血浆及全鱼、头尾匀浆的VTG含量增加,存在倒“U”型的剂量-效应关系。研究结果表明,PFBA对斑马鱼内分泌干扰效应明显,具有潜在的类雌激素效应。

图1 全氟丁酸(PFBA)暴露分别对雄性斑马鱼(a)、雌性斑马鱼(b)血浆及不同部位组织匀浆的VTG含量影响
Fig. 1 Effects of perfluorobutyric acid (PFBA) exposure on VTG content in plasma and tissue homogenates of male (a) and female (b) zebrafish
空白对照组与暴露组中不同性别的斑马鱼体内的VTG含量均表现为:血浆 >全鱼匀浆 >头尾匀浆。对于雄性斑马鱼(图1(a)),与空白对照组相比,所有暴露组(0.014、0.14、1.4、14、140 mg·L-1)中血浆及组织匀浆VTG含量均存在显著性差异(P<0.01)。在暴露浓度为1.4 mg·L-1时,PFBA对雄性斑马鱼的血浆、全鱼及头尾匀浆中VTG的诱导效应最大。对于雌性斑马鱼,4个暴露组(0.14、1.4、14、140 mg·L-1),雌性斑马鱼的头尾和全鱼匀浆VTG含量均存在显著性差异(P<0.01)。最低暴露浓度(0.014 mg·L-1),雌性斑马鱼血浆中VTG含量,与空白对照相比,不存在显著性差异(P≥0.05)。当暴露浓度为1.4 mg·L-1时,与雄鱼的表现相同,雌性斑马鱼的血浆、全鱼及头尾匀浆表现出最大诱导效应(图1(b))。由图1可知,雌性斑马鱼体内VTG含量远大于雄性。
2.1.2 PFBS暴露
21 d斑马鱼PFBS染毒实验结束后,发现空白对照组与暴露组中均未有斑马鱼死亡。所有PFBS暴露组中斑马鱼血浆、全鱼及头尾匀浆中VTG含量如图2所示。可以看出,与空白对照组相比,暴露组均能导致雄性斑马鱼(图2(a))和雌性斑马鱼(图2(b))血浆、全鱼及头尾匀浆的VTG含量升高,存在正相关的剂量-效应关系,表明PFBS可能具有潜在的雌激素效应。

图2 全氟丁烷磺酸(PFBS)暴露对雄性斑马鱼(a)、雌性斑马鱼(b)血浆及不同部位组织匀浆中VTG含量的影响
Fig. 2 Effects of perfluorobutane sulfonic acid (PFBS) exposure on VTG content in plasma and tissue homogenates of male (a) and female (b) zebrafish
空白对照组与暴露组中不同性别的斑马鱼体内VTG含量均表现为:血浆 >全鱼匀浆 >头尾匀浆。对于雄性斑马鱼(图2(a)),与空白对照组相比,所有暴露浓度组(1、10、100 μg·L-1)中血浆及组织匀浆VTG含量均存在显著性差异(P<0.01)。当暴露浓度为100 μg·L-1时,血浆、全鱼及头尾匀浆中VTG的诱导效应最大。对于雌性斑马鱼,3个暴露组(1、10、100 μg·L-1)中斑马鱼血浆及头尾匀浆中的VTG含量相比于空白对照组均存在显著性差异(P<0.01)。在最低暴露浓度下(1 μg·L-1),雌性斑马鱼全鱼匀浆中的VTG含量,与空白对照组相比不存在显著性差异(P>0.05)。
2.2 PFBA与PFBS暴露对斑马鱼甲状腺T3、T4的影响
2.2.1 PFBA暴露
不同暴露浓度组对斑马鱼T3和T4含量的影响如图3所示。随着PFBA暴露浓度的增加,斑马鱼体内T3和T4的含量降低,呈现明显的浓度-效应关系。与空白对照组相比,5个暴露组(0.014、0.14、1.4、14、140 mg·L-1)中PFBA对斑马鱼全鱼匀浆中T3和T4产生显著的抑制作用,均出现显著性差异(P<0.01)。其中PFBA浓度为140 mg·L-1对匀浆中T3和T4的抑制率最高,分别达到48.37%和65.13%。结果显示PFBA能显著抑制斑马鱼中甲状腺T3与T4水平。
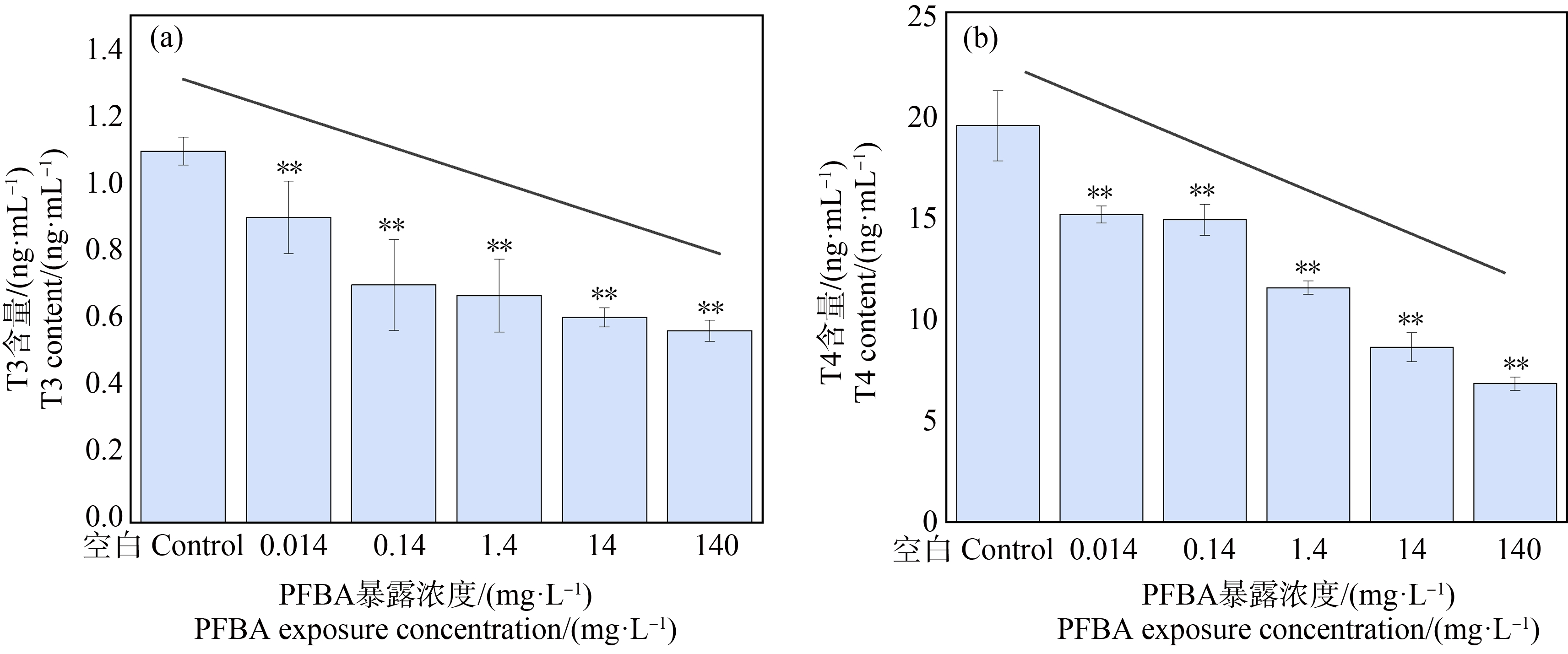
图3 全氟丁酸(PFBA)暴露对斑马鱼甲状腺T3(a)和T4(b)的影响
Fig. 3 Effects of perfluorobutyric acid (PFBA) exposure on thyroid T3 (a) and T4 (b) in zebrafish
2.2.2 PFBS暴露
PFBS不同暴露浓度组对斑马鱼T3和T4含量的影响如图4所示。斑马鱼暴露实验结束后,随着暴露浓度的不同,斑马鱼体内T3和T4出现不同程度的抑制与诱导作用。从剂量-效应关系看,斑马鱼匀浆中T3与T4含量,随着PFBS的暴露浓度(1、10、100 μg·L-1)先降低后升高,后又降低,存在倒“U”型的剂量-效应关系。与对照组相比,低暴露浓度组(1 μg·L-1)和高暴露浓度组(100 μg·L-1)PFBS对全鱼匀浆T3表现出显著的抑制效应(P<0.01),分别达到36.74%和38.20%,而中暴露浓度组(10 μg·L-1)与对照组相比,未存在明显诱导效应(P≥0.05)。对于斑马鱼T4,低暴露浓度组(1 μg·L-1)和高暴露浓度组(100 μg·L-1)2个暴露组与对照组相比,呈现显著降低(P<0.01),分别达到23.81、38.20%,整体上与T3表现出的趋势相同。
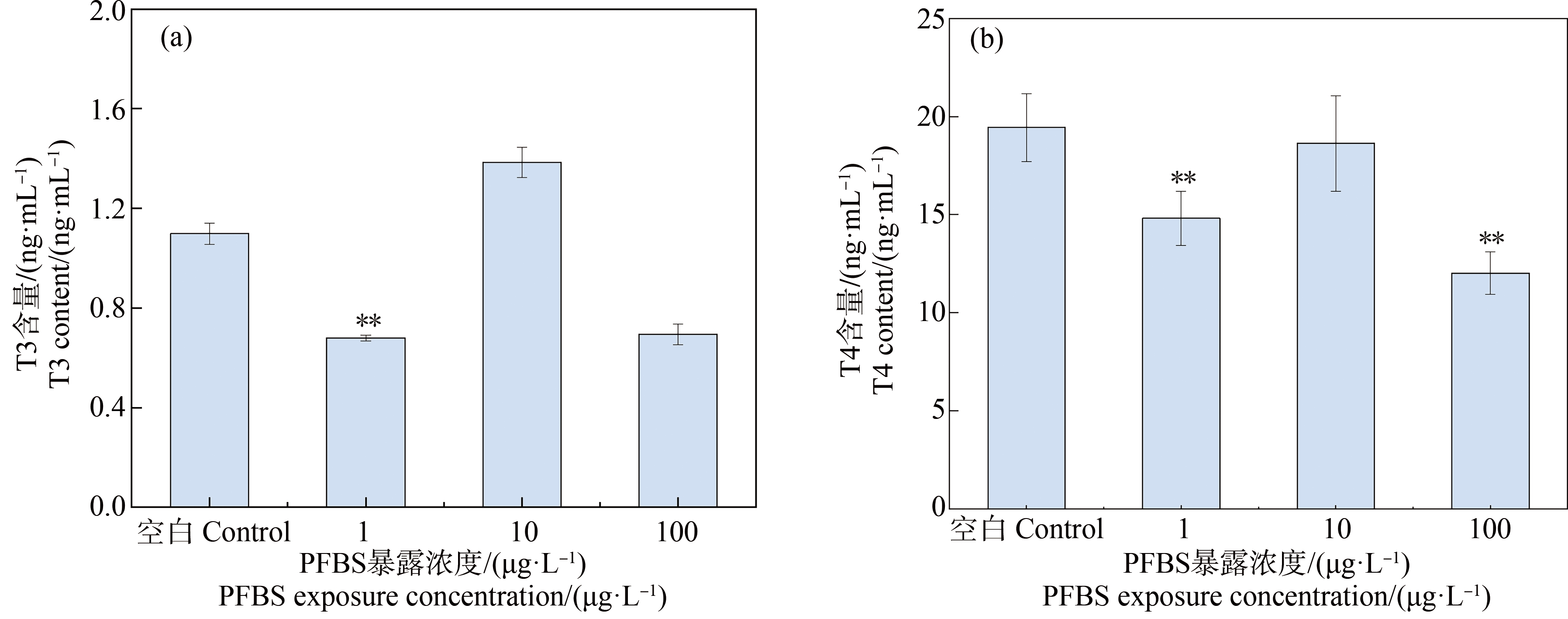
图4 全氟丁烷磺酸( PFBS) 暴露对斑马鱼甲状腺T3(a)和T4(b)含量的影响
Fig. 4 Effects of perfluorobutane sulfonic acid (PFBS) exposure on thyroid T3 (a) and T4 (b) contents of zebrafish
3 讨论(Discussion)
有研究表明卵黄蛋白原(VTG)是研究内分泌干扰效应的一种重要生物标志物,本研究通过检测暴露前后斑马鱼不同部位VTG含量来验证PFBA和PFBS对生物体的内分泌干扰效应。PFBA和PFBS的21 d毒性试验结束后,不同暴露浓度下,雄性斑马鱼和雌性斑马鱼均未出现死亡现象,表明在本研究的浓度范围内2种全氟替代品没有对斑马鱼造成急性毒性效应。慢性毒性实验结果表明,不同暴露浓度组斑马鱼的血浆、头尾匀浆、全鱼匀浆中VTG含量与PFBA浓度呈倒“U”型曲线关系。本研究结果与催产激素对罗非鱼肝脏中VTG含量变化的影响结果相似,均表现为中间浓度组的VTG含量要大于低浓度组与高浓度组[31]。
与空白对照组相比,不同PFBS暴露浓度组会导致不同性别的斑马鱼血浆、全鱼及头尾匀浆中的VTG含量升高,存在正相关的剂量-效应关系,该结果与天然雌激素雌二醇对草金鱼血浆中VTG含量变化的影响结果相似,均表现为VTG含量随暴露浓度的增加而升高[32]。PFOS暴露对雌性斑马鱼血浆和头尾匀浆VTG含量呈现倒“U”型的剂量-效应关系,对雄性斑马鱼存在负相关的剂量-效应关系[30]。2种全氟替代品对斑马鱼的VTG含量影响,与PFOS对斑马鱼的影响略有差异。PFBA和PFBS暴露对斑马鱼的内分泌干扰作用明显,由图2可以发现,不同PFBS浓度暴露组,斑马鱼血浆、全鱼匀浆及头尾匀浆样品中的VTG含量的排序均为雌性>>雄性,与斑马鱼雌性体内VTG含量远大于雄鱼有关。在本研究中,随2种污染物暴露强度增加,雄鱼和雌鱼体内的VTG含量均上升,表明对斑马鱼产生了内分泌干扰效应。
以往研究发现甲状腺激素能够调节机体的生长发育,会影响生物体内多种组织和器官的分化。邓觅[33]研究发现甲状腺激素在斑马鱼的生长发育过程中发挥着重要作用,从进化角度来说,甲状腺激素在硬骨鱼的整个生命周期中是必需的。本研究结果表明不同暴露浓度组的PFBA对斑马鱼体内甲状腺T3与T4含量的影响差异较大,表明该污染物可以诱导甲状腺,对鱼类发育与生长过程造成影响,干扰内分泌系统。可能原因为PFBA通过抑制点位结合进一步抑制甲状腺激素的合成[34]。不同暴露浓度的PFBS对斑马鱼匀浆中T3和T4的抑制效应不同,特别是中浓度暴露组,与对照组相比不具有统计学差异,可能是因为暴露浓度不同导致斑马鱼的抑制作用不同,但均能反映甲状腺水平[35]。PFBS在低浓度组导致甲状腺T3、T4均显著降低,本文结果与木伟娜[36]的研究结果一致。查阅文献可知,2种替代品通过对鱼类的下丘脑-垂体-甲状腺(HPT)轴的激素分泌以及甲状腺激素的生成、转运、结合和表达等方面干扰鱼类的甲状腺激素水平,进而影响鱼类的生长发育[37]。PFBS和PFBA暴露后雌鱼体内甲状腺激素水平呈剂量增加效应,表明通过干扰斑马鱼体内甲状腺激素的水平产生甲状腺内分泌干扰效应。总体上来看,短链全氟化合物不仅会引起甲状腺激素水平下降,也可能诱导刺激HPT轴,引起T3、T4水平的共同上升。
本研究所选PFBA和PFBS均为短链全氟化合物,生物富集性相对较小,在暴露后相当一段时间才显示出毒性效应,这可能与2种物质在体内的半衰期较短有关[38-39];但2种污染物对斑马鱼所产生的内分泌干扰效应存在差异,已有研究发现,全氟化合物的毒代动力学特性受官能团影响较大,且具有浓度依赖性[40]。本文中PFBS对斑马鱼体内VTG含量的影响与程艳等[30]研究的PFOS对斑马鱼VTG含量变化的影响基本一致,存在剂量-效应关系。此外,有研究表明全氟十二酸(perfluorododecanoic acid, PFDoA)和全氟己酸(perfluorohexanoic acid, PFHxA)通过引起斑马鱼甲状腺功能障碍,干扰甲状腺激素合成,导致斑马鱼幼鱼生长发育迟缓,具有明显的内分泌干扰效应[41]。本文研究的2种全氟替代品PFBA和PFBS分别与PFOS、PFBA和PFDoA、PFHxA具有相同的基础官能团(支链或直链同分异构体)和相似的基础结构(极其稳定的碳氟键),由此推测,与PFDoA、PFHxA相同,PFBA和PFBS通过抑制斑马鱼的甲状腺激素生成,表现出明显甲状腺干扰效应。
[1] Olsen G W, Burris J M, Ehresman D J, et al. Half-life of serum elimination of perfluorooctanesulfonate, perfluorohexanesulfonate, and perfluorooctanoate in retired fluorochemical production workers [J]. Environmental Health Perspectives, 2007, 115(9): 1298-1305
[2] Taniyasu S, Kannan K, So M K, et al. Analysis of fluorotelomer alcohols, fluorotelomer acids, and short- and long-chain perfluorinated acids in water and biota [J]. Journal of Chromatography A, 2005, 1093(1-2): 89-97
[3] Lin H J, Taniyasu S, Yamazaki E, et al. Per- and polyfluoroalkyl substances in the air particles of Asia: Levels, seasonality, and size-dependent distribution [J]. Environmental Science &Technology, 2020, 54(22): 14182-14191
[4] Jovicic V, Khan M, Zbogar-Rasic A, et al. Degradation of low concentrated perfluorinated compounds (PFCs) from water samples using non-thermal atmospheric plasma (NTAP) [J]. Energies, 2018, 11(5): 1290
[5] Fagbayigbo B O, Opeolu B O, Fatoki O S, et al. Validation and determination of nine PFCS in surface water and sediment samples using UPLC-QTOF-MS [J]. Environmental Monitoring and Assessment, 2018, 190(6): 346
[6] Chen S, Jiao X C, Gai N, et al. Perfluorinated compounds in soil, surface water, and groundwater from rural areas in Eastern China [J]. Environmental Pollution, 2016, 211: 124-131
[7] Lam J C, Lyu J L, Kwok K Y, et al. Perfluoroalkyl substances (PFASs) in marine mammals from the South China Sea and their temporal changes 2002-2014: Concern for alternatives of PFOS? [J]. Environmental Science &Technology, 2016, 50(13): 6728-6736
[8] MacInnis J J, French K, Muir D C, et al. Emerging investigator series: A 14-year depositional ice record of perfluoroalkyl substances in the High Arctic [J]. Environmental Science Processes &Impacts, 2017, 19(1): 22-30
[9] 金梦, 刘丽君, 赵波, 等. 长三角地区水体中全氟化合物的污染特征及风险评价[J]. 环境化学, 2023, 42(7): 2153-2162
Jin M, Liu L J, Zhao B, et al. Pollution characteristics and risk assessment of perfluoroalkyl substances in surface water from Yangtze River Delta [J]. Environmental Chemistry, 2023, 42(7): 2153-2162 (in Chinese)
[10] 李兵, 马浩天, 贠克明, 等. 全氟化合物的污染现状及分析方法研究进展[J]. 中国司法鉴定, 2022(6): 48-56
Li B, Ma H T, Yun K M, et al. The research progress on the pollution status and analytical methods of perfluoroalkyl substances [J]. Chinese Journal of Forensic Sciences, 2022(6): 48-56 (in Chinese)
[11] 刘世轲, 田浩廷, 刘艳, 等. 土壤与沉积物中全氟化合物污染现状及来源解析研究进展[J]. 安徽农学通报, 2023, 29(2): 122-128
Liu S K, Tian H T, Liu Y, et al. Research progress on the pollution status and source apportionment of polyfluoroalkyl substances in soil and sediment [J]. Anhui Agricultural Science Bulletin, 2023, 29(2): 122-128 (in Chinese)
[12] Yin T R, Chen H T, Reinhard M, et al. Perfluoroalkyl and polyfluoroalkyl substances removal in a full-scale tropical constructed wetland system treating landfill leachate [J]. Water Research, 2017, 125: 418-426
[13] Wang P, Lu Y L, Wang T Y, et al. Transport of short-chain perfluoroalkyl acids from concentrated fluoropolymer facilities to the Daling River Estuary, China [J]. Environmental Science and Pollution Research International, 2015, 22(13): 9626-9636
[14] Shi Y L, Vestergren R, Nost T H, et al. Probing the differential tissue distribution and bioaccumulation behavior of per- and polyfluoroalkyl substances of varying chain-lengths, isomeric structures and functional groups in crucian carp [J]. Environmental Science &Technology, 2018, 52(8): 4592-4600
[15] Qi Y J, Huo S L, Hu S B, et al. Identification, characterization, and human health risk assessment of perfluorinated compounds in groundwater from a suburb of Tianjin, China [J]. Environmental Earth Sciences, 2016, 75(5): 432
[16] Sun R, Wu M H, Tang L, et al. Perfluorinated compounds in surface waters of Shanghai, China: Source analysis and risk assessment [J]. Ecotoxicology and Environmental Safety, 2018, 149: 88-95
[17] Zhou Z, Liang Y, Shi Y L, et al. Occurrence and transport of perfluoroalkyl acids (PFAAs), including short-chain PFAAs in Tangxun Lake, China [J]. Environmental Science &Technology, 2013, 47(16): 9249-9257
[18] Venkatesan A K, Halden R U. Loss and in situ production of perfluoroalkyl chemicals in outdoor biosolids-soil mesocosms [J]. Environmental Research, 2014, 132: 321-327
[19] Chen L G, Sun J, Zhang H M, et al. Hepatic proteomic responses in marine medaka (Oryzias melastigma) chronically exposed to antifouling compound butenolide[5-octylfuran-2(5H)-one]or 4,5-dichloro-2-N-octyl-4-isothiazolin-3-one (DCOIT) [J]. Environmental Science &Technology, 2015, 49(3): 1851-1859
[20] Chen L G, Zhang W P, Ye R, et al. Chronic exposure of marine medaka (Oryzias melastigma) to 4,5-dichloro-2-N-octyl-4-isothiazolin-3-one (DCOIT) reveals its mechanism of action in endocrine disruption via the hypothalamus-pituitary-gonadal-liver (HPGL) axis [J]. Environmental Science &Technology, 2016, 50(8): 4492-4501
[21] Lou Q Q, Zhang Y F, Zhou Z, et al. Effects of perfluorooctanesulfonate and perfluorobutanesulfonate on the growth and sexual development of Xenopus laevis [J]. Ecotoxicology, 2013, 22(7): 1133-1144
[22] Chen L G, Hu C Y, Tsui M M P, et al. Multigenerational disruption of the thyroid endocrine system in marine medaka after a life-cycle exposure to perfluorobutanesulfonate [J]. Environmental Science &Technology, 2018, 52(7): 4432-4439
[23] 王京, 闫振广, 张天旭, 等. BDE-209对斑马鱼肠道的慢性毒性效应[J]. 环境工程技术学报, 2023, 13(1): 413-422
Wang J, Yan Z G, Zhang T X, et al. Chronic toxic effects of BDE-209 on the intestinal tract of zebrafish (Danio rerio) [J]. Journal of Environmental Engineering Technology, 2023, 13(1): 413-422 (in Chinese)
[24] 杨瑞泉, 叶婷, 冯雪, 等. 再生水对斑马鱼幼鱼下丘脑-垂体-甲状腺轴相关基因转录水平的影响[J]. 应用与环境生物学报, 2022, 28(1): 208-214
Yang R Q, Ye T, Feng X, et al. Effects of reclaimed water on gene transcription of the hypothalamuspituitary-thyroid axis in zebrafish larvae (Danio rerio) [J]. Chinese Journal of Applied and Environmental Biology, 2022, 28(1): 208-214 (in Chinese)
[25] Baumann L, Holbech H, Schmidt-Posthaus H, et al. Does hepatotoxicity interfere with endocrine activity in zebrafish (Danio rerio)? [J]. Chemosphere, 2020, 238: 124589
[26] Sugrue M L, Vella K R, Morales C, et al. The thyrotropin-releasing hormone gene is regulated by thyroid hormone at the level of transcription in vivo [J]. Endocrinology, 2010, 151(2): 793-801
[27] Godfrey A, Abdel-moneim A, Sepúlveda M S. Acute mixture toxicity of halogenated chemicals and their next generation counterparts on zebrafish embryos [J]. Chemosphere, 2017, 181: 710-712
[28] Hu C Y, Liu M Y, Tang L Z, et al. Probiotic intervention mitigates the metabolic disturbances of perfluorobutanesulfonate along the gut-liver axis of zebrafish [J]. Chemosphere, 2021, 284: 131374
[29] Babaei F, Ramalingam R, Tavendale A, et al. Novel blood collection method allows plasma proteome analysis from single zebrafish [J]. Journal of Proteome Research, 2013, 12(4): 1580-1590
[30] 程艳, 崔媛, 何平, 等. 全氟辛烷磺酸(PFOS)对斑马鱼血浆和组织匀浆中卵黄蛋白原含量的影响[J]. 生态毒理学报, 2012, 7(1): 65-70
Cheng Y, Cui Y, He P, et al. Effect of perfluorooctane sulfonate (PFOS) on vitellogenin levels in blood plasma and tissue homogenate of zebrafish (Brachydanio rerio) [J]. Asian Journal of Ecotoxicology, 2012, 7(1): 65-70 (in Chinese)
[31] 魏继海. 催产激素对尼罗罗非鱼类固醇激素、卵黄蛋白原含量及Vtg mRNA表达的影响[D]. 上海: 上海海洋大学, 2016: 32-33
Wei J H. Effects of hormone oxytocin on content of serum steroid hormones, vitellogenin and vtg mRNA expression in Oreochromis niloticus [D]. Shanghai: Shanghai Ocean University, 2016: 32-33 (in Chinese)
[32] 崔晓莹, 管博, 李正炎. 雌二醇、壬基酚和三丁基锡对草金鱼血浆卵黄蛋白原含量的联合效应[J]. 环境科学学报, 2019, 39(9): 3180-3187
Cui X Y, Guan B, Li Z Y. The combined effects of estradiol, nonylphenol and tributyltin on plasma vitellogenin in goldfish Carassius auratus [J]. Acta Scientiae Circumstantiae, 2019, 39(9): 3180-3187 (in Chinese)
[33] 邓觅. F-53B对斑马鱼甲状腺功能和抗氧化能力的影响及机制研究[D]. 南昌: 南昌大学, 2018: 3-4
Deng M. Effects of F-53B on thyroid function and antioxidant status and its mechanism in zebrafish [D]. Nanchang: Nanchang University, 2018: 3-4 (in Chinese)
[34] 瞿璟琰, 施华宏, 刘青坡, 等. 四溴双酚-A和五溴酚对红鲫甲状腺激素和脱碘酶的影响[J]. 环境科学学报, 2008, 28(8): 1625-1630
Qu J Y, Shi H H, Liu Q P, et al. Effects of tetrabromobisphenol-A and pentabromophenol on thyroid hormones and deiodinases of goldfish, Carassius auratus [J]. Acta Scientiae Circumstantiae, 2008, 28(8): 1625-1630 (in Chinese)
[35] Welshons W V, Thayer K A, Judy B M, et al. Large effects from small exposures. I. Mechanisms for endocrine-disrupting chemicals with estrogenic activity [J]. Environmental Health Perspectives, 2003, 111(8): 994-1006
[36] 木伟娜. 低剂量三丁基锡和镉联合暴露对鲤鱼甲状腺轴及抗氧化指标的影响[D]. 武汉: 华中农业大学, 2017: 45-46
Mu W N. Effect of low-concentration tributyltin, cadmium and their combination on the hypothalamic-pituitary-thyroid axis and antioxidant index in Cyprinus carpio [D]. Wuhan: Huazhong Agricultural University, 2017: 45-46 (in Chinese)
[37] 刘小燕, 刘珊, 张丽娟, 等. 六溴环十二烷对斑马鱼的甲状腺激素干扰效应研究[J]. 农业环境科学学报, 2017, 36(11): 2192-2198
Liu X Y, Liu S, Zhang L J, et al. Thyroid hormone-disrupting effects of hexabromocyclododecane in zebrafish (Danio rerio) [J]. Journal of Agro-Environment Science, 2017, 36(11): 2192-2198 (in Chinese)
[38] 唐欣瑶, 倪梦梅, 朱霞, 等. 全氟丁酸毒性研究进展[J]. 现代预防医学, 2021, 48(17): 3110-3114
Tang X Y, Ni M M, Zhu X, et al. Research progress on toxicity of perfluorobutanoic acid [J]. Modern Preventive Medicine, 2021, 48(17): 3110-3114 (in Chinese)
[39] 余果, 孙丽娜, 唐蕊, 等. 全氟丁烷磺酸对其耐受菌胞外聚合物特征的影响[J]. 农业环境科学学报, 2023, 42(5): 1032-1041
Yu G, Sun L N, Tang R, et al. Effects of perfluorobutanesulfonic acid on the extracellular polymeric substances of PFBS-resistant strains [J]. Journal of Agro-Environment Science, 2023, 42(5): 1032-1041 (in Chinese)
[40] 杨晓溪. 双酚AF和全氟化合物对斑马鱼的毒性效应研究[D]. 武汉: 华中农业大学, 2014: 26-27
Yang X X. Toxicity of bisphenol AF and perfluorinated chemicals on zebrafish [D]. Wuhan: Huazhong Agricultural University, 2014: 26-27 (in Chinese)
[41] Zhang S N, Guo X C, Lu S Y, et al. Exposure to PFDoA causes disruption of the hypothalamus-pituitary-thyroid axis in zebrafish larvae [J]. Environmental Pollution, 2018, 235: 974-982