人用感冒药扑热息痛的环境生态与人体健康风险近10年来引起了广泛的关注[1-2]。扑热息痛(paracetamol)是常用的非甾体抗炎药(NSAIDs),主要用于解热治疗感冒发烧和缓解疼痛。扑热息痛,包括其代谢物以及残留物,通过城市废水进入环境水体,主要包括药物生产废水、医院废水以及人与动物的排泄物[3]。由于污水处理厂的常规处理工艺不能完全去除扑热息痛,其在环境中具有“假持久性”;是水环境中检出率最高的药物与个人护理品(pharmaceuticals and personal care products, PPCPs)之一,浓度范围为ng·L-1~μg·L-1水平[4]。对中国厦门某污水处理厂中50种PPCPs进行检测,其中,扑热息痛的最高进水浓度达5 320 ng·L-1[5]。在中国珠江中扑热息痛的检出浓度为339 ng·L-1[6],北京地表水中扑热息痛的检出浓度高达3 577 ng·L-1[7]。此外,在中国台湾某些医院和污水处理厂的废水中发现了更高浓度的扑热息痛(高达100 433 ng·L-1)[8]。关于扑热息痛生物效应的作用机制,目前普遍认为是通过选择性地抑制环加氧酶(即COX-2)的代谢[9]。扑热息痛在治疗剂量时对人体是安全的,但急性或蓄积性的过量服用则会导致严重的肝损伤,肝细胞损伤诱导的细胞衰老有可能进一步发展成肝衰竭[10]。孕期服用扑热息痛可能会导致胎儿神经发育受损[11]。类似的子代神经毒性表征也在大鼠的仔鼠身上体现,Blecharz-Klin等[12]发现低浓度(5 mg·kg-1)扑热息痛暴露下,仔鼠的空间记忆、探索行为明显减弱。由于扑热息痛对靶向生物-人产生了广泛的负面生物效应,基于人用药物的read-across假说[13],其对环境中的非靶向生物(如鱼)的生态风险也不容忽视。
在(生态)毒理学领域,斑马鱼是一种替代性的脊椎动物模型,具有体型小、产卵数量多、胎间距短、胚胎透明、体外同步发育等特点,在环境污染物的毒性测试和环境生态风险研究中发挥着重要的作用[14-15]。然而,以斑马鱼为模式生物开展扑热息痛的毒性效应研究还极端缺乏,且毒性指标缺乏系统性。现有的少量研究表明,扑热息痛暴露会抑制斑马鱼胚胎的色素沉着[16],还会导致斑马鱼视网膜凋亡的现象显著增加[17],颅骨畸形增加[18]等发育异常现象。Chen等[19]研究发现,低剂量扑热息痛足以引起斑马鱼幼鱼肝损伤,扑热息痛诱导的肝毒性有明显的剂量和时间依赖性。除胚胎发育异常与肝毒性外,扑热息痛暴露还会导致斑马鱼的精子质量下降,影响生育能力[20]。为探究药物的神经毒性,行为学效应作为一个新的指标类型也越来越频繁地出现在毒性评估中。已有的斑马鱼行为学研究[21],主要分析药物暴露后的自发运动行为,以运动距离、运动轨迹、持续时间以及平均速度为指标。研究结果显示,扑热息痛暴露对斑马鱼幼鱼有运动抑制现象[22]。
同时考察斑马鱼的发育毒性和行为效应对于全面揭示扑热息痛的生物效应具有十分重要的意义。目前对于扑热息痛的毒性分析,在胚胎发育毒性方面比较透彻,运动行为学分析较少且一般仅分析运动距离指标,而缺乏斑马鱼转动转向指标[23-24]。本研究通过综合分析扑热息痛对斑马鱼的胚胎发育以及运动行为效应的影响,增加了斑马鱼转动转向相关的行为学指标,更加全面地分析了扑热息痛对斑马鱼的发育和运动行为的影响,为扑热息痛的水环境生态风险评价提供了基础数据和技术支持。
1 材料与方法(Materials and methods)
1.1 仪器与试剂
主要仪器:斑马鱼养殖循环系统(爱生,ESEN-AW-S1,中国);MGC-100光照培养箱(一恒,中国);SZX16体视镜(Olympus,日本);斑马鱼孵育盒(爱生,中国);24孔板和96孔板(Corning,美国);Zebrabox(ViewPoint Life Science,ZebraBox Revolution,法国);超高效液相色谱-串联质谱(UPLC-MS/MS)系统(Waters,Impact Ⅱ,美国):ACQUITY UPLC系统配有样品盘、自动进样器、二元泵,使用BEH C18液相色谱柱(150 mm×2.1 mm, 1.7 μm, Waters,美国);Xevo TQ MS质谱系统为三重四级杆,配有电喷雾离子源(ESI)。
主要试剂:扑热息痛(paracetamol, 99.9%; Dr. Ehrenstorfer,德国);二甲基亚砜(DMSO, G.R., 99%; Sigma-Aldrich,美国);10% Hank’s溶液:0.137 mol·L-1 NaCl,5.4 mmol·L-1 KCl,0.25 mmol·L-1 Na2HPO4,0.44 mmol·L-1 KH2PO4,1.3 mmol·L-1 CaCl2,1.0 mmol·L-1 MgSO4,4.2 mmol·L-1 NaHCO3;Milli-Q水(Merck Millipore,德国)。
1.2 实验材料
野生型Tubingen斑马鱼(Danio rerio)饲养在封闭的循环系统中,恒温28.5 ℃,每日固定光照时间14 h,黑暗时间10 h,早晚各喂食丰年虾1次。将斑马鱼成鱼以雌雄比1∶2置于孵育盒中,次日开灯1 h后收集并用Milli-Q水清洗斑马鱼胚胎,胚胎在28.5 ℃的恒温培养箱中孵育备用。
1.3 实验方法
1.3.1 胚胎暴露
标准品首先溶解在二甲基亚砜中制备成储备液,而后通过10% Hanks液逐级稀释制备暴露液,暴露液浓度分别为5 μg·L-1、50 μg·L-1、100 μg·L-1、200 μg·L-1、500 μg·L-1、1 mg·L-1、2.5 mg·L-1、5 mg·L-1,于4 ℃冷藏;暴露溶液的浓度采用UPLC-MS/MS检测。对照组溶剂为0.1%二甲基亚砜与10% Hank’s混合溶液。
在体视镜下挑选受精后6 h(6 hpf)的正常斑马鱼胚胎于玻璃培养皿中进行胚胎暴露,每个培养皿放置60~100枚胚胎和16 mL扑热息痛暴露液。每个浓度的扑热息痛暴露重复3次,每天中午更换50%的暴露液,并把死亡的胚胎或幼鱼挑出。暴露期间保持每天固定光照14 h、黑暗10 h,温度28.5 ℃。胚胎暴露持续至5 dpf,每24 h观察记录斑马鱼胚胎毒性终点情况。
1.3.2 运动行为实验
幼鱼运动行为的记录和量化通过使用Zebrabox的行为记录系统来实现,所使用的软件是Video Track for Zebrafish Software Version 3.5。选取发育完好、游泳能力正常的幼鱼,转移进入Zebrabox,先在黑暗条件下适应10 min,再交替给予光照10 min和黑暗10 min条件的周期光刺激,进行2个周期共40 min的行为学测试,数据记录间隔为1 min,原始最小记录间隔为1 s。
运动行为学分析测试了2种不同类型的行为终点:运动距离和转向行为,记录了斑马鱼在扑热息痛暴露下5~7 dpf的运动总量、转动方向和转角次数。运动行为实验使用96孔板,每孔1条幼鱼和200 μL暴露液,每个浓度组设24个平行;转动行为实验使用24孔板,给予斑马鱼幼鱼更大的生存空间,以免其因碰壁而改变或中止转向行为,每孔1条幼鱼和1 mL暴露液,每个浓度组设6个平行。行为实验期间斑马鱼幼鱼一直生活在96(或24)孔板中,给予固定光照14 h、黑暗10 h,温度28.5 ℃,不更换孔板中暴露液。
1.4 数据分析
作图采用Origin 7.5软件,数据统计采用Graphpad Prism 7软件单因素方差分析(one-way ANOVA)来检验各浓度组与对照组之间的差异,若P<0.05,则认为具有显著性差异。
2 结果(Results)
2.1 扑热息痛对斑马鱼的胚胎毒性
本实验共考察斑马鱼胚胎24 hpf死亡、72 hpf孵化、96 hpf心包囊肿和96 hpf脊柱弯曲4个毒性终点,将96 hpf心包囊肿和96 hpf脊柱弯曲合称为96 hpf发育形态异常,即畸形。胚胎暴露实验中,一些发育异常的斑马鱼仅表现为脊柱弯曲,一些仅表现为心包囊肿,而另一些斑马鱼则同时表现这2种性状(图1)。
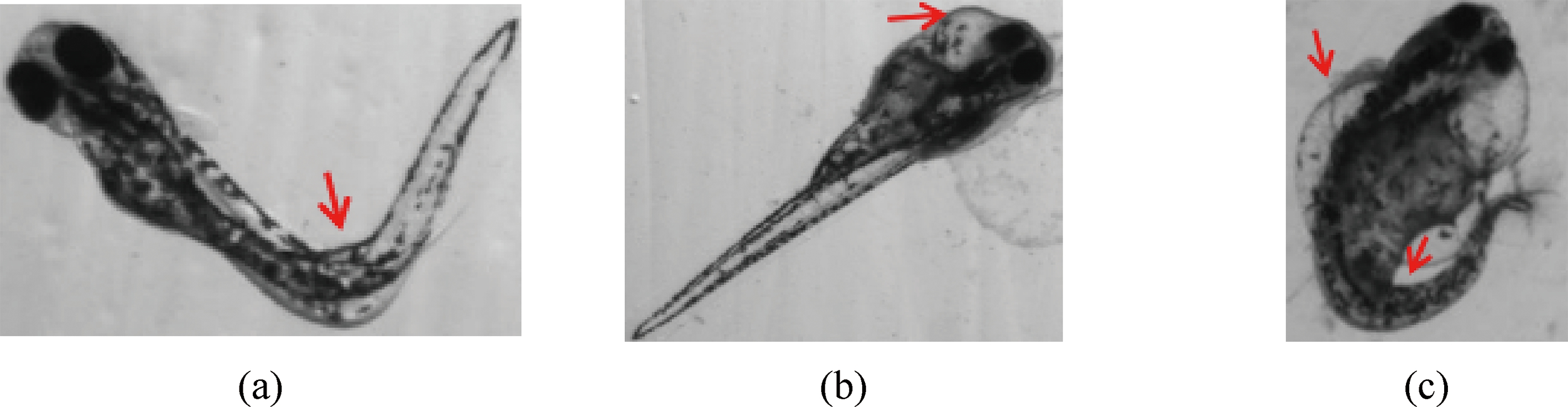
图1 96 hpf发育异常形态图
注:(a) 脊柱弯曲;(b) 心包囊肿;(c) 脊柱弯曲和心包囊肿同时出现。
Fig. 1 Effects of paracetamol on zebrafish embryo development after 96 h of exposure
Note: (a) Spinal curvature; (b) Pericardial cyst; (c) Simultaneous occurrence of spinal curvature and pericardial cyst.
斑马鱼胚胎暴露实验结果(表1)显示,斑马鱼胚胎死亡、孵化和畸形均与扑热息痛暴露浓度无明显的依赖关系。相对于空白对照组(24 h死亡率23.3%),在暴露浓度≥200 μg·L-1时,24 h死亡率整体稍微升高(27.0%~35.1%,除500 μg·L-1)。相对于空白组100%的孵化率,各暴露浓度实验组的孵化率稍微下降(90.0%~98.2%,其中1 mg·L-1和2.5 mg·L-1为90.0%)。各浓度实验组的致畸率(发育形态异常百分比)也略微上升(对照组为1.11%;实验组范围1.56%~5.49%)。整体来看,孵化率下降与致畸率上升在高浓度暴露组(浓度≥200 μg·L-1)尤为明显。考虑到环境中的扑热息痛是ng·L-1到低μg·L-1水平,真实环境中其对斑马鱼的致死效应和发育毒性可以忽略。
表1 扑热息痛对斑马鱼胚胎的发育形态影响
Table 1 Effects of paracetamol on zebrafish embryo development
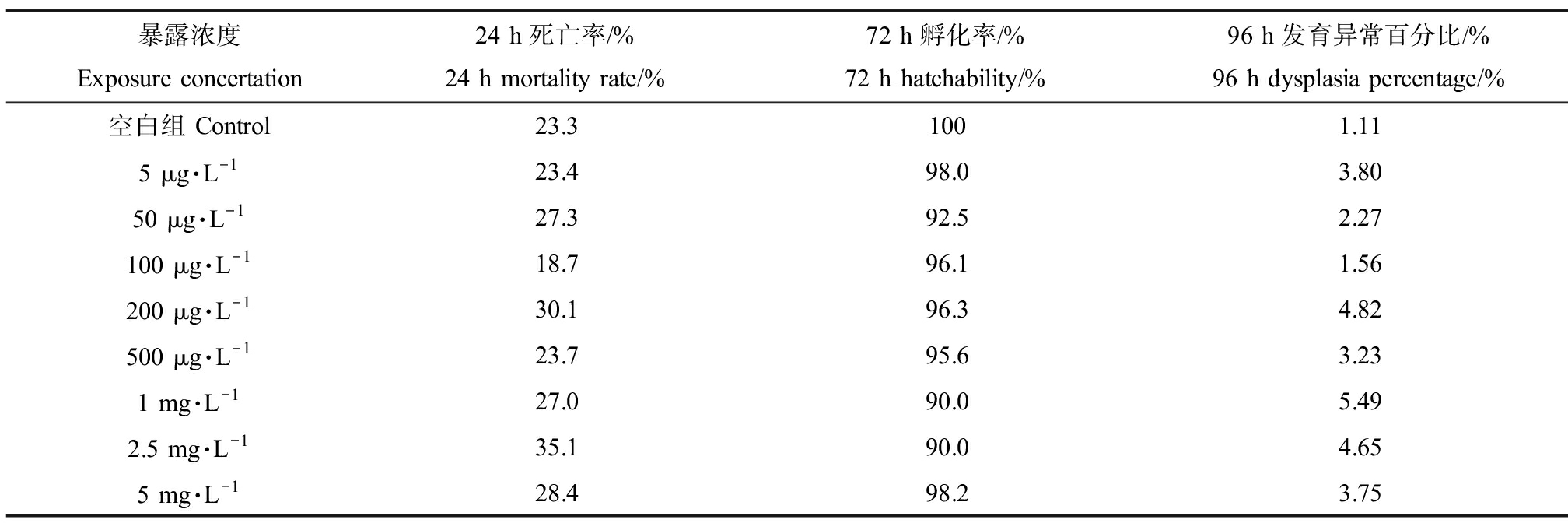
暴露浓度Exposure concertation24 h死亡率/%24 h mortality rate/%72 h孵化率/%72 h hatchability/%96 h发育异常百分比/%96 h dysplasia percentage/%空白组 Control23.31001.115 μg·L-123.498.03.8050 μg·L-127.392.52.27100 μg·L-118.796.11.56200 μg·L-130.196.34.82500 μg·L-123.795.63.231 mg·L-127.090.05.492.5 mg·L-135.190.04.655 mg·L-128.498.23.75
2.2 扑热息痛暴露对斑马鱼运动行为效应的影响
2.2.1 运动距离
在光、暗交替刺激下观察斑马鱼幼鱼的游动能力,每10 min运动总距离如图2所示。运动行为实验结果显示:斑马鱼幼鱼在黑暗时期活动更活跃。扑热息痛暴露整体抑制了斑马鱼幼鱼的运动能力,尤其是在黑暗时期。随着扑热息痛暴露时间的增加,斑马鱼运动抑制的程度也不断增强,光照和黑暗时期内,7 dpf斑马鱼的总移动距离均小于5 dpf和6 dpf,即相较于5 dpf和6 dpf,7 dpf斑马鱼幼鱼的运动能力下降。针对5 dpf、6 dpf和7 dpf斑马鱼幼鱼,除了最开始10 min的光刺激对浓度的变化不够敏感,所有光暗交替的其他暴露组在扑热息痛的浓度为5 μg·L-1时已经表现出来显著的运动抑制。

图2 扑热息痛对斑马鱼幼鱼运动距离的影响
注:(a) 5 dpf斑马鱼幼鱼;(b) 6 dpf斑马鱼幼鱼;(c) 7 dpf斑马鱼幼鱼;*P<0.05,**P<0.01,***P<0.001,****P<0.0001。
Fig. 2 The effects of paracetamol on the movement distance of zebrafish larvae
Note: (a) 5 dpf zebrafish larvae; (b) 6 dpf zebrafish larvae; (c) 7 dpf zebrafish larvae; *represents P<0.05, **represents P<0.01, ***represents P<0.001, ****represents P<0.0001.
2.2.2 转动行为
扑热息痛暴露对斑马鱼幼鱼转向行为实验结果显示:空白组斑马鱼的转向圈数表现为顺时针<逆时针,即正常状态下的斑马鱼逆时针转圈次数应多于顺时针。扑热息痛暴露改变了斑马鱼幼鱼的顺、逆时针转向规律,暴露组斑马鱼幼鱼多表现为顺时针转向圈数大于逆时针(或次数相当),即使在最低浓度暴露组(5 μg·L-1)。此外,扑热息痛暴露降低了斑马鱼幼鱼的转向能力,随着暴露时间的增加,斑马鱼幼鱼的转向圈数明显下降。相较于5 dpf,6 dpf斑马鱼幼鱼的转向圈数平均下降50%,7 dpf斑马鱼幼鱼的转向圈数平均下降70%。
健康斑马鱼幼鱼在正常行进时,尾部摆动频率较低,身体角度变化幅度不大;当遇到外源性刺激等异常情况时会出现大幅转向。本研究将斑马鱼行进角度[-10,10]定义为无转向,[10,90]和[-90,-10]定义为一般型转向,[90,180]和[-180,-90]定义为刺激型转向。转向实验结果显示:尽管扑热息痛暴露会改变斑马鱼转向频率,但实验组斑马鱼与空白对照组的转向角度分布几乎一致,即一般型转向次数最多,其次是无转向,刺激型转向次数最少。
扑热息痛不同浓度暴露组对斑马鱼幼鱼转向角度的影响统计结果见表2。对于无转向和一般型转向,扑热息痛暴露的影响是随浓度升高产生抑制-促进-抑制,在较低浓度时(5~50 μg·L-1),扑热息痛会抑制斑马鱼幼鱼的转向;随着扑热息痛暴露浓度增加(100~500 μg·L-1),斑马鱼受扑热息痛刺激,出现促进转向的现象;当扑热息痛浓度增加到较高值时(1~5 mg·L-1),斑马鱼受扑热息痛毒性效应影响,再次出现转向抑制。对于刺激型转向,各浓度扑热息痛暴露组与空白对照相比,均呈现转向抑制的现象。
表2 扑热息痛暴露对斑马鱼幼鱼转角的影响Table 2 The effects of paracetamol on the rotation of zebrafish larvae
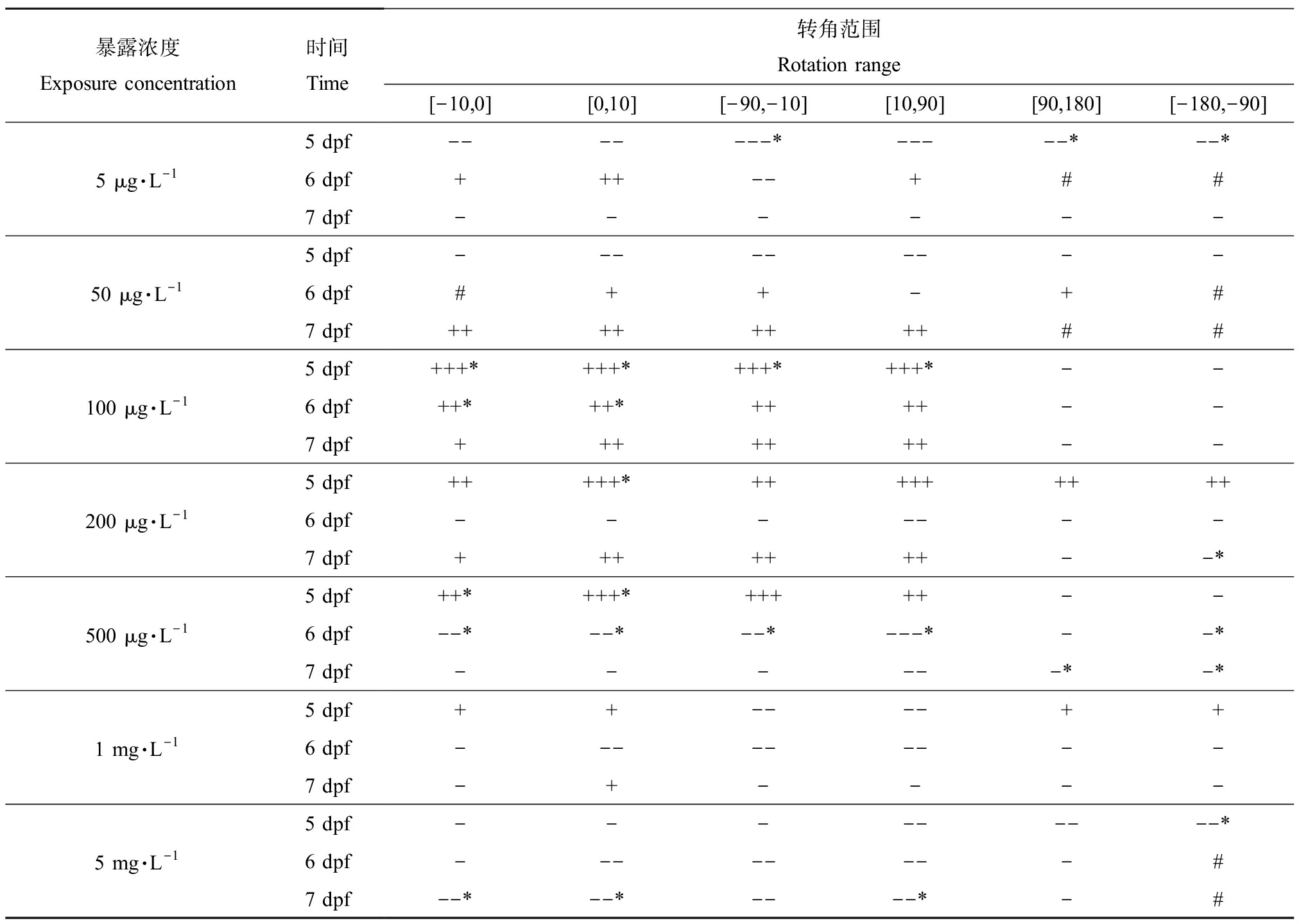
暴露浓度Exposure concentration时间Time转角范围Rotation range[-10,0][0,10][-90,-10][10,90][90,180][-180,-90]5 dpf-------*-----*--*5 μg·L-16 dpf+++--+##7 dpf------5 dpf---------50 μg·L-16 dpf#++-+#7 dpf++++++++##5 dpf+++*+++*+++*+++*--100 μg·L-16 dpf++*++*++++--7 dpf+++++++--5 dpf+++++*+++++++++200 μg·L-16 dpf-------7 dpf+++++++--*5 dpf++*+++*+++++--500 μg·L-16 dpf--*--*--*---*--*7 dpf------*-*5 dpf++----++1 mg·L-16 dpf---------7 dpf-+----5 dpf---------*5 mg·L-16 dpf--------#7 dpf--*--*----*-#
注:*P<0.05;“+”“-”代表暴露组10 min平均转向频率与对照组相差0~30,“++”“--”代表暴露组10 min平均转向频率与对照组相差30~100,“+++”“---”代表暴露组10 min平均转向频率与对照组相差>100;“#”代表无检出结果。
Note: *represents P<0.05; “+”“-” represent 10 min average turning frequency between the exposure groups and the control group differs 0~30, “++”“--”represent 10 min average turning frequency between the exposure groups and the control group differs 30~100, and “+++”“---”represent 10 min average turning frequency between the exposure groups and the control group differs >100; “#” represents no result was detected.
3 讨论(Discussion)
本研究利用斑马鱼胚胎毒性分析与运动行为效应影响相结合的方法,综合评估了扑热息痛暴露对斑马鱼发育与运动行为的影响。整体而言,相对于空白对照组,24 h致死率、胚胎发育毒性在高水平扑热息痛暴露浓度(≥200 μg·L-1)时较为明显;而运动行为效应在最低浓度暴露组(5 μg·L-1)已经有明显的变化,说明运动行为学指标相对于一般的发育毒性指标更为敏感。
3.1 胚胎毒性试验
胚胎毒性实验结果与以往研究结果基本相符。环境相关浓度(5~100 μg·L-1)的扑热息痛暴露对斑马鱼致死、孵化、致畸均无显著的浓度依赖关系,但在体视镜下可以观察到斑马鱼发育形态异常[22-23]。本实验中,高水平浓度扑热息痛(200 μg·L-1~5 mg·L-1)暴露对斑马鱼致死、孵化、致畸也无显著性影响,但与对照组相比,孵化率略有下降而致畸比例略有上升。这说明,扑热息痛对斑马鱼的急性毒性很弱,但有形态发育异常等亚致死毒性。斑马鱼胚胎出现心包水肿、脊椎弯曲等发育异常的状况,心包囊肿可能是由于体内毒素积聚,扰乱了渗透压调节系统,导致心包水化过度[25];一些研究表明,扑热息痛可剂量依赖性地抑制成骨细胞分化,并对骨骼发育产生不利影响[18]。Gao等[25]测定了扑热息痛暴露后斑马鱼骨骼发育相关基因的表达水平,根据qRT-PCR结果,推断扑热息痛对斑马鱼幼鱼骨骼发育具有毒性作用,可能通过降低runx2a、runx2b、Sp7、bmp2b和shh的mRNA水平而导致骨骼畸形,出现脊柱弯曲等发育畸形的情况。
3.2 运动行为效应影响
与以往单纯测定96、120或144 hpf中某一个具体时刻斑马鱼的行为实验不同,本研究自5~7 dpf 连续3 d测定扑热息痛对斑马鱼行为的影响,探究随发育进程扑热息痛对运动行为效应的影响变化,并在传统运动行为指标(自发运动总距离)外,增加了转向运动指标(顺逆时针运动规律以及转向角度频率分布),更加全面地反映了扑热息痛对斑马鱼运动行为的影响。
运动行为实验结果表明,扑热息痛暴露改变了斑马鱼幼鱼的运动能力与运动规律。在最低暴露浓度5 μg·L-1时,就使斑马鱼幼鱼出现运动抑制现象:总运动距离减少,顺逆时针转向规律改变,由正常状态下的逆时针转圈次数应多于顺时针变为顺时针转向圈数大于逆时针(或次数相当)。斑马鱼幼鱼的转角频率受扑热息痛暴露的影响较为复杂,随扑热息痛浓度增高呈现抑制-促进-抑制的现象,但在最低浓度暴露组同样有响应,5 μg·L-1扑热息痛暴露时,斑马鱼幼鱼的无转向、一般型转向和刺激型转向均受到抑制。此外,斑马鱼幼鱼运动抑制的程度随扑热息痛暴露时间的增加而增加,5、6和7 dpf斑马鱼幼鱼的游动总距离相较于空白对照分别平均下降10% (300~500 μg·L-1除外)、20%和25%;相较于5 dpf,6 dpf斑马鱼幼鱼的转向圈数平均下降50%,7 dpf斑马鱼幼鱼的转向圈数平均下降70%。
一些研究表明,斑马鱼幼鱼活动抑制的原因可能在于受药物刺激后出现体长缩短等发育不良现象[26]。但以往的研究更倾向于将斑马鱼运动行为的变化归因于神经毒性的结果,Park等[27]发现会诱发斑马鱼的大脑和脊髓神经元损伤,对神经系统有毒性作用,从而导致暴露于100 mg·L-1丙烯酰胺的5 dpf斑马鱼圆周运动,出现运动障碍。Zhao等[28]研究发现铅会破坏BDNF依赖的神经保护通路,这是一种关键的、深度参与神经系统发育并最终可能对运动特征起作用的通路,从而对斑马鱼幼鱼产生神经行为损伤,包括运动活动和转向行为的活动减弱,以及社会行为的活动亢进。已有研究发现,扑热息痛暴露会导致胆酰酯酶(ChE)活性上升,在高浓度活性氧和氮(ROS/RNS)的存在下,ChE活性的增加与神经退行有关[23]。此外,扑热息痛暴露还与氧化应激相关。然而,扑热息痛引起斑马鱼运动行为抑制的毒性机制目前仍不是很清楚,导致扑热息痛暴露后斑马鱼幼鱼运动行为变化的具体机制仍需进一步研究。
5~7 dpf行为测试期间,随着时间推移,斑马鱼幼鱼的运动能力与转向能力下降。究其原因,可能是5~7 dpf斑马鱼卵黄囊逐渐收缩,靠自身供给的营养越来越少,因此斑马鱼需要转向外界觅食,对扑热息痛的吸收量增大,扑热息痛的毒性效应会更加明显。
本研究结合斑马鱼胚胎毒性试验与行为效应影响综合评估扑热息痛的生态毒性。研究发现,环境相关低浓度水平的扑热息痛暴露(5~100 μg·L-1)对斑马鱼没有明显的急性毒性(致死、孵化等)和胚胎发育异常的亚致死效应;仅在高浓度暴露水平下(≥200 μg·L-1),上述毒性效应有所增强。在本研究设置的暴露浓度梯度内(5 μg·L-1~5 mg·L-1),扑热息痛对斑马鱼的胚胎毒性均没有浓度-效应关系。此外,相比较空白对照组,扑热息痛暴露组斑马鱼的运动距离和转向都有不同程度的影响,特别是在低浓度水平(5 μg·L-1)就表现出了很好的灵敏性(显著的运动抑制)。这说明,斑马鱼的运动行为学指标相较于胚胎发育终点更为灵敏,预示着与运动行为学效应相关的神经毒性指标可能对扑热息痛更为敏感。由于扑热息痛的毒性机制目前尚不是很清晰,未来需要结合神经毒性和运动行为效应开展进一步的研究。环境中低浓度、长期存在的扑热息痛需要引起人们的重视并长期关注。
[1] Nunes B, Antunes S C, Santos J, et al. Toxic potential of paracetamol to freshwater organisms: A headache to environmental regulators? [J]. Ecotoxicology and Environmental Safety, 2014, 107: 178-185
[2] Bauer A Z, Kriebel D, Herbert M R, et al. Prenatal paracetamol exposure and child neurodevelopment: A review [J]. Hormones and Behavior, 2018, 101: 125-147
[3] ![]() J, Piński A, Marchlewicz A, et al. Organic micropollutants paracetamol and ibuprofen—Toxicity, biodegradation, and genetic background of their utilization by bacteria [J]. Environmental Science and Pollution Research, 2018, 25(22): 21498-21524
J, Piński A, Marchlewicz A, et al. Organic micropollutants paracetamol and ibuprofen—Toxicity, biodegradation, and genetic background of their utilization by bacteria [J]. Environmental Science and Pollution Research, 2018, 25(22): 21498-21524
[4] Kostich M S, Batt A L, Lazorchak J M. Concentrations of prioritized pharmaceuticals in effluents from 50 large wastewater treatment plants in the US and implications for risk estimation [J]. Environmental Pollution, 2014, 184: 354-359
[5] Sun Q, Lv M, Hu A Y, et al. Seasonal variation in the occurrence and removal of pharmaceuticals and personal care products in a wastewater treatment plant in Xiamen, China [J]. Journal of Hazardous Materials, 2014, 277: 69-75
[6] Yang X, Chen F, Meng F G, et al. Occurrence and fate of PPCPs and correlations with water quality parameters in urban riverine waters of the Pearl River Delta, South China [J]. Environmental Science and Pollution Research, 2013, 20(8): 5864-5875
[7] Liu S J, Ding R, Nie X P. Assessment of oxidative stress of paracetamol to Daphnia magna via determination of Nrf1 and genes related to antioxidant system [J]. Aquatic Toxicology, 2019, 211: 73-80
[8] Lin A Y C, Yu T H, Lin C F. Pharmaceutical contamination in residential, industrial, and agricultural waste streams: Risk to aqueous environments in Taiwan, China [J]. Chemosphere, 2008, 74(1): 131-141
[9] Hinz B, Cheremina O, Brune K. Acetaminophen (paracetamol) is a selective cyclooxygenase-2 inhibitor in man [J]. FASEB Journal: Official Publication of the Federation of American Societies for Experimental Biology, 2008, 22(2): 383-390
[10] Meseguer-Ripolles J, Lucendo-Villarin B, Tucker C, et al. Dimethyl fumarate reduces hepatocyte senescence following paracetamol exposure [J]. iScience, 2021, 24(6): 102552
[11] Brune K, Renner B, Tiegs G. Acetaminophen/paracetamol: A history of errors, failures and false decisions [J]. European Journal of Pain, 2015, 19(7): 953-965
[12] Blecharz-Klin K, Piechal A, Jawna-Zboińska K, et al. Paracetamol—Effect of early exposure on neurotransmission, spatial memory and motor performance in rats [J]. Behavioural Brain Research, 2017, 323: 162-171
[13] Rand-Weaver M, Margiotta-Casaluci L, Patel A, et al. The read-across hypothesis and environmental risk assessment of pharmaceuticals [J]. Environmental Science &Technology, 2013, 47(20): 11384-11395
[14] Dai Y J, Jia Y F, Chen N, et al. Zebrafish as a model system to study toxicology [J]. Environmental Toxicology and Chemistry, 2014, 33(1): 11-17
[15] Bhagat J, Zang L Q, Nishimura N, et al. Zebrafish: An emerging model to study microplastic and nanoplastic toxicity [J]. The Science of the Total Environment, 2020, 728: 138707
[16] Sato Y, Dong W J, Nakamura T, et al. Transgenic zebrafish expressing rat cytochrome P450 2E1 (CYP2E1): Augmentation of acetaminophen-induced toxicity in the liver and retina [J]. International Journal of Molecular Sciences, 2023, 24(4): 4013
[17] Glasco D M, Wang Z D, Kang S, et al. Acetaminophen disrupts the development of pharyngeal arch-derived cartilage and muscle in zebrafish [J]. Journal of Developmental Biology, 2022, 10(3): 30
[18] Cedron V P, Weiner A M J, Vera M, et al. Acetaminophen affects the survivor, pigmentation and development of craniofacial structures in zebrafish (Danio rerio) embryos [J]. Biochemical Pharmacology, 2020, 174: 113816
[19] Chen Y J, Song W Y, Ge W, et al. Metabolic competency of larval zebrafish in drug-induced liver injury: A case study of acetaminophen poisoning [J]. Toxicological Sciences: An Official Journal of the Society of Toxicology, 2022, 189(2): 175-185
[20] Moreira D P, Ribeiro Y M, Ferreira C S, et al. Exposure to acetaminophen impairs gametogenesis and fertility in zebrafish (Danio rerio) [J]. Archives of Toxicology, 2023, 97(1): 263-278
[21] Tao Y, Li Z X, Yang Y, et al. Effects of common environmental endocrine-disrupting chemicals on zebrafish behavior [J]. Water Research, 2022, 208: 117826
[22] Xia L, Zheng L, Zhou J L. Effects of ibuprofen, diclofenac and paracetamol on hatch and motor behavior in developing zebrafish (Danio rerio) [J]. Chemosphere, 2017, 182: 416-425
[23] Nogueira A F, Pinto G, Correia B, et al. Embryonic development, locomotor behavior, biochemical, and epigenetic effects of the pharmaceutical drugs paracetamol and ciprofloxacin in larvae and embryos of Danio rerio when exposed to environmental realistic levels of both drugs [J]. Environmental Toxicology, 2019, 34(11): 1177-1190
[24] Erhunmwunse N O, Tongo I, Ezemonye L I. Acute effects of acetaminophen on the developmental, swimming performance and cardiovascular activities of the African catfish embryos/larvae (Clarias gariepinus) [J]. Ecotoxicology and Environmental Safety, 2021, 208: 111482
[25] Gao X L, Zhang Y L, Hou L, et al. Co-exposure to nanoplastics and acetaminophen causes skeletal dysplasia and behavioral abnormalities in zebrafish [J]. Ecotoxicology and Environmental Safety, 2023, 253: 114640
[26] Chen Q Q, Lackmann C, Wang W Y, et al. Microplastics lead to hyperactive swimming behaviour in adult zebrafish [J]. Aquatic Toxicology, 2020, 224: 105521
[27] Park J S, Samanta P, Lee S, et al. Developmental and neurotoxicity of acrylamide to zebrafish [J]. International Journal of Molecular Sciences, 2021, 22(7): 3518
[28] Zhao J, Zhang Q, Zhang B, et al. Developmental exposure to lead at environmentally relevant concentrations impaired neurobehavior and NMDAR-dependent BDNF signaling in zebrafish larvae [J]. Environmental Pollution, 2020, 257: 113627