自20世纪初人工合成塑料问世以来,便因其成本低廉、可塑性强等优异特性被大量使用。近60年来,塑料的产量呈爆炸式增长,目前全球每年生产量已经超过3.6亿t[1]。由于塑料耐降解、回收利用率低,导致其废弃物大量进入环境,并在其中累积、迁移和扩散[1]。环境中的塑料废弃物在物理、(光)化学以及生物作用下,可以进一步碎裂为更小的固体颗粒[2-3]。其中,粒径<5 mm的塑料碎片和颗粒被称为微塑料[4]。同时,也有部分微塑料是人们特意制造的,比如个人护理品中的塑料微珠[5]。近年来,微塑料已被证实广泛存在于自然界中,并被认为是塑料废弃物的主要形态[6]。水环境是塑料污染的重要汇。据估计,全球的塑料废弃物中约有11%进入水体环境[7],因此,微塑料污染对于水生生态系统的潜在危害受到了广泛关注。大量的研究都已表明,微塑料可被水生生物摄取,并可通过食物链传递,在不同生物学水平上产生一系列的毒性效应[6, 8]。
野生生物在环境中不可避免会遭受组织损伤,而影响其在环境中的适应性,因此,正常的组织修复与再生能力对于生物个体和种群均是极为重要的[9]。另一方面,组织受损但未能及时修复的生物可能对环境污染物的毒性作用更为敏感。然而,目前针对微塑料水生生物毒性的研究基本局限于健康生物体,从而极有可能低估其生态风险。
相对于哺乳动物,鱼类等低等脊椎动物具有更强大的再生能力。其中,斑马鱼尾鳍再生模型由于其组织结构相对简单、易于手术操作以及再生过程迅速等诸多优点而被广泛应用于再生科学以及毒理学中[10]。研究表明,经切除后,尾鳍的再生过程,即所谓“割处再生(epimorphic regeneration)”,在斑马鱼成鱼中持续2周,而幼鱼则仅需3 d即可完成[10-11]。在尾鳍被切除后,斑马鱼将会激活各种炎症以及再生相关基因,以促进尾鳍再生的顺利进行。整个再生过程可细分为4个阶段,即伤口愈合、上皮化、芽基形成和外生长[10, 12]。对于成鱼而言,在尾鳍切除后的0~12 h,上皮细胞快速向断尾处迁移,促使伤口闭合,这个过程称为伤口愈合阶段。12~24 h则为上皮化阶段,此过程中间质细胞向伤口迁移,使伤口表皮化。之后的24~48 h则为芽基形成阶段,随着表皮细胞的积聚,以及各种细胞的去组织化,伤口处开始形成芽基,以便后续再生过程的进行。芽基大致分为近端、远端、两侧区域。有别于正常的生长发育,芽基只存在于组织再生之中。而48 h直至尾鳍修复完全称之为外生长阶段,该阶段主要是近端的芽基快速生长以促使尾鳍的再生[10, 12]。
笔者研究组之前的研究已证实微塑料可以影响鱼类组织修复与再生能力[13]。然而,斑马鱼的尾鳍再生是一个高度组织化的过程,而微塑料作为颗粒物的特性使其对于不同再生阶段的暴露途径以及毒性效应存在差异,尤其是断尾创口愈合前后,颗粒物和创口微界面的相互作用可能在微塑料影响尾鳍再生时具有重要意义。通过对斑马鱼尾鳍不同的再生阶段进行微塑料的暴露,对比不同阶段对微塑料的响应差异,可以明确微塑料干扰尾鳍再生的窗口期,从而进一步揭示微塑料影响组织修复与再生的内在作用机制。
本研究以目前相关文献较多的聚苯乙烯微球为微塑料的代表,先通过比较斑马鱼幼鱼在尾鳍再生不同阶段暴露于微塑料的尾鳍再生面积以及游泳行为的变化,从结构和功能上确定不同阶段对微塑料毒性效应的响应差异;进一步通过研究关键基因的转录水平变化,初步揭示其中的相关机制。
1 材料与方法(Materials and methods)
1.1 化学试剂
聚苯乙烯微球(CAS:9003-53-6,标称直径为50 nm)购自上海阿拉丁试剂有限公司。超声混匀后微塑料用超纯水配制成实验所需浓度。
1.2 实验动物
本实验用斑马鱼为购置于中国斑马鱼资源中心的AB系野生型,约为6个月龄,健康状况良好。成鱼养殖用水为经曝气和活性炭过滤处理24 h以上的自来水。雌雄分开饲养,每天早晚按时喂食丰年虫和商品饲料。每周定时清理鱼缸以保证水质清洁。鱼房温度控制在(28.0±1.0) ℃,光暗周期为14 h光∶10 h暗。按照标准方法配鱼[13],收集斑马鱼鱼卵。28 ℃下约72 h胚胎孵化,挑选发育正常的幼鱼用于后续研究。
1.3 斑马鱼幼鱼尾鳍切除以及微塑料的暴露
实验设置4个处理组,包括1个曝气水对照组(记为Cont.)以及3个尾鳍再生不同阶段的微塑料暴露组,具体如图1所示。我们之前的研究表明1 mg·L-1的50 nm聚苯乙烯微球在断尾后持续暴露可以抑制斑马鱼幼鱼尾鳍再生[13]。考虑到本研究的实验设计,微塑料暴露浓度均设为3 mg·L-1。其中,3个不同阶段暴露分别为断尾前暴露,即暴露阶段在72~108 hpf (hour post fertilization,即受精后小时数),记为3 mg·L-1-1;断尾后再生前期暴露(108~144 hpf),记为3 mg·L-1-2;以及再生后期暴露(144~180 hpf),记为3 mg·L-1-3。在暴露阶段之外,其他时间幼鱼均在曝气水中培养。在108 hpf,所有幼鱼均进行断尾手术。断尾时,用三卡因(tricaine,CAS: 886-86-2,浓度为0.016%)溶液浸泡并麻醉幼鱼,之后将幼鱼平铺于琼脂板上,借助体视显微镜,用刀片紧沿着幼鱼脊柱末端切除尾鳍[13-14]。断尾后的幼鱼在曝气水中复苏后,放回之前的处理组内。暴露实验在6孔板中进行,每个孔5 mL暴露液,放置20条幼鱼。每个处理4个平行。在180 hpf,暴露实验结束。
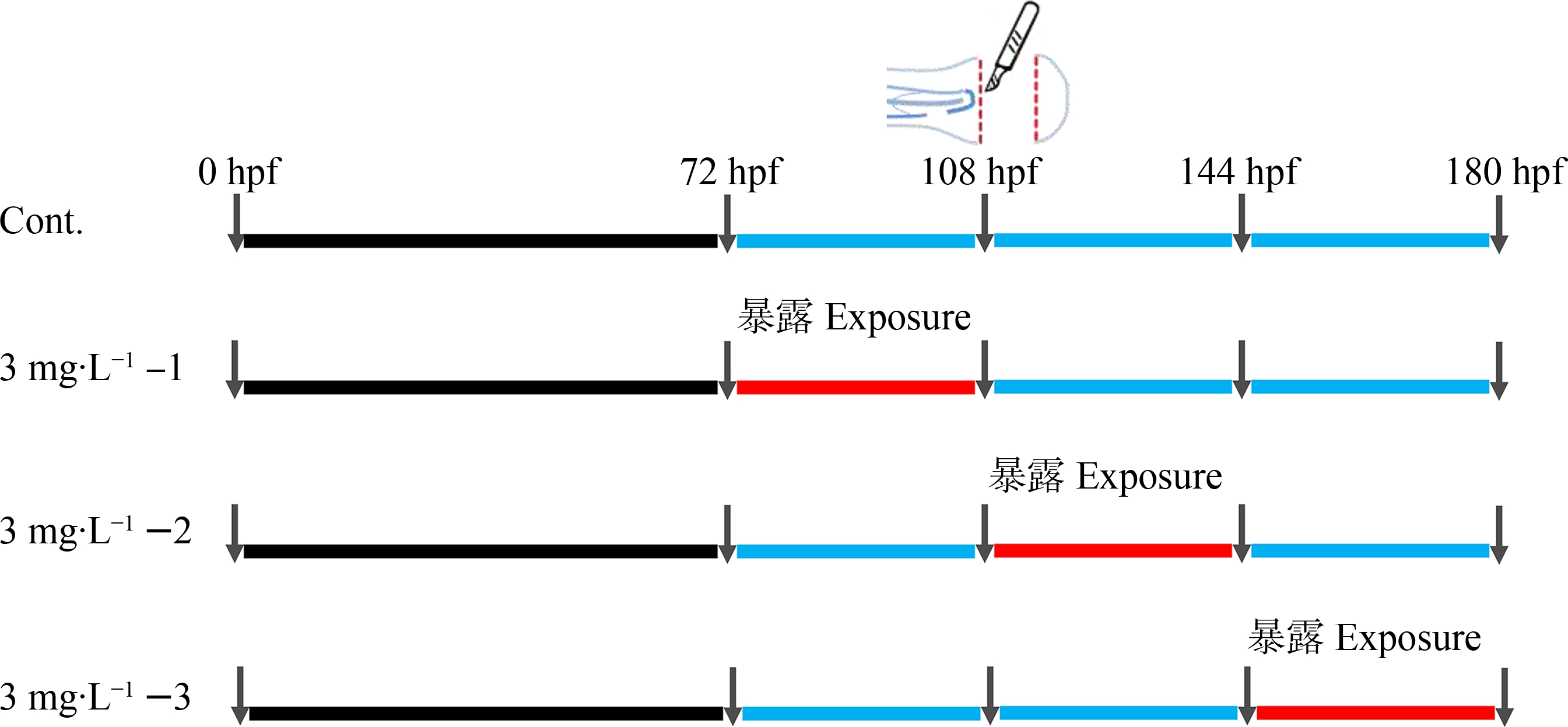
图1 斑马鱼幼鱼断尾和微塑料暴露实验示意图Fig. 1 Schematic of caudal fin amputation and microplastic exposure for larval zebrafish
1.4 斑马鱼幼鱼尾鳍再生面积及游泳行为测定
在180 hpf暴露实验结束后,每个平行中随机挑选5条幼鱼,在显微镜进行拍照,记录幼鱼尾鳍再生状况,并利用ImageJ软件对尾鳍的再生面积进行量化,并以对照组进行归一[13]。
同样,在暴露实验结束后,每个平行中随机挑选9条幼鱼并转移到96孔板中,每孔1条幼鱼,并将暴露液更换为100 μL曝气水。通过Zebralab高通量行为分析仪(Viewpoint,法国)先后对斑马鱼幼鱼自由游泳行为和在光周期下的游泳行为进行测定[13]。具体程序为:在连续光照适应20 min后,进行20 min持续光照下自由游泳行为测定,之后在40 min明暗光周期下(10 min暗-10 min明-10 min暗-10 min明)检测幼鱼对明暗转化刺激下的行为响应。
1.5 斑马鱼幼鱼免疫系统及再生信号通路相关基因的转录水平测定
幼鱼断尾和暴露均如前所述。在暴露实验结束后,将幼鱼取样(4个平行,每个平行约20条鱼合并为一个样品),并整体匀浆,用Trizol (Takara,日本)按照厂商的说明提取总RNA。测定总RNA的浓度和纯度,在确认符合要求后,通过反转录试剂盒(ReverTra Ace qPCR RT kit, Toyobo,日本)将RNA合成为cDNA第一链。参考之前的研究[13],选取了再生信号通路相关基因,同时考虑到免疫系统在组织修复与再生中的重要作用,也挑选了免疫系统若干基因,使用SYBR Green荧光定量PCR试剂盒(Toyobo,日本)对其转录水平进行测定。其中,再生信号通路相关基因包括Wnt/β-catenin通路中的lef1、wnt10a和wnt5b,成骨蛋白BMP通路中的bmp2b和bmp4,成纤维细胞生长因子FGF通路中的fgf20a和fgfr1a,胰岛素样生长因子IGF中的igf2b,Notch中的gata6和mfap4,视黄酸RA中的raldh2和cyp26a1,音猬因子Hh中shha,Activin通路中的activinβb,以及尾鳍中细胞增殖的标志基因pcna;而免疫系统相关基因则包括促炎性细胞因子tnf-α和il-1β,抗炎性细胞因子il-10,调控因子nf-κb2,趋化因子cxcl18b和cxcr3.2,其他细胞因子il-12α,以及中性粒细胞和巨噬细胞的特异性标志基因mpx和mpeg1。PCR反应条件为95 ℃变性3 min,之后40个循环设置为95 ℃ 15 s,60 ℃退火/延伸1 min。相对转录水平以管家基因β-actin进行校正。
1.6 统计分析
使用SPSS和GraphPad Prism进行数据处理以及绘图。实验数据确认符合正态分布及方差齐性后,通过单因素方差分析(one-way ANOVA)并以Dunnett’s检验进行多重比较。除表示基因转录水平变化的热图之外,其他结果均以平均值±标准误(Mean±SEM)表示。设P<0.05时有统计学差异。
2 结果(Results)
2.1 不同再生阶段微塑料暴露对斑马鱼幼鱼尾鳍再生面积的影响
在180 hpf暴露实验结束,即断尾后72 h对斑马鱼幼鱼尾鳍面积进行测量(图2)。与预期一致,此时对照组幼鱼尾鳍已基本完成再生。而不论哪个再生阶段暴露微塑料,幼鱼尾鳍面积均有减少,且抑制程度为再生前期暴露(3 mg·L-1-2)>再生后期暴露(3 mg·L-1-3)>断尾前暴露(3 mg·L-1-1),其相对面积分别为对照组的88.2%、90.2%和97.0%。其中,再生前期暴露(3 mg·L-1-2)与对照组相比有显著差异,但不同再生阶段暴露组间未见统计学差异。
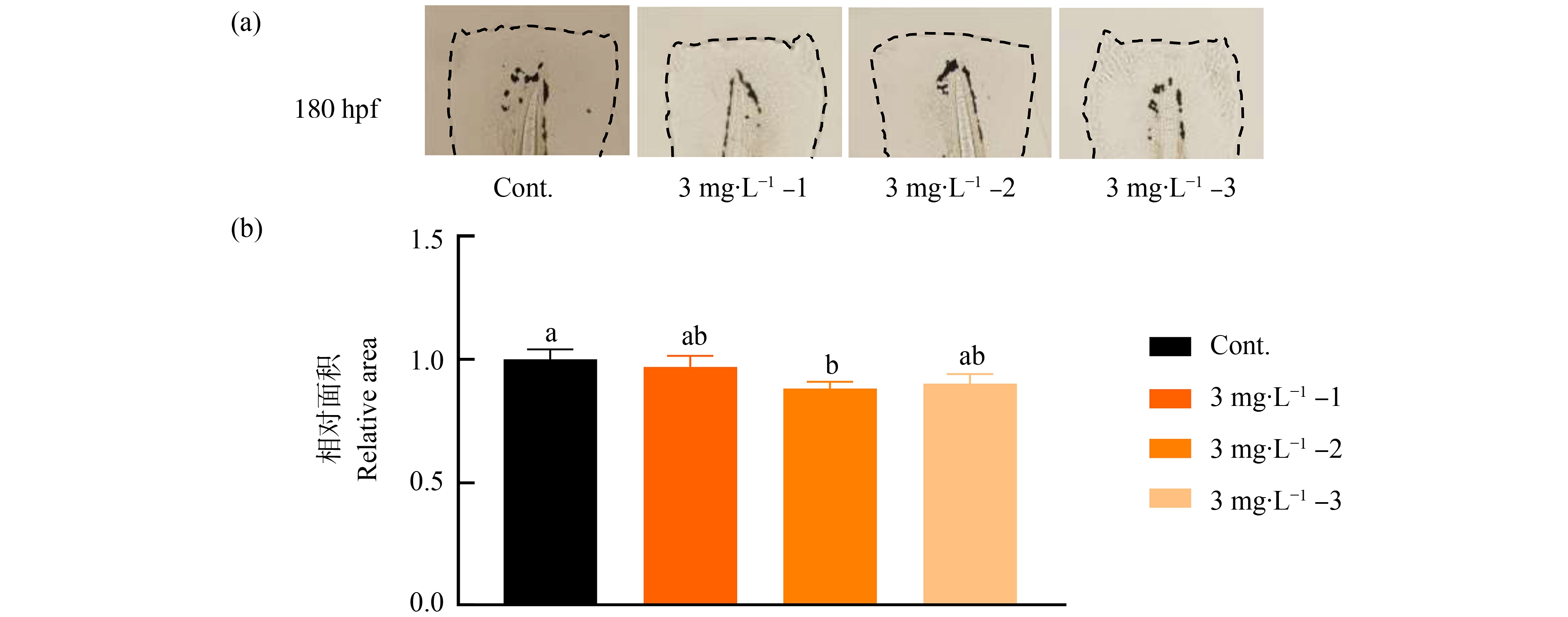
图2 尾鳍再生不同阶段微塑料暴露对斑马鱼幼鱼尾鳍面积的影响
注:(a)暴露实验结束(180 hpf)时各处理组再生尾鳍形态;(b)180 hpf时各处理组尾鳍的相对面积;结果用平均值±标准差表示;不同字母表示组间有显著差异(P<0.05);hpf即受精后小时数。
Fig. 2 Effect of microplastic exposure at different regeneration stages on the fin area in larval zebrafish
Note: (a) Representative pictures of regenerating fins at the end of exposure (180 hpf); (b) Quantification of the relative fin area at the end of exposure; the results are presented as the mean±SEM; the different letters represent statistically significant differences among different groups (P<0.05); hpf means hour post fertilization.
2.2 不同再生阶段微塑料暴露对斑马鱼幼鱼游泳行为的影响
在暴露结束后,测定了不同再生阶段微塑料暴露对斑马鱼幼鱼游泳行为的影响,结果如图3所示。在持续光照下(图3(b)),再生前期暴露(3 mg·L-1-2)显著增加了斑马鱼幼鱼的游泳速度,而其他2个暴露组则未见影响。在明暗光周期下(图3(c)),不同阶段微塑料暴露似乎均能增加幼鱼的游泳速度,且再生前期暴露(3 mg·L-1-2)的影响最为明显。
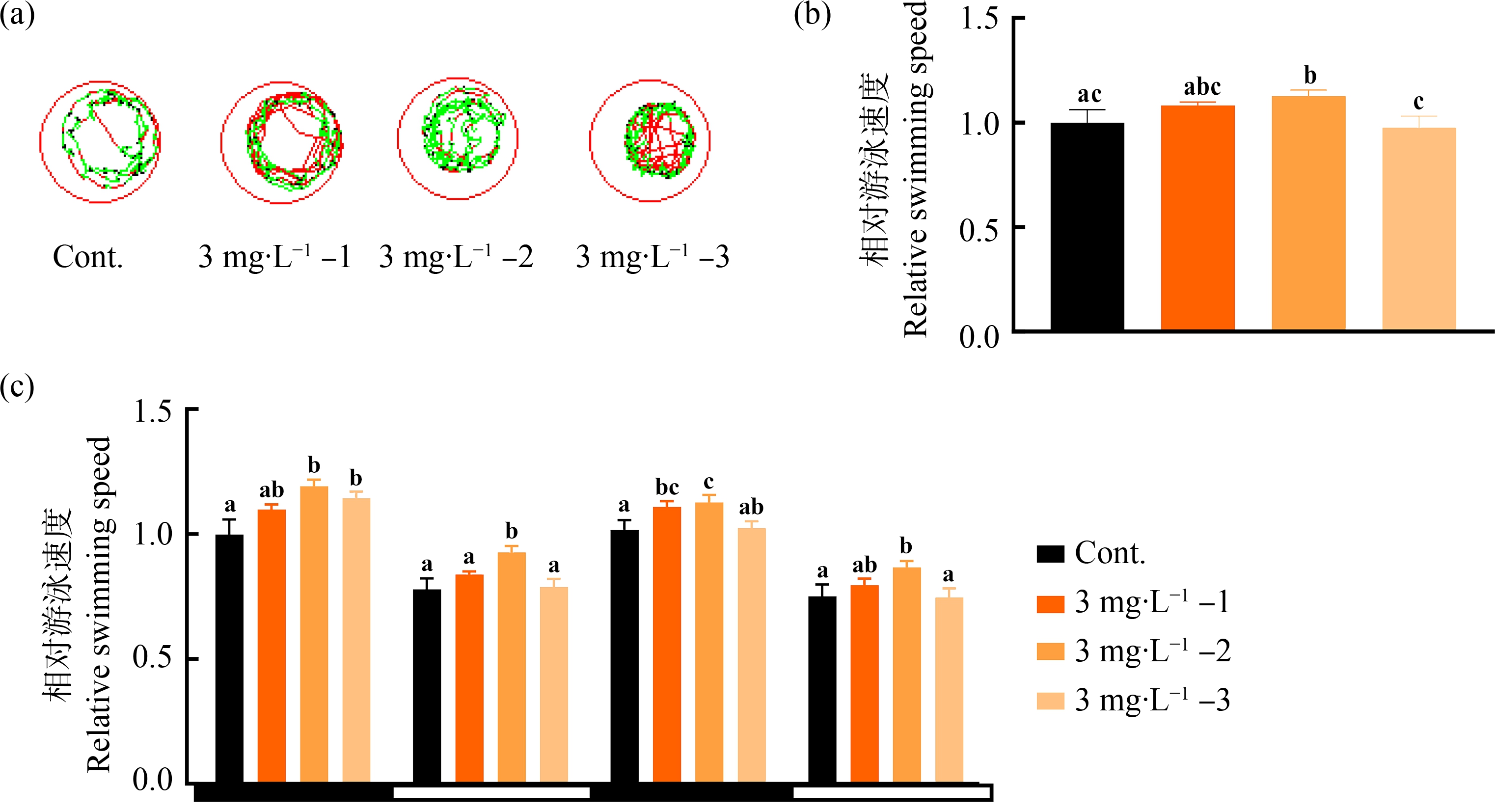
图3 尾鳍再生不同阶段微塑料暴露对斑马鱼幼鱼游泳行为的影响
注:(a)斑马鱼幼鱼在60 s内运动轨迹;黑线表示速度<2.2 mm·s-1,绿线表示速度介于2.2~6.6 mm·s-1,红线表示速度>6.6 mm·s-1;
(b)持续光照下的自由游泳相对速率;(c)光周期下的相对游泳速率;结果以平均值±标准误表示;不同字母表示组间有显著差异(P<0.05)。
Fig. 3 Effect of microplastic exposure at different regenerating stages on the locomotor behavior of larval zebrafish following caudal fin amputation
Note: (a) Trajectory of zebrafish larvae in 60 s; the black line represents the speed less than 2.2 mm·s-1, the green represents the speed between 2.2 and 6.6 mm·s-1, and the red represents the speed greater than 6.6 mm·s-1; (b) The relative free-swimming speed of zebrafish during 20 min of visible light; (c) The relative swimming speed of zebrafish during the photoperiod stimulation test; the results are presented as the mean±SEM; the different letters represent statistically significant differences among different groups (P<0.05).
2.3 不同再生阶段微塑料暴露对斑马鱼幼鱼免疫系统相关基因转录水平的影响
对于所检测的免疫系统相关基因而言,微塑料暴露能够下调大部分基因的转录水平(图4),且断尾后暴露(即3 mg·L-1-2或3 mg·L-1-3)的下调程度更为显著,比如il-10、cxcr3.2、mpx和mpeg1。而对于il-1β,虽然3个暴露阶段的转录水平无统计学差异,但断尾后暴露其mRNA的相对水平更低。基因tnf-α和cxcl18b则分别仅在断尾前(3 mg·L-1-1)或再生前期暴露(3 mg·L-1-2)有显著下调。调控因子nf-κb2在3个暴露组与对照组相比均无差异,但3 mg·L-1-3暴露组与其他2个暴露组间有显著差异。
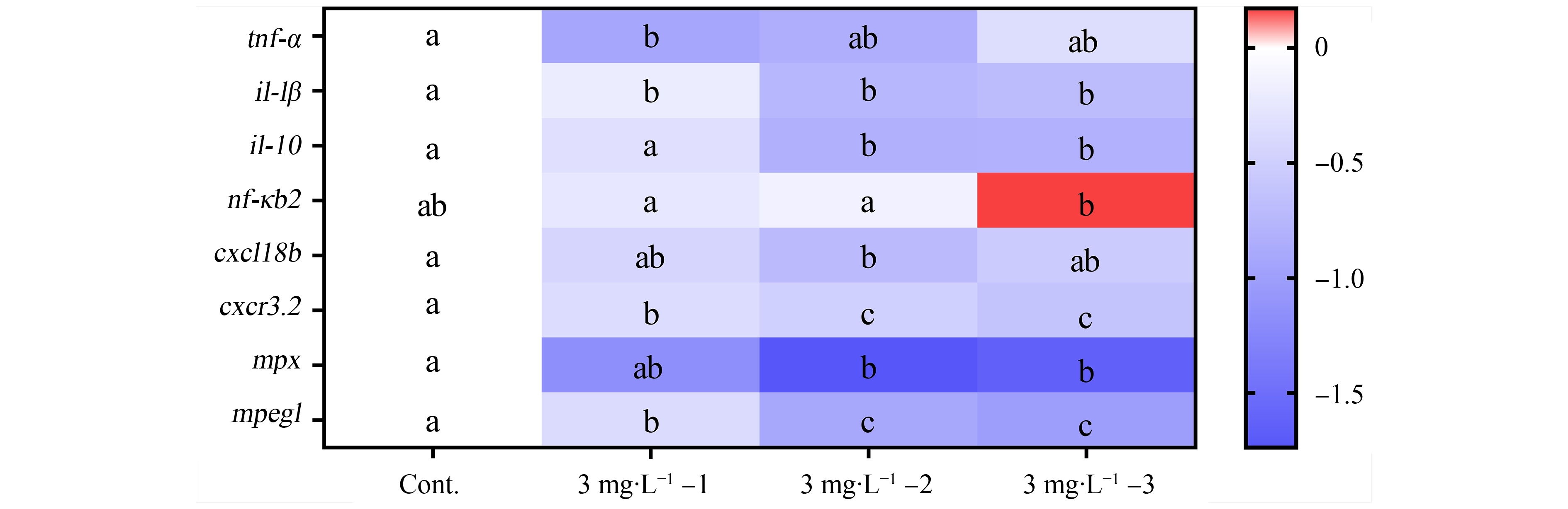
图4 尾鳍再生不同阶段微塑料暴露对斑马鱼幼鱼免疫系统相关基因转录水平的影响
注:不同字母表示组间有显著差异(P<0.05)。
Fig. 4 Effect of microplastic exposure at different regenerating stages on the transcript level of genes related to immune response in larval zebrafish
Note: The different letters represent statistically significant differences among different groups (P<0.05).
2.4 不同再生阶段微塑料暴露对斑马鱼幼鱼再生信号通路相关基因转录水平的影响
再生过程由一系列复杂的信号通路所调控,在微塑料暴露后相关基因的转录水平表现出上调或下调的不同趋势,如图5所示。其中,与对照组相比,断尾前暴露(3 mg·L-1-1)下调了wnt5b、fgf20a和mfap4基因的转录水平;再生前期暴露(3 mg·L-1-2)则下调了fgf20a和mfap4基因,但上调了wnt5b、bmp2b、gata6和activinβb;而再生后期暴露(3 mg·L-1-3)则下调了fgf20a、mfap4、cyp26a1和pcna,但上调了bmp2b和gata6基因的转录水平。对比3个暴露组,断尾后再生期的暴露似乎可以影响更多的基因。与断尾前暴露相比较,再生期的暴露不但上调了多个基因,比如bmp2b、gata6等,而且对同样的基因,也可能呈现不同的影响趋势,比如wnt5b。而对比2个再生期阶段(3 mg·L-1-2和3 mg·L-1-3)的暴露结果,除个别基因之外,虽然变化倍数不同,但基因的转录大致呈现类似的变化趋势。
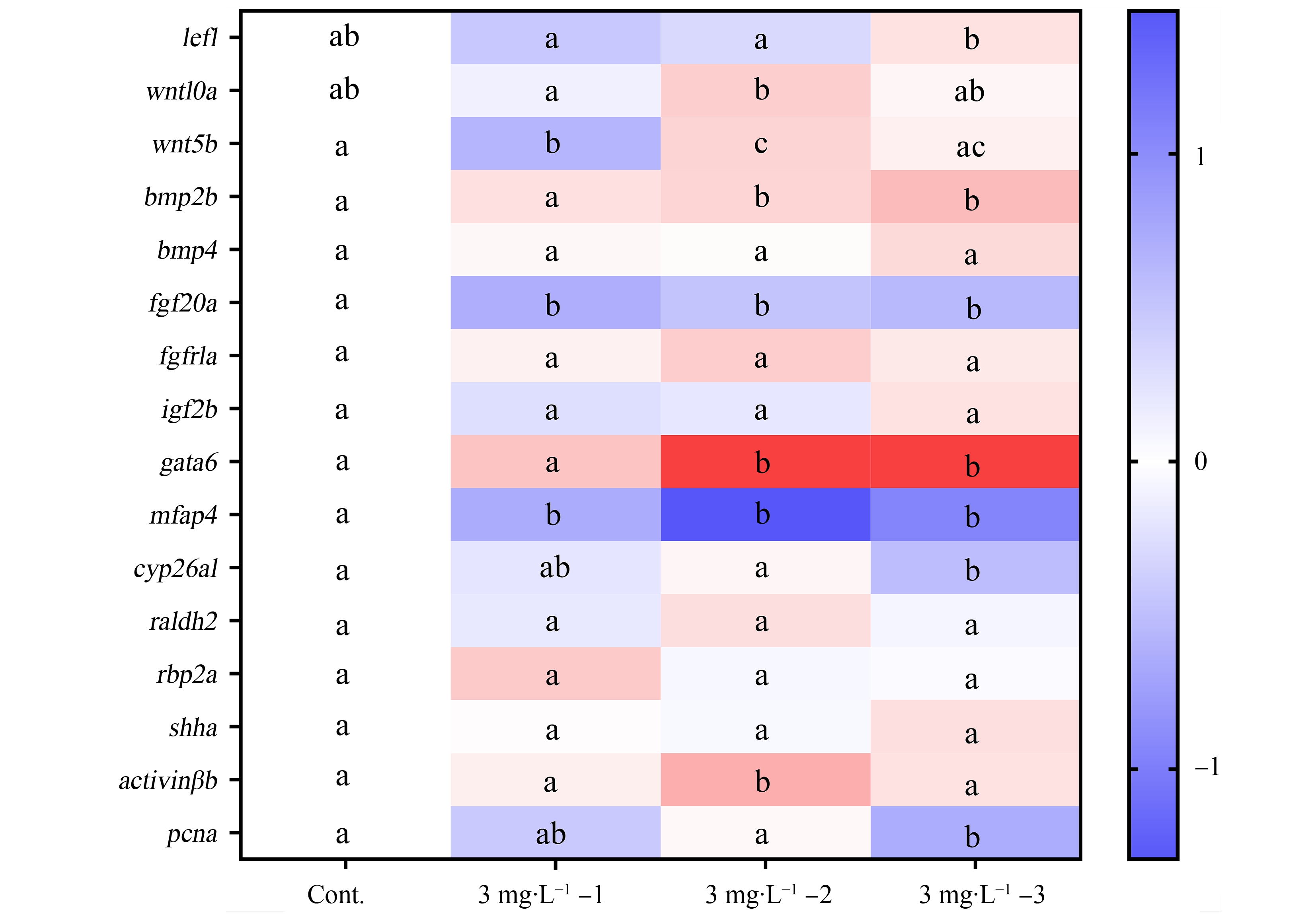
图5 尾鳍再生不同阶段微塑料暴露对斑马鱼幼鱼再生信号通路相关基因转录水平的影响
注:不同字母表示组间有显著差异(P<0.05)。
Fig. 5 Effect of microplastic exposure at different regenerating stages on the transcript level of genes involved in the signaling networks regulating fin regeneration in larval zebrafish
Note: The different letters represent statistically significant differences among different groups (P<0.05).
3 讨论(Discussion)
在本研究中,我们首先从再生尾鳍面积评估了不同阶段暴露于聚苯乙烯微塑料对斑马鱼幼鱼尾鳍再生的影响。研究发现,与之前的报道一致[13],不论哪个阶段的暴露,微塑料均能够或多或少抑制尾鳍的再生,而断尾后再生阶段暴露的影响则更为明显。我们之前的研究发现,当断尾幼鱼暴露于微塑料颗粒后,除了消化道之外,50 nm粒径的微塑料颗粒在尾鳍伤口处有明显分布,且能够破坏尾鳍处的亚细胞结构[13]。由此可知,尾鳍伤口可能作为额外的微塑料暴露途径,从而影响尾鳍再生进程的顺利进行。尤其在伤口愈合前后,颗粒物和创口微界面的相互作用对于微塑料影响生物组织修复与再生可能有重要意义。
尾鳍面积的变化可以反映微塑料对于再生尾鳍结构上的影响,进一步的,我们通过幼鱼游泳行为的变化评价了微塑料对尾鳍功能的影响。可以看出,斑马鱼幼鱼不论在持续光照下的自由游泳速度,还是对光周期的响应行为,均有不同程度的增加。我们之前的研究发现,幼鱼在断尾之后,可能会因为伤口的持续刺激(疼痛等原因)而使幼鱼游泳速率上升[15]。但是,微塑料更长时间的暴露(72 h)会导致幼鱼游泳速度下降。事实上,污染物导致鱼类游泳行为的变化和许多因素相关,除了尾鳍功能之外,神经、视觉、肌肉等方面的毒性效应均可能影响游泳速率,游泳行为的变化可能是上述不同因素共同作用的结果[16-17]。但是,我们的结果明确表明微塑料暴露会导致幼鱼游泳行为的改变,而这很可能归因于其对尾鳍再生过程的损害。对于水生生物而言,游泳是一项基本而关键的生存技能[17],而过度游泳行为可能使得幼鱼更容易被捕食者发现,从而影响其在野外的存活率。
斑马鱼幼鱼尾鳍切除后,免疫系统被强烈激活,不仅可以清除伤口处的病原微生物,而且在组织修复和再生中有重要的调控作用[18]。研究发现,在组织受损并形成伤口之后,凝血级联系统被激活,肥大细胞脱颗粒并释放细胞因子,随之开始炎症反应阶段。最初是中性粒细胞,之后是巨噬细胞,先后被招募到伤口处,清除细胞残骸,释放蛋白酶,并分泌一系列的生物活性小分子,从而启动组织重建,以及后续炎症细胞的活化、迁移和增殖[19-20]。炎症细胞中的中性粒细胞具有免疫调节作用,并影响炎症反应的启动,对再生过程作用显著;而巨噬细胞可调节尾鳍组织的外生长和辐状骨的形成,去除巨噬细胞将严重影响炎症消退和组织再生[19, 21-22]。而就炎症相关基因而言,研究者通过分析斑马鱼受伤后多个基因的时空表达模式,确证了其在斑马鱼组织修复和再生过程中的重要作用[23]。我们之前的研究也表明微塑料能够抑制斑马鱼的免疫应答,从而影响其尾鳍再生[13]。与此报道类似,本研究也发现不论在哪个阶段暴露,微塑料抑制了绝大部分炎症相关因子的转录,而炎症细胞的标志基因mpx和mpeg1同样被显著下调。同时,对比3个不同阶段,断尾后再生阶段的暴露相较于断尾前暴露,其对上述基因的抑制作用更为显著,这也和微塑料在不同阶段暴露对再生尾鳍面积的抑制程度相一致。
斑马鱼尾鳍再生涉及到复杂的调控机制,包括Wnt/β-catenin、成骨蛋白BMP、成纤维细胞生长因子FGF、胰岛素样生长因子IGF等信号通路均有重要作用[24]。其中,经典的Wnt/β-catenin信号途径,其被认为对于尾鳍再生过程是必要和充分的,扮演着作为调控中心的关键角色[24-25]。同时,研究也发现Wnt/β-catenin作为信号通路可调控伤口处的微环境,影响炎症细胞迁移以及细胞表型,可能在组织炎症和再生两者间起联系作用[19]。之前的研究表明,微塑料更长时间的暴露(72 h)会导致断尾幼鱼体内Wnt/β-catenin信号通路相关基因转录和表达的抑制[13]。然而,在本研究中,除了wnt5b基因在断尾前暴露被抑制外,断尾后再生阶段的暴露似乎一定程度可上调相应基因。BMP信号通路的主要作用是促进成骨细胞的分化[24]。同样的,断尾后暴露能够上调其中bmp2b基因的转录水平。类似的上调作用还发生在Activin通路中的activinβb基因。这可能表明了在一定程度的干扰下生物体内存在反馈调节作用,从而上调了再生信号相关通路基因的转录水平。然而,成纤维细胞生长因子FGF信号通路中的fgf20a,视黄酸RA中的cyp26a1,以及尾鳍中细胞增殖的标志基因pcna等,微塑料的暴露则依然对其转录存在不同程度的下调作用。同时,微塑料暴露能够上调Notch中的gata6基因,但下调了mfap4基因的转录水平。上述基因转录水平的变化我们也通过RNA-seq在转录组水平上进行了验证(数据未发表),虽然变化倍数有所差异,但其趋势是一致的。由此可以看出,尾鳍再生的调控网络相当复杂,阐明其分子和细胞机制还需要更多的生物学证据加以确认。但是,与尾鳍面积的结果类似,对比3个不同阶段的暴露,2个断尾后再生阶段的暴露影响了更多的基因,且其转录大致呈现类似的变化趋势。
研究表明,再生信号涉及的部分通路也和生物体的发育相关[10, 26],而实验中所采用的幼鱼也还处于发育过程中。其次,鉴于幼鱼中尾鳍再生过程较短,其中各阶段的划分并不明晰。同时,考虑到实验可操作性,本研究是通过幼鱼整体匀浆检测基因转录,其他组织和器官中相应基因的mRNA水平很可能干扰了再生尾鳍处的转录变化结果。因此,后续研究将通过在成鱼尾鳍再生不同阶段进行暴露,并单独对再生尾鳍进行检测,这可为揭示微塑料干扰尾鳍再生的内在机制提供更为可靠的证据。
应该注意到,本研究以及之前的毒理学相关报道中,微塑料的暴露浓度可能无法与真实的环境浓度相参照。在真实环境中,微塑料浓度在不同地点间有很大的差别。比如,就淡水水体而言,在已有的报道中,微塑料的浓度从每立方米水体几个颗粒到几千个颗粒不等[27]。同时,限于现有的采样方法和分析手段,目前的环境浓度数据并不准确。比如,利用不同孔径的微塑料采集网,其检测结果可能相差数百倍[28]。一般认为,目前的数据对于微塑料(尤其是小粒径的微塑料,比如纳米级微塑料)在环境水体中的浓度是严重低估的。但无论如何,相关毒理学数据对于评价微塑料的生态风险依然具有重要的参考意义。
总而言之,本研究表明聚苯乙烯微塑料暴露能够抑制斑马鱼尾鳍的再生,并在不同阶段表现出不同的毒性效应。综合再生尾鳍面积、游泳行为,以及免疫系统和再生信号通路相关基因的转录水平来看,相较于断尾前暴露,断尾后再生期(尤其是前期)微塑料对于尾鳍再生的影响更为显著,可能是微塑料抑制尾鳍再生的重要窗口期,也证实了微塑料颗粒和伤口微界面的相互作用在其影响尾鳍再生时具有重要的意义。
[1] Geyer R, Jambeck J R, Law K L. Production, use, and fate of all plastics ever made [J]. Science Advances, 2017, 3(7): e1700782
[2] Granby K, Rainieri S, Rasmussen R R, et al. The influence of microplastics and halogenated contaminants in feed on toxicokinetics and gene expression in European seabass (Dicentrarchus labrax) [J]. Environmental Research, 2018, 164: 430-443
[3] Koelmans A A, Redondo-Hasselerharm P E, Nor N H M, et al. Risk assessment of microplastic particles [J]. Nature Reviews Materials, 2022, 7(2): 138-152
[4] Arthur C, Baker J, Bamford H. Proceedings of the international research workshop on the occurrence, effects and fate of microplastic marine debris [R]. Washington DC: National Oceanic and Atmospheric Administration, 2009
[5] Rochman C M, Kross S M, Armstrong J B, et al. Scientific evidence supports a ban on microbeads [J]. Environmental Science &Technology, 2015, 49(18): 10759-10761
[6] Ma H, Pu S Y, Liu S B, et al. Microplastics in aquatic environments: Toxicity to trigger ecological consequences [J]. Environmental Pollution, 2020, 261: 114089
[7] Borrelle S B, Ringma J, Law K L, et al. Predicted growth in plastic waste exceeds efforts to mitigate plastic pollution [J]. Science, 2020, 369(6510): 1515-1518
[8] Nava V, Leoni B. A critical review of interactions between microplastics, microalgae and aquatic ecosystem function [J]. Water Research, 2021, 188: 116476
[9] Yoshinari N, Kawakami A. Mature and juvenile tissue models of regeneration in small fish species [J]. The Biological Bulletin, 2011, 221(1): 62-78
[10] Sehring I M, Weidinger G. Recent advancements in understanding fin regeneration in zebrafish [J]. Wiley Interdisciplinary Reviews Developmental Biology, 2020, 9(1): e367
[11] Iovine M K. Conserved mechanisms regulate outgrowth in zebrafish fins [J]. Nature Chemical Biology, 2007, 3(10): 613-618
[12] Pfefferli C, ![]() ńska A. The art of fin regeneration in zebrafish [J]. Regeneration, 2015, 2(2): 72-83
ńska A. The art of fin regeneration in zebrafish [J]. Regeneration, 2015, 2(2): 72-83
[13] Gu L Q, Tian L, Gao G, et al. Inhibitory effects of polystyrene microplastics on caudal fin regeneration in zebrafish larvae [J]. Environmental Pollution, 2020, 266(Pt 3): 114664
[14] Mathew L K, Sengupta S, Kawakami A, et al. Unraveling tissue regeneration pathways using chemical genetics [J]. The Journal of Biological Chemistry, 2007, 282(48): 35202-35210
[15] Sun L W, Gu L Q, Tan H N, et al. Effects of 17α-ethinylestradiol on caudal fin regeneration in zebrafish larvae [J]. The Science of the Total Environment, 2019, 653: 10-22
[16] Noyes P D, Haggard D E, Gonnerman G D, et al. Advanced morphological-behavioral test platform reveals neurodevelopmental defects in embryonic zebrafish exposed to comprehensive suite of halogenated and organophosphate flame retardants [J]. Toxicological Sciences: An Official Journal of the Society of Toxicology, 2015, 145(1): 177-195
[17] Tegelenbosch R A J, Noldus L P, Richardson M K, et al. Zebrafish embryos and larvae in behavioural assays [J]. Behaviour, 2012, 149(10-12): 1241-1281
[18] Ingerslev H C, Lunder T, Nielsen M E. Inflammatory and regenerative responses in salmonids following mechanical tissue damage and natural infection [J]. Fish &Shellfish Immunology, 2010, 29(3): 440-450
[19] Keightley M C, Wang C H, Pazhakh V, et al. Delineating the roles of neutrophils and macrophages in zebrafish regeneration models [J]. The International Journal of Biochemistry &Cell Biology, 2014, 56: 92-106
[20] Mescher A L, Neff A W, King M W. Inflammation and immunity in organ regeneration [J]. Developmental &Comparative Immunology, 2017, 66: 98-110
[21] Petrie T A, Strand N S, Yang C T, et al. Macrophages modulate adult zebrafish tail fin regeneration [J]. Development, 2014, 141(13): 2581-2591
[22] Li L, Yan B, Shi Y Q, et al. Live imaging reveals differing roles of macrophages and neutrophils during zebrafish tail fin regeneration [J]. The Journal of Biological Chemistry, 2012, 287(30): 25353-25360
[23] LeBert D C, Huttenlocher A. Inflammation and wound repair [J]. Seminars in Immunology, 2014, 26(4): 315-320
[24] Wehner D, Weidinger G. Signaling networks organizing regenerative growth of the zebrafish fin [J]. Trends in Genetics, 2015, 31(6): 336-343
[25] Wehner D, Cizelsky W, Vasudevaro M D, et al. Wnt/β-catenin signaling defines organizing centers that orchestrate growth and differentiation of the regenerating zebrafish caudal fin [J]. Cell Reports, 2014, 6(3): 467-481
[26] Tal T L, Franzosa J A, Tanguay R L. Molecular signaling networks that choreograph epimorphic fin regeneration in zebrafish - A mini-review [J]. Gerontology, 2010, 56(2): 231-240
[27] Science Advice for Policy by European Academies (SAPEA). A scientific perspective on microplastics in nature and society [R]. Berlin: SAPEA, 2019
[28] Dris R, Imhof H, Sanchez W, et al. Beyond the ocean: Contamination of freshwater ecosystems with (micro-) plastic particles [J]. Environmental Chemistry, 2015, 12(5): 539