-
随着工农业生产力水平的提高,国民经济发展步入迅猛增长时期,同时也带来了水体富营养化问题[1]。氨氮的超标是我国水体污染治理的首要难题,其原因在于生活污水工业废水排放不达标[2]。“十三五”生态环境保护规划中指出,我国要进一步推广再生水的循环和利用,而污水厂二级生化出水中氨氮含量过高影响了再生水的利用。为使污水厂二级生化出水可以作为再生水重复利用,须对其进行深度脱氮处理。
目前,污水厂常用的深度脱氮方法主要有生物法、人工湿地法和离子交换法等[3-5]。由于二级生化出水COD较低,采用生物法进行深度脱氮,须外加碳源,成本较高[6]。人工湿地法水量处理有限,在规划完善的城镇区域内,难以临时建设人工湿地用于二级生化出水的深度处理[7]。离子交换法通过应用对氨氮有较强选择性吸附作用的材料对水中氨氮进行处理。该方法具有性能稳定、可再生性强、原料来源广泛、成本低廉、不受场地的制约等优势,可以进行大规模推广使用[8]。常见的吸附材料有活性炭、蒙脱石、硅胶、氧化铝和沸石等[9]。
沸石凭借着价格低廉、吸附量大、可再生等优点成为广泛应用的脱氮材料[10]。天然沸石是一种以硅氧四面体为骨架的含水铝硅酸盐晶体化合物,其骨架中部分硅被铝替换,导致电荷失衡,从而产生电荷补偿而吸附的可交换性金属阳离子,进而使沸石具有离子交换性[11]。沸石去除氨氮的能力与其离子交换性和吸附性有关。天然沸石杂质含量较多,吸附效果不够理想。国内外众多研究人员致力于提升沸石对氨氮的吸附量[6-8]。粉末状沸石比表面积大,吸附效果好,但由于粉体颗粒细小,遇水容易泥化,导致难以分离。因此,亟需开发一种颗粒更大、适用于工程填料、且价格低廉的沸石。本研究选用20~40目天然斜发沸石进行改性,通过批次实验,探究了其对氨氮的吸附效果和特征,分析了吸附热力学动力学规律,可为这种改性沸石的实际工程应用提供参考。
全文HTML
-
实验中所选的吸附材料为河南信阳生产的天然斜发沸石,沸石为颗粒状,颜色为砖红色。经超纯水清洗后,破碎、烘干、过筛,取20~40目粒径沸石进行实验。
实验主要试剂包括酒石酸钾钠、纳氏试剂、NaOH、HCl、NH4Cl、NaCl,均为分析纯。实验选用模拟废水以1 000 mg·L−1的氨氮储备液稀释而成,实际废水选自成都安靖镇污水处理站出水。
-
实验仪器包括UV2600型紫外可见分光光度计(上海精密科学仪器有限公司)、HNY-100D型恒温振荡培养箱(天津市欧诺仪器仪表有限公司)、PHS-3C型数显pH计(上海仪电分极仪器有限公司)、L420型台式低速自动平衡离心机(湘仪离心机仪器有限公司)、YFX12程控马弗炉(上海意丰电炉有限公司)、Frontier型红外光谱仪(PerkinElmer)、EVO18型扫描电子显微镜(ZEISS)、QUANTAX 400型X射线能谱仪(Bruker)、NOVA4200E型比表面积测定仪(美国康塔仪器公司)、Empyrean型X射线衍射仪(荷兰帕纳科公司)。
-
实验前考察了酸碱盐及高温等改性方法对沸石吸附氨氮的效果的影响。根据前期实验结果,酸碱改性不能提高氨氮的去除率,氯化钠和高温改性可提高沸石对氨氮的去除率。本研究通过实验确定了联合改性时最佳氯化钠浓度和焙烧温度。在考察氯化钠浓度对吸附效果影响时,将10 g预处理后的沸石放入250 mL 锥形瓶中,并加入100 mL不同浓度的NaCl溶液(0、0.05、0.2、0.4、0.6、0.8、1.0、1.2 mol·L−1),恒温振荡24 h,再经超纯水多次漂洗,最后放入马弗炉中以300 ℃高温焙烧4 h改性。在8个250 mL锥形瓶中加入100 mL的8 mol·L−1模拟氨氮废水和 1.0 g改性沸石,振荡120 min后测定剩余氨氮浓度。在考察焙烧温度对吸附效果影响时,各取10 g 经NaCl (0.8 mol·L−1)溶液改性后的沸石,在马弗炉中以不同温度 (100、200、300、400、500、600、700、800 ℃)焙烧4 h。在8个250 mL锥形瓶中加入100 mL的8 mol·L−1模拟氨氮废水和 1.0 g改性沸石,振荡120 min后,测定剩余氨氮浓度。
在改性沸石投加量为 1 g·L−1,氨氮浓度为 8 mg·L−1,反应温度为 25 ℃的条件下,研究 pH对改性沸石吸附氨氮能力的影响;在氨氮浓度8 mg·L−1,pH为7,反应温度为 25 ℃的条件下,研究改性沸石投加量对吸附氨氮能力的影响;在改性沸石投加量为 8 g·L−1,pH为7,氨氮初始浓度为 10~500 mg·L−1时,研究反应温度对改性沸石吸附氨氮能力的影响。
选取天然及改性沸石各1 g,放于250 mL锥形瓶中,放入初始浓度为8 mg·L−1的模拟氨氮废水100 mL,分别振荡不同的时间,计算其吸附量;选取天然及改性沸石各1 g,放于250 mL锥形瓶中,分别加入100 mL不同浓度的模拟氨氮废水,放入恒温振荡培养箱,于25 ℃振荡120 min,计算沸石吸附量。
吸附量和去除率的计算方法见式(1)和式(2)。
式中:q为沸石对溶液中氨氮的吸附量,mg·g−1;
$\eta $ 为去除率;C0为初始Na+浓度,mg·L−1;C为平衡液中Na+浓度,mg·L−1;V为溶液体积,L;m为沸石质量,g。采用《纳氏试剂分光光度法》(HJ 535-2002)[12]测定氨氮。采用pH计指示电位滴定法测定阳离子交换量。
1.1. 原料与试剂
1.2. 实验仪器
1.3. 实验及测定方法
-
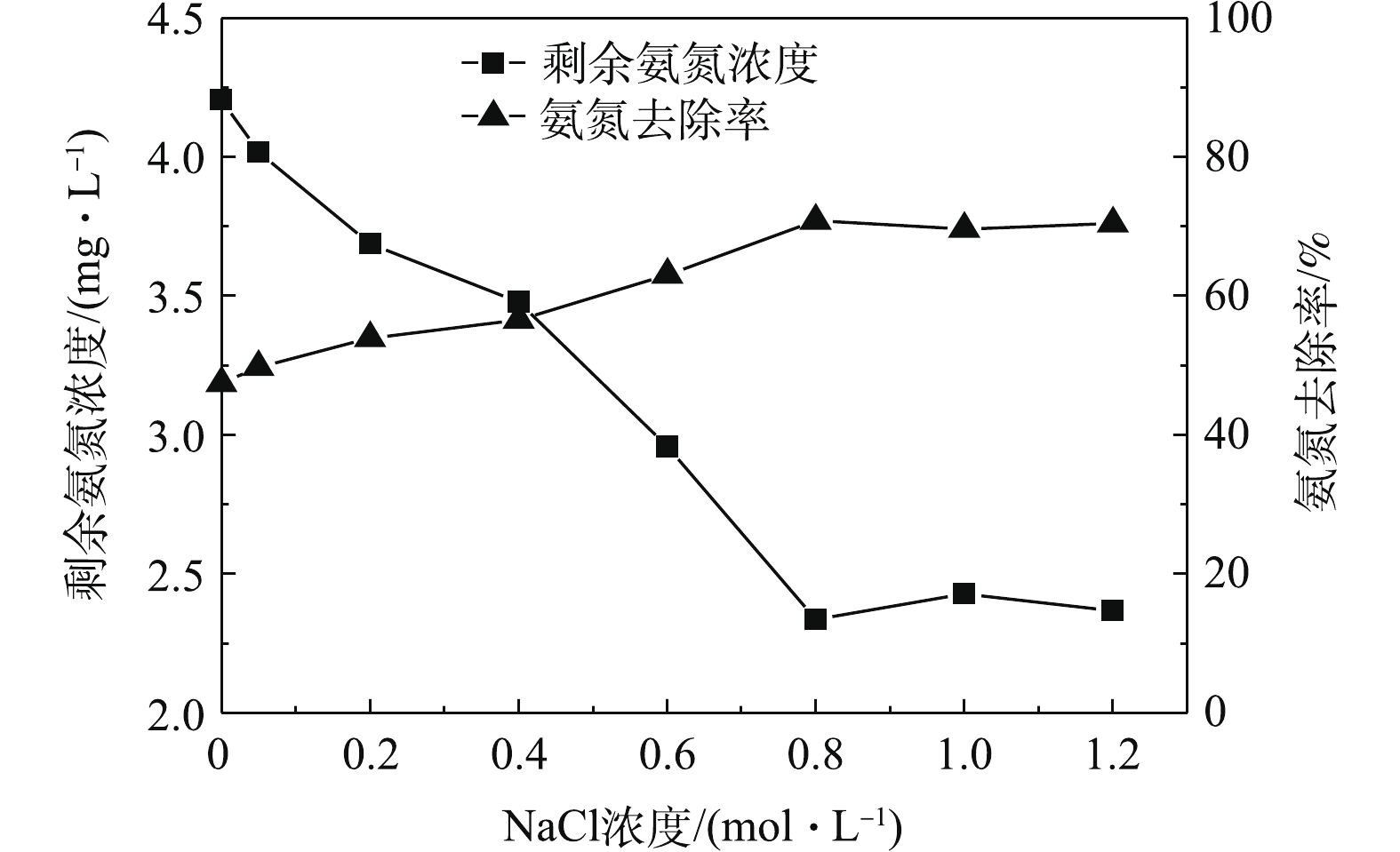
图1为NaCl浓度对改性沸石去除氨氮的影响结果。由图1可知,随着NaCl浓度的升高,氨氮的去除率也随之升高。这与林海等[13]的研究结果相似。产生该现象的原因是溶液中Na+与沸石中原有的半径较大的阳离子(Ca2+和Mg2+等)发生了置换。原有的阳离子半径较大,置换后导致沸石的孔径增大,进而增强了沸石去除氨氮的能力[8]。NaCl改性沸石对水中氨氮吸附性能明显高于天然沸石,这主要归功于经过NaCl改性后进入到沸石内部的Na+与水中氨氮进行离子交换反应。
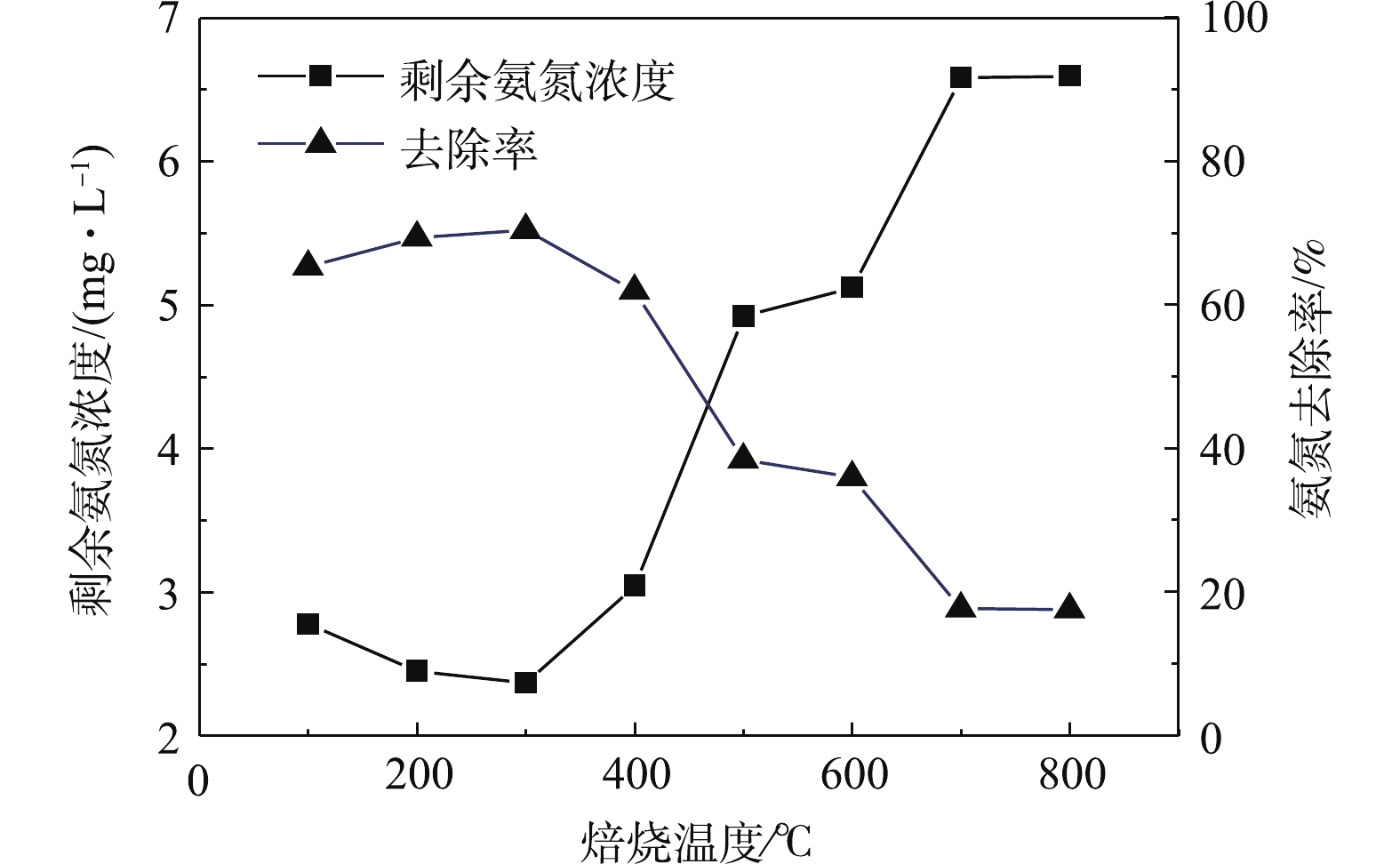
图2反映了温度对改性沸石去除氨氮的影响。可以看出,在温度比较低的情况下,温度的升高可导致去除率升高。在300 ℃时,去除效果最佳;但温度超过300 ℃后,氨氮的去除率明显下降。其原因是:高温焙烧可以清理内部孔道,去除杂质,增强氨氮去除率[14];而过高温度的焙烧会使沸石产生过热效应,使沸石内部结合水去除,导致内部孔道受热膨胀,破坏原有的孔道结构,增大了孔径,使之大于
$ {\rm{NH}}_4^ + $ 的直径,此时沸石吸附氨氮的能力开始减弱。综上所述,本研究确定氯化钠联合高温改性沸石的最佳条件为氯化钠浓度0.8 mol·L−1、焙烧温度300 ℃。
-
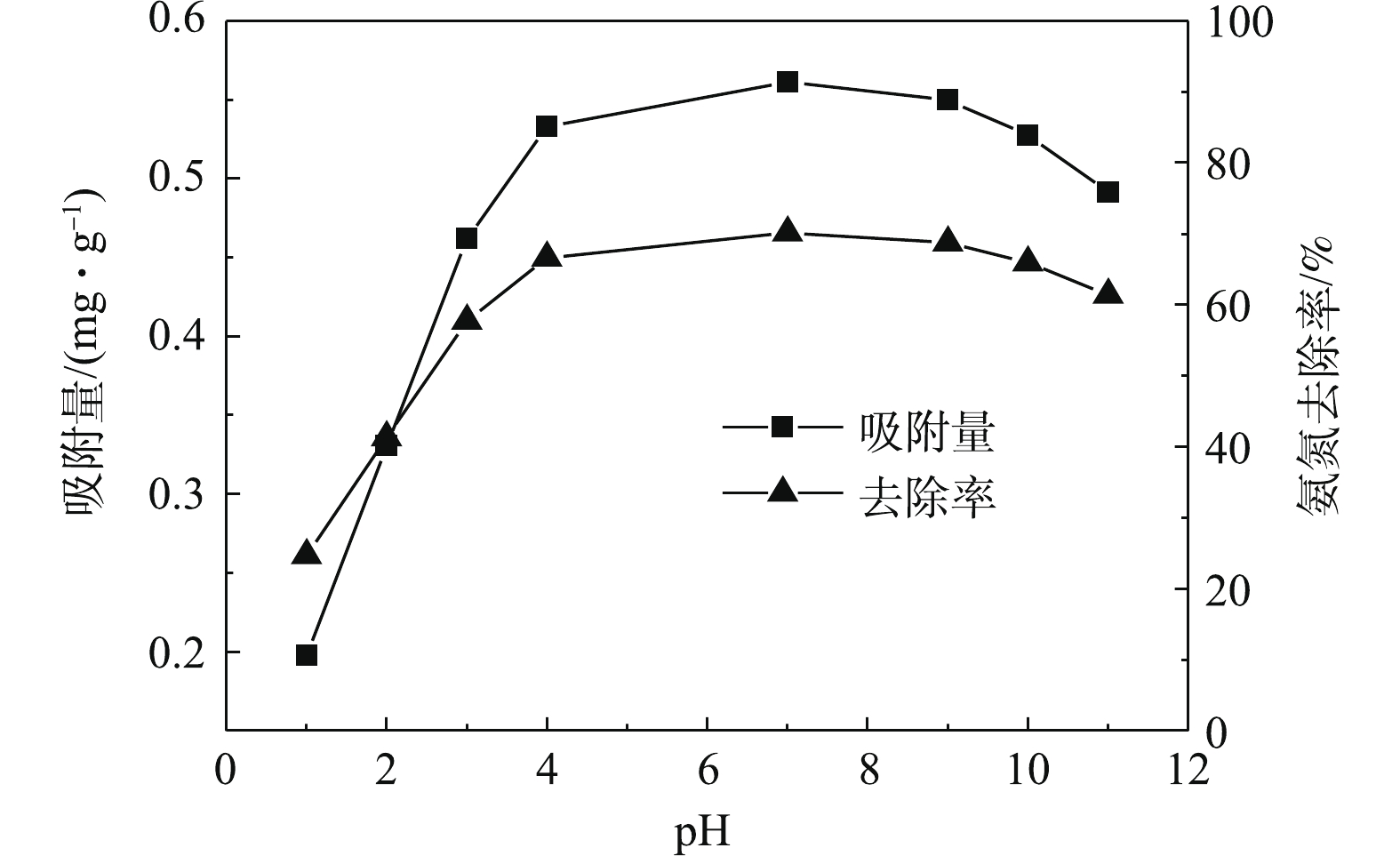
图3反映了pH对氨氮吸附量和去除率的影响。在酸性条件下,H+浓度较高,H+半径小于
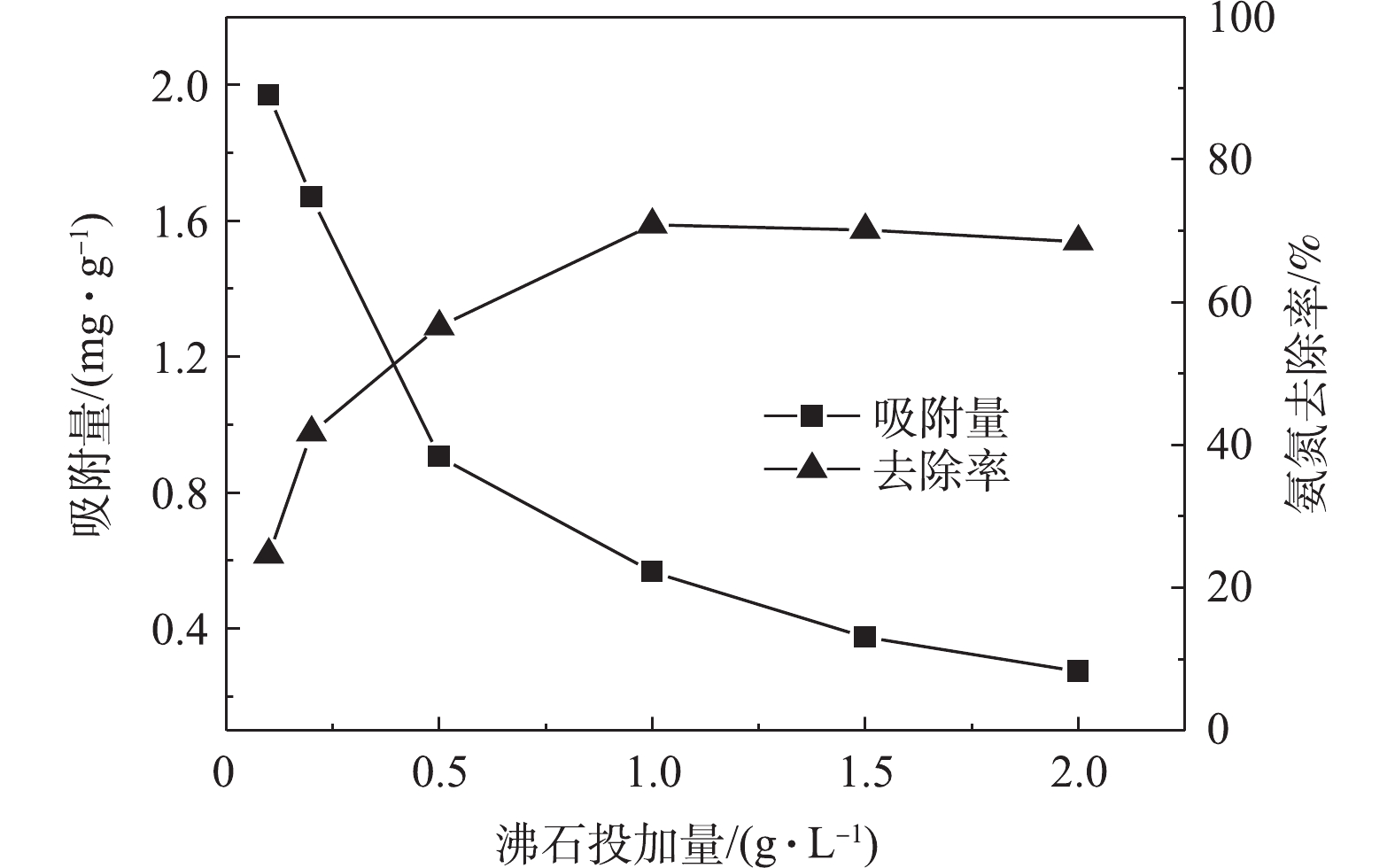
$ {\rm{NH}}_4^ + $ 离子的半径,抢占了沸石上与$ {\rm{NH}}_4^ + $ 的结合位点。在pH为4~10时稳定,随着pH的进一步升高迅速下降。在碱性环境下,对氨吸附效果下降的原因是,碱性环境中以$ {\rm{NH}}_4^ + $ 形式存在的游离态氨氮会与OH−生成溶解态的NH3,不利于$ {\rm{NH}}_4^ + $ 与沸石内的阳离子发生离子交换反应,所以氨氮去除率达到峰值后,随着pH升高开始下降。图4反映了沸石投加量对吸附量和去除率的影响。由图4可知,氨氮去除率随沸石投加量增大呈先升高后缓慢下降的趋势,这与ZHENG等[15]研究结果相一致,主要是由于吸附点位叠加导致吸附面积减少。而氨氮的去除在达到最大值后逐渐降低,这是由于在投加量较低时,颗粒与颗粒之间的间距较大,每个颗粒之间都会有较多的
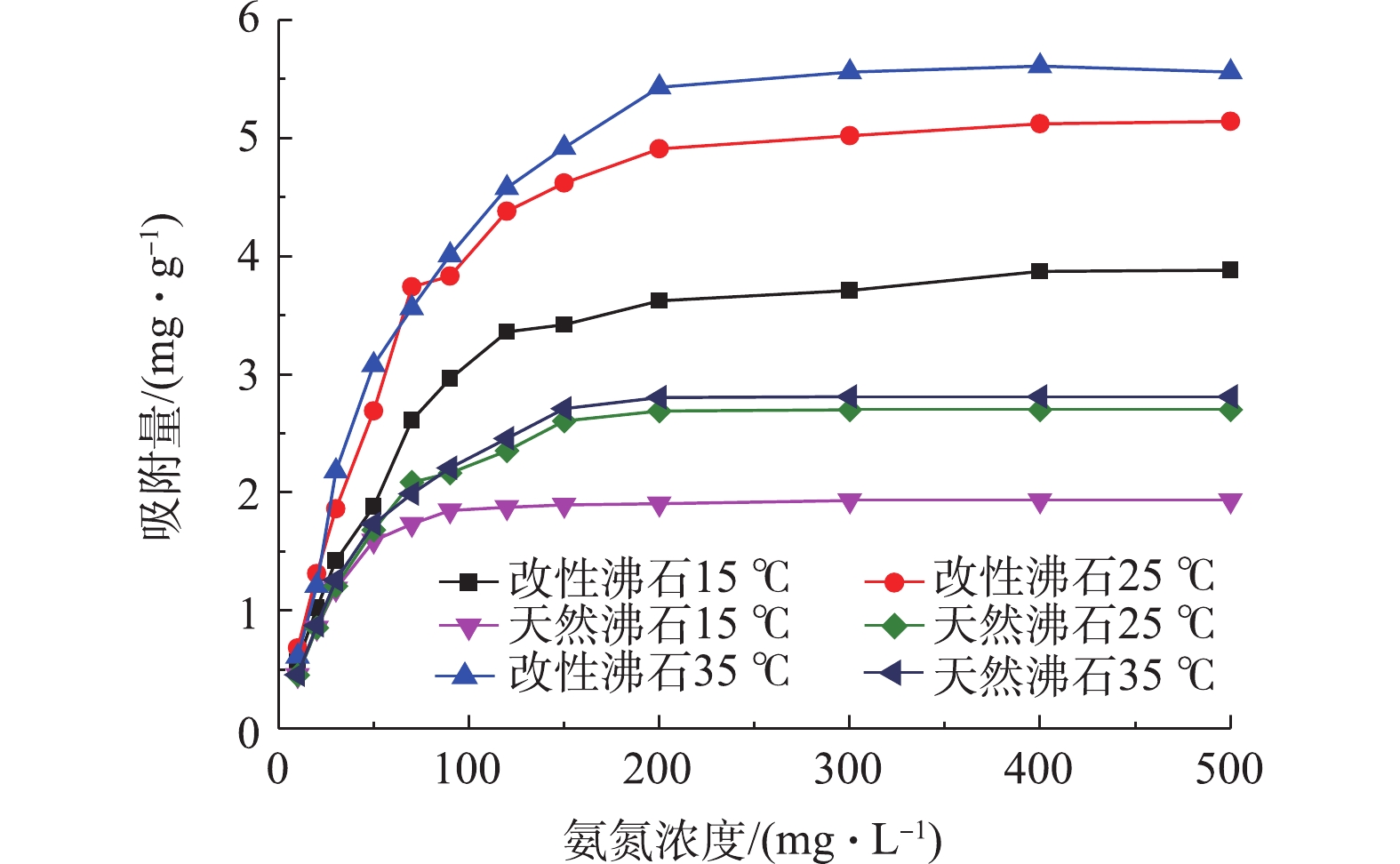
$ {\rm{NH}}_4^ + $ 聚集,有利于改性沸石与$ {\rm{NH}}_4^ + $ 进行离子交换,因此,改性沸石的投加量增加会提供更多的吸附位点来吸附氨氮,去除率也随之增加。本研究的沸石最佳投加量为10 g·L−1,此时氨氮的去除率为70.82%,远远高于天然沸石对氨氮的去除率(45.8%)。图5反映了不同温度下氨氮浓度对天然及改性沸石吸附量的影响。当氨氮浓度小于50 mg·L−1时,氨氮的吸附量受到温度的影响较小;当浓度大于50 mg·L−1时,温度对2类沸石吸附量影响较大,这与巩师俞[16]的研究结论类似。反应温度为15 ℃时的吸附效果与25 ℃和35 ℃的吸附效果相比较差,说明温度升高有利于提高沸石对水中氨氮的去除率。
-
实际水样来自于四川省成都市污水处理厂二级生化出水、锦江和镜湖。水样经絮凝沉淀处理后测定原水的氨氮初始浓度。从表1中可以看出,实际污水厂出水中氨氮浓度较低,为4.82 mg·L−1,满足《城镇污水处理厂污染物排放标准》(GB 18918-2002)中规定的氨氮一级A标准。二级生化出水经改性沸石吸附处理后,氨氮浓度降低至0.91 mg·L−1,满足《地表水环境质量标准》(GB 3838-2002)中规定Ⅳ类排放标准,并且符合国内大部分地区中水回用的标准。经处理的河水、湖水样品中氨氮的水质由Ⅳ类提高到Ⅱ类标准,但改性沸石对湖泊与河流水样中氨氮去除率相对略低。这可能是由于河水和湖水中污染成分较复杂,矿物质含量较多,抢占了沸石分子筛中与
$ {\rm{NH}}_4^ + $ 结合的孔道或空穴,降低了沸石对氨氮的吸附能力。可以看出,改性沸石应用在二级生化污水和湖泊河流水样处理中具有较好的去除效果。 -
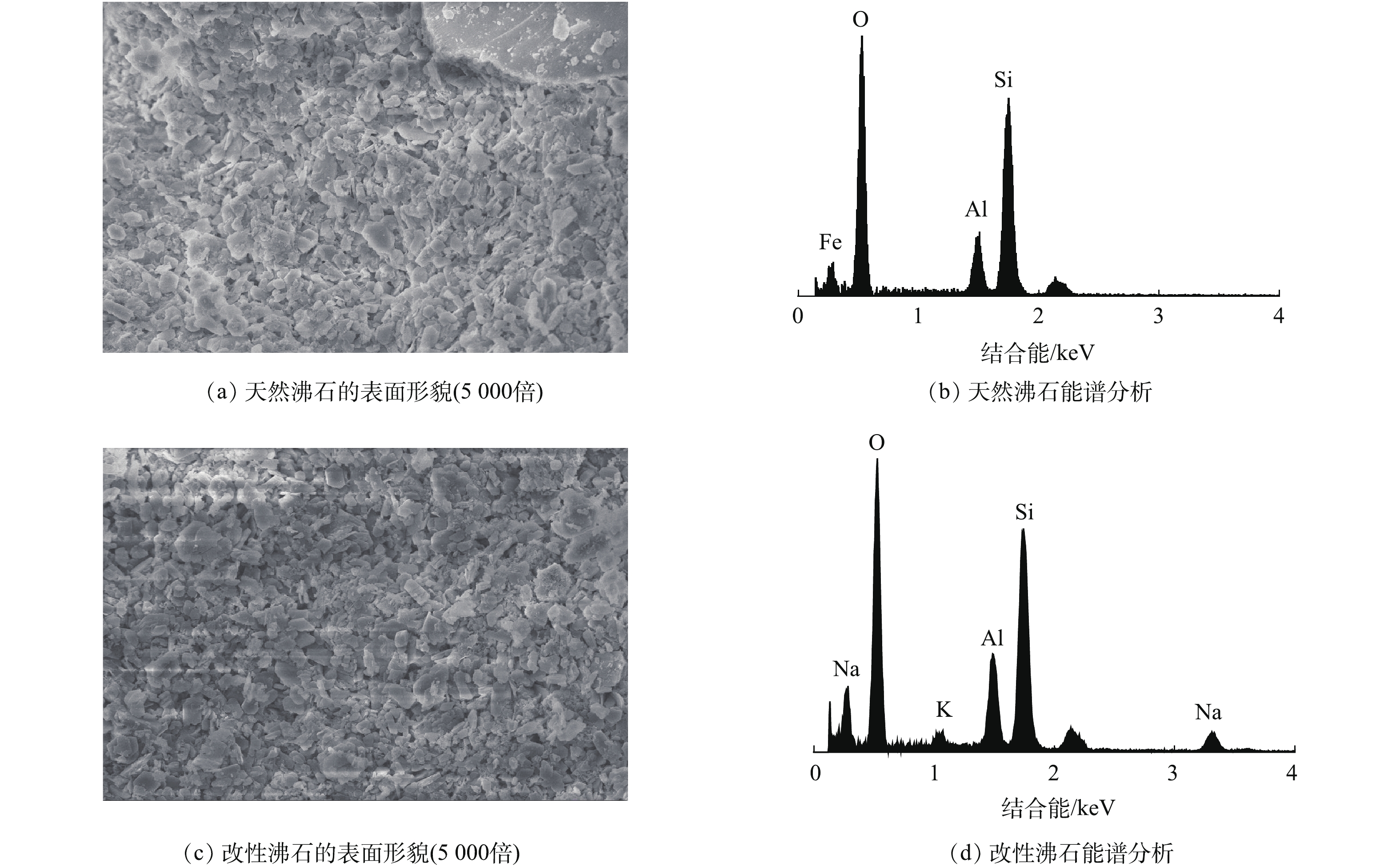
为了进一步探讨NaCl高温改性对沸石表面形貌和元素组成的影响,分别对天然及改性沸石进行了扫描电镜(SEM)和X射线能谱(EDS)分析,结果见图6。由图6可知,沸石改性后有较大变化,天然沸石表面疏松,孔道较少,改性后的沸石表面更加粗糙,孔道增多,这说明NaCl高温改性可以去除沸石内的水分、碳酸盐和有机物等杂质,拓宽了沸石内部孔道,增加了氨氮的内扩散速率,使沸石去除氨氮的能力大大提高。
由图6可以看出,天然沸石中含有铁元素,其颜色呈砖红色,改性后铁元素被交换,导致沸石表面颜色变暗,且沸石改性前后元素的含量发生了变化。天然沸石主要元素是Al、Si、O,没有检测到Na峰。改性沸石中出现了Na峰。说明经过改性,天然沸石中Fe3+、Mg2+等金属离子与粒子半径更小的Na+发生了离子交换反应,增大了离子交换容量,扩宽了沸石孔道,沸石中的内扩散速率增大,因此,改性沸石的去除氨氮能力的得到显著性提高。
表2为改性前后沸石的比表面积以及阳离子交换量的变化情况。可以看出,改性后的沸石拥有更大的比表面积、孔容和孔径,这与扫描电镜所显示的特征一致。天然沸石改性前后阳离子交换量提升约20%,这主要来源于NaCl改性作用,Na+交换了半径较大的金属阳离子,拓宽了沸石内部孔径,增加了沸石的阳离子交换量[17]。
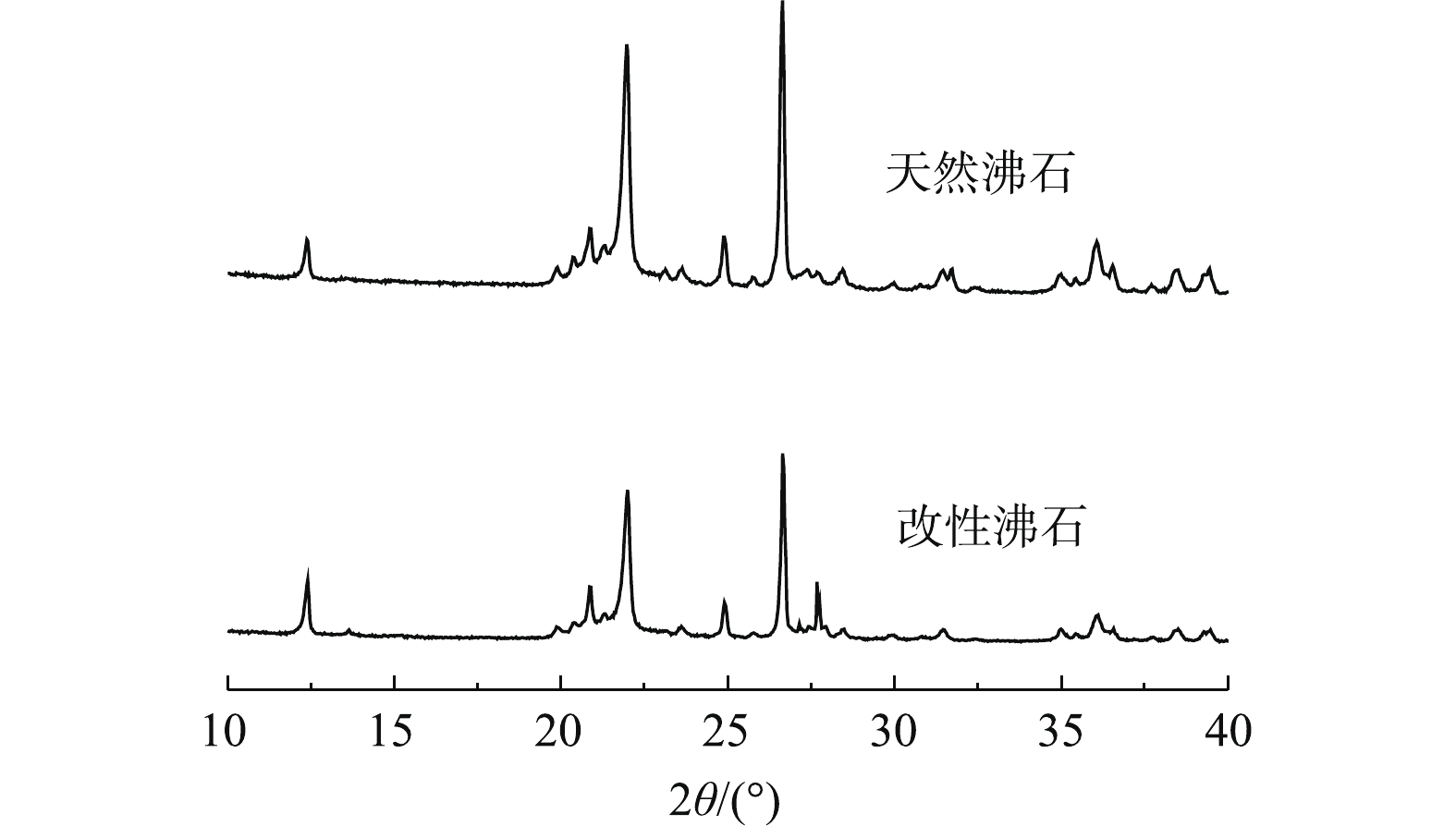
图7为天然沸石及改性沸石的X射线衍射图。参照XRD数据库可知,该沸石由72%的天然斜发沸石组成,少部分是丝光沸石和其他黏土矿物,石英和长石占比小于1.00%。由图7可知,改性前后沸石的特征峰数量和位置没有变化,说明沸石的晶体结构不会发生改变,这与刘思远等[18]的研究结论一致。但是改性后的沸石主衍射峰的强度都要低于天然沸石,说明改性后结晶度略微下降。这是由于沸石经过高温焙烧后,发生一定程度的失水,使其结晶度降低。过高温度的焙烧会破坏沸石的内部晶体结构,降低沸石对氨氮的吸附能力。改性过程使其内部结晶化程度降低,晶格缺陷度增加,表面活性增加,增强了其对氨氮的去除能力。
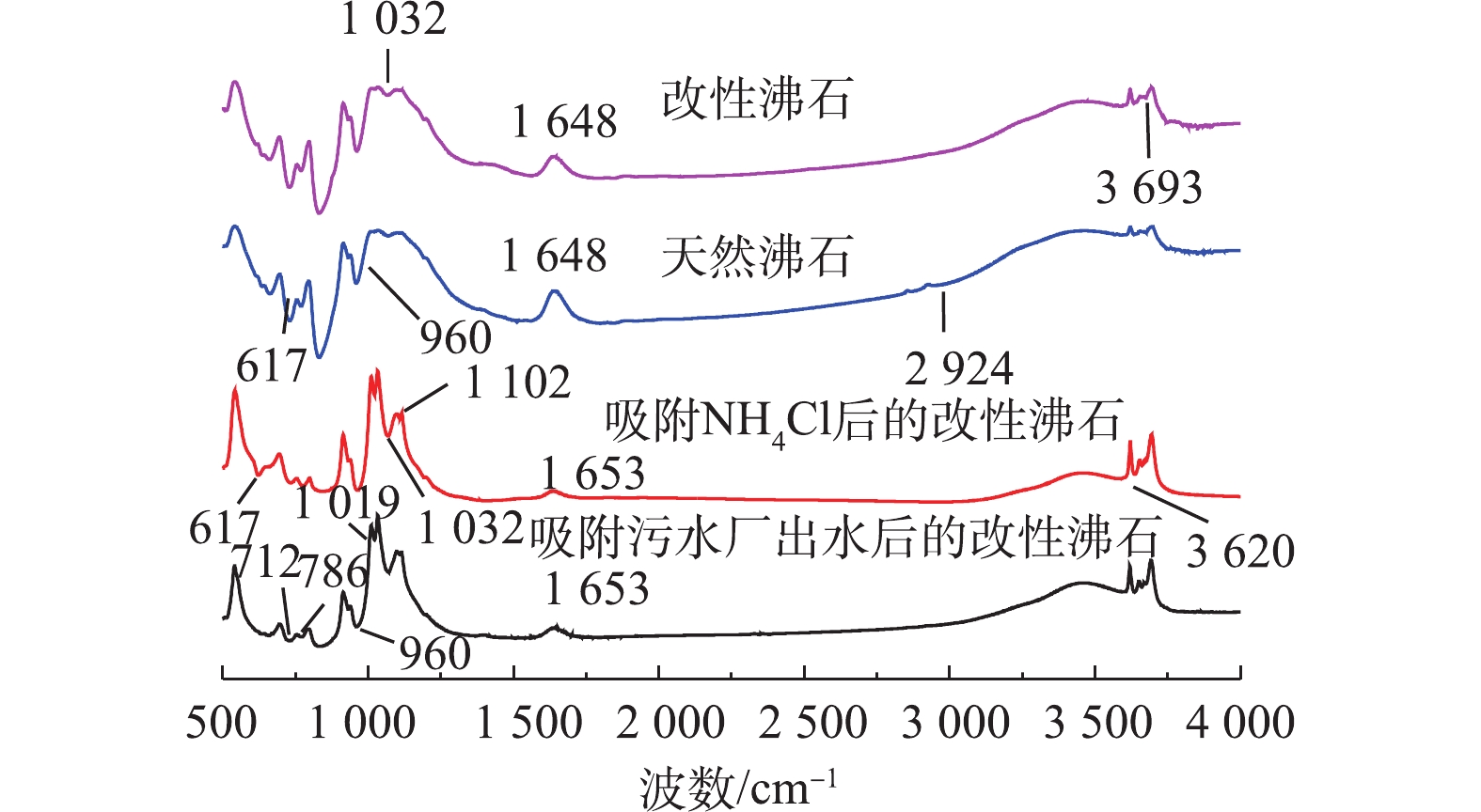
有研究[19]表明,材料表面的结构可以通过沸石骨架振动光谱和羟基吸收峰来表征,且这些官能团对材料的性能影响较大。图8为300 ℃氯化钠改性沸石、天然沸石、吸附NH4Cl后的改性沸石、吸附污水厂出水后的改性沸石的红外光谱。可以看出,天然沸石和300 ℃氯化钠改性沸石在结构上并没有较大差异,光谱图的趋势基本一致。3 600~3 700 cm−1处的宽吸收峰是由于羟基的收缩振动引起的[20]。天然沸石在2 924 cm−1处出现较小的吸收峰,是由于天然沸石孔道内含有少量受热易挥发的有机物,在此处产生了C—H伸缩振动,这与杨淑佳[21]的研究结论一致。而吸附NH4Cl和污水厂出水后的沸石在此处的伸缩振动峰从1 648 cm−1偏移至1 635 cm−1,这说明吸附的氨氮使该处的吸收峰发生偏移,原因是吸附后结晶水或吸附水的含量增多;在1 050 cm−1附近的Si—O—Si不对称伸缩振动峰在吸附氨氮后和表面的—NH2弯曲三原子基团不对称收缩峰重叠形成较突出的吸收峰,这与王国栋等[22]的研究结果一致。在430~800 cm−1处的较宽峰是沸石四面体骨架T—O(T为Si或Al)对称伸缩振动和T—O弯曲振动产生的吸收峰,吸附后的沸石在这个区间的峰强度变化较为明显,说明沸石吸附氨氮后,脱铝效果明显,硅铝比升高。吸附污水厂出水后的沸石在617 cm−1处T—O对称伸缩振动峰消失,是由于污水厂实际出水中含有
${\rm{SO}}_4^{2-} $ ,两者之间相互叠加消除了其吸收峰[23]。 -
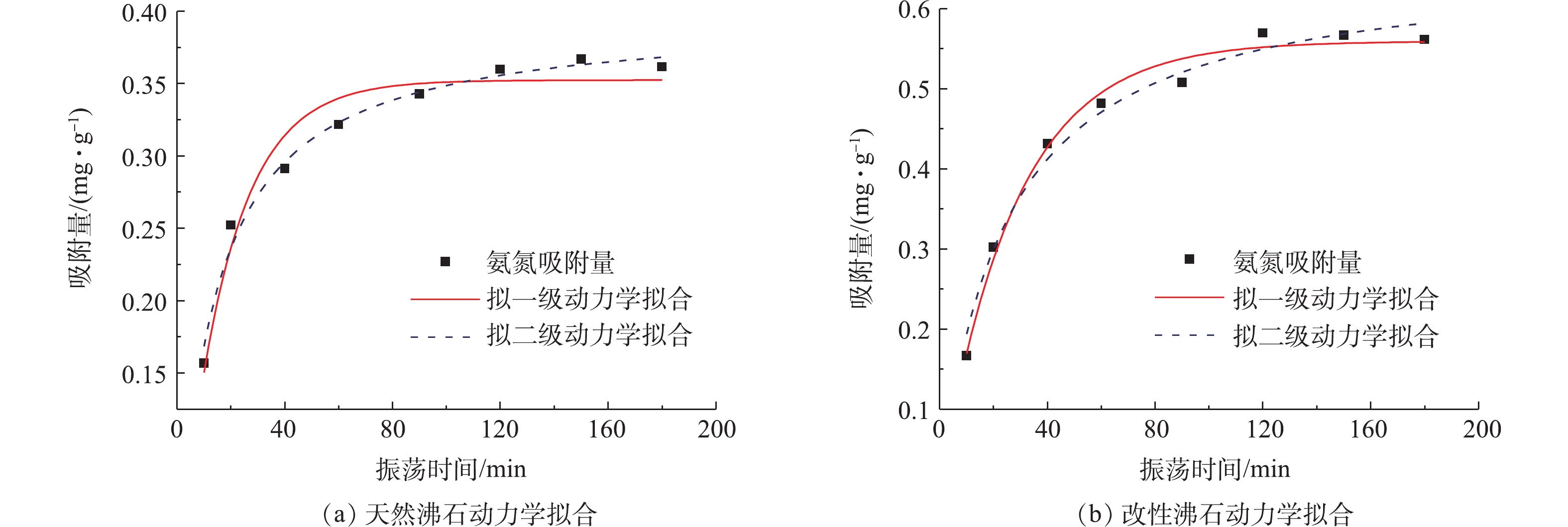
为探究吸附动力学机理,分别采用拟一级和拟二级反应动力学模型对结果进行拟合,实验结果如图9所示,动力学参数见表3。结果表明,拟二级动力学拟合性与拟一级动力学相比更好,这说明沸石去除水中氨氮的过程更符合拟二级动力学过程。沸石在水中吸附氨氮过程呈现“快速吸附、缓慢平衡”的现象[24],吸附刚开始时,溶液中氨氮浓度较大,推动力强,所以吸附速率较快。随着反应的进行,溶液中的氨氮浓度减少,传质推动力逐渐降低,吸附速率变慢,达到了缓慢平衡的过程。
-
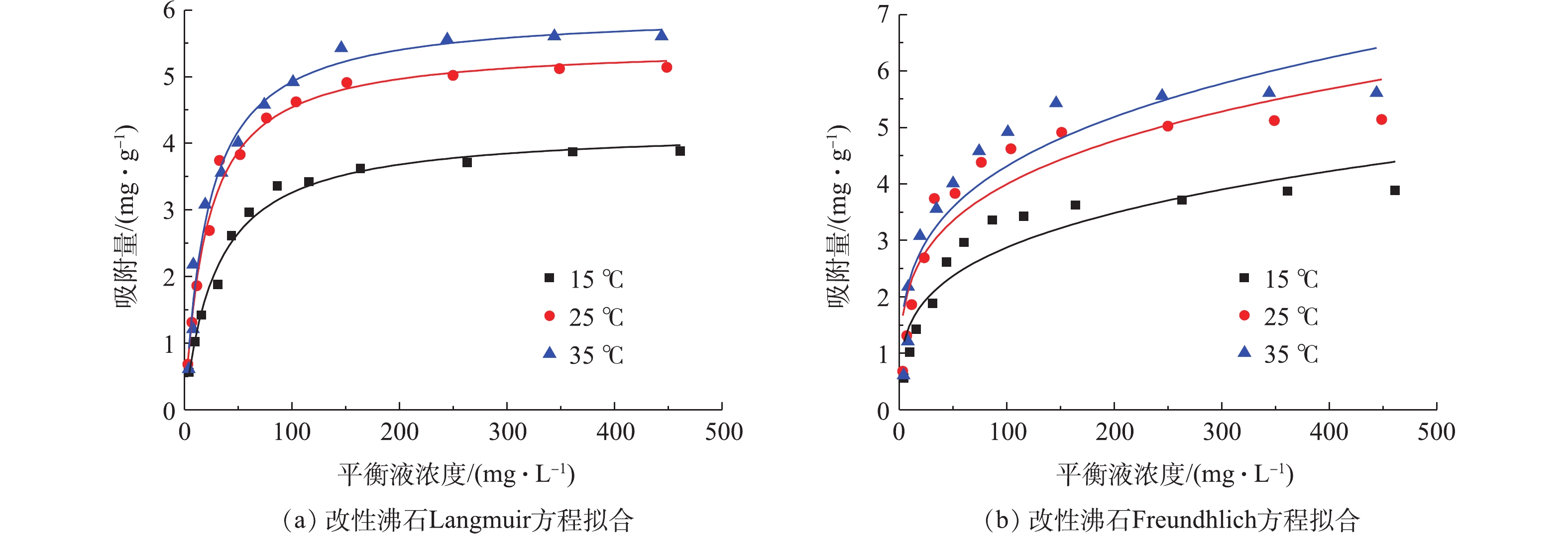
图10为Langmuir和Freundhlich方程对实验数据进行拟合的结果,拟合参数见表4。可以看出,改性沸石在不同温度下都较好地满足Langmuir等温曲线。说明改性沸石表面均匀并且对氨氮为单分子层吸附,被吸附的氨氮之间没有相互作用力。此时沸石对氨氮的理论最大吸附量为5.98 mg·g−1。
如表5所示,不同沸石对氨氮吸附过程均满足Langmuir模型。在单一污染条件下,改性沸石对氨氮的最大吸附量为5.98 mg·g−1,远远高于许育新等[25]测得的天然缙云斜发沸石的对氨氮的最大吸附量(4.05 mg·g−1),说明高温联合氯化钠改性能大幅度提高沸石对氨氮的吸附能力。而本研究的高温联合氯化钠改性沸石吸附量较大,与铝锰负载改性方法相比,具有成本低廉、制备方便、不产生二次污染的优点。
-
表6为对天然及改性沸石的热力学方程拟合结果。由表6可见,不同温度下的ΔG均小于0,且温度越高,ΔG越小,说明该反应为自发吸热过程,高温更利于该过程。吸收焓变ΔH均大于0,说明沸石吸附氨氮的过程是吸热过程,此结论与吸附等温线结论相吻合。吸附熵变ΔS均大于0,说明吸附前后体系无序性变大。因此,沸石吸附水中氨氮为自发、吸热、熵增过程。该结论与张亚峰等[27]的研究结果一致。
2.1. 沸石改性过程及其对氨氮的吸附效果
2.2. 氨氮吸附性能的影响因素
2.3. 改性沸石处理废水的实际应用
2.4. 改性沸石的形貌及结构表征
2.5. 吸附动力学分析
2.6. 吸附等温线分析
2.7. 吸附热力学分析
-
1)氯化钠联合高温改性能够显著提升沸石对氨氮的吸附性能。本研究得到的最佳改性条件:氯化钠浓度为0.8 mol·L−1,焙烧温度为300 ℃,此时改性沸石的饱和吸附量可达5.94 mg·L−1。此外,改性沸石对实际水样中氨氮的去除效果较好。
2) SEM、EDS、XRD、FT-IR分析结果表明,沸石表面呈现大量的孔道,比表面积较大,因此,可为氨氮的吸附提供结合位点。在NaCl改性沸石过程中,Na+交换了天然沸石中Fe3+、Mg2+等大半径的阳离子,增强了沸石对氨氮的去除能力。
3)拟二级动力学模型和Langmuir模型对氨氮的吸附过程具有更好的拟合度,在35 ℃时,由Langmuir模型拟合得到氨氮最大吸附量为5.98 mg·L−1。
4)吸附热力学计算结果表明,沸石对氨氮的吸附过程是自发的吸热过程,沸石对氨氮的吸附能力随着温度的升高而增强。



 下载:
下载: