-
聚羟基脂肪酸酯(polyhydroxyalkanoates,PHAs)是微生物体内一种天然的高分子聚合物,具有优良的生物可降解性、生产能耗低、无害化和资源化等特点[1],可有效解决难降解的塑料产品垃圾造成的“白色污染”问题[2]。传统PHAs生产方法多采用纯培养菌种合成,原料成本高,限制了PHAs的大规模生产和应用[3]。若利用活性污泥混合菌群合成PHAs,既能减少污水处理过程中的剩余污泥排放量,也能适应多种不同底物类型,可显著地降低PHAs的生产成本[4]。因此,利用活性污泥合成PHAs已成为近年来广大研究者关注的热点。研究表明,活性污泥既能在厌氧又能在好氧条件下积累PHAs[5]。但根据相关报道[6-7],有关活性污泥合成PHAs的研究,大多利用乙酸钠等碳源进行长时间驯化,积累高产PHAs菌种,成本高且不易进行控制。
目前,工业化生产PHAs纯菌种工艺所使用的碳源都是纯物质[8]。这种生产出来的PHAs成本高,其中底物成本是大规模生产PHAs产品时的主要成本,据估计,约40%的PHAs成本来自于底物[9],因此,最经济有效的PHAs生产工艺应该包括廉价底物的应用,并且微生物能够有效利用这种底物,高效率地合成PHAs。花生渣是一种可再生的、价格低廉的食物副产品,据调查,我国是花生总产量和花生油总产量最大的国家[10],因此,其作为底物来源可大大降低生产PHAs产品的成本,同时可进一步开发花生渣的应用价值。本研究采用连续流同步亚硝化反硝化脱氮除磷系统二沉池和A2O工艺水厂二沉池的剩余污泥,讨论未经驯化的剩余污泥以花生渣厌氧发酵产生的VFAs(挥发性脂肪酸)作为有机碳源合成PHAs的工况优化问题。
采用同步亚硝化反硝化脱氮除磷系统在连续流中的二沉池剩余污泥和A2O工艺运行的实际水厂二沉池剩余污泥,有研究[11]表明,活性污泥在COD≤800 mg·L−1时具有较好的合成PHAs的能力,PHAs的合成主要发生在厌氧阶段,因此,实验设计反应时间为5 h,COD为650~750 mg·L−1,在微氧的条件(DO≤0.2 mg·L−1)下,比较了2种污泥利用花生渣厌氧发酵产生的VFAs所合成PHAs的量。在原有的微氧条件下,通过增设前置曝气的方式消耗微生物原有的PHAs,使微生物处于“饥饿”状态,从而提高微氧过程中利用VFAs中充足的碳源合成PHAs的量。通过控制前置曝气时间、曝气气量促进PHAs的合成,可为活性污泥利用廉价碳源合成PHAs提供新的思路,且为利用脱氮除磷工艺剩余污泥合成PHAs提供参考。
全文HTML
-
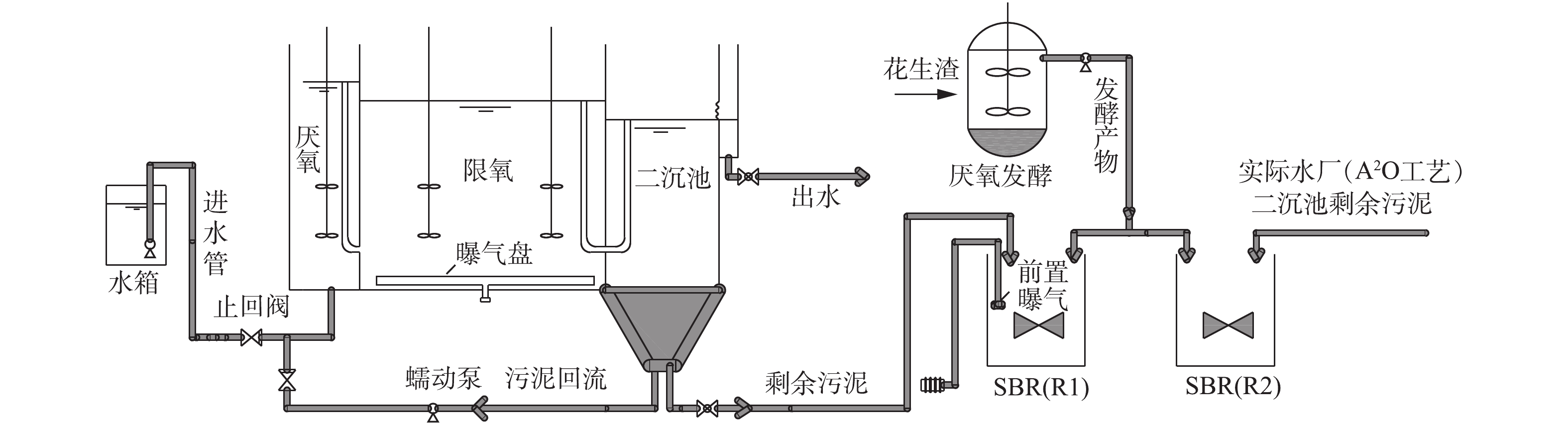
污泥取自广州市沥滘污水处理厂二沉池的剩余污泥和课题组连续流中亚硝化/反硝化除磷系统二沉池的剩余污泥[12]。
采用花生渣作为发酵液原材料。花生渣碎片经48 h晒干后,通过食物搅拌机搅碎后,用400目孔径过滤筛过滤,最后将花生渣加水进行发酵。
-
图1为厌氧-限氧的连续流反应器和运行同步亚硝化/反硝化脱氮除磷系统。该反应器的厌氧区体积为13.8 L,厌氧区底部连接水箱。限氧区体积为39 L,限氧区设曝气盘,二沉池底部连接蠕动泵,将部分污泥回流到厌氧区,剩余污泥添加到PHAs合成装置的一个烧杯中。PHAs合成装置含有2个有效体积为2 L的烧杯,烧杯连接搅拌装置以保证反应过程中泥水混合均匀,并连接有曝气装置进行前置曝气,发酵罐中装有搅拌桨,并保持密封以维持其厌氧状态。
-
本研究利用花生渣厌氧发酵产生的VFAs[13],在微氧(DO≤0.2 mg·L−1)的条件下合成PHAs,实验重复2次,测得数据取其平均值。分2个阶段进行实验。
第I阶段,取适当的二沉池剩余污泥于2个2 L的烧杯中,加入人工配制的营养液及发酵液。发酵液中VFAs含量为20 985~21 284 mg·L−1,COD为26 000~30 000 mg·L−1,TP为100~145 mg·L−1,氨氮(
${\rm{NH}}_4^{+} $ -N)为3 100~3 280 mg·L−1,蛋白质为1 760~2 250 mg·L−1,糖原为199~252 mg·L−1;营养液中镁离子(MgSO4·7H2O)为120 mg·L−1,钙离子(CaCl2)为30 mg·L−1,亚铁离子(FeSO4)为3 mg·L−1,EDTA为80 mg·L−1,H3BO3为0.5 mg·L−1,ZnSO4·7H2O为0.3 mg·L−1。设定连续流中同步亚硝化反硝化脱氮除磷系统二沉池的剩余污泥为R1,采用A2O工艺的实际水厂的剩余污泥为R2,控制污泥浓度(MLSS)为3 300~3 600 mg·L−1,COD为650~750 mg·L−1,pH为7~8,污泥反应时间为5 h,每间隔0.5 h取样,测得COD及TP的变化曲线,并检测ORP的变化情况[14-15]。此阶段主要考察2种脱氮除磷工艺下剩余污泥在微氧条件下合成PHAs的情况。第II阶段,采用第I阶段得出的具有良好PHAs合成能力的剩余污泥,在微氧前增设短时间曝气,其余操作步骤不变,其目的是消耗微生物原有的PHAs,使微生物处于“饥饿”状态,从而提高了微氧过程中PHAs积累净增量,此阶段主要考察曝气时间和曝气量对微氧阶段细胞内PHAs含量的影响。曝气实验分为2步骤。
设计曝气时间为15 min,曝气量分别为20、30、50 L·h−1,反应时间为5 h,每间隔30 min取样并测定其PHAs含量,在其中选出细胞内PHAs含量达到最高时所对应的曝气量。
在上述步骤中所确定的PHAs最高合成量对应的曝气量下,进行曝气时间对细胞内PHAs含量的影响实验。设计曝气时间分别为5、10、15和20 min,考察了曝气时间对细胞内PHAs含量的影响。
-
实验主要的分析项目包括COD、氨氮、总磷(TP)、DO、pH和Eh等。DO、pH、Eh采用WTW的系列仪器进行在线检测,其余项目按文献中的方法[16]进行测定。COD采用重铬酸钾消解法,TP采用钼锑抗分光光度法,氨氮(
${\rm{NH}}_4^{+} $ )采用纳氏试剂分光光度法,DO、pH、Eh采用德国WTW340i仪器进行在线监测。PHAs的测定采用气相色谱法[17],污泥经过离心、冷冻干燥后,取适量放于耐热管中。分别投加2 mL氯仿、2 mL体积分数为10%的硫酸的甲醇溶液,2 mL 50 mg·L−1苯甲酸的甲醇溶液。耐热管密封后,放入100 ℃的水浴锅中加热4 h,取出耐热管冷却至室温,加入2 mL去离子水,振荡10 min后,静止1 h。待溶液分层后,取下层有机相,用0.45 µm的滤膜过滤后,加入进样瓶中,然后进行色谱分析(安捷伦7080A-5975C气质联用仪)。色谱柱型号DB-1,进样口温度为230 ℃,柱箱从100 ℃保持2 min以后,以15 ℃·min−1升温至160 ℃,MS扫描范围为20~550。
1.1. 实验原料
1.2. 实验装置
1.3. 实验方法
1.4. 分析方法
-
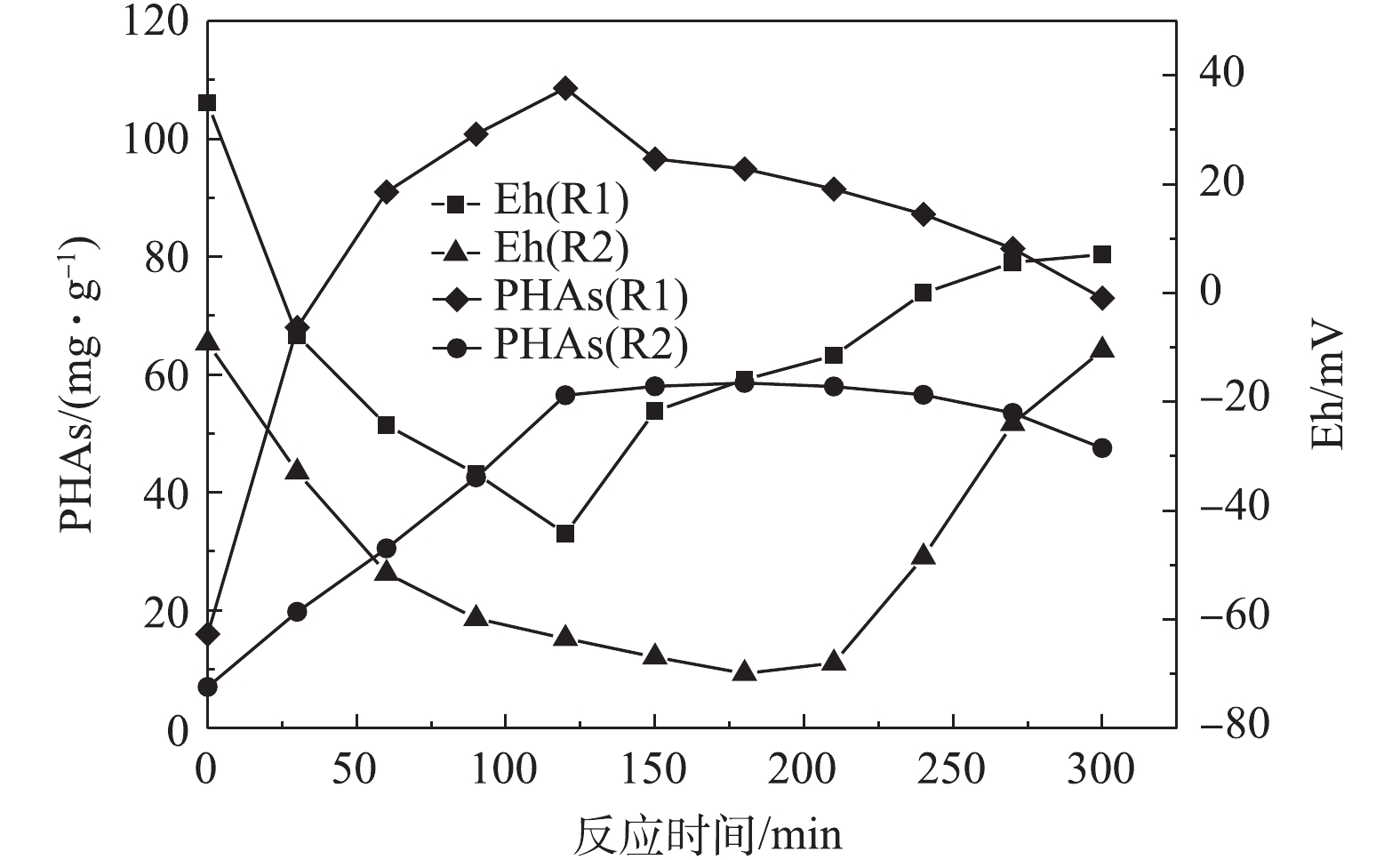
图2和图3反映了不同剩余污泥在微氧条件下合成PHAs量和Eh、TP、COD的变化情况。由图2可知,在R1和R2中初始的PHAs含量分别为16 mg·g−1和7.015 mg·g−1,说明这2种脱氮除磷工艺下的剩余污泥内的初始PHAs含量相差较大。由图2可知,R1和R2在微氧条件下合成PHAs的量达到最高值的过程中,PHAs含量随着Eh的减小而增加,在PHAs含量最高时,Eh分别为−44.2 mV和−69.9 mV,均为最低值。随后,随着PHAs的减少,Eh反而增大。这说明在微氧条件下,剩余污泥利用厌氧发酵产生的VFAs合成PHAs时,Eh可作为PHAs合成量的指示参数。
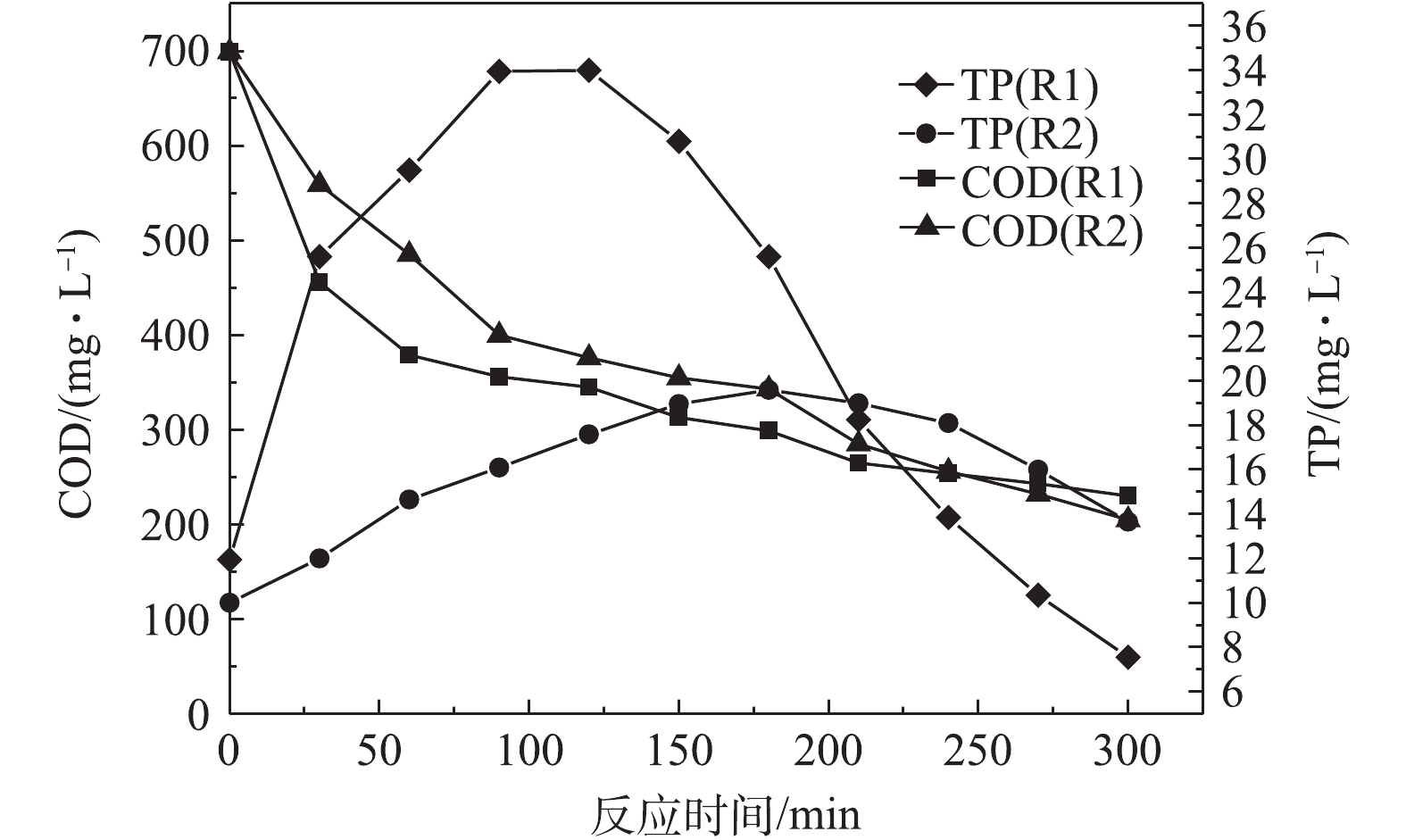
由图3可知:当反应为120 min时,R1中PHAs含量达到最大值,为108.6 mg·g−1,释磷34.0 mg·L−1,COD降低了345.0 mg·L−1;当反应为180 min时,R2中PHAs达到最大值,为58.58 mg·g−1,释磷19.6 mg·L−1,COD下降了356 mg·L−1。与R2相比,R1中的PHAs含量在更短的时间内可达到最大值,其碳源利用率更高,释磷量更多。这是因为R1是连续流中厌氧/限氧(A/OLA)工艺的剩余污泥,PHAs作为内碳源驱动同步亚硝化反硝化脱氮除磷过程[18]。在脱氮除磷的过程中,进水碳源偏低,污泥微生物利用PHAs作为内碳源参与细胞新陈代谢的循环过程,在厌氧时合成PHAs,好氧时消耗PHAs,不断经历“饱食”与“饥饿”的环境。当碳源充足时,通入少量氧气形成微氧环境,R1中微生物可以较快地通过氧化有机物进行合成代谢,积累PHAs,PHAs合成的能量来自于细胞内聚磷酸盐的水解[19],所以释磷量的变化能在一定程度上反映PHAs合成量的变化。R2中PHAs的含量较少,这是由于R2中的污泥是A2O工艺的剩余污泥,部分有机物会在R2中的微生物细胞内转化为糖原、聚磷酯,导致PHAs的积累量较少[20]。以上结果说明,2种脱氮除磷工艺下的剩余污泥在微氧条件下合成PHAs量有所不同,利用碳源合成PHAs量的大小与脱氮除磷的工艺有一定关系。
-
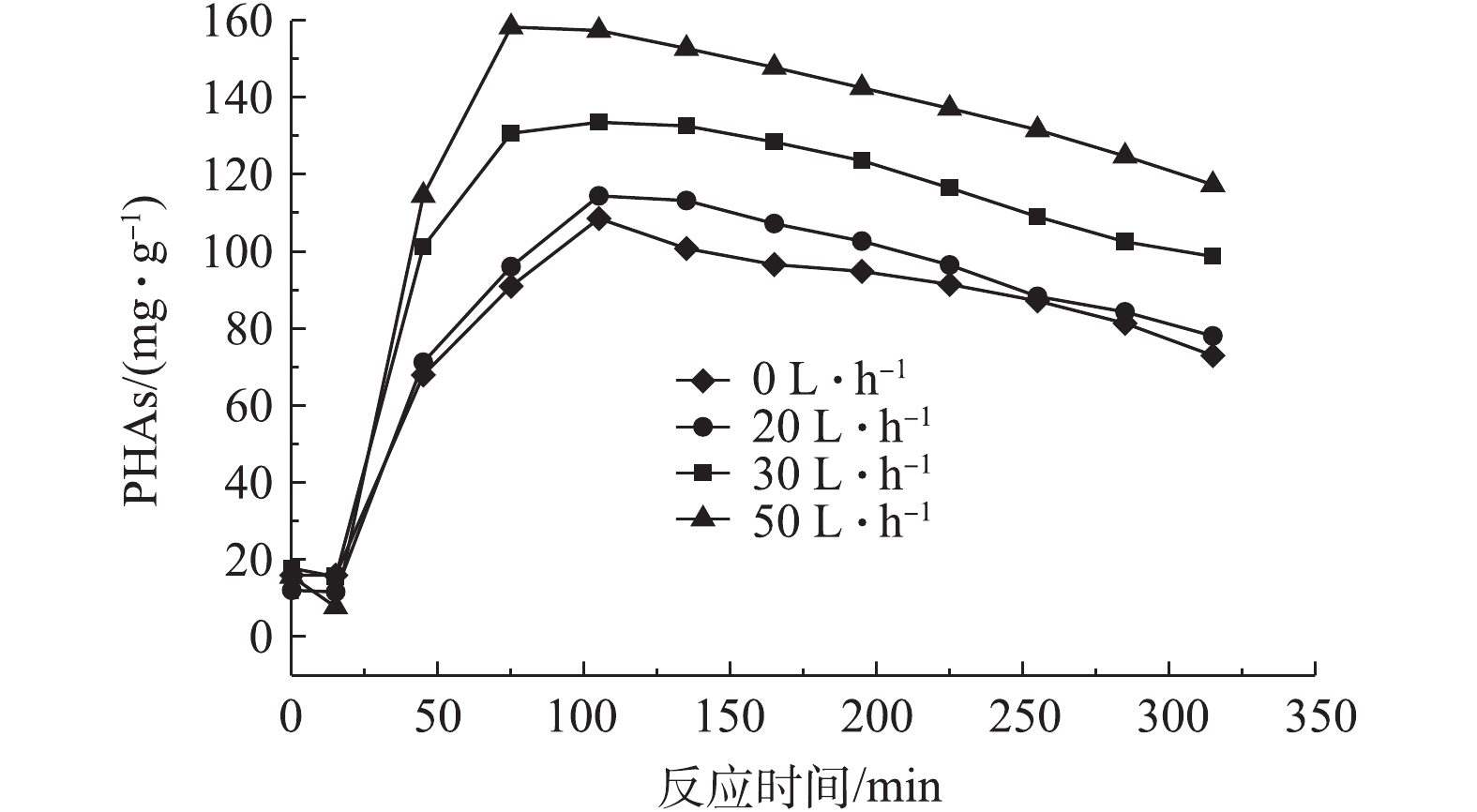
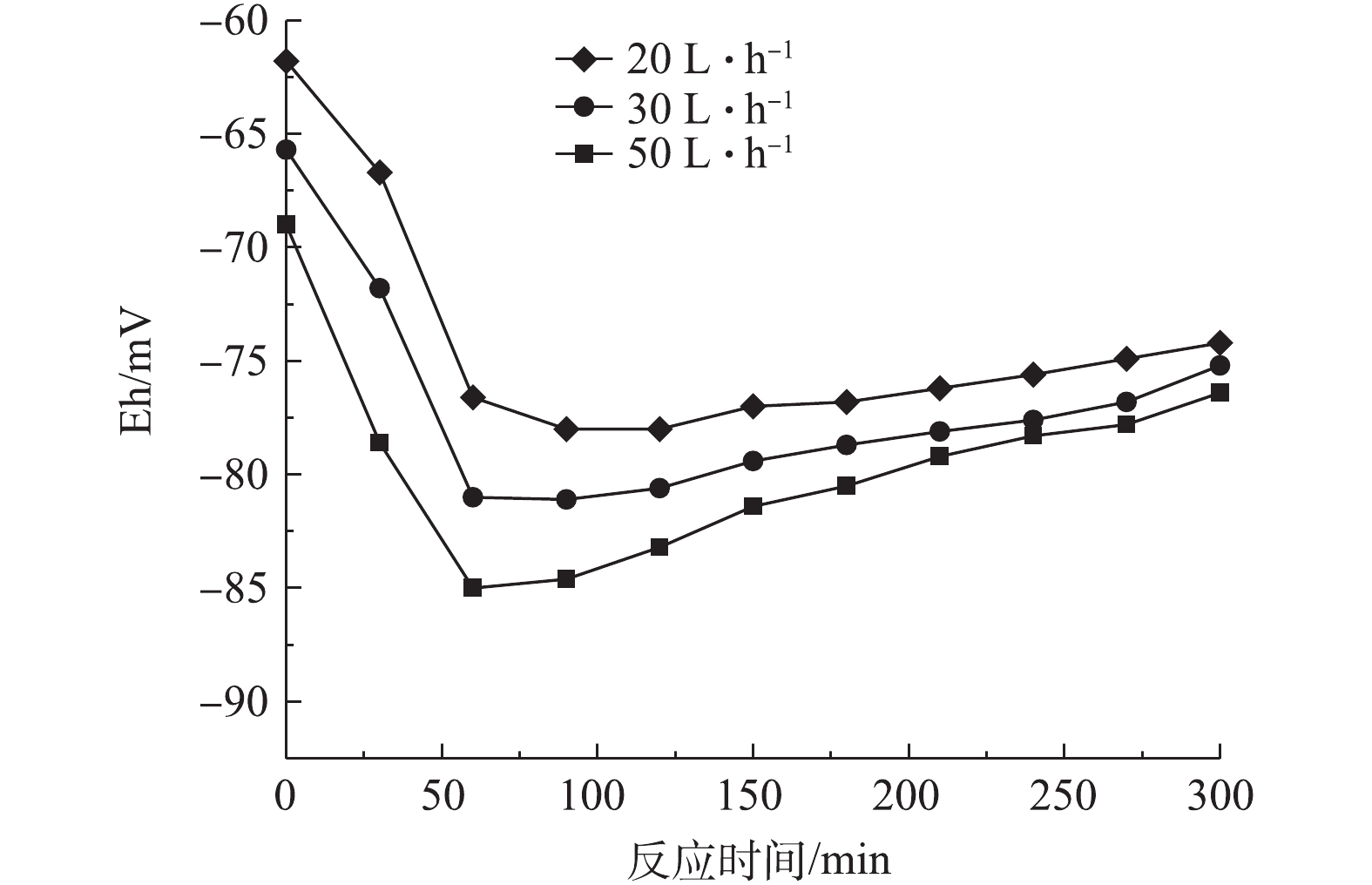
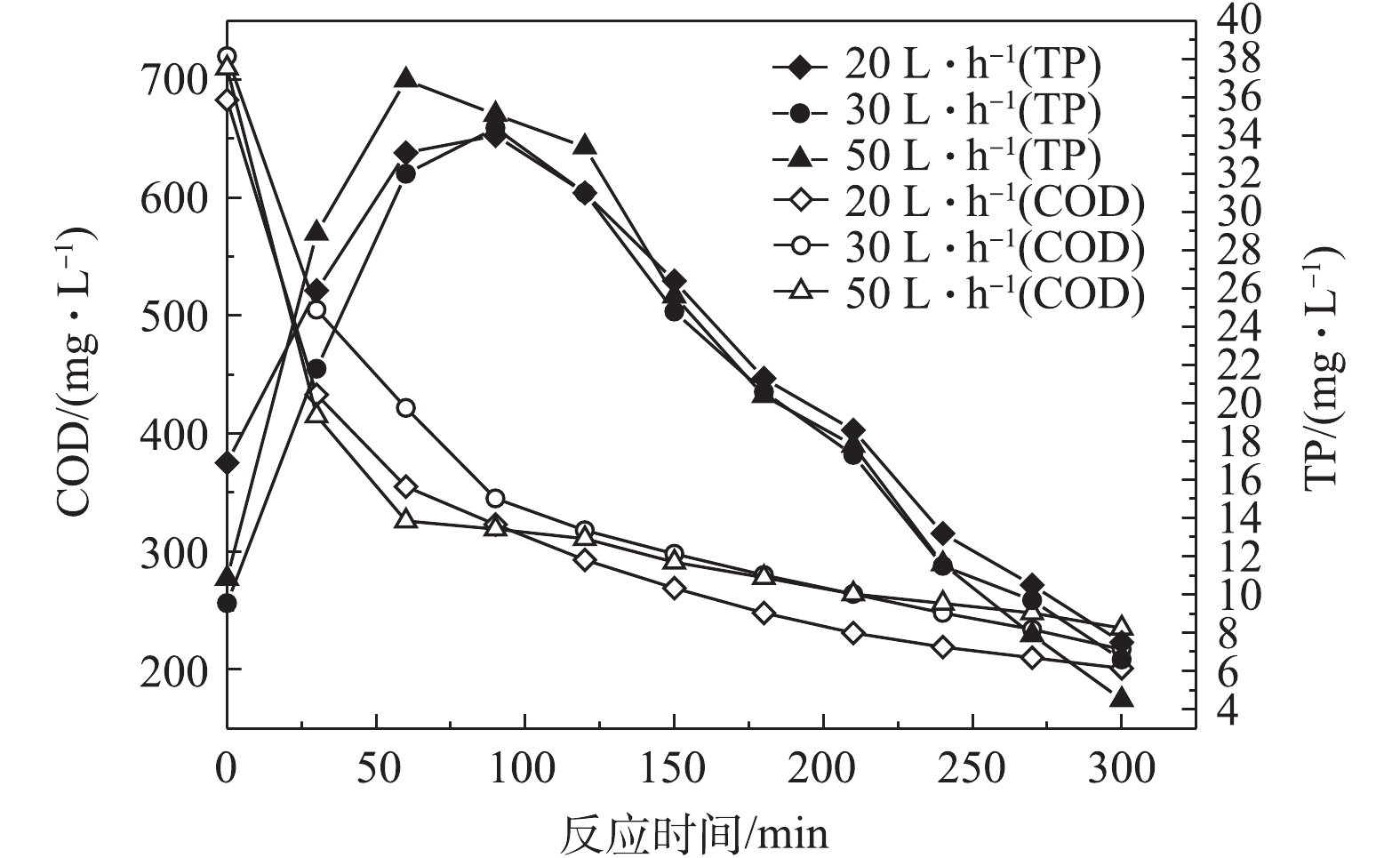
图4反映了前置曝气气量对R1中PHAs含量的影响结果,图5和图6分别反映了不同曝气量下R1合成PHAs过程中Eh、COD和TP的变化曲线。由图4可知,前置曝气会消耗R1中微生物细胞内的PHAs。曝气气量为20、30和50 L·h−1时,消耗细胞内PHAs的量分别为1.6、3.79、5.79 mg·g−1。但随着曝气量的增大,R1在微氧条件下合成PHAs的量也随之增加,分别为114.46,133.58和158.32 mg·g−1。当曝气量为50 L·h−1时,合成最高量PHAs所需的时间为60 min,较其他2种曝气量条件达到最高量所需的时间更短。这是因为在微氧条件下,曝气量越大,消耗原有基质的速率越大,造成细胞内“饥饿”的环境,微生物的匮乏条件更为严峻,增强了微生物对碳源的吸收动力[21]。待VFAs进入系统,微氧环境下提供少量的DO会为微生物吸收VFAs提供能量,具有合成PHAs能力的微生物能迅速利用外碳源合成PHAs。另外,如图5所示,同时对照图3可知,曝气前R1中Eh为34.9 mV,而在20、30、50 L·h−1曝气量下R1中对应的Eh分别为−61.8、−65.7、−69 mV,即曝气后Eh出现了下降,推测是因为厌氧发酵产生的VFAs中含有较多的细菌,而细菌与Eh有较强的相关性[22]。因此,在曝气后,可能因细菌的生长繁殖导致了Eh的降低,但20、30和50 L·h−1曝气量下最低的Eh分别为−78、−81.1和−85.0 mV,对应所需的时间分别为90、90、60 min。当Eh最小时,PHAs合成量最大,Eh仍可作为PHAs合成量的指示参数。如图6可知,当曝气量为20、30和50 L·h−1时,分别达到PHAs最高合成量时,释磷量分别为34,34.4和36.9 mg·L−1,COD分别下降360、375和384 mg·L−1。在相同曝气时间内,随着曝气量的增加,释磷量略有上升,但变化不大,有机物降解量呈现增长趋势,这与合成PHAs的量相符合。
以上结果表明,在微氧条件下,相同曝气时间内,曝气量越大,消耗PHAs量也越多,致使微生物处于“饥饿”的环境。曝气后再加入有机碳源VFAs,微生物能够利用微氧条件下提供的能量迅速吸收VFAs合成PHAs。当曝气量为50 L·h−1时,合成PHAs的量最大,达到158.32 mg·g−1。
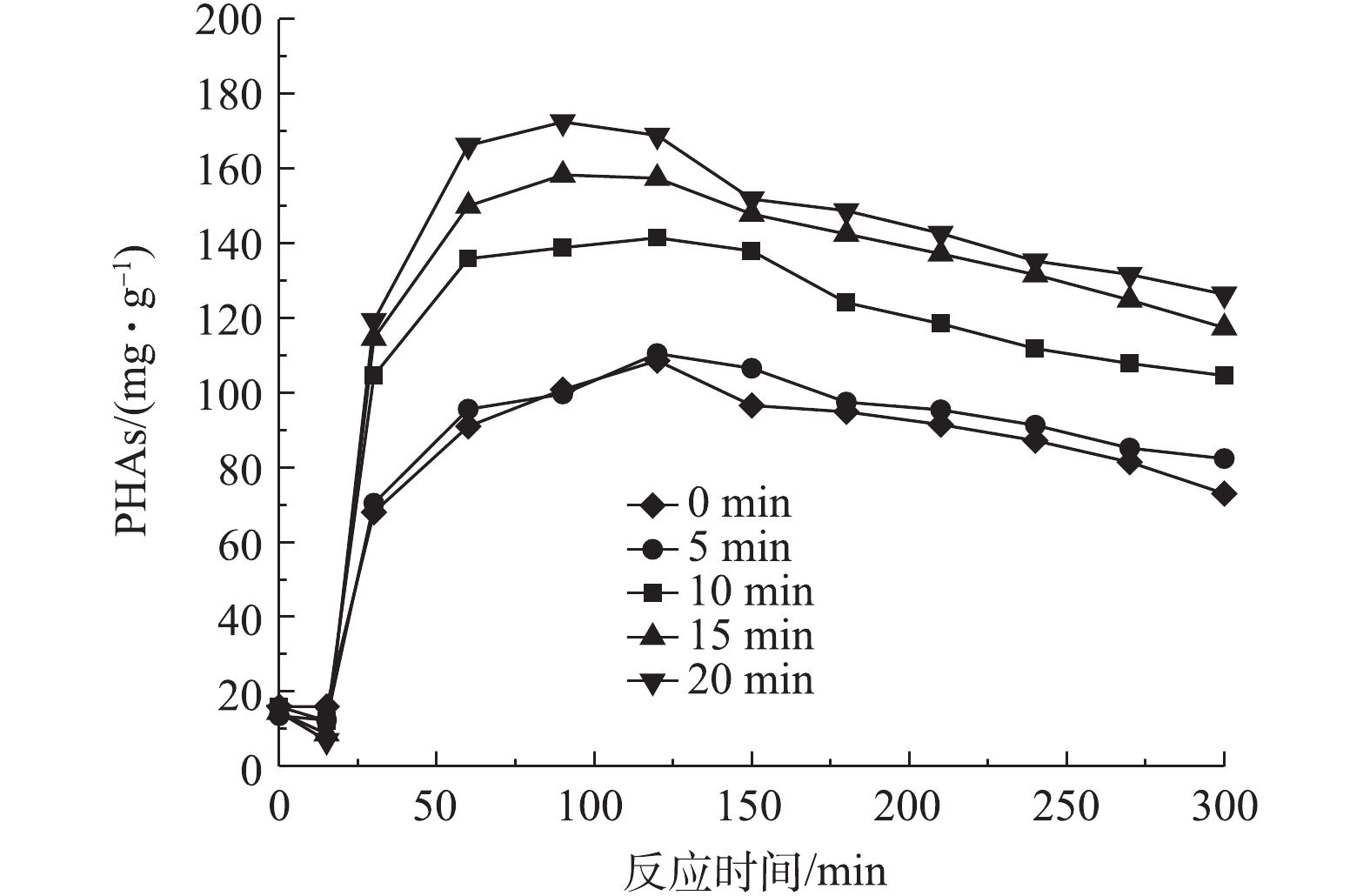
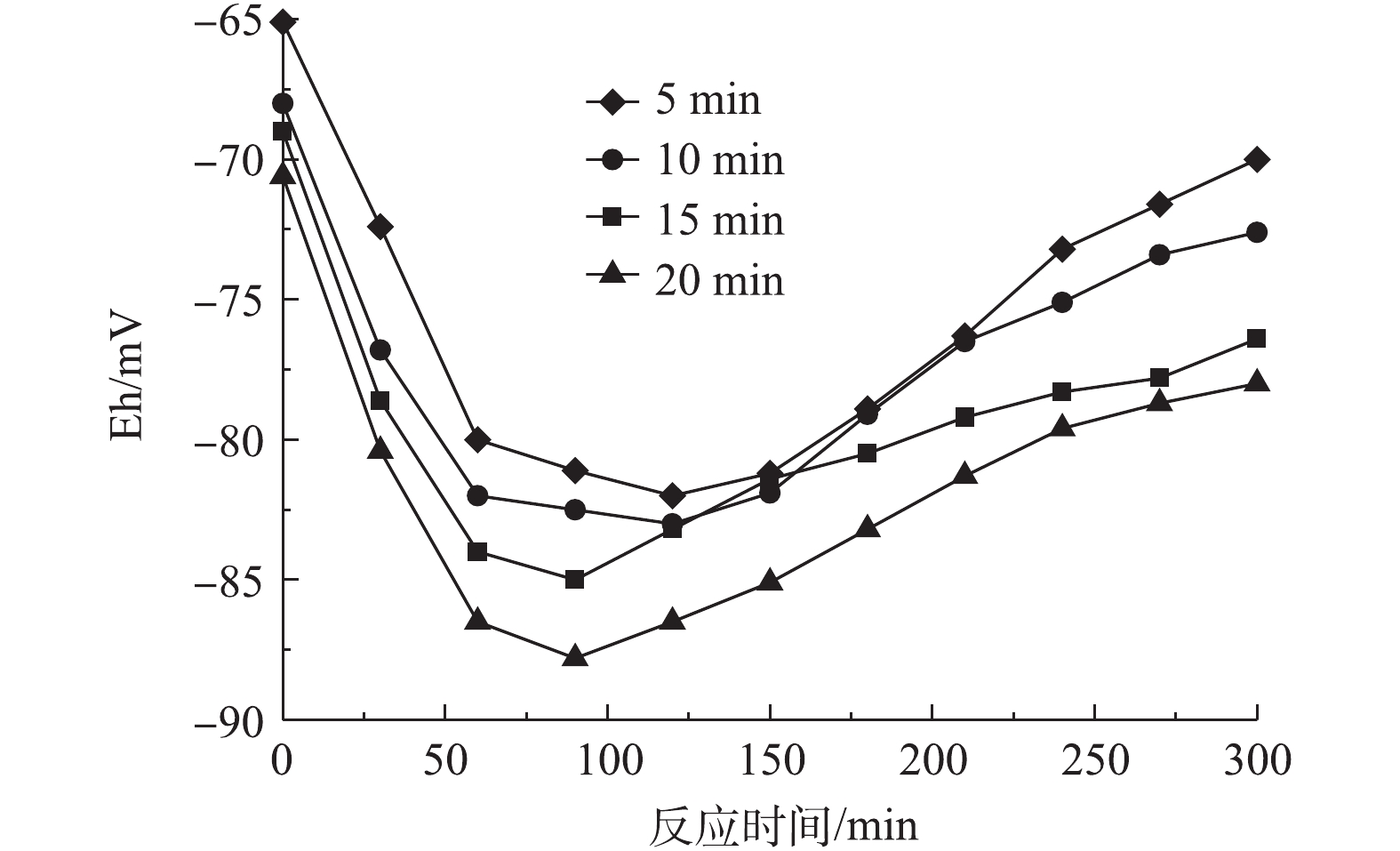
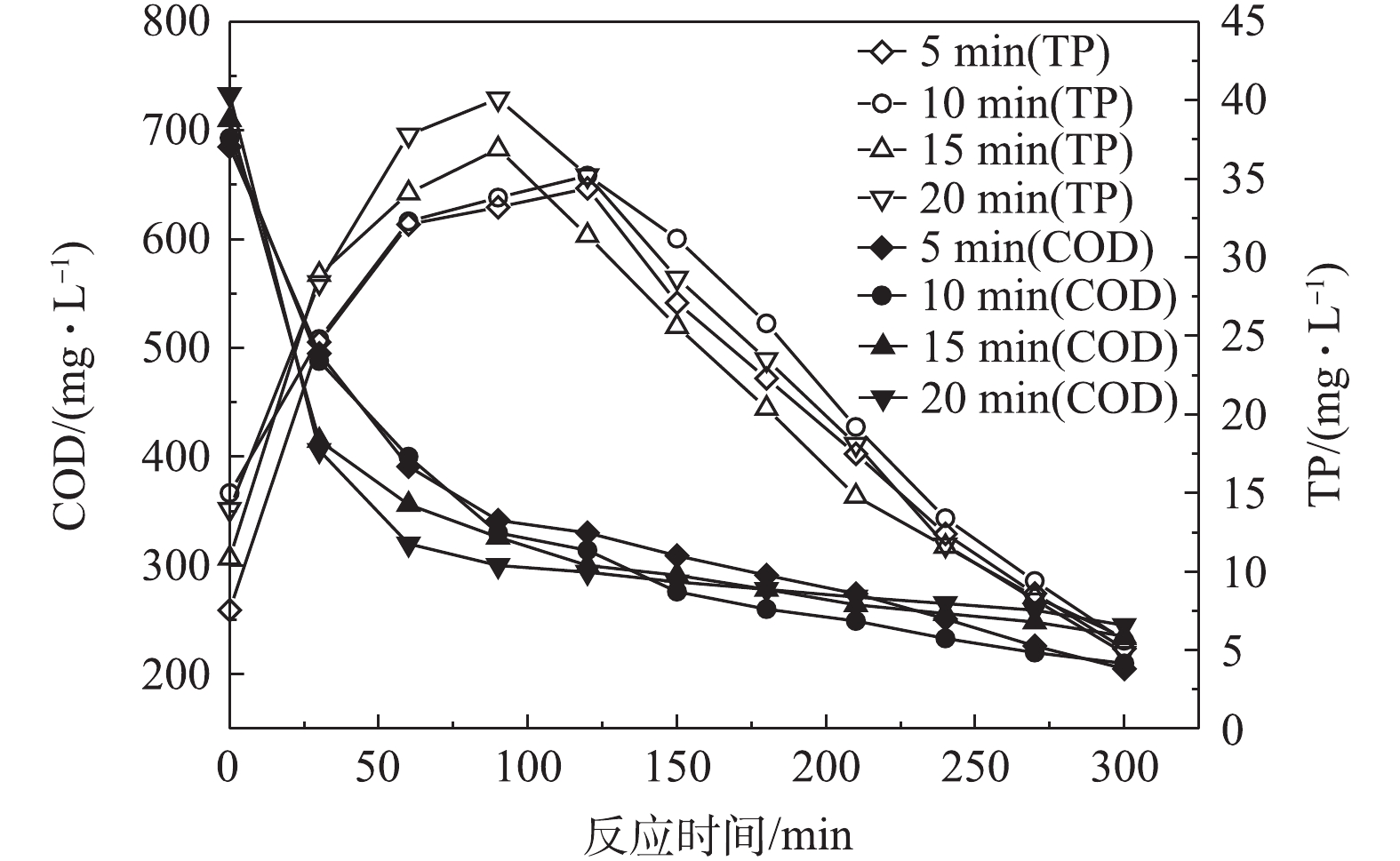
图7反映了前置曝气时间对R1合成PHAs量的影响结果,图8和图9分别反映了不同曝气时间下R1合成PHAs过程中Eh、COD和TP的变化。由图7可知,随着曝气时间的增加,消耗初始污泥中PHAs的量分别为1.2、3.81、5.79和7.6 mg·g−1,但合成PHAs的最高量呈增长的趋势,分别为110.5、141.48、158.32和172.5 mg·g−1。相比于无前置曝气时PHAs的最高合成量,曝气时间为5、10、15和20 min时,对应的PHAs最高合成量分别增长了1.7%、30.2%、45.78%和58.84%,并且随着曝气时间的增长,达到PHAs最高合成量所需的反应时间有提前的趋势。这表明增设前置曝气的方式能有效促进PHAs的合成,从而提高了PHAs最高合成量,并且能缩短合成PHAs最高量的时间,加快平均反应速率。由图8可知,随着曝气时间的延长,Eh也在下降。当Eh最低时,PHAs合成量最高,Eh的增减依旧能反映PHAs量的变化。由图9可以看出,随曝气时间的延长,释磷的差异并不大,但COD反应前1 h,降解速度小幅度增加。这说明前置曝气不仅能加快碳源的吸收,还能提高碳源的利用率。
以上结果表明,在微氧条件下,当曝气量为50 L·h−1时,随着曝气时间的增加,消耗初始PHAs含量越大,合成PHAs的量也越大。当曝气时间为20 min时,PHAs最高合成量为172.5 mg·g−1。
2.1. 不同脱氮除磷工艺下的剩余污泥在微氧条件下合成PHAs的情况
2.2. 前置曝气对R1在微氧条件下合成PHAs的影响
-
1)同步亚硝化反硝化脱氮除磷系统的剩余污泥比A2O工艺的剩余污泥更具有合成PHAs的能力,其中R1中PHAs最高合成量可达到108.6 mg·g−1,R2中PHAs最高合成量可达到58.58 mg·g−1。
2)增设前置曝气时,在微氧条件下,曝气量增大和曝气时间的延长可以促进PHAs的合成,当曝气量为50 L·h−1,曝气20 min后,PHAs的最高合成量可达到172.5 mg·g−1。
3)在120 min时,R1中的PHAs的合成量达到了最高值,为108.6 mg·g−1,此时,Eh达到了最低值,为−44.2 mV;在180 min时,R2中PHAs的合成量达到了最高值,为58.58 mg·g−1,此时,Eh达到了最低值,为−69.9 mV。



 下载:
下载: