-
短程硝化作用(NH4+-N→NO2−-N)的顺利实现是确保某些新型生物脱氮工艺(如短程硝化/反硝化工艺、厌氧氨氧化(ANAMMOX)工艺等)快速启动且高效稳定运行的前提[1-2]。随着上述新技术越来越多地应用于城镇生活污水的处理,如何达成并维持稳定的短程硝化过程随之成为污水生物脱氮领域的研究热点[3]。短程硝化作用的发生与稳定运行可通过调控和优化水处理反应装置的温度、水力停留时间(HRT)、溶解氧(DO)含量、pH值以及污泥龄(SRT)等工况参数来实现[4-6]。然而,对于低NH4+-N浓度、常温且水质波动较大的城镇生活污水,上述手段均无法有效抑制亚硝酸盐氧化菌(NOB)的过量增殖,致使系统中的短程硝化难以为继[4,7]。为此,亟需探寻新的技术手段或调控措施以期实现反应装置中稳定且高水平的NO2−-N累积率。
由于较低的氧化还原电位,NH4+-N既可在好氧条件下被硝化细菌氧化为NO2−-N或NO3−-N[8],也可在缺氧条件下被厌氧氨氧化菌(AnAOB)氧化[9],还可被某些微生物作为电子供体使其与Fe(Ⅲ)、硫酸盐或固体电极等反应[10-11]。考虑到生物电化学系统(BES)能够利用电活性微生物催化电极反应实现胞外电子与电极间的传递,进而完成污染底物的氧化或还原[12],则可推断NH4+-N可作为阳极底物被BES厌氧氧化。近年来,部分学者随之开展了此方面的尝试。MIN等[13]首次指出,BES在厌氧条件下具备高效转化NH4+-N的潜力。HE等[14]随之发现,以NH4+-N为唯一能源的BES可产生高达0.078 mA的电流峰值,系统脱氮效率则稳定在(49.2±5.9)%,此时阳极电活性生物膜中的优势菌群为Nitrosomonas europaea,推测该类微生物在厌氧条件下具有直接以NH4+-N为燃料进行产电的能力,或者可通过化能自养代谢合成有机物为产电菌提供能量。而有研究[15-18]相继表明,BES于特定条件下可在阳极培育出电活性氨氧化生物膜,此生物膜具备进行电极氨氧化反应的能力,即其可将NH4+-N作为底物进行氧化产能,并可获得类型迥异的氧化产物(如NOx−-N或气态氮化合物等)。由此可推测,在特定的实验条件下,电活性氨氧化生物膜应可通过电极氨氧化作用实现BES中NH4+-N的转化和NO2−-N的稳定积累,而如能将此技术应用于前述生物脱氮新工艺,则可弥补这些工艺在运行时存在的短程硝化作用难以实现且稳定性差的缺陷,另还具有操作简单、无需曝气且不会产生二次污染等优势。
目前关于采用生物电化学技术实现常温下城镇生活污水短程硝化的研究尚不多见,如何提高反应装置中电极氨氧化的作用强度仍需探究,相应条件下NH4+-N的氧化产物类型亦不明晰。本研究以序批式膜生物反应器(SBBR)为实验装置,对其施加电化学措施后置于常温下处理城镇生活污水,探究了系统的运行性能及其微生物特性。期间,通过调控外加阳极电势考察了系统中NH4+-N的转化效果及NO2−-N的累积规律,确定出较佳的阳极电势范围;而后在恒定最佳阳极电势的前提下探究了系统在启动及稳定运行阶段的氨氮转化性能、NO2−-N累积水平及微生物群落结构变化。期望通过此研究,探寻出一条可实现污水中NH4+-N氧化与NO2−-N稳定积累的新途径,为新型生物脱氮工艺的研发及应用提供参考。
-
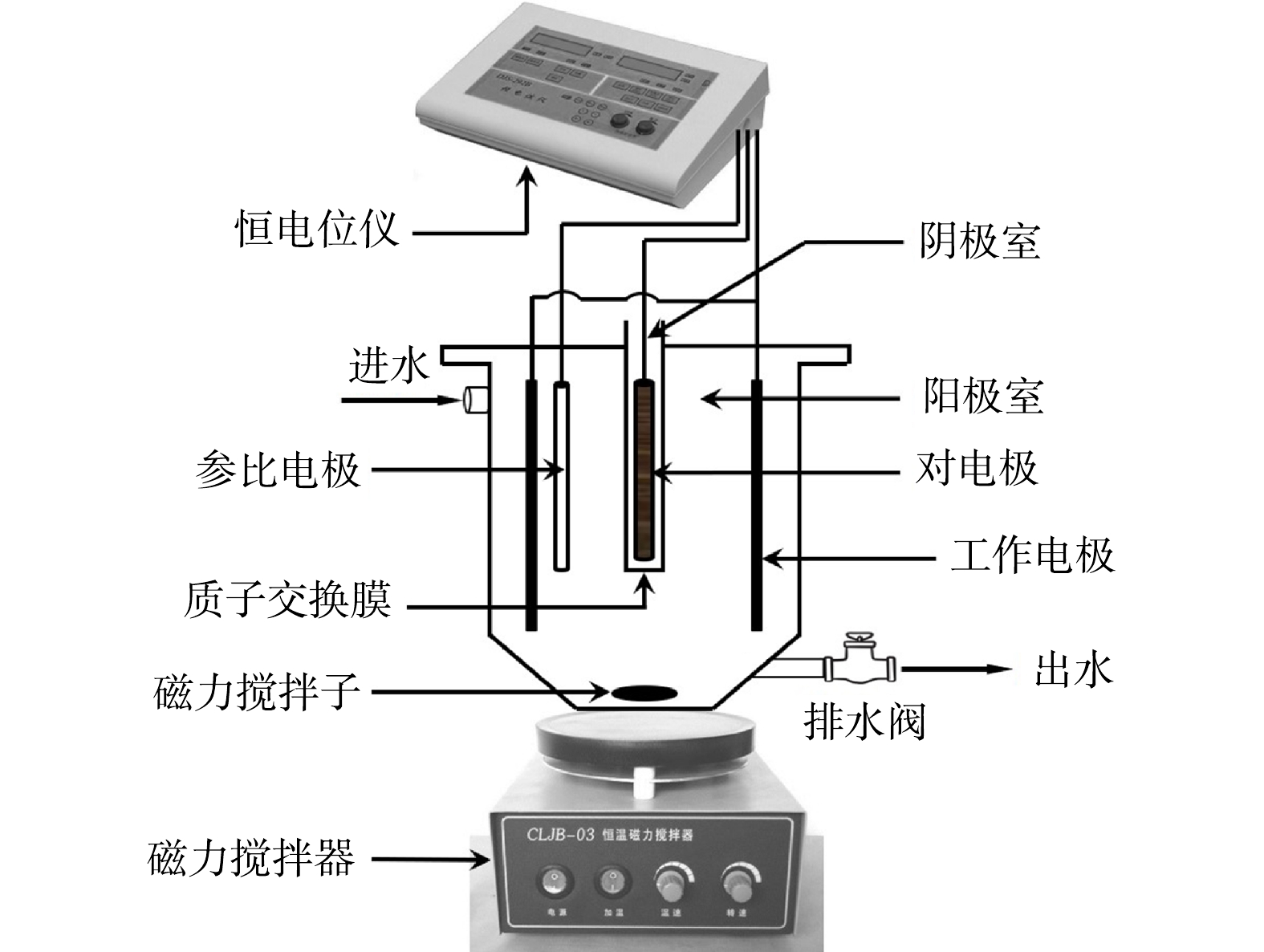
实验装置为生物电化学强化型SBBR(图1),其整体为圆柱形,内径为10 cm,有效容积为2.0 L,内部分为阴、阳两极室。将SBBR划分为3组(包括1组实验组和2组对照组)。其中,实验组标记为R1。实验开展时,将附着有硝化生物膜的石墨毡(长×宽×厚=20 cm×20 cm×3 mm)制作为圆筒状并固定于阳极室内,以此作为系统阳极(工作电极);另将长度为15 cm的石墨棒(d=8 mm)置于阴极室中以此作为系统阴极(对电极)。实验期间,阴极室与阳极室用质子交换膜(美国杜邦,N117)分隔。此外,以饱和甘汞电极(SCE)作为参比电极并将其置于靠近阳极位置。3个电极通过导线分别与恒电位仪(上海昕瑞,DJS-292C)相连。对照组分别标记为R2和R3,其中,R2为非生物对照组,其构型同R1且与恒电位仪相连,但工作电极(尺寸同上)未附着硝化生物膜;R3构型及工作电极类型均与R1一致,但其不与恒电位仪连接,阴、阳极之间亦未连接。实验期间各装置表面均覆盖铝箔以避免光照影响。
-
各组SBBR均按序批模式连续运行,即装置每天运行2个周期,各周期时长为12 h。典型周期内系统的运行过程可依次划分为进水期(t=15 min)、反应期(t=690 min)、排水期(t=10 min)和闲置期(t=5 min)。为提高SBBR阳极室中的传质效果,将各装置分别置于磁力搅拌器上,并在其中放置磁力搅拌子。实验期间各装置中的水温为14~23 ℃。在进水期间分别向各装置阳极室中吹入高纯氦气以确保其厌氧环境,另通过恒电位仪设置R1和R2在反应期间的阳极电势值(参比电极为SCE)。
本研究共持续214个周期。其中,前177个周期标记为A阶段,期间考察了不同阳极电势(0.00→1.20 V)对各系统运行性能的影响;后37个周期标记为B阶段,阶段伊始将各反应装置中的工作电极进行更新(即替换为前述附着有硝化生物膜的石墨毡),并恒定外加阳极电势为0.50 V,随之探究各系统的启动及运行性能,解析其中的微生物群落结构变化。
-
附着有硝化生物膜的石墨毡取自1套硝化型SBBR(标记为RO),此装置有效容积为20 L,内部填充石墨毡,填充容积比约40%。在前期实验中,RO的曝气速率设置为5 L·min−1(装置中的DO质量浓度约为(4.1±0.3) mg·L−1),温度通过水浴系统控制在(35±2)℃,进水(人工配水)中的NH4+-N设为(459.98±36.98) mg·L−1,RO的NH4+-N氧化效率(AOE)达94.26%,NO3−-N累积率(NaAE)和NO2−-N累积率(NiAE)分别为(90.29±3.11)%和(3.46±0.52)%。
A阶段的实验用水由50 mmol·L−1的磷酸盐缓冲液(pH=7.5)配制而成,包含14.32 g·L−1 Na2HPO4·12H2O、1.36 g·L−1 KH2PO4、0.5 g·L−1NaHCO3和2 mL·L−1微量元素溶液。其中,微量元素溶液参照QU等[15]的研究配制。此基质在使用前先进行高压蒸汽灭菌(T=121℃,t=20 min),再吹入高纯氦气(t=20 min)以去除其中的DO,而后在每周期伊始将其分别注入各SBBR的阴、阳极室中。另外,各SBBR的阳极室进水中需添加0.19 g·L−1 NH4Cl,以便使阳极室溶液中NH4+-N质量浓度维持在50 mg·L−1。在B阶段,阳极室进水更替为安徽农业大学园区生活污水,即原水经厌氧预处理后,将上清液泵入各装置阳极室中,其中耗氧有机物(以COD计,下同)、NH4+-N、NO2−-N、NO3−-N、TN和TP的质量浓度分别为(109.34±12.72)、(50.87±2.54)、(0.08±0.02)、(0.15±0.03)、(52.27±2.85)和(5.64±0.25) mg·L−1;同时,阴极室进水水质仍与A阶段相同。
-
1)水样采集及分析方法。每周期采集各SBBR进出水水样进行分析,样品设置3平行。水样中COD、TP、NH4+-N、NO2−-N、NO3−-N和TN的测定方法均参照文献[19]。反应装置中污水水温及溶解氧(DO)浓度利用便携式水质分析仪(Multi 340i,WTW)进行原位测定。R1和R2的电流密度可根据式(1)[20]计算获得。
式中:J为电流密度,μA·cm-2;I为电流值,μA,由恒电位仪测得;A为工作电极投影面积,cm2。
2)生物膜样品采集。在RO中采集生物膜样本(标记为SO),另在A阶段的第94、117个周期以及B阶段的第37个周期分别采集R1中的生物膜样品(附着于石墨毡上,对应标记为SA1、SA2和SB)。上述4组生物膜样品均用于后续实验分析。
3)基于16S rDNA的Illumina平台高通量测序。将所有生物膜样本送至上海美吉生物科技医药公司进行高通量分析测序。测序分析后,根据Barcode序列区分各个样本的数据,进行嵌合体过滤,得到可用于后续分析的有效数据,即Clean reads。为了研究样品的物种组成多样性,对所有样品的Clean reads进行聚类,以97%的一致性(identity)将序列聚类成OTUs(operational yaxonomic units),然后对OTUs的代表序列进行物种注释。
-
采用SPSS 28.0对实验数据进行统计分析;采用one-way ANOVA进行方差分析;采用Origin 2018作图,图中相关数据为平均值±标准差;本研究中污染物氧化效率、累积效率、转化速率及生成速率等的计算方法均参照ZHI等[21]的研究。
-
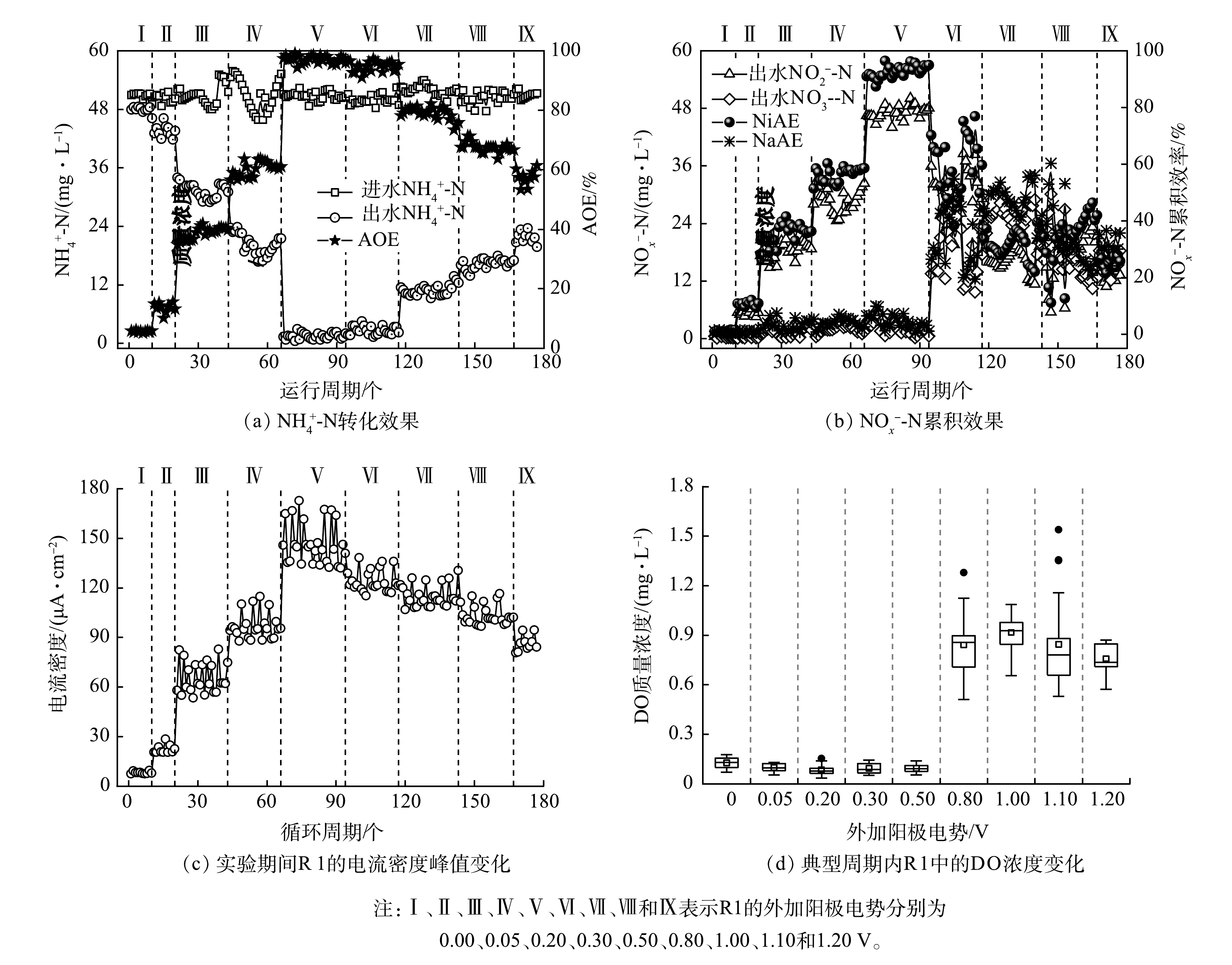
在A阶段考察了不同外加阳极电势对R1运行性能的影响(图2)。结合图2(a)和图2(b)可知,当外加阳极电势为0,R1的NH4+-N转化性能不佳,AOE和NiAE分别仅为(5.63±0.29)%和(1.04±0.35)%,此时系统出水中氮素以NH4+-N为主,质量浓度为(47.90±1.69) mg·L−1。随着外加阳极电势的适当增加(0.00~0.80 V),R1的氮素转化性能随之逐渐提高。其中,当外加阳极电势为0.50 V时,R1的AOE和NiAE分别增至(97.07±1.20)%和(92.79±2.12)%,此时系统阳极室出水中的氮素以NO2−-N为主,NH4+-N、NO2−-N和NO3−-N的质量浓度分别为(1.49±0.60)、(47.14±1.35)和(2.23±1.30) mg·L−1;当外加阳极电势为0.80 V时,R1的AOE仍维持在(94.75±3.69)%,但NiAE降至(59.35±10.82)%,即系统出水中的NO2−-N质量浓度维持在(29.69±5.52) mg·L−1,同时,R1出水中的NO3−-N质量浓度增至(17.69±5.50) mg·L−1,装置的NaAE随之提高至(35.40±11.01)%。当外加阳极电势≥1.00 V后,R1的氮素转化性能趋于恶化。在阳极电势为1.20 V的条件下,R1的AOE降至(57.43±2.64)%,此时装置出水中的NH4+-N质量浓度升至(21.71±1.18) mg·L−1,NO2−-N和NO3−-N的质量浓度则分别为(13.05±1.24) mg·L−1和(16.26±2.05) mg·L−1。由计算可知,此时R1的NaAE(≈(31.86±3.90)%)高于NiAE(≈(25.57±2.29)%)。图2(c)为实验期间R1在各周期内的电流密度峰值变化。可见,R1的电流密度峰值正比于其AOE,2组数据呈现较高的相关性(0.962**,P<0.001);当外加阳极电势为0.50 V时,R1的电流密度峰值可达(146.76±12.62) μA·cm−2。由图2(d)可见,当外加阳极电势≤0.50 V时,系统中的DO质量浓度稳定在(0.09±0.03) mg·L−1,即装置内部此时为厌氧环境;而当外加阳极电势≥0.80 V后,反应装置中的DO质量浓度升高至(0.86±0.18) mg·L−1。这表明此条件下系统内部的厌氧环境已无法保障[8]。理论上认为,电解水过程中析氧反应发生所需的标准电极电势E0(H2O/O2)为+1.23 V(vs. SHE,pH=0)[22]。但亦有研究[23]指出,在微生物催化作用下,E0(H2O/O2)可降至+0.82 V(vs. SHE,pH=7)。由此可推测,在外加阳极电势为0.80~1.20 V的条件下,R1的工作电极表面可能有析氧反应发生。本研究另测定了对照组(即R2和R3)的运行性能(数据未列出),发现各对照组的氮素转化性能始终较差,实验期间各对照装置进、出水中的NH4+-N浓度无显著变化,其AOE均低于1%。此外,R2的电流密度及其中的DO含量在实验期间亦分别仅为(7.46±1.04) μA·cm−2和(0.11±0.04) mg·L−1。
由上述结果可判断,对R1施加电化学强化措施可促使其中电极氨氧化作用的发生,即电活性微生物能以NH4+-N为底物进行氧化产能,且外加阳极电势及特定菌群结构的接种生物膜是确保该作用得以实现的必要条件。不同的外加阳极电势会影响R1的电流密度、NH4+-N转化效率及氧化产物类型。在0.50 V的外加阳极电势下,R1中电极氨氧化作用的强度能得到较大限度地提高,系统随之可取得理想的NH4+-N转化效果与高水平的NO2−-N累积量;0.80 V的外加阳极电势虽也能确保R1中较强的电极氨氧化作用,但此时系统中会发生析氧反应,在O2的介入下,NH4+-N氧化的产物转而以NO3−-N为主。值得注意的是,过高的阳极电势(≥1.00 V)不仅会导致R1中发生析氧反应,还会降低系统的运行性能。此结果可能归因于以下3点:1)过高的阳极电势增强了工作电极附近的电解水反应,致使电极附近pH急剧变化,进而影响了功能微生物的活性[24];2)过高的阳极电势造成功能微生物细胞膜的不可逆穿透或细胞组分的直接氧化,致使其代谢活性遭到抑制[25];3)工作电极的析氧反应使得系统中的厌氧环境被破坏,由此改变或抑制了电活性微生物的代谢途径及活性。
-
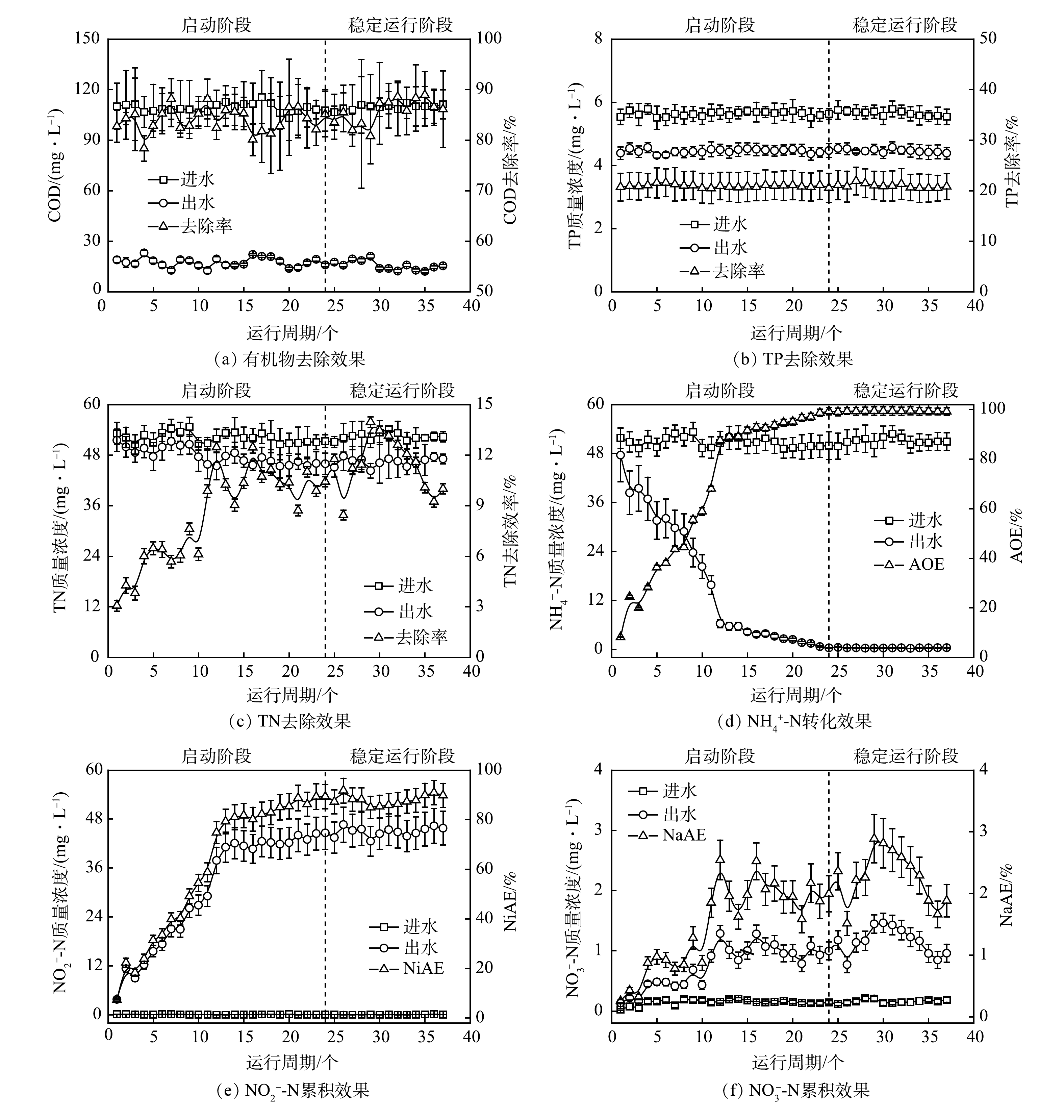
恒定外加阳极电势为0.50 V,而后考察了R1对生活污水的处理效果(图3)。可见,R1出水中的COD值在B阶段始终稳定在(16.87±1.16) mg·L−1。鉴于进水经厌氧预处理后其有机物含量偏低,R1的COD去除率在该阶段维持在(84.57±4.52)%。此外,R1在B阶段的除磷性能不佳,TP去除率仅为(20.95±2.83)%。不同于有机物和磷素,R1的氮素转化性能在B阶段伊始不甚理想,装置出水中TN与NH4+-N的质量浓度高达(51.84±2.64) mg·L−1和(47.61±6.53) mg·L−1,但在B阶段历经23个周期后,R1的氮素转化率逐渐提高。待系统稳定运行后,其出水中TN、NH4+-N、NO2−-N与NO3−-N的质量浓度分别为(46.40±0.98)、(0.34±0.05)、(44.91±1.11)和(1.15±0.22) mg·L−1,即装置此时的TN去除效率、AOE、NiAE和NaAE分别为(11.39±1.62)%、(99.33±0.11)%、(88.08±2.07)%和(2.25±0.42)%。本研究另考察了对照组(R2和R3)在B阶段的运行性能(数据未列出),发现各对照组难以对生活污水进行高效处理,其有机物、TP、TN和NH4+-N的去除率均低于5%。
由上述结果可知,当R1在0.50 V的阳极电势下处理生活污水时,系统能较快完成启动进程,且能取得理想的NH4+-N转化效果及高水平的NO2−-N累积率。值得注意的是,进水中一定含量的有机物并未影响R1中电极氨氧化作用的强度,系统的TN去除性能此时反而有所提升。此结果可能归因于以下2点:1)接种生物膜中存在一定数量的异养型微生物(反硝化菌等),其参与了系统中有机物的降解及部分NOx−-N的脱除;2)在外加阳极电势下,R1中富集了以有机物作为阳极底物的电化学活性细菌(地杆菌属(Geobacter)、希瓦氏菌属(Shewanella)等),此类电活性微生物的代谢活动促进了污水中有机物的去除。另外,R1在此阶段欠佳的TP去除率应源于装置中厌氧/好氧(缺氧)交替环境的缺失以及进水中有机碳源的匮乏[26]。
-
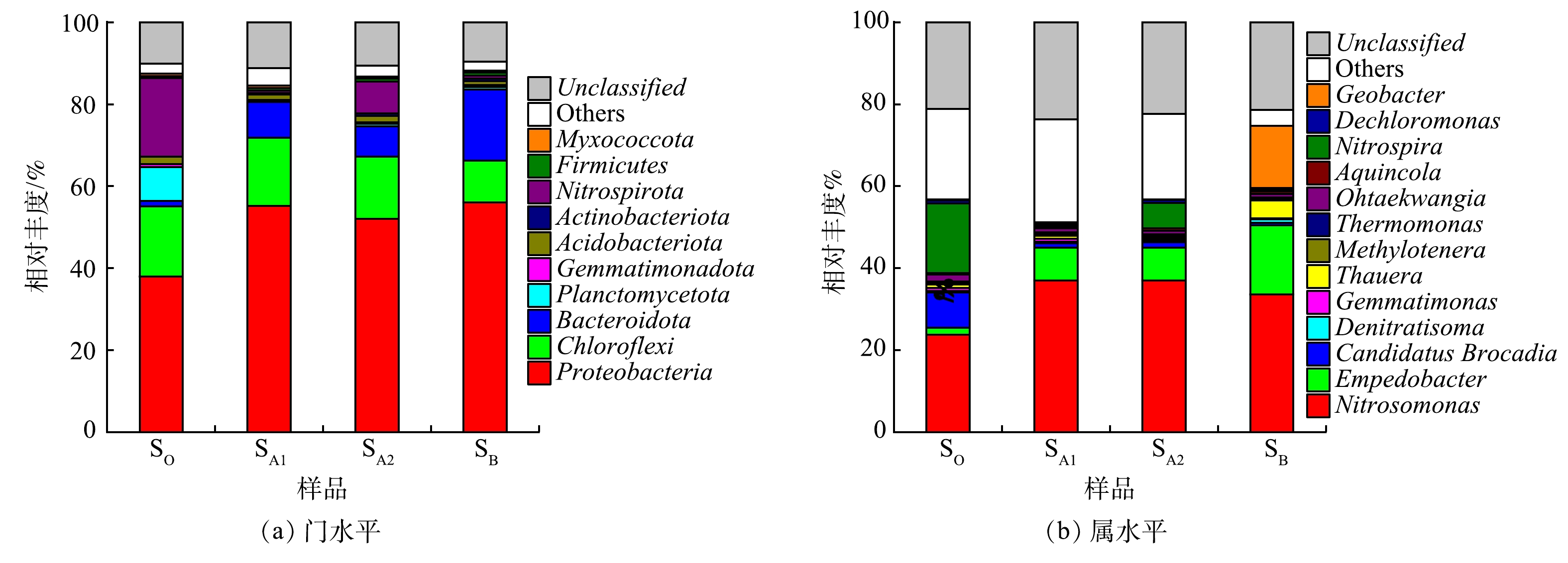
图4表明,变形菌门(Proteobacteria)、绿弯菌门(Chloroflexi)、硝化螺旋菌门(Nitrospirota)和浮霉菌门(Planctomycetota)是SO中含量较高的4个菌门,其在该样本中的相对丰度分别为37.90%、17.22%、19.15%和8.24%。有研究表明,Proteobacteria是污水生物处理系统中的优势菌门,大部分参与脱氮除磷及有机物降解过程的功能微生物(如好氧氨氧化菌(AOB)、NOB、反硝化菌和聚磷菌(PAOs)等)均属于此菌门[27];Chloroflexi可降解多糖和蛋白质等复杂化合物,亦可在生物膜或颗粒污泥的形成过程中起到骨架支撑作用[28];Nitrospirota中包含部分种类的NOB,其可将NO2−-N氧化为NO3−-N[29];Planctomycetota中存在脱氮微生物(AnAOB等),可参与污水处理过程中的氮循环过程[30]。结合1.3节中所述内容可推测,SO中的菌群结构特点应取决于RO的进水水质及运行条件。对于SA1、SA2和SB,其中的优势菌门均不同程度地异于SO。与SO相比,Proteobacteria在3组样本中的占比进一步提高,其相对丰度均超过50%;同时,SA1、SA2和SB中拟杆菌门(Bacteroidota)的含量亦呈现不同程度的增加,该菌门在3组样本中的相对丰度较SO分别增至8.77%、7.38%和17.38%;另一方面,3组样本中Planctomycetota和Nitrospirota的相对含量均降低,尤其对于SA1和SB,Planctomycetota和Nitrospirota在2组样本中的占比均<1%。此外,3组样本之间亦存在差异,主要表现为:SB中Bacteroidota的相对含量高于SA1和SA2;SA2中Nitrospirota的占比(7.76%)高于SA1(0.62%)和SB(0.66%)。上述结果表明,R1在不同实验阶段中稳定运行时,其微生物特性均较实验伊始发生改变,且其电活性生物膜中的微生物群落结构在不同实验条件下各具特点。其中,考虑到R1中的电极氨氧化作用在0.50~0.80 V的阳极电势下可得到较大程度的强化,3组样本中Proteobacteria含量的增加表明特定种类的电活性微生物在装置中得以富集;SA1和SB中低含量的Planctomycetota和Nitrospirota应归因于相应实验条件下R1内部的厌氧环境及其运行温度(≈14~23 ℃);而SA2中相对丰度较高的Nitrospirota则应源于0.80 V阳极电势下R1中发生的析氧反应。另外,B阶段进水中一定含量的有机物促进了R1中Bacteroidota含量的增加。Bacteroidota属化能有机营养菌,可降解多种复杂有机物[31];另有研究[15]表明,该菌门可作为BES中的优势菌群参与电活性生物膜与固体电极间的电子传递过程。则SB中含量增加的Bacteroidota可能会参与电极氨氧化反应,促进系统中NH4+-N的转化。
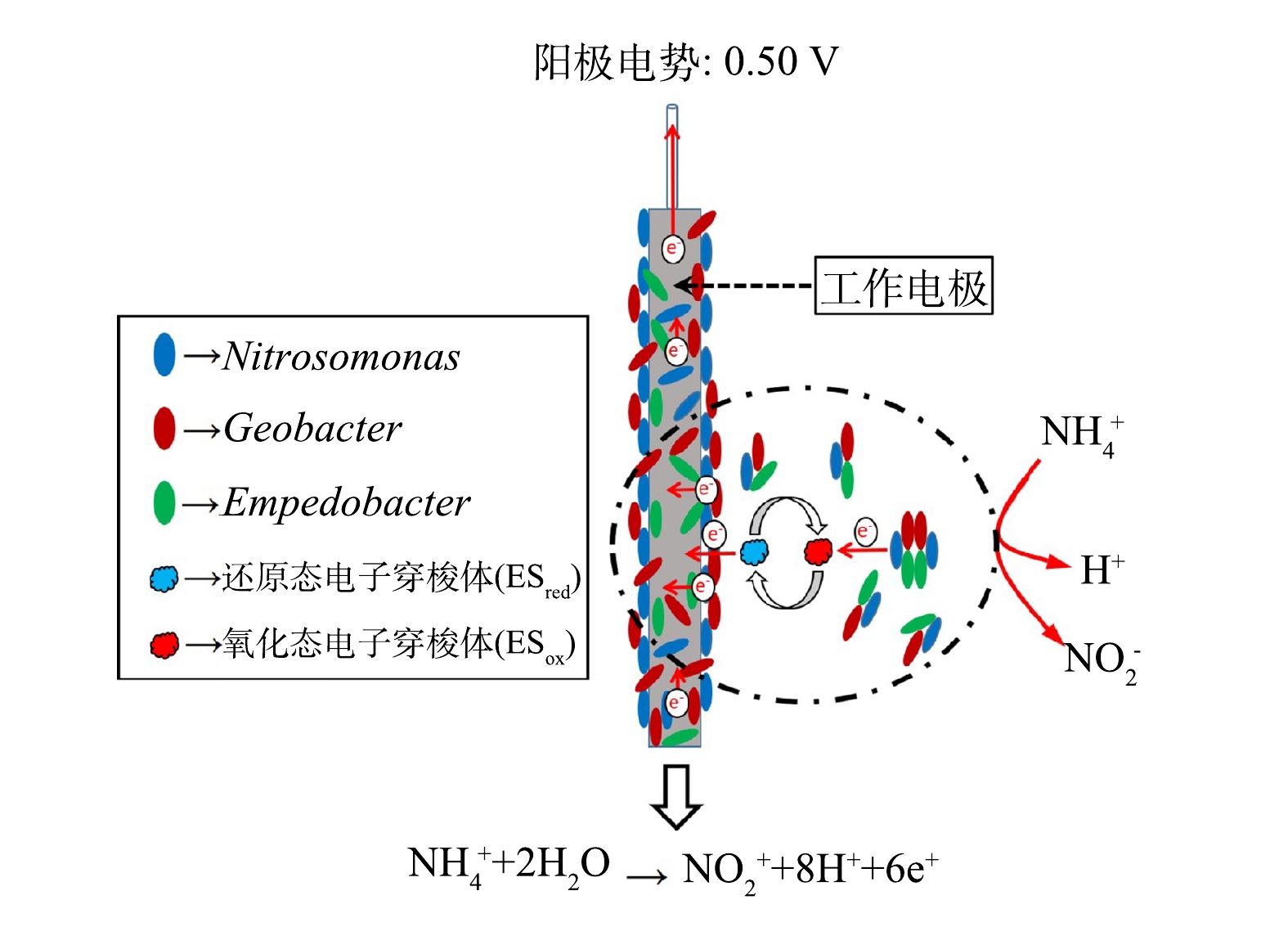
由图4还可见,SO中的优势菌属包括Nitrosomonas、Nitrospira和Candidatus Brocadia,其在该样本中的相对丰度分别为23.45%、17.01%和8.62%。其中,Nitrosomonas和Nitrospira分别隶属于AOB与NOB,是参与生物硝化(NH4+-N→NO2−-N→NO3−-N)过程的2种功能菌属[32];Candidatus Brocadia属AnAOB,其可与Nitrosomonas协同通过基于亚硝化的全程自养脱氮(CANON)反应实现氮素脱除[33]。Nitrosomonas和Nitrospira较高的丰度水平体现出RO高效的硝化性能,而SO中一定占比的Candidatus Brocadia则预示着RO中的部分NH4+-N可能通过CANON得以转化。随着R1相继进入A、B阶段,系统中Nitrospira和Candidatus Brocadia的相对含量均因装置运行模式及进水水质较RO发生改变而降低。然而,SA2中相对含量仍达6.25%的Nitrospira表明NOB能借助电极析氧反应在R1中实现增殖,并可在一定程度上增强系统的NO2−-N氧化性能。Nitrosomonas在SA1、SA2和SB中的相对含量(37.05%、37.03%和33.54%)均高于SO,且隶属于Bacteroidota的稳杆菌属(Empedobacter)在3组样本中的占比亦较SO为高,尤其对于SB,其中Empedobacter的相对丰度为16.88%。此外,SB中的优势菌属除Nitrosomonas和Empedobacter之外,还包括Geobacter(15.24%),该菌属的相对丰度均高于SO(0.23%)、SA1(0.25%)和SA2(0.18%)。通常认为,Nitrosomonas为化能自养菌,能以O2为电子受体将NH4+-N氧化为NO2−-N[34]。但也有研究表明,Nitrosomonas具备厌氧呼吸能力,能以NO2−-N为电子受体将NH4+-N厌氧氧化,并可在厌氧反应器中长期存活[35]。随着微生物电化学氨氧化技术的发展,相继又有研究发现,Nitrosomonas为阳极电活性氨氧化生物膜中的优势菌属[14-18],其在NH4+-N转化过程中起关键作用。鉴于Nitrosomonas代谢的多样性,并结合不同实验条件下R1的脱氮性能可断定,Nitrosomonas应是参与系统中电极氨氧化反应的关键功能微生物。在0.50 V的外加阳极电势下,R1中的Nitrosomonas能以阳极为电子受体,将NH4+-N厌氧氧化为NO2−-N,实现NH4+-N高效转化。需注意的是,当R1在B阶段稳定运行时,由于进水中挟带着一定含量的有机物,其阳极电活性生物膜中Empedobacter和Geobacter的相对含量均有不同程度地提升。其中,Empodebacter是一类化能异养菌,此菌属在代谢过程中能分泌黄素类化合物[36]。有研究[37]表明,黄素类化合物可作为电子穿梭体介导微生物胞外电子传递。由此推断Empedobacter可能采用分泌内生电子穿梭体的手段协助Nitrosomonas完成电极氨氧化反应,并在一定程度上提高了电活性生物膜的电子传递效率。另一方面,隶属于Proteobacteria的Geobacter是一种典型的电化学活性细菌,其通常以有机碳源作为阳极底物实现电能输出[38]。但也有研究指出,Geobacter还具有氨氧化的相关功能基因[39],即NH4+-N亦可作为其进行阳极氧化的电子供体。随之有研究证实,此菌属确能在BES中参与电极氨氧化反应[16]。基于此,B阶段Geobacter相对丰度的增加不仅有助于提高R1的有机物去除性能,也应对系统中的电极氨氧化反应起到了促进作用。由此可推测,当R1在B阶段处理生活污水时,稳定运行期间系统中的NH4+-N转化途径应如图5所示。另由图4可见,SB中Thauera的占比(4.29%)明显高于其他样本。Thauera为反硝化菌属,其可在缺氧或好氧条件下将NOx−-N还原[40],此菌属相对丰度的增加应导致了R1的TN去除性能在B阶段得以提升,而该实验结果则归因于进水中一定含量的有机碳源。
-
1)所构建的生物电化学强化型SBBR,通过调控外加电极电势可实现系统中电极氨氧化的发生及强化,且不同的外加阳极电势会显著影响系统中NH4+-N的转化效率及氧化产物类型。
2)当外加阳极电势由0.00 V增至0.50 V时,SBBR中电极氨氧化作用强度逐步提高,系统的AOE与NiAE分别增至(97.07±1.20)%和(92.79±2.12)%;当外加阳极电势≥0.80 V后,SBBR中NH4+-N的氧化产物因工作电极上的析氧反应转而以NO3−-N为主,电极氨氧化作用因电势不断升高而受到抑制,系统的AOE随之恶化。
3)将外加阳极电势恒定为0.50 V时,SBBR在常温下处理生活污水时可取得理想的NH4+-N转化效果(AOE为(99.33±0.11)%)与较高水平的NO2−-N累积量(NiAE为(88.08±2.07)%),此时系统中的电极氨氧化作用可得到较大程度的强化,其电活性生物膜中的优势菌属包括Nitrosomonas(33.54%)、Geobacter(15.24%)和Empodebacter(16.88%),三者在NH4+-N厌氧氧化过程中起关键作用。
-
本研究构建的基于生物电化学技术的电极氨氧化工艺无需曝气即可实现生活污水中NH4+-N的氧化与NO2−-N的稳定积累,既解决了困扰常规短程硝化工艺的NOB增殖的问题,又降低了工艺操作难度,因而具有较大的应用潜力,可促进新型生物脱氮新工艺的研发与应用。然而同时也应看到,目前尚未有研究明确证实Nitrosomonas具备胞外电子传递的能力;且对于生活污水而言,其含有的不同种类和浓度的有机物对电极氨氧化作用的影响及作用机制仍待进一步明晰;另外,Geobacter是否能够参与电极氨氧化反应尚需证实,该菌属与其它功能微生物(如Nitrosomonas等)之间的相互作用关系亦待阐明。总之,NH4+-N作为阳极底物在R1中发生氧化的具体机制(包括相应的电子传递途径及关键酶学特征等)及相关调控措施应在后续研究中进一步探究。
生物电化学措施下SBBR中的亚硝酸盐累积性能及微生物学特征
Accumulation performances of nitrite and associated microbiological characteristics in a sequencing batch biofilm reactor assisted by bioelectrochemical technology
-
摘要: 针对常温下生活污水短程硝化难以实现且稳定性差的难题,探究了生物电化学措施对序批式生物膜反应器(SBBR)中NO2−-N的累积性能及微生物学特征的影响。对SBBR施加生物电化学措施后,通过调控外加电极电势可实现其中电极氨氧化作用的发生及强化,且不同的外加阳极电势会显著影响系统中NH4+-N的转化效果、氧化产物类型及菌群结构。随着外加阳极电势由0.00增至0.50 V,SBBR中电极氨氧化作用的强度逐步提高,系统的NH4+-N氧化效率(AOE)与NO2−-N累积效率(NiAE)分别增至(97.07±1.20)%和(92.79±2.12)%;当外加阳极电势≥0.80 V后,SBBR中NH4+-N的氧化产物因工作电极上的析氧反应转而以NO3−-N为主,电极氨氧化作用的强度因电势不断升高而受到抑制,系统的AOE随之恶化。将外加阳极电势恒定为0.50 V,生物电化学强化型SBBR在常温下处理生活污水时可取得理想的NH4+-N转化效率(AOE=(99.33±0.11)%)与较高水平的亚硝酸盐累积量(NiAE=(88.08±2.07)%),此时系统中的电极氨氧化作用可得到较大程度的强化,其电活性生物膜中的优势菌属包括Nitrosomonas(33.54%)、Geobacter(15.24%)和Empodebacter(16.88%),三者在NH4+-N厌氧氧化过程中起关键作用。Abstract: Considering the difficulties of achievement and stability of partial nitrification when treating domestic sewage at ambient temperature, the experiments were conducted to explore the effects of bioelectrochemical assisted approach on nitrite accumulation performances and associated microbiological characteristics in a sequencing batch biofilm reactor (SBBR). When SBBR was assisted by bioelectrochemical technology, the regulation of the electrode potential could realize the cccurrence and enhancement of the electrode dependent ammonium oxidation process. Further, the different anode potential levels could significantly affect the transformation performances and oxidation product types of ammonium in the system, as well as the associated microbial community structures. As the applied anode potential increased from 0.00 to 0.50 V, the strength of the electrode dependent ammonium oxidation process increased gradually in the SBBR, and the ammonia oxidation efficiency (AOE) and nitrite accumulation efficiency (NiAE) of the system increased to (97.07±1.20)% and (92.79±2.12)%, respectively. As the applied anode potential was higher than 0.80 V, the products of ammonium oxidation in SBBR mainly changed into nitrate owing to occurrence of oxygen evolution reaction on the working electrode. Moreover, the electrode dependent ammonium oxidation process began to be inhibited in the system due to the increased anode potential levels, deteriorating the AOE. Regarding to the bioelectrochemical assisted SBBR operating with the applied anode potential of 0.50 V, ideal ammonia oxidation effect [AOE=(99.33±0.11)%] and high level of nitrite accumulation amount [NiAE=(88.08±2.07)%] could be achieved when the system was used to treat domestic sewage at ambient temperature. Correspondingly, the electrode dependent ammonium oxidation process could be highly strengthened in the reactor, Nitrosomonas (the relative abundance of 33.54%), Geobacter (the relative abundance of 15.24%) and Empodebacter (the relative abundance of 16.88%) were the three dominant bacterial genera in the electroactive biofilm, which played key roles in the process of anaerobic ammonia oxidation.
-

-
[1] CUI B, YANG Q, LIU X, et al. The effect of dissolved oxygen concentration on long-term stability of partial nitrification process[J]. Journal of Environmental Sciences, 2020, 90: 343-351. doi: 10.1016/j.jes.2019.12.012 [2] LIU C, YU D, WANG Y, et al. A novel control strategy for the partial nitrification and anammox process (PN/A) of immobilized particles: Using salinity as a factor[J]. Bioresource Technology, 2020, 302: 122864. doi: 10.1016/j.biortech.2020.122864 [3] CHEN H, TU Z, WU S, et al. Recent advances in partial denitrification-anaerobic ammonium oxidation process for mainstream municipal wastewater treatment[J]. Chemosphere, 2021, 278: 130436. doi: 10.1016/j.chemosphere.2021.130436 [4] LIU X, KIM M, NAKHLA G, et al. Partial nitrification-reactor configurations, and operational conditions: Performance analysis[J]. Journal of Environmental Chemical Engineering, 2020, 8(4): 103984. doi: 10.1016/j.jece.2020.103984 [5] GE S, WANG S, YANG X, et al. Detection of nitrifiers and evaluation of partial nitrification for wastewater treatment: A review[J]. Chemosphere, 2015, 140: 85-98. doi: 10.1016/j.chemosphere.2015.02.004 [6] JARAMILLO F, ORCHARD M, MUNOZ C, et al. Advanced strategies to improve nitrification process in sequencing batch reactors: A review[J]. Journal of Environmental Management, 2018, 218: 154-164. [7] 卞伟, 李军, 王盟, 等. 不同温度下溶解氧对短程硝化的影响及相关研究[J]. 中国给水排水, 2017, 33(7): 84-88. [8] SCHMIDT I, BOCK E. Anaerobic ammonia oxidation by cell-free extracts of Nitrosomonas europaea[J]. Antonie Van Leeuwenhoek, 1998, 73: 271-278. doi: 10.1023/A:1001572121053 [9] HOU M, XU R, LIN Z, et al. Vertical characteristics of anaerobic oxidation of ammonium (anammox) in a coastal saline-alkali field[J]. Soil and Tillage Research, 2020, 198: 104531. doi: 10.1016/j.still.2019.104531 [10] YANG W, WEBER K, SILVER W. Nitrogen loss from soil through anaerobic ammonium oxidation coupled to iron reduction[J]. Nature Geoscience, 2012, 5: 538-541. doi: 10.1038/ngeo1530 [11] GUO Q, HU H, SHI Z, et al. Towards simultaneously removing nitrogen and sulfur by a novel process: Anammox and autotrophic desulfurization-denitrification (AADD)[J]. Chemical Engineering Journal, 2016, 297: 207-216. doi: 10.1016/j.cej.2016.03.138 [12] SCHRODER U, HARNISCH F, ANGENENT L. Microbial electrochemistry and technology: Terminology and classification[J]. Energy & Environmental Science, 2015, 8: 513-519. [13] MIN B, KIM J, OH S, et al. Electricity generation from swine wastewater using microbial fuel cells[J]. Water Research, 2005, 39: 4961-4968. doi: 10.1016/j.watres.2005.09.039 [14] HE Z, KAN J, WANG Y, et al. Electricity production coupled to ammonium in a microbial fuel cell[J]. Environmental Science and Technology, 2009, 43: 3391-3397. doi: 10.1021/es803492c [15] QU B, FAN B, ZHU S, et al. Anaerobic ammonium oxidation with an anode as the electron acceptor[J]. Environmental Microbiology Reports, 2014, 6: 100-105. doi: 10.1111/1758-2229.12113 [16] 李建, 占国强, 王娟, 等. 生物电解池氨氧化脱氮产能[J]. 应用与环境生物学报, 2014, 20(6): 1058-1062. [17] VILAJELIU-PONS A, KOCH C, BALAGUER M, et al. Microbial electricity driven anoxic ammonium removal[J]. Water Research, 2018, 130: 168-175. doi: 10.1016/j.watres.2017.11.059 [18] 康岱, 崔梦瑶, 杨暖, 等. 电极电势调控对氨氧化脱氮与生物膜电活性的影响[J]. 应用与环境生物学报, 2020, 26(5): 1268-1274. [19] 国家环境保护总局. 水和废水监测分析方法[J]. 北京:中国环境科学出版社, 2002: 227-285. [20] 何丹, 张尔翼, 杨祖洁, 等. 甲烷生物燃料电池的产电影响因素及机制研究[J]. 环境科学学报, 2021, 41(9): 3446-3456. [21] ZHI W, YUAN L, JI G, et al. Enhanced long-term nitrogen removal and its quantitative molecular mechanism in tidal flow constructed wetlands[J]. Environmental Science & Technology, 2015, 49: 4575-4583. [22] 何泽兴, 史成香, 陈志超, 等. 质子交换膜电解水制氢技术的发展现状及展望[J]. 化工进展, 2021, 40(9): 4762-4773. [23] HERRON J A, KIM J, UPADHYE A A, et al. A general framework for the assessment of solar fuel technologies[J]. Energy & Environmental Science, 2014, 8(1): 126-157. [24] 高彬, 袁林江, 李宗伟. 阳极电势对MFC中产电的影响[J]. 环境工程学报, 2014, 8(11): 4774-4781. [25] 蒋沁芮, 杨暖, 吴亭亭, 等. 生物电化学脱氮技术研究进展[J]. 应用与环境生物学报, 2018, 24(2): 408-414. [26] 王梅香, 赵伟华, 王淑莹, 等. A2N2系统反硝化除磷性能的优化及稳定运行[J]. 中国环境科学, 2016, 36(11): 3311-3320. doi: 10.3969/j.issn.1000-6923.2016.11.014 [27] 张铃敏, 常青龙, 史勤, 等. CANON工艺短程硝化恢复调控及微生物种群结构变化[J]. 中国环境科学, 2019, 39(6): 2354-2360. doi: 10.3969/j.issn.1000-6923.2019.06.015 [28] SUN N, GE C, AHMAD H A, et al. Realization of microbial community stratification for single-stage nitrogen removal in a sequencing batch biofilter granular reactor[J]. Bioresource Technology, 2017, 241: 681-691. doi: 10.1016/j.biortech.2017.05.203 [29] VAL DEL RIO A, CAMPOS J L, DA SILVA C, et al. Determination of the intrinsic kinetic parameters of ammonia-oxidizing and nitrite-oxidizing bacteria in granular and flocculent sludge[J]. Separation and Purification Technology, 2019, 213: 571-577. doi: 10.1016/j.seppur.2018.12.048 [30] LIU Y, LIU W, LI Y, et al. Layered inoculation of anaerobic digestion and anammox granular sludges for fast start-up of an anammox reactor[J]. Bioresource Technology, 2021, 339: 125573. doi: 10.1016/j.biortech.2021.125573 [31] 张冰, 吴林蔚, 文湘华. 全国城市污水处理厂中微生物群落的溯源分析[J]. 环境科学, 2019, 40(8): 3699-3705. [32] 韩文杰, 吴迪, 周家中, 等. CANON生物膜载体储存及活性恢复研究[J]. 中国环境科学, 2020, 40(5): 2062-2072. doi: 10.3969/j.issn.1000-6923.2020.05.024 [33] 齐泽坤, 王建芳, 钱飞跃, 等. 全程自养颗粒污泥快速启动及混合营养型脱氮性能分析[J]. 环境科学, 2020, 41(10): 4653-4660. [34] BOCK E, WAGNER M. Oxidation of inorganic nitrogen compounds as an energy source[J]. Prokaryotes, 2006, 2: 457-495. [35] BEAUMONT H, HOMMES N G, SAYAVEDRA-SOTO L A, et al. Nitrite reductase of Nitrosomonas europaea is not essential for production of gaseous nitrogen oxides and confers tolerance to nitrite[J]. Journal of Bacteriology, 2002, 184(9): 2557-2560. doi: 10.1128/JB.184.9.2557-2560.2002 [36] JOOSTE P J, HUGO C J. The taxonomy, ecology and cultivation of bacterial genera belonging to the family Flavobacteriaceae[J]. International Journal of Food Microbiology, 1999, 53(2-3): 81-94. doi: 10.1016/S0168-1605(99)00162-2 [37] 张玉龙, 陈雪丽, 吴云当. 电子穿梭体及其介导的环境与地球化学过程研究进展[J]. 生态环境学报, 2021, 30(1): 213-222. [38] MAHADEVAN R, BOND D R, BUTLER J E, et al. Characterization of metabolism in the Fe(III)-reducing organism Geobacter sulfurreducens by constraint-based modeling[J]. Applied and Environmental Microbiology, 2006, 72(2): 1558-1568. doi: 10.1128/AEM.72.2.1558-1568.2006 [39] FRANCIS C A, BEMAN J M, KUYPERS M M M. New processes and players in the nitrogen cycle: the microbial ecology of anaerobic and archaeal ammonia oxidation[J]. ISME Journal, 2007, 1: 19-27. doi: 10.1038/ismej.2007.8 [40] 史文超, 桂梦瑶, 杜俊逸, 等. 典型微塑料对好氧反硝化菌群脱氮特性及反硝化相关基因的影响[J]. 环境工程学报, 2021, 15(4): 1333-1343. doi: 10.12030/j.cjee.202009015 -



 下载:
下载: