-
镉是一种有毒有害元素,长期高镉暴露将增加致癌风险[1]。镉在地壳中含量约为0.1 mg·kg−1,主要与硫和铅锌等元素以化合物形式伴生存在。铅锌矿、闪锌矿、铜硫矿等含镉硫化矿物开采过程中氧化产生的酸性矿坑水 (acid mine drainage, AMD) 通常富集高浓度的镉,导致矿区周边土壤、地表水及地下水镉污染。调查显示,部分受采矿影响的河流中镉质量浓度高达0.43~3.10 mg·L−1[2-4],超过我国《生活饮用水卫生标准》 (GB 5749-2022) 中镉限值 (0.005 mg·L−1) 85~619倍[5]。可见,高镉AMD已成为矿区流域水土污染的主要来源,成为当前我国生态文明建设和矿区水资源供需矛盾加剧的一项重大挑战。
近年来,基于碱性工业副产物、农渔业废弃物资源化利用的AMD处理研究得到越来越多的关注[6-8],进而促进了“以废治废”的可持续发展理念。我国是水产品生产和消费大国,每年仅虾、蟹等甲壳类水产品的消费量就高达8.4×106 t,产生的虾、蟹等甲壳生物质 (外壳,也称外骨骼) 约2.5~3.4×106 t[9],其中仅3%~10%被资源化利用,其余则被当作固废处置,既造成资源浪费,增加处置成本,也可能导致环境污染。甲壳生物质主要由碳酸钙、甲壳素、蛋白质和脂质组成,不仅可作为碱性材料中和AMD酸度,也可作为重金属离子的捕捉剂,是具有应用前景的AMD修复材料[10]。KONG等[11]利用富磷虾壳回收废水中的铀,最大吸附量为318.0 mg·g−1。李平等[12]通过甲壳素脱乙酰基制备了巯基酯化壳聚糖,发现其对镉离子的最大镉吸附量达28.5 mg·g−1。HU等[13]利用龙虾壳提取的壳聚糖去除废水中的铜和铅离子,最大吸附量分别为676.2和120.0 mg·g−1。虽然,目前利用甲壳类生物质去除重金属的研究已有不少,但大多数研究者均是以甲壳素或壳聚糖为研究对象,而直接将甲壳生物质作为多功能修复材料修复富含重金属的AMD研究鲜见,并且对于酸性条件下重金属的去除过程与作用机制仍不明确,因此需进一步开展研究。
本研究选取了4种较为常见的甲壳生物质,包括基围虾、对虾、蛎虾和梭子蟹壳,测定了其主要成分,并在AMD模拟水样和恒定pH的AMD模拟水样中探究其对镉的去除性能与机制,为AMD绿色低碳修复治理提供理论依据。
-
硫酸镉 (CdSO4·8/3H2O) 、无水乙酸钠 (CH3COONa) 、冰醋酸 (C2H4O2) 、盐酸 (HCl) 、氢氧化钠 (NaOH) 均为分析纯;镉标准溶液购于国家标准溶液储备库,实验过程中溶液均由超纯水配置。本研究所用的基围虾、对虾、蛎虾和梭子蟹壳来自山东省烟台市某海洋生物有限公司。
-
将收集的甲壳生物质用去离子水清洗干净,然后放置在55 ℃恒温鼓风干燥箱中烘至恒重。干燥后的甲壳生物质用粉碎机 (XS-25B,上海兆申科技有限公司) 打磨成粉末,然后通过100目尼龙筛,所得到的粉末样品保存在自封袋中密封备用。
-
称取20.00 g粉末状甲壳生物质于500 mL烧杯中,然后按固液比1∶20的比例加入1 mol·L−1 HCl溶液,并置于磁力搅拌器上以150 r·min−1的速率反应2 h。反应后将悬浊液全部转移至50 mL离心管中,并在5 000 r·min−1下离心5 min,然后倒掉上清液。残余物用去离子水清洗,再离心分离,重复几次直至悬浊液pH值恒定。最后将残余物连同离心管置于冷冻干燥机中干燥至恒重,并记录干样品质量。根据反应前后甲壳生物质的质量差推算得到碳酸钙含量[14]。
另称取脱钙后的甲壳生物质10.00 g于150 mL反应瓶中,加入100 mL浓度为2 mol·L−1 NaOH溶液 (1∶20) ,搅拌均匀,放置恒温水浴摇床60 ℃反应2 h。反应后离心分离固液,残余物用去离子水清洗干净,方法同上。最后将残余物冷冻干燥至恒重,并记录干样品质量,所得到的干样品为甲壳素,根据反应前后损失的质量得到蛋白质和脂质含量[14]。
-
称取1 145.4 mg的硫酸镉试剂于500 mL烧杯中,加入一定体积的10 mmol·L−1氯化钠溶液,用玻璃棒搅拌直至试剂溶解。将溶液全部转移至1 000 mL容量瓶中,再用上述氯化钠溶液定容、混匀,即获得镉质量浓度为1 000 mg·L−1的母液,然后将母液转移至蓝盖瓶中备用。为进一步探明甲壳生物质中碳酸钙组分对酸性条件下镉离子去除的影响,本研究进行了恒定pH条件下的镉去除实验。恒定pH的模拟液是将一定剂量的硫酸镉试剂溶解于pH为4.5的乙酸-乙酸钠缓冲液中。pH为4.5的乙酸-乙酸钠缓冲液是由18.00 g的醋酸钠和9.80 mL的冰醋酸混匀后加水稀释至1 000 mL配制而得。pH为9.0的硼酸-氯化钾缓冲液是将3.09 g硼酸溶入500 mL 0.1 mol·L−1氯化钾溶液中,再加入210 mL 0.1 mol·L−1 NaOH溶液,混匀而得。
动力学实验:称取100.0 mg甲壳生物质置于250 mL具塞玻璃反应瓶中,加入200 mL镉质量浓度为20 mg·L−1的模拟液,然后将反应瓶置于150 r·min−1的水平振荡器中,温度为25 ℃,设置3个重复实验。在反应时间为10、20、40、60、120、240、480 min时用注射器抽取上清液5 mL,通过0.45 μm滤头过滤。滤液用2%硝酸酸化,然后测定镉残余浓度。采用伪一级动力学方程 (式(1)) 和伪二级动力学方程 (式(2)) 模拟镉的去除动力学过程,并计算相关参数。
式中:Qt为在t时刻的吸附量,mg·g−1;t为反应时间,min;k1、k2为反应速率常数。
等温实验:将母液梯度稀释,以获得镉质量浓度分别为5、10、20、40、80 mg·L−1的模拟液,具体操作方法同上,反应时间为8 h。采用Langmuir模型 (式(3)) 和Freundlich模型 (式(4)) 模拟镉的去除过程,并计算吸附等温线相关参数。
式中:
$ {{Q}}_{\text{e}} $ 为平衡时Cd2+的吸附量,mg·g−1;ce为反应平衡时溶液中Cd2+质量浓度,mg·L−1;Qm为最大吸附量,mg·g−1;KL为Langmuir吸附常数,L·mg−1;KF为Freundlich吸附常数,mg1-n·Ln·g−1;n为常数。 -
采用0.1 mol·L−1 NaOH和0.1 mol·L−1 HCl将溶液初始pH值分别调节至3.0~9.0,以评价溶液初始pH值对镉去除率的影响。通过将剂量为0.5 g·L−1的甲壳生物质分别加入到含有10 mg·L−1镉和1、5、10 mmol·L−1钾、钙、钠、镁的混合溶液中,评价常见阳离子对镉去除的影响。为了探究重金属复合污染情况下甲壳生物质对镉等重金属去除的影响,本研究开展了混合组分下铜、锌、铅和镉的去除实验。其中铜、锌、铅的浓度设置为与实际AMD中的相当,为1 mmol·L−1,镉质量浓度同样为10 mg·L−1。
-
上清液中的镉离子质量浓度采用电感耦合等离子体发射光谱仪 (ICP-OES,PerkinElmer Avio 200,USA) 测定,微克每升 (μg·L−1) 水平下的镉离子质量浓度采用电感耦合等离子体质谱仪 (ICP-MS,Perkin Elmer NexION 300X,USA) 测定。溶液的pH值采用pH电极 (STAR A214,USA) 测定。
采用X射线衍射仪 (XRD,RIGAKUD/MAX 2550/PC,Japan) 分析反应前后甲壳生物质的矿物相组分。采用赛默飞世尔科技公司 (ThermoFisher Scientific) 的傅立叶变换红外光谱仪 (FTIR,Nicolet iS10,USA) 分析反应前后甲壳生物质的官能团变化。
-
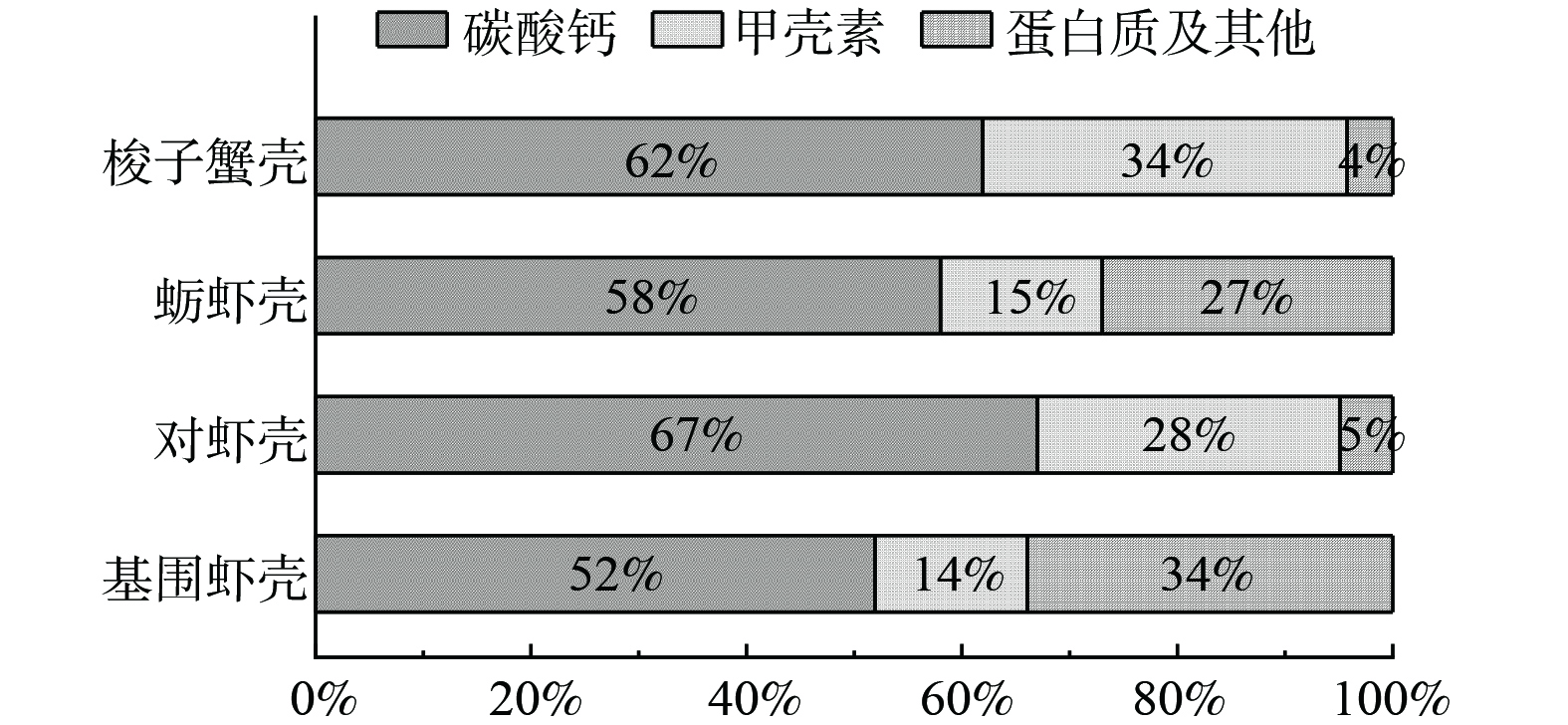
基围虾、对虾、蛎虾和梭子蟹壳中碳酸钙含量分别为52%、67%、58%和62% (图1),均超过50%,与碱渣中的碳酸钙含量 (56%) 相当,且高于纸浆厂废渣、钢渣、粉煤灰等其他碱性工业废弃物[6],说明甲壳生物质是潜在的碱性材料,可作为碳酸钙、氧化钙的替代品中和AMD酸度,调节其pH值。不同种类甲壳生物质中甲壳素的含量差异较大,范围为14%~34%,与前人报道的结果基本一致[15]。剩余的部分为蛋白质、脂质等,占比约4%~34%。
-
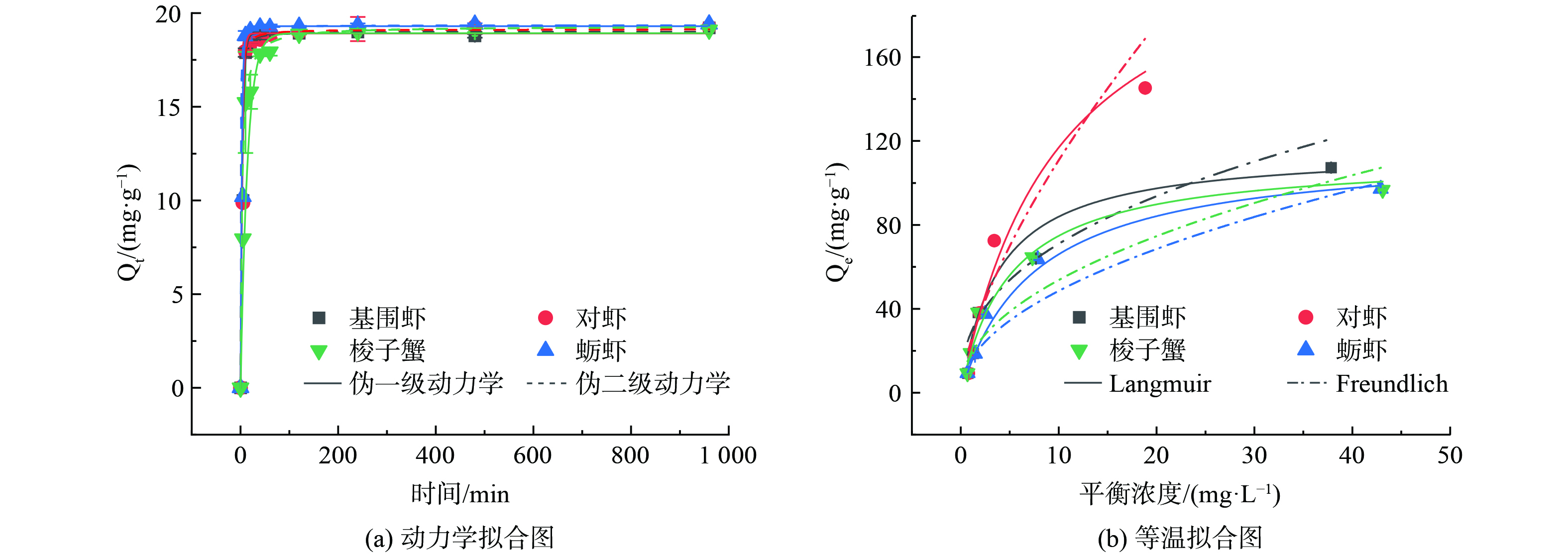
为探讨镉的去除过程及可能的速率控制步骤,采用伪一级和伪二级模型对动力学结果进行分析,如图2(a)和表1所示。4种甲壳生物质对镉的去除能力均在初始40 min内迅速增加,并在120~240 min内达到平衡 (图2(a)) 。与前人报道的甲壳类材料相比,本研究中甲壳生物质对重金属的去除效率更高[16, 17]。初始阶段甲壳生物质表面活性位点丰富,有利于镉离子从水溶液扩散到材料表面,这可能是镉离子快速去除的原因。随后,镉离子的去除以粒子内扩散为主,去除速率显著降低。动力学结果表明影响镉去除的速率限制步骤可能是粒子内扩散和外扩散。根据相关系数 (R2) ,4种甲壳生物质的动力学数据均与伪二级动力学模型拟合较好,R2 (0.968~0.997) 均大于伪一级模型 (R2 = 0.823~0.993) (表1) ,表明甲壳生物质对镉离子的去除过程可能受吸附质与吸附剂表面活性位点相互作用的调控。4种甲壳生物质对镉的去除动力学常数 (k) 差异较大,为0.018~0.155,这可能与材料的特性及各组分含量差异有关,但均高于前人报道的结果[18]。
4种甲壳生物质去除镉的等温线采用Langmuir和Freundlich模型拟合 (图2(b)) 。相关系数表明,Langmuir模型 (R2 = 0.971~0.994) 比Freundlich模型 (R2 = 0.803~0.872) 更好地描述了镉在甲壳生物质表面的去除行为 (表1) 。Langmuir模型假设吸附发生在均质表面,且为单层吸附模式。根据Langmuir模型计算出的四种甲壳生物质最大吸附量分别为对虾壳235.45 mg·g−1 > 蛎虾壳116.20 mg·g−1 > 基围虾116.04 mg·g−1 > 梭子蟹壳112.38 mg·g−1 (表1) 。相比于文献中其他吸附剂对镉的去除结果,本研究中4种甲壳生物质均有较好的镉去除能力[17, 19]。可见,以虾、蟹为代表的甲壳生物质是一种良好的镉污染水体修复材料。
-
为探究甲壳生物质在酸性条件下去除镉的微观机制,本研究分别在AMD模拟水样及恒定pH的AMD水样中进行了镉去除实验,并采用X射线衍射仪和傅立叶变换红外光谱仪对反应前后的甲壳生物质矿物相和官能团变化进行分析。
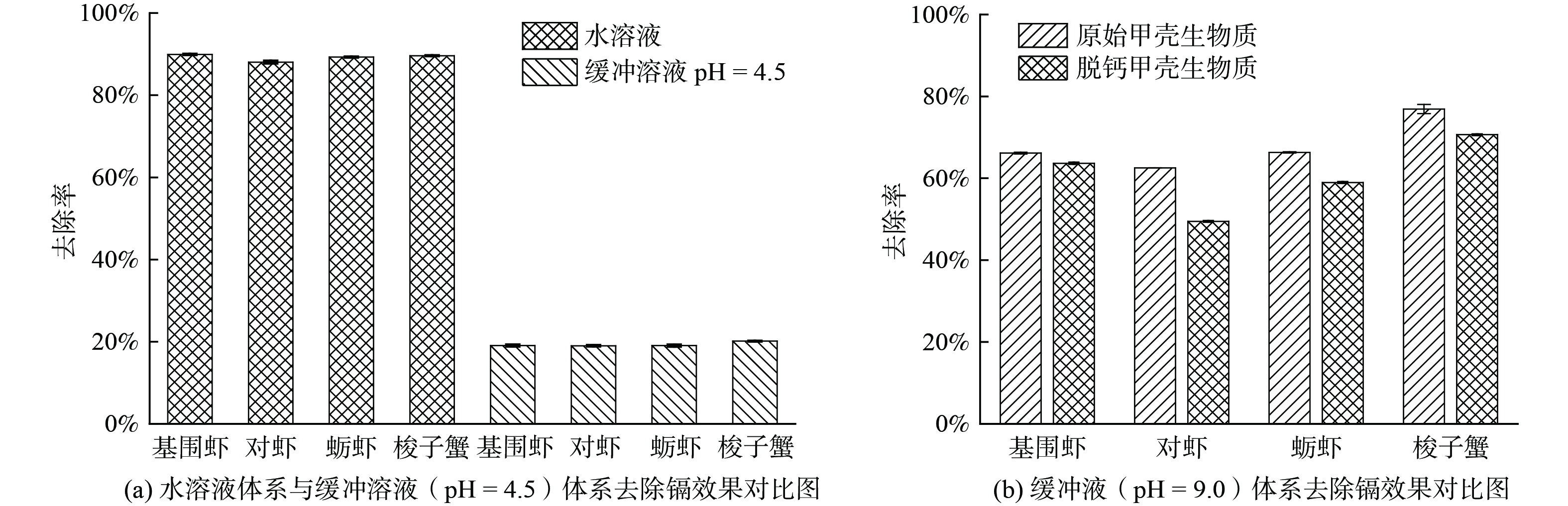
模拟水样中镉初始质量浓度为10 mg·L−1,初始pH为4.5,分别加入剂量为0.5 g·L−1的4种原始甲壳生物质后反应40 min。此时上清液中镉的残余质量浓度分别为1.006~1.195 mg·L−1,去除率约为88%~90% (图3(a)) 。反应后溶液pH值上升至9.0,这归因于甲壳生物质中碳酸钙组分的中和作用。碳酸钙通过中和作用消耗溶液中的质子 (H+) ,使pH值从初始的4.5上调至9.0。镉离子在酸性条件下迁移性高,不易被固相吸附和固定,而在碱性条件下,镉离子迁移能力显著降低,易附着在固相表面[16]。此外,在碱性条件下,碳酸根离子可与镉离子反应生成碳酸镉沉淀,进一步促进镉离子的去除。因此,为解析碳酸钙组分在镉离子的去除过程中发挥的作用,使用原始甲壳生物质在恒定pH AMD水样中于同样条件下进行了镉去除实验。结果表明,上清液中镉离子的残余质量浓度为7.870~8.099 mg·L−1,去除率为19%~21% (图3(a)) 。反应过程中pH值均保持恒定,为4.5,说明原始甲壳生物质中的碳酸钙组分在缓冲体系中消耗殆尽。原始甲壳生物质在缓冲液中的镉去除率比在水溶液中降低了约69%~71%。去除率的降低主要是由于缺少碳酸钙组分,未能通过生成碳酸镉沉淀及通过调节pH值影响镉离子的迁移能力来促进镉离子的去除。此外,使用原始甲壳生物质和脱钙甲壳生物质在pH为9.0的水溶液中进行了镉去除实验。结果表明,无论是原始甲壳生物质还是脱钙甲壳生物质,反应后溶液pH值与初始值基本一致。相比于原始甲壳生物质,脱钙甲壳生物质对镉离子的去除率约降低了23%~26% (图3(b)) 。该去除率的降低主要是由于脱钙甲壳生物质未能与镉离子生成碳酸镉沉淀导致的。上述观点在下文的XRD和FTIR结果中得到进一步支持。
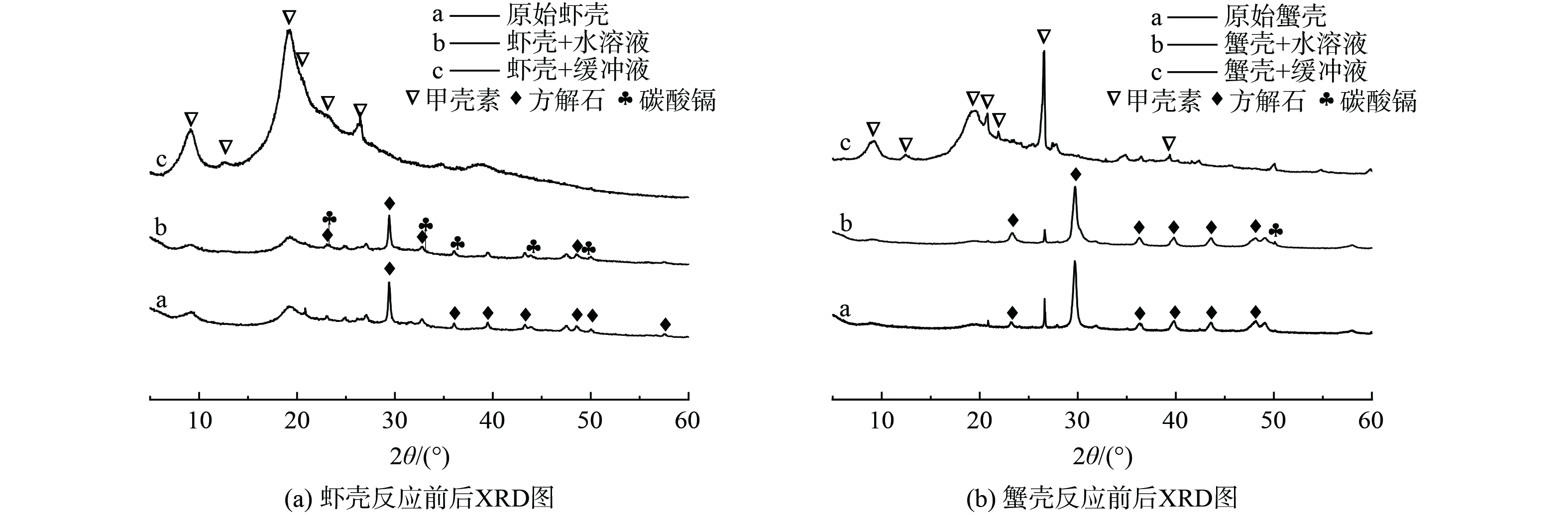
鉴于基围虾、对虾和蛎虾3种虾壳的表征结果相似,本研究仅展示基围虾的XRD和FTIR结果。如图4(a)所示,在原始虾壳的XRD图谱中存在2类衍射峰,其中位于2θ = 9.33°、12.71°、19.26°、20.81°、23.37°、26.34°位置的6个衍射峰,分别对应α-甲壳素的 (020) 、 (021) 、 (110) 、 (120) 、 (130) 和 (013) 结晶面[20];而位于2θ = 23.00°、29.39°、39.34°、43.00°、48.45°、57.30°位置的6个衍射峰,分别对应方解石的 (012) 、 (104) 、 (113) 、 (202) 、 (116) 和 (122) 晶面[20]。这说明甲壳生物质的主要矿物相为方解石和甲壳素,与主成分分析的结果一致。在模拟液中反应后,方解石衍射峰的强度略有降低,这可能是由于甲壳生物质中的部分碳酸钙与AMD模拟液中的质子 (H+) 发生中和作用被消耗导致的。而且,在模拟液反应后的甲壳生物质XRD图谱中 (图4(a)) ,在2θ = 23.485°、32.902°、36.415°、49.908°位置出现了3个小的衍射峰,分别对应于碳酸镉的 (012) 、 (006) 、 (110) 和 (018) 晶面 (JCPDS-1342) 。这说明有部分的镉离子与甲壳生物质中的碳酸钙反应,生成碳酸镉而被固定在材料表面。而在恒定pH的模拟液中反应后,甲壳生物质中的碳酸钙被缓冲液中的质子 (H+) 消耗殆尽,因此XRD图谱中未出现碳酸镉矿物相,并且α-甲壳素的衍射峰强度显著增强 (图4(a)) 。蟹壳反应前后的XRD图谱变化趋势与虾壳的基本一致,只是α-甲壳素、方解石和碳酸镉的衍射峰角度有轻微的偏移 (图3(b)) 。
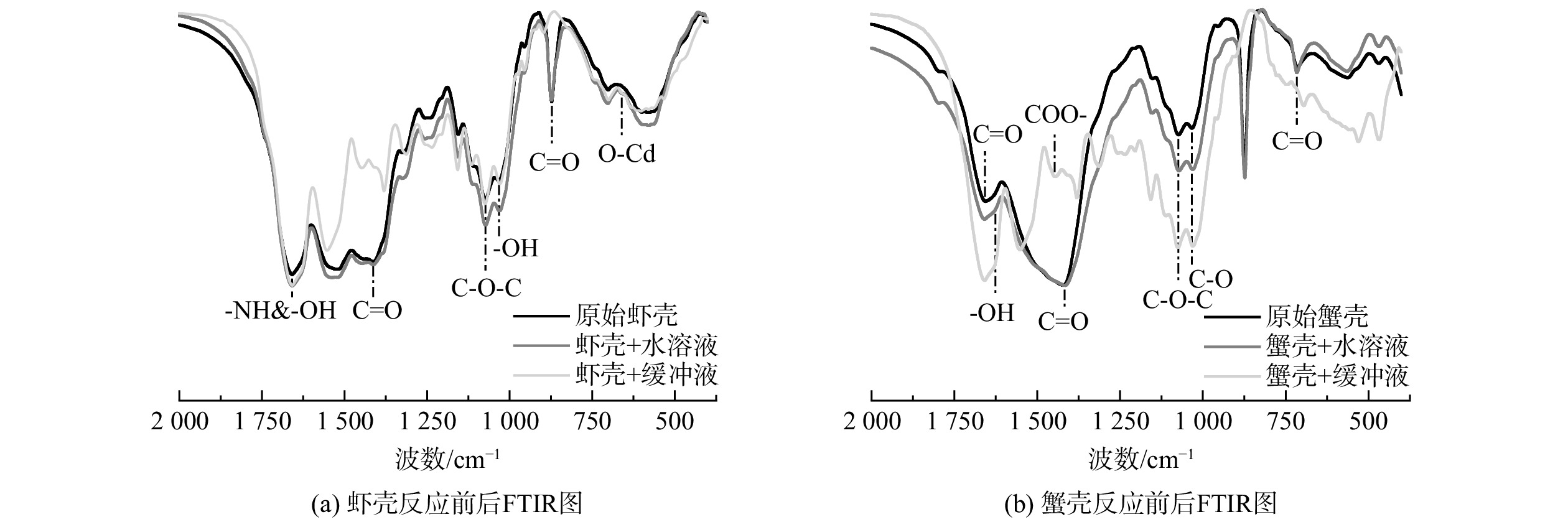
反应前后甲壳生物质的官能团变化如图5所示。位于1 658、1 319、1 074和875 cm−1处的吸收峰归因于酰胺和C=O的伸缩振动,属于甲壳素的特征吸收峰[21, 22]。在恒定pH的缓冲液中反应后,这些吸收峰强度明显增强,这是由于甲壳生物质中的碳酸钙损失殆尽,甲壳素占比显著增加导致的。该结果与XRD的结果一致。而且,在反应后甲壳生物质的FTIR图谱中660 cm−1处出现了1个小的吸收峰 (图5(a)) ,归属于Cd-O的伸缩振动,这可能是镉离子与材料表面的官能团相互作用产生的,说明这部分镉离子通过与官能团络合而被固定[23]。蟹壳反应前后的FTIR图谱与虾壳的基本一致,但反应后的蟹壳图谱中未出现Cd-O的伸缩振动,这可能是由于模拟液中镉离子浓度较低,发生的络合作用强度较小所致。
-
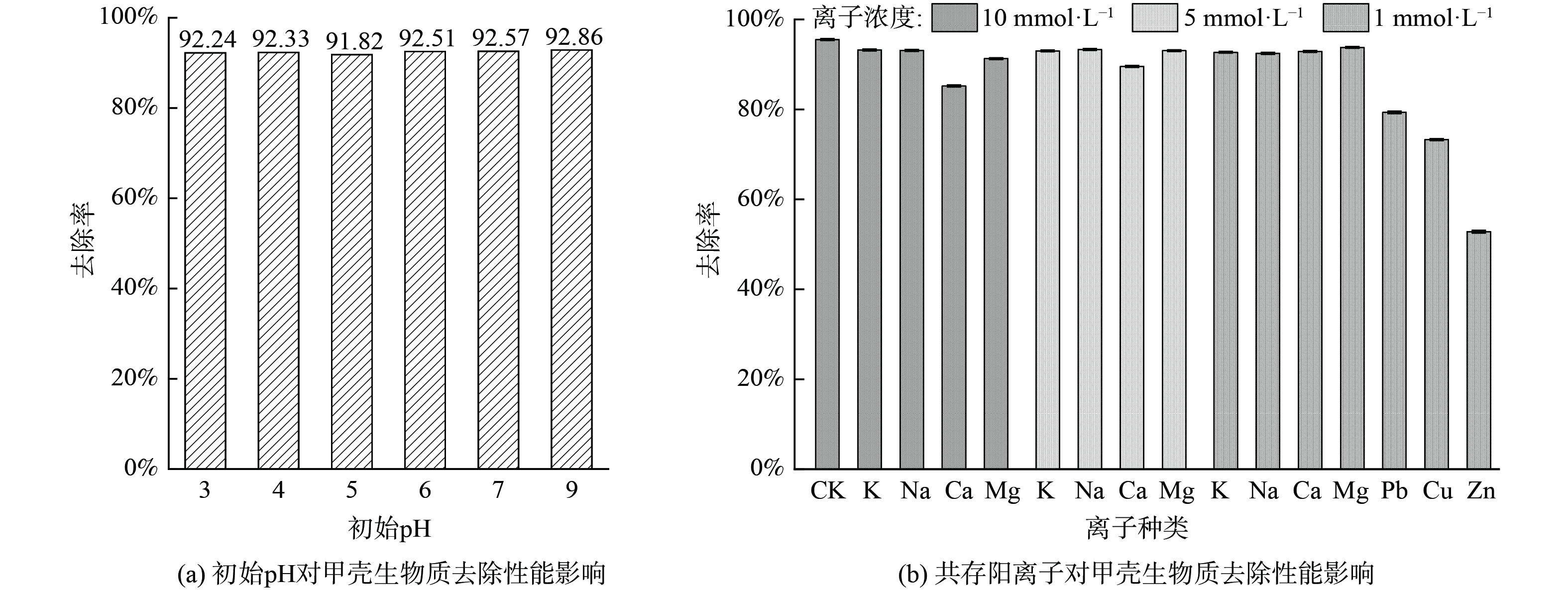
溶液初始pH值对4种甲壳生物质去除镉离子均无显著影响,如图6(a)所示 (以基团虾为例) 。这主要是由于甲壳生物质中含有丰富的碳酸钙 (52%~67%) 。即使溶液初始pH值为3.0,其含有的碳酸钙也能快速与溶液中的酸度中和,将pH值上调至9.0左右。这说明甲壳生物质尤其适用于含重金属离子的酸性废水的修复。由于各甲壳生物质之间对于镉去除无显著差异,故以基围虾虾壳为例展示去除效果如图6(a)。
钾、钙、钠、镁等阳离子是污/废水中最常见的共存阳离子,因此,本研究探究了这些共存阳离子在不同浓度梯度 (1、5、10 mmol·L−1) 下对甲壳生物质去除镉的影响。结果表明,在3个浓度梯度下这些共存阳离子对甲壳生物质去除镉均无显著影响;除了钙,在10 mmol·L−1下略微降低了甲壳生物质对镉的去除率 (图6(b)) 。这说明甲壳生物质在实际富含镉的酸性废水的修复中具有巨大的应用潜力。但当体系中存在铜、锌、铅等重金属,甲壳生物质对镉的去除率降低了21%~45% (图6(b)) ,说明铜、锌、铅抑制了甲壳生物质对镉的去除,这可能是由于这些亲铜元素之间发生了竞争吸附作用。
-
1) 甲壳生物质富含碳酸钙和甲壳素,是具有应用前景的高镉酸性矿坑水修复材料,对镉去除能力高达112.38~235.45 mg·g−1。
2) 在镉离子去除过程中,碳酸钙组分不仅可通过中和作用消耗质子提高溶液pH值,为甲壳生物质固定镉离子提供有利条件,也可与镉离子直接生成碳酸镉沉淀促进其在甲壳生物质表面的固定。
3) 此外,甲壳素组分上的活性位点如羟基、羰基等官能团也可与镉离子发生络合作用。本研究为甲壳生物质在AMD治理领域的应用开辟新途径,研究结果有助于为AMD绿色可持续修复治理提供理论依据。
甲壳生物质去除酸性矿坑水中镉的性能与机制
Efficiencies and mechanism of crustacean biomasses on removing cadmium in acid mine drainage
-
摘要: 采用低成本、可持续修复材料处理酸性矿坑水 (acid mine drainage, AMD) 具有重要的科研价值和应用前景。选取基围虾、对虾、蛎虾和梭子蟹壳4种甲壳生物质,探究其对AMD模拟水样及恒定pH的AMD水样中镉的去除性能与机制。结果表明:甲壳生物质具有良好的镉去除能力 (112.38~235.45 mg·g−1) ,其含有丰富的碳酸钙对镉去除起了至关重要的作用,可通过中和作用调高AMD的pH值,降低镉的迁移能力;也可与镉离子形成碳酸镉沉淀,促进镉的固定。此外,甲壳生物质中大量的羟基、羧基等官能团可通过络合作用捕获镉离子。研究结果为甲壳生物质的资源化利用和废弃矿山AMD的低成本、可持续修复提供了理论依据。Abstract: Using low-cost and sustainable remediation materials to treat acid mine drainage (AMD) has important scientific research values and application potentials. In this study, four crustacean biomasses including Metapenaeus ensis, prawn, talon shrimp and swimming crab shells were selected to explore the performance and mechanism of cadmium removal in simulated AMD samples with and without constant pH. It was concluded that crustacean biomasses have excellent cadmium removal capabilities ranging from 112.38 to 235.45 mg·g−1. Their abundant calcium carbonate played a crucial role in the cadmium removal, in which not only the pH values of AMD were increased by neutralization with reduced cadmium mobilization, but also the cadmium was stabilized by forming cadmium carbonate precipitates. In addition, a large number of hydroxyl, carboxyl and other functional groups in crustacean biomasses can also capture cadmium ions through the complexation. These findings provide theoretical basis in promoting the resource utilization of crustacean biomasses and the low-cost and sustainable remediation of AMD from abandoned mines.
-
Key words:
- acid mine drainage /
- crustacean biomass /
- cadmium /
- shrimp shell /
- resource utilization
-

-
表 1 甲壳生物质去除镉的动力学和等温线模型参数
Table 1. Parameters of kinetic and isotherm models for Cd removal on crustacean biomasses
动力学参数 伪一级模型 伪二级模型 Qe1/(mg·g−1) k1/(min−1) R2 Qe2/(mg·g−1) k2/(g·mg−1 ·h−1) R2 基围虾 18.914 0.255 0.930 19.015 0.090 0.984 对虾 18.919 0.295 0.823 19.134 0.077 0.973 蛎虾 19.300 0.363 0.993 19.347 0.155 0.997 梭子蟹 18.926 0.071 0.942 19.295 0.018 0.968 等温线参数 Langmuir模型 Freundlich模型 Qmax/(mg·g−1) KL/(L·mg−1) R2 KF/(L·mg−1) n R2 基围虾 116.038 0.261 0.971 28.195 2.494 0.866 对虾 235.447 0.099 0.983 23.973 1.504 0.803 蛎虾 116.204 0.131 0.994 15.440 2.011 0.867 梭子蟹 112.377 0.199 0.974 17.995 2.106 0.872 -
[1] EFSA. Cadmium dietary exposure in the European population[S]. 2012, 10: 2551. [2] 周立祥. 生物矿化: 构建酸性矿山废水新型被动处理系统的新方法[J]. 化学学报, 2017, 75(6): 552-559. [3] 陈宏坪, 韩占涛, 沈仁芳, 等. 废弃矿山酸性矿井水产生过程与生态治理技术[J]. 环境保护科学, 2021, 47(6): 73-80. [4] 艾雨露, 陈宏坪, 陈梦舫等. 全球主要产煤国煤矿AMD污染特征与治理技术 [J]. 煤炭学报, 2023, 48 (12): 4521-4535. [5] 国家市场监督管理总局, 国家标准化管理委员会. 生活饮用水卫生标准: GB 5749-2022[S]. 2022. [6] CHEN H P, AI Y L, JIA Y F, et al. Effective and simultaneous removal of heavy metals and neutralization of acid mine drainage using an attapulgite-soda residue based adsorbent[J]. Science of the Total Environment, 2022, 843: 157120. doi: 10.1016/j.scitotenv.2022.157120 [7] CHEN H P, LI J, DAI Z B, et al. In-situ immobilization of arsenic and antimony containing acid mine drainage through chemically forming layered double hydroxides[J]. Science of the Total Environment, 2023, 903: 166601. doi: 10.1016/j.scitotenv.2023.166601 [8] AI Y L, CHEN H P, CHEN M F, et al. Characteristics and mechanism of effectively capturing arsenate by sulfate intercalated and self-doping layered double hydroxide derived from field acid mine drainage[J]. Separation and Purification Technology, 2024, 331: 125763. doi: 10.1016/j.seppur.2023.125763 [9] 农业农村部渔业渔政管理局, 全国水产技术推广总站, 中国水产学会. 2022中国渔业统计年鉴[R]. 2023. [10] 贾郁菲, 陈宏坪, 张文影, 等. 甲壳生物质修复废弃煤矿酸性矿坑水研究进展 [J/OL]. 环境保护科学, 1-8[2024-01-17] https://doi.org/10.16803/j.cnki.issn.1004-6216.202303014. [11] KONG L J, ZHANG H M, JI W, et al. Recovery of phosphorus rich krill shell biowaste for uranium immobilization: A study of sorption behavior, surface reaction, and phase transformation[J]. Environmental Pollution, 2018, 243: 630-636. doi: 10.1016/j.envpol.2018.08.023 [12] 李平, 金兰淑, 林国林, 等. 巯基酯化壳聚糖的合成及对Cd2+的去除性能研究[J]. 环境工程学报, 2014, 8(1): 254-259. [13] HU W Q, CHEN S and JIANG H. Crayfish shell waste as safe biosorbent for removal of Cu2+ and Pb2+ from synthetic wastewater[J]. Chinese Journal of Chemical Physics, 2022, 35: 842-852. doi: 10.1063/1674-0068/cjcp2001011 [14] ABDOU E S, NAGY K S and ELSABEE M Z. Extraction and characterization of chitin and chitosan from local sources[J]. Bioresource Technology, 2008, 99: 1359-1367. doi: 10.1016/j.biortech.2007.01.051 [15] KURITA K. Chitin and chitosan: Functional biopolymers from marine crustaceans[J]. Marine Biotechnology, 2006, 8: 203-226. doi: 10.1007/s10126-005-0097-5 [16] PINTO P X, AL-ABED S R and EISMAN D J. Biosorption of heavy metals from mining influenced water onto chitin products[J]. Chemical Engineering Journal, 2011, 166: 1002-1009. doi: 10.1016/j.cej.2010.11.091 [17] KHAN A, BADSHAH S and AIROLDI C. Biosorption of some toxic metal ions by chitosan modified with glycidylmethacrylate and diethylenetriamine[J]. Chemical Engineering Journal, 2011, 171: 159-166. doi: 10.1016/j.cej.2011.03.081 [18] BOULAICHE W, HAMDI B and TRARI M. Removal of heavy metals by chitin: Equilibrium, kinetic and thermodynamic studies[J]. Applied Water Science, 2019, 9: 1-10. doi: 10.1007/s13201-018-0879-3 [19] YANG J, LI M, WANG Y F, et al. High-strength physically multi-cross-linked chitosan hydrogels and aerogels for removing heavy-metal ions[J]. Journal of Agricultural and Food Chemistry, 2019, 67: 13648-13657. doi: 10.1021/acs.jafc.9b05063 [20] 吴琦, 戴凌青, 杨文叶, 等. 虾壳粉对水溶液中阴、阳离子型染料的吸附[J]. 环境工程学报, 2019, 13(3): 594-606. [21] 晏侬洋, 王美丹, 张权, 等. 基于电镜与红外光谱技术研究不同处理方式对小龙虾虾壳粉表观结构的影响[J]. 食品安全质量检测学报, 2021, 12(8): 3182-3186. [22] DOU D T, WEI D L, GUAN X, et al. Adsorption of copper (II) and cadmium (II) ions by in situ doped nano-calcium carbonate high-intensity chitin hydrogels[J]. Journal of Hazardous Materials, 2022, 423: 127137. doi: 10.1016/j.jhazmat.2021.127137 [23] SANGEETHA K, PANGELIN V, SUDHA P N, et al. Novel chitosan based thin sheet nanofiltration membrane for rejection of heavy metal chromium[J]. International Journal of Biological Macromolecules, 2019, 132: 939-953. doi: 10.1016/j.ijbiomac.2019.03.244 -



 下载:
下载: