-
微藻的细胞结构简单、生长繁殖速度快,在自然水体中广泛存在[1-2],水中的C、N、P等物质可以作为微藻的生长基质,微藻利用进行C、N、P等物质生长繁殖. 微藻作为结构最简单的低等植物,培养较容易,环境适应能力和生存能力极强. 在生长繁殖过程对水中C、N、P等物质进行同化同时实现污水的净化[3]. 微藻中常用于污水处理的微藻种类大多是光合自养型,且为单细胞绿藻,它们对许多污水都具有耐受性,且油脂或碳水化合物的积累潜力较高[4]. 此外,微藻细胞中可积累大量甘油三脂(TAGs),使其成为生物柴油的重要来源[5].
微藻去除氮磷的理论早在1957年就有学者提出[6]. 污水中氮的主要以氨氮、硝酸盐、亚硝酸盐、有机氮的形式存在. 微藻利用细胞膜的同化作用吸收无机氮,利用 ATP、硝酸盐还原酶的作用,将硝酸盐转化成亚硝酸盐,在亚硝酸盐还原酶催化作用下,亚硝酸盐还原为铵盐,还原后的铵盐成为碳骨架的组成部分,最后藻细胞将其合成为氨基酸或者蛋白质[7]. 微藻对污水中磷的去除主要是吸收水中的无机磷,或pH等条件变化使磷酸盐产生沉淀进而被微藻吸附或沉降,主要利用磷的形式为
${\rm{H}}_2{\rm{PO}}_4^- $ 和${\rm{HPO}}_4^{2-}$ [8].已经有很多的研究表明,微藻不仅可以对市政污水进行有效去除,而且菌藻共生可以促进微藻生长[9-11]. Ma等[11]的研究结果表明,初始藻类浓度对细菌的生长的影响较大,细菌的存在对藻类的生长方式有显著影响,可在培养初期提高藻类生物量和营养去除率表明藻类培养初期藻类与细菌之间存在共生关系. Wang等[12]筛选出Exiguobacterium和Bacillus licheniformis和小球藻用于净化养猪废水,结果表明,共培养细菌可能会分泌一些代谢产物作为酶激活剂,并且微藻和细菌之间的酶学可能存在协调机制使得菌藻共生去除污水中TN、TP、氨氮等具有更好的效果. Huo等[13]研究了小球藻和醋生产废水中细菌共培养去除氮磷和生物量积累,结果表明菌藻共生显著提高了TN、TP等的去除率,但平均生长速率有所下降. Wang等[14]的研究表明,菌藻共培养不仅提高了微藻的脂质含量,还导致脂肪酸和蛋白质的组成发生变化. Kong等[15]的研究结果表明,菌藻共培养条件下,1 g·L−1葡萄糖可促进藻生物量的积累和光合色素的合成,5 g·L−1葡萄糖可促进脂质的积累而抑制叶绿素的合成. 然而,目前在该领域中使用微藻细菌的仍处于早期阶段[14,16-17].
在本研究中,在相同的光照条件下,在不同类型污水中进行菌藻共培养,测定栅藻的生长速率、光合作用效率、蛋白质、碳水化合物和总脂含量、官能团分析等,分析栅藻在不同条件菌藻共培养的差异和影响. 对污水中微藻的氮磷利用率进行进一步分析.
目前相关领域大多数研究主要对利用微藻改善污水水质,培养环境主要是利用人工污水培养基或灭菌污水,而利用实际生活污水处理与微藻培养制备生物柴油耦合研究较少,对微藻培养后菌群结构变化研究较少[9].
本文测定了菌藻共培养末期的菌群结构多样性,通过数据对比分析了影响栅藻生长和油脂合成的优势菌属.
-
原始藻株为Desmodesmus sp.(FACHB-2042)购买于中国科学院水生生物研究所淡水藻种库. 培养使用BG11培养基(100 mL)在200 mL锥形瓶进行自养培养. 该培养基包括:柠檬酸铁铵(3 g·L−1)、柠檬酸(3 g·L−1)、乙二胺四乙酸二钠镁(0.5 g·L−1)、NaNO3(30 g·L−1)、K2HPO4(0.78 g·L−1)、MgSO4·7H2O(1.5 g·L−1)、CaCl2·2H2O(18 g·L−1)、NaCO3(20 g·L−1)、NaMoO4(0.391 g·L−1)、MnCl2·4H2O(1.81 g·L−1)、ZnSO4·7H2O(0.222 g·L−1)、H3BO4(2.86 g·L−1)、Co(NO3)·6H2O(0.049 g·L−1)、CuSO4·5H2O(0.079 g·L−1). 菌藻共培养在不同处理类型的污水中进行,生活污水取自于校园内的两处生活污水,对其分别进行过滤(沉淀污水取上清液过0.45 μm滤膜)和沉淀(原水经12 h静置沉淀后取上清液)处理,分别进行高压灭菌和未灭菌处理. 在不同类型污水进行栅藻培养,初始吸光度OD680为0.1(OD680即为在680 nm处的吸光度),培养时间为20 d左右. 详细处理如表1所示. 在恒温光照培养箱中进行培养,培养条件为80 μmol·m−2·s−1,光照周期为12 h:12 h(光:暗),生长温度保持在25 ℃,每天摇藻3—4次以保证藻液能够进行充足的气体交换,随机更换培养瓶位置,以保证各个培养瓶中的微藻光合作用均匀.
培养时间为20 d左右,在0、2、4、6、8、10等偶数天测定其吸光度和光合效率. 期间用快速的尼罗红染色法测定其甘油三酯浓度,在培养结束时收集微藻生物质,通过离心(10000 r·min−1 , 15 min)收集微藻生物质. 使用冷冻干燥机(FD-1A-50)将湿的藻泥干燥以获得干燥粉,并保存在−20 ℃进行进一步的分析.
-
使用紫外分光光度计UV-6000测定栅藻在680 nm处的吸光度(OD680),计算其比生长速率. 最后对浓缩后藻液进行冷冻干燥,利用称重法测定培养末期生物量. 生物量(DW,mg·L−1)采用下式计算.
污水中的总氮用碱性过硫酸钾消解紫外分光光度法(GB11894-89)进行测定;总磷采用钼酸铵分光光度法(GB11893—89)进行测定;氨氮的测定采用纳氏试剂分光光度法(HJ535—2009).
-
栅藻的光合荧光参数测定采用调制叶绿素荧光成像系统(IMAGING-PAM),包括Fv/Fm、Y(Ⅱ). 在测量之前,将每种培养物取1.5 mL至2.0 mL离心管中,暗适应10 min,设定测量光强度、光化光强度、饱和脉冲光强度,使用内置的程序软件测量叶绿素荧光参数,其计算公式如下:
Fv/Fm表示PSII的最大光化学量子产量,其中Fm表示暗适应后的最大荧光产额,F0是暗荧光产额.
Y(Ⅱ)表示任意光照状态下PSII的实际量子产量(实际光合能力、实际光合效率),反映了光合链上电子传递的效率. 其中,
$F_{m}^{\prime} $ 为光下最大荧光产额,F为荧光产额. -
采用优化的尼罗红法[18]测定藻细胞内的甘油三脂浓度. 具体操作过程如下:取3 mL藻液和3 mL蒸馏水置于10 mL离心管,摇匀后均分两份,取1 mL25%二甲基亚砜分别加入,使其改变细胞通透性,其中一份加入0.05 mL尼罗红,利用点动机震荡使其混匀,避光染色时间为15 min,利用紫外分光光度计(日本日立,F-7000)测定570 nm处的吸光度(A570),采用标准加入法[19]制作标准曲线,甘油三酯浓度TAG(mg·L-1)计算如下式:
-
碳水化合物测定方法是苯酚-硫酸法[20]. 蛋白质测 定方法是Bradford法[21]. 总脂含量的测定方法使用改进的Bligh-Dyer法[22]. 叶绿素a的提取使用无水乙醇加超声. 过程如下:藻液取5 mL,抽滤使用0.45 μm滤膜,将剪碎后的滤纸置于50 mL离心管,使用10 mL无水乙醇震荡混匀,超声30 min,离心(10000 r·min−1,21 ℃)15 min,取5 mL上清液,用紫外可见分光光度仪(UV-2600)测定其吸光度.
-
藻菌聚集颗粒的有机官能团测定使用傅里叶漫反射红外光谱仪(Nicolet IS50). 样品量为2 mg,预处理使用冷冻干燥机(FD-IA-50),真空冷冻干燥(−50 ℃)成藻粉,光谱纯的溴化钾烘干4 h(120 ℃),藻粉和溴化钾以1:100的比例在玛瑙研钵中研磨混匀,放入压片扫描分析,波数范围为500—4000 cm−1.
-
基于16S rRNA的标准细菌V3V4区基因测序,并对测序结果的微生物多样性进行分析以研究培养末期污水的菌群结构. 主要包括:DNA提取、PCR扩增、电泳验证、PCR产物纯化及浓度测定、测序及测序结果分析. DNA提取使用的引物序列为338F:5’-ACTCCTACGGGAGGCAGCA-3’和806R:5’-GGACTACHVGGGTWTCTAAT-3’,对标准细菌16S V3V4高可变区进行序列扩增. 使用1.20%的琼脂糖凝胶电泳(北京六一,DYY-6C)验证,条件为电压恒压120 V,电流约为80 mA,时间20 min. Marker采用DL2000,紫外凝胶成像系统用于观察DNA片段大小. 群落DNA片段双端(Paired-end)测序的测序平台为Novaseq-PE250(Illumina,USA)平台.
-
所有样品均一式3份,对每个样品做3次重复测量,数据为平行样品的平均值±标准差. 独立样品数据分析采用SPSS软件20.0对所得数据进行单因素方差分析(P<0.05).
-
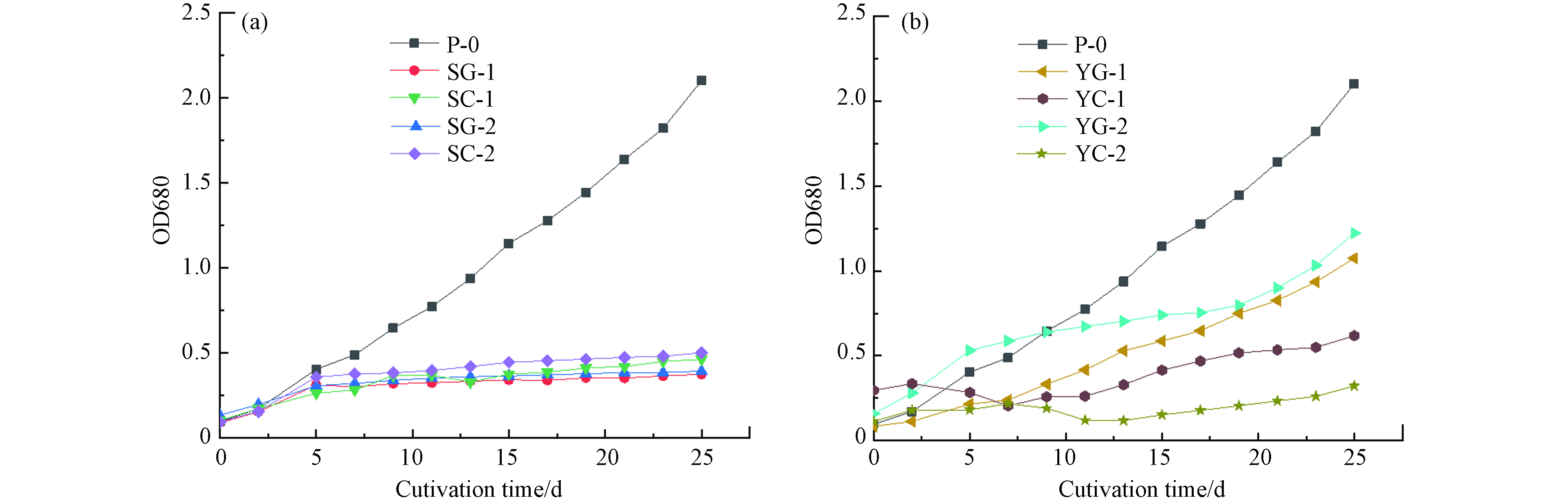
栅藻在自养和菌藻共培养中生长状况不同,如图1所示,其中自养条件下OD680在第25天达到2.1,干重在培养末期(第25天)达到567.93 mg·L−1. 为测定污水水质对菌藻共培养的影响,初始水质指标见表2,微藻细胞生物质平均元素组成研究表明,N/P摩尔比高于30:1会导致磷限制,N/P摩尔比小于5:1则会导致氮限制[23]. 生活污水I的N/P摩尔比均高于30:1,因此在其中存在磷限制,该污水中栅藻的光密度培养末期在0.5左右,而在生活污水Ⅱ中N/P摩尔比均大于5:1小于30:1,生活污水Ⅱ中栅藻的光密度在第28天最高达到1.23,N/P摩尔比可能是生活污水Ⅱ中栅藻光密度较生活污水I中高的原因.
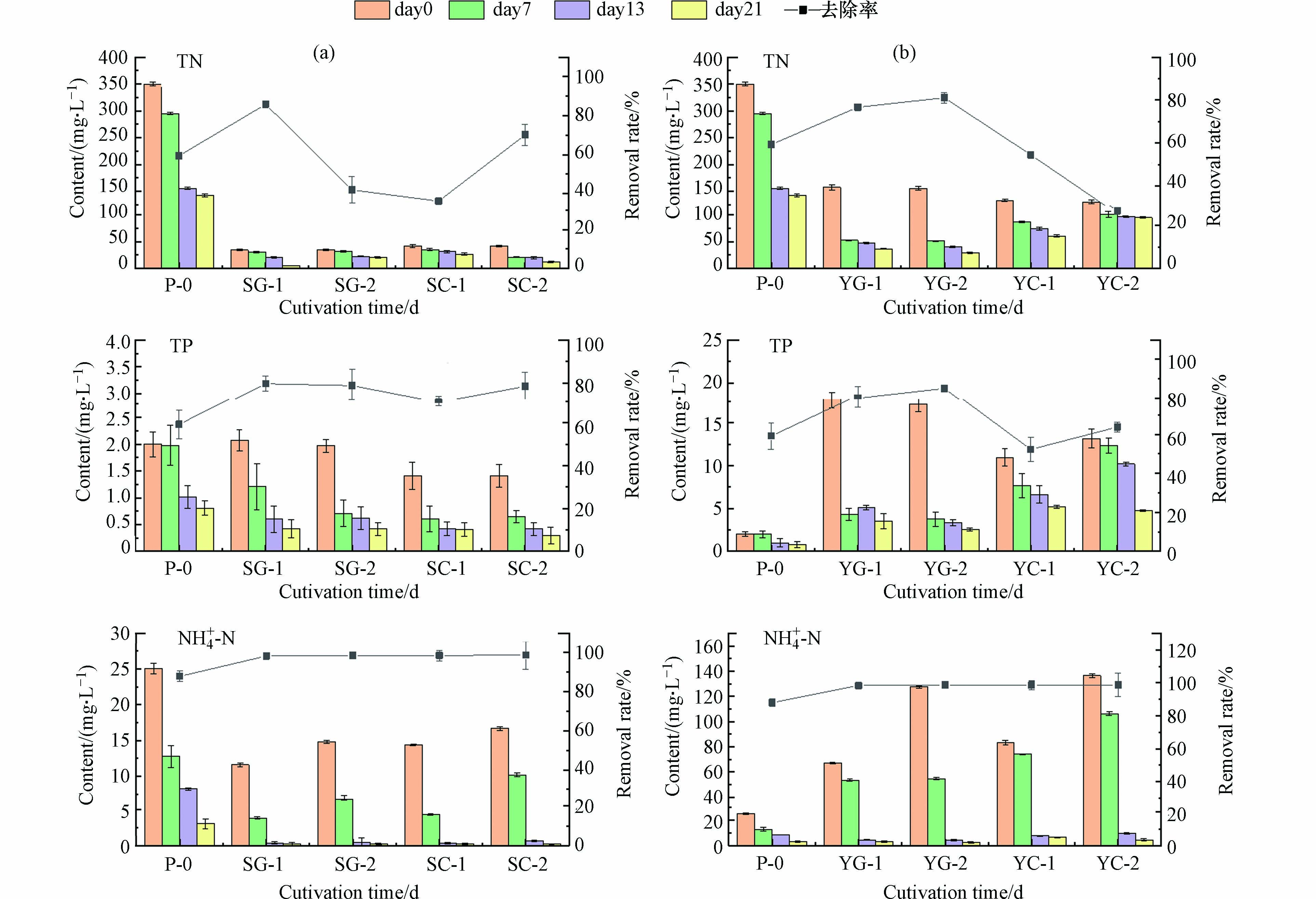
城市污水中微藻生长可利用的氮源主要有氨氮、硝态氮、亚硝态氮、有机氮等,转氨基作用可将氨氮直接合成氨基酸,且氮源的各种形态中氨氮的利用率最高[24].
在许多以市政污水二级出水为基质的研究中,微藻对氨氮的去除率都比硝态氮高[25-26]. 栅藻在不同污水类型中的的总氮总磷氨氮变化曲线和去除率见图2,其中NH4+-N的去除率较为明显,菌藻共培养的氨氮去除率均大于90%,生活污水Ⅱ中YG-2的氨氮去除率最高,为97.93 %. 对于TN的去除,生活污水Ⅱ过滤污水表现出较高的TN去除率,YG-2的去除率大于YG-1,可能菌藻共培养体系有助于氮磷去除. 已有研究表明细菌可以在培养初期提高微藻氮磷去除率[11]. 在生活污水I和生活污水Ⅱ中,未灭菌总磷的去除率比灭菌去除率高,说明菌藻共培养细菌的参与提高了栅藻对磷的去除.
也有研究表明,一些细菌可以在有氧的环境下超量摄取其平衡生长所需的磷酸盐[27]. Ma等[11]的研究表明,培养初期细菌有利于提高微藻的生长速度,且培养初期有助于微藻对氮磷的利用,通过分析显示细菌在培养初期参与了氮降解,微藻生物质积累致使磷的去除. 但在碱性条件下(pH>8.5),除磷途径主要是通过阳离子沉淀去除[28]. 生活污水Ⅱ生长条件是碱性环境(pH均大于8.5),推断其除磷途径可能是阳离子沉淀.
-
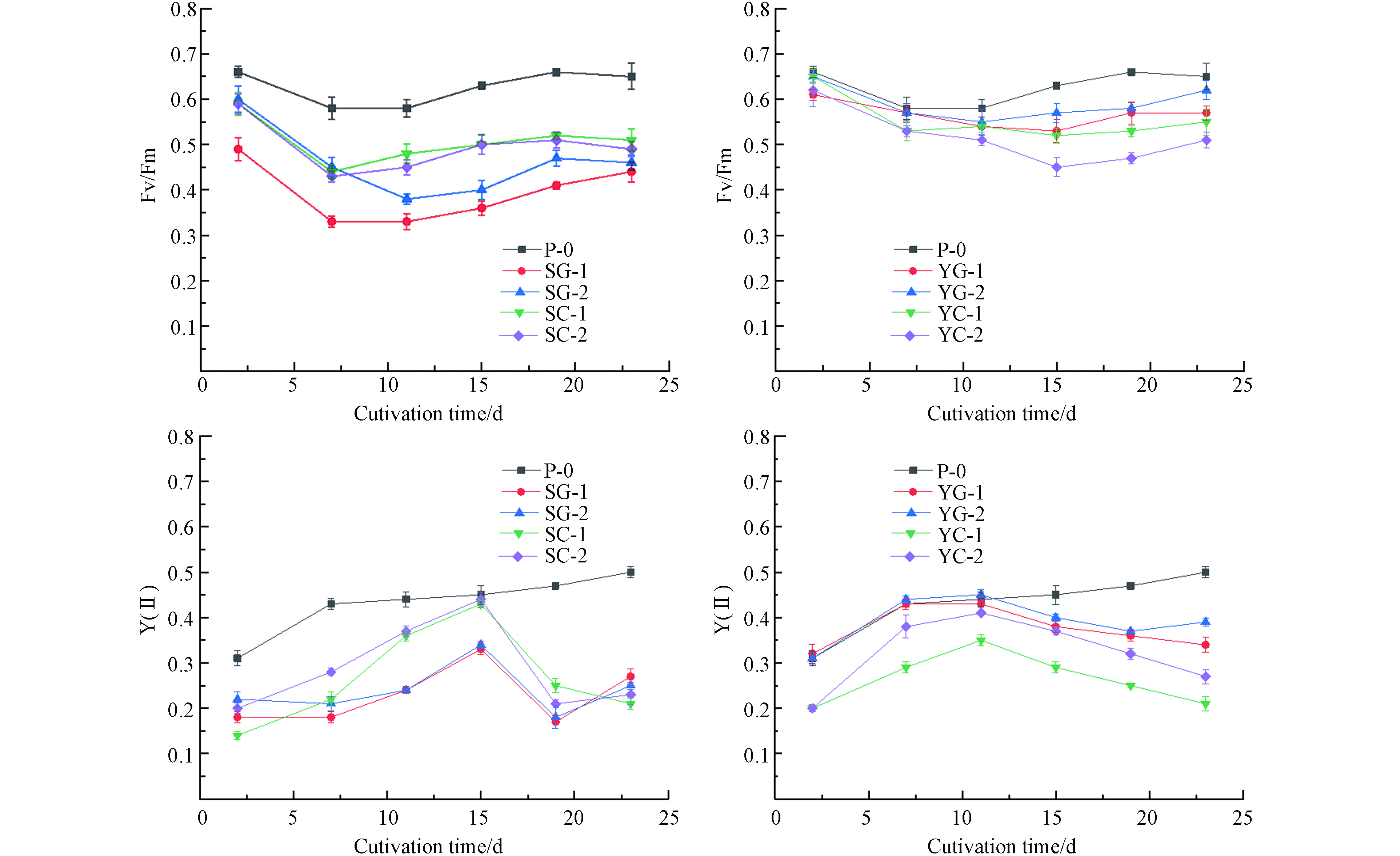
测定了自养和菌藻共培养下栅藻光系统II(PSⅡ)相关的光合参数:Fv/Fm,Y(Ⅱ). Fv/Fm是PSII最大光化学量子产量,即最大光能转化效率,反映植物的潜在光合作用能力,在受到环境胁迫时其值会降低,一般用来分析植物生长是否受到条件抑制[29].
如图3所示,自养条件下Fv/Fm均高于菌藻共培养,相比较受到的环境胁迫较小,菌藻共培养条件下栅藻生长需要时间适应。生活污水I中5 d后Fv/Fm逐渐增大,生活污水Ⅱ约10 d后Fv/Fm逐渐增大.
Y(Ⅱ)是任意光照状态下PSII的实际量子产量(实际光合能力、实际光和效率),反映了光合链上的电子传递效率. 在前15d内呈现上升趋势,随着栅藻生长,可能是受到污水中营养物质的限制,15 d之后进入相对生长下降期. 自养和菌藻共培养条件对比,自养条件下的实际光和效率Y(Ⅱ)较高. 未灭菌组实际光合效率均高于灭菌组,说明细菌的存在可能使光系统Ⅱ反应中心活性增强.
-
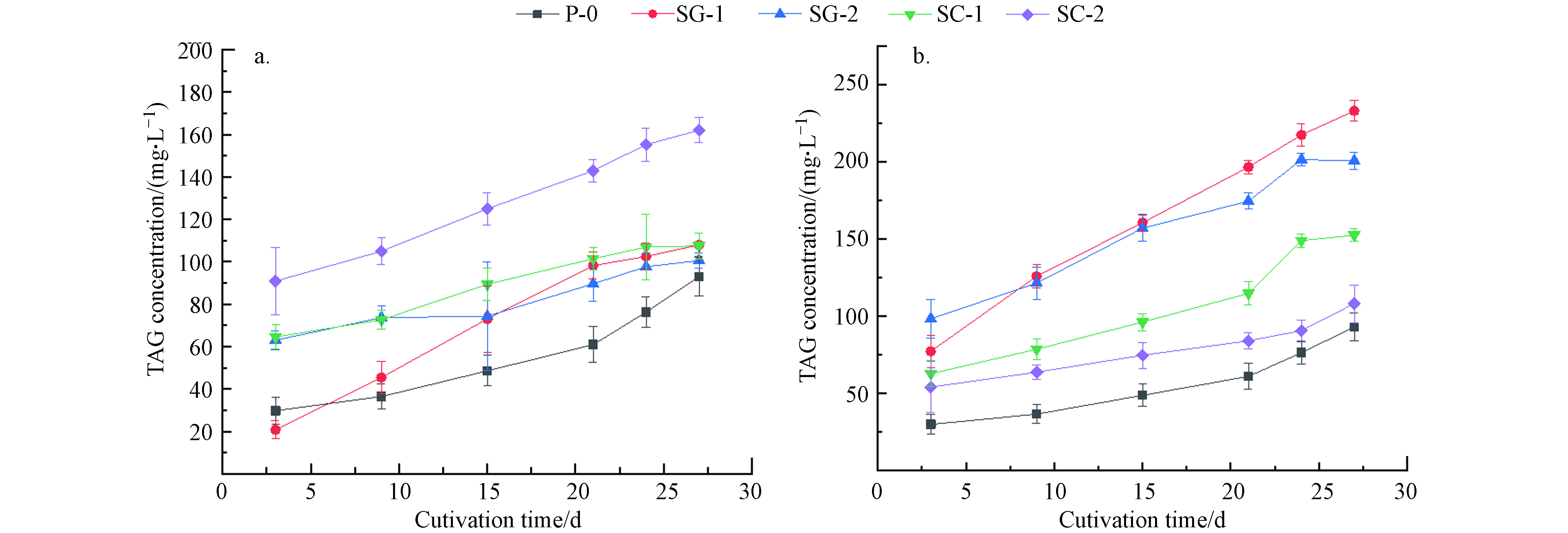
栅藻在不同污水生长条件下细胞内的甘油三酯积累量变化曲线如图4所示,菌藻共培养条件下甘油三酯含量均大于自养条件. 数据显示在生活污水I沉淀污水和生活污水Ⅱ过滤污水中甘油三酯含量更高,其中生活污水I中在27 d时甘油三酯含量最高,较自养提高了69.09 mg·L−1,生活污水Ⅱ中YG-1、YG-2的甘油三酯含量在27 d时相比于自养条件(92.96 mg·L−1),分别提高了140.05 mg·L−1、107.65 mg·L−1.
-
栅藻在不同培养类型下总脂含量、碳水化合物、蛋白质、叶绿素a如表3所示,YG-1、YG-2的总脂含量自养明显提高,分别提高了6.62 %、19.46 %.
栅藻在自养条件下的碳水化合物积累较菌藻共培养高,自养条件下达到了45.05 %,在自养情况下更多的积累了碳水化合物. Li等[30]的研究发现,Asterarcys sp. SCS-1881在自养条件下积累了更多的碳水化合物,这和栅藻在自养条件下碳水化合物含量较高结果一致. 不同的培养类型对蛋白质的积累的影响较小,蛋白质含量均在20 %左右,SG-2中栅藻的蛋白质积累较多,为30.43 %. 可能是不同培养条件下碳氮比差异导致. 研究显示由PSⅡ天线叶绿素a发出荧光占据很大比例,总量约为吸收光能的3%[31]. Abreu等[32]将自养和菌藻共培养条件下的小球藻进行对比分析,研究表明菌藻共培养下小球藻的生物量、脂类和蛋白质比自养条件下的更高,但在自养条件下,小球藻色素含量高达0.74 %(其中叶绿素占0.51%,类胡萝卜素占0.23%). 本文对比栅藻自养和菌藻共培养条件下的色素含量与Abreu等的研究一致,自养条件下叶绿素a较高,为5.99%. 图3显示自养条件下最大光合效率Fv/Fm和实际光和效率Y(Ⅱ)都较高,这也从另一个角度解释了自养比菌藻共培养条件下叶绿素a含量高.
-
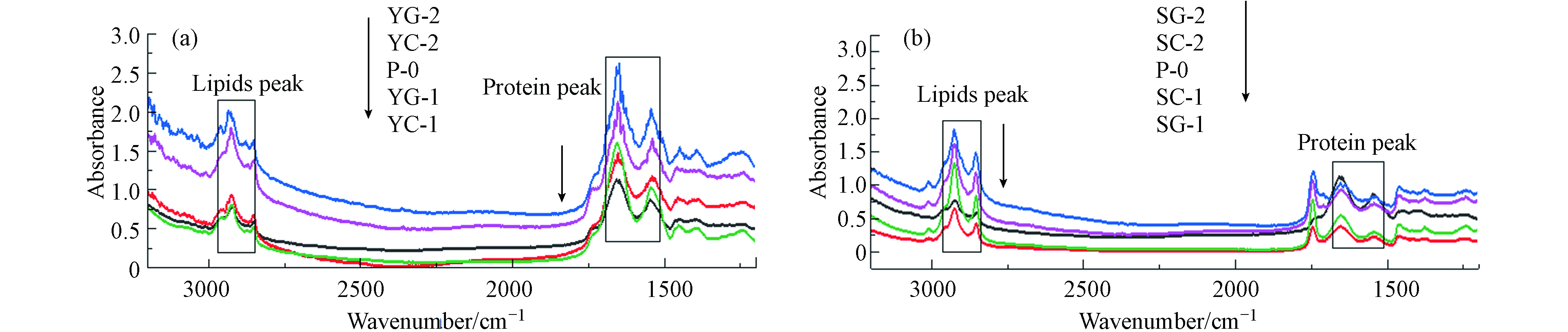
傅里叶变换红外光谱(FTIR)根据有机分子中不同波数下振动模式的不同,用来鉴定功能基团[33]. 官能团的振动可以区分出不同脂质,蛋白质,多糖和核酸化合物等细胞成分,也被用来评估营养胁迫下藻类生化成分的定量变化[34-37]. 图5是不同培养条件下菌藻絮体或纯藻的傅里叶红外光谱图. 不同的吸收峰和波长可以用来分析对应的官能团,藻类吸收峰对应的官能团及组分如表4所示.
FTIR可以用来分析藻细胞的各种化学成分信息. 结合表中的相关信息可以分析菌藻絮体不同的化学成分信息. 由图6可以看出,脂类的亚甲基基团(2930—2920 cm−1)是CH2的不对称伸缩振动,脂肪酸中的甲基基团和亚甲基基团(2875—2850 cm−1)是CH2、CH3的对称伸缩振动产生,在1655—1638 cm−1和1545—1540 cm−1是蛋白质酰胺I和酰胺Ⅱ,分别是C=O的对称伸缩振动和N—H、C—N键的对称变形振动. 如图5可以看出,栅藻在未灭菌培养条件下的脂类吸收峰较高,生活污水Ⅱ中栅藻的蛋白质吸收峰比生活污水I高,依据比尔-朗博特定律,菌藻共生条件下藻细胞内的脂质积累量更多,可能是细菌参与了栅藻的脂质积累.
-
研究表明,微生物系统中菌群多样性越高,外界环境变化对微生物的胁迫影响会比较小,其抵抗外界环境的变化能力较好、有利于系统进行自我调整、更新[9]. 为了能较为全面的评估微生物群落的alpha多样性,用Chao1[39]和Observed species指数分析群落丰富度,群落的多样性用Shannon[40]和Simpson[41]指数表征,Pielou’s evenness[42]指数表征均匀度,覆盖度用Good’s coverage[43]指数表征.
表5是不同样品的生物多样性指数,生活污水Ⅱ的群落丰富度和多样性比生活污水I高,其中YG-2的群落丰富度和物种多样性最高,外界环境对栅藻生长的胁迫影响较小,其抵抗外界环境变化能力较强. Pielou’s evenness指数表明,生活污水Ⅱ的群落均匀度比生活污水I高. Good’s coverage指数表征未检出物种比例,数值越大,表明未被检出5种比例越小,SG-2、SC-2、YG-2、YC-2的Good’s coverage指数均在0.99以上,说明未被检测出的物种占比较少,检测结果较好.
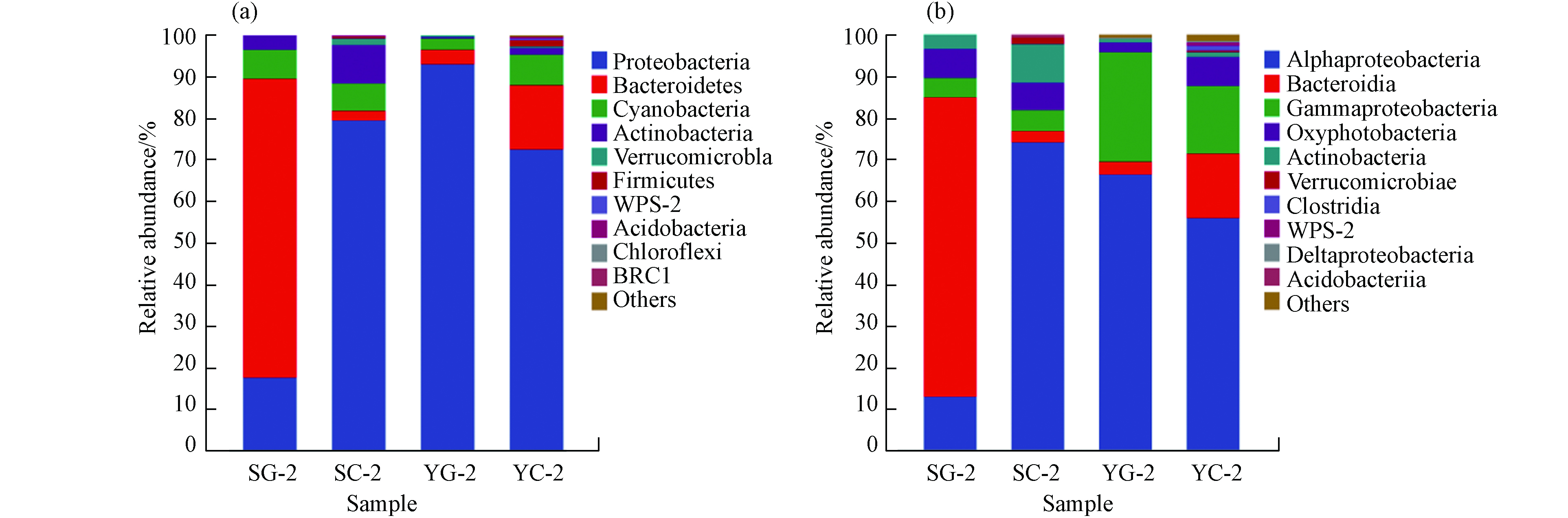
对SG-2、SC-2、YG-2、YC-2这4个样本分别进行门纲水平的相对丰度分析. 如图6所示,变形菌门(Proteobacteria)、拟杆菌门(Bacteroidetes)是菌群在门水平上的优势菌群,占比约为90%. 其中SC-2、YG-2中具有反硝化脱氮功能的变形菌门相对丰度均在80%以上. 变形菌门相对丰度高可能是未灭菌污水中总氮去除率高于灭菌污水的原因之一. 变形菌是污水处理中最重要的微生物之一,多数反硝化菌都属于变形菌门(Proteobacteria),它们对污染物生物降解有着重要作用[44-45].
图6(b)显示了在纲水平上的物种相对丰度,α变形菌(Alphaproteobacteria)、拟杆菌(Bacteroidia)、γ变形菌(Gammproteobacteria)总相对丰度之和在未灭菌污水中占比约90%,其中SG-2中的α变形菌(Alphaproteobacteria)比其余未灭菌污水相对丰度低约50%,在YG-2中γ变形菌(Gammproteobacteria)中相对丰度最大,占比为26.27%. γ变形菌(Gammproteobacteria)有助于有机物降解,有助于藻细胞内C、N、S等元素的循环,在异样反硝化、脱氮过程占优势,在污水处理中发挥重要作用[46,47]. 在生活污水Ⅱ中,YG-2的总氮的去除率最高,约为81.10%,进一步证明γ变形菌(Gammproteobacteria)在氮的降解中发挥一定作用.
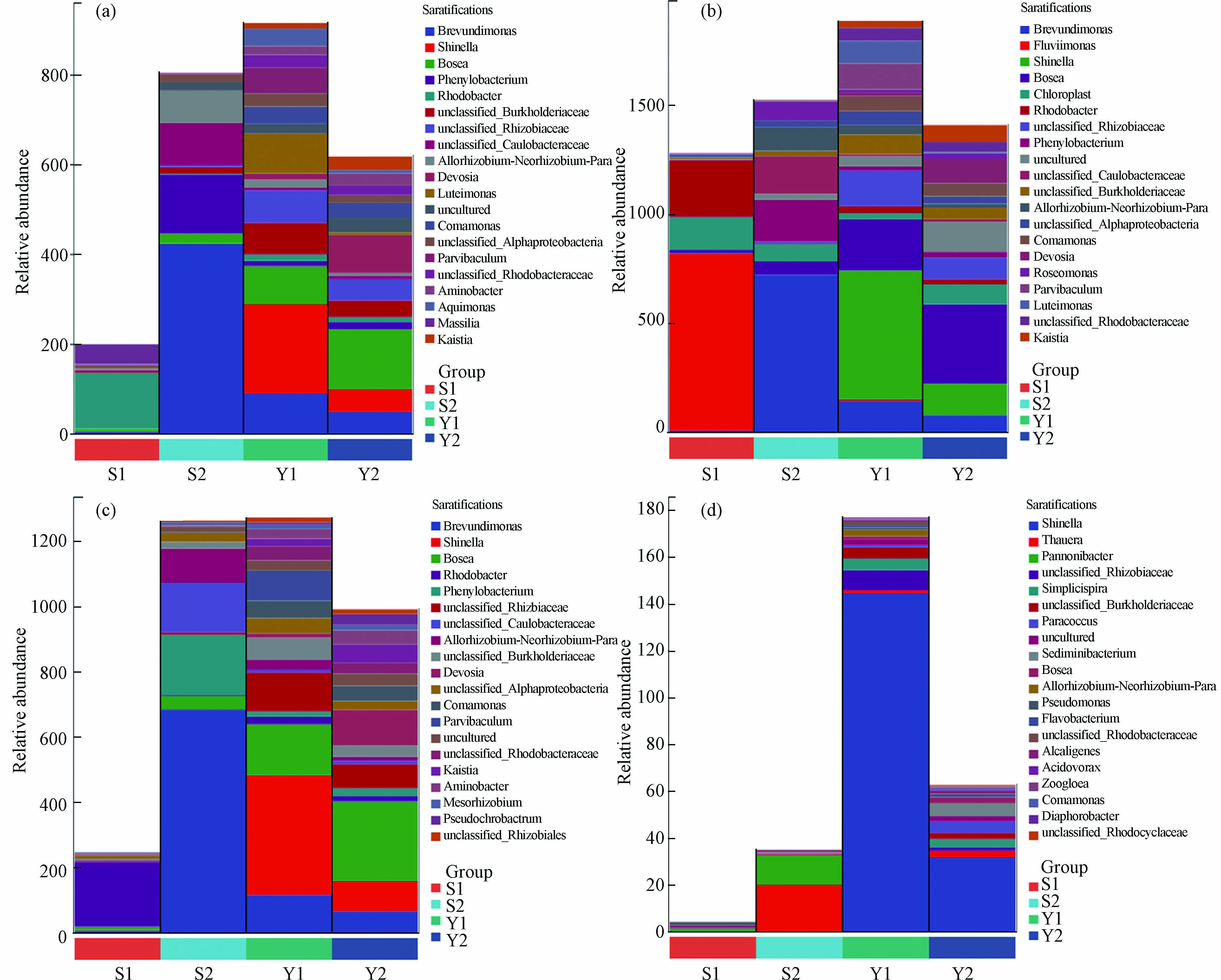
如图7所示选取了4种脂肪酸生物合成的二级途径,图中显示了不同代谢通路中菌群在属水平上的相对丰度,代谢通路包括superpathway of fatty acid biosynthesis initiation, fatty acid elongation -saturated, mycolate biosynthesis, nitrate reduction I (denitrification).
YG-2的物种组成相对丰度都较大,说明细菌对其脂肪酸合成具有一定的促进. 研究表明,污水中总氮去除主要作用是生物质吸收和硝化反硝化作用[48]. 在硝酸盐还原(反硝化)途径中,YG-2中代谢通路的物种组成相对丰度较高,这也Ⅱ中TN去除率较高的原因之一,细菌对TN的去除有一定贡献.
-
对比自养和菌藻共培养,自养比菌藻共培养表现出更高的生长速率和更多的色素含量,但菌藻共培养条件下油脂积累较高,其中YG-1和YG-2中藻细胞内的甘油三酯浓度分别比自养条件增加了140.05 mg·L−1、107.65 mg·L−1. 在生活污水Ⅱ培养下,藻细胞的总脂含量明显提高,其中YG-1、YG-2分别提高了6.62 %、19.46 %,但在自养条件下碳水化合物积累更多. 菌藻共培养提高了污水中氮磷的去除率,其中氨氮的去除率均达到了90 %以上. 高通量测序结果显示,YG-2的群落丰富度和物种多样性最高,外界环境对栅藻生长的胁迫影响较小,其抵抗外界环境变化能力较强. 门水平上的优势菌群为变形菌门(Proteobacteria)、拟杆菌门(Bacteroidetes),有助于污染物的降解.
菌藻共培养对栅藻去除生活污水中氮磷和脂质积累的影响
Effects of co-culture on removal of nitrogen, phosphorus and lipid accumulation in domestic sewage by Desmodesmus
-
摘要: 对栅藻分别进行自养和菌藻共培养. 自养利用BG11液体培养基,菌藻共培养则采用生活污水,对生活污水I和生活污水Ⅱ进行高压灭菌和未灭菌处理. 测定栅藻的生长、去除污水中氮磷能力、甘油三酯积累、光合作用和菌群多样性等. 结果显示,自养比菌藻共培养表现出更高的生长速率和更多的色素含量,但菌藻共培养条件下有更高的氮磷去除和油脂积累. 特别是生活污水Ⅱ中,甘油三酯浓度比自养提高了140.05 mg·L−1、107.65 mg·L−1,总脂含量分别提高了6.62%、19.46%,但在自养情况下碳水化合物含量达到了45.05%. 菌藻共培养中氮磷的去除率较高,其中氨氮的去除率均达到了90%以上. 利用高通量测序对未灭菌污水的菌群多样性进行测定,结果显示,YG-2群落丰富度和物种多样性最高,对于抵抗外界环境变化较有利. 主导菌群为变形菌门(Proteobacteria)、拟杆菌门(Bacteroidetes),有助于污染物的降解. 脂质积累较多的污水中菌群物种组成相对丰度在脂肪酸合成起始途径、脂肪酸延伸饱和、霉菌酸盐生物合成等脂肪酸生物合成的二级途径都较大,说明细菌对脂肪酸合成起到一定的促进作用.Abstract: The palisade was autotrophic and co-cultured with bacteria and Desmodesmus sp. respectively. Autotrophic uses BG11 liquid culture medium, and co-culture of bacteria and Desmodesmus sp. uses domestic sewage, which is autoclaved and unsterilized for domestic sewage I and sewageII. The growth, nitrogen and phosphorus removal capacity, triglyceride accumulation, photosynthesis and microbial diversity of palisade Desmodesmus sp. were measured. The results showed that autotrophic culture showed higher growth rate and more pigment content than co-culture of bacteria and Desmodesmus sp. , but there was higher nitrogen and phosphorus removal and oil accumulation under co-culture of bacteria and Desmodesmus sp. . Especially in the domestic sewage II, the triglyceride concentration increased by 140.05 mg·L−1 and 107.65 mg·L−1 compared with autotrophic, and the total fat content increased by 6.62% and 19.46% respectively, but the carbohydrate content reached 45.05% under autotrophic conditions. The removal rate of nitrogen and phosphorus was higher in the co-culture of bacteria and Desmodesmus sp. , and the removal rate of ammonia nitrogen reached more than 90%. High throughput sequencing was used to determine the microbial diversity of the unsterilized sewage. The results showed that YG-2 had the highest community richness and species diversity, which was favorable for resisting the changes of the external environment. The dominant bacteria are Proteobacteria and Bacteroidetes, which are conducive to the degradation of pollutants. The relative abundance of species composition of bacteria in sewage with large lipid accumulation is relatively large in the secondary pathway of fatty acid biosynthesis, such as the starting pathway of fatty acid synthesis, the extension saturation of fatty acid, and the mycotic acid salt biosynthesis, which indicates that bacteria play a certain role in promoting fatty acid synthesis.
-

-
表 1 不同的污水处理类型及处理方式
Table 1. Different sewage treatment types and treatment methods
编号
Number培养基成分
Medium composition处理方式
Processing methodP-0 BG11液体培养基 — SG-1 生活污水I 沉淀+过滤+灭菌 SG-2 生活污水I 沉淀+过滤 SC-1 生活污水I 沉淀+灭菌 SC-2 生活污水I 沉淀 YG-1 生活污水Ⅱ 沉淀+过滤+灭菌 YG-2 生活污水Ⅱ 沉淀+过滤 YC-1 生活污水Ⅱ 沉淀+灭菌 YC-2 生活污水Ⅱ 沉淀 注:沉淀污水为污水经过12 h静沉取上清液部分;过滤为沉淀上清液污水过0.45 μm滤膜;灭菌为高压灭菌. 表 2 不同污水类型的水质指标
Table 2. Water quality indicators of different sewage types
水质指标
Water quality index总氮/(mg·L)
TN总磷/(mg·L−1)
TP氨氮/(mg·L−1)
NH4+-N总有机碳/(mg·L−1)
TOC氢离子浓度指数
pHN/P摩尔比
The molar ratio of N/PSG-1 34.45±1.56 2.07±0.75 1.16±0.29 279.35±0.10 5.16±0.11 36.73 SG-2 35.17±1.36 1.97±0.24 1.48±0.17 302.15±0.14 7.99±0.15 39.40 SC-1 41.81±2.35 1.41±0.25 0.74±0.13 289.90±0.17 8.8±0.14 65.45 SC-2 42.01±1.86 1.41±0.22 1.67±0.27 296.00±0.19 7.38±0.10 65.76 YG-1 157.00±4.22 17.78±1.04 67.05±0.69 351.50±0.13 10.01±0.12 19.49 YG-2 155.57±3.76 17.20±0.88 127.45±0.96 314.05±0.14 8.43±0.14 19.96 YC-1 132.76±1.77 10.96±1.40 83.25±1.90 266.30±0.12 10.03±0.15 26.74 YC-2 130.11±3.04 13.15±1.09 136.36±1.38 161.35±0.10 8.18±0.12 21.84 表 3 栅藻的碳水化合物、蛋白质、总脂含量、叶绿素a含量
Table 3. Carbohydrate, protein, total lipid content and chlorophyll a content of Desmodesmus sp.
样品
Sample总脂/%
Total lipids蛋白质/%
Protein碳水化合物/%
Carbohydrate叶绿素a/%
Chl aP-0 20.46±1.23 19.05±2.13 45.05±2.01 5.99±1.20 SG-1 20.12±2.31 16.21±1.01 28.35±0.67 3.18±0.93 SG-2 21.24±2.10 18.43±3.20 30.82±1.76 6.09±1.45 SC-1 20.46±2.43 17.62±4.15 40.41±2.01 4.86±1.12 SC-2 21.12±1.30 18.15±2.14 25.38±2.31 3.73±1.31 YG-1 27.08±1.45 19.41±1.12 13.92±4.24 3.56±0.49 YG-2 39.92±3.10 23.08±2.05 21.58±1.06 5.59±1.11 YC-1 21.46±2.11 19.79±2.05 20.65±2.32 3.87±0.85 YC-2 27.22±3.23 21.38±1.56 12.98±2.01 5.58±0.24 表 4 藻类分析FTIR分析主要光谱带特征吸收峰[38]
Table 4. Characteristic absorption peaks of main spectral bands in FTIR analysis of algae[38]
序号
Number峰位/cm−1
Peak position官能团
Functional group组分
Component分析
Analysis1 2970—2960 υasCH3 脂类 甲基基团 2 2930—2920 υasCH2 脂类 亚甲基基团 3 2875—2850 υCH2,CH3 脂类 脂肪酸中甲基和亚甲基基团 4 1655—1638 υC=O 蛋白质(酰胺I) 蛋白质,也有可能包含烯烃和芳香烃化合物中的
C=C伸缩振动5 1545—1540 δN-H,δC-H 蛋白质(酰胺Ⅱ) 蛋白质 表 5 不同样品的生物多样性指数
Table 5. Biodiversity indices of different samples
样品
SampleChao1 Observed species Shannon Simpson Pielou’s evenness Good’s coverage SG-2 356.597 326.6 2.17292 0.486781 0.260191 0.998645 SC-2 1288.91 1150.3 5.41534 0.897742 0.532599 0.99439 YG-2 3482.29 3450.2 8.69133 0.984484 0.739533 0.994759 YC-2 3113.53 3108.5 8.52242 0.9838 0.734564 0.998024 -
[1] ROCHAIX J D. Chlamydomonas reinhardtii[M]//Brenner's Encyclopedia of Genetics. Amsterdam: Elsevier, 2013: 521-524. [2] 田朝玉, 叶晓, 华威, 等. 基于污水处理的微藻培养研究进展 [J]. 环境工程, 2016, 34(3): 1-5. doi: 10.13205/j.hjgc.201603001 TIAN C Y, YE X, HUA W, et al. Research progress of microalgae cultivation using wastewater resources [J]. Environmental Engineering, 2016, 34(3): 1-5(in Chinese). doi: 10.13205/j.hjgc.201603001
[3] 朱新曼, 尹儿琴, 刘友春, 等. 微藻处理污水的可行性研究 [J]. 山东农业大学学报(自然科学版), 2019, 50(3): 509-512. ZHU X M, YIN E Q, LIU Y C, et al. Study on the feasibility treating wastewater by Chlamydomonas reinhardtii [J]. Journal of Shandong Agricultural University (Natural Science Edition), 2019, 50(3): 509-512(in Chinese).
[4] 杨晶晶. 利用斜生栅藻处理废水中氮磷的研究[D]. 太原: 太原理工大学, 2018. YANG J J. Study on removal of nitrogen and Phosphorus in wastewater based on Scenedesmus obliquus[D]. Taiyuan: Taiyuan University of Technology, 2018(in Chinese).
[5] ZHOU X P, GE H M, XIA L, et al. Evaluation of oil-producing algae as potential biodiesel feedstock [J]. Bioresource Technology, 2013, 134: 24-29. doi: 10.1016/j.biortech.2013.02.008 [6] OSWALD W J, GOTAAS H B, GOLUEKE C G, et al. Algae in waste treatment (with discussion) [J]. Sewage and Industrial Wastes, 1957, 29(4): 437-457. [7] CAI T, PARK S Y, LI Y B. Nutrient recovery from wastewater streams by microalgae: Status and prospects [J]. Renewable and Sustainable Energy Reviews, 2013, 19: 360-369. doi: 10.1016/j.rser.2012.11.030 [8] 甄茜, 蔡婕, 郭行, 等. 微藻在废水脱氮除磷中的应用 [J]. 水处理技术, 2017, 43(8): 7-12. doi: 10.16796/j.cnki.1000-3770.2017.08.002 ZHEN X, CAI J, GUO X, et al. Application of microalgae in removing nitrogen and Phosphorus from wastewater [J]. Technology of Water Treatment, 2017, 43(8): 7-12(in Chinese). doi: 10.16796/j.cnki.1000-3770.2017.08.002
[9] 涂仁杰, 金文标, 韩松芳, 等. 细菌对城市污水中小球藻生长和油脂积累的影响 [J]. 环境科学, 2017, 38(10): 4279-4285. doi: 10.13227/j.hjkx.201703054 TU R J, JIN W B, HAN S F, et al. Effects of bacteria on the growth of and lipid accumulation in Chlorella pyrenoidosa cultivated in municipal wastewater [J]. Environmental Science, 2017, 38(10): 4279-4285(in Chinese). doi: 10.13227/j.hjkx.201703054
[10] MOHD UDAIYAPPAN A F, HASAN H A, TAKRIFF M S, et al. Microalgae-bacteria interaction in palm oil mill effluent treatment [J]. Journal of Water Process Engineering, 2020, 35: 101203. doi: 10.1016/j.jwpe.2020.101203 [11] MA X C, ZHOU W G, FU Z Q, et al. Effect of wastewater-borne bacteria on algal growth and nutrients removal in wastewater-based algae cultivation system [J]. Bioresource Technology, 2014, 167: 8-13. doi: 10.1016/j.biortech.2014.05.087 [12] WANG Y Y, WANG S Y, SUN L Q, et al. Screening of a Chlorella-bacteria consortium and research on piggery wastewater purification [J]. Algal Research, 2020, 47: 101840. doi: 10.1016/j.algal.2020.101840 [13] HUO S H, KONG M, ZHU F F, et al. Co-culture of Chlorella and wastewater-borne bacteria in vinegar production wastewater: Enhancement of nutrients removal and influence of algal biomass generation [J]. Algal Research, 2020, 45: 101744. doi: 10.1016/j.algal.2019.101744 [14] LIANG Z J, LIU Y, GE F, et al. Efficiency assessment and pH effect in removing nitrogen and phosphorus by algae-bacteria combined system of Chlorella vulgaris and Bacillus licheniformis [J]. Chemosphere, 2013, 92(10): 1383-1389. doi: 10.1016/j.chemosphere.2013.05.014 [15] KONG W, SONG H, CAO Y, et al. The characteristics of biomass production lipid accumulation and chlorophyll biosynthesis of Chlorella vulgaris under mixotrophic cultivation [J]. African Journal of Biotechnology, 2011, 10: 11620-11630. [16] de GODOS I, VARGAS V A, BLANCO S, et al. A comparative evaluation of microalgae for the degradation of piggery wastewater under photosynthetic oxygenation [J]. Bioresource Technology, 2010, 101(14): 5150-5158. doi: 10.1016/j.biortech.2010.02.010 [17] ZHU S N, HUO S H, FENG P Z. Developing designer microalgal consortia: A suitable approach to sustainable wastewater treatment[M]//Microalgae Biotechnology for Development of Biofuel and Wastewater Treatment. Singapore: Springer Singapore, 2019: 569-598. [18] CHEN W, ZHANG C W, SONG L R, et al. A high throughput Nile red method for quantitative measurement of neutral lipids in microalgae [J]. Journal of Microbiological Methods, 2009, 77(1): 41-47. doi: 10.1016/j.mimet.2009.01.001 [19] ANDERSEN J E T. The standard addition method revisited [J]. TrAC Trends in Analytical Chemistry, 2017, 89: 21-33. doi: 10.1016/j.trac.2016.12.013 [20] DUBOIS M, GILLES K A, HAMILTON J K, et al. Colorimetric method for determination of sugars and related substances [J]. Analytical Chemistry, 1956, 28(3): 350-356. doi: 10.1021/ac60111a017 [21] BRADFORD M M. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding [J]. Analytical Biochemistry, 1976, 72(1/2): 248-254. [22] MSANNE J, XU D, KONDA A R, et al. Metabolic and gene expression changes triggered by nitrogen deprivation in the photoautotrophically grown microalgae Chlamydomonas reinhardtii and Coccomyxa sp. C-169 [J]. Phytochemistry, 2012, 75: 50-59. doi: 10.1016/j.phytochem.2011.12.007 [23] CHEVALIER P, de la NOÜE J. Efficiency of immobilized hyperconcentrated algae for ammonium and orthophosphate removal from wastewaters [J]. Biotechnology Letters, 1985, 7(6): 395-400. doi: 10.1007/BF01166210 [24] ZHU J Y, RONG J F, ZONG B N. Factors in mass cultivation of microalgae for biodiesel [J]. Chinese Journal of Catalysis, 2013, 34(1): 80-100. doi: 10.1016/S1872-2067(11)60497-X [25] GAO F, LI C, YANG Z H, et al. Removal of nutrients, organic matter, and metal from domestic secondary effluent through microalgae cultivation in a membrane photobioreactor [J]. Journal of Chemical Technology & Biotechnology, 2016, 91(10): 2713-2719. [26] RUIZ-MARIN A, MENDOZA-ESPINOSA L G, STEPHENSON T. Growth and nutrient removal in free and immobilized green algae in batch and semi-continuous cultures treating real wastewater [J]. Bioresource Technology, 2010, 101(1): 58-64. doi: 10.1016/j.biortech.2009.02.076 [27] WANG J H, ZHANG T Y, DAO G H, et al. Microalgae-based advanced municipal wastewater treatment for reuse in water bodies [J]. Applied Microbiology and Biotechnology, 2017, 101(7): 2659-2675. doi: 10.1007/s00253-017-8184-x [28] SUKAČOVÁ K, TRTÍLEK M, RATAJ T. Phosphorus removal using a microalgal biofilm in a new biofilm photobioreactor for tertiary wastewater treatment [J]. Water Research, 2015, 71: 55-63. doi: 10.1016/j.watres.2014.12.049 [29] GUO H, YAO J T, SUN Z M, et al. Effect of temperature, irradiance on the growth of the green Alga Caulerpa lentillifera (Bryopsidophyceae, Chlorophyta) [J]. Journal of Applied Phycology, 2015, 27(2): 879-885. doi: 10.1007/s10811-014-0358-7 [30] LI T, YANG F F, XU J, et al. Evaluating differences in growth, photosynthetic efficiency, and transcriptome of Asterarcys sp. SCS-1881 under autotrophic, mixotrophic, and heterotrophic culturing conditions [J]. Algal Research, 2020, 45: 101753. doi: 10.1016/j.algal.2019.101753 [31] PAPAGEORGIOU G C, Govindjee. Chlorophyll a Fluorescence: A Signature of Photosynthesis[M]. [M]. Springer, 2005 [32] ABREU A P, FERNANDES B, VICENTE A A, et al. Mixotrophic cultivation of Chlorella vulgaris using industrial dairy waste as organic carbon source [J]. Bioresource Technology, 2012, 118: 61-66. doi: 10.1016/j.biortech.2012.05.055 [33] ALAM M A, WAN C, GUO S L, et al. Characterization of the flocculating agent from the spontaneously flocculating microalga Chlorella vulgaris JSC-7 [J]. Journal of Bioscience and Bioengineering, 2014, 118(1): 29-33. doi: 10.1016/j.jbiosc.2013.12.021 [34] WAGNER H, LIU Z X, LANGNER U, et al. The use of FTIR spectroscopy to assess quantitative changes in the biochemical composition of microalgae [J]. Journal of Biophotonics, 2010, 3(8/9): 557-566. [35] DEAN A P, SIGEE D C, ESTRADA B, et al. Using FTIR spectroscopy for rapid determination of lipid accumulation in response to nitrogen limitation in freshwater microalgae [J]. Bioresource Technology, 2010, 101(12): 4499-4507. doi: 10.1016/j.biortech.2010.01.065 [36] MAYERS J J, FLYNN K J, SHIELDS R J. Rapid determination of bulk microalgal biochemical composition by Fourier-Transform Infrared spectroscopy [J]. Bioresource Technology, 2013, 148: 215-220. doi: 10.1016/j.biortech.2013.08.133 [37] STEHFEST K, TOEPEL J, WILHELM C. The application of micro-FTIR spectroscopy to analyze nutrient stress-related changes in biomass composition of phytoplankton algae [J]. Plant Physiology and Biochemistry, 2005, 43(7): 717-726. doi: 10.1016/j.plaphy.2005.07.001 [38] MURDOCK J N, WETZEL D L. FT-IR microspectroscopy enhances biological and ecological analysis of algae [J]. Applied Spectroscopy Reviews, 2009, 44(4): 335-361. doi: 10.1080/05704920902907440 [39] CAUSEY B D. Parametric estimation of the number of classes in a population [J]. Journal of Applied Statistics, 2002, 29(6): 925-934. doi: 10.1080/02664760220136221 [40] SHANNON C E. A mathematical theory of communication [J]. The Bell System Technical Journal, 1948, 27(3): 379-423. doi: 10.1002/j.1538-7305.1948.tb01338.x [41] SIMPSON E H. Measurement of diversity [J]. Nature, 1949, 163(4148): 688. doi: 10.1038/163688a0 [42] PIELOU E C. The measurement of diversity in different types of biological collections [J]. Journal of Theoretical Biology, 1966, 13: 131-144. doi: 10.1016/0022-5193(66)90013-0 [43] GOOD I J. The population frequencies of species and the estimation of population parameters [J]. Biometrika, 1953, 40(3/4): 237-264. doi: 10.2307/2333344 [44] MAO Y P, XIA Y, ZHANG T. Characterization of Thauera-dominated hydrogen-oxidizing autotrophic denitrifying microbial communities by using high-throughput sequencing [J]. Bioresource Technology, 2013, 128: 703-710. doi: 10.1016/j.biortech.2012.10.106 [45] ZHU I, GETTING T. A review of nitrate reduction using inorganic materials [J]. Environmental Technology Reviews, 2012, 1(1): 46-58. doi: 10.1080/09593330.2012.706646 [46] FENG C J, ZHANG Z J, WANG S M, et al. Characterization of microbial community structure in a hybrid biofilm-activated sludge reactor for simultaneous nitrogen and phosphorus removal[J]. Journal of Environmental Biology, 2013, 34(2 Spec No): 489-499. [47] SHEN Z Q, ZHOU Y X, HU J, et al. Denitrification performance and microbial diversity in a packed-bed bioreactor using biodegradable polymer as carbon source and biofilm support [J]. Journal of Hazardous Materials, 2013, 250/251: 431-438. doi: 10.1016/j.jhazmat.2013.02.026 [48] LEI Y J, TIAN Y, ZHANG J, et al. Microalgae cultivation and nutrients removal from sewage sludge after ozonizing in algal-bacteria system [J]. Ecotoxicology and Environmental Safety, 2018, 165: 107-114. doi: 10.1016/j.ecoenv.2018.08.096 -



 下载:
下载: